Ответы на тему «Соединения углерода»
1. Заполните таблицу 7.
Оксиды углерода(Таблица 7)
2. Опишите физиологическое действие угарного газа на организм человека
Связывает необратимо гемоглобил
Объясните, что является противоядием при отравлении угарным газом
Свежий воздух
3. Запишите не менее двух уравнений реакций, в результате которых образуется:
а) угарный газ б) углекислый газ
Для двух ОВР составьте электронный баланс, а для реакции обмена ионные уравнения.
4. Изобразите прибор (рис. 9), в котором можно получить и собрать углекислый газ. Подпишите формулы исходных веществ и продуктов реакции.
Опишите два способа обнаружения выделяющегося углекислого газа?
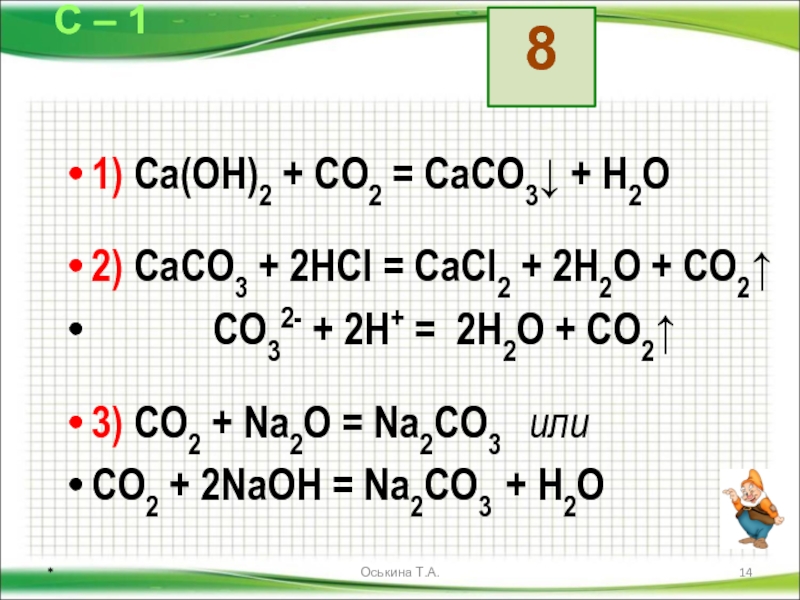
1) с Ca(OH)2 образует осадок CaCO3
2) CaCO3 + CO2 + h3O -> Ca(HCO3)2 Осадок далее переходит в прозрачный раствор
5. Изготовьте на отдельном листе бумаги формата А4 коллаж «Применение углекислого газа» или «Применение угарного газа» (по выбору). — Самостоятельно
Изготовьте на отдельном листе бумаги формата А4 коллаж «Применение углекислого газа» или «Применение угарного газа» (по выбору). — Самостоятельно
6. Составьте уравнение реакции образования угольной кислоты
1) Na2CO3 + h3SO4 -> Na2SO4 + CO2 + h3O
2) CO2 + h3O h3CO3
Укажите тип записанной реакции:
1) По числу и составу исходных веществ и продуктов реакции: соединение
2) По обратимости: обратимая
3) По изменению степеней окисления элементов: не ОВР
4) По использованию катализатора: некаталитическая
7. Дайте характеристику угольной кислоте, вписав пропущенные слова и словосочетания, формулы.
1. Формула h3CO3
2. Тип вещества — Сложное. Класс вещества — Кислота. Характеристика вещества: 1) По наличию кислорода — кислородная; 2) По основности — двухосновная; 3) По растворимости в воде — растворимая; 4) По степени электролитической диссоциации — слабая; 5) По стабильности — нестабильная.
3. Физические свойства — Очень нестойкая кислота, легко разлагается с образованием CO2 и h3O
4. Химические свойства — Взаимодействует с карбонатами, щелочами
5. Применение — Применяется для получения карбонатов, гидрокарбонатов, «дым» на сцене, тушения пожаров.
8. Заполните схему 10 формулами и названиями соединений.
Классификация солей угольной кислоты
Карбонаты: Na2CO3 — карбонат натрия; BaCO3 — карбонат бария
Гидрокарбонаты: NaHCO3 — гидрокарбонат натрия; Ca(HCO3)2 — гидрокарбонат кальция
9. Составьте уравнения реакций соответствующие схеме:
CO2 -> CaCO3 Ca(HCO3)2 -> CO2
1) CO2 + CaO -> CaCO3
2) CaCO3 + CO2 + h3O -> Ca(HCO3)2
3) Ca(HCO3)2 ->(t) CaCO3 + CO2 + h3O
Объясните, где в природе происходят превращения, уравнения реакций которых вы составили.
1) Растворение солей Ca в h3O
2) Образование сталактитов и сталагмитов
10. Составьте опорный конспект «Жесткость воды» — Самостоятельно
Составьте опорный конспект «Жесткость воды» — Самостоятельно
Реакции ионного обмена и условия их осуществления
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
- Na2CO3 + h3SO4 → Na2SO4 + CO2↑ + h3O
- 2Na(+) + CO3(2-) + 2H(+) + SO4(2-) → 2Na(+) + SO4(2-) + CO2↑ + h3O
- 2H(+) + CO3(2-) → CO2↑ + h3O
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
Диссоциации не подвергаются:
- оксиды
- газообразные вещества
- вода
Реакция ионного обмена идет до конца, если образуется газ, осадок или вода:
- Na2CO3 + 2HCl → CO2↑ + 2NaCl + h3O
- 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
- NaOH + HCl → NaCl + h3O
Полезные ссылки
Источник материала
Реакции ионного обмена (видео)
Соли угольной кислоты.
 9-й класс
9-й класс
Цели урока: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
Задачи урока:
– отработать навыки в решении расчетных и экспериментальных задачах;
– повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
– воспитывать коммуникативную культуру, уверенность в себе и своих знаниях, навыки контроля и самоконтроля.
Тип урока: изучение новой темы
Методические приемы: рассказ, демонстрации опытов.
Оборудование: раствор Na2CO3; раствор HCl, h3SO4, Ca(OH)2, Na2CO3 твердая, индикатор – фенолфталеин, штатив, газоотводная трубка; карточки – задания
Ход урока
I.
 Оргмомент.
Оргмомент.
II. Проверка домашнего задания.
Сегодня на уроке мы должны изучить соли угольной кислоты. Но прежде чем отправимся в увлекательный мир карбонатов, нам надо повторить свойства и строение h3CO3.
(2 человека у доски, 3 человека на рабочем месте)
У доски
1. Дать характеристику угольной кислоте: сила, основность, содержание кислорода. Составить уравнение диссоциации.
2. Химические свойства угольной кислоты.На месте.
- Дать характеристику аллотропным модификациям углерода.
- Дать сравнительную характеристику физических и химических свойств оксида углерода (VI) и оксида углерода (II): строение молекул, физические и химические свойства.
- Допишите определения:
а) адсорбция – это процесс – …
б) процесс выделения поглощенных веществ называется …
Пока ребята готовят ответы на вопрос, мы проведем небольшую письменную работу (10 вопросов)
- Разновидности простого вещества, образованного одним и тем же химическим элементом? (Аллотропные видоизменения)
- Электронная формула атома углерода.

- Количество электронов на внешнем уровне у элементов IV группы главной подгруппы (четыре)
- Летучие водородные соединения С и Si? (СН4 – метан, SiН4 – силан)
- Формула высших оксидов элементов IV группы главной подгруппы? (RО2)
- Масса 0,5 моль СО2 ? (22г)
- Объем 2 моль СН4 при н.у.? (44,8 л)
- Чего больше по массе в угарном газе углерода или кислорода? (кислорода С:О=3:4)
- Степень окисления углерода в угарном газе и углекислом газе? (+2;+ 4)
- Что такое сухой лед?
Проверка (правильные ответы на доске)
Ребята проверяют исправляют ошибки, выставляют себе оценки.
Проверка ответов у доски: рассмотрим свойства h3CO3.
III. Объяснение нового материала.
h3CO3 диссоциирует в две стадии. Сколько
типов солей образует данная соль?
Сколько
типов солей образует данная соль?
(По ходу опроса записывают схему на доске)
h3CO3
В повседневной жизни мы часто сталкиваемся с солями угольной кислоты (питьевая сода, известняк, мрамор, мел и т.п.)
Списывают с доски в тетрадь тривиальные названия солей.
Стихотворение о карбонатах. (Пока учащиеся пишут)
На земле живут три брата
Из семейства карбонатов.
Старший брат красавец – мрамор.
Славен именем каррары
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк
Потому и назван так.Знаменит своим трудом
Возводя за домом дом.
И способен и умел младший
Мягкий братец мел.
Как рисует посмотри
Этот …СаСО3.
CaCO3 – мел, известняк, мрамор
NaHCO3 – питьевая сода
Na2CO3 – кальцинированная сода
Na2CO3·10h3O – кристаллическая сода
CaCO3 – жемчуг (минерал арагонит)
Получение солей: назовите лабораторный способ получения солей.
(кислота + основание–> соль + вода – реакция нейтрализации)
Для получения солей угольной кислоты используют –>C02
2NaOH+CO2–>Na2CO3+h3O, если избыток CО2 получаются кислые соли
Na2CO3+CO2+h3O–>2NaHCO3
Химические свойства.
- Отношение к нагреванию.
- Реагирует солями (тип реакций?)
- С кислотами
- Гидролизу подвергаются соли угольной кислоты образуя в результате кислые соли в щелочной среде.
CaCO3–> CaO + CO2
CaHCO3–>CaCO3+CO2+h3O
(Это свойство позволяет использовать гидрокарбонаты в пищевой промышленности в качестве разрыхлителя теста)
В результате реакций выделяется CO2, как его обнаружить?
– лучина тухнет.
— через раствор известковой воды (Ca (OH)2) образуется осадок белого цвета.
Ca(OH)2+CO2–>CaCO3+h3O,
но если дальше пропускать CO2 осадок растворяется
CaCO3+CO2+h3O–>Ca(HCO3)2
Na2CO3+CaSO4–>K2SO4+CaCO3
(На доске расписывает ученик полное и сокращенное ионное уравнение)
Na2CO3+2HCl–>2NaCl+CO2+h3O
Наблюдение “вскипание”.
Реакция взаимодействия солей h3CO3 с кислотами – качественная.
Геологи используют это свойство для определения карбонатных минералов.
Опыт. |
Na2CO3+HCl Na2CO3(р-р)+HCl CaCO3(мел)+HCl |
вскипание |
Самостоятельно составьте уравнения
химических реакций.
Испытать раствор Na2CO3 индикатором фенолфталеином (раствор малинового цвета)
Вывод: соли угольной кислоты имеют общие свойства солей и специфические: 1) взаимодействие с кислотами; 2) гидролиз.
IV. Решение задачи
Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
V. Подведение итогов урока (выставление оценок).
VI. Домашнее задание
§ 33, № 21-22 (с. 91-92) устно, задача 3 (с.92).Как написать сбалансированное химическое, полное ионное и чистое ионное уравнение для реакции между водными растворами карбоната натрия и хлорида кальция?
Вы имеете дело с реакцией двойного замещения, в которой два  (2 -) #, и образуют Нерастворимый карбонат кальция , # «CaCO» _3 #, который выпадает в осадок из раствора.(цвет (зеленый) (2 «NaCl»)) #
(2 -) #, и образуют Нерастворимый карбонат кальция , # «CaCO» _3 #, который выпадает в осадок из раствора.(цвет (зеленый) (2 «NaCl»)) #
Обратите внимание, что у вас есть два катиона натрия и два аниона хлорида на стороне продуктов, поэтому у вас # 2 «NaCl» #.
# «Na» _2 «CO» _text (3 (aq]) + «CaCl» _text (2 (aq]) -> «CaCO» _text (3 (s)) darr + 2 «NaCl» _text ((aq] ) #
Выровняйте следующее химическое уравнение: Na2CO3 (водн.) + CaCl2 (водн.) & Стрелка вправо; CaCO3 (т.) + NaCl (водн.).
Вопрос:
Выровняйте следующее химическое уравнение: Na2CO3 (водн.) + CaCl2 (водн.) & Стрелка вправо; CaCO3 (т.) + NaCl (водн.).
Балансировка химических уравнений
Химические уравнения должны быть сбалансированы, чтобы удовлетворить закону сохранения материи, который гласит, что материя не может быть создана или разрушена. Уравновешивание уравнения относится к сложению коэффициентов в уравнении, чтобы сделать количество и тип каждого атома одинаковыми на стороне реагента и продукта уравнения.
Уравновешивание уравнения относится к сложению коэффициентов в уравнении, чтобы сделать количество и тип каждого атома одинаковыми на стороне реагента и продукта уравнения.
Ответ и объяснение: 1
Вычисленное уравнение: {eq} \ rm Na_2CO_ {3 (aq)} + \; CaCl_ {2 (aq)} \ longrightarrow CaCO_ {3 (s)} + \; 2NaCl _ {(aq)} {/ eq}
Чтобы сбалансировать это уравнение, мы начнем с несбалансированного уравнения :
{экв} \ rm Na_2CO_ {3 (водн.)} + \; CaCl_ {2 (водн.)} \ Longrightarrow CaCO_ {3 (s)} + \; NaCl _ {(водн.)} {/ eq}
Балансировка требует, чтобы мы добавляли коэффициенты перед реагентами и / или продуктами по мере необходимости, чтобы получить одинаковое количество атомов каждого конкретного типа в обеих частях уравнения.
Начиная с натрия (Na), мы видим, что есть два иона натрия на стороне реагента и только один ион натрия на стороне продукта. Добавление коэффициента два перед NaCl дает два иона натрия на стороне продукта, и теперь натрий уравновешен.
В каждой части уравнения есть по одному карбонатному иону, поэтому карбонат сбалансирован как есть.
Кальций также уже сбалансирован, показывая по одному иону кальция на каждой стороне стрелки.
Два иона хлорида находятся на стороне реагента, и с коэффициентом два перед NaCl есть также два иона хлорида на стороне продукта.Хлорид сбалансирован.
Единственный коэффициент, необходимый для балансировки этого уравнения, — это двойка перед NaCl, что дает следующее сбалансированное уравнение:
{экв} \ rm Na_2CO_ {3 (водн.)} + \; CaCl_ {2 (водн.)} \ Longrightarrow CaCO_ {3 (s)} + \; 2NaCl _ {(водн.)} {/ eq}
Стехиометрия; Найдите процентный выход твердого карбоната кальция, полученного при 5,0 мл 1,0 M
Ограничивающие проблемы с реагентами на самом деле представляют собой всего лишь две обычные проблемы стехиометрии, решаемые более или менее вместе.Вот как это делается. Первый шаг — написать и сбалансировать уравнение, которое вы предоставили.
CaCl2 + Na2CO3 ==> CaCO3 + 2NaCl
Step2a. Перевести г CaCl2 в моль. mols = граммы / молярная масса = приблизительно 0,0036, но вам нужно пройти ВСЕ эти вычисления и сделать их более точно.
2b. Перевести M и L Na2CO3 в моль. mols = M x L = приблизительно 0,005
Шаг 3a. Теперь, используя коэффициенты в сбалансированном уравнении, преобразуйте каждый из молей в 2a и 2b в моли продукта CaCO3.Для CaCl2 это
0,0036 моль CaCl2 x (1 моль CaCO3 / 1 моль CaCl2) = 0,0036 x (1/1) = 0,0036 моль CaCO3 прибл.
3b. Сделайте то же самое для Na2CO3.
0,005 моль Na2CO3 x (1 моль CaCO3 / 1 моль Na2CO3) = 0,005 x (1/1) = приблизительно 0,005 моль CaCO3.
3c. Вы видите, что значения сформированного продукта mols не совпадают, поэтому одно из них должно быть неправильным; правильным значением для ограничения проблем с реагентами ВСЕГДА является меньшее значение, и реагент, производящий это значение, является ограничивающим реагентом.
Шаг 4.Вышеупомянутое касается двух вещей. Во-первых, теперь вы знаете моли образовавшегося продукта (в данном случае 0,0036 молей CaCO3), а во-вторых, что был идентифицирован ограничивающий реагент. Чтобы определить количество произведенного CaCO3 в граммах, достаточно
Во-первых, теперь вы знаете моли образовавшегося продукта (в данном случае 0,0036 молей CaCO3), а во-вторых, что был идентифицирован ограничивающий реагент. Чтобы определить количество произведенного CaCO3 в граммах, достаточно
граммы = моль x молярная масса = 0,0036 x 100 г CaCO3 / моль CaCO3 = 0,36 г произведенного CaCO3. Это теоретическая доходность и конец проблемы. Эта конкретная проблема не требует от вас ничего делать с ограничивающим реагентом. Итак, вы говорите: «Почему я это идентифицировал?» и ответ в основном потому, что проблема требует, чтобы ее идентифицировали.Некоторые учителя СНАЧАЛА определяют ограничивающий реагент и используют его для определения стехиометрии проблемы. Я так не делаю. Я рассчитываю теоретический выход и тем самым определяю ограничивающий реагент. Надеюсь это поможет. Распечатайте и сохраните. Эта процедура будет работать на 99,9% ограничивающих проблем с реагентами, с которыми вы, вероятно, столкнетесь. Иногда задается вопрос, какая часть «другого неограничивающего реагента» остается непрореагировавшей, и это просто еще одна обычная проблема стехиометрии. Если бы вас спросили, что в этой задаче, вы бы сделали это. «Другой» реагент — Na2CO3. Сколько было использовано.
Если бы вас спросили, что в этой задаче, вы бы сделали это. «Другой» реагент — Na2CO3. Сколько было использовано.
0,0036 моль CaCl2 x (1 моль Na2CO3 / 1 моль CaCl2) = 0,0036 x 1/1 = 0,0036 моль Na2CO3 использованного. Первоначально у вас было 0,005, поэтому у вас должно быть 0,005–0,0036 = 0,0014, а оставшийся преобразованный мл равен M = моль / л.
1M = 0,0014 / л и L = 0,0014 / 1M = 0,0014 л, и это преобразовано в мл = 1,4 мл. Итак, вы израсходовали 3,6 из 5,00 мл, чтобы осталось 1,4 мл непрореагировавшего 1M Na2CO3. 🙂
Разница между карбонатом натрия и карбонатом кальция
Карбонат-ион (CO 3 ) имеет валентность -2 и образует соединения с натрием (Na), имеющим валентность +1, и кальцием (Ca), имеющим валентность. валентность +2.Полученные соединения представляют собой карбонат натрия (Na 2 CO 3 ) и карбонат кальция (CaCO 3 ). Первый известен как кальцинированная сода или стиральная сода, а второй, известный как кальцит, является основным компонентом мела, известняка и мрамора. Оба являются очень распространенными соединениями. Хотя карбонат кальция, который составляет 4 процента земной коры, является победителем в этой категории. Оба являются белыми порошками, которые можно использовать во многих случаях, но у них есть некоторые ключевые различия.
Оба являются очень распространенными соединениями. Хотя карбонат кальция, который составляет 4 процента земной коры, является победителем в этой категории. Оба являются белыми порошками, которые можно использовать во многих случаях, но у них есть некоторые ключевые различия.
TL; DR (слишком долго; не читал)
Карбонат натрия имеет более высокий pH, чем карбонат кальция, и более растворим.Он широко известен как кальцинированная сода. Карбонат кальция естественным образом встречается в меле, мраморе и известняке.
Карбонат натрия можно получить из карбоната кальция
Карбонат кальция естественным образом встречается в ряде сырых форм, включая мрамор, мел, известняк и раковины морских существ. Основными сырьевыми источниками карбоната натрия являются троновая руда или минерал нахколит, сырая форма бикарбоната натрия. Обработчики нагревают эти материалы для получения карбоната натрия.
Производители также могут получать карбонат натрия из карбоната кальция и хлорида натрия. Общее уравнение для этой реакции:
Общее уравнение для этой реакции:
CaCO 3 + NaCl -> CaCl 2 + Na 2 CO 3
Процесс очистки состоит из 7 этапов, и конечный результат известен как синтетическая кальцинированная сода.
Сравнение pH и растворимости
Как карбонат натрия, так и карбонат кальция являются основными. В 10 миллимолярном растворе pH карбоната натрия составляет 10,97, а pH карбоната кальция — 9,91. Карбонат натрия умеренно растворим в воде и часто используется для повышения pH в воде плавательных бассейнов.Карбонат кальция имеет очень низкую растворимость в чистой воде, но он растворяется в воде, содержащей диоксид углерода, который растворяется с образованием угольной кислоты. Эта склонность растворяться в дождевой воде является причиной эрозии, которая сформировала известняковые скалы и пещеры по всему миру.
Использование в доме и в промышленности
Промышленность зависит от карбоната кальция и карбоната натрия для различных целей.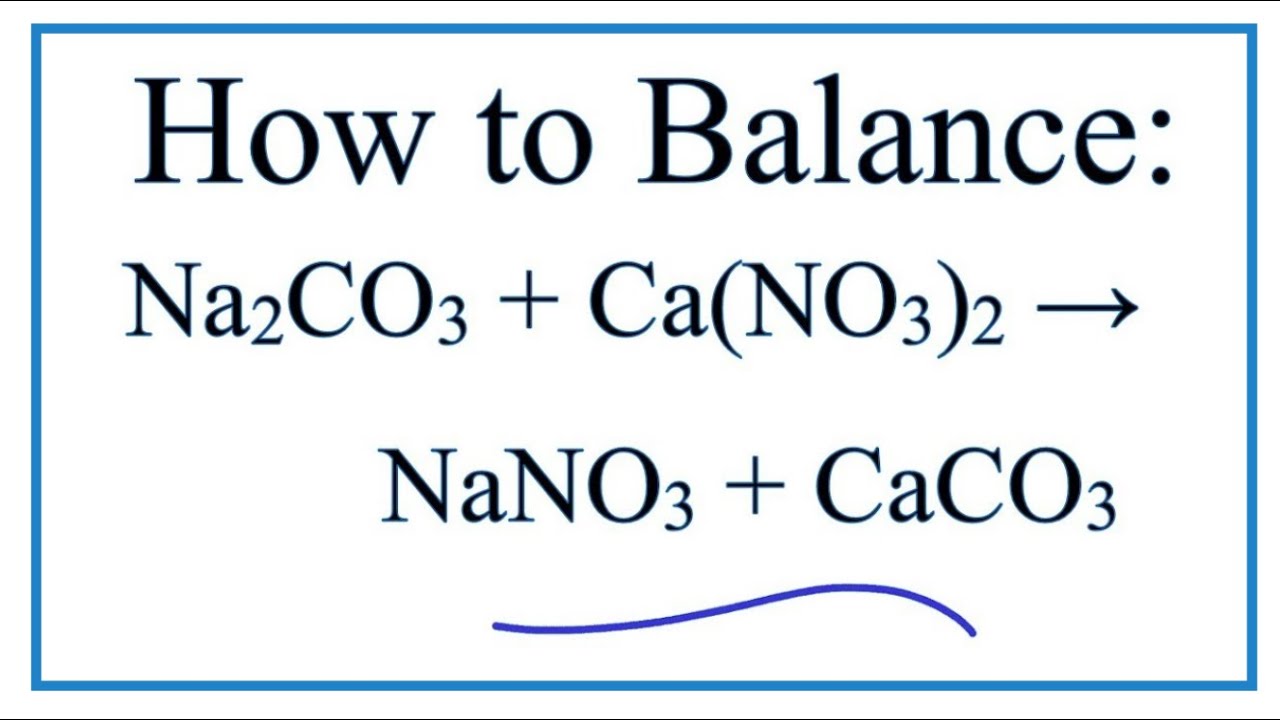 Производители стекла используют карбонат натрия в качестве флюса, потому что, когда вы добавляете его в кремнеземную смесь, он снижает температуру плавления.В доме его чаще всего используют для смягчения воды, очистки бассейнов и закрепления красок.
Производители стекла используют карбонат натрия в качестве флюса, потому что, когда вы добавляете его в кремнеземную смесь, он снижает температуру плавления.В доме его чаще всего используют для смягчения воды, очистки бассейнов и закрепления красок.
Основное применение карбоната кальция — строительная промышленность, где он используется в качестве добавки к строительным растворам и основного компонента в гипсокартоне и шовной смеси. Производители красок используют его в качестве пигмента краски, а садовники — в качестве удобрения для повышения pH почвы. У вас может даже быть немного карбоната кальция в вашей аптечке, потому что это эффективный антацид и добавка кальция.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
(PDF) Улавливание CO2 водным раствором Na2CO3, интегрированное с образованием высококачественного CaCO3 и выделением чистого CO2 в комнатных условиях
Ссылки
[1] Дж. Оексманн, А. Катер, Минимизация тепловой нагрузки регенерации при дожигании
CO
2
улавливание влажной химической абсорбцией: ошибочный акцент на низкую теплоемкость сорбционных растворителей ab-
, Int. J. Greenh. Газ Контроль 4 (2010) 36–43.
[2] K.Z. Дом, C.F. Харви, М.Дж. Азиз, Д.Шраг, Энергетические штрафы после захвата и хранения CO
CO
2
и его последствия для модернизации установленной в США базы
, Energy Environ. Sci. 2 (2009) 193–205.
[3] Б.А. Оенекан, Г. Рошель, Энергоэффективность конфигураций отпарной колонны для захвата
CO
2
водными аминами, Ind. Eng. Chem. Res. 43 (2006) 2457–2464.
[4] Л. Рейнал, П.А. Буйон, А. Гомес, П. Брутин, От МЭА к расслоению растворителей и
будущих шагов, дорожная карта по снижению стоимости улавливания углерода после сжигания,
Chem. Англ. J. 171 (2011) 742–752.
Англ. J. 171 (2011) 742–752.
[5] Т. Супап, Р. Идем, П. Тонтивахвутикул, К. Сайван, Анализ моно-
этаноламина и продуктов его окислительного разложения во время поглощения CO
2
абсорбция из
мочистых газов: сравнительное исследование аналитических методов GC-MS, HPLC-RID и CE-DAD
и возможных оптимальных комбинаций, Ind. Eng. Chem. Res. 45 (2006)
2437–2451.
[6] П. Джексон, М. Атталла, Воздействие на окружающую среду улавливания дожигания — новые идеи
, Энергетические процедуры 4 (2011) 2277–2284.
[7] М. Карл, Р.Ф. Райт, Т.Ф. Берглен, Б. Денби, Исследование наихудшего сценария для оценки воздействия на окружающую среду
выбросов аминов с завода по улавливанию CO
2
, Int. J.
Контроль парниковых газов 5 (2011) 439–447.
[8] H. Lepaumier, D. Picq, P.L. Carrette, Новые амины для улавливания CO
2
, I. Механизмы разложения амина
в присутствии CO
2
, Ind. Eng. Chem. Res.48 (2009)
Eng. Chem. Res.48 (2009)
9061–9067.
[9] S.B. Фредриксен, К.-Ж. Йенс, Окислительное разложение водных растворов аминов
MEA, AMP, MDEA, pz: обзор, Energy Procedure 37 (2013) 1770–1777.
[10] Ф. Барзагли, Ф. Мани, М. Перуццини, От парникового газа к сырью: образование
карбамата аммония из CO
2
и NH
3
в органических растворителях и его каталитических
превращение в мочевину в мягких условиях, Green Chem.13 (2011) 1267–1274.
[11] Ф. Барзагли, Ф. Мани, М. Перуццини, Поглощение диоксида углерода в виде аммиака и амина
карбаматов и их эффективное превращение в мочевину и 1,3-дизамещенные мочевины, J.
CO
2
Утил. 13 (2016) 81–89.
[12] Ф. Мани, М. Перуццини, П. Стоппиони, Комбинированный процесс захвата CO
2
карбонатом калия
и производство основных карбонатов цинка (II): CO
2
выброс из бикарбонат
растворов при комнатной температуре и давлении, Energy Fuels 22 (2008) 1714–1719.
[13] Ф. Мани, М. Перуццини, Ф. Барзагли, Роль цинка (II) в абсорбции-десорбции
CO
2
водным NH
3,
потенциально затратная -эффективный метод для улавливания CO
2
и переработки
, ChemSusChem 1 (2008) 228–235.
[14] T.N.G. Борхани, А. Азарпур, В. Акбари, S.R.W. Альви, З.А. Manan, CO
2
улавливание с растворами карбоната калия
: современный обзор, Int.J. Парниковый газ
Control 41 (2015) 142–162.
[15] А. Перес-Саладо Кампс, Э. Мейер, Б. Румпф, Г. Маурер, Растворимость CO
2
в водных растворах KCl и в водных растворах K
2
CO
3
, J. Chem. Англ. Данные 52
(2007) 817–832.
[16] H.E. Бенсон, Дж. Филд, W.P. Haynes, Улучшенный процесс абсорбции CO
2
использует горячие карбонатные растворы
, Chem.Англ. Прог. 52 (1956) 433–438.
[17] Х. Хаяси, Дж. Таниучи, Дж. Фуруясики, С. Сугияма, С. Хирано, Н. Шигемото,
Сугияма, С. Хирано, Н. Шигемото,
Т. Нонака, Эффективное извлечение диоксида углерода из дымовых газов угольных электростанций
установки с циклическим неподвижным слоем более K
2
CO
3
-on-Carbon, Ind. Eng. Chem. Res.
37 (1998) 185–191.
[18] С. Ван дер Зее, Ф. Земан, Производство осажденного углеродистого осажденного карбоната кальция
из бетонных отходов, Кан.J. Chem. Англ. 94 (2016) 2153–2159.
[19] О. Велтс, М. Уйбу, Дж. Каллас, Р. Куусик, CO
2
Минерализация: концепция совместного использования
потоков отходов сланцевой энергетики в CaCO
3
производство , Энергетические процедуры 37
(2013) 5921–5928.
[20] Дж. П. Кейси, 3-е издание, Целлюлоза и бумага: химия и химическая технология, том.
IV John Wiley and Sons, Нью-Йорк, 1983.
[21] S. Teir, S. Eloneva, R.Зевенховен, Производство осажденного карбоната кальция
из силикатов кальция и диоксида углерода, Energy Convers. Управлять. 46 (2005)
Управлять. 46 (2005)
2954–2979.
[22] R. Baciocchi, A. Polettini, R. Pomi, V. Prigiobbe, V. Nikulshina Von Zedwitz,
A. Steinfeld, CO
2
секвестрация путем прямой газо-твердой карбонизации загрязненного воздуха
контрольных остатков (APC), Energy Fuels 20 (2006) 1933–1940.
[23] G.H. Вольф, А.В.Г. Чизмешья, Дж.Дифенбахер, М. МакКелви, Наблюдение на месте
CO
2
реакций секвестрации с использованием новой системы микрореакций, Environ. Sci.
Technol. 38 (2004) 932–936.
[24] Ф. Мани, М. Перуццини, П. Стоппиони, CO
2
Поглощение водным NH
3
растворов:
Формирование карбамата, бикарбоната и карбоната аммония по
13
C ЯМР
, исследование Green Chem.8 (2006) 995–1000.
[25] Э. Брайтмайер, В. Фёльтер, ЯМР-спектроскопия углерода-13, 3-е изд., VCH-Weinheim,
Германия, 1990.
[26] R.J. Хук, Исследование некоторых стерически затрудненных аминов как потенциальных соединений для очистки диоксида углерода
, Ind. Eng. Chem. Res. 36 (1997) 1779–1790.
Eng. Chem. Res. 36 (1997) 1779–1790.
[27] T.J. Эдвардс, Дж. Ньюман, Дж. М. Праусниц, Термодинамика парожидкостного равновесия для системы аммиак-вода, Ind. Eng. Chem. Fundam. 17 (1978) 264–269.
[28] З. Дуан, Р. Сан, Улучшенная модель, рассчитывающая растворимость CO
2
в чистой воде и
водных растворах NaCl от 273 до 533 К и от 0 до 2000 бар, Chem. Геол. 193
(2003) 257–271.
[29] J.T. Куллинане, Г. Рошель, Кинетика абсорбции диоксида углерода водными растворами
карбоната калия и пиперазина, Ind. Eng. Chem. Res. 45 (2006) 2531–2545.
[30] G.R. Say, F.J. Heinzelmann, J.N. Айенгар, Д.W. Savage, A. Bisio, G. Sartori, Новая концепция затрудненного амина
для одновременного удаления двуокиси углерода и сероводорода
из газов, Chem. Англ. Прогр. 80 (1984) 72–77.
[31] Д.У. Savage, G. Astarita, S. Joshi, Химическая абсорбция и десорбция диоксида углерода
из горячих карбонатных растворов, Chem. Англ. Sci. 35 (1980) 1513–1522.
Англ. Sci. 35 (1980) 1513–1522.
[32] Ф. Барзагли, Ф. Мани, М. Перуццини, Сравнительное исследование поглощения CO
2
в
некоторых алканоламинах без растворителей и в водном моноэтаноламине (MEA),
Environ.Sci. Technol. 50 (2016) 7239–7246.
F. Barzagli et al. Journal of CO₂ Utilization 22 (2017) 346–354
354
Ecoles thématiques
Chers amis, collègues, amateurs de verre
La 75 и сессия Генеральной ассамблеи объединений наций после объявления 2022 SERA l’année internationale du Verre.
Vous Trouverez ici quelques extraits de la résolution de l’ONU.
L’assemblée Générale des Nations Unies rappelle que le verre est un acteur du développement strong.
Elle est également Soviente que le verre сопровождает l’humanité depuis des siècles en améliorant la qualité de vie миллионов людей и que ce matériau qui est l’un des plus важных, поливалентных и трансформеров истории, Estmental un élément fólément dans de nombreux domaines, dont l’industrie aérospatiale et le secteur cars, l’architecture, les arts, le numérique, l’énergie, les soins de santé, les travaux menés en labratoires, l’optique ainsi que l’emballage et le склад.
L’assemblée Générale des Nations Unies considère que le verre, les technologies liées au verre et les nouvelles Innovations dans ce domaine peuvent offrir des возможностей dans les application modernes, notamment mais nonexclusive les panneaux d’affichage et les capteurs en verre ultrafin les câbles à fiber optique, les équipements de labratoire, les lentilles et les microscopes optiques, les édicaux, les Applications Pharmaceutiques, le verre photovoltaïque, les plastiques renforcés et l’isolation.
L’assemblée Générale des Nations Unies reconnaît que, bien que sa production soit une activité à forte Intensité énergétique dont les effets actels et passés sur l’environnement ne sont pas négligeables, le verre peut servir d’alternative aux Plastiques et al. autres matériaux и потенциальный вкладчик в создание способов производства и потребления товаров длительного пользования.
L’assemblée Générale des Nations Unies considère les progrès réalisés dans la fabrication du verre pour réduire la consomation d’énergie, les émissions atmosphériques et les autres incidences environmental, ainsi que les pogrès de renforcer la durabenforcer ‘améliorer l’efficacité de sa production, de faire progresser l’utilisation длительного использования природных ресурсов, telles que le sable, et de passer à l’utilisation d’énergies renouvelables.
L’assemblée Générale des Nations Unies considère que l’Année internationale du verre, en 2022, mettra en valeur le rôle technologique, scientifique, économique, Environmental, Historique et artistique du verre dans nos sociétés, en insistant des Nos sociétés Технологии в развитие и потенциальный вклад в развитие долговременного развития и социального обеспечения, обеспечивающего восстановление экономической ситуации и реконструкцию вируса коронавируса 19 (COVINS). réunissant les thèmes de la technologie, de l’histoire sociale et de l’art dans Desducatifs et des expositions muséales.
L’assemblée Générale des Nations Unies considère également que la célébration de l’Année internationale du verre, en 2022, est l’occasion de promouvoir la вклад в научную среду и методы в развитие прочного обеспечения продвижения по службе женщин и детей, участие и вклад в науку, технологии и инновации, развитие в образовании.
L’assemblée Générale des Nations Unies se félicite que l’Année internationale du verre, в 2022 году, посредник по обмену практическими примерами и созданием партнерских отношений между основными партиями, подготовленными к участию в партнерских программах по вопросам развития. durabilité de l’industrie du verre, à créer des emplois et à améliorer les moyens de subsistance, et qu’elle puisse contribuer à mettre au jour les Возможности приоритетных инвестиций, les besoins en matière de renforcement des Capacitémes et les mécanisis трансферты технологий.
durabilité de l’industrie du verre, à créer des emplois et à améliorer les moyens de subsistance, et qu’elle puisse contribuer à mettre au jour les Возможности приоритетных инвестиций, les besoins en matière de renforcement des Capacitémes et les mécanisis трансферты технологий.
Ce projet d’année internationale du verre a été portée par l’ICG, le CGA, et l’ICOMGlass avec le soutien de milliers de частных и d’organismes.
Côté français, Федерация синдикалистских ассоциаций Métiers du Verre, Федерация Cristal et du Verre и Союз науки и технологий Verrières как единое целое для защиты и поддержки новых проектов.
2022 sera donc l’année internationale du Verre . L’USTV profitera pleinement de cette event for promouvoir auprès d’un large public le Verre et tous les métiers autour du verre, ансамблей, артистов, любителей, любителей.
Pour célébrer dignement cette année, le Conseil d’administration mettra en place et soutiendra des Initiatives à tous les niveaux: local et / ou national pour mettre en avant le verre, pour montrer les atouts et les enjeux du verre, et montrer tout ce qu’il est possible de développer, réaliser et rêver avec le verre.