что, как сбалансировать и часто задаваемые вопросы —
By Падмакши Котоки
Карбонат бария относится к классу карбонатов щелочноземельных металлов, которые могут реагировать с сильными кислотами, такими как серная кислота. Давайте подробно рассмотрим их реакцию.
Серная кислота (H2SO4) представляет собой сильную, бесцветную, гигроскопичную минеральную кислоту, которая при реакции с карбонатом бария (BaCO3), белое твердое соединение, образует белый кристаллический сульфат металла. BaCO3 представляет собой вредное химическое вещество без запаха, которое не смешивается с водой, но смешивается с большинством кислот.
Обсудим химические и физические характеристики реакции между H2SO4 и БаСО3, такие как образующиеся продукты, энтальпия реакции, ионное уравнение и т. д.
Что является произведением H2SO4 и БаСО3Сульфат бария и угольная кислота образуются как продукты, когда карбонат бария соединяется с серной кислотой. Бикарбонат, H2CO3, мгновенно диссоциирует на воду и углекислый газ.
Бикарбонат, H2CO3, мгновенно диссоциирует на воду и углекислый газ.
BaCO3 (S) + H2SO4(водн.) —> BaSO4(S) + H2CO3 (Водно)
Какой тип реакции Н2SO4 + БаСО3H2SO4 + БаСО3 представляет собой реакцию двойного замещения, также известную как реакция метатезиса солей.
Как сбалансировать H2SO4 + БаСО3Ниже приведены шаги, чтобы сбалансировать реакцию, упомянутую ниже, в соответствии с закон сохранения массы:
BaCO3 + H2SO4 -> BaSO4 + H2CO3
- Количество молей атомов каждого реагирующего элемента подсчитывают и заносят в таблицу.

| атомы | Сторона реагента | Сторона продукта |
|---|---|---|
| барий | 1 | 1 |
| углерод | 1 | 1 |
| Сера | 1 | 1 |
| Кислород | 7 | 7 |
| водород | 2 | 2 |
- Во-первых, элементы главной группы, в данном случае Ba, S и C, уравниваются как со стороны реагента, так и со стороны продукта.
- Наконец, атомы кислорода и водорода уравновешены.

- Вышеупомянутая реакция уже уравновешена из-за равного количества атомов каждого элемента, присутствующего как на стороне реагента, так и на стороне продукта.
- Таким образом, сбалансированное химическое уравнение для H2SO4 + БаСО3 дается ниже.
- BaCO3 + H2SO4 —> BaSO4 + H2CO3
Титрование BaCO3 и Н2SO4 не будет продолжаться, даже если H2SO4 является сильной кислотой, но BaCO3 не ведет себя как основание в реакции.
H2SO4 + БаСО3 Чистое ионное уравнениеЧистое ионное уравнение H2SO4 + БаСО3 это: BaCO3(S) + 2H+(Водно) + ТАК42-(Водно) = BaSO4(S) + 2H+(Водно) + CO32-(Водно)
Шаги для получения чистого ионного уравнения следующие:
- Сбалансированное уравнение отмечено с учетом фазы каждого соединения.

- BaCO3 (с) + Н2SO4 (водн.) = BaSO4 (с) + Н2CO3 (Водно)
- Реагирующие соединения, находящиеся в водной фазе и способные диссоциировать в воде, расщепляются на соответствующие им ионы.
- Наконец, ионы-наблюдатели, если они есть, удаляются для достижения общего ионного уравнения.
- Чистое ионное уравнение:
- BaCO3 (с) + 2H+(Водно) + ТАК42-(Водно) = BaSO4 (с) + 2H+ (водн.) + CO32- (Водно)
H2SO4 + БаСО3 имеет следующие сопряженные пары:
- Сопряженное основание H2SO4 это HSO4–
- Сопряженное основание H2CO3 является ОХС3–
- Дисперсионные силы Ван-дер-Ваальса, водородные связи и диполь-дипольные взаимодействия межмолекулярные силы которые держат H2SO4 молекулы вместе.

- Сильные электростатические ионные силы притяжения существуют между Ba2+ и СО32- ионы как, BaCO3 является ионным соединением.
- Межмолекулярные силы между H2CO3 молекулы — это лондоновские дисперсионные силы, диполь-дипольные силы и силы водородной связи.
Компания энтальпия реакции из H2SO4 + БаСО3 составляет 47.11 кДж/моль (приблизительное значение).
| Соединения | Моли | Энтальпия образования, ΔH⁰f (КДж / моль) |
|---|---|---|
| H2SO4 (Водно) | 1 | -909. 27 27 |
| BaCO3 (S) | 1 | -1216 |
| BaSO4 (S) | 1 | -1465.2 |
| H2CO3 (Водно) | 1 | -612.96 |
- Энтальпия реакции рассчитывается по формуле: ΔH⁰ф (реакция) = ΣΔН⁰ф (продукты) – ΣΔН⁰f (реагенты)
- Стандартная энтальпия реакции = [1×(-1465.2) + 1×(-612.96)] – [1×(-1216) + 1×(-909.27)] кДж/моль = 47.11 кДж/моль.
BaCO3 и Н2SO4 не будет производить буферный раствор из-за присутствия сильной кислоты, H2SO4.
Реакция BaCO3 + H2SO4 не является полной реакцией, так как она не достигает завершения. Это потому, что BaSO4 на поверхности BaCO образуется слой3 который разделяет два реагента. Таким образом, реакция заканчивается вскоре после ее начала, поскольку H2SO4 теперь больше не контактирует с BaCO3.
Н2SO4 + БаСО3 экзотермическая или эндотермическая реакцияH2SO4 + БаСО3 является эндотермической реакцией, так как стандартная энтальпия реакции положительна; таким образом, система обеспечивает или поглощает энергию, чтобы запустить реакцию в прямом направлении.
H2SO4 + БаСО3 не является окислительно-восстановительной реакцией, так как степени окисления реагирующих элементов не меняются по обе стороны реакции.
Н2SO4 + БаСО3 реакция осажденияH2SO4 + БаСО3 представляет собой реакцию осаждения, так как полученный продукт представляет собой белый нерастворимый осадок BaSO4.
Н2SO4 + БаСО3 Обратимая или необратимая реакцияH2SO4 + БаСО3 является необратимой реакцией, потому что BaSO4 Образуется остаток, не смешивающийся с водой, в результате чего обратная реакция невозможна.
H2SO4 + БаСО3 является примером реакции двойного замещения, поскольку катионы и анионы меняются местами с образованием соответствующих продуктов.Механизм двойного перемещения
ЗаключениеСульфат бария, встречающийся в природе в виде минерального барита, представляет собой белое кристаллическое твердое вещество, синтезированное реакцией BaCO.3 с H2SO4. Сульфат бария является ключевым компонентом бурового раствора для нефтяных скважин. Он также хорошо работает в качестве наполнителя для пластмасс. Это также демонстрирует применимость в области медицины.
что, как сбалансировать и часто задаваемые вопросы —
By Тулума Дас
BaCO3 представляет собой карбонат щелочного металла, а HCl представляет собой неорганическую кислоту. Давайте исследуем, как эти два соединения реагируют друг на друга.
Давайте исследуем, как эти два соединения реагируют друг на друга.
HCl, сильный минеральная кислота, реагирует с BaCO3, основная соль, приводящая к образованию соли и кислоты в первую очередь. Полученная кислота сразу же разлагается на газ и жидкость.
Эта статья даст некоторое представление обо всех важнейших характеристиках реакции между HCl и BaCO.3.
Что является продуктом HCl и BaCO3Хлорид бария (BaCl2), диоксид углерода (CO2) и вода ( H2O) являются продуктами реакции HCl + BaCO3. Углекислота ( H2CO3), нестабильное соединение, легко разлагается на углекислый газ и воду. Реакция показана ниже.Реакция между HCl и BaCO3
Какой тип реакции HCl + BaCO?3HCl + BaCO3 относится к типу реакции двойного замещения.
Неуравновешенное уравнение реакции HCl + BaCO3 is
HCl + BaCO3 = BaCl2 + CO2 + H2O
Ниже приведены шаги, которые необходимо выполнить, чтобы получить сбалансированное уравнение.
- Количество атомов Ba, C и O слева и справа одинаково.
- HCl + BaCO3 = BaCl2 + CO2 + H2O
- Количество атомов H и Cl слева и справа равно 1 и 2 соответственно.
- HCl + БаСО3 = БаCl2 + CO2 + H2O
- Мы умножим HCl на 2, чтобы количество атомов H и Cl стало одинаковым.
- Наконец, сбалансированное уравнение выглядит следующим образом.
- 2HCl + BaCO3 = BaCl2 + CO2 + H2O
Определить количество малорастворимой соли BaCO3 HCl, мы должны вернуться титрование.
Пипетка, мерная колба, коническая колба, мерный цилиндр, бюретка и штатив для титрования
Индикаторныефенолфталеин используется в качестве индикатора в этой процедуре титрования.
Процедура- Возьмите BaCO3 пробу в коническую колбу и с помощью пипетки добавляли HCl (известный объем и концентрация).
- Как следует перемешайте и добавьте несколько капель индикатора.
- Титруют избыток HCl раствором NaOH известной концентрации из бюретки до изменения окраски на светло-розовую.
- Повторите процедуру 2-3 раза, чтобы избежать ошибок и запишите показания бюретки.
- Наконец, используя формулу S1V1 = S2V2, можно найти количество непрореагировавшей HCl.
- От количества HCl, прореагировавшего с BaCO3, количество BaCO3 можно определить.

Сеть ионное уравнение для реакции HCl + BaCO3 is
CO32- (водн.) + 2H+ (водный) → H2О (л) + СО2 (Г)
Чтобы вывести чистое ионное уравнение, следуйте ниже шагов.
- Растворимые ионные соединения могут диссоциировать на катионы и анионы.
- HCl, БаСО3и BaCl2 будучи ионными, могут быть записаны как катионы и анионы.
- 2H+ (водн.) + 2Cl— (водн.) + Ба2+ (водн.) + CO32- (водн.) = Ба2+ (водн.) + 2Cl— (вод) + H2О (л) + СО2 (Г)
- Наконец, после отмены ионов-спектаторов с обеих сторон, мы можем получить результирующее ионное уравнение.

В реакции HCl + BaCO3,
- Сопряженным основанием кислоты HCl является Cl.–.
- Для BaCO3, сопряженная пара это невозможно.
- Молекула HCl имеет два межмолекулярные силы; диполь-дипольные и лондоновские дисперсионные силы. Диполь-дипольное взаимодействие более существенно из-за его полярной природы.
- BaCO3 будучи ионным по своей природе, обладает электростатической силой притяжения.
Компания энтальпия реакции значение для реакции HCl + BaCO3 составляет -2.0 кДж/моль. Он рассчитывается следующим образом.
| Соединения | Энтальпия образования (кДж/моль) |
|---|---|
| HCl (водн.) | -167.2 |
| BaCO3 (Водно) | -1214.8 |
| BaCl2 (Водно) | -871.9 |
| CO2 (Г) | -393.5 |
| H2О (л) | -285.8 |
Изменение энтальпии = (энтальпии образования всех продуктов) – (энтальпии образования всех реагентов)
= [(-871.9) + (-285.8) + (-393.5)] – [2*(-167.2) + (-1214.8)]
= -2.0 кДж/моль.
HCl + BaCO3 буферный растворHCl + BaCO3 не может произвести буферный раствор потому что HCl — сильная кислота, а BaCO3 не содержит сопряженного основания HCl.
HCl + BaCO3 является полной реакцией, так как кислота HCl полностью реагирует с солью BaCO3.
HCl + BaCO3 экзотермическая или эндотермическая реакцияHCl + BaCO3 is экзотермический в природе, что видно из расчета энтальпии реакции -2.0 кДж/моль.
HCl + BaCO3 окислительно-восстановительная реакцияHCl + BaCO3 нельзя назвать окислительно-восстановительная реакция поскольку степени окисления атомов реагентов и молекул продуктов неизменны.
HCl + BaCO3 реакция осажденияHCl + BaCO3 не реакция осаждения потому что продукт BaCl2 представляет собой водорастворимое твердое вещество, CO2 является газом, а H2О жидкий.
HCl + BaCO3 является необратимой реакцией, так как после образования продуктов реакция не возвращается в левую сторону.
HCl + BaCO3 реакция смещенияHCl + BaCO3 является реакцией замещения, так как ионы поменять местами между двумя реагентами BaCO3 и HCl.
Заключение
В заключение, конечными продуктами являются BaCl.2, CO2и H2O при взаимодействии соляной кислоты с карбонатом бария. BaCl2 представляет собой водорастворимое белое твердое вещество, а CO2 представляет собой бесцветный негорючий газ. Реакция является примером реакции двойного замещения.
Карбонат бария – свойства, применение и метод производства
Перейти к содержимому
Что такое карбонат бария?
Карбонат бария – Свойства: Карбонат бария представляет собой белое вещество без запаха, мало растворимое в воде, слабо растворимое в этаноле; Карбонат бария является основным карбонатом бария; Карбонат бария используется в производстве стекла, керамики и других неорганических химических веществ. 0006 +91
0006 +91
Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
BaCO3/Карбонат бария Структура
BaCO3 представляет собой белое малорастворимое твердое вещество без запаха. Это минерал с формулой BaCO3. Он встречается в виде минерала барита, который является основным источником бария.
Карбонат бария имеет простую кубическую кристаллическую структуру. Каждый ион Ba2+ окружен шестью ионами CO3- в кубической плотноупакованной конфигурации.
Химические свойства карбоната бария – BaCO3
- Карбонат бария представляет собой белое твердое вещество, нерастворимое в воде. Он мало растворим в разбавленной кислоте и очень хорошо растворим в горячей концентрированной серной кислоте. Карбонат бария реагирует с кислотами с образованием сульфата бария и углекислого газа.
- Карбонат бария представляет собой белый порошок без запаха и вкуса. Он нерастворим в воде, но растворим в кислоте. Он используется как антацид и как источник бария в рентгенографических исследованиях.

- При добавлении карбоната бария в воду он растворяется с образованием ионов бария (Ba2+) и карбонат-ионов (CO32-). Ионы бария притягиваются к отрицательным зарядам на поверхности эритроцитов. Это приводит к слипанию эритроцитов, что видно на рентгенограмме.
Различное использование карбоната бария – BaCO3
- Минерал барит представляет собой разновидность сульфата бария [BaSO4]. Это тяжелый белый порошкообразный минерал, встречающийся в природе. Он используется в производстве красок, бумаги, пластмасс и резины. Он также используется в производстве соединений бария, которые используются в производстве фейерверков, сигнальных ракет и других взрывчатых веществ.
- Карбонат бария представляет собой химическое соединение с формулой BaCO3. Это белое твердое вещество, растворимое в воде. Он производится как побочный продукт процесса Solvay.
- Карбонат бария используется в производстве других соединений бария, в качестве флюса в металлургии и в качестве наполнителя в пластмассах и резине.
 Он также используется в производстве стекла и керамики.
Он также используется в производстве стекла и керамики.
Метод производства BaCO3
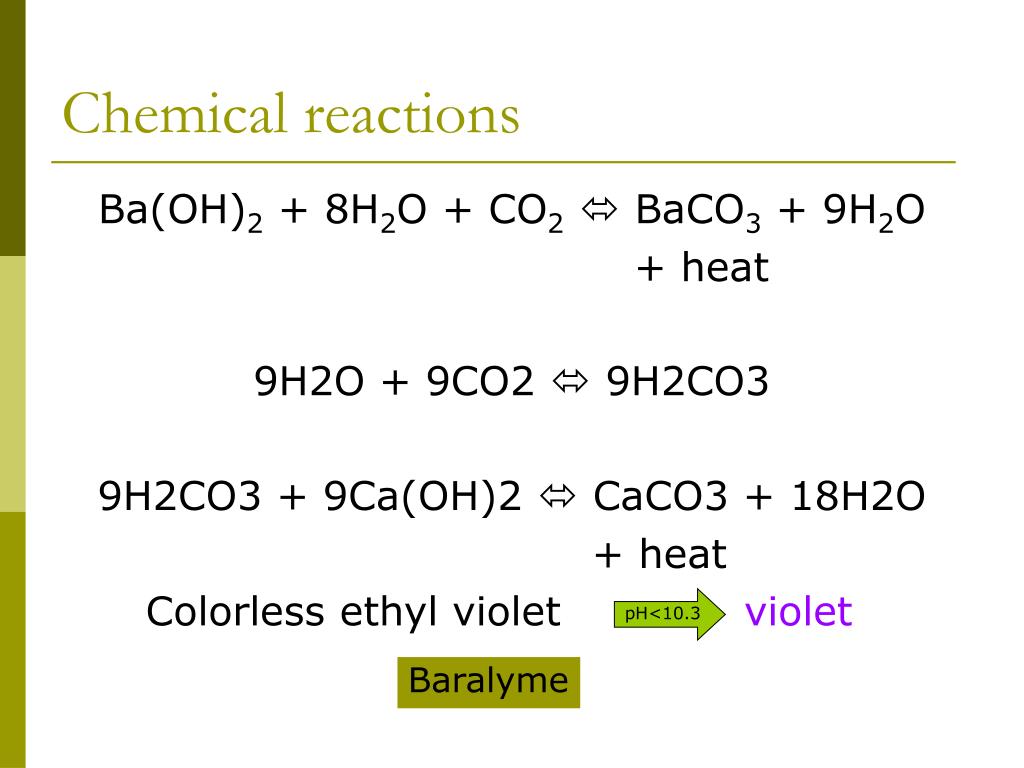
- Синтетический процесс получения BaCO3 начинается с реакции гидроксида бария с диоксидом углерода. Гидроксид бария получают путем взаимодействия оксида бария с водой.
- В этом эссе мы обсудим метод производства BaCO3.
- Производство BaCO3 осуществляется путем взаимодействия BaO с CO2. Реакция проводится в печи при температуре около 1200 градусов Цельсия. BaO смешивают с CO2 и затем помещают в печь. Затем печь нагревают до желаемой температуры и дают возможность образоваться BaCO3. Затем BaCO3 собирают и охлаждают.
- BaCO3, полученный в результате этого процесса, представляет собой белое порошкообразное вещество. Он используется в различных областях, в том числе в качестве наполнителя в пластмассах, в качестве абсорбента для газов и жидкостей, а также в качестве компонента различных видов цемента.
Связанный контент
Карбонат бария — BaCo3
| |||||||||||||||







 Он также используется в производстве стекла и керамики.
Он также используется в производстве стекла и керамики. Я прочитал предупреждения внизу страницы.’.
Я прочитал предупреждения внизу страницы.’. 