Карбонат натрия, гидрокарбонат натрия — самое интересное
Химия — интереснейшая наука, которая объясняет большую часть происходящих вокруг нас процессов и явлений. Причем, эти явления не ограничиваются простым растворением сахара в чашке чая или же гидролизом веществ, который зачастую является основой того или иного промышленного процесса, но и такими сложными, как создание органического вещества без участия живого организма. Иными словами, химия — это наука жизни в плане большинства происходящих вокруг нас явлений. Химия может все рассказать о кислотах, основаниях, щелочах и солях. Об одной из последних далее пойдет речь — карбонат натрия. Давайте рассмотрим все, связанное с карбонатом натрия, начиная химической формулой и заканчивая применением в промышленности и жизни.
Итак, карбонат натрия, формула которого записывается так: Na2CO3, — это соль угольной кислоты, которая также носит название натриевая соль угольной кислоты, или кальцинированная сода. Данное вещество выглядит как простой белый порошок, состоящий из мелких крупиц, не имеющий никакого запаха и с достаточно неприятным вкусом. Может вызвать сильные отравления и язвы желудочно-кишечного тракта, если попадет внутрь человеческого организма в большом количестве. Структурная формула выглядит следующим образом: два атома натрия одной парой электронов связаны с атомами кислорода (на каждый атом натрия приходится один кислород), атомы кислорода связаны одинарными связями с атомом углерода, а углерод, в свою же очередь, связан четырьмя (две пары) электронами с атомом кислорода. Таким образом, мы видим следующую интересную картину: атомы натрия стали положительными ионами с зарядами +1, атомы кислорода отрицательными и имеющими заряд -2, а углерод, который отдал четыре электрона, имеет заряд +4. Таким образом, карбонат натрия, а точнее, его молекула, имеет полярность в некоторых местах.
Может вызвать сильные отравления и язвы желудочно-кишечного тракта, если попадет внутрь человеческого организма в большом количестве. Структурная формула выглядит следующим образом: два атома натрия одной парой электронов связаны с атомами кислорода (на каждый атом натрия приходится один кислород), атомы кислорода связаны одинарными связями с атомом углерода, а углерод, в свою же очередь, связан четырьмя (две пары) электронами с атомом кислорода. Таким образом, мы видим следующую интересную картину: атомы натрия стали положительными ионами с зарядами +1, атомы кислорода отрицательными и имеющими заряд -2, а углерод, который отдал четыре электрона, имеет заряд +4. Таким образом, карбонат натрия, а точнее, его молекула, имеет полярность в некоторых местах.
Также существует и немного другая соль: гидрокарбонат натрия, имеющая химическую формулу NaHCO3, которая также может вызвать отравления, если попадет внутрь организма. Гидрокарбонат натрия реагирует с более активными, чем натрий, металлами, при этом натрий восстанавлявается. Еще эта соль может прореагировать со щелочью более активного металла, и произойдет восстановление натрия. Если же проводить гидролиз данной соли, то нужно отметить, что гидроксид натрия — сильная щелочь, а угольная кислота имеет достаточно слабый характер, поэтому в первую очередь получится основание и в пробирке будет щелочная среда, распознать которую можно при помощи фенол-фталеина (окрасит раствор соли в малиновый цвет).
Еще эта соль может прореагировать со щелочью более активного металла, и произойдет восстановление натрия. Если же проводить гидролиз данной соли, то нужно отметить, что гидроксид натрия — сильная щелочь, а угольная кислота имеет достаточно слабый характер, поэтому в первую очередь получится основание и в пробирке будет щелочная среда, распознать которую можно при помощи фенол-фталеина (окрасит раствор соли в малиновый цвет).
Если говорить про карбонат натрия, химические свойства которого практически не отличаются от химических свойств гидрокарбоната, то можно отметить, что, если проводить электролиз расплава и раствора этой соли, то «поведение» у них будет совершенно одинаковое. Давайте рассмотрим.
Электролиз расплава карбоната натрия закончится тем, что выделится карбонат-ион и два моля натрия. Если же проводить гидролиз раствора этой соли, то получится такая картина: на аноде восстановится водород, на катоде — гидроксо-группа, в итоге получится, что останется карбонат-анион и два моля натрия.
Также можно и нужно отметить, что карбонат натрия реагирует с такими веществами, как более сильные кислоты, например, азотная, соляная или серная. Происходит замещение, то есть, восстанавливается угольная кислота, которая тут же разлагается на воду и углекислый газ или диоксид углерода, и получается соль той кислоты, которую добавили к карбонату натрия.
Примерно такая же картинка получается, если добавить растворимую (и никакую другую, иначе реакция не пойдет!) соль более сильной кислоты, но в продуктах реакции должен получиться газ, осадок или вода.
формула, состав, применение :: SYL.ru
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO3 (брутто-формула).
Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na2CO3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.
NaHCO3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na+ и Н+. Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н+, которые раздражают стенки желудка, вызывают боль и жжение.
При этом происходит нейтрализация избытка протонов Н+, которые раздражают стенки желудка, вызывают боль и жжение.
Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50–60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.
Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества.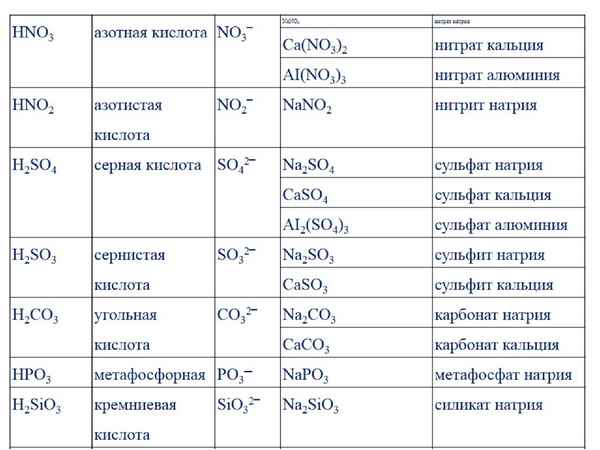 Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Гидрокарбонат натрия: формула соединения
Брутто-формула CHNaO3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO3. Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO3) = 84 г/моль.
Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na+, замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО3–. При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO3 = Na+ + НСО3–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
Реакция обмена с другими солями
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н+ и Cl–. Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO3 = Na+ + НСО3–;
HCl = Н+ + Cl–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.
Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO3 + СН3СООН = Na+ + СН3СОО– + Н2О + СО2↑. Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.
Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.
УЗНАЙТЕ О ПРИГОТОВЛЕНИИ БИКАРБОНАТА НАТРИЯ
Химическое соединение бикарбоната натрия (название ИЮПАК: гидрокарбонат натрия), также известное как пищевая сода или бикарбонат соды, имеет формулу NaHCO3. Это соль, состоящая из катиона натрия (Na+) и аниона бикарбоната (HCO3). Бикарбонат натрия представляет собой белое кристаллическое вещество, которое обычно выглядит как мелкий порошок. Он имеет несколько соленый, щелочной вкус, похожий на стиральную соду (карбонат натрия). Нахколит является природной минеральной формой.
Это соль, состоящая из катиона натрия (Na+) и аниона бикарбоната (HCO3). Бикарбонат натрия представляет собой белое кристаллическое вещество, которое обычно выглядит как мелкий порошок. Он имеет несколько соленый, щелочной вкус, похожий на стиральную соду (карбонат натрия). Нахколит является природной минеральной формой.
Получение бикарбоната натрия
Метод Solvay в первую очередь отвечает за производство бикарбоната натрия. Реакция Сольвея представляет собой реакцию на водной основе с участием хлорида натрия, аммиака и диоксида углерода. Карбонат кальция используется в качестве источника CO2, а образующийся оксид кальция используется для извлечения аммиака из хлорида аммония. Чистота продукта низкая (75%). Карбонат натрия, вода и углекислый газ используются для создания чистого продукта. Углекислый газ соединяется с водным раствором гидроксида натрия с образованием бикарбоната натрия. Карбонат натрия является первым продуктом этой реакции.
Карбонат натрия является первым продуктом этой реакции.
Na2CO3 + CO2 + h3O → 2 NaHCO3
Затем добавление диоксида углерода в вышеуказанную реакцию приводит к образованию бикарбоната натрия.
Na2CO3 + CO2 + h3O → 2 NaHCO3
Основные области применения бикарбоната натрия
Пищевая сода — это химическое вещество, имеющее широкий спектр применения. Он доступен по цене, и из-за его широкого использования он стал обычным предметом домашнего обихода. Его применение включает:
В медицине —
Он используется в качестве антацида для лечения расстройства желудка и изжоги. Его быстрый эффект уменьшает желудочную кислоту, принося облегчение на короткое время. Его щелочная природа помогает облегчить расстройство желудка, нейтрализуя избыток соляной кислоты в желудке.
При медицинских кризах, таких как серьезная почечная недостаточность, сердечный приступ или неконтролируемый диабет, назначают инфузионные инъекции 5% бикарбоната натрия.

Используется в производстве косметических средств, косметики и средств личной гигиены.
Используется при производстве ушных капель.
Вводится внутривенно, чтобы уменьшить побочные эффекты химиотерапии.
Благодаря своим антибактериальным свойствам используется для чистки полости рта и зубов.
Дома-
Это удивительное химическое вещество, которое в основном используется в качестве чистящего средства, ингредиента для приготовления пищи и дезинфицирующего средства.
Используется для приготовления мучного теста в качестве пищевой соды. Этот разрыхлитель используется в качестве разрыхлителя (химического вещества, которое выделяет газ и заставляет тесто подниматься и расширяться) при производстве хлеба, тортов, печенья, блинов, пирожков и другой выпечки.

Бикарбонат натрия взаимодействует с винной кислотой с образованием углекислого газа, когда разрыхлитель смешивается с водой в тесте для торта.
Пищевая сода часто используется для ускорения приготовления таких продуктов, как грамм или чана.
Используется для приготовления газированной газированной воды и газированных напитков.
Содово-кислотные огнетушители включают пищевую соду. В этом огнетушителе находятся две отдельные канистры, содержащие раствор гидрокарбоната натрия и серную кислоту. Кислота вступает в реакцию с раствором соды при нажатии на ручку огнетушителя, выделяя значительное количество углекислого газа. Газ CO2 выходит вместе с движущейся жидкостью. Он приземляется на горящий объект, перекрывая подачу кислорода и гася огонь.
Жидкость, попадающая на горящее вещество, охлаждает его и способствует снижению температуры воспламенения, тушению пожара.

Используется, среди прочего, для мытья полов, раковин и кухонной утвари.
Пищевая сода используется для уничтожения микроорганизмов на поверхностях в качестве дезинфицирующего средства.
Для уничтожения тараканов и других вредителей используется как пестицид.
Обладает способностью сводить на нет последствия коррозии.
Может использоваться для дезодорации старых ковров, ковриков, шкафов, обуви, холодильников и пылесосов, среди прочего.
Удаляет стойкие пятна на полу, одежде и мебели.
Это кондиционер и смягчитель воды, который используется для удаления грязи с одежды.
В садоводстве-
Пищевая сода может использоваться в качестве природного пестицида в саду для уничтожения опасных насекомых и грибков, поражающих растения.

Его можно вносить в почву, чтобы повысить уровень pH и сделать ее щелочной. Некоторые растения предпочитают щелочную почву.
Также подходит для чистки садового инвентаря.
Характеристики гидрокарбоната натрия
Негорюч.
Порошковая пыль не так взрывоопасна, как другие виды пыли.
Температура плавления 50 градусов Цельсия.
NaHCO3 представляет собой белое кристаллическое вещество без запаха.
Это основа природы.
ЗАКЛЮЧЕНИЕ
Пищевая сода, хлебная сода, пищевая сода и бикарбонат соды — все это общие названия соли, которая обычно продается в супермаркетах вместе с разрыхлителем. В Соединенных Штатах чаще используется пищевая сода, хотя в Австралии, Великобритании и Ирландии чаще используется бикарбонат соды. Натрон — это название, данное ему во многих странах Северной и Центральной Европы. Бикарбонат натрия, бикарбонат натрия, бикарбонат и бикарбонат являются примерами сокращенных разговорных версий. Префикс би в бикарбонате происходит от старой системы наименования, которая предшествует молекулярным знаниям и относится к двум молярным эквивалентам углекислого газа, выделяемого гидрокарбонатом/бикарбонатом калия при его разложении на (ди)карбонат калия и оксид калия. (калий)
В Соединенных Штатах чаще используется пищевая сода, хотя в Австралии, Великобритании и Ирландии чаще используется бикарбонат соды. Натрон — это название, данное ему во многих странах Северной и Центральной Европы. Бикарбонат натрия, бикарбонат натрия, бикарбонат и бикарбонат являются примерами сокращенных разговорных версий. Префикс би в бикарбонате происходит от старой системы наименования, которая предшествует молекулярным знаниям и относится к двум молярным эквивалентам углекислого газа, выделяемого гидрокарбонатом/бикарбонатом калия при его разложении на (ди)карбонат калия и оксид калия. (калий)
Гидрокарбонат натрия синтезируют путем растворения твердого натрия карбонат в воде. а. Предскажите продукты и напишите химическое уравнение, которое это похоже на двойку реакция смещения. Вы можете написать h3O как «H(OH)», чтобы лучше прогнозировать продукты. b. Напишите суммарное ионное уравнение для этого процесса.
Вопрос
Пошаговый ответ
Бикарбонат натрия синтезируется путем растворения твердого натрия карбонат в воде.
 а. Предскажите продукты и напишите химическое уравнение, которое
представляет этот процесс. Хин…
а. Предскажите продукты и напишите химическое уравнение, которое
представляет этот процесс. Хин…Гидрокарбонат натрия синтезируют растворением твердого натрия карбонат в воде. а. Предскажите продукты и напишите химическое уравнение, которое представляет этот процесс. Подсказка: это выглядит как двойной реакция смещения. Вы можете написать h3O как «H(OH)», чтобы лучше прогнозировать продукты. b. Напишите суммарное ионное уравнение для этого процесса.
Рекомендуемый AI ответ:
Чтобы синтезировать бикарбонат натрия, вы растворяете твердый карбонат натрия в воде. Продуктами этой реакции являются натрий и углекислый газ.Рекомендация видео с лучшим совпадением:
Решено проверенным экспертом
У нас нет заданного вами вопроса, но вот рекомендуемое видео, которое может помочь.
Лучшее соответствие Вопрос:
Гидрокарбонат натрия также известен как бикарбонат соды. Когда это
соединение нагревается, оно разлагается на карбонат натрия, углекислый газ и пары воды.
а) Напишите сбалансированное уравнение для этой реакции
Когда это
соединение нагревается, оно разлагается на карбонат натрия, углекислый газ и пары воды.
а) Напишите сбалансированное уравнение для этой реакции
Рекомендуемые видео
Расшифровка
Вещества реагируют, чтобы сформировать новые вещи. Химическая реакция должна подчиняться закону, согласно которому материя не создается и не разрушается. В этой задаче мы хотим установить сбалансированное химическое уравнение. Так называлось вещество, из которого делали воду, углекислый газ и соль. Люди там. Сбалансированная химическая реакция показывает, что 10 превращаются в продукты. Солнечные реагенты и карбонат натрия, три углекислого газа и вода SD являются карбонатами в результате реакции. Химическая реакция неуравновешенная Чтобы уравновесить уравнение, нужно поставить коэффициент. Цифры написаны на бумаге. Количество элементов в двух уравнениях будет одинаковым, если вы составите формулу. Давайте проведем инвентаризацию числа N A H C. Две части уравнения в левой части — это А и Единица.




