Оксид бария: способы получения и химические свойства
Оксид бария BaO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, летучий при высоких температурах. Энергично реагирует с водой (образуется щелочной раствор). Проявляет основные свойства.
Относительная молекулярная масса Mr = 153,33; относительная плотность для тв. и ж. состояния d = 5,72; tпл ≈ 2020º C.
1. Оксид бария получается при разложении карбоната бария при температуре 1000 — 1450º C. В результате разложения образуется оксид бария и углекислый газ:
BaCO3 = BaO + CO2
2. В результате разложения нитрата бария при температуре 620 — 670º С образуется оксид бария, оксид азота (IV) и кислород:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
3. Оксид бария можно получить сжиганием бария в в кислороде при температуре до 500º С, в результате реакции образуется оксид бария:
Оксид бария можно получить сжиганием бария в в кислороде при температуре до 500º С, в результате реакции образуется оксид бария:
2Ba + O2 = 2BaO,
4. Пероксид бария разлагается при температуре выше 790º С с образованием оксида бария и кислорода:
2BaO2 = 2BaO + O2
5. Карбонат бария вступает в реакцию с углеродом (коксом) и образует оксид бария и угарный газ при выше 1000º С:
BaCO3 + C = BaO + 2CO
1. Оксид бария реагирует с простыми веществами:
1.1. Оксид бария реагирует с кислородом при температуре до 500º С и образует пероксид бария:
2BaO + O2 = 2BaO2
1. 2. При 1100 — 1200º С оксид бария вступает в реакцию с алюминием и образует барий и алюминат бария:
2. При 1100 — 1200º С оксид бария вступает в реакцию с алюминием и образует барий и алюминат бария:
4BaO + 2Al = 3Ba + Ba(AlO2)2
1.3. Оксид бария вступает во взаимодействие с кремнием при 1200º С с образованием силиката бария и бария:
3BaO + Si = BaSiO3 + 2Ba
2. Оксид бария взаимодействует со сложными веществами:
2.1. Оксид бария взаимодействует с кислотами:
Оксид бария с разбавленной соляной кислотой образует хлорид бария и воду:
BaO + 2HCl = BaCl2 + H2O
2.2. Оксид бария реагирует с кислотными оксидами.
Оксид бария при комнатной температуре реагирует с углекислым газом с образованием карбоната бария:
BaO + CO2 = BaCO3
2.3. Оксид бария взаимодействует с водой при комнатной температуре, образуя гидроксид бария:
BaO + H2O = Ba(OH)2
Понравилось это:
Нравится Загрузка…
Откройте для себя 15 невероятных фактов о реакции h3SO3 + BaO —
By Сохини Ачарья
H2SO3 неорганическая слабая кислота. Молекула H2SO3 можно найти в газовой фазе. BaO — сильное основание. Попробуем разобраться в некоторых особенностях реакции между H2SO3 и БаО.
H2SO3 представляет собой бесцветное вещество с запахом серы. ЧАС2SO3 представляет собой белое твердое вещество с коррозионными свойствами.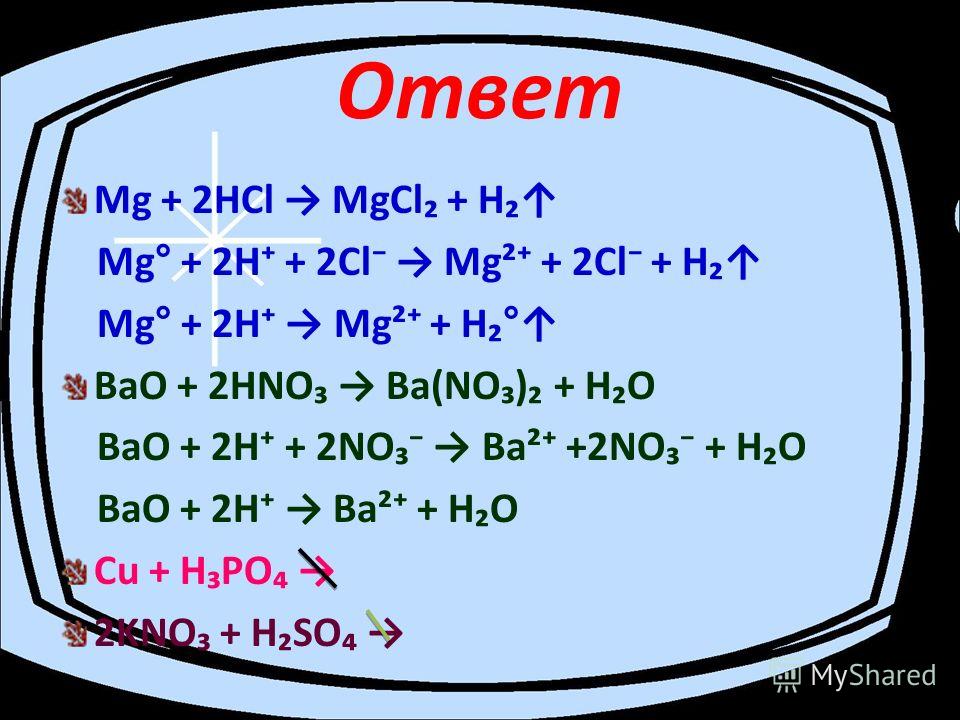 BaO также известен как бария, и это гигроскопический негорючий состав. Обычно BaO используется в качестве осушителя в различных химических реакциях.
BaO также известен как бария, и это гигроскопический негорючий состав. Обычно BaO используется в качестве осушителя в различных химических реакциях.
В этой статье мы попытаемся изучить некоторые часто задаваемые вопросы о H2SO3 и реакция BaO, такая как характер реакции, продукт реакции, энтальпия, межмолекулярные силы и т. д.
Что является произведением H2SO3 + БаО?Сульфит бария (BaSO3) и вода (H2O) являются продуктами реакции между сернистой кислотой (H2SO3) и оксид бария (BaO).
H2SO3 + ВаО = ВаSO3 + H2O
Какой тип реакции Н2SO3 + БаО?H2SO3 + Реакция BaO является примером реакция нейтрализации между слабой кислотой и сильным основанием. ЧАС2SO3 является слабой кислотой, а BaO является сильным основанием.
Количество отдельных атомов (H, S, O, Ba) в реагентах и продуктах должно быть одинаковым в сбалансированном химическом уравнении. Чтобы получить сбалансированное уравнение, мы должны выполнить несколько шагов.
- Здесь обнаружено, что присутствуют четыре отдельных элемента. Следовательно, на первом этапе каждая молекула помечена как A, C, D и E.
- Теперь реакция выглядит так: А. H2SO3 + С BaO = D BaSO3 + ЭХ2O
- Коэффициенты всех тех же элементов переставляются по их стехиометрической пропорции, и мы получаем, H = 2A + 0C = 0D + 2E, S = 1A + 0C = 1D + 0E, O = 3A + 1C = 3D + 1E, Ba = 0A + 1C = 1D + 0E.
- Затем, вычисляя коэффициент и переменные методом исключения Гаусса, мы получаем требуемые значения A, C, D и E.

- Он находится как, А = 1, С = 1, D = 1 и Е = 1.
- Теперь установлено, что число молей каждого элемента равно с обеих сторон.
| Символ стихий | Моль на стороне реагента | Родинки на стороне продукта |
|---|---|---|
| H | 2 | 2 |
| S | 1 | 1 |
| O | 3 | 3 |
| Ba | 1 | 1 |
- Следовательно, общее сбалансированное уравнение будет H2SO3 + ВаО = ВаSO3 + H2O
Сила Н2SO3 можно определить титрованием слабой кислоты сильным основанием.
Бюретка, пипетка на 20 мл, коническая колба, подставка для бюретки, стаканы, мерный цилиндр, мерная колба и воронка.
Титр и титрантВ H2SO3 + Реакция титрования BaO, H2SO3 — титр, BaO — титрант.
Индикаторныефенолфталеин используется в качестве индикатора для определения конечной точки в этой реакции нейтрализации кислотно-основного состояния.
Процедура- В бюретку отбирают стандартизированный раствор BaO.
- 20 мл Н2SO3 неизвестной концентрации отбирают в коническую колбу пипеткой на 20 мл.
- В коническую колбу к кислоте добавляют 1-3 капли индикатора фенолфталеина.
- Из бюретки в коническую колбу по каплям добавляли BaO до появления розового окрашивания в конце.

- Этот процесс повторялся не менее 3-4 раз для получения точных показаний.
- Сила Н2SO3 рассчитывается по формуле N1V1 = N2V2.
H2SO3 + Реакция BaO имеет следующее общее ионное уравнение:
H+ +HSO3– + Ба2+ + О2- = Ба2+ + ТАК32- + H+ +ОН–
- H2SO3 диссоциирует на H+ и ХСО3– ионов.
- BaO диссоциирует на Ba2+ + О2- ионов.
- BaSO3 диссоциирует на Ба2+ и так32- ионов.
- H2O диссоциирует на H+ и ОН– ионов.

- Следовательно, чистое ионное уравнение H2SO3 + BaO представляет собой H+ +HSO3– + Ба2+ + О2- = Ба2+ + ТАК32- + H+ +ОН–
H2SO3 + BaO имеет следующие сетевые сопряженные пары
- Сопряженное основание H2SO3 это HSO3– (отдавая протон).
- Сопряженной кислотой BaO является Ba2+ (согласно концепции Льюиса).
- Сопряженная кислота H2О есть Н3O+.
H2SO3 + BaO обладает следующими межмолекулярными силами,
- H2SO3 обладает электростатической силой притяжения между протонами и ионами сульфита.

- BaO имеет ковалентная связь.
Стандартная энтальпия реакции между H2SO3 + BaO составляет -286349.39 кДж/моль, что является отрицательным значением.
| молекула | Энтальпия (образования) кДж/моль |
|---|---|
| H2SO3 | 52.89 |
| BaO | -553.5 |
| BaSO3 | -1030 |
| H2O | -285820 |
- Изменение энтальпии = (сумма энтальпий образования продуктов) – (сумма энтальпий образования реагентов) = [-1030 + (-) 285820] – [52.
 89 + (-) 553.50] = – 286349.39 кДж/моль.
89 + (-) 553.50] = – 286349.39 кДж/моль.
H2SO3 + раствор BaO не является буферный раствор потому что Х2SO3 является слабой кислотой, но BaO не является сопряженным основанием этой кислоты.
Н2SO3 + BaO полная реакция?H2SO3 + Реакция BaO — полная реакция, так как продукты реакции BaSO3 и Н2O оба являются стабильными веществами.
Н2SO3 + BaO экзотермическая или эндотермическая реакция?H2SO3 + BaO реакция экзотермический так как получается отрицательное значение изменения энтальпии, и когда эти два элемента реагируют друг с другом, выделяется тепло.
Н2SO3 + BaO окислительно-восстановительная реакция?H2SO3 + Реакция BaO не является окислительно-восстановительной реакцией, так как степени окисления элементов (Ba, S, H) в ходе реакции не меняются.
H2SO3 + Реакция BaO не является реакцией осаждения, поскольку, хотя BaSO3 мало растворим в воде, осадка в ходе этой реакции не образуется.
Н2SO3 + BaO обратимый или необратимый?H2SO3 + Реакция BaO необратима, так как в этой реакции образуются продукты BaSO3 и Н2О, не превращайтесь обратно в реагенты.
Н2SO3 + BaO реакция замещения?H2SO3 + BaO реакция представляет собой реакция двойного вытеснения как ионы реагентов, H2SO3 и BaO меняются местами и производят новые соединения в качестве продуктов.
Вывод:Реакция H2SO3 с BaO – реакция нейтрализации, характеризующаяся образованием соли и воды. ЧАС2SO3 используется в пищевой, косметической промышленности. BaSO3 молекула имеет как ионную, так и ковалентную связь.
ЧАС2SO3 используется в пищевой, косметической промышленности. BaSO3 молекула имеет как ионную, так и ковалентную связь.
Рецепт булочек на пару | Приятного аппетита
Шаг 1
Слегка смажьте среднюю миску арахисовым или растительным маслом ; отложить. Налейте ⅓ стакана теплой воды в небольшую миску, посыпьте 2 ч. л. быстрорастворимые сухие дрожжи и дайте постоять 1 минуту, чтобы дрожжи размягчились. Добавить ½ стакана теплого цельного молока или овсяного молока , 3 ст. сахара и 2 ст. арахисовое или растительное масло и размешивать до растворения дрожжей и сахара.
Шаг 2
Смесь 1½ ч. л. разрыхлитель и 2½ стакана плюс 5 ст. плюс 2 ч. л. (355 г) универсальной муки в миске стационарного миксера для смешивания. Сделайте углубление в центре и влейте дрожжевую смесь. Перемешайте резиновой лопаткой, чтобы сформировать рваное тесто, которое в основном очищает стенки миски, когда вы его смешиваете. Дайте постоять, не накрывая, 3 минуты.
Дайте постоять, не накрывая, 3 минуты.
Шаг 3
Прикрепите чашу к миксеру с крюком для теста и взбейте на средней скорости, пока тесто не соберется в шар вокруг крючка, около 1 минуты. Продолжайте бить пока тесто не станет в основном гладким и эластичным, но все еще липким, около 30 секунд.
Шаг 4
С помощью гибкого скребка для теста перенесите тесто на слегка
поверхность, присыпанную мукой, и перевернуть, чтобы тесто слегка обвалялось в муке, чтобы с ним было легче обращаться.
Аккуратно вымесить до гладкости, мягкости, слегка липкой и округлой формы, около 30
секунды. Когда вы нажимаете пальцем на тесто, оно должно пружинить, оставляя только
слабое углубление. (В качестве альтернативы вы можете замесить тесто в большой миске с помощью резиновой
шпатель и немного смазки для локтя. Месить на поверхности, слегка присыпая мукой, пока
мягкое, гладкое тесто, около 4 минут. Если тесто кажется сухим, работайте в теплом
воды по чайной ложке по мере необходимости.
Шаг 5
Поместите тесто в подготовленную миску и поверните, чтобы покрыть с маслом. Накройте полиэтиленовой пленкой и оставьте в теплом месте без сквозняков почти до в два раза больше, около 1 часа.
Шаг 6
Вырежьте двенадцать 3-дюймовых квадратов пергаментной бумаги. Очень слегка посыпьте поверхность мукой, если тесто кажется липким. Переложите тесто на поверхность и сформировать толстое бревно. Разрежьте ножом поперек на 12 равных частей (можно разрезать тесто пополам, потом еще раз пополам, потом каждую порцию на трети, чтобы получилось). Используя легким прикосновением скатайте каждую часть в шар. Ударьте по каждому мячу тыльной стороной ладони, чтобы сделать диск диаметром 3 дюйма.
Шаг 7
Раскатайте диск из теста, работая сверху вниз или от середины к краю, часто вращая, чтобы предотвратить прилипание, в тонкий овал размером примерно 5×3 дюйма. Смазать немного оставшимся 2 ч. л. овощей или арахисового масла на половину овала, затем сложите его, чтобы получился полумесяц. Положите его на пергаментный квадрат и установите в противни или корзины для варки на расстоянии от стенок. Повторите то же самое с оставшимися дисками на расстоянии около 1 дюйма (это хорошо, если документы перекрываются). Если вам не хватает места, поместите дополнительные продукты на противень. Неплотно накройте булочки кухонным полотенцем и дайте подняться в теплом месте без сквозняков, пока они не увеличатся почти вдвое, на 20–30 минут.
Положите его на пергаментный квадрат и установите в противни или корзины для варки на расстоянии от стенок. Повторите то же самое с оставшимися дисками на расстоянии около 1 дюйма (это хорошо, если документы перекрываются). Если вам не хватает места, поместите дополнительные продукты на противень. Неплотно накройте булочки кухонным полотенцем и дайте подняться в теплом месте без сквозняков, пока они не увеличатся почти вдвое, на 20–30 минут.
Шаг 8
Примерно за 10 минут до готовности булочек наполните чашу пароварки или другую большую кастрюлю наполовину залейте водой и доведите до кипения. Немного уменьшите огонь до постоянный пар.
Шаг 9
Поставьте противни на кастрюлю, накройте крышкой и паровыми булочками, пока они не поднимутся и не станут сухими, 6–8 минут. Снимите кастрюлю с огня и подождите, пока спадет пар, прежде чем снимать крышку, наклоняя ее от себя, чтобы конденсат не капал на булочки, а горячий пар не попадал на лицо. Выньте противни из кастрюли и с помощью металлической лопаточки переложите булочки на пергаментной бумаге на решетку.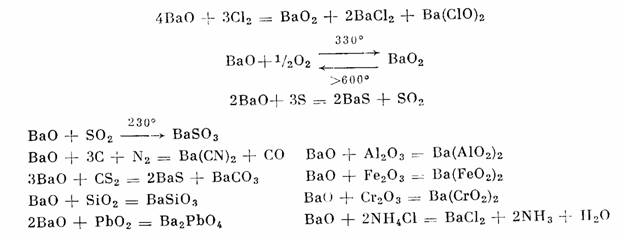 Дайте остыть 5 минут. Неплотно накройте крышкой, чтобы не высыхала. При необходимости вытрите влагу с противней перед приготовлением на пару булочек. Если вы не готовитесь заранее, как только все булочки будут приготовлены, верните их на подносы, при необходимости поставив их вверх, и накройте крышкой, чтобы они оставались мягкими, пока они не будут готовы к употреблению.
Дайте остыть 5 минут. Неплотно накройте крышкой, чтобы не высыхала. При необходимости вытрите влагу с противней перед приготовлением на пару булочек. Если вы не готовитесь заранее, как только все булочки будут приготовлены, верните их на подносы, при необходимости поставив их вверх, и накройте крышкой, чтобы они оставались мягкими, пока они не будут готовы к употреблению.
Делать заранее: Булочки можно делать на 5 дней вперед. Поместите в герметичный контейнер и охладите или заморозьте на срок до 1 месяца. Если они заморожены, разморозьте и снова готовьте на пару около 3 минут или накройте влажным кухонным полотенцем и разогрейте в микроволновой печи с интервалом в 30 секунд.
Восемь сокровищница рисового пудинга (Ba Bao Fan, 八宝饭)
Опубликовано: · Обновлено:





 89 + (-) 553.50] = – 286349.39 кДж/моль.
89 + (-) 553.50] = – 286349.39 кДж/моль.