Тугоплавкие металлы — Википедия
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Тугоплавкие металлы | Расширенная группа тугоплавких металлов [1] |
Тугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию. Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как материаловедение, металлургия и в технических науках. Определение тугоплавких металлов относится к каждому элементу группы по разному. Основными представителями данного класса элементов являются элементы пятого периода — ниобий и молибден; шестого периода — тантал, вольфрам и рений. Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности. Благодаря порошковой металлургии из них можно получать детали для разных областей промышленности.
Определение
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000
Видео по теме
Свойства
Физические свойства
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различается, потому что они являются членами различных групп [5][6].
Сопротивление к деформации ползучести является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов[7][8].
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.[5]
Применение
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Вольфрам был найден в 1781 г. Шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C (6170 °F)
Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило не превышает 90 %. Смешивание легирующего материала с ним низкое даже при спекании [9].
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь[10]. Нити накаливания, состоящие из вольфрама, находят своё применение в быту и в приборостроении. Лампы более эффективно преобразуют электроэнергию в свет с повышением температуры[9]. В вольфрамовой газодуговой сварке (англ.) оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат[11][12]. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах[13]. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис»
Сплавы молибдена
Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов[17].
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом [18][19].
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде[20][21][22][23].
Сплавы ниобия
Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путём отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит своё применение при создании сопел в жидкостных ракетных двигателях, например таких как Apollo CSM (англ.)[24]. Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C[24].
Тантал
Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов[25].
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает их одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350 K до 1900 K). Как было указано выше, они не должны контактировать с кислородом.
См. также
Примечания
- ↑ H. Ortner. International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ Michael Bauccio. Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 9780871704788.
- ↑ Wilson, J. W. General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624.
- ↑ Joseph R. Davis. Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444.
- ↑ 1 2 Borisenko, V. A. Investigation of the temperature dependence of the hardness of molybdenum in the range of 20-2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — DOI:10.1007/BF00775076.
- ↑ Fathi, Habashi. Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — DOI:10.1080/08827509808962488.
- ↑ Schmid, Kalpakjian. Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358.
- ↑ Weroński, Andrzej; Hejwowski, Tadeusz. Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265.
- ↑ 1 2 Erik Lassner, Wolf-Dieter Schubert. Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532.
- ↑ National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material. Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- ↑ Michael K. Harris. Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287.
- ↑ William L. Galvery, Frank M. Marlow. Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517.
- ↑ W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics..
- ↑ P. Ramakrishnan. Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303.
- ↑ Arora, Arran. Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — Вып. 19. — № 4. — С. 210—216.
- ↑ V. S. Moxson, F. H. Froes. Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — Вып. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z.
- ↑ Robert E. Smallwood. TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 9780803102033.
- ↑ Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A. Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — Вып. 39. — С. 374—376. — DOI:10.1023/A:1024903616630.
- ↑ Gupta, C. K. Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580.
- ↑ Michael J. Magyar. Commodity Summary 2009:Molybdenum. United States Geological Survey. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg. Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — Вып. 102. — С. 25.
- ↑ Neikov Oleg D. Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220.
- ↑ Joseph R. Davis. Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969.
- ↑ 1 2 John Hebda. Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001. Архивировано 17 декабря 2008 года.
- ↑ J. W. Wilson. Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624.
Для дополнительного чтения
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5–9 June 2000, London: James & James Ltd (2000). Проверено 26 сентября 2010.
- Donald Spink. Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019.
- Earl Hayes. Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020.
wikipedia.green
Тугоплавкие металлы Википедия
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Тугоплавкие металлы | Расширенная группа тугоплавких металлов[1] |
Тугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию. Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как материаловедение, металлургия и в технических науках. Определение тугоплавких металлов относится к каждому элементу группы по разному. Основными представителями данного класса элементов являются элементы пятого периода — ниобий и молибден; шестого периода — тантал, вольфрам и рений. Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности. Благодаря порошковой металлургии из них можно получать детали для разных областей промышленности.
Определение
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000 °F (2,200 °C). Это необходимо для их определения как тугоплавких металлов[2]. Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные[3], в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий. Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам[4].
Свойства
Физические свойства
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различается, потому что они являются членами различных групп[5][6].
Сопротивление к деформации ползучести является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов[7][8].
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.[5]
Применение
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Вольфрам был найден в 1781 г. Шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C (6170 °F)
Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило не превышает 90 %. Смешивание легирующего материала с ним низкое даже при спекании[9].
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь[10]. Нити накаливания, состоящие из вольфрама, находят своё применение в быту и в приборостроении. Лампы более эффективно преобразуют электроэнергию в свет с повышением температуры[9]. В вольфрамовой газодуговой сварке (англ.) оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат[11][12]. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах[13]. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис»[14]. Иногда он находит своё применение благодаря своей плотности. Например, он находит своё применение в производстве клюшек для гольфа[15][16]. В таких деталях применение не ограничивается вольфрамом, так как более дорогой осмий тоже может быть использован.
Сплавы молибдена
Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов[17].
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом[18][19].
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде[20][21][22][23].
Сплавы ниобия
Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путём отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит своё применение при создании сопел в жидкостных ракетных двигателях, например таких как Apollo CSM (англ.)[24]. Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C[24].
Тантал
Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов[25].
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает их одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350 K до 1900 K). Как было указано выше, они не должны контактировать с кислородом.
См. также
Примечания
- ↑ H. Ortner. International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ Michael Bauccio. Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 9780871704788.
- ↑ Wilson, J. W. General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624.
- ↑ Joseph R. Davis. Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444.
- ↑ 1 2 Borisenko, V. A. Investigation of the temperature dependence of the hardness of molybdenum in the range of 20-2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — DOI:10.1007/BF00775076.
- ↑ Fathi, Habashi. Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — DOI:10.1080/08827509808962488.
- ↑ Schmid, Kalpakjian. Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358.
- ↑ Weroński, Andrzej; Hejwowski, Tadeusz. Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265.
- ↑ 1 2 Erik Lassner, Wolf-Dieter Schubert. Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532.
- ↑ National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material. Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- ↑ Michael K. Harris. Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287.
- ↑ William L. Galvery, Frank M. Marlow. Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517.
- ↑ W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics..
- ↑ P. Ramakrishnan. Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303.
- ↑ Arora, Arran. Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — Вып. 19. — № 4. — С. 210—216.
- ↑ V. S. Moxson, F. H. Froes. Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — Вып. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z.
- ↑ Robert E. Smallwood. TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 9780803102033.
- ↑ Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A. Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — Вып. 39. — С. 374—376. — DOI:10.1023/A:1024903616630.
- ↑ Gupta, C. K. Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580.
- ↑ Michael J. Magyar. Commodity Summary 2009:Molybdenum. United States Geological Survey. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg. Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — Вып. 102. — С. 25.
- ↑ Neikov Oleg D. Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220.
- ↑ Joseph R. Davis. Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969.
- ↑ 1 2 John Hebda. Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001. Архивировано 17 декабря 2008 года.
- ↑ J. W. Wilson. Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624.
Для дополнительного чтения
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5–9 June 2000, London: James & James Ltd (2000). Проверено 26 сентября 2010.
- Donald Spink. Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019.
- Earl Hayes. Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020.
wikiredia.ru
Тугоплавкие металлы — WiKi
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000 °F (2,200 °C). Это необходимо для их определения как тугоплавких металлов[2]. Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные[3], в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий. Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам[4].
Физические свойства
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различается, потому что они являются членами различных групп[5][6].
Сопротивление к деформации ползучести является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов[7][8].
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.[5]
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Вольфрам был найден в 1781 г. Шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C (6170 °F)
Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило не превышает 90 %. Смешивание легирующего материала с ним низкое даже при спекании[9].
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь[10]. Нити накаливания, состоящие из вольфрама, находят своё применение в быту и в приборостроении. Лампы более эффективно преобразуют электроэнергию в свет с повышением температуры[9]. В вольфрамовой газодуговой сварке (англ.) оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат[11][12]. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах[13]. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис»[14]. Иногда он находит своё применение благодаря своей плотности. Например, он находит своё применение в производстве клюшек для гольфа[15][16]. В таких деталях применение не ограничивается вольфрамом, так как более дорогой осмий тоже может быть использован.
Сплавы молибдена
Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов[17].
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом[18][19].
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде[20][21][22][23].
Сплавы ниобия
Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путём отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит своё применение при создании сопел в жидкостных ракетных двигателях, например таких как Apollo CSM (англ.)[24]. Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C[24].
Тантал
Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов[25].
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает их одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350 K до 1900 K). Как было указано выше, они не должны контактировать с кислородом.
ru-wiki.org
Тугоплавкие металлы
тугоплавкие металлы и, тугоплавкие металлы химияТугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию. Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как материаловедение, металлургия и в технических науках. Определение тугоплавких металлов относится к каждому элементу группы по разному. Основными представителями данного класса элементов являются элементы пятого периода — ниобий и молибден; шестого периода — тантал, вольфрам и рений. Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности. Благодаря порошковой металлургии из них можно получать детали для разных областей промышленности.
Содержание
- 1 Определение
- 2 Свойства
- 2.1 Физические свойства
- 2.2 Химические свойства
- 3 Применение
- 3.1 Вольфрам и его сплавы
- 3.2 Сплавы молибдена
- 3.3 Сплавы ниобия
- 3.4 Тантал
- 3.5 Сплавы рения
- 4 Общие свойства тугоплавких металлов
- 5 См. также
- 6 Примечания
- 7 Для дополнительного чтения
Определение
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000 °F (2,200 °C). Это необходимо для их определения как тугоплавких металлов. Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий. Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
Свойства
Физические свойства
| Название | Ниобий | Молибден | Тантал | Вольфрам | Рений |
|---|---|---|---|---|---|
| Температура плавления | 2750 K (2477 °C) | 2896 K (2623 °C) | 3290 K (3017 °C) | 3695 K (3422 °C) | 3459 K (3186 °C) |
| Температура кипения | 5017 K (4744 °C) | 4912 K (4639 °C) | 5731 K (5458 °C) | 5828 K (5555 °C) | 5869 K (5596 °C) |
| Плотность | 8,57 г·см³ | 10,28 г·см³ | 16,69 г·см³ | 19,25 г·см³ | 21,02 г·см³ |
| Модуль Юнга | 105 ГПа | 329 ГПа | 186 ГПа | 411 ГПа | 463 ГПа |
| Твёрдость по Виккерсу | 1320 МПа | 1530 МПа | 873 МПа | 3430 МПа | 2450 МПа |
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различается, потому что они являются членами различных групп.
Сопротивление к деформации ползучести (англ.) является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов.
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.
Применение
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Основная статья: ВольфрамВольфрам был найден в 1781 г. Шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C (6170 °F)
Вольфрам.Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило не превышает 90 %. Смешивание легирующего материала с ним низкое даже при спекании.
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь. Нити накаливания, состоящие из вольфрама, находят своё применение в быту и в приборостроении. Лампы более эффективно преобразовывают электроэнергию в свет с повышением температуры. В вольфрамовой газодуговой сварке (англ.) оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис». Иногда он находит своё применение благодаря своей плотности. Например, он находит своё применение в производстве клюшек для гольфа. В таких деталях применение не ограничивается вольфрамом, так как более дорогой осмий тоже может быть использован.
Сплавы молибдена
Основная статья: Молибден Молибден.Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов.
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом.
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде.
Сплавы ниобия
Основная статья: Ниобий Ниобий. Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путём отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит своё применение при создании сопел в жидкостных ракетных двигателях, например таких как Apollo CSM (англ.). Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C.
Тантал
Основная статья: Тантал (элемент) Тантал.Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Основная статья: Рений Рений.Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов.
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает их одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350 K до 1900 K). Как было указано выше, они не должны контактировать с кислородом.
См. также
- Огнеупорные материалы
Примечания
- ↑ H. Ortner. International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Проверено 26 сентября 2010. Архивировано из первоисточника 20 июня 2012.
- ↑ Michael Bauccio. Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 9780871704788.
- ↑ Wilson, J. W. General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624.
- ↑ Joseph R. Davis. Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444.
- ↑ 1 2 Borisenko, V. A. Investigation of the temperature dependence of the hardness of molybdenum in the range of 20-2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — DOI:10.1007/BF00775076.
- ↑ Fathi, Habashi Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — DOI:10.1080/08827509808962488.
- ↑ Schmid, Kalpakjian. Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358.
- ↑ Weroński, Andrzej; Hejwowski, Tadeusz. Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265.
- ↑ 1 2 Erik Lassner, Wolf-Dieter Schubert. Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532.
- ↑ National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material. Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- ↑ Michael K. Harris. Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287.
- ↑ William L. Galvery, Frank M. Marlow. Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517.
- ↑ W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics..
- ↑ P. Ramakrishnan. Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303.
- ↑ Arora, Arran Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — Вып. 19. — № 4. — С. 210—216.
- ↑ V. S. Moxson, F. H. Froes Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — Вып. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z.
- ↑ Robert E. Smallwood. TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 9780803102033.
- ↑ Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A. Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — Вып. 39. — С. 374—376. — DOI:10.1023/A:1024903616630.
- ↑ Gupta, C. K. Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580.
- ↑ Michael J. Magyar. Commodity Summary 2009:Molybdenum. United States Geological Survey. Проверено 26 сентября 2010. Архивировано из первоисточника 20 июня 2012.
- ↑ D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — Вып. 102. — С. 25.
- ↑ Neikov Oleg D. Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220.
- ↑ Joseph R. Davis. Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969.
- ↑ 1 2 John Hebda Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001. Архивировано из первоисточника 17 декабря 2008.
- ↑ J. W. Wilson. Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624.
Для дополнительного чтения
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5–9 June 2000, London: James & James Ltd (2000). Проверено 26 сентября 2010.
- Donald Spink Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019.
- Earl Hayes Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020.
| ||||||||||||||||||||||||||||||||||||||
тугоплавкие металлы в, тугоплавкие металлы и, тугоплавкие металлы природоведение, тугоплавкие металлы химия
Тугоплавкие металлы Информацию О

Тугоплавкие металлы Комментарии
Тугоплавкие металлы
Тугоплавкие металлы
Тугоплавкие металлы Вы просматриваете субъект
Тугоплавкие металлы что, Тугоплавкие металлы кто, Тугоплавкие металлы описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
2.2.4. Тугоплавкие металлы
Ктугоплавким относятся металлы с температурой плавления выше 1700°С: вольфрам, молибден, тантал, ниобий, хром, цирконий, рений. Чаще всего их получают методами порошковой металлургии с использованием электровакуумных технологий выплавки и очистки.
Применение тугоплавких металлов:
•изделия электровакуумной техники;
•нагревательные элементы;
•испарители в установках термического осаждения для получения тонких высокопроводящих и резистивных пленок;
•тонкопленочные резисторы;
•термопары для измерения высоких температур.
Все тугоплавкие металлы при нагревании на воздухе до температур выше 600°С интенсивно окисляются с образованием летучих оксидов. Поэтому в качестве нагревательных элементов они работают в вакууме или в защитной инертной среде, например в аргоне. Тугоплавкие металлы имеют ничтожно малое давление насыщенных паров — важное качество для материала испарителя при получении тонких пленок.
Вольфрам (W) — наиболее тугоплавкий из всех металлов (Тпл = 3400°С), имеет высокую твердость, хорошую проводимость
(ρ = 0,055 мкОм·м).
Вольфрам — один из важнейших материалов электровакуумной техники. Благодаря волокнистой структуре, приобретаемой в результате обработки ковкой и волочением, тонкая вольфрамовая проволока диаметром до 0,01мм обладает высокой гибкостью. Вольфрам — основной материал для изготовления нитей ламп накаливания. Однако проволока и спирали из чистого вольфрама при высоких температурах становятся хрупкими вследствие процессов рекристаллизации, сопровождающихся интенсивным ростом зерна до размеров поперечного сечения проволоки. Для улучшения свойств чистого вольфрама в него вводят различные присадки. Оксид тория Th3O3 замедляет процесс рекристаллизации и препятствует росту зерна, добавки оксидов кремния SiO2 и алюминия Al2O3 улучшают формоустойчивость вольфрамовой проволоки. В элек-
35
тровакуумном производстве применяют вольфрам марок ВА (с кремне-алюминиевойприсадкой) и ВТ (с присадкой оксида тория).
Из вольфрама изготовляют катоды высокого напряжения мощных генераторных ламп, рентгеновских трубок с рабочей температурой 2200…2800 К. Вольфрамовые катоды обладают стабильной эмиссией электронов и способностью работать в высоком вакууме. Катоды из торированного вольфрама ВТ имеют более высокие эмиссионные свойства.
Вольфрам обладает наименьшим температурным коэффициентом линейного расширения среди всех чистых металлов (αl =
= 4,4 10-6К-1).Это свойство используется для изготовления термически стойких спаев вольфрама с тугоплавкими стеклами.
Вольфрам и его сплавы с молибденом, иридием, рением используют также для нагревательных элементов, работающих при температурах выше 1200°С, и для высокотемпературных термопар. Благодаря высокой твердости, дугостойкости, электроэрозионной стойкости и низкой свариваемости вольфрам широко используется в высоконагруженных разрывных контактах.
Молибден (Mo) — аналог вольфрама, но несколько менее тугоплавкий (Тпл = 2620°С) и менее твердый. Отожженный молибден с мелкозернистой структурой значительно пластичнее вольфрама, он широко используется для различных деталей сложной конфигурации. Среди всех тугоплавких металлов молибден обладает наименьшим удельным сопротивлением (ρ = 0,05 мкОм·м).
Молибден используется для нагревательных элементов в высокотемпературных (до 1700°С) электрических печах, работающих в защитной атмосфере. Из молибдена изготовляют сетки и электроды электронных ламп и другие вспомогательные детали электровакуумных приборов (крючки, нити, подвески), работающие в напряженном тепловом режиме.
Большое практическое значение имеют сплавы вольфрама с молибденом, которые образуют структуру твердого раствора во всем диапазоне концентраций. Сплавы, содержащие 45%Мо, обладают максимальным удельным сопротивлением и твердостью, высокой эрозионной стойкостью. Их применяют для высоконагруженных контактов в защитной среде.W-Mo-сплавыиспользуют также
для нитей накаливания электроламп и катодов подогрева, так как они имеют более высокие механические свойства, чем чистый вольфрам, хотя и более низкие допустимые рабочие температуры.
Рений (Re) — редкий и тяжелый металл с температурой плавления, близкой к температуре плавления вольфрама (Тпл = 3180°С). Рений твердый и прочный, как вольфрам, и пластичный, как молибден, имеет высокое удельное сопротивление (ρ = 0,214 мкОм·м), стоек к дуге постоянного тока. Рений часто применяют в сплавах для высоконагруженных разрывных контактов, например, сплавы W+15…20%Re отличаются повышенной износостойкостью.
Рений и его сплавы с вольфрамом применяют в производстве электровакуумных приборов взамен вольфрама, так как он меньше испаряется в атмосфере водорода, отличается более длительным сроком службы. Re- и W-Re-сплавыиспользуются для термопар до 2500…2800°С в защитной среде.
Врадиоэлектронике рений применяют для защиты от коррозии
иизноса деталей из меди, вольфрама и молибдена. Тонкие пленки рения используются для прецизионных резисторов в интегральных схемах.
Тантал (Та) по тугоплавкости несколько уступает вольфраму (Тпл = 3000°С), но значительно превосходит его по пластичности, что позволяет изготовлять фасонные детали, проволоку и фольгу толщиной до 10 мкм. Тантал образует на поверхности плотную оксидную пленку Та2О5, устойчивую до температуры 1500°С. Это свойство используется при производстве электролитических и тонкопленочных конденсаторов высокой удельной емкости, получаемых путем анодного оксидирования.
Тантал широко используется в электровакуумной технике для ответственных деталей: анодов и сеток генераторных ламп, катодов накаливания. Благодаря своей способности поглощать газы в диапазоне температур 600…1200°С, тантал применяют в вакуумной аппаратуре в качестве стабилизатора высокого вакуума (геттера). Тантал используется также в тонкопленочных технологиях при производстве резисторов. На воздухе происходит активное растворение азота в танталовой пленке с образованием нитридной пленки Та2N, обладающей высокой стабильностью свойств.
Ниобий (Nb) — металл, близкий по свойствам к танталу, но более легкоплавкий (Тпл = 2500°С), обладает высокой газопоглощающей способностью в температурном интервале 400…900°С. Поэтому в электровакуумных приборах детали из ниобия одновременно выполняют функции геттера. У ниобия среди всех тугоплавких металлов наименьшая работа выхода электронов, его применяют в качестве катодов накаливания в мощных генераторных лампах. Среди всех химических элементов ниобий обладает самой высокой критической температурой перехода в сверхпроводящее состояние (Тсв = = 9,2 К). Поэтому ниобий, как и тантал (Тсв = 4,5 К), применяют в криогенной технике.
Хром (Cr) обладает сравнительно невысокой температурой плавления (Тпл = 1900°С) по сравнению с другими тугоплавкими металлами, но в противоположность остальным металлам этой группы является весьма распространенным в земной коре. Его отличительная особенность — высокая стойкость к окислению, поэтому хром используется для защитных покрытий изделий (хромирование), в том числе эксплуатируемых при повышенных температурах.
Хром обладает хорошей адгезионной способностью к стеклу, керамике, ситаллам и хорошо совместим с другими проводящими материалами. Поэтому технология осаждения тонких пленок хрома на подложку широко используется в микроэлектронике при изготовлении резисторов, адгезионных подслоев для контактных площадок
итокопроводящих соединений.
2.2.5.Сверхпроводящие металлы и сплавы
Сверхпроводимость — это состояние вещества, характеризуемое отсутствием электрического сопротивления. Сверхпроводимость наблюдается у ряда металлов и сплавов при температурах, близких к абсолютному нулю. Температура перехода в сверхпрово-
дящее состояние называется критической температурой сверхпроводимости -Тсв.
При температуре ниже Тсв электрический ток, наведенный в сверхпроводящем контуре, будет циркулировать бесконечно долго, не убывая, при условии поддержания низкой температуры. Удель-
ное сопротивление материала в сверхпроводящем состоянии составляет порядка 10-25 Ом·м, что в 1017 раз меньше, чем у меди.
Физическая природа сверхпроводимости. Впервые явление сверхпроводимости было обнаружено у ртути (Тсв = 4,2 К) голландским физиком Камерлинком-Онессом в 1911 г. Современная теория сверхпроводимости, основанная на квантовых представлениях, была предложена в 1957 г. американскими учеными Бардиным, Купером и Шриффером. Значительный вклад в развитие теории сверхпроводимости внесли работы советского академика Н.Н.Боголюбова.
В металле свободные электроны, движущиеся в среде положительно заряженных ионов, взаимодействуют с тепловыми колебаниями решетки, обмениваясь с ней квантами тепловой энергии — фононами, при этом электроны могут поглощать или отдавать энергию, т.е. изменять свой импульс. Обмен фононами между электронами при участии решетки происходит непрерывно. В результате обменного фононного взаимодействия пара электронов с разными импульсами и антипараллельными спинами испытывают взаимное притяжение и образуют так называемую куперовскую пару.
Рассмотрим упрощенную схему (рис. 9). Электрон 1, движущийся между ионами, притягивает ближайшие ионы, создавая по траектории движения локальную зону повышенной плотности положительного заряда. Электрон 2, движущийся вслед за первым, притягивается этой зоной. В результате, косвенным образом, через решетку, между электронами возникают силы притяжения. Силы притяжения невелики, парные образования слабо локализованы в пространстве, они постоянно распадаются и создаются, образуя электронный конденсат.
При низких температурах (<Тсв) энергия тепловых колебаний решетки чрезвычайно мала и спаренные электроны не рассеиваются на дефектах структуры. Особенность куперовских пар — их импульсная упорядоченность. Электронные волны, описывающие движение пар, имеют одинаковую длину и фазу. Фактически движение всех электронных пар можно рассматривать как распространение одной электронной волны, которая не рассеивается решеткой, «обтекает» дефекты структуры.
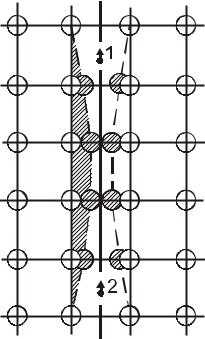
Рис. 9. Схема образования электронных пар в сверхпроводнике
При температуре абсолютного нуля все электроны, расположенные вблизи уровня Ферми, связаны в пары. При повышении температуры часть электронных пар распадается. Неспаренные электроны переходят с основных уровней на возбужденные, и их движение затрудняется рассеянием на дефектах структуры. При температуре Тсв происходит полный разрыв всех куперовских пар, и состояние сверхпроводимости исчезает.
Сверхпроводники обладают специфическими магнитными свойствами. Поскольку электроны с противоположно направленными спинами связаны в пары, результирующий спиновый момент пары равен нулю, и сверхпроводник становится идеальным диамагнетиком. Как всякие диамагнетики, сверхпроводники выталкиваются из магнитного поля. Внешнее магнитное поле совершенно не проникает в толщину образца, затухая в тончайшем поверхностном слое (10-7…10-8 м). Эффект выталкивания выражен столь сильно, что с помощью магнитного поля можно удерживать постоянный магнит над кольцом из сверхпроводящего материала. Однако состояние сверхпроводимости может быть разрушено, если напряженность магнитного поля превысит некоторое критическое значениеНсв.
В настоящее время известно более 30 металлов, обладающих сверхпроводимостью при криогенных температурах, и более 1000
40
сверхпроводниковых сплавов и химических соединений различных элементов. Параметры некоторых сверхпроводниковых материалов представлены в табл. 5.
|
|
|
| Таблица 5 | ||
| Свойства сверхпроводниковых материалов | |||||
|
|
|
|
|
| |
| Сверхпровод- | Критическая | Сверхпровод- | Критическая |
|
|
| температура Тсв, | температура Тсв, | ||||
| ники | К | ники | К |
| |
|
|
| ||||
| Элементарные: | Сплавы: | ||||
| Ir | 0,14 | 35БТ | 8,7 |
|
|
| Al | 1,2 | 65БТ | 9,7 |
|
|
| In | 3,4 | Химические соединения: | |||
| Sn | 3,7 | ||||
|
|
|
|
| ||
| Hg | 4,2 | V3Ga | 14,8 |
|
|
| Ta | 4,5 | V3Si | 17 |
|
|
| V | 5,3 | Nb3Sn | 18,3 |
|
|
| Pb | 7,2 | Nb3Ga | 20,3 |
|
|
| Nb | 9,4 | Nb3Ge | 24,3 |
|
|
По характеру перехода материала из сверхпроводящего состояния в состояние обычной электропроводимости под действием магнитного поля различают сверхпроводники I и II рода. У сверхпроводников I рода этот переход происходит скачкообразно, как только напряженность поля достигнет критического значения.Сверхпроводники II рода переходят из одного состояния в другое постепенно. Большинство чистых металлов являются сверхпроводниками I рода с критическими температурами перехода ниже 4,2 К.
К сверхпроводникам II рода из чистых металлов можно отнести ниобий и ванадий. Из всех элементов, способных переходить в сверхпроводящее состояние, самую высокую критическую температуру перехода имеет ниобий — 9,4 К. К сверхпроводникам II рода относятся все интерметаллидные соединения и сплавы. Наиболее высокими критическими параметрами (значениями температуры перехода, критической напряженности магнитного поля и допустимых токов) обладают сплавы и соединения ниобия. Например, по проволоке из станнида ниобия Nb3Sn в полях с индукцией примерно 10 Тл можно пропускать ток с плотностью выше 109 А/м2 (103 А/мм2). Практическое использование нашли сверхпроводящие сплавы с высоким содержанием ниобия: 65БТ (63…68%Nb + 22…26%Ti +
8,5…11,5%Zr) и 35БТ (60…64%Ti + 33,5…36,5%Nb + 1,7…4,3%Zr).
Например, сплав 65БТ имеет критическое значение плотности тока
2,8.106 А/м2.
В 1986 г. было обнаружено явление высокотемпературной сверхпроводимости, которой обладают некоторые виды керамики на основе редкоземельных металлов с характерным расположением атомов. Например, соединения лантана La2-xМхСuО4 (где М = Ва, Sr) переходят в сверхпроводящее состояние при температуре, близкой к температуре жидкого азота. В сплавах иттрия YВа2Сu3О7 переход в сверхпроводящее состояние происходит при температуре — 173°С и выше.
Разрабатываются новые материалы, обладающие большей плотностью тока и более высокой температурой перехода в сверхпроводящее состояние. Перспективными в этом отношении являются так называемые висмутовые системы с химической формулой Bi2Sr2Са2Сu2Ох, температура перехода которых достигает-158°С.
Сверхпроводящие элементы и устройства находят все более широкое применение в самых различных областях науки и техники. Для достижения сверхпроводящего состояния в этих устройствах используется среда жидкого гелия или более дешевый хладоагент — жидкий водород.
Одно из главных применений сверхпроводников связано с получением сверхсильных магнитных полей напряженностью свыше 107 А/м. Это позволяет изготовлять обмотки мощных генераторов, электрических машин и трансформаторов с малой массой, размерами и очень высоким КПД. В сверхпроводящих системах не требуется внешний источник питания. Они применяются также для кабелей мощных линий электропередач, волноводов с малым затуханием, устройств памяти и управления. Сверхпроводники используют для изготовления мощных магнитов (например, поезда на магнитной подушке), криогенных гироскопов, якорь которых «плавает» в магнитном поле (опоры без трения).
studfiles.net
Тугоплавкие металлы
К тугоплавким относятся металлы с температурой плавления выше 1700°С: вольфрам, молибден, тантал, ниобий, хром, цирконий, рений. Чаще всего их получают методами порошковой металлургии с использованием электровакуумных технологий выплавки и очистки.
Применение тугоплавких металлов:
• изделия электровакуумной техники;
• нагревательные элементы;
• испарители в установках термического осаждения для получения тонких высокопроводящих и резистивных пленок;
• тонкопленочные резисторы;
• термопары для измерения высоких температур.
Все тугоплавкие металлы при нагревании на воздухе до температур выше 600°С интенсивно окисляются с образованием летучих оксидов. Поэтому в качестве нагревательных элементов они работают в вакууме или в защитной инертной среде, например в аргоне. Тугоплавкие металлы имеют ничтожно малое давление насыщенных паров важное качество для материала испарителя при получении тонких пленок.
Вольфрам (W) наиболее тугоплавкий из всех металлов (Тпл = 3400°С), имеет высокую твердость, хорошую проводимость (ρ = 0,055 мкОм·м).
Вольфрам один из важнейших материалов электровакуумной техники. Благодаря волокнистой структуре, приобретаемой в результате обработки ковкой и волочением, тонкая вольфрамовая проволока диаметром до 0,01мм обладает высокой гибкостью. Вольфрам основной материал для изготовления нитей ламп накаливания. Однако проволока и спирали из чистого вольфрама при высоких температурах становятся хрупкими вследствие процессов рекристаллизации, сопровождающихся интенсивным ростом зерна до размеров поперечного сечения проволоки. Для улучшения свойств чистого вольфрама в него вводят различные присадки. Оксид тория Th3O3 замедляет процесс рекристаллизации и препятствует росту зерна, добавки оксидов кремния SiO2 и алюминия Al2O3 улучшают формоустойчивость вольфрамовой проволоки. В электровакуумном производстве применяют вольфрам марок ВА (с кремне-алюминиевой присадкой) и ВТ (с присадкой оксида тория).
Из вольфрама изготовляют катоды высокого напряжения мощных генераторных ламп, рентгеновских трубок с рабочей температурой 2200…2800 К. Вольфрамовые катоды обладают стабильной эмиссией электронов и способностью работать в высоком вакууме. Катоды из торированного вольфрама ВТ имеют более высокие эмиссионные свойства.
Вольфрам обладает наименьшим температурным коэффициентом линейного расширения среди всех чистых металлов ( αl =
= 4,4⋅10-6К-1). Это свойство используется для изготовления термически стойких спаев вольфрама с тугоплавкими стеклами.
Вольфрам и его сплавы с молибденом, иридием, рением используют также для нагревательных элементов, работающих при температурах выше 1200°С, и для высокотемпературных термопар. Благодаря высокой твердости, дугостойкости, электроэрозионной стойкости и низкой свариваемости вольфрам широко используется в высоконагруженных разрывных контактах.
Молибден (Mo) аналог вольфрама, но несколько менее тугоплавкий (Тпл = 2620°С) и менее твердый. Отожженный молибден с мелкозернистой структурой значительно пластичнее вольфрама, он широко используется для различных деталей сложной конфигурации. Среди всех тугоплавких металлов молибден обладает наименьшим удельным сопротивлением (ρ = 0,05 мкОм·м).
Молибден используется для нагревательных элементов в высокотемпературных (до 1700°С) электрических печах, работающих в защитной атмосфере. Из молибдена изготовляют сетки и электроды электронных ламп и другие вспомогательные детали электровакуумных приборов (крючки, нити, подвески), работающие в напряженном тепловом режиме.
Большое практическое значение имеют сплавы вольфрама с молибденом, которые образуют структуру твердого раствора во всем диапазоне концентраций. Сплавы, содержащие 45%Мо, обладают максимальным удельным сопротивлением и твердостью, высокой эрозионной стойкостью. Их применяют для высоконагруженных контактов в защитной среде. W-Mo-сплавы используют также для нитей накаливания электроламп и катодов подогрева, так как они имеют более высокие механические свойства, чем чистый вольфрам, хотя и более низкие допустимые рабочие температуры.
Рений (Re) редкий и тяжелый металл с температурой плавления, близкой к температуре плавления вольфрама (Тпл = 3180°С). Рений твердый и прочный, как вольфрам, и пластичный, как молибден, имеет высокое удельное сопротивление (ρ = 0,214 мкОм·м), стоек к дуге постоянного тока. Рений часто применяют в сплавах для высоконагруженных разрывных контактов, например, сплавы W+15…20%Re отличаются повышенной износостойкостью.
Рений и его сплавы с вольфрамом применяют в производстве электровакуумных приборов взамен вольфрама, так как он меньше испаряется в атмосфере водорода, отличается более длительным сроком службы. Reи W-Re-сплавы используются для термопар до
2500…2800°С в защитной среде.
В радиоэлектронике рений применяют для защиты от коррозии и износа деталей из меди, вольфрама и молибдена. Тонкие пленки рения используются для прецизионных резисторов в интегральных схемах.
Тантал (Та) по тугоплавкости несколько уступает вольфраму (Тпл = 3000°С), но значительно превосходит его по пластичности, что позволяет изготовлять фасонные детали, проволоку и фольгу толщиной до 10 мкм. Тантал образует на поверхности плотную оксидную пленку Та2О5, устойчивую до температуры 1500°С. Это свойство используется при производстве электролитических и тонкопленочных конденсаторов высокой удельной емкости, получаемых путем анодного оксидирования.
Тантал широко используется в электровакуумной технике для ответственных деталей: анодов и сеток генераторных ламп, катодов накаливания. Благодаря своей способности поглощать газы в диапазоне температур 600…1200°С, тантал применяют в вакуумной аппаратуре в качестве стабилизатора высокого вакуума (геттера). Тантал используется также в тонкопленочных технологиях при производстве резисторов. На воздухе происходит активное растворение азота в танталовой пленке с образованием нитридной пленки Та2N, обладающей высокой стабильностью свойств.
Ниобий (Nb) металл, близкий по свойствам к танталу, но более легкоплавкий (Тпл = 2500°С), обладает высокой газопоглощающей способностью в температурном интервале 400…900°С. Поэтому в электровакуумных приборах детали из ниобия одновременно выполняют функции геттера. У ниобия среди всех тугоплавких металлов наименьшая работа выхода электронов, его применяют в качестве катодов накаливания в мощных генераторных лампах. Среди всех химических элементов ниобий обладает самой высокой критической температурой перехода в сверхпроводящее состояние (Тсв = 9,2 К). Поэтому ниобий, как и тантал (Тсв = 4,5 К), применяют в
криогенной технике.
Хром (Cr) обладает сравнительно невысокой температурой плавления (Тпл = 1900°С) по сравнению с другими тугоплавкими металлами, но в противоположность остальным металлам этой группы является весьма распространенным в земной коре. Его отличительная особенность высокая стойкость к окислению, поэтому хром используется для защитных покрытий изделий (хромирование), в том числе эксплуатируемых при повышенных температурах.
Хром обладает хорошей адгезионной способностью к стеклу, керамике, ситаллам и хорошо совместим с другими проводящими материалами. Поэтому технология осаждения тонких пленок хрома на подложку широко используется в микроэлектронике при изготовлении резисторов, адгезионных подслоев для контактных площадок и токопроводящих соединений.
Материал взят из книги Электротехнические материалы (Л.Г. Петрова)
studik.net
Тугоплавкие металлы — это… Что такое Тугоплавкие металлы?
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Тугоплавкие металлы | Расширенная группа тугоплавких металлов[1] |
Тугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию. Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как материаловедение, металлургия и в технических науках. Определение тугоплавких металлов относится к каждому элементу группы по разному. Основными представителями данного класса элементов являются элементы пятого периода — ниобий и молибден; шестого периода — тантал, вольфрам и рений. Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности. Благодаря порошковой металлургии из них можно получать детали для разных областей промышленности.
Определение
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, что бы металлы имели температуру плавления выше 2 200 °C. Это необходимо для их определения как тугоплавких металлов[2]. Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные[3], в то время как более широкое определение этих металлов позволяет включить в этот список еще и элементы имеющие температуру плавления 2123K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий. Трансурановые элементы (все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам[4].
Свойства
Физические свойства
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различается, потому что они являются членами различных групп[5][6].
Сопротивление к деформации ползучести (англ.) является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов[7][8].
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.[5]
Применение
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Вольфрам был найден в 1781 году шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C.
Вольфрам.Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило выше 90 %. Смешивание легирующего материала с ним низкое даже при спекании[9].
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь[10]. Нити накаливания, состоящие из вольфрама, находят свое применение в быту и в приборостроении. Лампы более эффективно преобразовывают электроэнергию в свет с повышением температуры[9]. В вольфрамовой газодуговой сварке (англ.) оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат[11][12]. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах[13]. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис»[14]. Иногда он находит свое применение благодаря своей плотности. Например, он находит свое применение в производстве клюшек для гольфа[15][16]. В таких деталях применение не ограничивается вольфрамом, так как более дорогой осмий тоже может быть использован.
Сплавы молибдена
Молибден.Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов[17].
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом[18][19].
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде[20][21][22][23].
Сплавы ниобия
Ниобий. Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путем отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит свое применение при создании сопел в жидкостных ракетных двигателях, например таких как Apollo CSM (англ.)[24]. Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C[24].
Тантал
Тантал.Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Рений.Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов[25].
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает это одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350K до 1900K). Как было указано выше, они не должны контактировать с кислородом.
См. также
Примечания
- ↑ H. Ortner International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Архивировано из первоисточника 20 июня 2012. Проверено 26 сентября 2010.
- ↑ Michael Bauccio Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 19939780871704788
- ↑ Wilson, J. W General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624
- ↑ Joseph R. Davis Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444
- ↑ 1 2 Borisenko, V. A. Investigation of the temperature dependence of the hardness of molybdenum in the range of 20—2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — DOI:10.1007/BF00775076
- ↑ Fathi, Habashi Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — DOI:10.1080/08827509808962488
- ↑ Schmid, Kalpakjian Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358
- ↑ Weroński, Andrzej; Hejwowski, Tadeusz Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265
- ↑ 1 2 Erik Lassner, Wolf-Dieter Schubert Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532
- ↑ National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- ↑ Michael K. Harris Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287
- ↑ William L. Galvery, Frank M. Marlow Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517
- ↑ W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics..
- ↑ P. Ramakrishnan Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303
- ↑ Arora, Arran Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — В. 19. — № 4. — С. 210—216.
- ↑ V. S. Moxson, F. H. Froes Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — В. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z
- ↑ Robert E. Smallwood TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 19849780803102033
- ↑ Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A. Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — В. 39. — С. 374—376. — DOI:10.1023/A:1024903616630
- ↑ Gupta, C. K. Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580
- ↑ Michael J. Magyar Commodity Summary 2009:Molybdenum. United States Geological Survey. Архивировано из первоисточника 20 июня 2012. Проверено 26 сентября 2010.
- ↑ D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — В. 102. — С. 25.
- ↑ Neikov Oleg D. Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220
- ↑ Joseph R. Davis Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969
- ↑ 1 2 John Hebda Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001.
- ↑ J. W. Wilson Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624
Литература
- Levitin, Valim High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5—9 June 2000, London: James & James Ltd (2000). Проверено 26 сентября 2010.
- Donald Spink Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — В. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019
- Earl Hayes Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — В. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020
xzsad.academic.ru
