Щёлочноземельные металлы — Gpedia, Your Encyclopedia
| Группа → | 2 | |
|---|---|---|
| ↓ Период | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 |
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra)[2][3], унбинилий (Ubn).
Бериллий и магний
Раньше Be и Mg не относили к щёлочноземельным металлам, потому что их гидроксиды не являются щелочами. Be(OH)2 — амфотерный гидроксид. Mg(OH)2 — малорастворимое основание, которое дает слабощелочную реакцию и окрашивает индикатор.
Be не реагирует с водой, Mg — очень медленно (при обычных условиях) в отличие от всех остальных щёлочноземельных металлов.
Однако сегодня, согласно определению ИЮПАК, бериллий и магний относят к щёлочноземельным.
Физические свойства
К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако согласно номенклатуре ИЮПАК щёлочноземельными металлами следует считать все элементы 2-й группы[2]. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже обладает некоторыми химическими свойствами, общими для щелочноземельных металлов, но в остальном заметно отличается от них, в частности, значительно меньшей активностью, и рядом свойств напоминает всё тот же алюминий.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см 3).
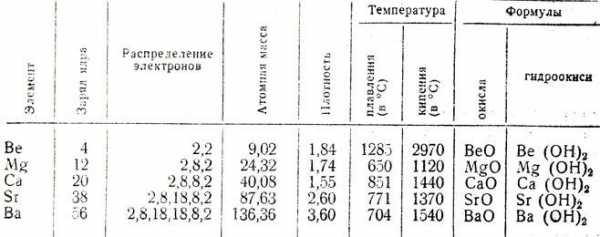
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм (По Полингу) | Ионный радиус, нм (По Полингу) | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,031 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,065 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,113 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,135 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
| 120 | Унбинилий Ubn |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
- Be+2H+⟶Be2++h3↑{\displaystyle {\mathsf {Be+2H^{+}\longrightarrow Be^{2+}+H_{2}\uparrow }}}
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
- Be+2OH−+2h3O→[Be(OH)4]2−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}+2H_{2}O\rightarrow [Be(OH)_{4}]^{2-}+H_{2}\uparrow }}}
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
- Be+2OH−→BeO22−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}\rightarrow BeO_{2}^{2-}+H_{2}\uparrow }}}
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (магний с холодной водой реагирует очень медленно, но при внесении раскалённого порошка магния в воду, а также в горячей воде — бурно):
- Sr+2h3O⟶Sr(OH)2+h3↑{\displaystyle {\mathsf {Sr+2H_{2}O\longrightarrow Sr(OH)_{2}+H_{2}\uparrow }}}
Также кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
- Ca+h3⟶Cah3{\displaystyle {\mathsf {Ca+H_{2}\longrightarrow CaH_{2}}}}
- 3Sr+N2⟶Sr3N2{\displaystyle {\mathsf {3Sr+N_{2}\longrightarrow Sr_{3}N_{2}}}}
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
- BeO+2NaOH+h3O⟶Na2[Be(OH)4]{\displaystyle {\mathsf {BeO+2NaOH+H_{2}O\longrightarrow Na_{2}[Be(OH)_{4}]}}}
- BeO+2HCl⟶BeCl2+h3O{\displaystyle {\mathsf {BeO+2HCl\longrightarrow BeCl_{2}+H_{2}O}}}
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
- MgO+2HCl⟶MgCl2+h3O{\displaystyle {\mathsf {MgO+2HCl\longrightarrow MgCl_{2}+H_{2}O}}}
- MgO+h3O⟶Mg(OH)2{\displaystyle {\mathsf {MgO+H_{2}O\longrightarrow Mg(OH)_{2}}}}
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
- CaO+h3O⟶Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}}}
- SrO+2HCl⟶SrCl2+h3O{\displaystyle {\mathsf {SrO+2HCl\longrightarrow SrCl_{2}+H_{2}O}}}
- BaO+Al2O3 →to Ba(AlO2)2{\displaystyle {\mathsf {BaO+Al_{2}O_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}}}}
- BaO+2Al(OH)3 →to Ba(AlO2)2+3h3O{\displaystyle {\mathsf {BaO+2Al(OH)_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}+3H_{2}O}}}
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
- Be(OH)2+2KOH⟶K2BeO2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2KOH\longrightarrow K_{2}BeO_{2}+2H_{2}O}}}
- Be(OH)2+2HCl⟶BeCl2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2HCl\longrightarrow BeCl_{2}+2H_{2}O}}}
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого Mg(OH)2 до очень сильного Ra(OH)2, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
- Ba(OH)2+SO3⟶BaSO4+h3O{\displaystyle {\mathsf {Ba(OH)_{2}+SO_{3}\longrightarrow BaSO_{4}+H_{2}O}}}
- 3Sr(OH)2+2h4PO4⟶Sr3(PO4)2+6h3O{\displaystyle {\mathsf {3Sr(OH)_{2}+2H_{3}PO_{4}\longrightarrow Sr_{3}(PO_{4})_{2}+6H_{2}O}}}
- Ra(OH)2+Al2O3⟶Ra(AlO2)2+h3O{\displaystyle {\mathsf {Ra(OH)_{2}+Al_{2}O_{3}\longrightarrow Ra(AlO_{2})_{2}+H_{2}O}}}
- Ba(OH)2+Zn(OH)2⟶Ba[Zn(OH)4]{\displaystyle {\mathsf {Ba(OH)_{2}+Zn(OH)_{2}\longrightarrow Ba[Zn(OH)_{4}]}}}
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) на Земле. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, содержание которого равно относительно массы земной коры оценивается по-разному: от 2 % до 13,3 %[4]. Немногим ему уступает магний, содержание которого равно 2,35 %. Распространены в природе также барий и стронций, содержание которых соответственно равно 0,039 % и 0,0384 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 2·10−4% от массы земной коры. Радиоактивный радий — это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[5][неавторитетный источник?][6].
Биологическая роль
Магний содержится в тканях животных и растений (например, в хлорофилле), является кофактором многих ферментативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция состоят минеральные «скелеты» некоторых представителей многих групп беспозвоночных (губки, кишечнополостные, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы: мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях[прояснить], так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария (кроме сульфата ввиду его чрезвычайно малой растворимости) и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Примечания
www.gpedia.com
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — это… Что такое ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ?
- ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
ПОДГРУППА IIA
БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ
Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя элементами, которые собственно и образуют семейство щелочноземельных металлов. Фактически, бериллий и в меньшей степени магний более сходны с первыми элементами подгруппы IIIA. Особенностью электронного строения любого элемента подгруппы IIA является наличие двух электронов на внешнем слое и внутренняя электронная структура по типу предыдущего благородного газа. Способность отдавать два внешних валентных электрона возрастает в подгруппе с увеличением атомного радиуса и атомного номера элемента. Максимальная степень окисления составляет II, но имеются сведения о существовании соединений со степенью окисления I. Такие соединения неустойчивы и диспропорционируют с образованием свободного металла и иона М(II).
Физические и химические свойства. Все элементы подгруппы IIA химически активны и поэтому в свободном состоянии в природе не существуют. Щелочноземельные металлы энергично реагируют с водой, вытесняя водород и образуя гидроксиды, как и щелочные металлы. Магний взаимодействует только с кипящей водой, а бериллий не реагирует даже с парами при высокой температуре. Бериллий отличается от остальных элементов подгруппы и даже от магния по химическим и многим физическим свойствам. Такое отличие характерно для всех элементов, начинающих подгруппы А, что объясняется малым радиусом иона и соответственно высокой зарядовой плотностью. Особенности и отличия свойств бериллия приведены ниже.
Физические свойства. Бериллий очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу (табл. 3).
Кристаллическая структура. Различие в физических свойствах всех металлов этой подгруппы объясняется различием их кристаллической структуры, а кальций имеет две модификации.
Взаимодействие с кислотами. Все эти элементы реагируют с разбавленными растворами минеральных кислот (типа HCl), а бериллий растворяется менее энергично. Соли бериллия (продукты реакций бериллия с кислотами, например, BeCl2) имеют более ковалентную связь, чем соли других металлов этой подгруппы, и поэтому обладают в растворе меньшей электропроводностью. В водных растворах соли бериллия гидратированы благодаря малому радиусу иона Be2+ и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие от других металлов плохо реагирует с азотной кислотой, так как на поверхности образуется защитная пассивирующая пленка BeO.
Оксиды и гидроксиды. При взаимодействии с кислородом Be и Mg образуют оксиды МО, а другие, более активные металлы, могут образовывать и пероксиды, например BaO2. Пероксиды могут образовываться и по реакции гидроксидов Ca, Sr и Ba с h3O2. Растворимость гидроксидов возрастает по мере увеличения радиуса иона и ослабления притяжения между ионом металла и гидроксид-ионом.
Комплексообразование. Ион Be2+ обладает высоким химическим сродством к ионам или молекулам, имеющим электронную пару. Например, 2 иона :Cl:предоставляют две электронные пары для образования химической связи в :Cl:Be:Cl:, 4 электрона распределяются на 2s- и 2p-гибридизованных орбиталях, формируя линейное строение молекулы BeCl2 с ковалентными свойствами. Be2+ способен удерживать большее число электронных пар, образуя различные комплексные ионы с координационным числом 4 (наиболее стабильные лиганды гидроксид-ион, альдегид, эфир, дикарбоновые кислоты, дикетоны). Be2+, как и другие члены подгруппы IIA, образует устойчивые комплексы с этилендиаминтетрауксусной кислотой (ЭДТА). Благодаря прочности комплексов с ЭДТА эта кислота часто используется для анализа содержания кальция и магния
см. также ХИМИЯ АНАЛИТИЧЕСКАЯ.
Источники сырья и применение.
См. также МАГНИЕВАЯ ПРОМЫШЛЕННОСТЬ.
Остальные металлы этой подгруппы получают электролизом расплавов их солей, они также имеют несколько крупных областей применения. Так, прокаливание известняка (минерал, содержащий CaCO3, MgCO3 и силикаты) с целью получения оксида кальция негашеной извести является многотоннажным производством. При частичной гидратации получается гашеная известь. Оба продукта применяются в производстве цемента, штукатурки и строительного раствора. Сульфат кальция соcтава CaSO4Ч0,5h3O известен как гипс, который при смешении с водой затвердевает с небольшим расширением в результате образования CaSO4*2h3O. См. также КАЛЬЦИЙ.
Энциклопедия Кольера. — Открытое общество. 2000.
- ЩЕЛОЧНЫЕ МЕТАЛЛЫ
- АЛЮМИНИЯ СЕМЕЙСТВО
Смотреть что такое «ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ» в других словарях:
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ, двухвалентные металлы, составляющие вторую группу периодической таблицы: БЕРИЛЛИЙ, МАГНИЙ, КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ и РАДИЙ. Все они отличаются легкостью, мягкостью и сильной реактивностью. Все эти металлы, кроме… … Научно-технический энциклопедический словарь
щелочноземельные металлы — Группа, включ. Са, Sr, Ba и Ra; первые три применяются в металлургии в кач ве раскислителей. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN alkali earth metals … Справочник технического переводчика
Щелочноземельные металлы — Alkaline earth metals Щелочноземельные металлы. Металлы второй группы Периодической системы, а именно: бериллий, магний, кальций, стронций, барий и радий называются так потому, что оксиды кальция, стронция и бария ранее были найдены химиками в… … Словарь металлургических терминов
щелочноземельные металлы — [alkali earth metals] группа, включающая Са, Sr, Ba и Ra; первые три применяются в металлургии в качестве раскислителей; Смотри также: Металлы щелочные металлы чистые металлы ультрачистые металлы … Энциклопедический словарь по металлургии
Щелочноземельные металлы — Щёлочноземельные металлы химические элементы: кальций Ca, стронций Sr, барий Ba, радий Ra (иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg). Названы так потому, что их оксиды «земли» (по терминологии алхимиков)… … Википедия
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — хим. элементы II гр. периодич. системы Менделеева: кальций, стронций, барий и радий. Назв. связано с тем, что их оксиды ( земли по терминологии алхимиков) сообщают воде щелочную реакцию. Химически Щ. м. весьма активны, причём их активность… … Большой энциклопедический политехнический словарь
Щелочные и щелочноземельные металлы — (хим.), или металлы щелочей и щелочных земель. Нерастворимые в воде окислы металлов, а также и некоторых неметаллов прежде называли землями за их порошковый вид. Среди этих земель легко отличить такие, которые хотя и мало растворимы, но образуют… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
МЕТАЛЛЫ — МЕТАЛЛЫ, химические элементы, обладающие высокой тепло и электропроводностью, атомы которых связаны в кристаллические решетки единственным в своем роде способом. Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь
Металлы как горючие — Металлы как ракетное горючие, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но уменьшает… … Википедия
Металлы как горючее — Металлы как ракетное горючее, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но… … Википедия
Книги
- Химия за 30 секунд, Коллектив авторов. Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 194 руб аудиокнига
dic.academic.ru
Щёлочноземельные металлы — Википедия РУ
Раньше Be и Mg не относили к щёлочноземельным металлам, потому что их гидроксиды не являются щелочами. Be(OH)2 — амфотерный гидроксид. Mg(OH)2 — малорастворимое основание, которое дает слабощелочную реакцию и окрашивает индикатор.
Be не реагирует с водой, Mg — очень медленно (при обычных условиях) в отличие от всех остальных щёлочноземельных металлов.
Однако сегодня, согласно определению ИЮПАК, бериллий и магний относят к щёлочноземельным.
К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако согласно номенклатуре ИЮПАК щёлочноземельными металлами следует считать все элементы 2-й группы[2]. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже обладает некоторыми химическими свойствами, общими для щелочноземельных металлов, но в остальном заметно отличается от них, в частности, значительно меньшей активностью, и рядом свойств напоминает всё тот же алюминий.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм (По Полингу) | Ионный радиус, нм (По Полингу) | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,031 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,065 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,113 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,135 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
| 120 | Унбинилий Ubn |
а Радиоактивные изотопы
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
- Be+2H+⟶Be2++h3↑{\displaystyle {\mathsf {Be+2H^{+}\longrightarrow Be^{2+}+H_{2}\uparrow }}}
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
- Be+2OH−+2h3O→[Be(OH)4]2−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}+2H_{2}O\rightarrow [Be(OH)_{4}]^{2-}+H_{2}\uparrow }}}
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
- Be+2OH−→BeO22−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}\rightarrow BeO_{2}^{2-}+H_{2}\uparrow }}}
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (магний с холодной водой реагирует очень медленно, но при внесении раскалённого порошка магния в воду, а также в горячей воде — бурно):
- Sr+2h3O⟶Sr(OH)2+h3↑{\displaystyle {\mathsf {Sr+2H_{2}O\longrightarrow Sr(OH)_{2}+H_{2}\uparrow }}}
Также кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
- Ca+h3⟶Cah3{\displaystyle {\mathsf {Ca+H_{2}\longrightarrow CaH_{2}}}}
- 3Sr+N2⟶Sr3N2{\displaystyle {\mathsf {3Sr+N_{2}\longrightarrow Sr_{3}N_{2}}}}
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
- BeO+2NaOH+h3O⟶Na2[Be(OH)4]{\displaystyle {\mathsf {BeO+2NaOH+H_{2}O\longrightarrow Na_{2}[Be(OH)_{4}]}}}
- BeO+2HCl⟶BeCl2+h3O{\displaystyle {\mathsf {BeO+2HCl\longrightarrow BeCl_{2}+H_{2}O}}}
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
- MgO+2HCl⟶MgCl2+h3O{\displaystyle {\mathsf {MgO+2HCl\longrightarrow MgCl_{2}+H_{2}O}}}
- MgO+h3O⟶Mg(OH)2{\displaystyle {\mathsf {MgO+H_{2}O\longrightarrow Mg(OH)_{2}}}}
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
- CaO+h3O⟶Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}}}
- SrO+2HCl⟶SrCl2+h3O{\displaystyle {\mathsf {SrO+2HCl\longrightarrow SrCl_{2}+H_{2}O}}}
- BaO+Al2O3 →to Ba(AlO2)2{\displaystyle {\mathsf {BaO+Al_{2}O_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}}}}
- BaO+2Al(OH)3 →to Ba(AlO2)2+3h3O{\displaystyle {\mathsf {BaO+2Al(OH)_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}+3H_{2}O}}}
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
- Be(OH)2+2KOH⟶K2BeO2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2KOH\longrightarrow K_{2}BeO_{2}+2H_{2}O}}}
- Be(OH)2+2HCl⟶BeCl2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2HCl\longrightarrow BeCl_{2}+2H_{2}O}}}
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого Mg(OH)2 до очень сильного Ra(OH)2, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
- Ba(OH)2+SO3⟶BaSO4+h3O{\displaystyle {\mathsf {Ba(OH)_{2}+SO_{3}\longrightarrow BaSO_{4}+H_{2}O}}}
- 3Sr(OH)2+2h4PO4⟶Sr3(PO4)2+6h3O{\displaystyle {\mathsf {3Sr(OH)_{2}+2H_{3}PO_{4}\longrightarrow Sr_{3}(PO_{4})_{2}+6H_{2}O}}}
- Ra(OH)2+Al2O3⟶Ra(AlO2)2+h3O{\displaystyle {\mathsf {Ra(OH)_{2}+Al_{2}O_{3}\longrightarrow Ra(AlO_{2})_{2}+H_{2}O}}}
- Ba(OH)2+Zn(OH)2⟶Ba[Zn(OH)4]{\displaystyle {\mathsf {Ba(OH)_{2}+Zn(OH)_{2}\longrightarrow Ba[Zn(OH)_{4}]}}}
Магний содержится в тканях животных и растений (например, в хлорофилле), является кофактором многих ферментативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция состоят минеральные «скелеты» некоторых представителей многих групп беспозвоночных (губки, кишечнополостные, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы: мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях[прояснить], так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария (кроме сульфата ввиду его чрезвычайно малой растворимости) и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
http-wikipediya.ru
Щелочноземельные металлы — это… Что такое Щелочноземельные металлы?
- Щелоков Н.
- Щелочные почвы
Смотреть что такое «Щелочноземельные металлы» в других словарях:
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ, двухвалентные металлы, составляющие вторую группу периодической таблицы: БЕРИЛЛИЙ, МАГНИЙ, КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ и РАДИЙ. Все они отличаются легкостью, мягкостью и сильной реактивностью. Все эти металлы, кроме… … Научно-технический энциклопедический словарь
щелочноземельные металлы — Группа, включ. Са, Sr, Ba и Ra; первые три применяются в металлургии в кач ве раскислителей. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN alkali earth metals … Справочник технического переводчика
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ПОДГРУППА IIA БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя… … Энциклопедия Кольера
Щелочноземельные металлы — Alkaline earth metals Щелочноземельные металлы. Металлы второй группы Периодической системы, а именно: бериллий, магний, кальций, стронций, барий и радий называются так потому, что оксиды кальция, стронция и бария ранее были найдены химиками в… … Словарь металлургических терминов
щелочноземельные металлы — [alkali earth metals] группа, включающая Са, Sr, Ba и Ra; первые три применяются в металлургии в качестве раскислителей; Смотри также: Металлы щелочные металлы чистые металлы ультрачистые металлы … Энциклопедический словарь по металлургии
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — хим. элементы II гр. периодич. системы Менделеева: кальций, стронций, барий и радий. Назв. связано с тем, что их оксиды ( земли по терминологии алхимиков) сообщают воде щелочную реакцию. Химически Щ. м. весьма активны, причём их активность… … Большой энциклопедический политехнический словарь
Щелочные и щелочноземельные металлы — (хим.), или металлы щелочей и щелочных земель. Нерастворимые в воде окислы металлов, а также и некоторых неметаллов прежде называли землями за их порошковый вид. Среди этих земель легко отличить такие, которые хотя и мало растворимы, но образуют… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
МЕТАЛЛЫ — МЕТАЛЛЫ, химические элементы, обладающие высокой тепло и электропроводностью, атомы которых связаны в кристаллические решетки единственным в своем роде способом. Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь
Металлы как горючие — Металлы как ракетное горючие, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но уменьшает… … Википедия
Металлы как горючее — Металлы как ракетное горючее, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но… … Википедия
Книги
- Химия за 30 секунд, Коллектив авторов. Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 194 руб аудиокнига
dic.academic.ru
Щёлочноземельные металлы — википедия орг
Раньше Be и Mg не относили к щёлочноземельным металлам, потому что их гидроксиды не являются щелочами. Be(OH)2 — амфотерный гидроксид. Mg(OH)2 — малорастворимое основание, которое дает слабощелочную реакцию и окрашивает индикатор.
Be не реагирует с водой, Mg — очень медленно (при обычных условиях) в отличие от всех остальных щёлочноземельных металлов.
Однако сегодня, согласно определению ИЮПАК, бериллий и магний относят к щёлочноземельным.
К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако согласно номенклатуре ИЮПАК щёлочноземельными металлами следует считать все элементы 2-й группы[2]. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже обладает некоторыми химическими свойствами, общими для щелочноземельных металлов, но в остальном заметно отличается от них, в частности, значительно меньшей активностью, и рядом свойств напоминает всё тот же алюминий.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм (По Полингу) | Ионный радиус, нм (По Полингу) | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,031 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,065 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,113 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,135 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
| 120 | Унбинилий Ubn |
а Радиоактивные изотопы
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
- Be+2H+⟶Be2++h3↑{\displaystyle {\mathsf {Be+2H^{+}\longrightarrow Be^{2+}+H_{2}\uparrow }}}
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
- Be+2OH−+2h3O→[Be(OH)4]2−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}+2H_{2}O\rightarrow [Be(OH)_{4}]^{2-}+H_{2}\uparrow }}}
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
- Be+2OH−→BeO22−+h3↑{\displaystyle {\mathsf {Be+2OH^{-}\rightarrow BeO_{2}^{2-}+H_{2}\uparrow }}}
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (магний с холодной водой реагирует очень медленно, но при внесении раскалённого порошка магния в воду, а также в горячей воде — бурно):
- Sr+2h3O⟶Sr(OH)2+h3↑{\displaystyle {\mathsf {Sr+2H_{2}O\longrightarrow Sr(OH)_{2}+H_{2}\uparrow }}}
Также кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
- Ca+h3⟶Cah3{\displaystyle {\mathsf {Ca+H_{2}\longrightarrow CaH_{2}}}}
- 3Sr+N2⟶Sr3N2{\displaystyle {\mathsf {3Sr+N_{2}\longrightarrow Sr_{3}N_{2}}}}
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
- BeO+2NaOH+h3O⟶Na2[Be(OH)4]{\displaystyle {\mathsf {BeO+2NaOH+H_{2}O\longrightarrow Na_{2}[Be(OH)_{4}]}}}
- BeO+2HCl⟶BeCl2+h3O{\displaystyle {\mathsf {BeO+2HCl\longrightarrow BeCl_{2}+H_{2}O}}}
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
- MgO+2HCl⟶MgCl2+h3O{\displaystyle {\mathsf {MgO+2HCl\longrightarrow MgCl_{2}+H_{2}O}}}
- MgO+h3O⟶Mg(OH)2{\displaystyle {\mathsf {MgO+H_{2}O\longrightarrow Mg(OH)_{2}}}}
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
- CaO+h3O⟶Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}}}
- SrO+2HCl⟶SrCl2+h3O{\displaystyle {\mathsf {SrO+2HCl\longrightarrow SrCl_{2}+H_{2}O}}}
- BaO+Al2O3 →to Ba(AlO2)2{\displaystyle {\mathsf {BaO+Al_{2}O_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}}}}
- BaO+2Al(OH)3 →to Ba(AlO2)2+3h3O{\displaystyle {\mathsf {BaO+2Al(OH)_{3}\ {\xrightarrow {t^{o}}}\ Ba(AlO_{2})_{2}+3H_{2}O}}}
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
- Be(OH)2+2KOH⟶K2BeO2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2KOH\longrightarrow K_{2}BeO_{2}+2H_{2}O}}}
- Be(OH)2+2HCl⟶BeCl2+2h3O{\displaystyle {\mathsf {Be(OH)_{2}+2HCl\longrightarrow BeCl_{2}+2H_{2}O}}}
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого Mg(OH)2 до очень сильного Ra(OH)2, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
- Ba(OH)2+SO3⟶BaSO4+h3O{\displaystyle {\mathsf {Ba(OH)_{2}+SO_{3}\longrightarrow BaSO_{4}+H_{2}O}}}
- 3Sr(OH)2+2h4PO4⟶Sr3(PO4)2+6h3O{\displaystyle {\mathsf {3Sr(OH)_{2}+2H_{3}PO_{4}\longrightarrow Sr_{3}(PO_{4})_{2}+6H_{2}O}}}
- Ra(OH)2+Al2O3⟶Ra(AlO2)2+h3O{\displaystyle {\mathsf {Ra(OH)_{2}+Al_{2}O_{3}\longrightarrow Ra(AlO_{2})_{2}+H_{2}O}}}
- Ba(OH)2+Zn(OH)2⟶Ba[Zn(OH)4]{\displaystyle {\mathsf {Ba(OH)_{2}+Zn(OH)_{2}\longrightarrow Ba[Zn(OH)_{4}]}}}
Магний содержится в тканях животных и растений (например, в хлорофилле), является кофактором многих ферментативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция состоят минеральные «скелеты» некоторых представителей многих групп беспозвоночных (губки, кишечнополостные, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы: мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях[прояснить], так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария (кроме сульфата ввиду его чрезвычайно малой растворимости) и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
www-wikipediya.ru
Химические свойства щелочноземельных металлов. Применение щелочноземельных металлов. Физические свойства щелочноземельных металлов
Рассмотрим химические свойства щелочноземельных металлов. Определим особенности их строения, получения, нахождения в природе, применение.
Положение в ПС
Для начала определим расположение этих элементов в периодической системе Менделеева. Они располагаются во второй группе главной подгруппе. К ним относят кальций, стронций, радий, барий, магний, бериллий. Все они на внешнем энергетическом уровне содержат по два валентных электрона. В общем виде бериллий, магний и щелочноземельные металлы на внешнем уровне имеют ns2 электронов. В химических соединениях они проявляют степень окисления +2. Во время взаимодействия с другими веществами они проявляют восстановительные свойства, отдавая электроны с внешнего энергетического уровня.

Изменение свойств
По мере возрастания ядра атома бериллий, магний и щелочноземельные металлы усиливают свои металлические свойства, так как наблюдается возрастание радиуса их атомов. Рассмотрим физические свойства щелочноземельных металлов. Бериллий в обычном состоянии является металлом серого цвета со стальным блеском. Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Физические свойства
Магний в качестве простого вещества является белым металлом, образующим на воздухе оксидное покрытие. Он имеет гексагональную кристаллическую решетку.
Физические свойства щелочноземельных металлов кальция, бария, стронция схожи. Они представляют собой металлы с характерным серебристым блеском, покрывающиеся под воздействием кислорода воздуха желтоватой пленкой. У кальция и стронция кубическая гранецентрированная решетка, барий имеет объемно-центрированную структуру.
Химия щелочноземельных металлов основывается на том, что у них металлический характер связи. Именно поэтому они отличаются высокой электрической и тепло проводимостью. Температуры их плавления и кипения больше, чем у щелочных металлов.

Способы получения
Производство бериллия в промышленных объемах осуществляется путем восстановления металла из фторида. Условием протекания данной химической реакции является предварительное нагревание.
Учитывая, что щелочноземельные металлы в природе находятся в виде соединений, для получения магния, стронция, кальция проводят электролиз расплавов их солей.

Химические свойства
Химические свойства щелочноземельных металлов связаны с необходимостью предварительного устранения с их поверхности слоя оксидной пленки. Именно она определяет инертность данных металлов к воде. Кальций, барий, стронций при растворении в воде образуют гидроксиды, имеющие ярко выраженные основные свойства.
Химические свойства щелочноземельных металлов предполагают их взаимодействие с кислородом. Для бария продуктом взаимодействия является пероксид, для всех остальных после реакции образуются оксиды. У всех представителей данного класса оксиды проявляют основные свойства, только для оксида бериллия характерны амфотерные свойства.
Химические свойства щелочноземельных металлов проявляются и в реакции с серой, галогенами, азотом. При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.

Качественные реакции
Основные формулы щелочноземельных металлов, рассматриваемые в курсе неорганической химии, связаны с солями. Для выявления представителей данного класса в смеси с другими элементами, можно использовать качественное определение. При внесении солей щелочноземельных металлов в пламя спиртовки, наблюдается окрашивание пламени катионами. Катион стронция дает темный красный оттенок, катион кальция – оранжевый цвет, а катион бария зеленый тон.
Для выявления катиона бария в качественном анализе используют сульфат анионы. В результате данной реакции образуется сульфат бария белого цвета, который нерастворим в неорганических кислотах.
Радий является радиоактивным элементом, который в природе содержится в незначительных количествах. При взаимодействии магния с кислородом, наблюдается ослепительная вспышка. Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные способы получения металлов называют кальциетермией и магниетермией.

Особенности применения
Каково применение щелочноземельных металлов? Кальций и магний используют для изготовления легких сплавов и редких металлов.
К примеру, магний содержится в составе дюралюминия, а кальций — это компонент свинцовых сплавов, используемых для получения оболочек кабелей и создания подшипников. Широко применение щелочноземельных металлов в технике в виде оксидов. Негашеная известь (оксид кальция) и жженая магния (оксид магния) требуются для строительной сферы.
При взаимодействии с водой оксида кальция происходит выделение существенного количества теплоты. Гашеная известь (гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.
Соли металлов второй группы
Соли магния, бериллия, щелочноземельных металлов можно получить путем взаимодействия с кислотами их оксидов. Хлориды, фториды, иодиды данных элементов являются белыми кристаллическими веществами, в основном хорошо растворимыми в воде. Среди сульфатов растворимостью обладают только соединения магния и бериллия. Наблюдается ее снижение от солей бериллия к сульфатам бария. Карбонаты практически не растворяются в воде либо имеют минимальную растворимость.
Сульфиды щелочноземельных элементов в незначительных количествах содержатся в тяжелых металлах. Если направить на них освещение, можно получить различные цвета. Сульфиды включаются в состав светящихся составов, именуемых фосфорами. Применяют подобные краски для создания светящихся циферблатов, дорожных знаков.
Распространенные соединения щелочноземельных металлов
Карбонат кальция является самым распространенным на земной поверхности элементом. Он является составной частью таких соединений, как известняк, мрамор, мел. Среди них основное применение имеет известняк. Этот минерал незаменим в строительстве, считается отличным строительным камнем. Кроме того, из данного неорганического соединения получают негашеную и гашеную извести, стекло, цемент.
Применение известковой щебенки способствует укреплению дорог, а благодаря порошку можно снизить кислотность почвы. Природный мел представляет собой раковины древнейших животных. Данное соединение используют для изготовления резины, бумаги, создания школьных мелков.
Мрамор востребован у архитекторов, скульпторов. Именно из мрамора были созданы многие уникальные творения Микеланджело. Часть станций московского метро облицована именно мраморными плитками. Карбонат магния в больших объемах используется при изготовлении кирпича, цемента, стекла. Он нужен в металлургической промышленности для удаления пустой породы.
Сульфат кальция, содержащийся в природе в виде гипса (кристаллогидрата сульфата кальция), применяется в строительной отрасли. В медицине данное соединение применяется для изготовления слепков, а также для создания гипсовых повязок.
Алебастр (полуводный гипс) при взаимодействии с водой выделяет огромное количество тепла. Это также применяется в промышленности.
Английская соль (сульфат магния) применяется в медицине в виде слабительного средства. Данное вещество обладает горьким вкусом, оно обнаружено в морской воде.
«Баритовая каша» (сульфат бария) не растворяется в воде. Именно поэтому данную соль применяют в рентгенодиагностике. Соль задерживает рентгеновские лучи, что позволяет выявлять заболевания желудочно-кишечного тракта.
В составе фосфоритов (горной породы) и апатитов есть фосфат кальция. Они нужны для получения соединений кальция: оксидов, гидроксидов.
Кальций играет для живых организмов особое значение. Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Для того чтобы избежать проблем со здоровьем, каждые сутки человек должен потреблять примерно 1,5 грамма кальция. Основная проблема заключается в том, что для того, чтобы организм усваивал 0,06 грамма кальция, необходимо съедать 1 грамм жира. Максимальное количество данного металла содержится в салате, петрушке, твороге, сыре.

Заключение
Все представители второй группы главной подгруппы таблицы Менделеева необходимы для жизни и деятельности современного человека. Например, магний является стимулятором обменных процессов в организме. Он должен присутствовать в нервной ткани, крови, костях, печени. Магний является активным участником и фотосинтеза у растений, так как он является составной частью хлорофилла. Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.
fb.ru
Щёлочноземельные металлы — ALL
Образцы щёлочноземельных металлов Металлический радий
Металлический радийЩёлочноземельные металлы — химические элементы, образующие 2-ую группу периодической таблицы элементов Д. И. Менделеева. К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Sr) и радий (Ra). Элемент под номером 120 (унбинилий, Ubn) в случае его синтеза также, вероятно, будет относиться к данной группе химических элементов. Бериллий и магний не всегда относят к щелочноземельным металлам, поскольку по химическим свойствам больше напоминают алюминий, а не эти металлы.
В природе чаще всего встречаются кальций и магний: в основном в виде карбонатов, гидрокарбонатов и сульфатов, а также в составе различных минералов.
Содержание кальция в земной коре — 3,38 % от её массы. Магний — 2,35 % от массы земной коры. Радий — редкий радиоактивный металл, его содержание в земной коре — 10−10% от её массы.
Происхождение названия связано с тем, что оксиды щёлочноземельных металлов (по терминологии алхимиков — «земли») растворяются в воде с образованием растворимых оснований — щелочей. На внешней электронной оболочке атомов щёлочноземельных металлов находится 2 s-электрона, ей предшествует оболочка из 2 s- и 6 р-электронов.
Физические свойства[править]
Щёлочноземельные металлы имеют серебристо-белый или серый цвет, гораздо более твёрдые, чем щелочные металлы. Ножом они практически не режутся (исключение — стронций). Плотность их растёт с увеличением порядкового номера. Плотность радия — 5,5 г/см3, то есть сравнима с железом.
Химические свойства[править]
Щёлочноземельные металлы всегда двухвалентны и проявляют в соединениях степень окисления +2. Обладают высокой химической активностью и в природе в свободном состоянии не встречаются. Активность их возрастает при увеличении порядкового номера. Таким образом, радий является наиболее активным из них.
Кальций, стронций, барий и радий быстро окисляются на влажном воздухе (в сухом медленнее), покрываясь смесью оксидов, гидроксидов, карбонатов и нитридов, поэтому их, подобно щелочным металлам, хранят под слоем керосина. При нагревании на воздухе эти металлы энергично горят, образуя оксиды:
2Ca + O2 → 2CaO
Бериллий и магний при комнатной температуре покрываются защитной оксидной плёнкой. Но в мелкодисперсном виде эти металлы пирофорны.
Кальций, стронций, барий и радий бурно реагируют с водой при комнатной температуре. При этом образуются щёлочи, сила которых возрастает от гидроксида кальция к гидроксиду радия.
Ba + 2H2O → Ba(OH)2 + H2↑
Магний заметно взаимодействует с водой только при нагревании. Компактный бериллий с водой и водяным паром не реагирует.
Биологическая роль[править]
Магний входит в состав хлорофилла растений, который необходим для синтеза АТФ. Кальций — важный макроэлемент, входит в состав костей и зубов.
Стронций может замещать кальций в скелете, а при избыточном поступлении в организм, вызывать стронциевый рахит.
Биологическое значение бериллия и бария на сегодняшний день недостаточно понятно. Все соединения бериллия и бария токсичны. Радий обладает сильной радиотоксичностью.
Меры предосторожности[править]
Кальций, стронций и барий нельзя брать руками из-за их способности реагировать с влагой, находящейся на коже. Образующаяся при этом щёлочь может вызвать химические ожоги.
- Химическая энциклопедия. Бериллий, Магний, Кальций, Стронций, Барий, Радий.
- Большая Советская Энциклопедия. Щёлочноземельные металлы.
allll.net

