Щёлочноземельные металлы — это… Что такое Щёлочноземельные металлы?
| Группа → | 2 | ||
|---|---|---|---|
| ↓ Период | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 |
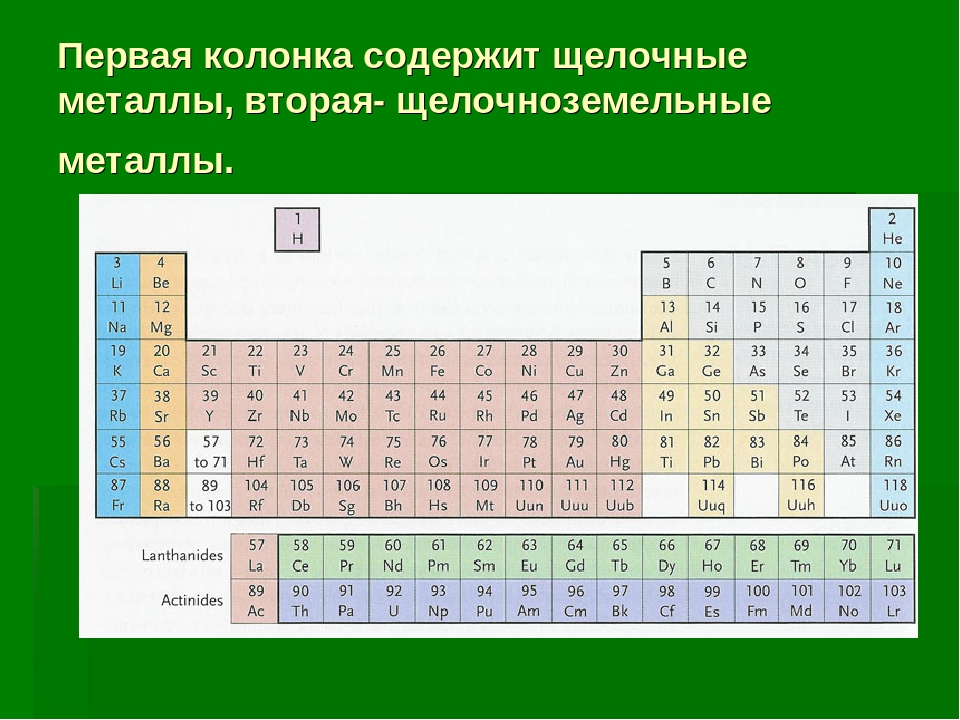
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10 −4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
Литература
Щелочноземельные металлы, подготовка к ЕГЭ по химии
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются
легкостью, мягкостью и сильной реакционной способностью.
Отличаются
легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF 2 — флюорит
Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
MgBr2 + Ca → CaBr2 + Mg
Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Ca + H2O → Ca(OH)2 + H2↑
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных
металлов постоянная +2.
Степень окисления у щелочноземельных
металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
Ca + I2 → CaI2 (йодид кальция)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + N2 → (t) Ca3N2 (нитрид кальция)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)
Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
MgCO3 → (t) MgO + CO2
Ca(NO3)2 → (t 2)2 + O2
Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- Реакция с водой
- Амфотерный оксид бериллия
BaO + HCl → BaCl2 + H2O
CaO + H2SO4 → CaSO4 + H2O
MgO + SO3 → MgSO4
CaO + CO 2 → CaCO3
CaO + SiO2 → CaSiO3
В нее вступают все, кроме оксида бериллия.
CaO + H2O → Ca(OH)2
MgO + H2O → Mg(OH)2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + HCl → BeCl2 + H2O
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
BeO + Na2O → Na2BeO2
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется
слабый электролит (вода).
Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Be(OH)2 + HCl → BeCl2 + H2O
Be(OH)2 + NaOH → Na2[Be(OH)4]
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочноземельные металлы
К понятию щелочноземельных металлов относится часть элементов II группы системы Менделеева: бериллий, магний, кальций, стронций, барий, радий. Четыре последних металла имеют наиболее ярко выраженные признаки щелочноземельной классификации, поэтому в некоторых источниках бериллий и магний не включают в список, ограничиваясь четырьмя элементами.
Свое название металла получили благодаря тому, что при взаимодействии их оксидов с водой образуется щелочная среда. Физические свойства щелочноземельных металлов: все элементы имеют серый металлический цвет, при нормальных условиях имеют твердую структуру, с ростом порядкового номера увеличивается их плотность, имеют очень высокую температуру плавления. В отличие от щелочных металлов, элементы данной группы не режутся ножом (за исключением стронция). Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.
Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.
Характеристика щелочноземельных металлов свидетельствует об их высокой активности. В особенности это относится к элементам с большим порядковым номером. Например, бериллий в нормальных условиях не ступает во взаимодействие с кислородом и галогенами. Для запуска механизма реагирования его необходимо нагреть до температуры свыше 600 градусов по Цельсию. Магний в нормальных условиях имеет на поверхности оксидную пленку и также не реагирует с кислородом. Кальций окисляется, но достаточно медленно. А вот стронций, барий и радий окисляются практически мгновенно, поэтому их хранят в безкислородной среде под керосиновым слоем.
Все оксиды усиливают основные свойства с ростом порядкового номера металла. Гидроксид бериллия представляет собой амфотерное соединение, которое не реагирует с водой, но хорошо растворяется в кислотах. Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция — сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде. А гидроксид радия — это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция — сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде. А гидроксид радия — это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Способы получения
Получают гидроксиды щелочноземельных металлов путем воздействия воды на чистый элемент. Реакция протекает при комнатных условиях (кроме бериллия, для которого требуется повышение температуры) с выделением водорода. При нагревании все щелочноземельные металлы реагируют с галогенами. Полученные соединения используются в производстве большого ассортимента продукции от химических удобрений до сверхточных деталей микропроцессора. Соединения щелочноземельных металлов проявляют такую же высокую активность, как и чистые элементы, поэтому их используют во многих химических реакциях.
Чаще всего это происходит при реакциях обмена, когда необходимо вытеснить из вещества менее активный металл. В окислительно-восстановительных реакциях принимают участие в качестве сильного восстановителя. Двухвалентные катионы кальция и магния придает воде так называемую жесткость. Преодоление этого явления происходит путем осаждения ионов при помощи физического воздействия или добавления в воду специальных смягчающих веществ. Соли щелочноземельных металлов образуются путем растворения элементов в кислоте либо в результате реакций обмена. Полученные соединения имеют прочную ковалентную связь, поэтому обладают невысокой электропроводностью.
В природе щелочноземельные металлы не могут находиться в чистом виде, так как быстро вступают во взаимодействие с окружающей средой, образую химические соединения. Они входят в состав минералов и горных пород, содержащихся в толще земной коры. Наиболее распространен кальций, немного уступает ему магний, довольно часто встречаются барий и стронций. Бериллий относится к редким металлам, а радий — к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла. Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.
Бериллий относится к редким металлам, а радий — к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла. Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.
Получают щелочноземельные металлы путем разложения сложных веществ и выделения из них чистого вещества. Бериллий добывают путем восстановления его из фторида при воздействии высокой температуры. Барий восстанавливает из его оксида. Кальций, магний и стронций получают путем электролиза их хлоридного расплава. Сложнее всего синтезировать чистый радий. Его добывают путем воздействия на урановую руду. По подсчетам ученых в среднем на одну тонну руды приходится 3 грамма чистого радия, хотя встречаются и богатые месторождения, в которых содержится целых 25 грамм на тонну. Для выделения металла используются методы осаждения, дробной кристаллизации и ионного обмена.
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов очень обширен и охватывает многие отрасли. Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы. Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии. Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы. Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии. Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют как один из восстановителей при получении титана. Его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет. Оксид магния горит ярким ослепительным пламенем, что нашло отражение в военном деле, где он используется для изготовления зажигательных и трассирующих снарядов, сигнальных ракет и светошумовых гранат. Является одним из важнейших элементов для регуляции нормального процесса жизнедеятельности организма, поэтому входит в состав некоторых лекарств.
Кальций в чистом виде практически не применяют. Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани. Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами. Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани. Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами. Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
к щелочноземельным металлам не относится 1) кальций 2) бериллий в) стронций б) бариий
при спалюванні вуглеводню масою 4,4 г утворилося 0,3 моль CO2 і вода. Ця рідина масою о,11 г займає обєм 56 мл. визначте формулу сполуки
Які науки належать до природничих наук?
Смесь меди и магния массой 15 г обработали раствором серной кислоты. В результате реакции выделился газ объемом 6,72 л (н.у.). Определите количество … вещества меди в смеси.
ПОЖАЛУЙСТА СРОЧНО!!!для данных веществ определите класс неорганических соединений: K2O, HCl, LiOH, Cu(OH)2, FeO, Al2O3, Na2O, BeO, NO, N2O5, CO2, SO2, … CO, KOH, SiO2, S2O, Al(OH)3, Cr(OH)2, h3CO3, HF, MnO, h3SO4, Cr(OH)3, Fe(OH)2, h3O
h3SO4+K уравнение реакции ионного обмена
Раствор в колбе перемешивают, не отрывая её дна от поверхности стола (почему?)
Срочно помогите!
На безводную щелочь KOH подействовали смесью озона с кислородом.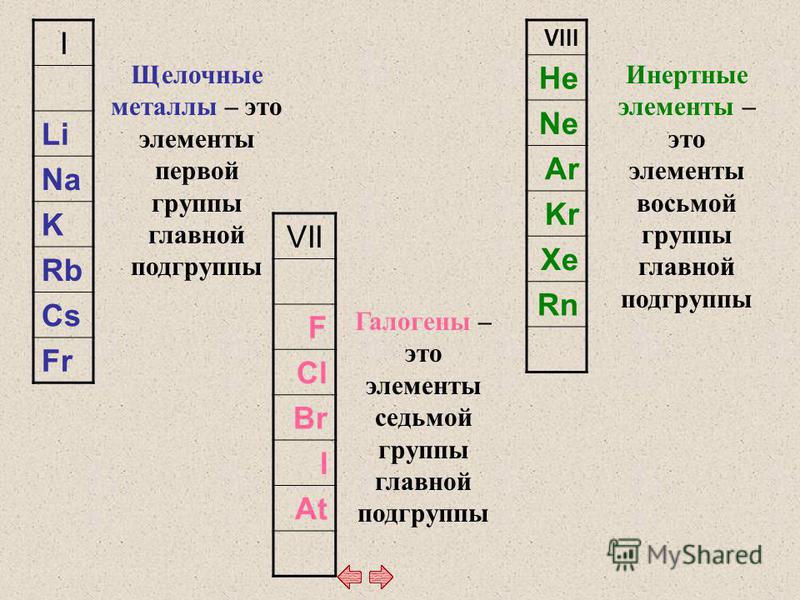 Полученный продукт реакции экстрагировали жидким аммиаком и подвергл
… и гидролизу с выделением газа. В атмосфере этого газа сожгли металлический натрий, а преимущественный продукт этой реакции добавили в холодную воду. Получившуюся неустойчивую жидкость добавили с спиртовому раствору гидроксида лития при 0 градусах Цельсия, а полученный продукт реакции нагрели до 250 градусов. В результате получился порошок вещества, поглощающий углекислый газ с образованием среднего карбоната, плохо растворимого в воде. Если же ту самую неустойчивую жидкость добавить к раствору нитрата серебра, выпадет осадок и выделится газ. Полученный осадок может также быть получен действием раствора нитрата серебра на раствор среднего фосфита натрия.
Надо определить все продукты реакций и написать все уравнения реакций.
Полученный продукт реакции экстрагировали жидким аммиаком и подвергл
… и гидролизу с выделением газа. В атмосфере этого газа сожгли металлический натрий, а преимущественный продукт этой реакции добавили в холодную воду. Получившуюся неустойчивую жидкость добавили с спиртовому раствору гидроксида лития при 0 градусах Цельсия, а полученный продукт реакции нагрели до 250 градусов. В результате получился порошок вещества, поглощающий углекислый газ с образованием среднего карбоната, плохо растворимого в воде. Если же ту самую неустойчивую жидкость добавить к раствору нитрата серебра, выпадет осадок и выделится газ. Полученный осадок может также быть получен действием раствора нитрата серебра на раствор среднего фосфита натрия.
Надо определить все продукты реакций и написать все уравнения реакций.
Химия. Даны шесть елементов: Na, Cu(2 валентность), Fe(2 валентность), Al, Fe(3 валентность) и Ca.
К ним даны 9 кислотных остатков: HF — вторидна, HCl
… — хлоридна, HBr — бромидна, HJ — йодидна, H[tex]_{4}[/tex]S — сульфитна, H[tex]_{4}[/tex]CO[tex]_{3}[/tex] — карбонатна, H[tex]_{4}[/tex]SiO[tex]_{3}[/tex] — силикатна, HNO[tex]_{4}[/tex] — нитритна
Сделать из них кислоты. Спам удаляю мгновенно. Пожалуйсто, знатоки химии, мне нужна ваша помощь. Это только часть задания. Если я приду, с не выполненым заданием по химии, меня отчислят… Помогите, молю((
Вторую часть задания размещу, когда выполнят первую часть( данную сейчас)
Спам удаляю мгновенно. Пожалуйсто, знатоки химии, мне нужна ваша помощь. Это только часть задания. Если я приду, с не выполненым заданием по химии, меня отчислят… Помогите, молю((
Вторую часть задания размещу, когда выполнят первую часть( данную сейчас)
При озонолизе углеводорода состава С7Н14 с последующей обработкой озонида цинковой пылью были получены ацетон и 2-метилпропаналь. Напишите структурную … формулу этого углеводорода и назовите его по номенклатуре IUPAC. Приведите структурные формулы продуктов взаимодействия этого углеводорода со следующими реагентами: а) Cl2 в CCl4; б) Cl2 в C2H5OH; в) водный раствор KMnO4; г) NaIO4, KMnO4(кат.), h3O, Ch4COCh4; д) Ch3N2, t°; е) CF3COOH, h3O2
Смесь металлических хрома и марганца, общей массой 24г, подвергли хлорированию при нагревании. Продукт реакции поместили в избыток воды. Образовалось
… 500г 5,04%-го раствора соли и осадок, нерастворимый в воде. Определите массу хрома в исходной смеси.
Ответ приведите в граммах с точностью до целых.
Проверочная работа по щелочноземельным металлам
Проверочная работа по теме «Бериллий, магний и щелочноземельные металлы»
К щелочноземельным металлам не относится:
а) кальций; б) радий; в) кадмий; г) барий.Электронная формула 1s2 2s2 2p6 3s2 соответствует элементу:
а) магнию; б) кальцию; в) бериллию; г) цинку.Металлические свойства в ряду Ba-Sr-Ca-Be:
а) увеличивается в) не изменяется;
б) уменьшается; г) изменяется периодически;
Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1; б) +2; в) +3; г) +4.Щелочноземельные металлы проявляют сильные:
а) окислительные свойства; в) амфотерные свойства;
б) восстановительные свойства; г) нейтральные свойства.Единственный металл среди щелочноземельных образующий пероксид при взаимодействии с кислородом:
а) магний б) стронций в) кальций г) барийНаиболее энергично реагирует с водой:
а) магний б) кальций в) бериллий г) стронцийПри взаимодействии элементов II группы главной подгруппы с водой образуется:
а) кислота и выделяется водород в) оксид и выделяется водород
б) соль и вода г) щелочь и выделяется водород
Оксид какого металла реагирует и с кислотами и с основаниями:
а) MgO б) BeO в) CaO г) BaO
Все металлы II группы главной подгруппы имеют серебристо-белый цвет за исключением:
а) радия б) магния в) стронция г) кальция
Проверочная работа по теме «Бериллий, магний и щелочноземельные металлы»
К щелочноземельным металлам не относится:
а) кальций; б) радий; в) кадмий; г) барий.
Электронная формула 1s2 2s2 2p6 3s2 соответствует элементу:
а) магнию; б) кальцию; в) бериллию; г) цинку.Металлические свойства в ряду Ba-Sr-Ca-Be:
а) увеличивается в) не изменяется;
б) уменьшается; г) изменяется периодически;
Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1; б) +2; в) +3; г) +4.Щелочноземельные металлы проявляют сильные:
а) окислительные свойства; в) амфотерные свойства;
б) восстановительные свойства; г) нейтральные свойства.Единственный металл среди щелочноземельных образующий пероксид при взаимодействии с кислородом:
а) магний б) стронций в) кальций г) барийНаиболее энергично реагирует с водой:
а) магний б) кальций в) бериллий г) стронцийПри взаимодействии элементов II группы главной подгруппы с водой образуется:
а) кислота и выделяется водород в) оксид и выделяется водород
б) соль и вода г) щелочь и выделяется водород
Оксид какого металла реагирует и с кислотами и с основаниями:
а) MgO б) BeO в) CaO г) BaO
Все металлы II группы главной подгруппы имеют серебристо-белый цвет за исключением:
а) радия б) магния в) стронция г) кальция
Металлы щелочноземельные — Энциклопедия по машиностроению XXL
У некоторых парамагнитных металлов (твердые и жидкие щелочные металлы, щелочноземельные металлы), парамагнетизм которых вызывается спиновыми магнитными моментами электронов проводимости, магнитная восприимчивость X почти не зависит от температуры. [c.43]
[c.43]Щелочноземельные металлы. Щелочноземельные металлы обладают малой работой выхода электронов. Используются для получения активных катодов газоразрядных ламп, газопоглотителей и др. [c.85]
Растворимость. Практически нерастворимы в железе щелочные металлы, щелочноземельные металлы Ag, Hg, Pb, Bi. [c.319]
Бериллий вступает в реакцию с ра. плавленными галогенидами щелочных металлов, восстанавливая их до металла, пока не наступает равновесие. Бериллий не взаимодействует с расплавленными галогенидами щелочноземельных металлов и магния, но восстанавливает галогениды алюминия и тяжелых металлов. Щелочноземельные металлы и магний можио успешно применять для получения бериллия из его галогенидов. [c.60]
Щелочноземельные металлы в свободном металл Ическом состоянии не применяются, за исключением специальных случаев. [c.17]
[c.17]
Получили применение смеси хлористых, азотнокислых и азотистокислых солей щелочноземельных металлов и смеси щелочей. Наиболее применяемые составы солей с указанием области их применения приведены в табл. 27. [c.289]
Во избежание загорания плавку магниевых сплавов проводят под слоем универсальных флюсов из хлористых и фтористых солей щелочных и щелочноземельных металлов или в среде защитных газов. [c.169]К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся все щелочные и щелочноземельные металлы (за исключением бериллия), в том числе имеющий большое техническое значение магний (табл. 4). [c.33]
Наиболее коррозионно неустойчивые металлы находятся в подгруппах А I и II групп периодической системы элементов, это щелочные и щелочноземельные металлы. [c.325]
Магний — щелочноземельный металл, II группы Периодической системы элементов, порядковый номер 12 (см. табл. 1), атомная масса 24,312. Цвет светло-серый. Характерным свойством магния является малая плотность 1,74 г/см , температура плавления магния 650 °С. Кристаллическая решетка гексагональная (с/а = 1,62354). Теплопроводность магния значительно меньше, чем у алюминия 125 Вт/(м-К), а коэффициенты линейного расширения примерно одинаковы (26,1 10 при (20—100 С) I. Технический магний Мг1 содержит 99,92 % Mg. В качестве примесей присутствуют Ре, Si, Ni, Na, Al, Мп. Вредными примесями являются Ре, Ni, Си и S1, снижающие коррозионную стойкость магния. Механические свойства литого магния сГв = 115 МПа, о ,., = 25 МПа, б 8 %, Е = = 45 ГПа, НВ 300 МПа, а деформированного (прессованные прутки) Оц 200 МПа, ст ,., = 9 МПа, б =— 11,5 %, НВ 400 Л Па. На воздухе м, 11 ит легко воспламеняется. Используется в пиротехнике и химической промышленности.
[c.337]
табл. 1), атомная масса 24,312. Цвет светло-серый. Характерным свойством магния является малая плотность 1,74 г/см , температура плавления магния 650 °С. Кристаллическая решетка гексагональная (с/а = 1,62354). Теплопроводность магния значительно меньше, чем у алюминия 125 Вт/(м-К), а коэффициенты линейного расширения примерно одинаковы (26,1 10 при (20—100 С) I. Технический магний Мг1 содержит 99,92 % Mg. В качестве примесей присутствуют Ре, Si, Ni, Na, Al, Мп. Вредными примесями являются Ре, Ni, Си и S1, снижающие коррозионную стойкость магния. Механические свойства литого магния сГв = 115 МПа, о ,., = 25 МПа, б 8 %, Е = = 45 ГПа, НВ 300 МПа, а деформированного (прессованные прутки) Оц 200 МПа, ст ,., = 9 МПа, б =— 11,5 %, НВ 400 Л Па. На воздухе м, 11 ит легко воспламеняется. Используется в пиротехнике и химической промышленности.
[c.337]
Тонкие слои адсорбированных щелочных и щелочноземельных металлов на поверхности тел существенно снижают работу выхода.
 Особенно сильно уменьшается работа выхода металлов и полупроводников при адсорбции на их предварительно очищенных поверхностях слоев цезия, бария и их оксидов. Углерод и кислород при адсорбции на поверхности тел. как правило, увеличивают их работу выхода (табл. 25.2, рис. 25.1 и 25.2).
[c.567]
Особенно сильно уменьшается работа выхода металлов и полупроводников при адсорбции на их предварительно очищенных поверхностях слоев цезия, бария и их оксидов. Углерод и кислород при адсорбции на поверхности тел. как правило, увеличивают их работу выхода (табл. 25.2, рис. 25.1 и 25.2).
[c.567]Оксидный термокатод — смесь оксидов металлов, нанесенная на металлический керн. В низкотемпературных катодах, работающих в интервале температур от 900 до 1300 К, используются смеси оксидов щелочноземельных металлов — бария, кальция и стронция. Эти [c.570]
Кристаллические структуры металлов непосредственно определяются характером межатомных связей. Так, в самых простых металлах — щелочных и щелочноземельных, имеющих во внешней оболочке по одному-два s-электрона,— при низких температурах [c.167]
Первые два металла этой подгруппы занимают особое положение бериллий по некоторым свойствам близок к алюминию, а магний — к цинку. Кальций, стронций и барий называют щелочноземельными. Они образуют гидриды и нитриды с увеличением атомной массы это взаимодействие усиливается.
[c.68]
Кальций, стронций и барий называют щелочноземельными. Они образуют гидриды и нитриды с увеличением атомной массы это взаимодействие усиливается.
[c.68]
Щелочноземельные металлы 68 Щелочные металлы 65 [c.207]
Щелочноземельные металлы восстанавливают бериллий из его галоидных солей. [c.518]
Даны основы металлургии магния, бериллия, лития и щелочноземельных металлов (кальция, стронция, бария). Освещены важнейшие свойства этих металлов и области их применения. Рассмотрены вопросы экономичности технологий, утилизации отходов, а также охраны труда. [c.20]
БАРИЕВЫЕ РУДЫ, минералы, представляющие собой сернокислые и углекислые соединения бария и имеющие промышленное значение. В настоящее время такое значение имеют два минерала барит, или тяжелый шпат, — природный сульфат бария BaSOj (ВаО 65,7 %, SOg 34,3 %), витерит — природный карбонат бария ВаСОз (ВаО 77,7%, СОа 22,3%). Витерит по сравнению с баритом как баритовое сырье играет меньшую роль благодаря относительной редкости его месторождений (сокр. м-ний) промышленного значения, хотя содержание в нем ВаО больше и перерабатывается ои легче барита. Чистые разности барита и витерита приближаются к их теоретич. составу, но обычно благодаря примесям содержание соответствующих основных химич. компонентов бывает 98—99%. Обычные примеси к бариту — кварц, кальцит, окислы железа, иногда марганца, пирит, сульфаты металлов щелочноземельной группы, сульфиды свинца (галенит), цинка (цинковая обманка). Уд. в. барита 3,8—4,8, витерита 4,3 твердость 3—4 оба минерала кристаллизуются в ромбической системе. Барит встречается в кристаллич. разностях, легко раскалывающихся благодаря отчетливо выраженной спайности ( мягкие бариты), и в скрыто кристаллических плотных разностях ( твердые бариты). Витерит образует кристаллича-
[c.183]
м-ний) промышленного значения, хотя содержание в нем ВаО больше и перерабатывается ои легче барита. Чистые разности барита и витерита приближаются к их теоретич. составу, но обычно благодаря примесям содержание соответствующих основных химич. компонентов бывает 98—99%. Обычные примеси к бариту — кварц, кальцит, окислы железа, иногда марганца, пирит, сульфаты металлов щелочноземельной группы, сульфиды свинца (галенит), цинка (цинковая обманка). Уд. в. барита 3,8—4,8, витерита 4,3 твердость 3—4 оба минерала кристаллизуются в ромбической системе. Барит встречается в кристаллич. разностях, легко раскалывающихся благодаря отчетливо выраженной спайности ( мягкие бариты), и в скрыто кристаллических плотных разностях ( твердые бариты). Витерит образует кристаллича-
[c.183]
ЧЕРНЫЕ МЕТАЛЛЫ имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость и во многих слу чаях обладают полиморфизмом (о последнем см. гл. II, п. 6) Наиболее типичным металлом этой группы является железо ЦВЕТНЫЕ МЕТАЛЛЫ чаще всего имеют характерную ок раску красную желтую, белую. Обладают большой пластич Fio Tbro, малой твердостью, относительно низкой температурой II, лл ленпя, для ннх характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
[c.15]
гл. II, п. 6) Наиболее типичным металлом этой группы является железо ЦВЕТНЫЕ МЕТАЛЛЫ чаще всего имеют характерную ок раску красную желтую, белую. Обладают большой пластич Fio Tbro, малой твердостью, относительно низкой температурой II, лл ленпя, для ннх характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
[c.15]
Флюсы для сварки легированных и высоколегированных сталей должны обеспечивать минимальное окисление легирующих элементов в шве. Для этого приме няют плавленые и керамические пизкокремпистые, бескреинистые и фторидные флюсы. Их шлаки имеют высокое содержание СаО, СгР и А1,0ч. Плавленые флюсы изготовляют из плавикового шпата, алюмосиликатов, алюминатов, путем сплавления в электропечах. Их шлаки имеют основной характер. Керамические флюсы приготовляют из порошкообразных компонентов путем замеса их на жидком стекле, гранулирования и последующего прокаливания. Основу керамических флюсов составляет мрамор, плавиковый шпат и хлориды щелочноземельных металлов. В них также входят ферросплавы сильных раскислителей (кремния, титана, алюминия) и легирующих элементов и чистые металла. Шлаки керамических флюсов имеют основной или пассивный характер и обеспечивают получение в металле шва заданное содержание легирующих элементов.
[c.194]
В них также входят ферросплавы сильных раскислителей (кремния, титана, алюминия) и легирующих элементов и чистые металла. Шлаки керамических флюсов имеют основной или пассивный характер и обеспечивают получение в металле шва заданное содержание легирующих элементов.
[c.194]
Пленка оксида покрывает капли расплавленного металла и препятствует сплавлению их между собой и основным металлом. Для разрушения и удаления пленки и защиты металла от повторного окисления при сварке используют специальные флюсы или ведут сварку в атмосфере инертных газов. Флюсы состоят из смеси хлористых и фтористых солей щелочноземельных металлов (Na I, K I, Ba Ij, LiF, aFj и др.). Действие флюсов основано на растворении пленки оксидов. При сварке в защитных газах пленка разрушается в результате электрических процессов в том случае, если она оказывается в катодной области дуги. Это реализуется при сварке плавящимся электродом на постоянном токе обратной полярности и сварке не-плавящимся электродов на переменном токе с использованием специальных источников тока (см.
 разд. 5, гл. II, п. 6).
[c.236]
разд. 5, гл. II, п. 6).
[c.236]Хотя между коррозионной стойкостью металлов, которая характеризуется скоростью протекания термодинамически возможных электрохимических коррозионных процессов, и их термодинамическими характеристиками [например, (1 л1Лобр1 и наблюдается некоторое соответствие (щелочные и щелочноземельные металлы наименее устойчивы, а благородные металлы наиболее устойчивы), однако между ними нет простой однозначной зависимости. Металл, нестойкий в одних условиях, в других условиях часто оказывается стойким. Это обусловлено тем, что протекание термодинамически возможного процесса бывает сильно заторможено образующимися вторичными труднорастворимыми продуктами коррозии, пассивными пленками или какими-либо другими факторами. Так, термодинамически весьма неустойчивые Ti, А1 и Mg (см. табл. 28) в ряде сред коррозионностойки благодаря наступлению пассивности. [c.324]
Все элементы имеют внешние валентные оболочки с числом электронов, равным номеру группы (от 1 для щелочных металлов и до 8 у инертных газов) У щелочных и щелочноземельных металлов (I и II основные группы) внешними являются один или два -электрона, вращающиеся по круговым орбитам и обра-вующие электронные облака в форме сферического слоя. У всех элементов, начиная с III группы, р-оболочки достраиваются из шести электронов, вращающихся по эллиптическим орбитам и образующих электронные облака в форме трех перпендикулярных гантелей или шести эллипсоидов со взаимно-прямоугольными большими осями У всех элементов, начиная с III группы, достраиваются внутренние d- и /-электронные оболочки
[c.10]
У всех элементов, начиная с III группы, р-оболочки достраиваются из шести электронов, вращающихся по эллиптическим орбитам и образующих электронные облака в форме трех перпендикулярных гантелей или шести эллипсоидов со взаимно-прямоугольными большими осями У всех элементов, начиная с III группы, достраиваются внутренние d- и /-электронные оболочки
[c.10]
В состав стекла вводят нуклеаторы — вещества, образующие центры кристаллизации. Раньше в качестве нуклеаторов применяли коллоидные частицы Си, Ag, Аи, которые становились зародышами кристаллизации в результате облучения изделия проникающей радиацией (фотокерамы). Сейчас дорогой фотохимический процесс исключен в качестве нуклеаторов применяют сульфиды железа, окись титана, фториды и фосфиды щелочных и щелочноземельных металлов. [c.191]
Сильная окисляемость при высоких температурах с образованием тугоплавкой (Т л=2200°С) окисной пленки А1аОз, имеющей большую плотность по сравнению с алюминием (р=3,85 г/см ). Окисная пленка затрудняет сплавление, способствует непроварам и охрупчивает металл. Поэтому окисную пленку удаляют со свариваемых кромок механическими и химическими способами перед сваркой, во время сварки защищают зону сварки инертным газом, катодным распылением, применяют покрытия и флюсы на основе солей щелочных и щелочноземельных металлов (Na l, NaF, КС1 и
[c.133]
Окисная пленка затрудняет сплавление, способствует непроварам и охрупчивает металл. Поэтому окисную пленку удаляют со свариваемых кромок механическими и химическими способами перед сваркой, во время сварки защищают зону сварки инертным газом, катодным распылением, применяют покрытия и флюсы на основе солей щелочных и щелочноземельных металлов (Na l, NaF, КС1 и
[c.133]
К органическим добавкам, подходящим для использования в противокоррозионных смазках, относятся органические амины, нафтенат цинка, различные продукты окисления нефти, соли сульфированных масел, содержащие щелочные и щелочноземельные металлы, и различные другие соединения [43]. В течение длительного времени успешно применяют ланолин, получаемый при обработке шерсти. Его активными составляющими являются высокомолекулярные жирные спирты и кислоты. Иногда в противокоррозионные смазки добавляют свинцовые мыла, которые образуют плохо растворимый Pb lj при взаимодействии с Na l, попадающим на поверхность металла при прикосновении потных рук. [c.272]
[c.272]
Успех Бальмера направил внимание исследователей на поиски сериальных зависимостей в спектрах других веществ. В первую очередь были исследованы спектры щелочных металлов, затем щелочноземельных и некоторых других элементов. Несмотря на трудность расшифровки, и здесь найдены были серии, и, что очень важно, полученные формулы очень напоминали сериальную формулу для водорода. Отличие сводится к поправочным членам а и Р, имеющим для водорода значения, равные нулю [c.716]
Спектры щелочных и щелочноземельных металлов и других элементов гораздо сложнее спектра водорода. Одним из отличий, имеющих место и в других сложных элементах, является мульти-плетный характер линий линии состоят из нескольких (две, три и более) компонент с близкими значениями частот. Частоты отдельных компонент также подчинены определенным закономерностям. Разыскивать закономерности в таких сложных спектрах нелегко, и это явилось в значительной степени делом догадки и остроумия. Благодаря работам Ридберга и других выяснились некоторые правила, помогающие обнаруживать и выделять отдельные серии. В настоящее время теория атома позволила обосновать многие такие правила. В частности, принадлежность линии к той или другой серии можно установить по характеру аномального расщепления в магнитном поле (см. 172).
[c.717]
Благодаря работам Ридберга и других выяснились некоторые правила, помогающие обнаруживать и выделять отдельные серии. В настоящее время теория атома позволила обосновать многие такие правила. В частности, принадлежность линии к той или другой серии можно установить по характеру аномального расщепления в магнитном поле (см. 172).
[c.717]
Боридный термокатод — катод на основе металлоподобных соединений типа МеВе, где iMe — щелочноземельный, редкоземельный металлы или торий. В качестве термокатода наиболее широко применяется гекса-борид лантана, реже — гексабориды иттрия и гадолиния и диборид хрома. Покрытие оксидного слоя тонкой пленкой осмия понижает работу выхода катода и увеличивает его эмиссионную способность. Термоэмиссионные катоды из гексаборида лантана работают при температуре 1650 К и обеспечивают получение плотности тока ТЭ до 50 А/см . Высокая механическая прочность и устойчивость таких катодов к ионной бомбардировке позволяет использовать их в режиме термополевой эмиссии (при напряженности внешнего электрического поля 10° В/см значительная часть эмиссионного тока обусловлена туннелированием электронов сквозь барьер). В этом режиме катод из гексаборида лантана при температуре 1400—1500 К может эмитировать ток с плотностью до 1000 A/ м . Катоды из гексаборида лантана не отравляются на воздухе и устойчиво работают в относительно плохом вакууме. Срок их службы не зависит от давления остаточных газов в приборе до давлений порядка 10 Па. Эти катоды используются в ускорителях и различных вакуумных устройствах.
[c.571]
В этом режиме катод из гексаборида лантана при температуре 1400—1500 К может эмитировать ток с плотностью до 1000 A/ м . Катоды из гексаборида лантана не отравляются на воздухе и устойчиво работают в относительно плохом вакууме. Срок их службы не зависит от давления остаточных газов в приборе до давлений порядка 10 Па. Эти катоды используются в ускорителях и различных вакуумных устройствах.
[c.571]
Ртуть и ее соединения весьма ядовиты очень вредны пары ртути. Щелочные и щелочноземельные металлы, магний, алюминий, цинк, олово, свинец, кадмий, платина, золото и серебро пастворяютс.я в ртут.и, образуя амальгамы. Слабо растворяются в ртути медь и никель. Приборы, содержащие ртуть, должны иметь металлическую арматуру из вольфрама, железа или тантала, так как эти металлы не растворимы в ртути. [c.35]
Баббит Сатко. Сплав свинца с 2% Sn и добавками малых количеств других металлов, главным образом щелочных и щелочноземельных, носит название Сатко-металла. От отечественного баббита БК2 этот сплав отличается тем, что содержит ртуть вместо натрия и дополнительные добавки алюминия, калия и лития.
[c.337]
От отечественного баббита БК2 этот сплав отличается тем, что содержит ртуть вместо натрия и дополнительные добавки алюминия, калия и лития.
[c.337]
Галлоиды взаимодействуют с бериллием при слабом нагреве. Расплавы щелочноземельных металлов с бериллием не взаимодейстпуют. [c.518]
Никель. Серебристо-белого цвета металл — Ni с температурой плавления 1452 С выпускается нескольких марок с содержанием до 99,99% Ni при использовании электровакуумной плавкп. В интервале 25— 600 С значение ТК1 = 1,55-10 Иград. Электрические свойства отожженного никеля р = 0,0683 ом-мм 1м, TKR = 6,8-10 Иград. Никель применяют в качестве оснований (кернов) оксидных катодов, которые активируют окислами в. основном щелочноземельных металлов (ВаО, SrO), с целью снижения работы выхода. Для упрочнения никеля-используют присадку марганца (2,3—5,4%) из марганцовистого никеля изготовляют прочные сетки и траверсы небольших приемно-усилительных ламп. Алюминированный никель в виде ленты, покрытой тонким слоем алюминия (8—15 мкм), обладает высоким коэффициентом теплового излучения (до 0,8) такую ленту используют для анодов небольших электронных ламп. Допустимая для никеля температура в вакууме составляет 800° С.
[c.299]
Допустимая для никеля температура в вакууме составляет 800° С.
[c.299]
Спектры щелочных металлов и щелочноземельных элементов (один и два валентных s-электрона) были уже подробно разобраны, и мы к ним возвращаться не будем. Остановимся сейчас на спектрах атомов с достраивающейся р-оболочкой, начиная с элементов с одним и двумя р-электронами. Атомы с ббльшим числом р-электронов и с замкнутой оболочкой (инертные газы) будут рассмотрены в следующих параграфах. [c.237]
Бериллий, магний и щелочноземельные металлы
Взаимодействие с простыми веществами. Бериллий, магний и щелочноземельные металлы легко взаимодействуют с кислородом и серой, образуя оксиды и сульфиды, например [c.234]БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ [c.231]
Строение атомов бериллия, магния и щелочноземельных металлов. Положение металлов в ряду напряжений. Отношение к воде, кислотам, кислороду и окислителям. Окиси и гидроокиси, их получение и химическая характеристика. Важнейшие растворимые и нерастворимые соли. Соли магния и кальция в природных водах. Жесткость воды и методы ее устранения. [c.204]
Окиси и гидроокиси, их получение и химическая характеристика. Важнейшие растворимые и нерастворимые соли. Соли магния и кальция в природных водах. Жесткость воды и методы ее устранения. [c.204]
При нагревании бериллий, магний и щелочноземельные металлы реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами, например [c.235]
Взаимодействие с кислотами. Бериллий, магний и щелочноземельные металлы взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода [c.235]
Составить электронные схемы строения атомов бериллия, магния и щелочноземельных металлов. [c.330]
Как бериллий, магний и щелочноземельные металлы относятся к воде, кислороду воздуха, кислотам и щелочам Составить уравнения соответствующих реакций. [c.231]
Особенности солей бериллия, магння и щелочноземельных металлов. Соли щелочноземельных металлов, внесенные в пламя горелки, дают характерное окращивание пламени кальций — кирпично-красное, стронций — карминно-красное, барий — желтовато-зеленое. На этом свойстве солей основано качественное определение этих элементов. [c.236]
Соли щелочноземельных металлов, внесенные в пламя горелки, дают характерное окращивание пламени кальций — кирпично-красное, стронций — карминно-красное, барий — желтовато-зеленое. На этом свойстве солей основано качественное определение этих элементов. [c.236]
Составить уравнения реакций получения в технике бериллия, магния и щелочноземельных металлов. Указать условия и сущность реакций. [c.231]
II группа. По сравнению с щелочными металлами бериллий, магний и щелочноземельные металлы обладают более сильно выраженными свойствами к комплексообразованию. Особенно выделяется в этом отношении бериллий, что связано с наличием сильного электрического поля его иона. Магний по своей комплексообразующей способности приближается к бериллию. [c.393]
Бериллий, магний и щелочноземельные металлы с водородом образуют гидриды общей формулы К На. [c.242]
Подгруппа бериллия. Эту подгруппу составляют металлы бериллий, магний и щелочноземельные металлы. Их атомы на внещнем энергетическом уровне имеют по два электрона. Отдавая их, проявляют в соединениях степень окисления +2. Все металлы подгруппы — сильные восстановители, однако несколько более слабые, чем щелочные металлы. [c.297]
Их атомы на внещнем энергетическом уровне имеют по два электрона. Отдавая их, проявляют в соединениях степень окисления +2. Все металлы подгруппы — сильные восстановители, однако несколько более слабые, чем щелочные металлы. [c.297]
Распространенность в природе. Массовые доли бериллия, магния и щелочноземельных металлов в земной коре составляют 6-10- % (Ве), 2,10% (М ), 3,60% (Са), 0,04% (5г), 0,05% (Ва), 1-10-> >% (Ка). В свободном состоянии эти металлы в природе не встречаются. [c.234]
Бериллий, магний и щелочноземельные металлы имеют значительно более высокую способность к комплексообразованию с комплексонами, чем щелочные металлы, выражающуюся как в высоких значениях констант устойчивости, так и в большем разнообразии форм образуемых ими комплексонатов [657— 665]. [c.356]
ПРОИЗВОДСТВО БЕРИЛЛИЯ, МАГНИЯ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. ПРИМЕНЕНИЕ МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ [c.237]
Бериллий, магний и щелочноземельные металлы [c.
 117]
117]Бериллий, магний и щелочноземельные металлы нашли широкое применение в промышленности. Они входят в состав многих сплавов, которые отличаются легкостью, повышенными механическими свойствами и коррозионной стойкостью. Бериллиевые бронзы — сплавы меди с бериллием (0,5—2% Ве) — используются для производства пружин, безыскрового инструмента для работы во взрывоопасных условиях. Сплавы магния с алюминием, цинком, марганцем широко применяются в авиа- и автомобилестроении. Радий используется для получения сплава с бериллием, который служит источником нейтронов в ядерных реакторах. [c.237]
Бериллий, магний и щелочноземельные металлы (кальций, стронций, барий, радий) образуют ПА группу периодической системы. [c.94]
Свойства бериллия, магния и щелочноземельных металлов. Бериллий, магний и щелочноземельные металлы имеют серебристо-белый цвет, легкие (за исключением радия), хотя плотность их значительно выше, чем у щелочных металлов. Бериллий и магний кристаллизуются в гексагональной решетке. Кальций, стронций и барий имеют аналогичные кристаллические решетки (кубическая гранецентрированная). Ионы и атомы бериллия, как имеющие самые малые размеры ионов и атомов элементов данной подгруппы, образуют наиболее прочную кристаллическую решетку. Поэтому бериллий по твердости, температурам плавления и кипения значительно превосходит остальные элементы главной подгруппы И группы. [c.327]
Бериллий и магний кристаллизуются в гексагональной решетке. Кальций, стронций и барий имеют аналогичные кристаллические решетки (кубическая гранецентрированная). Ионы и атомы бериллия, как имеющие самые малые размеры ионов и атомов элементов данной подгруппы, образуют наиболее прочную кристаллическую решетку. Поэтому бериллий по твердости, температурам плавления и кипения значительно превосходит остальные элементы главной подгруппы И группы. [c.327]
Свойства бериллия, магния и щелочноземельных металлов. Бериллий, магний и щелочноземельные металлы имеют серебристо-белый цвет, легкие (за исключением радия), хотя плотность их значительно выше, чем у щелочных металлов. Бериллий и магний кристал- [c.380]
Эту подгруппу составляют металлы бериллий, магний и щелочноземельные металлы. Щелочноземельные металлы — это кальций, стронций, барий и радий. Свое название они получили потому, что их оксиды ( земли ) дают с водой щелочные растворы. [c. 274]
274]
СУЛЬФИДЫ БЕРИЛЛИЯ, МАГНИЯ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ [c.43]
Металлы подгруппы цинка образуют подобно бериллию, магнию и щелочноземельным металлам нитриды состава МедНо и соответственные азиды. При этом в соответствии с электронным строением атомов этих металлов образуются стабильные [c.13]
Нитриды металлов II группы. Нитриды бериллия, магния и щелочноземельных металлов. Нитрид бериллия состава по- [c.25]
Атомы всех рассматриваемых элементов в основном состоянии имеют на внешнем уровне по два спаренных х-электрона (табл. 24). В возбужденном состоянии эти внешние электроны находятся в состоянии в котором атомы могут быть двухвалентными. Радиусы атомов элементов главной подгруппы II группы меньше, чегл у атомов соответствующих щелочных металлов (например, радиусы атомов лития и бериллия составляют, соответственно, 0,1586 и 0,1040 нм). По сравнению с соответствующими щелочными металлами, у атомов бериллия, магния и щелочноземельных металлов, энергия ионизации возрастает. Так, первый потенциал ионизации лития составляет 632 кДж/моль атомов, а бериллия— 899 кДж/моль атомов (ср. данные табл. 22 и 24). [c.380]
Так, первый потенциал ионизации лития составляет 632 кДж/моль атомов, а бериллия— 899 кДж/моль атомов (ср. данные табл. 22 и 24). [c.380]
Атомы бериллия, магния и щелочноземельных металлов в нормальном состоянии имеют нулевую валентность, поскольку у них нет неспаренных электронов. Однако эти элементы можно перевести в возбужденное состояние, в котором внешний электронный слой атомов приобретает конфигурацию ns пр — появляются два неспаренных электрона. Для этого надо затратить определенную энергию, закономерно убывающую при переходе от бериллия к барию (62 ккал г-атом для Ве, 36 ккал г-атом для В а) в соответствии с ростом объема атома. Несмотря на то, что энергия, затраченная на возбуждение, велика, при образовании химических соединений происходит выигрыш энергии за счет энергии связи. Поэтому соединения указанных элементов достаточно прочны и в них элементы проявляют степень окисления, равную двум. [c.131]
Подгруппа бериллия, магния и щелочноземельных металлов Ве, Mg, Са, 5г, Ва, На (з ). Их наружный слой атомов состоит из двух 5-элек-тронов. Максимальная положительная валентность в возбужденном состоянии 2. Отрицательная валентность не характерна. [c.83]
Их наружный слой атомов состоит из двух 5-элек-тронов. Максимальная положительная валентность в возбужденном состоянии 2. Отрицательная валентность не характерна. [c.83]
Щелочные и щелочноземельные металлы относятся к 5-элементам. На внешнем электронно.м слое у атомов щелочных металлов один з-электрон (пз ) у атомов бериллия, магния и щелочноземельных металлов—два з-электрона (пз ). Сверху вниз в подгруппах этих элevleн-тов радиусы атомов увеличиваются, энергия ионизации уменьшается, способность отдавать электроны с внешнего слоя увеличивается, поэтому восстановительная способность тоже увеличивается. [c.284]
Бериллий, магний и щелочноземельные металлы получают электролизом расплавов их хлоридов или термическим восстановением их соединений [c.237]
Смотреть главы в:
Составление химических уравнений 1979 -> Бериллий, магний и щелочноземельные металлы
Курс общей и неорганической химии -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии -> Бериллий, магний и щелочноземельные металлы
Общая химия -> Бериллий, магний и щелочноземельные металлы
Лабораторный практикум по общей химии -> Бериллий, магний и щелочноземельные металлы
Неорганическая химия -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии Издание 2 1954 -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии Издание 3 -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии Издание 4 -> Бериллий, магний и щелочноземельные металлы
Практикум по общей химии Издание 5 -> Бериллий, магний и щелочноземельные металлы
Щелочноземельные металлы | Введение в химию
Цель обучения
- Предскажите степень окисления щелочноземельного металла.

Ключевые моменты
- Щелочноземельные металлы — это блестящие, серебристо-белые металлы, обладающие некоторой реакционной способностью при стандартной температуре и давлении.
- Все щелочноземельные металлы легко теряют два своих внешних электрона с образованием катионов с зарядом 2+.
- Все щелочноземельные металлы, кроме магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения.
- Магний и кальций присутствуют повсеместно и необходимы всем известным живым организмам.
Срок
- Щелочноземельные металлы Группа химических элементов в периодической таблице со схожими свойствами: блестящие, серебристо-белые, несколько реактивные при стандартной температуре и давлении. Они легко теряют два своих крайних электрона с образованием катионов с зарядом +2.
Свойства щелочноземельных металлов
Щелочноземельные металлы (бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra)) представляют собой группу химических элементов в s-блоке таблица Менделеева с очень похожими свойствами:
- блестящий
- серебристо-белый
- несколько реактивных металлов при стандартных температуре и давлении
- легко теряют два своих крайних электрона с образованием катионов с зарядом 2+
- низкой плотности
- низкая температура плавления
- низкие точки кипения
Щелочноземельные металлы включают элементы 2 группы. Все обнаруженные щелочноземельные металлы встречаются в природе.
Все обнаруженные щелочноземельные металлы встречаются в природе.
Реакции щелочноземельных металлов
Все щелочноземельные металлы имеют два электрона в валентной оболочке, поэтому они теряют два электрона, образуя катионы с зарядом 2+. Большая часть химии наблюдалась только у первых пяти членов группы; химический состав радия не изучен из-за его радиоактивности.
С химической точки зрения все щелочные металлы реагируют с галогенами с образованием ионных галогенидов щелочноземельных металлов.Все щелочноземельные металлы, кроме бериллия, также реагируют с водой с образованием сильнощелочных гидроксидов, с которыми следует обращаться с большой осторожностью. Более тяжелые щелочноземельные металлы реагируют более энергично, чем более легкие.
Щелочные металлы имеют вторые по величине первые энергии ионизации в соответствующие периоды периодической таблицы Менделеева. Это происходит из-за их низких эффективных ядерных зарядов и способности достичь полной конфигурации внешней оболочки, потеряв всего два электрона. {-} + H_ {2 (g)} [/ latex], где E = Ca, Sr или Ba
{-} + H_ {2 (g)} [/ latex], где E = Ca, Sr или Ba
Соединения щелочноземельных металлов
- Галогениды алкилмагния (RMgX, где R = углеводородная группа и X = галоген) используются для синтеза органических соединений. Вот пример: [латекс] 3RMgCl + SnCl_ {4} \ rightarrow 3MgCl_ {2} + R_ {3} SnCl [/ latex]
- Оксид магния (MgO) используется в качестве материала для преломления печного кирпича и изоляции проводов (температура плавления 2852 ° C).
- Карбонат кальция (CaCO 3 ) в основном используется в строительной промышленности и для производства известняка, мрамора, мела и кораллов.
Радиоактивность
Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения: бериллий-7, бериллий-10 и кальций-41 являются радиоизотопами в следовых количествах. Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Все изотопы радия радиоактивны.
Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Все изотопы радия радиоактивны.
Встречаемость в природе
Изумруд — это встречающееся в природе соединение бериллия. В земной коре содержится большое количество кальция и магния, которые составляют несколько важных породообразующих минералов, таких как доломит (долостон) и кальцит (известняк).Остальные нерадиоактивные члены группы присутствуют только в меньших количествах. Месторождения каждого из этих минералов разрабатываются для извлечения элементов для дальнейшего использования. Радий с максимальным периодом полураспада 1601 год присутствует в природе только тогда, когда он пополняется цепочкой распада в результате радиоактивного распада более тяжелых элементов.
Изумруд Изумруд — разновидность берилла, минерала, содержащего щелочноземельный металл бериллий. Бериллий встречается в природе только в сочетании с другими элементами в минералах.Биологическая роль и токсичность щелочноземельных металлов
Магний и кальций необходимы всем известным живым организмам. Они задействованы более чем в одной роли. Например, насосы ионов магния или кальция играют роль в некоторых клеточных процессах. Магний действует как активный центр некоторых ферментов, а соли кальция играют структурную роль в костях.
Они задействованы более чем в одной роли. Например, насосы ионов магния или кальция играют роль в некоторых клеточных процессах. Магний действует как активный центр некоторых ферментов, а соли кальция играют структурную роль в костях.
Стронций играет важную роль в морской водной жизни, особенно в твердых кораллах, которые используют стронций для создания своих экзоскелетов.Стронций и барий находят применение в медицине. Например, «бариевая мука» используется в радиографической визуализации, а соединения стронция используются в некоторых зубных пастах.
Однако бериллий и радий токсичны. Низкая растворимость бериллия в воде означает, что он редко доступен для биологических систем. Его роль в живых организмах неизвестна, и, когда они встречаются, он обычно очень токсичен. Радий имеет низкую доступность и очень радиоактивен, что делает его токсичным для жизни.
Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
металлов | Безграничная химия
Щелочные металлы
Щелочные металлы — это химические элементы из s-блока периодической таблицы. Они обладают гомологичными физическими и химическими свойствами.
Цели обучения
Вспомните периодические тенденции, наблюдаемые в щелочных металлах.
Основные выводы
Ключевые моменты
- Щелочные металлы — это группа химических элементов из s-блока периодической таблицы со схожими свойствами: они кажутся серебристыми и их можно разрезать пластиковым ножом.
- Щелочные металлы обладают высокой реакционной способностью при стандартной температуре и давлении и легко теряют свой внешний электрон с образованием катионов с зарядом +1.
- Все обнаруженные щелочные металлы встречаются в природе.
- Большинство щелочных металлов находят множество различных применений, таких как атомные часы рубидия и цезия, натриевые лампы и поваренная соль.
Ключевые термины
- щелок : Сильный едкий щелочной раствор солей калия или натрия, полученный выщелачиванием древесной золы.Он широко используется в производстве мыла, а также в биодизеле.
- щелочной металл : любой из мягких, легких, реакционноспособных металлов группы 1 Периодической таблицы Менделеева; литий, натрий, калий, рубидий, цезий и франций.
- атомные часы цезия : основной стандарт частоты, в котором электронные переходы между двумя сверхтонкими основными состояниями атомов цезия-133 используются для управления выходной частотой.
Щелочные металлы — это группа химических элементов в периодической таблице со следующими физическими и химическими свойствами:
- блестящий
- мягкий
- серебристый
- высокореактивный при стандартной температуре и давлении
- легко теряют свой крайний электрон, образуя катионы с зарядом +1
Все они легко режутся пластиковым ножом из-за их мягкости, а их блестящая поверхность быстро тускнеет на воздухе из-за окисления.Из-за их высокой реакционной способности щелочные металлы должны храниться под маслом, чтобы предотвратить реакцию с воздухом. В современной номенклатуре ИЮПАК щелочные металлы включают элементы группы 1, за исключением водорода. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
Щелочные металлы : Литий хранится в масле из-за его высокой реакционной способности.
Периодические тенденции щелочных металлов
Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).Эта группа находится в s-блоке периодической таблицы, поскольку у всех щелочных металлов крайний электрон находится на s-орбитали. Щелочные металлы представляют собой лучший пример групповых тенденций в свойствах в периодической таблице с элементами, демонстрирующими аналогичные свойства. Например, при движении вниз по таблице все известные щелочные металлы показывают:
- увеличение атомного радиуса,
- уменьшение электроотрицательности
- повышение реактивности
- понижение температуры плавления и кипения
Как правило, их плотность увеличивается при движении вниз по столу, за исключением калия, который менее плотен, чем натрий.
Реакции щелочных металлов
Щелочные металлы бурно реагируют с водой, галогенами и кислотами. В результате реакции выделяется удивительное количество тепла и света. В химическом уравнении щелочные металлы представлены буквой M. Вот несколько примеров уравнений реакции:
- Щелочные металлы реагируют с кислородом с образованием оксидов, которые имеют более тусклый вид и более низкую реакционную способность. Оксиды гораздо менее химически активны, чем чистые металлы.
[латекс] 4 {\ text {M}} _ {(\ text {s})} + {\ text {O}} _ {2 (\ text {g})} \ rightarrow 2 {\ text {M }} _ {2} \ text {O} [/ latex]
- Оксиды активно реагируют с водой с образованием гидроксида.Образующиеся гидроксиды этих элементов полностью диссоциируют в воде с образованием некоторых из самых сильных из известных оснований. Гидроксид натрия (NaOH), также называемый щелочью, представляет собой промышленную основу.
[латекс] {\ text {M}} _ {2} \ text {O} _ {(\ text {s})} + \ text {H} _ {2} {\ text {O}} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} [/ latex]
- Чистый щелочной металл также может напрямую реагировать с водой. В этом случае металл представляет собой основной ангидрид. Выделяется газообразный водород, который легко воспламеняется.
[латекс] 2 {\ text {M}} _ {(\ text {s})} +2 {\ text {H}} _ {2} \ text {O} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} + {\ text {H}} _ {2 (\ text {g})} [/ latex]
- Воздействие галогена на щелочной металл вызывает чрезвычайно экзотермическую реакцию, в результате которой образуется ионная соль. Почти каждая соль щелочного металла хорошо растворяется в воде. Они образуют проводящие растворы, что доказывает их ионную природу.
[латекс] 2 {\ text {M}} _ {(\ text {s})} + {\ text {Cl}} _ {2 (\ text {g})} \ rightarrow 2 \ text {MCl} _ {(\ text {s})} [/ latex]
Встречаемость в природе
Все обнаруженные щелочные металлы встречаются в природе.Были проведены эксперименты, чтобы попытаться синтезировать унунениум (Uue), который, вероятно, станет следующим членом группы, если попытка окажется успешной. Предполагается, что следующим щелочным металлом после унунения будет негэкспентиум (Uhp), элемент, который еще не получил даже попыток синтеза из-за его чрезвычайно высокого атомного номера.
Применение щелочных металлов
Большинство щелочных металлов находят множество различных применений. Двумя наиболее известными применениями чистых элементов являются атомные часы рубидия и цезия, из которых атомные часы цезия являются наиболее точным представлением времени, известным по состоянию на 2012 год.Обычно соединения натрия используются в натриевых лампах, излучающих очень эффективный свет. С другой стороны, поваренная соль или хлорид натрия использовались с древних времен.
Щелочноземельные металлы
Щелочноземельные металлы — это химические элементы в s-блоке периодической таблицы с очень похожими физическими и химическими свойствами.
Цели обучения
Предскажите степень окисления щелочноземельного металла.
Основные выводы
Ключевые моменты
- Щелочноземельные металлы — это блестящие, серебристо-белые металлы, обладающие некоторой реакционной способностью при стандартной температуре и давлении.
- Все щелочноземельные металлы легко теряют два своих внешних электрона с образованием катионов с зарядом 2+.
- Все щелочноземельные металлы, кроме магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения.
- Магний и кальций присутствуют повсеместно и необходимы всем известным живым организмам.
Ключевые термины
- Щелочноземельные металлы : Группа химических элементов в периодической таблице со схожими свойствами: блестящие, серебристо-белые, несколько реактивные при стандартной температуре и давлении.Они легко теряют два своих крайних электрона с образованием катионов с зарядом +2.
Свойства щелочноземельных металлов
Щелочноземельные металлы (бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra)) представляют собой группу химических элементов в s-блоке таблица Менделеева с очень похожими свойствами:
- блестящий
- серебристо-белый
- несколько реактивных металлов при стандартных температуре и давлении
- легко теряют два своих крайних электрона с образованием катионов с зарядом 2+
- низкой плотности
- низкая температура плавления
- низкие точки кипения
Щелочноземельные металлы включают элементы 2 группы.Все обнаруженные щелочноземельные металлы встречаются в природе.
Реакции щелочноземельных металлов
Все щелочноземельные металлы имеют два электрона в валентной оболочке, поэтому они теряют два электрона, образуя катионы с зарядом 2+. Большая часть химии наблюдалась только у первых пяти членов группы; химический состав радия не изучен из-за его радиоактивности.
С химической точки зрения все щелочные металлы реагируют с галогенами с образованием ионных галогенидов щелочноземельных металлов.Все щелочноземельные металлы, кроме бериллия, также реагируют с водой с образованием сильнощелочных гидроксидов, с которыми следует обращаться с большой осторожностью. Более тяжелые щелочноземельные металлы реагируют более энергично, чем более легкие.
Щелочные металлы имеют вторые по величине первые энергии ионизации в соответствующие периоды периодической таблицы Менделеева. Это происходит из-за их низких эффективных ядерных зарядов и способности достичь полной конфигурации внешней оболочки, потеряв всего два электрона. Вторая энергия ионизации всех щелочных металлов также несколько мала.
Бериллий — исключение. Он не реагирует с водой или паром, а его галогениды ковалентны. Все соединения, в состав которых входит бериллий, имеют ковалентную связь. Даже фторид бериллия, который является наиболее ионным соединением бериллия, имеет низкую температуру плавления и низкую электропроводность при плавлении.
Вот список некоторых обычных реакций щелочноземельных металлов, где E = элементы, которые действуют как восстановители:
- Металлы восстанавливают галогены с образованием ионных галогенидов: [латекс] \ text {E} _ {(\ text {s})} + \ text {X} _ {2} \ rightarrow \ text {EX} _ {2 ( \ text {s})} [/ latex] где X = F, Cl, Br или I
- Металлы восстанавливают O2 с образованием оксидов:
[латекс] 2 \ text {E} _ {(\ text {s})} + \ text {O} _ {2} \ rightarrow 2 \ text {EO} _ {(\ text {s})} [ / латекс]
- Более крупные металлы реагируют с водой с образованием газообразного водорода: [латекс] \ text {E} _ {(\ text {s})} +2 \ text {H} _ {2} \ text {O} _ {( \ text {l})} \ rightarrow \ text {E} _ {(\ text {aq})} ^ {2+} +2 \ text {OH} _ {(\ text {aq})} ^ {-} + \ text {H} _ {2 (\ text {g})} [/ latex], где E = Ca, Sr или Ba
- Металлы подвергаются реакциям трансметаллирования с обменом лигандов: [латекс] \ text {Ae} + \ text {Hg} {\ {\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} \ rightarrow [\ text {Ae} \ {{\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} (\ text {THF}) _ {2}] [/ latex], где Ae = Ca, Sr или Ba.
Соединения щелочноземельных металлов
- Галогениды алкилмагния (RMgX, где R = углеводородная группа и X = галоген) используются для синтеза органических соединений. Вот пример: [латекс] 3 \ text {RMgCl} + \ text {SnCl} _ {4} \ rightarrow 3 \ text {MgCl} _ {2} + \ text {R} _ {3} \ text {SnCl} [/ латекс]
- Оксид магния (MgO) используется в качестве материала для преломления печного кирпича и изоляции проводов (температура плавления 2852 ° C).
- Карбонат кальция (CaCO 3 ) в основном используется в строительной промышленности и для производства известняка, мрамора, мела и кораллов.
Радиоактивность
Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения: бериллий-7, бериллий-10 и кальций-41 являются радиоизотопами в следовых количествах. Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Все изотопы радия радиоактивны.
Встречаемость в природе
Изумруд — это встречающееся в природе соединение бериллия. В земной коре содержится большое количество кальция и магния, которые составляют несколько важных породообразующих минералов, таких как доломит (долостон) и кальцит (известняк).Остальные нерадиоактивные члены группы присутствуют только в меньших количествах. Месторождения каждого из этих минералов разрабатываются для извлечения элементов для дальнейшего использования. Радий с максимальным периодом полураспада 1601 год присутствует в природе только тогда, когда он пополняется цепочкой распада в результате радиоактивного распада более тяжелых элементов.
Изумруд : Изумруд — разновидность берилла, минерала, содержащего щелочноземельный металл бериллий. Бериллий встречается в природе только в сочетании с другими элементами в минералах.
Биологическая роль и токсичность щелочноземельных металлов
Магний и кальций необходимы всем известным живым организмам. Они задействованы более чем в одной роли. Например, насосы ионов магния или кальция играют роль в некоторых клеточных процессах. Магний действует как активный центр некоторых ферментов, а соли кальция играют структурную роль в костях.
Стронций играет важную роль в морской водной жизни, особенно в твердых кораллах, которые используют стронций для создания своих экзоскелетов.Стронций и барий находят применение в медицине. Например, «бариевая мука» используется в радиографической визуализации, а соединения стронция используются в некоторых зубных пастах.
Однако бериллий и радий токсичны. Низкая растворимость бериллия в воде означает, что он редко доступен для биологических систем. Его роль в живых организмах неизвестна, и, когда они встречаются, он обычно очень токсичен. Радий имеет низкую доступность и очень радиоактивен, что делает его токсичным для жизни.
Алюминий
Алюминий — мягкий серебристый металл из группы бора периодической таблицы.
Цели обучения
Опишите свойства алюминия.
Основные выводы
Ключевые моменты
- Алюминий — мягкий, легкий и ковкий серебристый металл, не растворимый в воде.
- В подавляющем большинстве соединений алюминий имеет степень окисления 3+, но известны соединения со степенью окисления +1 и +2.
- Алюминий содержит много известных изотопов, массовые числа которых находятся в диапазоне от 21 до 42.
- Алюминий является наиболее широко используемым цветным металлом и в основном легирован, что улучшает его механические свойства.
Ключевые термины
- алюминий : металлический химический элемент (обозначение Al) с атомным номером 13.
- пассивация : относится к материалу, который становится «пассивным», то есть меньше подвержен влиянию факторов окружающей среды, таких как воздух или вода.
Физические свойства алюминия
Алюминий это:
- относительно мягкий
- прочный
- легкий
- пластичный
- податливый
- внешний вид от серебристого до тускло-серого
- не растворяется в воде при нормальных условиях
- немагнитный
- плохо воспламеняется
- способный быть сверхпроводником
Химические свойства
Алюминий устойчив к коррозии из-за явления пассивации.Когда металл подвергается воздействию воздуха, образуется тонкий поверхностный слой оксида алюминия. Этот оксидный слой защищает находящийся под поверхностью алюминий от дальнейшего окисления. Как и многие другие металлы, алюминий также может окисляться водой с образованием водорода и тепла:
[латекс] 2 \ text {Al} \ quad + \ quad 3 {\ text {H}} _ {2} \ text {O} \ quad \ longrightarrow \ quad {\ text {Al}} _ {2} { \ text {O}} _ {3} +3 {\ text {H}} _ {2} [/ latex]
Хотя алюминий чрезвычайно легко окисляется, можно удалить оксидный слой с образца без его немедленного риформинга.Самый простой и безопасный способ — подключить батарею к образцу и провести электролиз либо в инертной атмосфере (например, газообразный аргон), либо в условиях вакуума.
Подавляющее большинство соединений алюминия имеют степень окисления 3+. Координационное число алюминия может варьироваться, но обычно Al 3+ является тетра- или гексакоординированным. Это означает, что у него будет 4 или 6 лигандов.
Галогениды алюминия: использование в качестве кислот Льюиса
Алюминий — очень реактивный металл, который легко вступает в реакцию с трехвалентными соединениями продукта.Его галогениды (AlF 3 , AlCl 3 , AlBr 3 и AlI 3 ) являются общими примерами. Трехвалентный алюминий является электронодефицитным и поэтому исключительно полезен в качестве кислоты Льюиса, особенно в органическом синтезе.
Гидриды алюминия и алюминийорганические соединения
Существует множество соединений эмпирической формулы AlR 3 и AlR 1,5 Cl 1,5 . Эти разновидности обычно имеют тетраэдрические центры Al. С большими органическими группами триорганоалюминий существует в виде трехкоординированных мономеров, таких как триизобутилалюминий.
Важным гидридом алюминия является алюмогидрид лития (LiAlH 4 ), который используется в качестве восстановителя в органической химии. Его можно производить из гидрида лития и трихлорида алюминия:
[латекс] 4 \ text {LiH} \ quad + \ quad \ text {Al} {\ text {Cl}} _ {3} \ quad \ longrightarrow \ quad \ text {LiAl} {\ text {H}} _ {4} \ quad + \ quad 3 \ text {LiCl} [/ латекс]
Алюминий общего назначения
Алюминий — наиболее широко используемый цветной металл. Алюминий почти всегда легирован, что заметно улучшает его механические свойства, особенно при отпуске.Например, обычная алюминиевая фольга и банки для напитков состоят из сплавов с содержанием алюминия от 92% до 99%. Некоторые из многих применений металлического алюминия находятся в:
- Транспортировка листов, труб, отливок и т. Д.
- Упаковка (банки, фольга и др.)
- Строительство (окна, двери, сайдинг, строительная проволока и т. Д.)
- Широкий ассортимент предметов домашнего обихода, от кухонной утвари до бейсбольных бит и часов
- Столбы уличного освещения, мачты парусных судов, прогулочные шесты и т. Д.
- Наружные оболочки бытовой электроники, а также корпуса для оборудования (например, фотоаппаратуры)
- Линии электропередачи для распределения электроэнергии
- Алюминий особой чистоты, используемый в электронике и компакт-дисках
- Радиаторы для электронных устройств, таких как транзисторы и процессоры
- Материал подложки из ламината с металлическим сердечником, плакированного медью, используемого в светодиодном освещении высокой яркости
- Алюминий порошковый, используемый в красках и пиротехнике
- Множество стран, включая Францию, Италию, Польшу, Финляндию, Румынию, Израиль и бывшую Югославию, выпустили монеты, отчеканенные из алюминия или алюминиево-медных сплавов
Использование алюминия при транспортировке : Austin «A40 Sports» в алюминиевом корпусе (ок.1951).
Частей Периодической таблицы
Группа 2A (или IIA ) периодической таблицы — щелочные соединения . земные металлы : бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они тяжелее и менее реакционноспособен, чем щелочные металлы Группы 1А. Имя приходит из-за того, что оксиды этих металлов давали основные растворы при растворении в воде, и они оставались твердыми при температурах доступный древним алхимикам.Как и элементы Группы 1А, щелочноземельные металлы слишком реактивны, чтобы их можно было найти в природе в их элементальная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях самых высоких энергий. ( нс 2 ). Они меньше, чем щелочные металлы того же периода и, следовательно, имеют более высокую энергию ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокие температуры плавления, чем щелочные металлы. металлы: бериллий плавится при 1287 ° C, магний при 649 ° C, кальций при 839 ° C, стронций при 768 ° C, барий при 727 ° C и радий при 700 ° C. Они есть более твердые металлы, чем элементы группы 1А, но мягкие и легкие по сравнению со многими переходными металлами.
Соли металлов группы 2А менее растворимы в воде, чем соли металлов Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли Группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2A прочно связываются с молекулами воды и кристаллизуются в виде гидратов ; среди них — английская соль, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z = 4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от греческое слово, обозначающее минерал берилл, beryllo . Он находится в земная кора при концентрации 2.6 частей на миллион, что делает его 47-м по количеству обильный элемент. Первичные руды бериллия являются бериллами [силикат бериллия-алюминия, Be 3 Al 2 (SiO 3 ) 6 ] и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы ювелирного качества включают изумруды и аквамарин; зеленый цвет из этих драгоценных камней происходит из следовых количеств хрома.
Из-за своего небольшого размера и высокой плотности заряда бериллий связывает через ковалентную связь вместо ионной связи.Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температуры.
Из бериллия делают окна для рентгеновских трубок (это прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель, для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в оболочках для ядерного оружия и в ядерной энергетике. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; длительное воздействие бериллия приводит к воспаление легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z = 12).
Магний — серебристо-белый относительно мягкий металл. Название элемента происходит от Магнезия, район в Фессалии в центральной Греции. Он находится в земная кора с концентрацией 2,3%, что делает ее 7-й по величине обильный элемент. Большое количество магния также присутствует в минералы в мантии Земли. Его получают из морской воды, карналита. [MgKCl 3 6H 2 O], доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ], и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, фотоаппараты, велосипедные рамы, жесткий диск приводы и т. д. Магний окисляется легче, чем железо, и используется в расходных анодах для защиты железных труб и других структуры, которые легко подвержены коррозии.
Магний горит на воздухе бриллиантом. белое пламя и используется в фейерверках и зажигательных бомбах.(Это было используется в одноразовых лампах-вспышках, но это использование было вытеснено другими виды освещения.) Магниевые костры ставить очень сложно наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с азот с образованием нитрида магния (Mg 3 N 2 ), и с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде знакомых соединений. Магний оксид MgO используется в огнеупорных кирпичах, которые способны выдерживает высокие температуры в каминах и печах (магний оксид плавится при 2800 ° С).Гептагидрат сульфата магния, MgSO 4 7H 2 O, более известная как английская соль, это миорелаксант и легкое слабительное. Гидроксид магния, Mg (OH) 2 , также известное как молоко магнезии, слабительное и антацидное средство. («Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний гидроксид плохо растворяется в воде, он имеет тенденцию к образованию мелового, белого цвета. суспензия, внешне похожая на молоко, но значительно отличающаяся физиологические эффекты.)
Зеленые растения содержат молекулу, называемую хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота. В Молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтез, энергия света преобразуется в химическую энергия, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами. (углеводороды, содержащие связи углерод-бром) с образованием магнийорганических соединений реактивы Гриньяра (в честь их первооткрывателя Виктора Гриньяр, лауреат Нобелевской премии по химии 1912 г.). Эти соединения чрезвычайно полезны при формировании новый углерод-углерод связи, и часто используются в синтезе органических соединений. Реагенты Гриньяра, как известно, чувствительны к воде, поэтому необходимо соблюдать осторожность. приняты для обеспечения того, чтобы аппарат, в котором протекает реакция выполняется очень сухо.
Кальций (Ca, Z = 20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от латинское слово, обозначающее лайм, calx . Он находится в земная кора с концентрацией 4,1%, что делает ее 5-й по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существа, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных жителей существа (в виде гидроксиапатита кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca (OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве материалы, такие как штукатурка, раствор и цемент.Строительный раствор изготавливается из оксида кальция, CaO, также известного как известь, или негашеная известь. Когда оксид кальция обрабатывается водой, он образует гидроксид кальция, Ca (OH) 2 , или гашеная известь, поглощающая углекислый газ из воздух и постепенно образует карбонат кальция, CaCO 3 . Известь, нагретая водородом в кислороде, горит ярко-белым. свет, который можно сфокусировать в узкий луч, видимый на большом расстояния. Такое освещение использовалось в маяках, в съемку, а в театрах ставить софиты (оставив актера «в в центре внимания «).
Хлорид кальция — это расплывчатый (он поглощает достаточно воды из воздух, который растворяется в растворе) и используется для удаления влаги с воздуха в сырых подвалах. (Потребовался бы более сильный человек что я сопротивляюсь тому, чтобы называть свежеоткрытую коробку с хлоридом кальция, не вёл себя должным образом как «малолетний расплывающийся организм».)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда, такой как кальций и магний; эти соли вызывают некоторое количество мыла и моющие средства для выпадения в осадок в виде «мыльной пены»; эти минералы выпадают в осадок со временем образует «накипь» в воде обогреватели и кастрюли.Кальций можно удалить водой смягчители, которые обменивают ионы кальция на ионы натрия, которые имеют 1+ и не выпадают в осадок.
Стронций (Sr, Z = 38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан, город в Шотландии, где был добыт минерал стронтианит. открыли, из которого впервые был выделен стронций.Он находится в земная кора с концентрацией 370 частей на миллион, что делает ее 16-м по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании дают ярко-красный цвет и по этой причине используется в фейерверках и осветительных ракетах. Радиоактивный стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку он химически похож на кальций, он включается в кости у людей, которые подвергаются этому.Стронций-90 — бета-излучатель, и препятствует выработке красных кровяных телец.
Барий (Ba, Z = 56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово barys , что означает «тяжелый», применительно к высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 ppm, что делает ее 14-й по величине обильный элемент.Он содержится в рудах барита [сульфат бария, BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в 1500-х годов в виде «болонских камней» (ныне известный как барий сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти камни светились как при свете, так и при нагревании. Соли бария при нагревании приобретают зеленый цвет и используются в фейерверк (в виде нитрата бария, Ba (NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так нерастворим в том, что он проходит через тело до всасывания барий может иметь место. Используется при диагностике некоторых проблемы с кишечником в виде «бариевых клизм»: сульфат бария непрозрачен для рентгеновских лучей и может использоваться для рентгена пищеварительной системы. тракт.
Радий (Ra, Z = 88).
Радий — мягкий блестящий радиоактивный металл.Имя элемента произошло от латинского слова «луч», , радиус , так как способность светиться в темноте слабым голубым светом. Он находится в земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее 84-й элемент по распространенности. Он содержится в следовых количествах в урановые руды, но коммерчески используемый радий легче получить из отработавшее ядерное топливо.
Радий был открыт Пьера и Марии Кюри в 1898 году; они добыли миллиграмм радия из трех тонн урановой руды.Радий производится в радиоактивный распад урана-235, урана-238, тория-232 и плутоний-241. После его открытия и до опасностей радиация были поняты, радий использовался во многих шарлатанских лекарствах и запатентованные лекарства. Из радия сделали светящиеся в темноте часы лица начала 1900-х годов; альфа-частицы, испускаемые радием ударил частицы сульфида цинка, заставив их светиться, но остановился по корпусу часов по стеклу в циферблате.Многие из рабочие, рисовавшие эти циферблаты, заболели или умерли от лучевая болезнь.
Список литературы
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Природные строительные блоки: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Press, 2001.
Дэвид Л.Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Щелочноземельные металлы | Encyclopedia.com
КОНЦЕПЦИЯ
Шесть щелочноземельных металлов — бериллий, магний, кальций, стронций, барий и радий — составляют группу 2 в периодической таблице элементов. Это ставит их рядом с щелочными металлами в Группу 1, и, как следует из их названий, эти два семейства имеют ряд общих характеристик, в первую очередь их высокую реакционную способность.Кроме того, подобно щелочным металлам или любому другому семейству в периодической таблице, не все члены семейства щелочных металлов созданы в равной степени с точки зрения их изобилия на Земле или их полезности для жизни человека. Магний и кальций имеют множество применений, от строительных и других структурных применений до пищевых добавок. Фактически, оба являются важными компонентами метаболизма живых существ, в том числе человеческого тела. Барий и бериллий находят множество специализированных применений в областях от ювелирных изделий до медицины, а стронций в основном используется в фейерверках.С другой стороны, радий редко используется вне лабораторий, во многом потому, что его радиоактивные свойства представляют опасность для жизни человека.
КАК ЭТО РАБОТАЕТ
Определение семейства
Выражение «семейства элементов» относится к группам элементов периодической таблицы, которые имеют общие характеристики. К ним относятся (помимо щелочноземельных металлов и щелочных металлов) переходные металлы, галогены, благородные газы, лантаноиды и актиниды. (Все это описано в отдельных эссе в этой книге.) Кроме того, существует несколько более крупных категорий в отношении общих черт, которые часто пересекаются по семейным линиям; таким образом, все элементы классифицируются как металлы, металлоиды и неметаллы. (Они также обсуждаются в отдельных эссе, в которых упоминаются «сироты» или элементы, не принадлежащие ни к одной из упомянутых выше семей.) внешние наблюдаемые характеристики, а также поведение электронов в атомных структурах элементов.Например, металлы, которые составляют подавляющее большинство элементов периодической таблицы Менделеева, имеют тенденцию быть блестящими, твердыми и пластичными (то есть они могут гнуться, не ломаясь). Многие из них плавятся при довольно высоких температурах, и практически все они плавятся. они испаряются (становятся газами) при высоких температурах. Металлы также образуют ионные связи, самую прочную форму химической связи.
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ЩЕЛОЧНЫХ МЕТАЛЛОВ.
Что касается семейств, существуют определенные наблюдаемые свойства, которые в прошлом побудили химиков сгруппировать щелочноземельные металлы вместе.Эти свойства будут обсуждаться применительно к щелочноземельным металлам, но следует подчеркнуть еще один момент, связанный с разделением элементов на семейства. С прогрессом в понимании, который последовал за открытием электрона в 1897 году, наряду с развитием квантовой теории в начале двадцатого века, химики разработали более фундаментальное определение семейства с точки зрения электронной конфигурации.
Как уже отмечалось, семейство щелочноземельных металлов занимает вторую группу или столбец в периодической таблице.Все элементы в определенной группе, независимо от их видимых различий, имеют общий образец конфигурации своих валентные электроны — электроны «снаружи» атома, участвующие в химической связи. (Напротив, остовные электроны, которые занимают более низкие энергетические области внутри атома, не играют никакой роли в связывании элементов.)
Все члены семейства щелочноземельных металлов имеют конфигурацию валентных электронов с 2 . Это означает, что два электрона участвуют в химической связи, и что эти электроны движутся по орбитали или диапазону вероятностей, примерно соответствующему сфере.Орбитальная диаграмма s соответствует первому из нескольких подуровней в пределах основного энергетического уровня.
Каким бы ни был номер основного энергетического уровня, который соответствует периоду или строке периодической таблицы, атом имеет такое же количество подуровней. Таким образом, бериллий в периоде 2 имеет два основных энергетических уровня, а его валентные электроны находятся на подуровне 2 s 2 . На другом конце группы находится радий в периоде 7. Хотя радий намного сложнее, чем бериллий, с семью энергетическими уровнями вместо двух, тем не менее, он имеет ту же конфигурацию валентных электронов, только на более высоком энергетическом уровне: 7 с. 2 .
ГЕЛИЙ И ЩЕЛОЧНЫЕ МЕТАЛЛЫ.
Если изучить валентные электронные конфигурации элементов периодической таблицы, можно заметить удивительную симметрию и порядок. Все члены группы, хотя их основные уровни энергии различаются, обладают общими характеристиками. их паттерны валентной оболочки. Кроме того, для восьми групп, пронумерованных в версии периодической таблицы для Северной Америки, номер группы соответствует количеству валентных электронов.
Есть только одно исключение: гелий с конфигурацией валентных электронов 1 с 2 обычно помещается в группу 8 с благородными газами.Исходя из этой конфигурации s 2 , может показаться логичным разместить гелий поверх бериллия в семействе щелочноземельных металлов; но есть несколько причин, по которым этого не делается. Во-первых, очевидно, что гелий не металл. Что еще более важно, гелий ведет себя совершенно иначе, чем щелочноземельные металлы.
В то время как гелий, как и остальные благородные газы, очень устойчив к химическим реакциям и образованию связей, щелочноземельные металлы известны своей высокой реакционной способностью, то есть склонностью к образованию или разрыву связей между атомами или молекулами, так что материалы трансформируются.(Аналогичная взаимосвязь существует в группе 1, которая включает водород и щелочные металлы. Все они имеют одинаковую валентную конфигурацию, но водород никогда не входит в состав семейства щелочных металлов.)
Характеристики щелочноземельных металлов
Как щелочные металлы, щелочноземельные металлы обладают свойствами основания, в отличие от кислоты. Щелочноземельные металлы блестящие, большинство из них белого или серебристого цвета. Как и их «кузены» из семейства щелочных металлов, они светятся характерными цветами при нагревании.Кальций светится оранжевым светом, стронций — очень ярко-красным, а барий — зеленым яблоком. Физически они мягкие, но не такие мягкие, как щелочные металлы, многие из которых можно разрезать ножом.
Еще одно сходство щелочноземельных металлов со щелочными металлами заключается в том, что четыре из них — магний, кальций, стронций и барий — были идентифицированы или выделены в первом десятилетии XIX века английским химиком сэром Хамфри. Дэви (1778-1829). Примерно в то же время Дэви также выделил натрий и калий из семейства щелочных металлов.
РЕАКТИВНОСТЬ.
Щелочноземельные металлы менее реактивны, чем щелочные металлы, но, как и щелочные металлы, они гораздо более реактивны, чем большинство элементов. Опять же, как и их «кузены», они реагируют с водой с образованием газообразного водорода и гидроксида металла, хотя их реакции менее выражены, чем реакции щелочных металлов. Металлический магний в чистом виде горюч, и при контакте с воздухом он горит интенсивным белым светом, соединяясь с кислородом с образованием оксида магния.Точно так же кальций, стронций и барий реагируют с кислородом с образованием оксидов.
Из-за своей высокой реакционной способности щелочноземельные металлы редко появляются сами по себе в природе; скорее, они обычно встречаются с другими элементами в сложной форме, часто в виде карбонатов или сульфатов. Это, опять же, еще одно сходство со щелочными металлами. Но в то время как щелочные металлы имеют тенденцию образовывать катионы 1+ (положительно заряженные атомы), щелочноземельные металлы образуют катионы 2+, то есть катионы с положительным зарядом 2.
ТОЧКИ КИПЕНИЯ И ПЛАВЛЕНИЯ.
Один из способов отличия щелочноземельных металлов от щелочных металлов — это точки плавления и кипения — те температуры, соответственно, при которых твердый металл превращается в жидкость, а жидкий металл — в пар. Для щелочных металлов температуры кипения и плавления уменьшаются с увеличением атомного номера. Однако для щелочноземельных металлов картина не так ясна.
Самые высокие температуры плавления и кипения у бериллия, у которого действительно самый низкий атомный номер.Он плавится при 2348,6 ° F (1287 ° C) и кипит при 4789,8 ° F (2471 ° C). Эти цифры намного выше, чем для лития, щелочного металла в тот же период, что и бериллий, который плавится при температуре 356,9 ° F (180,5 ° C) и кипит при температуре 2457 ° F (1347 ° C).
Магний, второй щелочноземельный металл, плавится при температуре 1202 ° F (650 ° C) и кипит при температуре 1,994 ° F (1090 ° C), что значительно ниже, чем для бериллия. Однако точки плавления и кипения выше для кальция, трети щелочноземельных металлов, и их значение составляет 1547.6 ° F (842 ° C) и 2703,2 ° F (1484 ° C) соответственно. Температуры плавления и кипения неуклонно снижаются по мере повышения уровня энергии через стронций, барий и радий, но эти температуры никогда не бывают ниже, чем для магния.
ИЗОБИЛИЕ.
Из щелочноземельных металлов наиболее распространен кальций. Он занимает пятое место среди элементов земной коры, составляя 3,39% элементарной массы. Он также является пятым по распространенности в организме человека, с долей 1,4%. Магний, который составляет 1.93% земной коры является восьмым по содержанию элементом на Земле. Он занимает седьмое место в организме человека, составляя 0,50% от массы тела.
Барий занимает семнадцатое место среди элементов земной коры, хотя на его долю приходится всего 0,04% массы элемента. Ни он, ни три других щелочных металла не появляются в организме в незначительных количествах: действительно, барий и бериллий ядовиты, а радий настолько радиоактивен, что воздействие на него может быть чрезвычайно вредным.
В земной коре стронций присутствует в количестве 360 частей на миллион (ppm), что на самом деле довольно много по сравнению с рядом элементов.В океане его содержание составляет около 8 промилле. Напротив, содержание бериллия в земной коре измеряется в частях на миллиард (ppb) и оценивается в 1900 ppb. Гораздо более редким является радий, который составляет всего 0,6 частей на триллион земной коры — факт, который сделал его выделение французско-польским физиком и химиком Мари Кюри (1867-1934) еще более впечатляющим.
ПРИМЕНЕНИЕ В РЕАЛЬНОМ ЖИЗНИ
Бериллий
В восемнадцатом веке французский минералог Рене Жюст-Гаюи (1743–1822) заметил, что и изумруды, и минерал берилл обладают схожими свойствами.Французский химик Луи-Николя Воклен (1763-1829) в 1798 году определил общий элемент: бериллий (Be), имеющий атомный номер 4 и атомную массу 9,01 а.е.м. Прошло около трех десятилетий, прежде чем немецкий химик Фридрих Вёлер (1800–1882) и французский химик Антуан Бюсси (1794–1882), работая независимо друг от друга, сумели выделить элемент.
Бериллий содержится в основном в изумрудах и аквамаринах, драгоценных камнях, являющихся формами берилла, состоящего из алюмосиликатного соединения бериллия.Хотя он токсичен для человека, бериллий, тем не менее, находит применение в сфере здравоохранения: поскольку он пропускает больше рентгеновских лучей, чем стекло, бериллий часто используется в рентгеновских трубках.
Металлические сплавы, содержащие около 2% бериллия, имеют тенденцию быть особенно прочными, устойчивыми к износу и стабильными при высоких температурах. Например, медно-бериллиевые сплавы применяются в ручных инструментах в отраслях промышленности, где используются легковоспламеняющиеся растворители, поскольку инструменты, изготовленные из этих сплавов, не вызывают искр при ударе друг о друга.Сплавы бериллия и никеля применяются для специализированных электрических соединений, а также для высокотемпературных применений.
Магний
Английский ботаник и врач Неемия Грю (1641-1712) в 1695 году обнаружил сульфат магния в источниках недалеко от английского города Эпсом, графство Суррей. Это соединение, с тех пор называемое «английской солью», давно известно своей лечебной ценностью. Соль Эпсома используется для лечения эклампсии, состояния, которое вызывает судороги у беременных. Это соединение также является сильным слабительным и иногда используется для избавления организма от ядов, таких как родственный элемент магния, барий.
Некоторое время ученые путали оксид магнезии с известью или карбонатом кальция, который на самом деле включает другой щелочноземельный металл. В 1754 году шотландский химик и физик Джозеф Блэк (1728-1799) написал «Эксперименты с магнезией, альбой, негашеной извести и некоторыми другими щелочными веществами», важную работу, в которой он различал магнезию и известь. Дэви в 1808 году объявил магнезию оксидом нового элемента, который он назвал магнием, но прошло около 20 лет, прежде чем Бюсси удалось выделить этот элемент.
Магний (Mg) имеет атомный номер 12 и атомную массу 24,31 а.е.м. Он содержится в основном в таких минералах, как доломит и магнезит, оба из которых являются карбонатами; а в карналлите — хлорид. Силикаты магния включают асбест, тальк или тальк и слюду. Не все формы асбеста содержат магний, но тот факт, что многие из них содержат, только показывает, как химические реакции могут изменять свойства, которыми обладает элемент в отдельности.
ВАЖНЫЙ КОМПОНЕНТ ЗДОРОВЬЯ.
В то время как магний легко воспламеняется, асбест когда-то использовался в больших количествах в качестве антипирена. И хотя асбест был в значительной степени удален из общественных зданий по всей территории Соединенных Штатов из-за сообщений, связывающих воздействие асбеста с раком, магний является важным компонентом здоровья живых организмов. Он играет важную роль в хлорофилле, зеленом пигменте растений, который улавливает энергию солнечного света, и по этой причине он также используется в удобрениях.
В организме человека ионы магния (заряженные атомы) помогают в процессе пищеварения, и многие люди принимают минеральные добавки, содержащие магний, иногда в сочетании с кальцием.Существует также его использование в качестве слабительного, о котором уже упоминалось. Английские соли, как и положено их щелочному или щелочному качеству, чрезвычайно горькие — это вещество, которое человек принимает только в условиях крайней необходимости. С другой стороны, молоко с магнезией — слабительное с гораздо менее неприятным вкусом.
МАГНИЙ УХОДИТ НА ВОЙНУ.
Отличительной чертой химической универсальности магния является то, что этот же элемент, столь важный для сохранения жизни, также широко использовался в войне.Незадолго до Первой мировой войны Германия была ведущим производителем магния во многом благодаря методу электролиза, разработанному немецким химиком Р. В. Бунзеном (1811-1899). Когда Соединенные Штаты начали войну против Германии, американские компании начали производить магний в больших количествах.
Бунзен обнаружил, что порошкообразный магний горит ярким белым пламенем, а на войне магний использовался в осветительных ракетах, трассирующих пулях и зажигательных бомбах, которые воспламеняются и горят при ударе.Яркий свет, образующийся при горении магния, также нашел применение в ряде случаев в мирное время — например, в фейерверках и вспышках, используемых в фотографии.
Магний нашел применение в другой мировой войне. К тому времени, когда нацистские танки вошли в Польшу в 1939 году, немецкий военно-промышленный комплекс начал использовать металл для строительства самолетов и другой военной техники. Америка снова ввела в действие свою собственную машину для военного производства, резко увеличив производство магния до почти 184 000 тонн (166 924 800 кг) в 1943 году.
КОНСТРУКТИВНЫЕ ПРИМЕНЕНИЯ.
В первую мировую войну магний использовался в основном из-за его зажигательных свойств, но во время Второй мировой войны он в основном использовался в качестве конструкционного металла. Он легкий, но прочнее на единицу массы, чем любой другой обычный конструкционный металл. Как металл для строительных машин и другого оборудования, магний по популярности уступает только железу и алюминию (который примерно на 50% плотнее магния).
Автомобильная промышленность — одна из областей производства, в которой особенно важны структурные свойства магния.По обе стороны Атлантики автопроизводители используют или испытывают детали автомобилей, изготовленные из сплавов магния и других металлов, в первую очередь алюминия. Магний легко превращается в сложные конструкции, что может означать сокращение количества деталей, необходимых для сборки автомобиля, и, следовательно, упрощение процесса сборки.
Среди видов спортивного оборудования, в котором используются магниевые сплавы, — маски для ловцов бейсбола, лыжи, беговые машины и даже подковы. В различных марках лестниц, портативных инструментов, электронного оборудования, биноклей, фотоаппаратов, мебели и багажа также используются детали из этого легкого и прочного металла.
Кальций
Дэви выделил кальций (Са) с помощью электролиза в 1808 году. Элемент, название которого происходит от латинского calx, или «известь», имеет атомный номер 20 и атомную массу 40,08. . Основными источниками кальция являются известняк и доломит, оба из которых являются карбонатами, а также сульфатный гипс.
В виде известняка и гипса кальций использовался в качестве строительного материала с древних времен и продолжает находить применение в этой области.Известь смешивают с глиной, чтобы сделать цемент, а цемент смешивают с песком и водой, чтобы сделать раствор. Кроме того, при смешивании с песком, гравием и водой из цемента получается бетон. Мрамор, который когда-то использовался для строительства дворцов, а сегодня используется в основном для декоративных элементов, также содержит кальций.
В сталелитейной, стекольной, бумажной и металлургической промышленности используются гашеная известь (гидроксид кальция) и негашеная известь или оксид кальция. Он помогает удалять загрязнения из стали и загрязняющие вещества из дымовых труб, а карбонат кальция в бумаге обеспечивает гладкость и непрозрачность готового продукта.Когда карбид кальция (CaC 2 ) добавляется в воду, образуется легковоспламеняющийся газ ацетилен (C 2 H 2 ), используемый в сварочных горелках. В различных соединениях кальций используется как отбеливатель; материал при производстве удобрений; и как заменитель соли в качестве плавильного агента на обледенелых дорогах.
Пищевая, косметическая и фармацевтическая промышленность используют кальций в составе антацидов, зубной пасты, жевательной резинки и витаминов. Кальций важен для живых существ даже в большей степени, чем магний, и присутствует в листьях, костях, зубах, раковинах и кораллах.В организме человека он помогает свертыванию крови, сокращению мышц и регулированию сердцебиения. Содержащийся в зеленых овощах и молочных продуктах кальций (вместе с добавками кальция) рекомендуется для профилактики остеопороза. Последнее, состояние, связанное с потерей плотности костей, особенно поражает пожилых женщин и приводит к тому, что кости становятся хрупкими и легко ломаются.
Стронций
Ирландский химик и врач Адэр Кроуфорд (1748-1795) и шотландский химик и хирург Уильям Камберленд Крукшенк (1790-1800) в 1790 году открыли то, что Кроуфорд назвал «новым видом земли», недалеко от Стронтиана в Шотландии.Год спустя английский химик Томас Чарльз Хоуп (1766-1844) начал изучать найденную Кроуфордом и Крукшенком руду, которую они назвали стронцией.
В отчетах, составленных в 1792 и 1793 годах, Хоуп объяснила, что стронцию можно отличить от извести или гидроксида кальция на с одной стороны, и барита или гидроксида бария, с другой, в силу его реакции на испытания пламенем. В то время как кальций производил красное пламя, а барий — зеленое, стронция светилась ярко-красным светом, который легко отличить от более темного красного цвета кальция.
И снова Дэви выделил новый элемент с помощью электролиза в 1808 году. Впоследствии он был назван стронцием (Sr), его атомный номер 38 и атомная масса 87,62. Серебристо-белый, он быстро окисляется на воздухе, образуя бледно-желтую оксидную корку на любой свежесрезанной поверхности.
Хотя он имеет свойства, аналогичные свойствам кальция, сравнительная редкость стронция и затраты, связанные с его извлечением, не создают экономических стимулов для его использования вместо его гораздо более распространенного родственного элемента.Тем не менее, у стронция есть несколько применений, в первую очередь из-за его яркого малинового пламени. Поэтому его применяют при изготовлении фейерверков, сигнальных ракет и трассирующих пуль, то есть снарядов, излучающих свет при полете по воздуху.
Одно из наиболее спорных «применений» стронция касалось радиоактивного изотопа стронция-90, побочного продукта испытаний ядерного оружия в атмосфере с конца 1940-х годов. Изотоп упал на землю в виде мелкого порошка, покрыл траву, был проглочен коровами и в конечном итоге попал в молоко, которое они производили.Из-за своего сходства с кальцием изотоп попал в зубы и десны детей, которые пили молоко, что вызвало проблемы со здоровьем, которые помогли положить конец атмосферным испытаниям в начале 1960-х годов.
Барий
Аспекты истории бария аналогичны истории других щелочноземельных металлов. В восемнадцатом веке химики были убеждены, что оксид бария и оксид кальция представляют собой одно и то же вещество, но в 1774 году шведский химик Карл Вильгельм Шееле (1742-1786) продемонстрировал, что оксид бария представляет собой отдельное соединение.Дэви выделил этот элемент, как и два других щелочноземельных металла, с помощью электролиза в 1808 году.
Барий (Ba) имеет атомную массу 137,27 и атомный номер 56. Он появляется в основном в рудах барита, a сульфат и витерит карбонат. Сульфат бария используется как белый пигмент в красках, а карбонат бария применяется при производстве оптического стекла, керамики, глазури. керамика и специальная посуда. Одно из наиболее важных применений — это смазка для бурового долота, известная как «буровой раствор» или суспензия для бурения нефтяных скважин.Как и ряд родственных ему элементов, барий (в форме нитрата бария) используется в фейерверках и факелах. В моющих средствах для моторных масел для поддержания чистоты двигателей используются оксид бария и гидроксид бария.
Бериллий — не единственный щелочноземельный металл, используемый для получения рентгеновских лучей, и магний не единственный член семейства, применяемый в качестве слабительного. Барий используется в клизмах, а сульфат бария используется для покрытия внутренней оболочки кишечника, чтобы врач мог исследовать пищеварительную систему пациента.(Хотя барий ядовит, но в форме сульфата бария он безопасен для проглатывания, потому что соединение не растворяется в воде или других жидкостях организма.) Перед рентгенологическим обследованием пациента могут попросить выпить меловую жидкость сульфата бария. который поглощает большую часть излучения, испускаемого рентгеновским аппаратом. Это добавляет контрастности черно-белому рентгеновскому снимку, позволяя врачу поставить более обоснованный диагноз.
Радий
Сегодня радий (Ra; атомный номер 88; атомная масса 226 а.е.м.) мало используется вне исследований; Тем не менее, история его открытия Марией Кюри и ее мужем Пьером (1859–1906), французским физиком, является важной главой не только в истории химии, но и в истории человечества в целом.Вдохновленная открытием радиоактивных свойств урана французским физиком Анри Беккерелем (1852–1908), Мария Кюри увлеклась темой радиоактивности, по которой она написала свою докторскую диссертацию. Задавшись целью найти другие радиоактивные элементы, она и Пьер переработали большое количество урановой обманки, руды, обычно обнаруживаемой на урановых рудниках. В течение года они обнаружили элемент полоний, но были убеждены, что другой радиоактивный ингредиент присутствует — хотя и в гораздо меньших количествах — в смоляной обманке.
Кюри потратили большую часть своих сбережений на покупку тонны руды и начали работу по извлечению достаточного количества предполагаемого Элемента 88 для годной пробы — 0,35 унции (1 г). Практически непрерывно трудясь в течение четырех лет, Кюри — к тому времени утомленные и испытывающие финансовые затруднения — наконец произвели необходимое количество радия. Их судьба должна была улучшиться: в 1903 году они разделили Нобелевскую премию по физике с Беккерелем, а в 1911 году Мари получила вторую Нобелевскую премию, на этот раз по химии, за открытия полония и радия.Она — единственный человек в истории, удостоенный Нобелевской премии в двух различных научных категориях.
Поскольку Кюри не смогли запатентовать свой процесс, они не получили прибыли от множества «радиевых центров», которые вскоре возникли, рекламируя недавно открытый элемент как лекарство от рака. На самом деле, как оказалось, опасность, связанная с этим высокорадиоактивным веществом, перевешивала любые преимущества. Таким образом, радий, который когда-то использовался в светящейся краске и на циферблатах часов, был выведен из употребления.Смерть Марии Кюри от лейкемии в 1934 году произошла в результате длительного воздействия радиации и других элементов.
ГДЕ ПОДРОБНЕЕ
«Щелочноземельные металлы». ChemicalElements.com (веб-сайт).
«Щелочноземельные металлы» (веб-сайт).
Ebbing, Darrell D .; Р.А. Д. Вентворт; и Джеймс П. Бирк. Введение в химию. Бостон: Хоутон Миффлин, 1995.
Керрод, Робин. Материя и материалы. Иллюстрировано Терри Хэдлером. Тарритаун, Нью-Йорк: Benchmark Books, 1996.
Мебейн, Роберт К. и Томас Р. Рыболт. Металлы. Иллюстрировано Анни Матсик. Нью-Йорк: Книги двадцать первого века, 1995.
Oxlade, Chris. Металл. Чикаго, Иллинойс: Библиотека Хайнемана, 2001.
Снедден, Роберт. Материалы. Des Plaines, IL: Heinemann Library, 1999.
«Визуальные элементы: группа 1 — щелочноземельные металлы» (веб-сайт).
КЛЮЧЕВЫЕ ТЕРМИНЫ
ЩЕЛОЧНЫЕ ЗЕМЛИ МЕТАЛЛЫ:
Группа 2 периодической таблицы элементов с конфигурациями валентных электронов n s 2 . Шесть щелочноземельных металлов, все из которых обладают высокой химической реакционной способностью, — это бериллий, магний, кальций, стронций, барий и радий.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ:
Элементы группы 1 периодической таблицы элементов, за исключением водорода. Все щелочные металлы имеют один валентный электрон на орбитали s1 и обладают высокой реакционной способностью.
КАТИОН:
Положительный ион, который образуется, когда атом теряет один или несколько электронов. Все щелочноземельные металлы имеют тенденцию к образованию катионов 2+ (произносится как KAT-ieunz).
ЭЛЕКТРОЛИЗ:
Использование электрического тока, чтобы вызвать химическую реакцию.
ION:
Атом или группа атомов, которые потеряли или получили один или несколько электронов и, таким образом, имеют чистый электрический заряд.
ИЗОТОПЫ:
Атомы, которые имеют одинаковое количество протонов и, следовательно, принадлежат к одному элементу, но различаются количеством нейтронов. Это приводит к разнице масс. Изотопы могут быть стабильными или нестабильными, то есть радиоактивными. Так обстоит дело с изотопами радия, радиоактивного члена семейства щелочноземельных металлов.
ORBITAL:
Шаблон вероятностей относительно положения электрона для анатома в определенном энергетическом состоянии.Все шесть щелочноземельных металлов имеют валентные электроны на орбитали s 2 , которая описывает более или менее сферическую форму.
ПЕРИОДЫ:
Строки периодической системы элементов. Они представляют собой последовательные основные энергетические уровни в атомах задействованных элементов.
ОСНОВНОЙ УРОВЕНЬ ЭНЕРГИИ:
Значение, указывающее расстояние, на которое электрон может уйти от ядра анатома. Это обозначается целым числом, начиная с 1 и двигаясь вверх.Чем выше основной энергетический уровень, тем больше энергия в атоме и тем сложнее структура орбиталей.
РАДИОАКТИВНОСТЬ:
Термин, описывающий явление, при котором определенные материалы подвергаются форме распада, вызванной испусканием частиц высокой энергии. «Разложение» в этом смысле не означает «гниение»; вместо этого радиоактивные изотопы продолжают превращаться в другие изотопы, пока не станут стабильными.
РЕАКЦИОННАЯ СПОСОБНОСТЬ:
Тенденция образования или разрыва связей между атомами или молекулами таким образом, что материалы трансформируются.
СОЛЬ:
Вообще говоря, соединение, объединяющее металл и неметалл. Более конкретно, соли (наряду с водой) являются продуктом реакции между кислотой и основанием.
SHELL:
Группа электронов на одном основном уровне энергии.
SUBLEVEL:
Область в пределах основного энергетического уровня, занятая электронами в анатоме. Каким бы ни было число n главного энергетического уровня, существует n подуровней.На каждом основном энергетическом уровне первым заполняется подуровень, соответствующий орбитальной схеме s , где все щелочноземельные металлы имеют свои валентные электроны.
ЭЛЕКТРОНЫ ВАЛЕНЦИИ:
Электроны, занимающие самые высокие энергетические уровни в анатоме и участвующие в химических связях.
Гиперглоссарий MSDS: Щелочная земля
Гиперглоссарий MSDS: Щелочная земляОпределение
Щелочноземельный элемент — это любой элемент во втором столбце периодической таблицы Менделеева.Эти элементы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra):
Не путайте этот термин со словом щелочной, которое относится к щелочному веществу (имеющему pH больше 7) или щелочному металлу.
Дополнительная информация
Щелочноземельные элементы содержатся во многих обычных материалах. Например, ионы кальция являются основным компонентом ваших костей, магний используется в различных сплавах металлов, стронций используется в телевизионных трубках, а соединения бария используются в качестве рентгеноконтрастных агентов.Радий — очень редкий радиоактивный материал. Бериллий — токсичный и канцерогенный материал, требующий особого обращения.
Ca, Sr и Ba в своей элементарной (металлической) форме реагируют с воздухом и водой, но в гораздо меньшей степени, чем их аналоги из щелочных металлов. Эта реакционная способность увеличивается по мере движения вниз по столбцу от Ca к Ba. Реакцию элементарных Ca, Sr и Ba с водой можно описать химическим уравнением ниже, где M = щелочноземельный металл.
M (с) + 2 H 2 O M 2+ (вод.) + 2 HO — (вод.) + H 2 (г)
В некоторых случаях тепло этой реакции может воспламенить газообразный водород (H 2 ), который выделяется в реакции.
Хотя эти металлы блестят при резке, они имеют тенденцию тускнеть на воздухе. Кальций, барий и стронций следует хранить в инертной атмосфере и / или в минеральном масле.
Обратите внимание, что существует большая разница между щелочноземельным металлом (например, Ca) и катионом щелочноземельного металла (например, Ca 2+ ).Опасности часто зависят от химического состояния материала!
Соответствие паспорту безопасности (SDS)
Бериллий токсичен как в элементарной форме, так и в солях / соединениях, таких как Be 2+ , поэтому необходимо использовать специальные меры предосторожности, такие как респираторы, когда может выделяться пыль или пары Be или его соединений. См. Ссылки ниже для получения дополнительной информации. Все остальные щелочные металлы легко воспламеняются и вступают в реакцию с водой, поэтому при их использовании необходимо соблюдать особую осторожность, и должен быть доступен соответствующий огнетушитель класса D.
Элементарные Mg, Ca, Ba и Sr несовместимы с некоторыми классами химикатов, такими как галогенированные растворители. См. Примечания к щелочным металлам для получения дополнительной информации.
Дополнительная литература
См. Также: щелочной металл, галоген, инертный, реагирующий с водой.
Дополнительные определения от Google и OneLook.
Последнее обновление записи: суббота, 1 февраля 2020 г.Права на эту страницу принадлежат ILPI, 2000-2021 гг. Несанкционированное копирование или размещение на других веб-сайтах категорически запрещено. Присылайте нам предложения, комментарии и пожелания относительно новых участников (при необходимости, укажите URL-адрес) по электронной почте.
Заявление об ограничении ответственности : Информация, содержащаяся в данном документе, считается правдивой и точной, однако ILPI не дает никаких гарантий относительно правдивости каких-либо утверждений. Читатель использует любую информацию на этой странице на свой страх и риск. ILPI настоятельно рекомендует читателям проконсультироваться с соответствующими местными, государственными и федеральными агентствами по вопросам, обсуждаемым здесь.
Щелочноземельные металлы. Их химические характеристики — Классификация элементов в периодической таблице по группам по электронному строению
Щелочноземельные металлы — это элементы группы IIA, которые обладают свойствами, характерными для металлов, но образуют гидроксиды при взаимодействии с водой и ионами со степенью окисления +2.
Щелочноземельные металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).Щелочноземельные металлы имеют два валентных электрона . Они очень реактивны и не встречаются в естественном состоянии в их элементарном состоянии. Два валентных электрона легко удаляются с образованием двухвалентных катионов. Щелочноземельные металлы — хорошие проводники электричества. У них низкая энергия ионизации , низкая сродства к электрону и низкая электроотрицательность . Щелочноземельные металлы имеют степень окисления +2 и электронную структуру в S подоболочке, занятой 2 электронами, обозначенную как Xs 2 .
Источник: ChemistryLearner — https://www.chemistrylearner.com/alkaline-earth-metals
Практические вопросы
Ханская академия
Официальная подготовка MCAT (AAMC)
Практический экзамен 3 Раздел C / P Отрывок 10 Вопрос 54
Практический экзамен 4 Раздел C / P Отрывок 4 Вопрос 20
Ключевые точки
- Щелочноземельные металлы имеют два валентных электрона
- Они имеют низкую энергию ионизации, низкое сродство к электрону и низкую электроотрицательность
- Они обладают высокой реакционной способностью и часто образуют двухвалентные катионы
- Они хорошие проводники электричества
- Щелочноземельные металлы имеют степень окисления +2
Ключевые термины
- Валентный электрон : электрон внешней оболочки, который может участвовать в химических связях
- Энергия ионизации: энергия, необходимая для удаления электрона из валентной оболочки газообразного атома
- Сродство к электрону: изменение энергии, которое происходит, когда атом получает электрон
- Электроотрицательность: мера способности атома притягивать электроны в связи
- Степень окисления: номер, присвоенный элементу в химической комбинации, который представляет количество потерянных электронов
- Электронная структура: описательные числовые отнесения к электронам на различных уровнях энергии и спиновых состояниях в атоме
Научный обзор щелочноземельных металлов
Обзор
Щелочноземельные металлы — следующая колонка в периодической таблице после щелочных металлов.Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У них есть два электрона во внешней оболочке, от которых они отказываются в химических реакциях.
Бериллий (Be)
Бериллий (атомный номер 4) — хрупкое металлическое вещество, которое обычно содержится в других соединениях и минералах. Минерал, содержащий бериллий, берилл, был известен с древних времен как драгоценные камни изумруд и аквамарин. При использовании в сплавах бериллий делает другие металлы более прочными, например алюминий и медь.Часто используется в аэрокосмической промышленности. Однако бериллиевая пыль очень токсична для легких, вызывая заболевание, подобное хронической пневмонии.
Магний (Mg) и кальций (Ca)
Магний (атомный номер 12) также реагирует, особенно с кислородом. Он почти никогда не встречается в природе в виде чистого магния, но может быть получен искусственно. Это важный элемент как для растений, так и для животных, поскольку ионы магния используются многими различными ферментами. Магний часто сплавлен с алюминием для производства прочных и легких металлов для аэрокосмической, автомобильной и электронной промышленности.Кальций (атомный номер 20) очень распространен в таких соединениях, как карбонат кальция (природный известняк) и мел. Это важно для жизни, особенно для развития и поддержания костей и зубов.
Стронций (Sr) и барий (Ba)
Стронций (атомный номер 38) реагирует с кислородом, особенно в воде. В природе он содержится в соединениях и минералах, но его радиоактивный изотоп стронций 90 обнаруживается в осадках. Барий (атомный номер 56) настолько реагирует с кислородом воздуха, что обычно хранится под маслом, как и щелочные металлы.Он содержится в таких минералах, как барит или сульфат бария (BaSO4).
Радий (Ra)
Радий (атомный номер 88) радиоактивен во всех изотопах. Изотоп с самым длинным периодом полураспада составляет около 1600 лет. Однако радий является естественным продуктом распада урана, поэтому его обычно находят вместе с ураном. Он известен как радиоактивный элемент из-за экспериментов Мари и Пьера Кюри в конце 19-го и начале 20-го веков. Радиевую краску когда-то использовали для часовых стрелок, чтобы они светились в темноте, но от нее отказались в пользу более безопасных альтернатив.Сама Мария Кюри умерла от последствий своих экспериментов с радием.
Заинтересованы в услугах репетиторства по естественным наукам? Узнайте больше о том, как мы помогаем тысячам студентов каждый учебный год.
SchoolTutoring Academy — ведущая компания по оказанию образовательных услуг для школьников и школьников. Мы предлагаем учебные программы для учащихся K-12, AP и колледжей. Чтобы узнать больше о том, как мы помогаем родителям и ученикам в Чикаго, штат Иллинойс, посетите раздел «Репетиторство в Чикаго, штат Иллинойс».
.