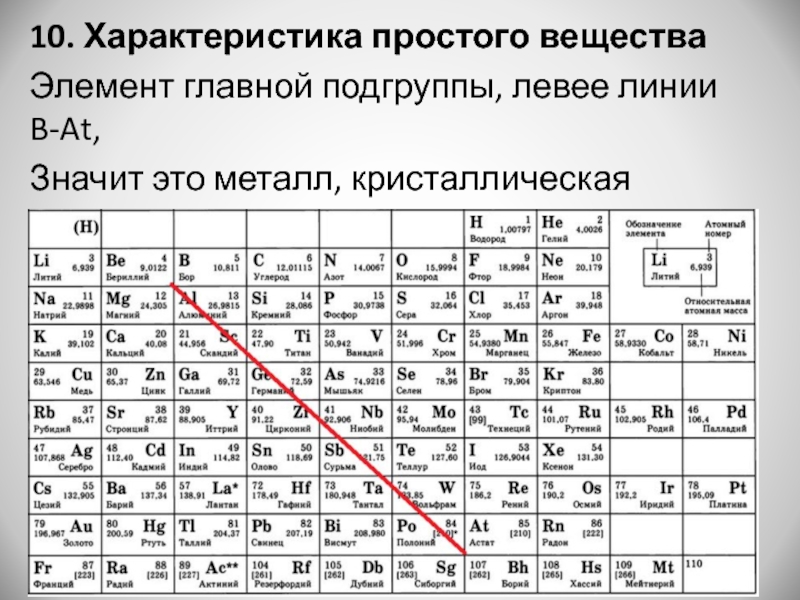
свойства, месторождения и способы получения, области применения
Вольфрам (от латинского Wolframium) — химический элемент с относительной атомной массой 183,84. В периодической таблице Менделеева он обозначен символом W, принадлежит к шестой группе и имеет атомный номер 74. В обычных условиях существует в виде твёрдого блестящего серебристо-серого металла, тяжёлого и тугоплавкого.
Химически стоек к большинству кислот и царской водке, растворим в перекиси водорода и смеси плавиковой и азотной кислот. Он практически неразрушим и применяется везде, где надо работать с высокими температурами, выполнять сварку и вытягивать металлические нити.
- Происхождение названия
- Месторождения и способы получения
- Физические и химические свойства
- Области применения
- Биологическая роль
Происхождение названия
Имя Wolframium произошло от известного с XVI века минерала вольфрамит, что в переводе с немецкого звучало как «волчий крем». При выплавке олова из его руд, содержавших вольфрам, между ними происходила реакция с усиленным пенообразованием, поэтично описанная так: «Олово пожирал, как волк пожирает овцу». В XVIII веке шведский химик Шеелер при обработке минерала тунгстена азотной кислотой обнаружил в продуктах реакции неизвестное серое вещество с серебристым отливом. Исходный минерал позже переименовали в шеелит, а новый элемент стал называться вольфрамом. До сих пор у американцев, англичан и французов существует его старинное шведское обозначение «тяжёлый камень».
При выплавке олова из его руд, содержавших вольфрам, между ними происходила реакция с усиленным пенообразованием, поэтично описанная так: «Олово пожирал, как волк пожирает овцу». В XVIII веке шведский химик Шеелер при обработке минерала тунгстена азотной кислотой обнаружил в продуктах реакции неизвестное серое вещество с серебристым отливом. Исходный минерал позже переименовали в шеелит, а новый элемент стал называться вольфрамом. До сих пор у американцев, англичан и французов существует его старинное шведское обозначение «тяжёлый камень».
Месторождения и способы получения
Этот элемент относится к группе очень редких металлов и в природе встречается в виде сложных кислородных соединений с железом, марганцем, кальцием, свинцом, медью и редкоземельными элементами. Эти минералы входят в состав гранитных пород, а концентрация чистого вещества не превышает 2%. Самые большие месторождения обнаружены в Казахстане, Китае, Канаде и США. Добычей занимаются также Боливия, Португалия, Россия, Узбекистан и Южная Корея.
При получении вольфрама сначала обогащают его руду и отделяют ценные компоненты от пустой породы. Метод обогащения — измельчение и флотация с последующей магнитной сепарацией и окислительным обжигом. Готовый концентрат спекают с содой, при этом получается растворимый вольфрамит натрия, или выщелачивают содовым раствором в автоклавах при высоких температурах под давлением, нейтрализуют и осаждают в виде вольфрамата кальция.
Из них уже выделяют очищенные от большинства примесей окиси вольфрама, которые потом при температурах около 700 °C восстанавливают водородом. Так получается наиболее чистый порошкообразный вольфрам. Для придания порошку сплошной волокнистой структуры его прессуют в токе водорода, постепенно увеличивая температуру почти до границ плавления, чтобы металл стал пластичным и ковким.
Физические и химические свойства
Металл имеет объёмно-центрированную кубическую кристаллическую решётку, обладает парамагнитными свойствами и устойчивостью к вакууму.
Вольфрам не взаимодействует с концентрированной соляной и разбавленной серной кислотой. Его поверхность слегка окисляется царской водкой и азотной кислотой.
Он растворяется в перекиси водорода, в смеси фтористоводородной и азотной кислот, в присутствии окислителей вступает в реакцию со щелочами, выделяя большое количество тепла. Легко соединяется с углеродом, образуя высокопрочный карбид, однако, при низких температурах металл быстро окисляется и становится ломким. Наиболее часто используются:
- триоксиды, называемые вольфрамовыми ангидридами;
- соли, образующие полимерные анионы;
- перекисные соединения;
- соединения с серой, галогенами и углеродом.

Области применения
Для металлургии вольфрам — основа тугоплавких материалов. На Всемирной Парижской выставке в 1900 году публике впервые была показана сталь с его добавками. Высокая температура плавления и пластичность сделали металл незаменимым в изготовлении нитей для ламп накаливания и других вакуумных трубок, покрытия транзисторов, используемых в жидкокристаллических дисплеях, а также электродов для аргонной сварки. Большая плотность вольфрама позволила ему стать основой деталей баллистических ракет, бронебойных пуль и снарядов в артиллерии.
Сплавы вольфрама, произведённые методом порошковой металлургии, отличаются твёрдостью и жаропрочностью, кислотостойкостью и устойчивостью к истиранию. Они обязательные компоненты лучших марок высоколегированных сталей, где буквы в названии обозначают состав:
- WA — соединение вольфрама с алюминием и кремнием. Характеризуется повышенной температурой начальной рекристаллизации, прочностью после отжига.

- WCu — композиция с медью используется для изготовления высоковольтных выключателей и транзисторов, в установках радиолокации и биполярной электронике.
- WL — добавка оксида лантана увеличивает эмиссионные свойства.
- WLZ — вольфрам c оксидом лантана и оксидом циркония — идеальный материал для электродов, работающих под высоким напряжением.
- WZ — вольфрам с оксидом церия используют как материал для сварочных электродов. Увеличиваются характеристики зажигания и срок службы.
- WM — сплав вольфрама и молибдена. Имеет высокую прочность и помогает сохранить пластичность после отжига.
- WK — вольфрам с добавкой калия получает хорошую размерную стабильность и сопротивление ползучести.
- WRe — легирование рением даёт возможность термоэлементам, сделанным из такой стали, работать при температурах более 2000 °C.
Уникальные свойства позволяют изготавливать лучшие инструменты для хирургии, танковую броню и оболочки снарядов, пластины для бронежилетов, ответственные части авиационной и авиакосмической промышленности, контейнеры для радиоактивных отходов, ёмкости для выращивания кристаллов сапфиров. Карбид вольфрама — основа композитных материалов с гордым названием «победит», его используют для обработки металлов в машиностроении, горнодобывающей промышленности, для бурения скважин. В вакуумных печах нагревательные элементы термопары изготовлены из вольфрамовых сплавов.
Карбид вольфрама — основа композитных материалов с гордым названием «победит», его используют для обработки металлов в машиностроении, горнодобывающей промышленности, для бурения скважин. В вакуумных печах нагревательные элементы термопары изготовлены из вольфрамовых сплавов.
Его соединения получили распространение как катализаторы и пигменты в различных производствах химической и лакокрасочной промышленности. Применение вольфрамовых солей дисульфидов в качестве высокотемпературной смазки связано с образованием аморфной плёнки серы, которая покрывает трущиеся металлические поверхности. Монокристаллы других вольфраматов используют для нужд ядерной физики, они детекторы радиоактивных излучений. Среди традиционных ювелирных украшений уверенно расширяют свою нишу изделия из карбида вольфрама. Их полированная поверхность прекрасно отражает свет и называется «серым зеркалом», которое невозможно поцарапать, изогнуть и сломать.
Биологическая роль
Вольфрам не имеет большого биологического значения.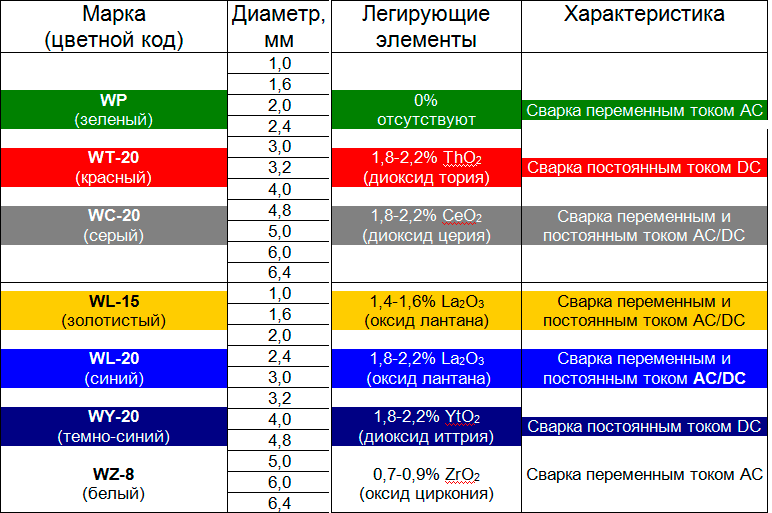 У некоторых бактерий обнаружены ферменты, его содержащие. Поэтому появились гипотезы, что вольфрам участвовал в возникновении жизни на ранних этапах. Ювелирные украшения из него не вызывают аллергических реакций, а металлическая пыль вольфрама при вдыхании раздражает слизистые органов носоглотки и гортани человека.
У некоторых бактерий обнаружены ферменты, его содержащие. Поэтому появились гипотезы, что вольфрам участвовал в возникновении жизни на ранних этапах. Ювелирные украшения из него не вызывают аллергических реакций, а металлическая пыль вольфрама при вдыхании раздражает слизистые органов носоглотки и гортани человека.
что за металл? Свойства и сферы применения
Поделиться:
Вольфрам — что за металл? Свойства и сферы применения
23.09.2019
Одним из самых распространенных химических элементов является вольфрам. Он обозначается символом W и имеет атомный номер — 74. Вольфрам относится к группе металлов, имеющих высокую стойкость к изнашиванию и температуру плавления. В периодической системе Менделеева он находится в 6-й группе, обладает схожими свойствами с «соседями» — молибденом, хромом.
Открытие и история
Еще в XVI веке был известен такой минерал, как вольфрамит. Он был интересен тем, что при выплавке олова из руды его пена превращался в шлак и, конечно же, это мешало производству. С тех пор, вольфрамит стали называть «волчья пена» (с нем. Wolf Rahm). Название минерала перешло и на сам металл.
Он был интересен тем, что при выплавке олова из руды его пена превращался в шлак и, конечно же, это мешало производству. С тех пор, вольфрамит стали называть «волчья пена» (с нем. Wolf Rahm). Название минерала перешло и на сам металл.
Шведский химик Шееле в 1781 году обрабатывал азотной кислотой металл шеелит. В процессе эксперимента у него получился жёлтый тяжёлый камень — оксид вольфрама (VI). Через два года братья Элюар (испанские химики) получили из саксонского минерала сам вольфрам в чистом виде. Добывают этот элемент и его руды в Португалии, Боливии, Южной Корее, России, Узбекистане, а наибольшие запасы были найдены в Канаде, США, Казахстане и Китае. В год добывается всего 50 тонн этого элемента, поэтому он дорого стоит. Рассмотрим подробнее, что за металл вольфрам.
Свойства элемента
Как уже было сказано ранее, вольфрам – это один из самых тугоплавких металлов. Он имеет блестящий светло-серый цвет. Его температура плавления 3422°С, а кипения — 5555°C, плотность в чистом виде — 19,25 г/см3, а твердость 488 кг/мм². Это один из самых тяжелых металлов, обладающий высокой коррозионной стойкостью. Он практически не растворим в серной, соляной и плавиковой кислотах, но быстро вступает в реакцию с перекисью водорода. Что за металл вольфрам, если он не реагирует с расплавленными щелочами? Вступая в реакцию с гидроксидом натрия и кислородом, он образует два соединения – вольфрамат натрия и обычную воду Н2О. Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Это один из самых тяжелых металлов, обладающий высокой коррозионной стойкостью. Он практически не растворим в серной, соляной и плавиковой кислотах, но быстро вступает в реакцию с перекисью водорода. Что за металл вольфрам, если он не реагирует с расплавленными щелочами? Вступая в реакцию с гидроксидом натрия и кислородом, он образует два соединения – вольфрамат натрия и обычную воду Н2О. Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Получение вольфрама
На вопрос о том, к какой группе металлов относится вольфрам, можно ответить, что он входит в категорию редких элементов, как рубидий и молибден. А это, в свою очередь, означает, что для него характерны небольшие масштабы производства. Кроме того, такой металл не получают восстановлением из сырья, сначала он перерабатывается на химические соединения.
Как же происходит получение редкого металла? Из рудного материала выделяют необходимый элемент и концентрируют его в растворе или осадке. Следующим шагом получают чистое химическое соединение путем очистки. Из полученного вещества выделяют чистый редкий металл – вольфрам. Для обогащения руды используют гравитацию, флотацию, магнитную или электростатическую сепарацию. В результате получают концентрат, который содержит 55-65% ангидрида вольфрама WO3. Для получения порошка его восстанавливают при помощи водорода или углерода. Для некоторых изделий, на этом процесс получения элемента заканчивается. Так, вольфрамовый порошок используют для приготовления твердых сплавов.
Следующим шагом получают чистое химическое соединение путем очистки. Из полученного вещества выделяют чистый редкий металл – вольфрам. Для обогащения руды используют гравитацию, флотацию, магнитную или электростатическую сепарацию. В результате получают концентрат, который содержит 55-65% ангидрида вольфрама WO3. Для получения порошка его восстанавливают при помощи водорода или углерода. Для некоторых изделий, на этом процесс получения элемента заканчивается. Так, вольфрамовый порошок используют для приготовления твердых сплавов.
Изготовление штабиков
Мы уже выяснили, что за металл вольфрам, а теперь узнаем, в каком сортаменте он изготавливается. Из порошкового соединения изготавливают компактные слитки – штабики. Для этого используют только порошок, который был восстановлен водородом. Их изготавливают путем прессования и спекания. Получаются довольно прочные, но хрупкие слитки. Иными словами, они плохо поддаются ковке. Для улучшения этого технологического свойства, штабики подвергают высокотемпературной обработке.
Вольфрамовые прутки
Конечно же, это один из самых распространенных видов продукции из этого металла. Что за вольфрам используется для их изготовления? Это вышеописанные штабики, которые подвергаются ковке на ротационной ковочной машине. Важно отметить, что процесс происходит в нагретом состоянии (1450-1500°С). Полученные прутки применяют в самых различных отраслях промышленности. Например, для изготовления сварочных электродов. Кроме того, вольфрамовые прутки нашли широкое применение в нагревателях. Они работают в печах при температуре до 3000 °С в вакууме, инертном газе или водороде. Прутки также могут быть использованы как катоды электронных и газоразрядных приборов, радиоламп. Интересно, что сами по себе электроды являются неплавящимися, и поэтому во время сварки, необходима подача присадочного материала (проволока, прут). При расплавлении со свариваемым материалом он создает сварочную ванну.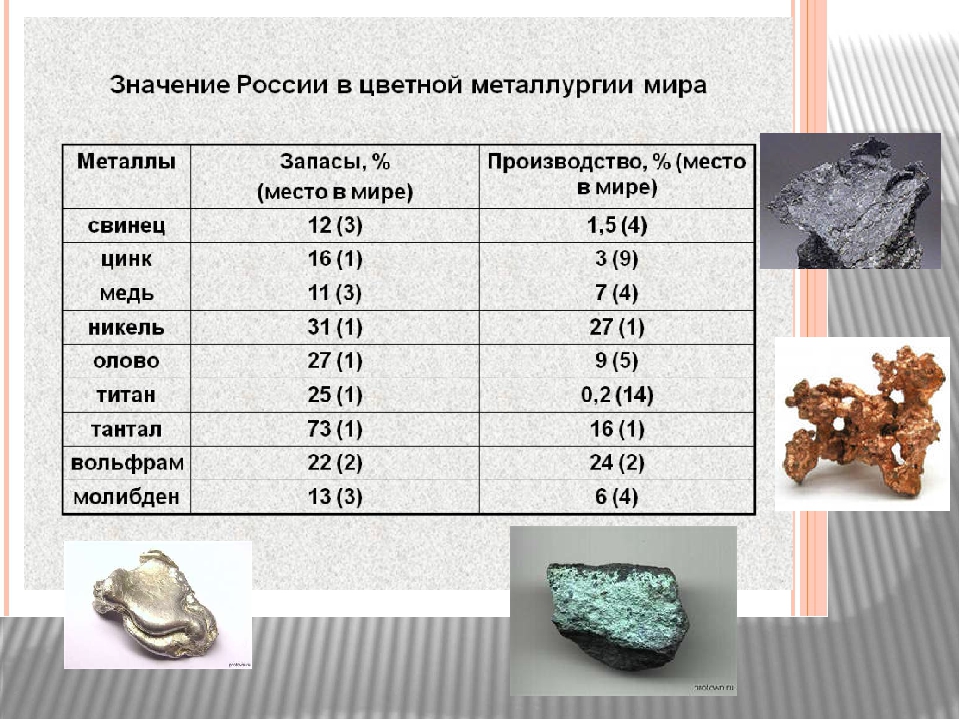
Вольфрам и проволока
Вот еще один вид широко распространённой продукции. Вольфрамовая проволока изготавливается из кованых прутков, рассмотренных нами ранее. Волочение производится с постепенным снижением температуры от 1000°С до 400°С. Затем проводят очистку изделия путем отжига, электролитической полировкой или электролитическим травлением. Поскольку вольфрам – тугоплавкий металл, проволока используется в элементах сопротивления в нагревательных печах при температурах до 3000°С. Из нее изготавливают термоэлектрические преобразователи, а также спирали ламп накаливания, петлевые подогреватели и многое другое.
Соединения вольфрама с углеродом
Карбиды вольфрама считаются очень важными с практической точки зрения. Они применяются для изготовления твердых сплавов. Соединения с углеродом имеют положительный коэффициент электросопротивления и хорошую проводимость металла. Карбиды вольфрама образуются двух видов: WC и W2C. Они различаются своим поведениям в кислотах, а также растворимостью в других соединениях с углеродом. На основе вольфрамовых карбидов изготавливают два типа твердых сплавов: спеченные и литые. Последние получают из порошкообразного соединения и карбида с недостатком С (менее 3%) путем литья. Второй тип изготавливают из монокарбида вольфрама WC и цементирующего металла-связки, которым может выступать никель или кобальт. Спеченные сплавы получают только методом порошковой металлургии. Порошок цементирующего металла и карбид вольфрама смешивают, прессуют и спекают. Такие сплавы обладают высокой прочностью, твёрдостью износоустойчивостью.
Карбиды вольфрама образуются двух видов: WC и W2C. Они различаются своим поведениям в кислотах, а также растворимостью в других соединениях с углеродом. На основе вольфрамовых карбидов изготавливают два типа твердых сплавов: спеченные и литые. Последние получают из порошкообразного соединения и карбида с недостатком С (менее 3%) путем литья. Второй тип изготавливают из монокарбида вольфрама WC и цементирующего металла-связки, которым может выступать никель или кобальт. Спеченные сплавы получают только методом порошковой металлургии. Порошок цементирующего металла и карбид вольфрама смешивают, прессуют и спекают. Такие сплавы обладают высокой прочностью, твёрдостью износоустойчивостью.
В современной металлургической промышленности их используют для обработки металлов резанием и для изготовления бурового инструмента. Одним из самых распространённых сплавов являются ВК6 и ВК8. Их применяют для изготовления фрез, резцов, сверл и другого режущего инструмента. Область применения карбидов вольфрама достаточно объёмная. Так, их используют для изготовления: бронебойных припасов; деталей двигателей, самолетов, космических кораблей и ракет; оборудования в атомной промышленности; хирургических инструментов. На Западе особенно широко применяются карбиды вольфрама в ювелирных изделиях, в особенности, для изготовления свадебных колец. Металл смотрится красиво, эстетично, его легко обрабатывать.
Область применения карбидов вольфрама достаточно объёмная. Так, их используют для изготовления: бронебойных припасов; деталей двигателей, самолетов, космических кораблей и ракет; оборудования в атомной промышленности; хирургических инструментов. На Западе особенно широко применяются карбиды вольфрама в ювелирных изделиях, в особенности, для изготовления свадебных колец. Металл смотрится красиво, эстетично, его легко обрабатывать.
Это объясняется тем, что они невероятно износоустойчивы. Чтобы поцарапать такое изделие, придется приложить немало усилий. Даже через несколько лет, кольцо будет выглядеть как новое. Оно не потускнеет, не повредится рельефный узор, да и полированная часть не потеряет своего блеска.
Вольфрам и рений
Сплав этих двух элементов довольно широко применяется для изготовления высокотемпературных термопар. Вольфрам – какой металл? Как и рений, это жаропрочный металл, а легирование элементов снижает это свойство. Но что, если взять два практически одинаковых вещества? Тогда температура их плавления снижаться не будет.
Но что, если взять два практически одинаковых вещества? Тогда температура их плавления снижаться не будет.
Если использовать рений в качестве присадки, будет наблюдаться повышение жаропрочности и пластичности вольфрама. Данный сплав получают методом плавки в порошковой металлургии. Термопары, изготавливаемые из этих материалов, являются жаропрочными и могут измерять температуру больше 2000°С, но только в инертной среде. Конечно же, подобные изделия стоят дорого, ведь в один год добывается всего 40 тонн рения и только 51 тонна вольфрама.
Источник: syl.ru
Вольфрам | Encyclopedia.com
буря
просмотров обновлено 18 мая 2018
Примечание. Эта статья, первоначально опубликованная в 1998 году, была обновлена в 2006 году для издания электронной книги.
Обзор
Вольфрам — это переходный металл. Переходные металлы — это группа элементов, находящихся в середине периодической таблицы. Они занимают ячейки в строках с 4 по 7 между группами 2 и 13. Периодическая таблица представляет собой диаграмму, показывающую, как химические элементы связаны друг с другом.
Они занимают ячейки в строках с 4 по 7 между группами 2 и 13. Периодическая таблица представляет собой диаграмму, показывающую, как химические элементы связаны друг с другом.
Эти металлы имеют очень похожие физические и химические свойства. Одним из необычных свойств вольфрама является его очень высокая температура плавления 3410°C (6170°F). Это самая высокая температура плавления любого металла. Еще одним важным его свойством является способность сохранять свою прочность при очень высоких температурах. Эти свойства объясняют основное применение вольфрама — производство сплавов. Сплав получают путем плавления и смешивания двух или более металлов. Смесь имеет свойства, отличные от свойств отдельных металлов.
SYMBOL
W
ATOMIC NUMBER
74
ATOMIC MASS
183.85
FAMILY
Group 6 (VIB)
Transition metal
PRONUNCIATION
TUNG-stun
Credit for Открытие вольфрама часто разделяется между тремя людьми — испанскими учеными Доном Фаусто Д’Эльюярдом (1755—1833) и его братом Доном Хуаном Хосе Д’Эльюярдом (1754—96) и шведским химиком Карлом Вильгельмом Шееле (1742—1786). Химический символ вольфрама, W, взят из альтернативного названия элемента, вольфрама.
Химический символ вольфрама, W, взят из альтернативного названия элемента, вольфрама.
Открытие и наименование
Первое упоминание о вольфраме и его соединениях относится примерно к 1761 году. Немецкий химик Иоганн Готтлоб Леманн (1719-67) изучал минерал, известный как вольфрамит. Он обнаружил в минерале два новых вещества, но не признал, что это новые элементы.
Примерно двадцать лет спустя Шееле также изучал этот минерал. Он произвел из него белый кислый порошок. Шееле знал, что порошок — новое вещество. Но он не смог выделить из него чистый элемент. Открытие Шееле на самом деле было вольфрамовой кислотой (H 2 WO 4 ). (См. врезку о Шееле в статье хлор в Томе 1.)
Металлический вольфрам был впервые получен в 1783 году братьями Д’Эльюярд. В 1777 году их отправили в Швецию для изучения минералогии. После возвращения в Испанию братья вместе работали над рядом проектов. Один проект включал анализ вольфрамита. Они производили вольфрамовую кислоту, как Шееле, но пошли еще дальше. Они нашли способ получить чистый металлический вольфрам из кислоты. За эту работу их обычно считают первооткрывателями вольфрама.
Они нашли способ получить чистый металлический вольфрам из кислоты. За эту работу их обычно считают первооткрывателями вольфрама.
Название «вольфрам» происходит от шведской фразы, означающей «тяжелый камень». В некоторых частях мира этот элемент до сих пор называют другим именем — вольфрам. Это название происходит от немецкого выражения Wolf rahm, или «волчья пена (пена)». Химический символ элемента взят из немецкого названия, а не из шведского.
Физические свойства
Вольфрам представляет собой твердое хрупкое твердое вещество, цвет которого варьируется от стально-серого до почти белого. Его температура плавления является самой высокой среди всех металлов и составляет 3410°C (6170°F), а температура кипения составляет около 5,9°С.00°C (10 600°F). Его плотность составляет около 19,3 грамма на кубический сантиметр. Вольфрам очень хорошо проводит электрический ток.
Химические свойства
Вольфрам является относительно неактивным металлом. Не соединяется с кислородом при комнатной температуре. Он подвергается коррозии (ржавеет) при температурах выше 400 °C (700 °F). Он не очень легко реагирует с кислотами, хотя растворяется в азотной кислоте или царской водке. Царская водка представляет собой смесь соляной и азотной кислот.
кислоты. Он часто реагирует с материалами, которые не реагируют ни с одной кислотой по отдельности.
Он подвергается коррозии (ржавеет) при температурах выше 400 °C (700 °F). Он не очень легко реагирует с кислотами, хотя растворяется в азотной кислоте или царской водке. Царская водка представляет собой смесь соляной и азотной кислот.
кислоты. Он часто реагирует с материалами, которые не реагируют ни с одной кислотой по отдельности.
Встречается в природе
Вольфрам никогда не встречается в природе как свободный элемент. Его наиболее распространенными рудами являются минералы шеелит или вольфрамат кальция (CaWO 4 ) и вольфрамит, или вольфрамат железа марганца (Fe, MnWO 4 ). Считается, что содержание вольфрама в земной коре составляет около 1,5 частей на миллион. Это один из самых редких элементов.
Крупнейшими производителями вольфрама в мире являются Китай, Россия и Португалия. В 19 в США вольфрам не добывали.96. Подробная информация о производстве и использовании вольфрама в США отсутствует. Эта информация скрыта от общественности в целях защиты компаний, производящих и использующих вольфрам.
В некоторых частях мира вольфрам до сих пор называют вольфрамом. Это название происходит от немецкого выражения Wolf rahm, или «волчья пена (пена)».
Изотопы
Существует пять встречающихся в природе изотопов вольфрама. Это вольфрам-180, вольфрам-182, вольфрам-183, вольфрам-184 и вольфрам-186. Изотопы представляют собой две или более формы элемента. Изотопы отличаются друг от друга массой число. Число, написанное справа от названия элемента, является массовым числом. Массовое число представляет собой количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация является изотопом.
Известно также около дюжины радиоактивных изотопов вольфрама. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обстреливают атомы. Эти частицы впиваются в атомы и делают их радиоактивными.
Ни один из радиоактивных изотопов вольфрама не имеет серьезного коммерческого применения.
Экстракция
Металлический вольфрам можно получить нагреванием оксида вольфрама (WO 3 ) с алюминием :
Также получается при пропускании водорода через горячую вольфрамовую кислоту (H 2 WO 4 ):
Наиболее важные области применения изготовление сплавов. Вольфрам используется для повышения твердости, прочности, эластичности (гибкости) и прочности на растяжение (способность к растяжению) сталей. Металл обычно готовят в одной из двух форм. Ферровольфрам — это сплав железа и вольфрама. Обычно он содержит от 70 до 80 процентов вольфрама. Ферровольфрам смешивают с другими металлами и сплавами (обычно со сталью) для получения специальных сплавов. Вольфрам также производится в виде порошка. Затем его можно добавлять к другим металлам для получения сплавов.
Около 90 процентов всех вольфрамовых сплавов используются в горнодобывающей, строительной, электротехнической и металлообрабатывающей технике.
Около 90 процентов всех вольфрамовых сплавов используются в горнодобывающей, строительной, электротехнической и металлообрабатывающей технике. Эти сплавы используются для изготовления быстрорежущих инструментов; нагревательные элементы в печах; детали для самолетов и космических аппаратов; оборудование, используемое в радио, телевидении и радиолокации; перфораторы; металлорежущие инструменты; и подобное оборудование.
Небольшое, но очень важное количество вольфрама используется для изготовления ламп накаливания. Очень тонкая металлическая проволока, из которой состоит нить накала этих ламп, сделана из вольфрама. Электрический ток проходит через провод, заставляя его нагреваться и излучать свет. Он не плавится из-за высокой температуры плавления вольфрама.
Соединения
Вероятно, самым важным соединением вольфрама является карбид вольфрама (WC). Карбид вольфрама имеет очень высокую температуру плавления 2780°C (5000°F). Это самый прочный конструкционный материал. Из него изготавливают детали электрических цепей, режущие инструменты, металлокерамику, твердый сплав. Металлокерамика представляет собой материал, состоящий из керамики и металла. Керамика представляет собой глиноподобный материал. Металлокерамика используется там, где в течение длительного времени имеют место очень высокие температуры. Например, из металлокерамики могут быть изготовлены детали ракетного двигателя или реактивного двигателя.
Из него изготавливают детали электрических цепей, режущие инструменты, металлокерамику, твердый сплав. Металлокерамика представляет собой материал, состоящий из керамики и металла. Керамика представляет собой глиноподобный материал. Металлокерамика используется там, где в течение длительного времени имеют место очень высокие температуры. Например, из металлокерамики могут быть изготовлены детали ракетного двигателя или реактивного двигателя.
Карбид вольфрама изготавливается путем связывания карбида вольфрама с другим металлом. Продукт очень прочный и сохраняет прочность при высоких температурах. Цементированные карбиды используются для резки горных пород и металлов. Они могут работать со скоростью, в 100 раз превышающей скорость аналогичных инструментов из стали.
Влияние на здоровье
Вольфрам не играет существенной роли в здоровье растений, людей или животных. В умеренных количествах он также практически не представляет опасности для здоровья.
История вольфрама | Среднезападный вольфрам
Вольфрам представляет собой тяжелый металлический элемент , член третьей группы переходных металлов. Он имеет символ W , его атомный номер равен 74 , а его атомный вес равен 183,85 . Название происходит от шведского tung sten, что означает «тяжелый камень». Вольфрам также известен как wolfram , от WOLFRAMITE, минерала, из которого этот элемент был впервые обнаружен английским химиком Peter Woulfe в 1779 году. Металл был впервые выделен в 1783 году испанскими учеными Хосе и Фаусто д’Эльхуяр через восстановление с помощью древесного угля вольфрамовой кислоты, содержащейся в вольфрамите.
Он имеет символ W , его атомный номер равен 74 , а его атомный вес равен 183,85 . Название происходит от шведского tung sten, что означает «тяжелый камень». Вольфрам также известен как wolfram , от WOLFRAMITE, минерала, из которого этот элемент был впервые обнаружен английским химиком Peter Woulfe в 1779 году. Металл был впервые выделен в 1783 году испанскими учеными Хосе и Фаусто д’Эльхуяр через восстановление с помощью древесного угля вольфрамовой кислоты, содержащейся в вольфрамите.
Вольфрам встречается главным образом в минералах шеелите , вольфрамите , гюбнерите и ферберите . В Соединенных Штатах эти минералы наиболее заметны в Калифорнии и Колорадо. В других местах они встречаются в Китае, Бурятской республике России, Казахстане, Южной Корее, Боливии и Португалии. Металл получают в промышленных масштабах восстановлением оксида вольфрама водородом или углеродом. Чистый металл имеет цвет от серо-стального до оловянно-белого цвета. Его физические свойства включают самая высокая температура плавления среди всех металлов, 3410°C (6170°F) , температура кипения 5660°C (10220°F) и плотность 19,3 г/куб см .
Чистый металл имеет цвет от серо-стального до оловянно-белого цвета. Его физические свойства включают самая высокая температура плавления среди всех металлов, 3410°C (6170°F) , температура кипения 5660°C (10220°F) и плотность 19,3 г/куб см .
Чистый вольфрам Металл легко поддается ковке, формованию, волочению и прессованию, тогда как в нечистом состоянии он хрупок и с трудом поддается обработке. Вольфрам окисляется на воздухе, особенно при более высоких температурах, но он устойчив к коррозии и лишь слегка подвергается воздействию большинства минеральных кислот. В соответствии с остальными Transition Elements , он отображает диапазон степеней окисления : 0, +1, +2, +3, +4, +5 и +6. Это объясняет множество сложных ионов и координационных комплексов, в которых можно найти вольфрам. Неизвестно, что вольфрам имеет какое-либо биологическое значение.
Поскольку тепло заставляет вольфрам расширяться примерно с той же скоростью, что и стекло, этот металл широко используется для изготовления уплотнений между стеклом и металлом. Вольфрам или его сплавы используются для нитей накала электрических ламп, электронных и телевизионных ламп, электрических контактных точек для автомобильных распределителей, нагревательных элементов для электрических печей, а также для космических, ракетных и высокотемпературных применений.
Вольфрам или его сплавы используются для нитей накала электрических ламп, электронных и телевизионных ламп, электрических контактных точек для автомобильных распределителей, нагревательных элементов для электрических печей, а также для космических, ракетных и высокотемпературных применений.
Карбид вольфрама является важным соединением в металлообрабатывающей, горнодобывающей и нефтяной промышленности. Такие сплавы, как быстрорежущая сталь, кристит и стеллит, используемые в быстрорежущих инструментах, содержат вольфрам. Другими важными соединениями вольфрама являются вольфраматы кальция и магния, которые используются в флуоресцентном освещении, и дисульфид вольфрама, который используется в качестве высокотемпературной смазки при температурах до 500°С. Соединения вольфрама также находят применение в химической, красочной и кожевенные производства.
. . .
Библиография и ссылки:
- Беус, А.А., изд.