Изопропанол Вики
| Изопропанол | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Пропан-2-ол |
| Традиционные названия | Изопропиловый спирт |
| Хим. формула | C3H8O |
| Рац. формула | CH3CH(OH)CH3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 60,09 г/моль |
| Плотность | 0,7851 г/см³ |
| Динамическая вязкость | 0,00243 Па·с |
| Энергия ионизации | 10,1 ± 0,1 эВ[1] |
| Термические свойства | |
| Т. плав. | -89,5 °C |
| Т. кип. | 82,4 °C |
| Т. всп. | 11,7 °C |
| Т. свспл. | 400 °C |
| Пр. взрв. | 2 ± 1 об.%[1] |
| Мол. теплоёмк. | 155,2 Дж/(моль·К) |
| Давление пара | 4,4 кПа при 20 °C |
| Химические свойства | |
| pKa | 16,5 |
| Растворимость в бензоле | хорошо растворим |
| Растворимость в ацетоне | растворим |
| Оптические свойства | |
| Показатель преломления | 1,3776 (nD, 20°C) |
| Структура | |
| Дипольный момент | 1,66 Д |
| Классификация | |
| Рег. номер CAS | 67-63-0 |
| PubChem | 3776 |
| Рег. номер EINECS | 200-661-7 |
| SMILES | |
| InChI | |
| RTECS | NT8050000 |
| ChEBI | 17824 и 43588 |
| Номер ООН | 1219 |
| ChemSpider | 3644 |
| Безопасность | |
| ЛД50 | 12800 мг/кг (кролик) |
| Токсичность | Класс опасности 3 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Изопропи́ловый спирт (пропано́л-2, втор-пропанол, изопропано́л, диметилкарбино́л, ИПС) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — пропанол-1.
При нормальных условиях прозрачная, бесцветная жидкость с резким запахом и мягким горьким вкусом[2].
Изопропиловый спирт используется в качестве заменителя этилового спирта в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей, медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности.
В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине, благодаря своей относительно низкой токсичности[3].
75 % водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивает более высокую эффективность и лучшее обеззараживание[4].
Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита[5].
Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу.
Как и все летучие спирты, огнеопасен. Умеренно токсичен, требует осторожного обращения.
Свойства[ | код]
Химические свойства[ | код]
Рациональная химическая формула изопропилового спирта Ch4CH(OH)Ch4{\displaystyle {\ce {Ch4CH(OH)Ch4}}}.
Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры.
Гидроксильная группа может быть вытеснена галогенами.
С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол.
При дегидрировании превращается в ацетон[6].
Реагирует с сильными окислителями.
В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения.
Растворяет некоторые виды пластмасс и резины.
Физические свойства[ | код]
Бесцветная жидкость с характерным спиртовым запахом, более резким, чем у этанола, по запаху их можно в некоторых случаях отличить.
Коэффициент преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода . Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К). Удельная теплота сгорания 34,1 МДж/кг.
Пар хорошо смешивается с воздухом, в диапазоне взрывоопасных концентраций образует взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C.
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях.
С водой образует азеотропную смесь 87,9 % изопропилового спирта с температурой кипения 80,2 °C.
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение[7]:
| Концентрация спирта, об % | Концентрация спирта, вес. % | Температура замерзания, °C |
|---|---|---|
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Получение[ | код]
Применяются два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена[8][9].
Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена
- Ch4CH=Ch3+h3SO4⟶(Ch4)2CHOSO2OH+h3O⟶(Ch4)2CHOH{\displaystyle {\ce {Ch4CH=Ch3 + h3SO4 ->(Ch4)2CHOSO2OH + h3O -> (Ch4)2CHOH}}}.
Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона.
На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH{\displaystyle {\ce {(Ch4)2CHOSO2OH}}}, серной кислоты h3SO4{\displaystyle {\ce {h3SO4}}} и воды h3O{\displaystyle {\ce {h3O}}}. На второй стадии процесса — сернокислотный экстракт нагревается с водой и отгоняется образующийся изопропиловый спирт.
Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора — (в скобках указаны условия процессов): ортофосфорной кислоты h4PO4{\displaystyle {{\ce {h4PO4}}}} на твёрдом неорганическом носителе при 240—260°С и 2,5—6,5 МПа) или на носителе из катионообменной смолы при 130—160°С и 8,0—10,0 МПа.
Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами[6].
Современный способ гидрирования ацетона водородом:
- Ch4COCh4+h3→katCh4CH(OH)Ch4{\displaystyle \mathrm {CH_{3}COCH_{3}+H_{2}{\xrightarrow {kat}}CH_{3}CH(OH)CH_{3}} }
Гидрирование ацетона впаровой фазе в присутствии твёрдого медно-никельхромитного катализатора[10][11].
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[12] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[11][13].
Применение[ | код]
Изопропиловый спирт используют для получения:
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием.
Медицина[ | код]
70 % изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток.
Влияние на человека[ | код]
- Ингаляционное
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает[14].
Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ, которые не вызывают раздражений и иных побочных эффектов. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из емкости с площадью менее 20 см² в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей[15].
- Пероральное
Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко[2].
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл.
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов[2].
Наркотические свойства[ | код]
Изопропиловый спирт обладает наркотическим действием[14], наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола[16]. Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов вызывает состояние глубокого наркоза и смерть[15].
При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающем ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко.
Примечания[ | код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0359.html
- ↑ 1 2 3 R. J. Slaughter, R. W. Mason, D. M. G. Beasley, J. A. Vale, L. J. Schep. Isopropanol poisoning // Clinical Toxicology (Philadelphia, Pa.). — 2014-06-01. — Т. 52, вып. 5. — С. 470–478. — ISSN 1556-9519. — DOI:10.3109/15563650.2014.914527.
- ↑ Papa, A. J. «Propanols» // Ullmann’s Encyclopedia of Industrial Chemistry : Weinheim: Wiley-VCH. — 2005.
- ↑ «Guide to Local Production: WHO-recommended Handrub Formulations» (англ.) // World Health Organization. — 2009. — Август.
- ↑ Otitis Externa (Swimmer’s Ear) (26 февраля 2010). Проверено 21 февраля 2016. Архивировано 26 февраля 2010 года.
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон (недоступная ссылка — история). Проверено 26 ноября 2011. Архивировано 21 марта 2012 года.
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse (недоступная ссылка — история). Проверено 10 августа 2011. Архивировано 15 октября 2011 года.
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
ru.wikibedia.ru
Формула Пропилового спирта структурная химическая
Структурная формула
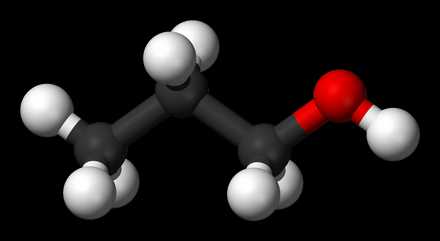 |
Истинная, эмпирическая, или брутто-формула: C3H8O
Химический состав Пропилового спирта
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 3 | 60% |
| H | Водород | 1.008 | 8 | 13,4% |
| О | Кислород | 15,999 | 2 | 26,6% |
Молекулярная масса: 60,096
Пропиловый спирт (пропан-1-ол, 1-пропанол) C3H7OH — одноатомный спирт. Встречается в природе в небольших количествах как продукт ферментации. Так, он является компонентом сивушного масла. Существует изомер 1-пропанола — изопропиловый спирт (пропан-2-ол, 2-пропанол).
Физические свойства
Бесцветная жидкость со спиртовым запахом, смешивается с водой и образует с ней азеотропную смесь (т. кип. 87,5—88,0°С, 71,8% по массе 1-пропанола). Растворим в этаноле, диэтиловом эфире, ацетоне, бензоле и других органических растворителях.
Химические свойства
Пропиловый спирт обладает всеми химическими свойствами первичных одноатомных спиртов. Так он может быть превращён в галогеналканы: взаимодействие с йодом и красным фосфором даёт 1-йодпропан с 80% выходом, тогда как взаимодействие хлорида фосфора (III) при катализе хлоридом цинка либо хлористого тионила при катализе ДМФА даёт 1-хлорпропан. Реакция 1-пропанола с уксусной кислотой в присутствии серной кислоты даёт пропилацетат. В то время как кипячение только с муравьиной кислотой в течение суток даёт пропилформиат с выходом 65%. Окисление бихроматом калия с серной кислотой в условиях отгонки образующего пропаналя позволяет получать его с выходом 50%. Более глубокое окисление хромовым ангидридом даёт пропионовую кислоту. Взаимодействие со щелочными металлами даёт соответствующие пропиолаты металлов. Причём реакция протекает менее интенсивно чем с этиловым спиртом и намного менее интенсивно чем с водой.
Получение
В промышленности 1-пропанол получают путём гидроформилирования этилена с последующим гидрированием образовавшегося пропаналя. 1-Пропанол получается в качестве побочного продукта при сбраживании зерна на этанол, но этот способ получения не имеет особого промышленного значения.
Применение
1-Пропанол применяют в качестве растворителя для восков, полиамидных чернил, природных и синтетических смол, полиакрилонитрила; в производстве полиэтилена низкого давления; для получения карбометоксицеллюлозы; как обезжириватель металлов; сорастворитель поливинилхлоридных адгезивов; желатинирующий и пластифицирующий агент целлюлозноацетатных плёнок; алкилирующий агент. Его используют также для синтеза пропионовой кислоты, пропионового альдегида, пропилацетата, пропиламина, ПАВ, пестицидов, некоторых фармацевтических препаратов.
Топливо
1-Пропанол имеет высокое октановое число (118). Однако производство его слишком дорого для того, чтобы он стал широко применяемым топливом.
Токсикология
Употребление пропилового спирта, также как и этилового спирта, вызывает алкогольное опьянение. В организме человека пропиловый спирт окисляется до пропионовой кислоты, более едкой, чем уксусная кислота, в связи с чем токсичность пропилового спирта значительно выше, чем у этилового (ЛД50 для пропилового спирта = 1870 мг/кг, для этилового спирта 7060 мг/кг). В то же время по сравнению с метиловым спиртом, ЛД50 которого составляет 1,5 мг/кг, пропиловый спирт относительно безопасен. На 2011 год был зафиксирован один смертельный случай отравления пропиловым спиртом.
Безопасность
Горюч. ПДК пропилового спирта в воздухе рабочей зоны 10 мг/м3, в атмосферном воздухе населенных пунктов — не более 0,3 мг/м3.
formula-info.ru
2-пропанол Википедия
| Изопропанол | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Пропан-2-ол |
| Традиционные названия | Изопропиловый спирт |
| Хим. формула | C3H8O |
| Рац. формула | CH3CH(OH)CH3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 60,09 г/моль |
| Плотность | 0,7851 г/см³ |
| Динамическая вязкость | 0,00243 Па·с |
| Энергия ионизации | 10,1 ± 0,1 эВ[1] |
| Термические свойства | |
| Т. плав. | -89,5 °C |
| Т. кип. | 82,4 °C |
| Т. всп. | 11,7 °C |
| Т. свспл. | 400 °C |
| Пр. взрв. | 2 ± 1 об.%[1] |
| Мол. теплоёмк. | 155,2 Дж/(моль·К) |
| Давление пара | 4,4 кПа при 20 °C |
| Химические свойства | |
| pKa | 16,5 |
| Растворимость в бензоле | хорошо растворим |
| Растворимость в ацетоне | растворим |
| Оптические свойства | |
| Показатель преломления | 1,3776 (nD, 20°C) |
| Структура | |
| Дипольный момент | 1,66 Д |
| Классификация | |
| Рег. номер CAS | 67-63-0 |
| PubChem | 3776 |
| Рег. номер EINECS | 200-661-7 |
| SMILES | |
| InChI | |
| RTECS | NT8050000 |
| ChEBI | 17824 и 43588 |
| Номер ООН | 1219 |
| ChemSpider | 3644 |
| Безопасность | |
| ЛД50 | 12800 мг/кг (кролик) |
| Токсичность | Класс опасности 3 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Изопропи́ловый спирт (пропано́л-2, втор-пропанол, изопропано́л, диметилкарбино́л, ИПС) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — пропанол-1.
При нормальных условиях прозрачная, бесцветная жидкость с резким запахом и мягким горьким вкусом[2].
Изопропиловый спирт используется в качестве заменителя этилового спирта в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей, медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности.
В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине, благодаря своей относительно низкой токсичности[3].
75 % водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивает более высокую эффективность и лучшее обеззараживание[4].
Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита[5].
Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу.
Как и все летучие спирты, огнеопасен. Умеренно токсичен, требует осторожного обращения.
Свойства
Химические свойства
Рациональная химическая формула изопропилового спирта Ch4CH(OH)Ch4{\displaystyle {\ce {Ch4CH(OH)Ch4}}}.
Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры.
Гидроксильная группа может быть вытеснена галогенами.
С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол.
При дегидрировании превращается в ацетон[6].
Реагирует с сильными окислителями.
В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения.
Растворяет некоторые виды пластмасс и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резким, чем у этанола, по запаху их можно в некоторых случаях отличить.
Коэффициент преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода . Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К). Удельная теплота сгорания 34,1 МДж/кг.
Пар хорошо смешивается с воздухом, в диапазоне взрывоопасных концентраций образует взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C.
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях.
С водой образует азеотропную смесь 87,9 % изопропилового спирта с температурой кипения 80,2 °C.
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение[7]:
| Концентрация спирта, об % | Концентрация спирта, вес. % | Температура замерзания, °C |
|---|---|---|
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Получение
Применяются два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена[8][9].
Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена
- Ch4CH=Ch3+h3SO4⟶(Ch4)2CHOSO2OH+h3O⟶(Ch4)2CHOH{\displaystyle {\ce {Ch4CH=Ch3 + h3SO4 ->(Ch4)2CHOSO2OH + h3O -> (Ch4)2CHOH}}}.
Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона.
На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH{\displaystyle {\ce {(Ch4)2CHOSO2OH}}}, серной кислоты h3SO4{\displaystyle {\ce {h3SO4}}} и воды h3O{\displaystyle {\ce {h3O}}}. На второй стадии процесса — сернокислотный экстракт нагревается с водой и отгоняется образующийся изопропиловый спирт.
Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора — (в скобках указаны условия процессов): ортофосфорной кислоты h4PO4{\displaystyle {{\ce {h4PO4}}}} на твёрдом неорганическом носителе при 240—260°С и 2,5—6,5 МПа) или на носителе из катионообменной смолы при 130—160°С и 8,0—10,0 МПа.
Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами[6].
Современный способ гидрирования ацетона водородом:
- Ch4COCh4+h3→katCh4CH(OH)Ch4{\displaystyle \mathrm {CH_{3}COCH_{3}+H_{2}{\xrightarrow {kat}}CH_{3}CH(OH)CH_{3}} }
Гидрирование ацетона впаровой фазе в присутствии твёрдого медно-никельхромитного катализатора[10][11].
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[12] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[11][13].
Применение
Изопропиловый спирт используют для получения:
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием.
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток.
Влияние на человека
- Ингаляционное
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает[14].
Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ, которые не вызывают раздражений и иных побочных эффектов. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из емкости с площадью менее 20 см² в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей[15].
- Пероральное
Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко[2].
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл.
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов[2].
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием[14], наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола[16]. Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов вызывает состояние глубокого наркоза и смерть[15].
При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающем ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0359.html
- ↑ 1 2 3 R. J. Slaughter, R. W. Mason, D. M. G. Beasley, J. A. Vale, L. J. Schep. Isopropanol poisoning // Clinical Toxicology (Philadelphia, Pa.). — 2014-06-01. — Т. 52, вып. 5. — С. 470–478. — ISSN 1556-9519. — DOI:10.3109/15563650.2014.914527.
- ↑ Papa, A. J. «Propanols» // Ullmann’s Encyclopedia of Industrial Chemistry : Weinheim: Wiley-VCH. — 2005.
- ↑ «Guide to Local Production: WHO-recommended Handrub Formulations» (англ.) // World Health Organization. — 2009. — Август.
- ↑ Otitis Externa (Swimmer’s Ear) (26 февраля 2010). Проверено 21 февраля 2016. Архивировано 26 февраля 2010 года.
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон (недоступная ссылка — история). Проверено 26 ноября 2011. Архивировано 21 марта 2012 года.
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse (недоступная ссылка — история). Проверено 10 августа 2011. Архивировано 15 октября 2011 года.
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
wikiredia.ru
Пропанол-2 Википедия
| Изопропанол | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Пропан-2-ол |
| Традиционные названия | Изопропиловый спирт |
| Хим. формула | C3H8O |
| Рац. формула | CH3CH(OH)CH3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 60,09 г/моль |
| Плотность | 0,7851 г/см³ |
| Динамическая вязкость | 0,00243 Па·с |
| Энергия ионизации | 10,1 ± 0,1 эВ[1] |
| Термические свойства | |
| Т. плав. | -89,5 °C |
| Т. кип. | 82,4 °C |
| Т. всп. | 11,7 °C |
| Т. свспл. | 400 °C |
| Пр. взрв. | 2 ± 1 об.%[1] |
| Мол. теплоёмк. | 155,2 Дж/(моль·К) |
| Давление пара | 4,4 кПа при 20 °C |
| Химические свойства | |
| pKa | 16,5 |
| Растворимость в бензоле | хорошо растворим |
| Растворимость в ацетоне | растворим |
| Оптические свойства | |
| Показатель преломления | 1,3776 (nD, 20°C) |
| Структура | |
| Дипольный момент | 1,66 Д |
| Классификация | |
| Рег. номер CAS | 67-63-0 |
| PubChem | 3776 |
| Рег. номер EINECS | 200-661-7 |
| SMILES | |
| InChI | |
| RTECS | NT8050000 |
| ChEBI | 17824 и 43588 |
| Номер ООН | 1219 |
| ChemSpider | 3644 |
| Безопасность | |
| ЛД50 | 12800 мг/кг (кролик) |
| Токсичность | Класс опасности 3 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Изопропи́ловый спирт (пропано́л-2, втор-пропанол, изопропано́л, диметилкарбино́л, ИПС) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — пропанол-1.
При нормальных условиях прозрачная, бесцветная жидкость с резким запахом и мягким горьким вкусом[2].
Изопропиловый спирт используется в качестве заменителя этилового спирта в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей, медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности.
В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине, благодаря своей относительно низкой токсичности[3].
75 % водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивает более высокую эффективность и лучшее обеззараживание[4].
Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита[5].
Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу.
Как и все летучие спирты, огнеопасен. Умеренно токсичен, требует осторожного обращения.
Свойства
Химические свойства
Рациональная химическая формула изопропилового спирта Ch4CH(OH)Ch4{\displaystyle {\ce {Ch4CH(OH)Ch4}}}.
Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры.
Гидроксильная группа может быть вытеснена галогенами.
С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол.
При дегидрировании превращается в ацетон[6].
Реагирует с сильными окислителями.
В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения.
Растворяет некоторые виды пластмасс и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резким, чем у этанола, по запаху их можно в некоторых случаях отличить.
Коэффициент преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода . Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К). Удельная теплота сгорания 34,1 МДж/кг.
Пар хорошо смешивается с воздухом, в диапазоне взрывоопасных концентраций образует взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C.
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях.
С водой образует азеотропную смесь 87,9 % изопропилового спирта с температурой кипения 80,2 °C.
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение[7]:
| Концентрация спирта, об % | Концентрация спирта, вес. % | Температура замерзания, °C |
|---|---|---|
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Получение
Применяются два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена[8][9].
Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена
- Ch4CH=Ch3+h3SO4⟶(Ch4)2CHOSO2OH+h3O⟶(Ch4)2CHOH{\displaystyle {\ce {Ch4CH=Ch3 + h3SO4 ->(Ch4)2CHOSO2OH + h3O -> (Ch4)2CHOH}}}.
Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона.
На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH{\displaystyle {\ce {(Ch4)2CHOSO2OH}}}, серной кислоты h3SO4{\displaystyle {\ce {h3SO4}}} и воды h3O{\displaystyle {\ce {h3O}}}. На второй стадии процесса — сернокислотный экстракт нагревается с водой и отгоняется образующийся изопропиловый спирт.
Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора — (в скобках указаны условия процессов): ортофосфорной кислоты h4PO4{\displaystyle {{\ce {h4PO4}}}} на твёрдом неорганическом носителе при 240—260°С и 2,5—6,5 МПа) или на носителе из катионообменной смолы при 130—160°С и 8,0—10,0 МПа.
Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами[6].
Современный способ гидрирования ацетона водородом:
- Ch4COCh4+h3→katCh4CH(OH)Ch4{\displaystyle \mathrm {CH_{3}COCH_{3}+H_{2}{\xrightarrow {kat}}CH_{3}CH(OH)CH_{3}} }
Гидрирование ацетона впаровой фазе в присутствии твёрдого медно-никельхромитного катализатора[10][11].
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[12] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[11][13].
Применение
Изопропиловый спирт используют для получения:
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием.
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток.
Влияние на человека
- Ингаляционное
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает[14].
Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ, которые не вызывают раздражений и иных побочных эффектов. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из емкости с площадью менее 20 см² в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей[15].
- Пероральное
Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко[2].
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл.
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов[2].
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием[14], наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола[16]. Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов вызывает состояние глубокого наркоза и смерть[15].
При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающем ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0359.html
- ↑ 1 2 3 R. J. Slaughter, R. W. Mason, D. M. G. Beasley, J. A. Vale, L. J. Schep. Isopropanol poisoning // Clinical Toxicology (Philadelphia, Pa.). — 2014-06-01. — Т. 52, вып. 5. — С. 470–478. — ISSN 1556-9519. — DOI:10.3109/15563650.2014.914527.
- ↑ Papa, A. J. «Propanols» // Ullmann’s Encyclopedia of Industrial Chemistry : Weinheim: Wiley-VCH. — 2005.
- ↑ «Guide to Local Production: WHO-recommended Handrub Formulations» (англ.) // World Health Organization. — 2009. — Август.
- ↑ Otitis Externa (Swimmer’s Ear) (26 февраля 2010). Проверено 21 февраля 2016. Архивировано 26 февраля 2010 года.
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон (недоступная ссылка — история). Проверено 26 ноября 2011. Архивировано 21 марта 2012 года.
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse (недоступная ссылка — история). Проверено 10 августа 2011. Архивировано 15 октября 2011 года.
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
wikiredia.ru
Изопропиловый спирт — это… Что такое Изопропиловый спирт?
| Изопропанол | |
| Общие | |
|---|---|
| Систематическое наименование | Пропан-2-ол |
| Сокращения | Изопропанол, 2-пропанол |
| Традиционные названия | Изопропиловый спирт |
| Химическая формула | CH3CH(OH)CH3 |
| Эмпирическая формула | C3H8O |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 60,09 а. е. м. |
| Молярная масса | 60,09 г/моль |
| Плотность | 0,7851 г/см³ |
| Динамическая вязкость (ст. усл.) | 0,00243 Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | -89,5 °C |
| Температура кипения | 82,4 °C |
| Температура вспышки | 11,7 °C |
| Температура самовоспламенения | 400 °C |
| Молярная теплоёмкость (ст. усл.) | 155,2 Дж/(моль·К) |
| Давление пара | 4,4 кПа при 20 °C |
| Химические свойства | |
| pKa | 16,5 |
| Растворимость в бензоле | хорошо растворим |
| Растворимость в ацетоне | растворим |
| Оптические свойства | |
| Показатель преломления | 1,3776 |
| Структура | |
| Дипольный момент | 1,66 Д |
| Классификация | |
| Рег. номер CAS | 67-63-0 |
| SMILES | CC(O)C |
| Безопасность | |
| Токсичность | довольно высокая |
Изопропиловый спирт, пропанол-2 (2-пропанол), изопропанол, диметилкарбинол, ИПС — простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — 1-пропанол. Принадлежит к веществам 3-го класса опасности (умеренно опасные вещества) по степени воздействия на организм, обладает наркотическим действием. Граница ПДК для паров изопропанола в воздухе составляет 10 мг/м3. Отравление изопропиловым спиртом возникает в результате вдыхания паров, содержащих концентрацию, превышающую ПДК, кумулятивными свойствами не обладает[1]. Потребление внутрь уже в небольших дозах вызывает отравление. Широко используется как технический спирт в средствах для чистки стёкол, оргтехники и т. п. и как растворитель в промышленности (где растворители необходимы).
Свойства
Химические свойства
Химическая формула (рациональная) изопропилового спирта: CH3CH(OH)CH3.
Изопропанол обладает свойствами вторичных спиртов жирного ряда, в том числе образует простые и сложные эфиры. Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.[2]
Реагирует с сильными окислителями. Агрессивен в отношении некоторых видов пластика и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резковатым по сравнению с этанолом (по чему их можно в некоторых случаях отличить), tплавления −89,5 °C, tкипения 82,4 °C, плотность 0,7851 г/см³ (при 20 °C), tвспышки 11,7 °C. Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси. Давление паров — 4,4 кПа (при 20 °C). Относительная плотность пара — 2,1, относительная плотность смеси пар/воздух — 1,05 (при 20 °C).
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь (87,9 % изопропилового спирта, tкипения 83,38 °C).
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице[3]:
| Концентрация спирта об % | Концентрация спирта вес % | Температура замерзания °C |
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Получение
Существует два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена.[4][5]
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена
- CH3CH=CH2 + H2SO4 → (CH3)2CHOSO3H + H2O → (CH3)2CHOH.
Сырьем может служить пропан-пропиленовая фракция с содержанием пропилена 30-90 % (фракция пиролиза и крекинга нефти). Однако наблюдается тенденция к использованию чистого пропилена, так как в этом случае процесс можно вести при невысоких давлениях, резко снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH, H2SO4 и Н2О, на второй — сернокислотный экстракт нагревается с водой и удаляется образующийся изопропиловый спирт. Прямую гидратацию пропилена осуществляют в основном в присутствии твердого катализатора (в скобках указаны условия процессов): Н3РО4 на носителе (240—260°С; 2,5-6,5 МПа) или катионообменной смолы (130—160°С; 8,0-10,0 МПа). Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Современный способ:
Гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора.[6][7]
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[8] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[9][7]
Применение
Изопропиловый спирт используют для получения:
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители).
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта как антисептик для пропитки медицинских салфеток.
Влияние на человека
Оказывает раздражающее воздействие на глаза и дыхательные пути, при кратком воздействии больших концентраций паров вызывает головную боль. Может оказывать угнетающее действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК, может вызвать потерю сознания. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обуславливает его токсическое действие. Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Предельно допустимая концентрация изопропанола в воздухе равна 10 миллиграммов на кубический метр.
Изопропанол органолептически заметно отличается от этанола и не может быть ошибочно принят за этанол. Имеет отличный от этанола запах, более «грубый». При приеме внутрь вызывает опьянение, сходное с алкогольным. Изопропанол окисляется в организме при участии альдегиддегидрогеназы до ацетона. Скорость окисления в среднем в 2 — 2,5 раза ниже, чем у этанола, поэтому опьянение изопропанолом очень стойкое. При частом употреблении к изопропанолу быстро развивается непереносимость, а в отдельных случаях — гиперчувствительность и аллергия. Хотя токсичность изопропанола примерно в 3,5 раза больше, чем у этанола, но при этом опьяняющее действие его также выше в 10 раз[источник не указан 546 дней]. По этой причине смертельных отравлений изопропанолом не зафиксировано, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием.[1] Наркотический эффект изопропанола почти в 2 раза превышает аналогичный эффект этанола.[10] Концентрация 1,2 %, воздействующая в течение 4 часов оказывает наркотический эффект. При аналогичном воздействии в течение 8 часов — в половине случаев наблюдается смертельный исход.[11]
Примечания
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
- ↑ Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse
dikc.academic.ru
