ПДК в воздухе рабочей зоны, методики исследований, характеристики
Замерить «СПИРТ ИЗОПРОПИЛОВЫЙ»
Характеристики вещества в каталоге загрязняющих веществ от группы компаний «Лаборатория».
Химическое название вещества по IUPA : пропан-2-ол.
Структурная формула : C3H8O
Синонимы : изопропанол; диметилкарбинол; вторичный пропиловый спирт.
Код загрязняющего вещества : 1051
Агр.состояние : жидкость/газ
Класс опасности : 1051
ОБУВ (ориентировочный безопасный уровень воздействия): –
ЛОС : –
РПОХВ : ВТ-000742
CAS : 67-63-0
RTECS : NT8050000
EC : 200-661-7
ПДК м.р. (предельно допустимая концентрация в атмосферном воздухе максимальная разовая): 0,6 мг/м³
ПДК с.с. (предельно допустимая концентрация в атмосферном воздухе среднесуточная): – мг/м³
Лимитирующий показатель : рефл.
ПДК р.з. (предельно допустимая концентрация в воздухе рабочей зоны максимальная разовая): 50/10 мг/м³
Класс опасности : 3
Особенности действия на организм : –
Применяется на производствах : химическая, текстильная, фармацевтическая, нефтегазовая промыш- ленность. Полиграфия.
Диапазоны определения вещества «СПИРТ ИЗОПРОПИЛОВЫЙ» в промышленных выборсах, воздухе рабочей зоны, атмосферном воздухе различаются и определяются методиками исследования. Список методик смотрите ниже.
СПИРТ ИЗОПРОПИЛОВЫЙ: методики исследования в промышленных выбросах
Замерить СПИРТ ИЗОПРОПИЛОВЫЙ в промышленных выбросах
| Номер методики | Диапазон |
|---|---|
| ФР.1.31.2011.11272 (М-22) | (0,01-100) мг/м3 |
| Методика выполнения измерений массовой концентрации 2-этилгексанола в промышленных выбросах производства бутиловых спиртов МВИ № 062-4-А | — |
СПИРТ ИЗОПРОПИЛОВЫЙ: методики исследования в атмосферном воздухе
Замерить СПИРТ ИЗОПРОПИЛОВЫЙ в атмосферном воздухе
| Номер методики | Диапазон |
|---|---|
РД 52. 04.186-89, часть 1; прил. 5.3.4 04.186-89, часть 1; прил. 5.3.4 |
(0,1-2) мг/м3 |
| ФР.1.31.2011.11272 (М-22) | (0,01-100) мг/м3 |
| МУК 4.1.600-96 | (0,30-10,00) мг/м3 |
| РД 52.04-186-89 п. 5.3.3.2. | (0,22-2,2) мг/м3 |
СПИРТ ИЗОПРОПИЛОВЫЙ: методики исследования в воздухе рабочей зоны
Замерить СПИРТ ИЗОПРОПИЛОВЫЙ в воздухе рабочей зоны
| Номер методики | Диапазон |
|---|---|
| ФР.1.31.2011.11272 (М-22) | (0,01-100) мг/м3 |
| МУ 5297-90 | — |
Не нашли, что искали?
Укажите свой номер телефона и получите бесплатную консультацию специалиста и персональное предложение по нашим услугам.
Пропанол-2: химические свойства и получение
Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
CH3-CHOH-CH3
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.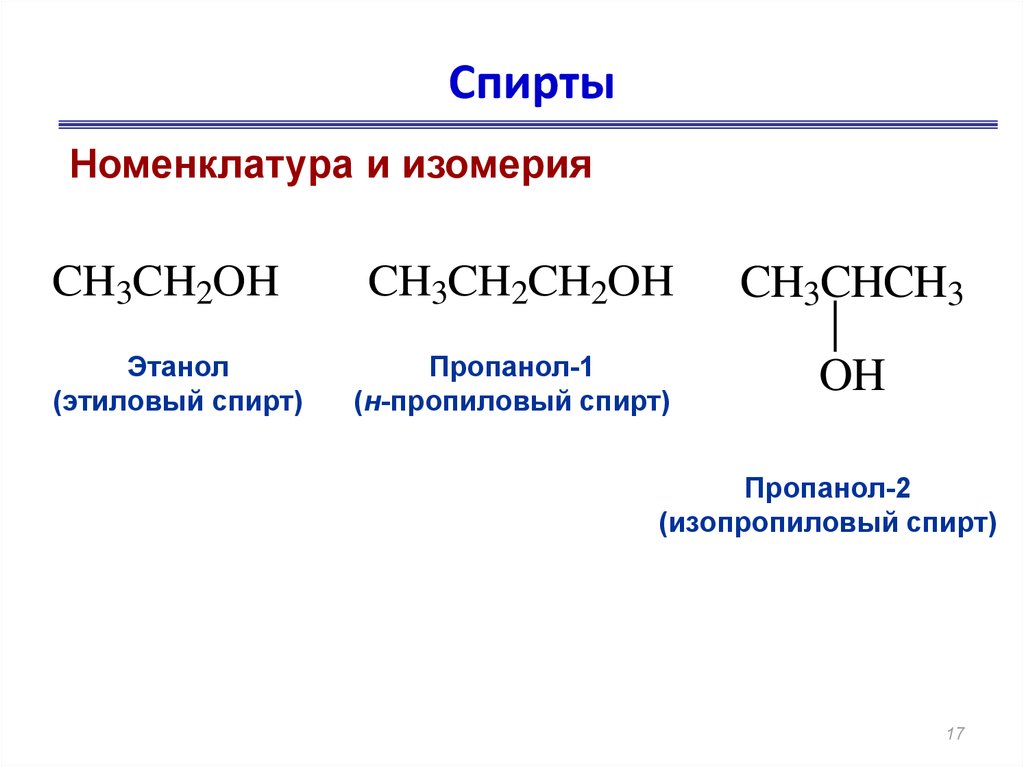 |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры —
это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода. |
2СН3–CHOH–CH3 + 2K → 2СН3–CHOK–CH3 + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, изопропилат калия разлагается водой: |
СН3–CHOK–CH3 + H2O → СН3–CHOH–CH3 + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
СН3–CHOH–CH3 + HBr → СН3–CHBr–CH3 + H2O
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
СН3–CHOH–CH3 + NH3 → СН3–CHNH2–CH3 + H2O
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
СН3–CHOH–CH3 + СH3COOH → СH3COO–CH(CH3)2 + H2O
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
СН3–CHOH–CH3 → СH3–CH=CH2 + H2O
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
2СН3–CHOH–CH3 → (СН3)2CH–O–СH(CH3)2 + H2O
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания пропанола-2: |
2C3H7OH + 9O2 = 6CO2 + 8H2O
5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
Например, при дегидрировании пропанола-2 образуется ацетон. |
СН3–CHOH–CH3 → СН3–CO–CH3 + H2
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl–CH3 + NaOH → СН3–CHOH–CH3 + NaCl
2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
3.
 Гидратация алкенов
Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
Понравилось это:
Нравится Загрузка…
Узнать формулу, структуру, свойства и применение
0
Сохранить
Скачать публикацию в формате PDF Изопропиловый спирт представляет собой углеводородное соединение, содержащее спиртовую функциональную группу. Изопропанол лучше действует как медицинский спирт, чем этанол, потому что он меньше сушит кожу. Низкая цена изопропанола делает его популярным ингредиентом в косметической промышленности. Изопропил также выступает в качестве исходного материала для многих других химических веществ. В 1920 году химики Standard Oil впервые произвели изопропиловый спирт путем гидратации пропилена. В промышленных масштабах и сегодня из гидратации пропилена производят изопропиловый спирт.
В 1920 году химики Standard Oil впервые произвели изопропиловый спирт путем гидратации пропилена. В промышленных масштабах и сегодня из гидратации пропилена производят изопропиловый спирт.
В этой статье мы обсудим изопропиловый спирт и поймем формулу и структуру изопропанола. Мы также узнаем о его свойствах, как физических, так и химических. Также представлена таблица, показывающая различия между этиловым спиртом и изопропиловым спиртом. Влияние изопропанола на здоровье и окружающую среду также должно следовать. Также следуют различные применения изопропанола.
Изопропиловый спирт
Ниже приведены некоторые важные характеристики изопропилового спирта:
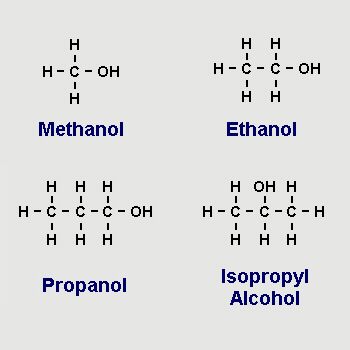
- Изопропиловый спирт представляет собой тип вторичного спирта, имеющего углеродную цепь, состоящую из трех атомов углерода. Он имеет молекулярную массу 60,10 а.е.м.
- Название IUPAC изопропанола — пропан-2-ол, представленное как \(\left({CH}_{3}\right)_{2} {CHOH}\). Аббревиатура изопропилового спирта – изопропанол.
 {3}\) гибридизацию.
{3}\) гибридизацию.Структура изопропилового спирта представлена на следующем изображении. Модель шара и стержня изопропанола также следует.
Свойства изопропилового спирта
Изопропанол подпадает под категорию спирта и проявляет все свойства, обычно проявляемые функциональной группой спирта. Приведенные ниже списки охватывают физические и химические свойства изопропилового спирта.
Физические свойства
Физические свойства изопропилового спирта: 9{\ circ} {С} \).
- Изопропиловый спирт образует водородные связи с водой, что делает его растворимым в воде.
Химические свойства
Химические свойства изопропилового спирта:
Окисление Изопропиловый спирт является вторичным спиртом и при обработке окислителями образует кетон. На изображении ниже показано окисление изопропанола в ацетон.
Конверсию также можно проводить с другими окислителями на основе хрома, такими как хлорхромат пиридиния (PCC), триоксид хрома и дихромат натрия. В биологических системах изопропанол превращается в ацетон ферментом алкогольдегидрогеназой.
В биологических системах изопропанол превращается в ацетон ферментом алкогольдегидрогеназой.
Дегидратация: Изопропиловый спирт подвергается удалению воды с образованием пропилена.
Галогенпроапан: Изопропиловый спирт реагирует с галогенидами фосфора (III) с образованием соответствующего замещенного галогенсодержащего соединения. В приведенном ниже механизме присутствует реакция другого вторичного спирта.
Атом кислорода действует как нуклеофил и атакует атом фосфора. В результате уходит один атом брома. Этот свободный бромид-ион атакует спирт по механизму SN2, давая соответствующее соединение брома. 9{+}+\frac{1}{2} {H}_{2}\)
Изопропоксид натрия находит различные применения в органическом синтезе, например, при этерификации. Изопропиловый спирт реагирует с карбоновыми кислотами с образованием соответствующих сложных эфиров. Эта реакция называется этерификацией Фишера.
Побочные эффекты изопропилового спирта
Изопропанол менее токсичен для живых организмов, чем метанол и этиленгликоль. Однако при длительном контакте с изопропиловым спиртом могут возникнуть некоторые побочные эффекты.
Однако при длительном контакте с изопропиловым спиртом могут возникнуть некоторые побочные эффекты.
- Изопропиловый спирт может вызывать кожную сыпь, зуд, сухость и покраснение при длительном контакте.
- Вдыхание изопропилового спирта может привести к респираторным заболеваниям.
- Более высокие концентрации изопропанола повреждают печень и почки.
- Изопропиловый спирт относительно безопасен для окружающей среды, поскольку он биоразлагаем. Однако крупные разливы могут негативно повлиять на жизнь животных и растений.
Разница между этиловым спиртом и изопропиловым спиртом
Хотя и изопропанол, и этанол могут действовать как дезинфицирующие средства, существует много различий. Some of them are
| Serial Number | Point | Ethyl alcohol (Ethanol), | Isopropyl alcohol (Isopropanol) |
1. | IUPAC Name | Этан-1-ол | Пропан-2-ол |
| 2. | Химическая формула | Ch4Ch3OH | (Ch4)2CHOH |
| 3. | Type of alcohol | Primary alcohol | Secondary alcohol |
| 4. | Consumability | Can be consumed safely. | Токсичный при употреблении |
| 5. | Основное применение | Дезинфицирующее средство для электронных устройств | Медицинский спирт для медицинских целей |
3 Спирты Использование Iso
30011 Коммерчески важный изопропанол имеет множество применений. Некоторые из них:
- Антисептические свойства изопропанола позволяют использовать его в качестве медицинского спирта.
- Он также широко используется в дезинфицирующих средствах и других чистящих средствах.
- Изопропиловый спирт является исходным материалом для получения различных органических соединений.

- Многие неполярные соединения растворяются в изопропаноле, что делает его хорошим растворителем.
- Он также присутствует в мыле и лосьонах.
- В автомобильной промышленности изопропиловый спирт действует как добавка к топливу, помогающая удалять влагу из природного газа.
Посетите Testbook не только для изучения, но и для практики ваших тестов!
Часто задаваемые вопросы по изопропиловому спирту
В.1 Как обычно называется изопропиловый спирт?
Ans.1 Изопропиловый спирт широко известен как медицинский спирт.
Q.2 Какова молекулярная масса изопропилового спирта?
Ответ 2 Молекулярная масса изопропилового спирта составляет 60,10 а.е.м.
В.3 Для чего используется изопропиловый спирт?
Ans.3 Изопропиловый спирт в основном используется в качестве дезинфицирующего средства. У него есть и много других приложений.
В.4 Является ли изопропиловый спирт растворителем?
Ans.4 Изопропиловый спирт может действовать как растворитель благодаря своей способности растворять различные неполярные соединения. 9{\ circ} {С} \).
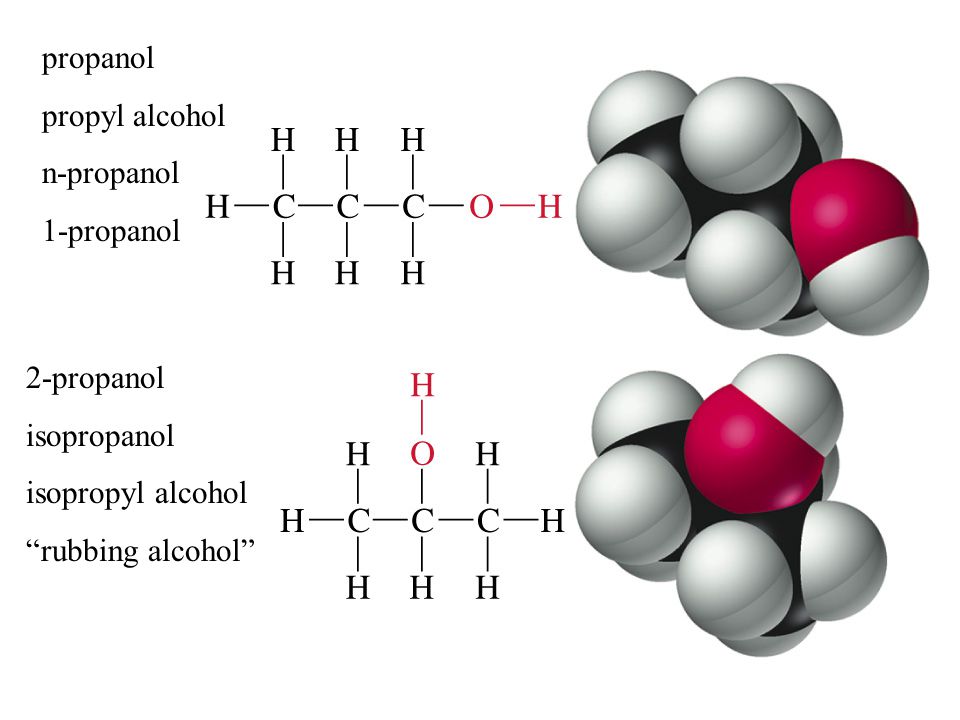
Скачать публикацию в формате PDF Изомерия — структурная
Изомерия — структурная Изомерия — структурная В таблице ниже показаны две молекулы, которые являются структурными изомерами друг друга. Обратите внимание, что они имеют одну и ту же химическую формулу, но разные структурные формулы (и, следовательно, разные структуры и свойства).
Этанол Диметиловый эфир химическая формула С 2 Н 6 О С 2 Н 6 О сокращенная структурная формула СН 3 СН 2 ОН СН 3 ОСН 3 «фигурка» Трехмерная конструкция


В таблице ниже показаны две молекулы, которые являются структурными изомерами друг друга. Обратите внимание, что они имеют одну и ту же химическую формулу, но разные структурные формулы (и, следовательно, разные структуры и свойства).

 {3}\) гибридизацию.
{3}\) гибридизацию.