СОДА КАЛЬЦИНИРОВАННАЯ ТЕХНИЧЕСКАЯ NA2CO3
СОДА КАЛЬЦИНИРОВАННАЯ ТЕХНИЧЕСКАЯ NA2CO3
|
Контактный телефон:
+ 7 (3842) 78-12-31 |
|||
Применение
Предназначается для применения в качестве сырья в различных отраслях промышленности: в стекольной, для изготовления стеклоизделий, к которым не предъявляются высокие требования по светопропусканию; в производстве стройматериалов; в металлургической, химической и нефтедобывающей.
Технические требования
|
Наименование показателей |
Норма |
|
|
Марка А |
Марка Б |
|
|
1. Внешний вид |
Кристаллическое вещество в виде кусков неправильной формы от светло-серого до светло-коричневого цвета |
Не нормируется |
|
2. Массовая доля углекислого натрия (Na 2CO3), %, не менее |
98,0 |
96,0 |
|
3. |
96,0 |
92,0 |
|
4. Массовая доля потери при прокаливании при (270-300) °С, %, не более |
2,0 |
4,0 |
|
5. Массовая доля хлоридов в пересчете на NaCl, %, не более |
2,0 |
4,0 |
|
6. Массовая доля железа в пересчете на Fe2О3, %, не более |
0,1 |
0,2 |
|
7. |
0,2 |
1,0 |
Упаковка
Мягкие специализированные полипропиленовые контейнеры.
Транспортировка
Всеми видами транспорта.
Транспортная маркировка со знаком «Беречь от влаги».
Гарантийный срок хранения 6 месяцев со дня изготовления.
Возврат к списку
Na NaOh Na2co3 NaCl NaNo3
Билет №1 (3)
Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
Дано: | Решение: |
Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% | Mвозд = 29 г/моль M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль Пусть ν(C m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г ν(C) : ν(H) = = 4 : 10 ⇒ С4Н10 M(C4H10) = 48 + 10 = 58 г/моль |
CxHy– ? | Ответ: С4Н10 |
Билет №2 (3)
Осуществить превращения:
Натрий → гидроксид натрия → карбонат натрия → хлорид натрия → нитрат натрия
0 +1 -2 +1 -2 +1 0
2Na + 2H2O → 2NaOH + H2↑
в-ль ок-ль
Na0 – 1e— → Na+1 | 2
2H +1 + 2e— → H2 | 1
2NaOH + CO2 → Na2CO3 + H2O
2Na+ + 2OH– + CO2 → 2Na+ + CO32– + H2O
2OH– + CO2 → CO32– + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32– + 2H+ + 2Cl– → 2Na+ + 2Cl– + CO2↑ + H2O
CO32– + 2H+ → CO2↑ + H2O
NaCl + AgNO3 → NaNO3 + AgCl↓
Na+ + Cl– + Ag+ + NO3– → Na+ + NO3– + AgCl↓
Cl– + Ag+
Билет №3 (3)
Какой объём хлора прореагирует с
натрием массой 34,5г. Определить массу
хлорида натрия.
Определить массу
хлорида натрия.
Дано: | Решение: |
m(Na) = 34,5г | 34,5 г x л y л 2Na + Cl2 → 2NaCl 2 моль 1 моль 2 моль 46 г 22,4 л 117 г m = M ∙ ν V = Vm ∙ ν M(Na) = 23 г/моль M(NaCl) = 58,5 г/моль m(Na) = 23 г/моль ∙ 2 моль = 46 г m(NaCl) = 58,5 г/моль ∙ 2 моль = 117 г Vm = 22,4 л/моль V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(Cl2) – ? m(NaCl) – ? | Ответ: V(Cl2) = 16,8 л; m(NaCl) = 87,8 г |
Билет №4 (3)
Осуществить превращения:
Магний → хлорид магния → гидроксид магния → оксид магния → сульфат магния
Mg MgCl2 Mg(oh)2 MgO MgSo4
0 +1 -1 +2 -1 0
Mg + 2HCl MgCl2 + H2↑
в-ль ок-ль
Mg0 – 2e— → Mg+2 | 1
2H+ + 2e— → H20 | 1
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg2+ + 2Cl– + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + 2Cl–
Mg2+ + 2OH– → Mg(OH)2↓
Mg(OH)2 MgO + H2O
MgO + H2SO4 → MgSO4 + H2O
MgO + 2H+ + SO42–→ Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №5 (3)
Какой объём хлора прореагирует с железом массой 400г, если массовая доля примесей в нём 20%?
Дано: | Решение: |
mобр(Fe) = 400 г ωприм = 20% | 320 г x л 2Fe + 3Cl2 → 2FeCl3 2 моль 3 моль 112 г 67,2 л mприм = 0,2 ∙ 400 г = 80 г m(Fe) = mобр – mприм = 400 г – 80 г = 320 г M(Fe) = 56 г/моль; m(Fe) = 56 г/моль ∙ 2 моль = 112 г Vm = 22,4 л/моль V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л |
V(Cl2) – ? | Ответ: V(Cl2) = 192 л |
Билет №6 (3)
Осуществить превращения:
Медь → хлорид меди (II) → гидроксид меди (II) → оксид меди (II) → медь
Cu CuCl2 Cu(oh)2 CuO Cu
Cu + Cl2 → CuCl2
в—льок—ль
Cu0 – 2e— → Cu+2 | 1
Cl2 + 2e— → 2Cl– | 1
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + 2Cl–
Cu2+ + 2OH– → Cu(OH)2↓
Cu(OH)2 CuO + H2O
+2 –2 0 t 0 +1 –2
CuO + H2 Cu + H2O
ок—льв—ль
Cu+2 + 2e— → Cu0 | 1
H20 – 2e— → 2H+1 | 1
Билет №7 (3)
При прокаливании 300 г известняка,
содержащего 10% примесей, получено 75 г
негашеной извести. Найти массовую долю
выхода продукта реакции от теоретически
возможного.
Найти массовую долю
выхода продукта реакции от теоретически
возможного.
Дано: | Решение: |
mобр(CaCO3) = 300г ωприм = 10% mпракт(CaO) = 75г | 270 г x г CaCO3 CaO + CO2 1 моль 1 моль 100 г 56 г mприм = 300 г ∙ 0,1 = 30 г m(CaCO3) = 300 г – 30 г = 270 г = 151,2 г — mтеор(CaO) = 0,496 = = 49,6% |
η(CaO) – ? | Ответ: η(CaO) = 49,6 % |
Билет №8 (3)
Какова масса соли, получившейся в результате взаимодействия 100 г соляной кислоты с 14 г оксида кальция?
Дано: | Решение: |
m(HCl) = 100 г m(CaO) = 14 г | 0,25 моль х моль CaO + 2HCl → CaCl2 + H2O 1 моль 2 моль 1 моль m = M ∙ ν M(CaCl2) = 40 + 71 = 111 г/моль m(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г |
m(CaCl2) – ? | Ответ: m(CaCl2) = 27,8 г |
Билет №9 (3)
Какой объём ацетилена необходимо сжечь для получения 24 л оксида углерода (IV)?
Дано: | Решение: |
V(CO2) = 24 л | x л 24 л 2C2H2 + 5O2 → 4CO2 + 2H2O 2V 4V |
V(C2H2) – ? | Ответ: V(C2H2) = 12 л |
Билет №10 (3)
Осуществить превращения:
Гидроксид меди (II) → сульфат меди (II) → медь →
→ оксид меди (II) → нитрат меди (II)
a Опишите, как производится стиральная сода из поваренной соли хлорида натрия Напишите уравнения.
 ..
..Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 4 Углерод и его соединения
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 2 — Глава 2 Кислоты, основания и соли > Упражнение > Вопрос 191
Вопрос 191 Упражнение
(a) Опишите, как производится стиральная сода из хлорида натрия (поваренной соли). Напишите уравнения всех протекающих реакций.
Напишите уравнения всех протекающих реакций.
(b) Укажите, является ли водный раствор стиральной соды кислой или щелочной. Обоснуйте свой ответ.
(c) Что имеется в виду, когда говорят, что стиральная сода обладает моющими свойствами?
(d) Назовите два важных применения стиральной соды (или карбоната натрия).
Ответ:
Стиральная сода производится из хлорида натрия в следующем процессе:
Этап 1: Холодный и концентрированный раствор хлорида натрия, называемый рассолом, взаимодействует с аммиаком и двуокисью углерода для получения гидрокарбоната натрия.
NaCl + NH 3 + H 2 O + CO 2 → NaHHCO 3 + NH 4 Cl
Стадия 2: Образовавшийся гидрокарбонат натрия отделяют фильтрованием, сушат и нагревают. Далее он разлагается до карбоната натрия.
2NAHCO 3 → NA 2 CO 3 + CO 2 + H 2 O
Ангивонный карбонат натрия называется содовой пепел.
Этап 3: Кальцинированную соду затем растворяют в воде и перекристаллизовывают, чтобы получить кристаллы промывной соды, содержащие 10 молекул кристаллизационной воды.
Na 2 CO 3 + 10H 2 O → Na 2 CO 3. 10H 2 O
900 02 (b) Водный раствор соды является щелочным, потому что он превращает лакмусовую краску в красную. синий.(c) Стиральная сода обладает очищающим свойством, таким образом, она удаляет грязь и жир с грязной одежды. Они усиливают моющие свойства стиральной соды.
(d) Сода для стирки может использоваться для:
Используется в качестве очищающего средства.
Используется для устранения постоянной жесткости воды.
Связанные вопросы
** Какой цвет приобретают следующие индикаторы при добавлении к основанию или щелочи (например, гидроксиду натрия…
**(a)Почему кислоты не проявляют кислотного поведения в отсутствие воды?****(b)Почему водный раствор. ..
..
**Почему нельзя хранить творог и другие кислые продукты (например, лимон, сок и т. д.) в металлической таре…
**Что такое реакция нейтрализации? Объясните на примере. Составьте химическое уравнение реакции…
**Почему HCl, H2SO4, HNO3 и т. д. проявляют кислый характер в водной…
**Что понимают под сильными кислотами и слабыми кислотами? Классифицируйте следующие кислоты на сильные и слабые…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение
Главы
Глава 1 Химические реакции и уравнения
Глава 2 Кислоты, основания и соли
Глава 3 Металлы и неметаллы
Глава 4 Углерод и его соединения
Глава 5 Периодическая классификация элементов
Курсы
Краткие ссылки
Термины и политики
Термины и политики
2022 © Качественные учебные пособия Pvt Ltd Все права защищены
Неорганическая химия — Как различить NA2CO3 и NAHCO3 с помощью химического теста?
спросил
Изменено 4 года, 2 месяца назад
Просмотрено 27 тысяч раз
$\begingroup$
$\ce{Na2CO3}$ и $\ce{NaHCO3}$ имеют сходные реакции. Например, они могут реагировать с кислотой с образованием $\ce{CO2}$.
Например, они могут реагировать с кислотой с образованием $\ce{CO2}$.
Итак, мой вопрос:
Можно ли с помощью химического теста отличить $\ce{Na2CO3}$ от $\ce{NaHCO3}$?
Я знаю, что $\ce{NaHCO3}$ может быть термически разложен в $\ce{Na2CO3}$ по следующей реакции: $2\ce{NaHCO3->} \ce{Na2CO3} + \ce{CO2} + \ ce{h3O}$
Однако я не уверен, является ли термическое разложение химическим тестом.
- неорганическая химия
- ионные соединения
$\endgroup$
3
$\begingroup$
Нагревание соли является важным тестом для определения аниона в соли путем проверки выделяющегося газа. Этот тест называется 9}$$
При взаимодействии карбонатной соли с $\ce{MgSO4}$ выпадает белая соль, а при взаимодействии бикарбонатной соли с $\ce{MgSO4}$ не только осаждается белая соль, но и происходит бурное вскипание.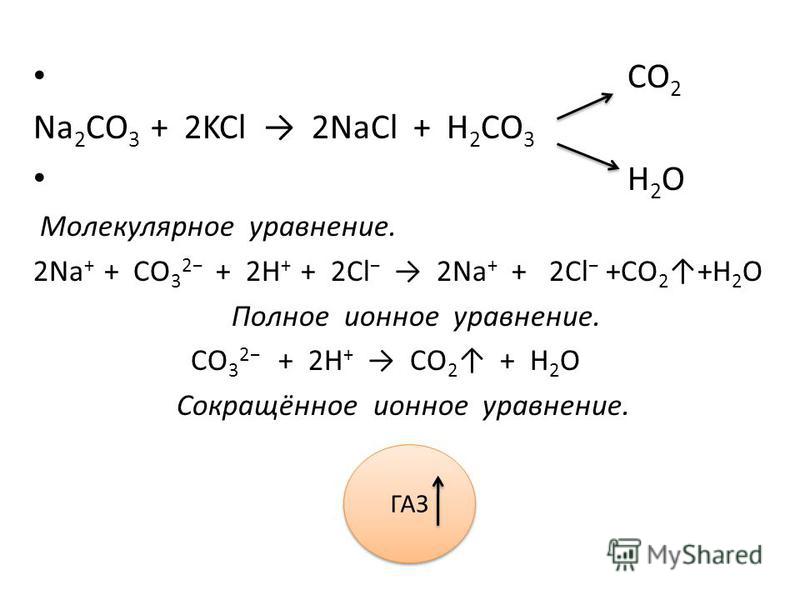 Газ обнаруживают, пропуская его через известковую воду.
Газ обнаруживают, пропуская его через известковую воду.
$\endgroup$
$\begingroup$
зависит от вашего оборудования. Вы можете оценить количество $\ce{NaHCO3}$, взяв известное количество образца, нагрев его до $\sim\pu{300 °C}$, охладив до комнатной температуры и снова измерив вес. Нулевые потери означают 100% $\ce{Na2CO3}$. Потеря $37\%$ веса означает $100\%$ $\ce{NaHCO3}$. Зависимость носит линейный характер в пределах потери массы $0-37\%$.
Лучше прореагировать грамм материала с $\ce{HCl}$, отправить с образованием $\ce{CO2}$ через насыщенный $\ce{Ba(OH)2}$ ($\ce{Ca(OH) )2}$ можно использовать, но это тоже не сработает), соберите, промойте насухо и взвесьте осадок $\ce{BaCO3}$. Оба эксперимента говорят вам, сколько анионов карбоната содержится в образце. Вы должны предположить, что $\ce{NaHCO3}$ и $\ce{Na2CO3}$ были единственными компонентами в смеси.
Вы также можете оценить соотношение на основе pH полученного раствора, если знаете, как рассчитать pH для буферов.
$\endgroup$
1
$\begingroup$
Как вы упомянули в своем посте, термическое разложение и измерение образующегося газа были бы одним из способов отличить то, что у вас есть. Однако я бы назвал это физическим, а не химическим методом.
Этот вид термического разложения не рассматривается большинством лабораторий по двум причинам:
Оба химиката дешевые . Обычно их покупают килограммами, и, глядя на то, что мы получаем за них, компания в основном берет с нас плату только за стоимость контейнеров и доставки.
Термическое разложение и измерение газов, по крайней мере в настоящее время, являются достаточно специализированным методом. Большинству лабораторий было бы трудно собрать воедино необходимое оборудование, и даже если бы они смогли его найти, скорее всего, не захотели бы этого делать.

Тем не менее, ваш вопрос кажется чисто академическим, а не практическим, поэтому давайте рассмотрим возможный химический метод.
Карбонат натрия хорошо известен своим использованием в неорганическом анализе, поскольку он реагирует с некоторыми металлами с образованием карбонатных солей четко определенного цвета.
Тест может различать медь (Cu), железо (Fe) и кальций (Ca), цинк (Zn) или свинец (Pb). К соли металла добавляют раствор карбоната натрия. Синий осадок указывает на ион Cu2+. Грязно-зеленый осадок указывает на ион Fe2+. Желто-коричневый осадок указывает на ион Fe3+. Белый осадок указывает на ион Ca2+, Zn2+ или Pb2+. (Источник: Википедия)
IIRC тест не работает с бикарбонатом натрия, поэтому вы можете использовать реакции с дешевым металлом, таким как железо, чтобы определить, есть ли у вас бикарбонат натрия или карбонат натрия.
$\endgroup$
0
$\begingroup$
Растворите образец в воде до известной концентрации и измерьте pH.

 Массовая доля углекислого натрия (Na2CO3) в пересчете на не прокаленный продукт, %, не менее
Массовая доля углекислого натрия (Na2CO3) в пересчете на не прокаленный продукт, %, не менее
 Массовая доля веществ, нерастворимых в воде, %, не более
Массовая доля веществ, нерастворимых в воде, %, не более
