Аммиак
783 Просмотры 2 Понравилось Опубликовано: May 15th 2020
Аммиак (он же Nh4, аммониак, гидрид азота или, согласно номенклатуре ИЮПАК) – неорганическое соединение, по своим физическим характеристикам представляющее собой газ, не имеющий цвета, с резким запахом. Из-за своей низкой относительно воздуха плотности является летучим. Полярная молекула с ковалентной связью на основе донорно-акцепторного механизма (азот выступает донором, предоставляющим акцептору – водороду не поделенную пару электронов на свободную орбиталь) выглядит как пирамида с азотом наверху.
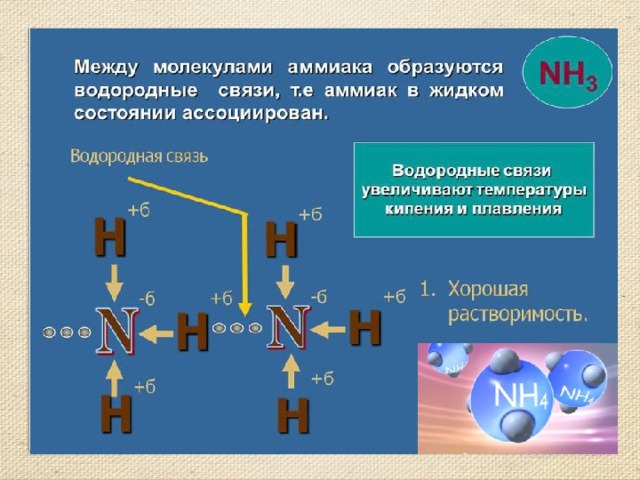
В жидком состоянии молекулы аммиака связываются между собой путём водородной связи. В данном случае она является ассоциацией электроотрицательного азота с водородом, который, в свою очередь, также связан с азотом в другой молекуле аммиака. В противовес воде, аммиак не способен формировать сложную цепь водородных связей по причине того, что в его молекуле присутствует всего одна не поделенная пара электронов, тогда как в воде их две. Поэтому он плохо проводит электрический ток, является менее вязкой жидкостью, а также обладает маленькой диэлектрической проницаемостью, которая составляет всего лишь 16,5 единиц. Неудивительно, что ни жидкий, ни твердый аммиак, являющийся кубическими кристаллами, не используют при производстве конденсаторов. Однако данная жидкость является прекрасным растворителем для значительного количества органических и неорганических соединений, а свет, попадающий в жидкий аммиак, существенно преломляется.
Поэтому он плохо проводит электрический ток, является менее вязкой жидкостью, а также обладает маленькой диэлектрической проницаемостью, которая составляет всего лишь 16,5 единиц. Неудивительно, что ни жидкий, ни твердый аммиак, являющийся кубическими кристаллами, не используют при производстве конденсаторов. Однако данная жидкость является прекрасным растворителем для значительного количества органических и неорганических соединений, а свет, попадающий в жидкий аммиак, существенно преломляется.
Происхождение названия и первые опыты по получению чистого аммиака
Первым человеком, занявшимся исследованием и выделением аммиака, был британский священник, философ и известный, благодаря открытию кислорода, химик Джозеф Пристли. Именно он в 1774 году обнаружил некое соединение, названное щелочным воздухом. Спустя некоторое время Луи Бертолле выявил точную химическую формулу аммиака. Открытия Бертолле и Пристли заставили многих учёных проводить недели и месяцы в лабораториях, исследуя различные способы синтезирования аммиака из азота и водорода. Самой оптимальной процедурой по синтезу аммиака считается процесс Габера, который был разработан спустя более ста лет с момента открытия аммиака. Немецкие химики Фриц Габер и Карл Бош придумали, как можно получить аммиак при высоком давлении, температуре 600 градусов Цельсия и в присутствии порошкообразного осмиевого катализатора. Первая установка по производству аммиака была построена крупнейшим в мире химическим концерном BASF в 1913 году. В данный момент её можно увидеть в техническом университете Германии, Карлсруэ.
Самой оптимальной процедурой по синтезу аммиака считается процесс Габера, который был разработан спустя более ста лет с момента открытия аммиака. Немецкие химики Фриц Габер и Карл Бош придумали, как можно получить аммиак при высоком давлении, температуре 600 градусов Цельсия и в присутствии порошкообразного осмиевого катализатора. Первая установка по производству аммиака была построена крупнейшим в мире химическим концерном BASF в 1913 году. В данный момент её можно увидеть в техническом университете Германии, Карлсруэ.
Применение аммиака в промышленности и прочих отраслях производственной деятельности
Чаще всего аммониак применяется в качестве сырья при производстве удобрений, в состав которых также входят нитрат и сульфат аммония, при синтезе полимеров, соды и множества других химических продуктов. Растворы аммиака играют роль растворителей в составах красящих и других средств. Так как аммиак является щёлочью, в химической промышленности он нередко служит для нейтрализации кислот. При производстве холодильников аммиак абсорбционного или компрессионного типа применяется в качестве хладагента.
При производстве холодильников аммиак абсорбционного или компрессионного типа применяется в качестве хладагента.
Десятипроцентный раствор аммиака, в быту известный как «нашатырный спирт», находит применение в сфере медицинского обслуживания как средство для выведения человека из обморочного состояния или его предотвращения. Это действие гидрида азота связано с тем, что резкий запах приводит к раздражению слизистой оболочки дыхательных путей, а также стимулирует работу центров мозга, отвечающих за дыхание, вследствие чего оно учащается и повышается артериальное давление. Также аммиак применяется для вызова рвоты при приеме раствора слабой концентрации внутрь, в качестве антисептика при обработке рук врачей-хирургов и иных представителей медицинского персонала и т. д. А при укусах некоторых насекомых слабоконцентрированный раствор аммиака может выступить в качестве средства, останавливающего процессы развития инфекции на кожных покровах.
В некоторых случаях аммиак представляет опасность для организма. Концентрированный, он способен вызвать ожоги пищевода и желудка при его непосредственном применении внутрь, либо же раздражение дыхательных путей вплоть до остановки дыхания (эти последствия также могут быть итогом долгой аммиачной ингаляции) при попадании паров концентрированного аммиака в организм через нос и рот.
Концентрированный, он способен вызвать ожоги пищевода и желудка при его непосредственном применении внутрь, либо же раздражение дыхательных путей вплоть до остановки дыхания (эти последствия также могут быть итогом долгой аммиачной ингаляции) при попадании паров концентрированного аммиака в организм через нос и рот.
Приборы для измерения концентрации аммиака в жидкостях и газах
Для того, чтобы выяснить, сколько приходится аммиака на единицу объёма жидкости или газа, используются такие приборы, как газоанализаторы, аммониевые колориметры и системы контроля загазованности атмосферы (датчики обнаружения аммиака). Действие газоанализаторов основано на физическом действии тока, проходящего через анализируемую загазованную область (терморезистор в зависимости от температуры регулирует сопротивление и, как следствие, меняется ток) либо на каталитических реакциях окисления компонентов газа. В свою очередь, принцип действия колориметра, настроенного на определение аммония, заключается в том, что данный прибор измеряет количество поглощенного анализируемым раствором света и, исходя из полученных данных, рассчитывает концентрацию того или иного вещества (в данном случае, аммиака) в исследуемой среде.
Зеленый аммиак: тернистый путь к новому чистому топливу
Вы услышите гораздо больше об аммиаке как экологически чистом топливе по мере того, как будет продолжаться гонка за нулевым выбросом углерода к 2050 году. В частности, это хороший вариант для дальних перевозок и автоперевозок. Итак, что это такое, как оно производится и как используется в качестве зеленого топлива?
Химически аммиак представляет собой молекулу, состоящую из трех атомов водорода, каждый из которых связан с одним центральным атомом азота. Оба очень расспространенных элемента; Атмосфера Земли состоит в основном из азота, а водород, конечно, является самым распространенным элементом во Вселенной. Это не значит, что его просто производить, но мы еще вернемся к этому.
При атмосферном давлении аммиак — очень вонючий газ с температурой кипения -33,3 ° C (-28,0 ° F). При хранении в холоде или под умеренным давлением его относительно легко сжижать, что делает его гораздо более легким в транспортировке и хранении экологически чистым топливом, чем водород. Вы можете возить его или хранить в цистернах, дешево, как чипсы. Хранить водород почти в 30 раз дороже .
Вы можете возить его или хранить в цистернах, дешево, как чипсы. Хранить водород почти в 30 раз дороже .
Действительно, во многих отношениях аммиак лучше хранит водород, чем сам газообразный водород; Н2 известен тем, что просачивается через металлические стенки контейнеров, делает сталь, с которой он контактирует, хрупкой и требует много энергии для сжижения при криогенных температурах. А еще есть плотность: это может показаться странным, но в галлоне аммиака в полтора раза больше водорода, чем в галлоне водорода, при прочих равных.
Аммиак опасен для человека,, классифицируемый как «чрезвычайно опасное вещество» в Соединенных Штатах, со строгими требованиями к отчетности для любого предприятия, которое использует значительное количество.
Сегодня его чаще всего используют в сельском хозяйстве, где в виде соли или раствора это мощное удобрение, ведущее к повышению урожайности некоторых зерновых культур. Это составляет почти 90 процентов коммерческого использования аммиака в Соединенных Штатах.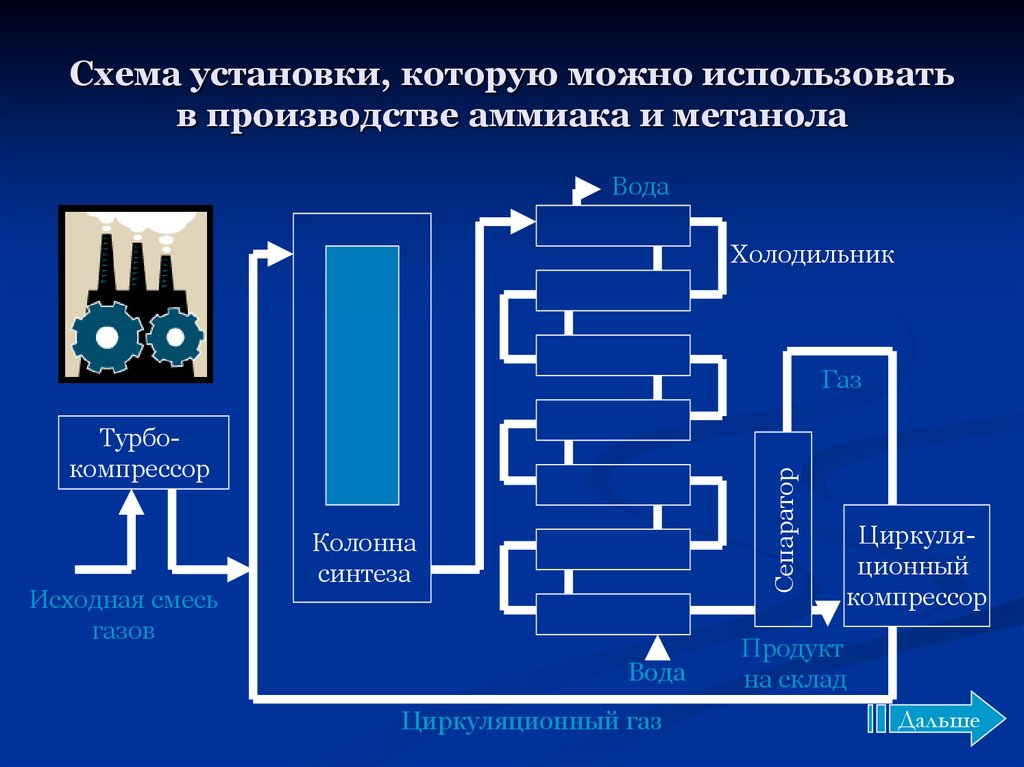 Остальное включает в себя промышленное использование в качестве предшественника практически всех синтетических соединений азота, использование в качестве бытового чистящего средства общего назначения, использование в качестве источника азота в процессе ферментации, использование в качестве антимикробного агента, в частности, для уничтожения бактерий E. coli в супер- мелкий говяжий фарш и другие виды использования.
Остальное включает в себя промышленное использование в качестве предшественника практически всех синтетических соединений азота, использование в качестве бытового чистящего средства общего назначения, использование в качестве источника азота в процессе ферментации, использование в качестве антимикробного агента, в частности, для уничтожения бактерий E. coli в супер- мелкий говяжий фарш и другие виды использования.
По объему аммиак (15,6 МДж / л) несет на 70 процентов больше энергии, чем жидкий водород (9,1 МДж / л при криогенных температурах), и почти в три раза больше энергии, чем сжатый газообразный водород (5,6 МДж / л при давлении 700 бар). . По весу он несет 6250 Втч / кг — более чем в 20 раз больше энергии, чем современные литиевые батареи, и более чем достаточно, чтобы преодолеть неэффективность, возникающую при извлечении энергии.
Дизельное топливо, как преобладающее ископаемое топливо для дальних перевозок, конечно, значительно лучше, давая вам 38,6 МДж / л и 12 667 Втч / кг в цикле сгорания. Но количества аммиака достаточно, чтобы об этом заговорить, и дни дизельного топлива сочтены.
Но количества аммиака достаточно, чтобы об этом заговорить, и дни дизельного топлива сочтены.
Есть несколько основных способов использования аммиака в качестве топлива. Один из них заключается в «крекинге» его обратно в газы h3 и N2, а затем использовании водорода в качестве топлива для сжигания или для производства электроэнергии с помощью топливных элементов. Австралийский CSIRO подсчитал, что с точки зрения эффективности отдача аммиака составляет около 2094 Вт · ч / кг при преобразовании в водород и прохождении через топливный элемент PEM. Это примерно 19 процентов от 10 МВтч / т возобновляемой энергии, необходимой для производства аммиака.
Другой вариант — сжигать аммиак непосредственно в качестве топлива для горения , объединяя его с кислородом для высвобождения энергии, с газообразным азотом и водой, единственными продуктами выхлопа. Это не очень просто — аммиак не горит при более низких температурах, поэтому обычно необходимо использовать другое топливо для сжигания вместе. Кроме того, если процесс сгорания не управляется должным образом, он может выделять большое количество закиси азота, мощного парникового газа. Но если все сделано правильно, CSIRO рассчитывает, что он возвращает 2315 Вт · ч / кг, или 21 процент энергии, затрачиваемой на синтез аммиака.
Кроме того, если процесс сгорания не управляется должным образом, он может выделять большое количество закиси азота, мощного парникового газа. Но если все сделано правильно, CSIRO рассчитывает, что он возвращает 2315 Вт · ч / кг, или 21 процент энергии, затрачиваемой на синтез аммиака.
Третий вариант — использовать аммиак непосредственно в качестве топлива для высокотемпературных твердооксидных топливных элементов (ТОТЭ) , создавая электричество с азотом и водой в качестве побочных продуктов. Это намного эффективнее, возвращая 5 510 Втч / кг, или 50 процентов потребляемой энергии. Недостатком здесь является то, что технология SOFC является дорогой и, как правило, работает медленно, предлагая низкую удельную мощность, но можно запустить гибридную систему с одним топливным баком, преобразовывая процент аммиачного топлива в водород, когда требуется импульсная мощность.
Производство обычного аммиака: кошмар с выбросами
В настоящее время производство аммиака — грязный и энергоемкий процесс. Большая часть производимого сегодня водорода начинается с водорода из метанового газа парового риформинга. Извлечение этого природного газа из земли всегда вызывает утечку метана в атмосферу, где это невероятно мощный парниковый газ, а процесс парового риформинга не только требует много энергии, но и выделяет углекислый газ как часть реакции.
Большая часть производимого сегодня водорода начинается с водорода из метанового газа парового риформинга. Извлечение этого природного газа из земли всегда вызывает утечку метана в атмосферу, где это невероятно мощный парниковый газ, а процесс парового риформинга не только требует много энергии, но и выделяет углекислый газ как часть реакции.
Чтобы объединить эти молекулы h3 с молекулами N2, взятыми из атмосферы, вам необходимо разорвать прочные связи, удерживающие эти атомы азота вместе. Обычно это делается с использованием процесса Габера-Боша, который нагревает смесь двух газов до температуры выше 400 ° C (752 ° F) и создает в них давление примерно до 250 бар в присутствии железного катализатора для создания жидкого аммиака.
Излишне говорить, что стоимость энергии здесь огромна, и большая часть ее обычно поступает из ископаемого топлива. Поскольку аммиак производится в огромных количествах — это второй по величине химикат в мире — в настоящее время на него приходится около 2 процентов мирового потребления ископаемой энергии и связанных с этим выбросов. Добавьте к этому химическую переработку и неорганизованные выбросы метана, и аммиак станет самым большим загрязнителем в промышленном химическом производстве на милю страны.
Добавьте к этому химическую переработку и неорганизованные выбросы метана, и аммиак станет самым большим загрязнителем в промышленном химическом производстве на милю страны.
При текущих уровнях производства на аммиак приходится около 1 процента всех антропогенных выбросов парниковых газов, и отсюда производство только растет.
Устойчивое производство аммиака
Можно сократить выбросы от текущего процесса производства аммиака, заменив экологически чистую энергию на ископаемую энергию в процессе Габера-Боша и используя улавливание и хранение углерода для отделения и секвестрации большей части выбросов CO2 в процессе риформинга метана. Однако невозможно предотвратить утечку метана, поэтому этот «голубой аммиак» по-прежнему наносит ущерб окружающей среде. Это считается переходным этапом.
Поистине «зеленый аммиак» можно производить, используя возобновляемую энергию для получения водорода путем электролиза, а затем пропуская его по процессу Габера-Боша, также используя зеленую энергию. Это относительно неэффективное использование возобновляемых источников энергии, но оно дает вам действительно свободный от выбросов источник аммиака. Это считается среднесрочным решением.
Это относительно неэффективное использование возобновляемых источников энергии, но оно дает вам действительно свободный от выбросов источник аммиака. Это считается среднесрочным решением.
В стадии разработки находятся и другие полностью экологически чистые методы, в том числе технология « обратного топливного элемента », которая преобразует возобновляемую энергию, воду и воздух в аммиак без необходимости отдельного процесса электролиза водорода. Они начинают выглядеть довольно эффективными, но в настоящее время они все еще слишком медленны, чтобы производить колоссальные объемы аммиака, необходимые для текущих сельскохозяйственных целей, не говоря уже о том, чтобы обслуживать развивающийся рынок экологически чистого жидкого топлива.
Подобные электрохимические решения — вот где нужно сосредоточить внимание и деньги; они являются наиболее многообещающим путем к нулевым выбросам для этого колоссального промышленного сектора, что бы ни спорили традиционные компании, работающие на ископаемом топливе.
По сути, аммиак действительно может стать пригодным для использования чистым топливом. Но путь сюда не ясен. Необходимо проделать значительную работу по разработке и расширению новых методов производства зеленого аммиака, а с другой стороны, необходимо проделать значительную работу по разработке эффективных и действенных способов использования энергии, которую он хранит. Обе стороны этого уравнения также должны стать конкурентоспособными по стоимости, если необходимо заменить дешевое грязное дизельное топливо.
Но исследования в этих областях набирают обороты, и аммиак будет намного проще хранить, транспортировать и распространять с использованием существующих сетей и технологий, чем водород.
Будьте в курсе в удобном формате, присоединяйтесь: TG-канал и ВК
Source: New Atlas
Via: Loz Blain
Теги: АммиакВодородВодородные топливные элементыИсточники энергииПарниковые газы
Аммиак | это… Что такое Аммиак?
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта)
Аммиак почти вдвое легче воздуха, ПДКр.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Содержание
|
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- Ko=1,8·10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды.

Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
и в спиртах:
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- (гидрохлорид метиламмония)
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды.
 С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой:
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH При слабом нагревании эти комплексы разлагаются на металл и NH3.
При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³[2].
Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³[2].
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³[3]. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³[4]. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области[5].
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода — продукт (NH3*H2O), представляющий собой газообразный аммиак NН3, растворенный в воде.
Аммиачная вода — продукт (NH3*H2O), представляющий собой газообразный аммиак NН3, растворенный в воде.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
- + 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер)[6]. В промышленности аммиак осушают в абсорбционных колоннах.
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России расходуется в среднем 1200 нм³ природного газа, в Европе — 900 нм³ [7][8][9][10][11].
Белорусский «Гродно Азот» расходует 1200 нм³ природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 нм³.[12]
Украинские производители потребляют от 750 нм³[13] до 1170 нм³[14] природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну аммиака[15].
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами неизвестно.
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот»]] | 2 635 | 2 403,3 |
| ОАО НАК «Азот» | 1 526 | 1 514,8 |
| ОАО «Акрон» | 1 526 | 1 114,2 |
ОАО «Невинномысский азот», г. Невинномысск Невинномысск | 1 065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| КОАО «АЗОТ» | 854 | 957,3 |
| ОАО «Азот» | 869 | 920,1 |
| ОАО «Кирово-Чепецкий хим. комбинат» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| ООО «МенделеевскАзот» | — | — |
| Итого | 13 321,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака.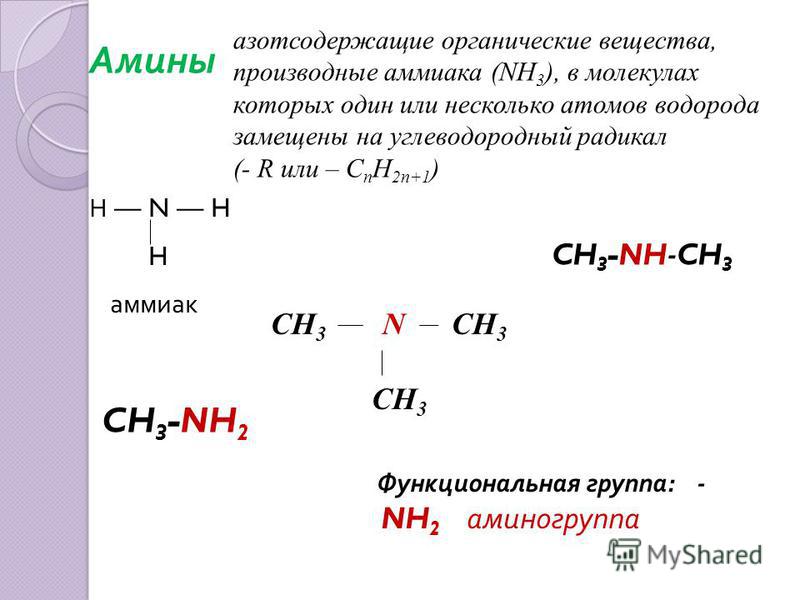 Россия — один из крупнейших мировых экспортеров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
Россия — один из крупнейших мировых экспортеров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
Производители аммиака на Украине
| Компания | 2007, тыс. т |
|---|---|
| Концерн «Стирол» | 1 331 |
| Одесский припортовый завод | 1 128 |
| Северодонецкое объединение Азот | 1 015 |
| « Азот» (Черкассы) | 778 |
| «Днепроазот» | 515 |
| «Ровноазот» | 382 |
| Итого | 5 148 |
Интересные факты
- Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелеными, ярко красные — черными.[16]
- Облака Юпитера состоят из аммиака.
- Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать.
 Например, приятный аромат приобретают астры[16]
Например, приятный аромат приобретают астры[16]
См. также
- Аммиакопровод
Примечания
- ↑ ГОСТ 6221-90. Аммиак жидкий технический. Технические условия
- ↑ http://www.rhbz.info/rhbz3.1.5.4.html Учебное пособие по РХБЗ. Характеристика аварийно химически опасных веществ
- ↑ ГОСТ 12.1.005-88. Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ↑ СанПиН 2.1.2.1002-00. Санитарно-эпидемиологические требования к жилым зданиям и помещениям
- ↑ «Известия». Наука
- ↑ Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. — М.: Мир, 1976. — 544 с.
- ↑ ФАКТОРЫ КОНКУРЕНТНОСТИ НА РЫНКЕ АММИАЧНО-НИТРАТНЫХ УДОБРЕНИЙ
- ↑ АММИАЧНЫЕ УСТАНОВКИ НА РОССИЙСКИХ ПРЕДПРИЯТИЯХ
- ↑ ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть I)
- ↑ ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть II)
- ↑ ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть III)
- ↑ Лукашенко потребовал ускорить модернизацию «Гродно Азота».
 21.by
21.by - ↑ Селитра аммиачная 095-2471996: Удар по гривне
- ↑ Селитра аммиачная 095-2471996: Наши химики — впереди российских
- ↑ Технология производства аммиака
- ↑ 1 2 Искусственное изменение окраски лепестков цветов. Удивительный мир растений
Ссылки
- Аммиак, газ // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммиак водный // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммониак // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммониемия // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- NIST Chemistry WebBook
- Искусственное изменение окраски лепестков цветов
Литература
- Ахметов Н. С. Общая и неорганическая химия.
 — М.: Высшая школа, 2001.
— М.: Высшая школа, 2001. - Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
- Акимова Л. Д. Изучающим основы холодильной техники. — М., 1996.
- Ельницкий А. П., Василевская Е. И., Шарапа Е. И., Шиманович И. Е. Химия. — Мн.: Народная асвета, 2007.
Nh4 (аммиак) измерения
- Önceki
- 1 картина 2
- Sonraki
Аммиак (Nh4) — это бесцветный, терпкий запах, ядовитый и едкий газ, тяжелее воздуха. Это химическое соединение, состоящее из азота и водорода. Даже аммиак (гидроксид аммония), разбавленный водой, очень агрессивен. Независимо от того, находится ли аммиак в газообразном или сжиженном виде, он вызывает ожоги при контакте с кожей и глазами. Когда аммиак смешивается с воздухом, он превращается в легковоспламеняющуюся смесь. Кроме того, газообразный аммиак соединяется с влагой в воздухе и едким газом (Nh4), который представляет собой комбинацию азота и водорода. Водорастворимый высокотоксичный остаточный продукт Nh4, который образуется в результате дезаминирования в основном аминокислот и других источников, таких как нуклеиновые кислоты и амины, осаждается на земле.
Это бесцветный газ с неприятным запахом, состоящий из аммиака, азота и водорода. Его химическая формула — Nh4. Хотя он не содержит ионов OH-, он проявляет слабые основные свойства.
Поскольку у него очень высокая скрытая теплота выделения газов, он также используется в качестве хладагента на промышленных объектах. Его молекулярная масса составляет 17,0304 1 г / моль, его температура кипения при давлении 33.34 атм составляет -239.81 ° C (78 К.). Поскольку он замерзает при -XNUMX градусах, он является газообразным при комнатной температуре. Форма молекулы — треугольная пирамида. Поскольку его молекулы полярны, он хорошо растворяется в воде.
Его используют на первом этапе при синтезе таких веществ, как аммиак, удобрения, лекарства, красители и отдушки. Аммиак также используется в чистящих средствах. Аммиак является токсичным веществом для живых существ, при его использовании необходимо соблюдать осторожность. Аммиак — это ковалентно связанное соединение. Это облигация неметалл + неметалл. Поскольку его молекулы полярны, он хорошо растворяется в воде. Молекулы аммиака образуют слабые водородные связи как с молекулами воды, так и между собой.
Поскольку его молекулы полярны, он хорошо растворяется в воде. Молекулы аммиака образуют слабые водородные связи как с молекулами воды, так и между собой.
По этой причине он хорошо растворяется в воде. При давлении 1 атм и 0 градусах 1 литр воды растворяет 1300 литров, а при 20 градусах 700 литров аммиака. В комнатных условиях содержание насыщенного раствора аммиака составляет 34 процента, а его плотность составляет 0,88 г / мл.
Коммерчески доступным аммиаком является гидроксид аммония, водный раствор аммиака.
Это бесцветный газ, состоящий из азота и водорода. У этого есть острый запах, который заставляет глаза людей слезиться и насморк. Это не жидкий газообразный аммиак, используемый в коммерческих целях, известный как аммиак. По сути, это гидроксид аммония, в котором аммиак растворяется в воде. Гидроксид аммония является очень сильной щелочью. Это очень полезно для уборки дома.
Газообразный аммиак получают двумя разными способами. В методе, обычно используемом в промышленности, азот и водород сжимаются и пропускаются через горячее железо или платину. Второй метод заключается в удалении дыма из труб заводов. Аммиак является одним из побочных продуктов, получаемых на газовых заводах.
Второй метод заключается в удалении дыма из труб заводов. Аммиак является одним из побочных продуктов, получаемых на газовых заводах.
Первоначально считалось, что он был построен возле храма Амона в 1770 годы, и именно поэтому он назывался аммиак, вдохновленный египетским богом Амоном. Аммиак получается как вторичный продукт на газовых и коксохимических заводах. Сегодня он синтетически получен из азота воздуха. Когда белки в организме человека и животных показывают распад, аммиак появляется и выделяется с мочой. При разложении белков животного и растительного происхождения небольшое количество аммиака выделяется в воздух.
Скрытая теплота газификации соединения аммиака очень высока, и он используется в качестве хладагента на промышленных предприятиях. Обычно он находится в форме газа в комнатных условиях. Кроме того, исходный материал используется для синтеза веществ при производстве аммиака, лекарств, красок, парфюмерии и удобрений. Кроме того, в моющих средствах используется аммиак, однако, поскольку аммиак является токсичным веществом для всего живого, его следует использовать осознанно. Очень легко растворим в воде. Газ аммиак вызывает отравление при вдыхании напрямую. Питье жидкостей, смешанных с аммиаком, также вызывает отравление. Симптомы отравления включают одышку, рвоту и диарею. Кроме того, газообразный аммиак вызывает отек легких и бронхит. Измерения, которые определяют количество аммиака в воздухе и жидкостях, проводятся уполномоченными лабораториями.
Очень легко растворим в воде. Газ аммиак вызывает отравление при вдыхании напрямую. Питье жидкостей, смешанных с аммиаком, также вызывает отравление. Симптомы отравления включают одышку, рвоту и диарею. Кроме того, газообразный аммиак вызывает отек легких и бронхит. Измерения, которые определяют количество аммиака в воздухе и жидкостях, проводятся уполномоченными лабораториями.
Наша компания также выполняет измерения аммиака (Nh4) в рамках измерений газа. В этих исследованиях соблюдаются соответствующие правовые нормы, стандарты и методы испытаний, опубликованные отечественными и зарубежными организациями. Аммиак, формула Nh4; представляет собой бесцветный, едкий и неприятный запах, состоящий из атома азота и атома водорода. Хотя он не содержит ОН-иона, он обладает отчетливым базовым свойством в воде. Молекула аммиака состоит из одного азота и трех атомов водорода.
Области применения следующие:
— краски
— парфюмерия
— Чистящие материалы
— Взрывчатка
— Производство удобрений
— промышленность
— производство азотной кислоты
— мочевина
— пластмассы
Зеленый Аммиак — замена водороду? / Хабр
На этой неделе я решил посмотреть, что происходит в методах хранения и использования водорода. Одна из тем с которой я пересекся это использования аммиака, как метода работы с водородом.
Одна из тем с которой я пересекся это использования аммиака, как метода работы с водородом.
В этой статье поговорим о том, в чем “засмес”, какие есть подводные камни и есть ли какие-то стартапы и компании, которые решают проблему в контексте устойчивого развития.
Что такого с водородом?
Вся история с водородом очень проста: если вы сжигаете водород, то вы получаете в качестве выхлопа воду (2h3 + О2 = 2Н2О) и тепло от сгорания.
В чем плюсы:
Нет выхлопа улгекислого газа и любых других вредных газов.
Выделяется много тепла на единицу массы. Удельная теплота сгорания примерно 140 Мдж на кг (у бензина около 40-45 МДж на кг).
Водород хорошо распространен в природе в форме соединений (в углеводородах и воде, например).
В чем минусы:
Водород занимает очень большой объем при комнатной температуре и атмосферном давлении, из-за этого на единицу объема у него очень маленькая энергоемоксть. При комнатных условиях в 1 литре водорода всего 0.
 08 грамм. Для практического применения его надо сжижать (-252 градуса), тогда его плотность увеличивается до примерно 70 грамм на литр. Сравните с 780 граммами на литр для бензина. В итоге бак на 100 литров водорода в криогенном состоянии (под -252 градусами) будет содержать примерно в 3 раза меньше энергии, чем бензиновый.
08 грамм. Для практического применения его надо сжижать (-252 градуса), тогда его плотность увеличивается до примерно 70 грамм на литр. Сравните с 780 граммами на литр для бензина. В итоге бак на 100 литров водорода в криогенном состоянии (под -252 градусами) будет содержать примерно в 3 раза меньше энергии, чем бензиновый.Криогеника означает усложнение хранения и транспортировке и затраты за сжижение (довольно сложное сжижение до низких температур), а так же контроль за давлением.
Водород является самым маленьким атомом и в газообразном виде имеет тенденцию проникать сквозь любые стенки, он пролезает через другие молекулы. Те водород медленно утекает даже из закрытого баллона через стенки.
Водород горит и образует взрывоопасную смесь с воздухом.
Существует 3 основных промышленных способа производства водорода —
Метановая конверсия паром подразумевает “обработку” метана в парах воды под высокой температурой и давлением.
 Таким образом получается относительно дешевый водород, одна проблема, на выходе мы имеем СО2. Весь цикл оказывается таковым, что проще было просто сжечь метан, получили бы меньше выхлопов углекислого газа. Сейчас более 75% объемов производства водорода делается таким образом. Большая надежда нефтегазовой отрасли состоит в том, чтобы делать водород именно таким образом и объявлять себя зелеными. Некоторые из нефтяников и газовиков на этом фоне хотят развивать технологии улавливания СО2 из результатов производства водорода и закачивания его обратно в пласт откуда взяли метан. Теоретически мы можем это СО2 там заблокировать на миллионы лет. Но возможно он все равно будет оттуда утекать.
Таким образом получается относительно дешевый водород, одна проблема, на выходе мы имеем СО2. Весь цикл оказывается таковым, что проще было просто сжечь метан, получили бы меньше выхлопов углекислого газа. Сейчас более 75% объемов производства водорода делается таким образом. Большая надежда нефтегазовой отрасли состоит в том, чтобы делать водород именно таким образом и объявлять себя зелеными. Некоторые из нефтяников и газовиков на этом фоне хотят развивать технологии улавливания СО2 из результатов производства водорода и закачивания его обратно в пласт откуда взяли метан. Теоретически мы можем это СО2 там заблокировать на миллионы лет. Но возможно он все равно будет оттуда утекать.Продувка водяного пара над раскаленным коксом. В целом идея так же, что и конверсией метана. На выходе углекислый газ и водород. В такой цепочке опять же это никакой не зеленый водород.
Электролиз. Это разложение воды на водород и кислород при помощи электричества. Сейчас на этот способ приходится 4% от объема производства водорода.
 Если электричество было добыто с низким углеродным следом, то и водород такой будет с низким углеродным следом.
Если электричество было добыто с низким углеродным следом, то и водород такой будет с низким углеродным следом.
Сейчас водород больше используется не как топливо, а как часть промышленной химии. Те пока эра водородной энергетики это какое-то возможное будущее. Но тк давление растет и есть отрасли, где очень трудно заменить ископаемое топливо, то на водород смотрят все больше, как на энергетическое топливо
При чем же тут аммиак
Аммиак это соединение 3 атомов водорода и азота. Особенность в том, что в таком виде водород “плотнее” упакован. Аммиак проще сжижается (при -36 градусах) и имеет более высокую плотность как газ (20 грамм на литр) и особенно как жидкость (680 грамм на литр, почти как бензин). А значит его проще сжижать и проще прокачивать в трубопроводах.
При сжигании аммиака в идеале можно получить только воду и азот. Правда сжигать аммиак довольно не просто, это требует специального механизма смешения с воздухом, присутствия катализаторов и контроля за образованием оксидов азота, которые ядовиты для людей. При этом аммиак выделяет не слишком много темпа на кг (18 Мдж на кг). Тогда в нашем сравнении с бензином аммиак лучше чистого водорода на 25-30%.
При этом аммиак выделяет не слишком много темпа на кг (18 Мдж на кг). Тогда в нашем сравнении с бензином аммиак лучше чистого водорода на 25-30%.
Другой вариант это использовать аммиак именно так механизм транспортировки водорода.
Но 80% аммиака на самом деле идет на производство удобрений, так что получение “зеленого” аммика” это и способ снизить углеродоемкость пищевой промышленности.
Промышленный метод производства аммиака сегодня это процесс Хабер-Бош, когда водород смешивают с азотом под высоким давлением и температурой в присутствии катализаторов. Процесс требует поддержания стабильным параметров и поэтому его трудно реализовать в рамках переменной мощности от возобновляемых источников.
Если бы могли найти иной дешевый способ генерации аммиака каким-то образом напрямую из воды и без процесса Хабер-Бош, мы могли бы получать готовый к транспортировке “зеленый” аммиак и затем и водород (через разложение аммиака).
В итоге интерес к аммиаку есть с трех направлений:
Зеленый аммиак для удобрений.

Аммиак как топливо в судах. Именно они сильнее всего рассматривают возможности аммиака и по первым прикидкам это более оптимальное решение, чем батереи или чем чистый водород. Для требуемого объема запаса энергии батареи слишком тяжелые, а чистый водород занимает слишком много места. Аммиак хуже, чем обычном топливо, но во всяком случае баки под него не слишком тяжелые, и занимают разумный объем судна.
Метод транспортировки самого водорода из мест его производства.
Стартапы и новости в области аммиака
Project HEGRA — проект в Норвегии по электрификации процесса производства аммика и полном функционировании на зеленой энергии. Это завод на 400 тыс тонн аммика в год. Довольно крупный проект.
Бизнесы связанные с проектом HEGRA (компания — wartsila) так же исследуют возможности использования аммика в двигателях внутреннего сгорания, а так же использования аммика в топливных ячейках. Пока результаты это общие слова.

Amogy — Ничего конкретного. Даже нечего обсуждать, просто рекламная страничка.
Jupiterionics — Идея базируется на электрохимическом производстве аммиака. Они базируют свою работу на прорыве в области электрохимического прямого производства аммиака. Между двумя электродами помещают смесь водорода, Li3N и специального обменного носителя. Под действием электрического тока, водород скапливается около отрицательного электрода, а Li3N у положительного. Носитель сначала имеет отрицательный заряд и мигрирует к Li3N, там происходит обмен атома водорода в носителе на атом лития. Носитель после этого мигрирует к отрицательному электроду, где производит обратный обмен, литий заменяется на водород. В итоге мы последовательно заменяем весь литий в соединении Li3N на водород и получаем Nh4 (аммиак). По заявлению создателей этот процесс происходит гораздо быстрее, чем аналогичные методы электролиза и позволяет избежать процесса Хабер-Бош. Для меня правда вопросы остаются в том, откуда они берут водород в самом начале.
 В итоге все это базируется на зеленом способе производитель электроэнергию. Но с другой стороны, если будет много дешевой энергии, то и процесс Хабер-Бош можно организовать на зеленой энергии, а стабильность снабжения обеспечить батареями. Стартап получил 2.65 млн австралийских долларов на развитие проекта и идеи в марте 2021 года.
В итоге все это базируется на зеленом способе производитель электроэнергию. Но с другой стороны, если будет много дешевой энергии, то и процесс Хабер-Бош можно организовать на зеленой энергии, а стабильность снабжения обеспечить батареями. Стартап получил 2.65 млн австралийских долларов на развитие проекта и идеи в марте 2021 года.Seaborg Technologies — хотят использовать ядерные реакторы на расплавах солей, размещенные на кораблях для производства водорода и аммиака. Хотя основной фокус просто на баржах с ядерными реакторами, как проект Академик Ломоносов.
Kapsom — фирма занимающаяся строительством химических заводов объявила, что сделала первый завод по зеленому аммиаку в Индии на 1500 тонн аммиака в год в 2020 году. Это конечно гораздо скромнее, чем 400 тыс тонн по проекту HERGA.
Yara — один из крупнейших производителей аммиака (и один из участников проекта HERGA) в апреле 2022 заказали 15 плавающих аммиачных терминала, как основу будущей системы заправки судов аммиаков.
 Это еще один признак большого изменения в индустрии. В рамках этого проекта Yara планирует сделать аммиак доступным для судов топливом к 2024 году.
Это еще один признак большого изменения в индустрии. В рамках этого проекта Yara планирует сделать аммиак доступным для судов топливом к 2024 году.
Выводы:
Пока аммиак как топливо выглядит как интересная идея, основной потенциал сосредоточен просто в “озеленении” производства обычного аммиака. Именно в этом направлении видны объемные инвестиции и реальный бизнес. Стоит ожидать, что там, где производят водород методом электролиза будет появляться и места производства аммиака.
Нам как инвесторам доступны компании работающие в этой области (wartsila, например есть на бирже), но сами стартапы пока на такой стадии, что обычного инвестору туда не войти.
От всей темы остается ощущение, что может быть много хайпа, но основной объем производства все равно будет связан со старым и скучным электролизом. Хотя на самом деле он не скучный, тк технология эффективного электролиза еще далека от совершенства и реальные затраты энергии значительно выше, чем теоретический минимум необходимый для разделения молекул.
Блог
Улавливание и хранение углекислого газа позволит относительно дешево производить углеродно-нейтральный аммиак
В настоящее время в правительстве обсуждаются пути монетизации запасов жирного газа полуострова Ямал. Рассматриваются различные варианты: разное соотношение СПГ и газопроводных поставок; разные схемы нефтехимических производств из жирных компонентов природного газа: строительство заводов по месту добычи или вывоз сырья в регионы, более близкие к рынкам сбыта. Уже в ближайший месяц ожидается итоговое решение.
Но в одном аспекте разночтений и разногласий нет: если мы говорим о монетизации запасов газа через газохимические производства, то есть, производства аммиака и метанола непосредственно из метана, их оправданно строить в регионе добычи, тем более, что частично можно использовать готовую инфраструктуру, связанную с проектами СПГ.
Кроме того, и капитальные затраты здесь ниже по сравнению с нефтехимическим производством. Cредняя стоимость инвестиций в производство аммиака находится на уровне $1 тыс. за тонну мощности, в то время как инвестиции в нефтехимическое производство составляют около $4 тыс. на тонну производимого продукта. Правда и цены на конечный продукт различаются примерно в той же пропорции.
Cредняя стоимость инвестиций в производство аммиака находится на уровне $1 тыс. за тонну мощности, в то время как инвестиции в нефтехимическое производство составляют около $4 тыс. на тонну производимого продукта. Правда и цены на конечный продукт различаются примерно в той же пропорции.
Поэтому главное отличие в том, что жирные компоненты природного газа относительно легко вывезти, а вывоз метана — это либо СПГ, а это уже сам по себе готовый продукт, либо достаточно дорогостоящий трубопроводный транспорт. В результате строительство газохимии непосредственно на Ямале оказывается единственным разумным решением.
Аммиак или СПГ?
Если говорить о конкретике, то о варианте производства аммиака на Ямале еще 15 марта написал «Коммерсантъ». Тогда речь шла о возможных трудностях при использовании российской технологии сжижения для проекта «Обский СПГ». Технология может быть заменена на технологию сжижения Linde или же проект может быть вообще перепрофилирован под производство аммиака, отмечало издание.
В апреле Леонид Михельсон заявил, что «Новатэк» планирует производство аммиака на Ямале — две линии по 2,2 млн т, одновременно или поэтапно.
При допущении расхода газа 1 тыс. кубометров на 1 т аммиака необходимо 2,2 млрд куб. м газовой добычи ежегодно на 2,2 млн т годовой мощности по аммиаку.
Для сравнения напомним, что мощность «Обского СПГ» составит до 5 млн т (7,5 млрд куб. м газа в год с учетом топливного газа). В то время как месторождения проекта пока могут обеспечивать 6 млрд куб. м добычи.
Таким образом, причины возможного перепрофилирования проекта, если оно действительно состоится, обусловлены, во-первых, трудностями в реализации СПГ-завода на российской технологии сжижения. Во-вторых, с возможным дефицитом сырья, хотя причина подобных разговоров может быть связана и с «торгом» по лицензиям на дополнительные месторождения.
Если же говорить без привязки к конкретным проекту и месторождениям, то по большому счету, газа на Ямале достаточно для самых различных вариантов его монетизации.
И если производство аммиака на Ямале будет создано, то оно может оказаться несколько дороже производств в более благоприятных регионах за счет логистических и климатических особенностей, как по капитальным, так и по операционным затратам. Это значит, что для обеспечения конкурентоспособности завод должен выигрывать в чем-то еще. Первое, сильное и самое очевидное преимущество — это сырьевой газ с низкой себестоимостью добычи и минимальными затратами на транспортировку.
Но с учетом влияния экологической повестки, есть основания предполагать, что оправданно наладить на Ямале производство «синего» аммиака, то есть продукта, где весь выделяемый при производстве углекислый газ подлежит захоронению.
«Зеленый» и «синий» аммиак
Действительно, уже сейчас по всему миру готовятся производства т. н. «зеленого» аммиака. Это аммиак из «зеленого» водорода, то есть получаемого электролизом с помощью ВИЭ.
«Зеленый» аммиак планируется использовать как в качестве бункерного топлива, так и в сегменте удобрений. По последним оценкам МЭА, в сильно декарбонизированном мире в 2050 году этот вид топлива будет преобладать в бункеровке.
По последним оценкам МЭА, в сильно декарбонизированном мире в 2050 году этот вид топлива будет преобладать в бункеровке.
К примеру, в Дании планируется производство «зеленого» аммиака мощностью в 1 ГВт, что соответствует объему аммиака в 900 тыс. т в год, это сопоставимо с классическим производством.
Альтернативой «зеленому» аммиаку является «синий» (иногда его называют «голубой») аммиак. Здесь производство будет основываться на классической схеме «метан — синтез-газ — водород + СО2«, но углекислый газ будет подлежать улавливанию и захоронению (CCS, carbon capture and storage).
Как и проекты по получению «зеленых» водорода и аммиака, проекты «синих» соединений окажутся дороже, вопрос насколько? Пока проектов CCS в мире очень немного, т. к. экономического смысла в них нет, особенно в условиях, когда стоимость выбросов углекислого газа отсутствует или невелика. По мере роста цен на выбросы и ужесточения углеродного регулирования их число увеличивается. Считается что стоимость улавливания и хранения углекислого газа составляет около $100 за тонну. Но это очень средние значения.
Но это очень средние значения.
Себестоимость CCS состоит из стоимости улавливания, транспортировки и захоронения углекислого газа. Основная составляющая в цене — себестоимость непосредственно улавливания углекислого газа. И главное здесь в том, что стоимость «захвата» тонны углерода с помощью технологий CCS может существенно разнится. И цена улавливания резко уменьшается для концентрированных потоков СО2.
Залог успеха — в дешевом CCS
Именно поэтому, когда обсуждается, что CCS «не взлетает» по причине дороговизны, речь идет часто об улавливании углекислого газа на ТЭС. Но в случае производства аммиака эти расходы намного ниже (до $25 за тонну по сравнению с $50-150 для ТЭС), см. рисунок 1.
Рисунок 1. Стоимость улавливания углекислого газа в зависимости от технологии. Источник: The Business Case for carbon capture. BCG.
С учетом минимальных расходов на транспортировку и хранение СО2, т. к. производство будет расположено в регионах газодобычи, суммарные расходы можно оценить менее $50 за тонну, а возможно и ниже.
При допущении расхода газа 1 тыс. кубометров на 1 т аммиака, получение тонны аммиака сопровождается примерно 2 т углекислого газа. В таком случае стоимость CCS в $50 за тонну увеличивает стоимость аммиака на $100 в дополнение к себестоимости производства «серого» продукта.
Себестоимость «серого» аммиака для разных проектов разнится т. к. зависит в том числе и от цены газа. Но глобальные цены на «серый» аммиак находятся в диапазоне $220 (2020 год) — 330 (1кв. 2021 г.) за тонну. Даже с учетом расходов на улавливание углекислого газа, «синий» аммиак окажется намного дешевле, чем самые оптимистичные варианты цены «зеленого» аммиака ($600+ за тонну).
Учитывая вышесказанное, можно предполагать, что ямальский «синий» аммиак будет конкурентоспособен на мировом рынке как «зеленого», так и «синего» аммиака.
Напомним, что представители «Новатэка» ранее уже высказывались о возможных проектах получения водорода на Ямале. А в январе 2021 года «Новатэк» подписал официальный меморандум о взаимопонимании в области производства и поставок водорода с компанией Uniper.
Но вопросы транспортировки водорода пока не решены. Танкерный вывоз (очень дорог за счет сжижения), равно как и подмешивание водорода в трубы (остается много технических и регуляторных вопросов) — варианты крайне длительной перспективы.
В этих условиях на среднесрочную перспективу единственным вариантом доставки водорода из удаленных локаций остается транспортировка в виде аммиака.
Правда, остается вопрос о наличии достаточного количества геологических структур для захоронения в ямальском, относительно новом, регионе добыче. В старых районах газодобычи, в частности, в Надым-Пур-Тазовском регионе таких возможностей больше, но для транспортировки необходим соответствующий трубопровод. В любом случае расстояния относительно невелики. С другой стороны, не исключено, что изначально производство аммиака будет «серым», с последующим выходом на «синий», по мере появления необходимых локаций на Ямале и создания глобального рынка углеродно-нейтрального аммиака.
RUPEC в Twitter, в Telegram, на Facebook
аммиак | Определение и использование
аммиак
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли Фриц Хабер Герхард Эртль
- Похожие темы:
- Процесс Габера-Боша нитрат аммония биогенный газ гидроксид аммония безводный аммиак
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
аммиак (NH 3 ) , бесцветный едкий газ, состоящий из азота и водорода. Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Использование аммиака
В основном аммиак используется в качестве удобрения. В Соединенных Штатах его обычно вносят прямо в почву из резервуаров, содержащих сжиженный газ. Аммиак также может быть в форме солей аммония, таких как нитрат аммония, NH 4 NO 3 , сульфат аммония, (NH 4 ) 2 SO 4 и различные фосфаты аммония. Мочевина, (H 2 N) 2 C=O, является наиболее часто используемым источником азота для удобрений во всем мире. Аммиак также используется в производстве коммерческих взрывчатых веществ (например, тринитротолуола [ТНТ], нитроглицерина и нитроцеллюлозы).
В текстильной промышленности аммиак используется при производстве синтетических волокон, таких как нейлон и вискоза. Кроме того, он используется при окрашивании и чистке хлопка, шерсти и шелка. Аммиак служит катализатором в производстве некоторых синтетических смол. Что еще более важно, он нейтрализует кислые побочные продукты нефтепереработки, а в резиновой промышленности предотвращает коагуляцию латекса-сырца во время транспортировки с плантации на фабрику. Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак служит катализатором в производстве некоторых синтетических смол. Что еще более важно, он нейтрализует кислые побочные продукты нефтепереработки, а в резиновой промышленности предотвращает коагуляцию латекса-сырца во время транспортировки с плантации на фабрику. Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак используется в различных металлургических процессах, включая азотирование листов сплава для упрочнения их поверхности. Поскольку аммиак легко разлагается с образованием водорода, он является удобным портативным источником атомарного водорода для сварки. Кроме того, аммиак может поглощать значительное количество тепла из окружающей среды (например, один грамм аммиака поглощает 327 калорий тепла), что делает его полезным в качестве хладагента в холодильном оборудовании и оборудовании для кондиционирования воздуха. Наконец, среди его второстепенных применений — включение в некоторые бытовые чистящие средства.
Наконец, среди его второстепенных применений — включение в некоторые бытовые чистящие средства.
Получение аммиака
Чистый аммиак был впервые получен английским ученым-физиком Джозефом Пристли в 1774 году, а его точный состав определил французский химик Клод-Луи Бертолле в 1785 году. Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота. N 2 + 3H 2 → 2NH 3
Эта реакция требует использования катализатора, высокого давления (100–1000 атмосфер) и повышенной температуры (400–550 °C [750–1020 °F]). Действительно, равновесие между элементами и аммиаком способствует образованию аммиака при низкой температуре, но для достижения удовлетворительной скорости образования аммиака требуется высокая температура. Можно использовать несколько различных катализаторов. Обычно катализатор представляет собой железо, содержащее оксид железа. Однако в качестве катализаторов использовались как оксид магния на оксиде алюминия, который был активирован оксидами щелочных металлов, так и рутений на угле. В лаборатории аммиак лучше всего синтезировать путем гидролиза нитрида металла.
мг 3 N 2 + 6H 2 O → 2NH 3 + 3Mg(OH) 2
Обычно катализатор представляет собой железо, содержащее оксид железа. Однако в качестве катализаторов использовались как оксид магния на оксиде алюминия, который был активирован оксидами щелочных металлов, так и рутений на угле. В лаборатории аммиак лучше всего синтезировать путем гидролиза нитрида металла.
мг 3 N 2 + 6H 2 O → 2NH 3 + 3Mg(OH) 2
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Физические свойства аммиака
Аммиак — бесцветный газ с резким резким запахом. Его температура кипения составляет -33,35 ° C (-28,03 ° F), а температура замерзания составляет -77,7 ° C (-107,8 ° F). Он имеет высокую теплоту испарения (23,3 кДж на моль при температуре кипения), и с ним можно обращаться как с жидкостью в термоизолированных контейнерах в лаборатории. (Теплота испарения вещества – это количество килоджоулей, необходимое для испарения одного моля вещества без изменения температуры.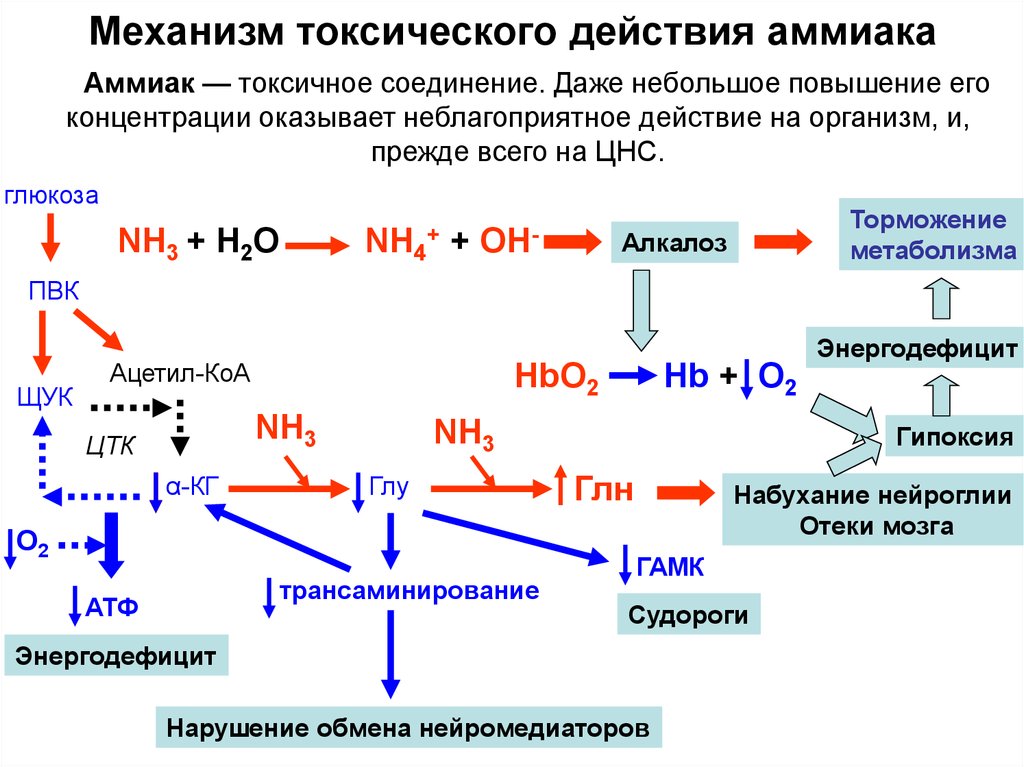 ) Молекула аммиака имеет форму тригональной пирамиды с тремя атомами водорода и неподеленной парой электронов, присоединенной к атом азота. Это полярная молекула, и она сильно ассоциирована из-за сильных межмолекулярных водородных связей. Диэлектрическая проницаемость аммиака (22 при -34 ° C [-29°F]) ниже, чем у воды (81 при 25 °C [77 °F]), поэтому он является лучшим растворителем для органических материалов. Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель. Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
2NH 3 ⇌ NH 4 + + NH 2 −
) Молекула аммиака имеет форму тригональной пирамиды с тремя атомами водорода и неподеленной парой электронов, присоединенной к атом азота. Это полярная молекула, и она сильно ассоциирована из-за сильных межмолекулярных водородных связей. Диэлектрическая проницаемость аммиака (22 при -34 ° C [-29°F]) ниже, чем у воды (81 при 25 °C [77 °F]), поэтому он является лучшим растворителем для органических материалов. Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель. Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
2NH 3 ⇌ NH 4 + + NH 2 −
Химическая активность аммиака
Сгорание аммиака протекает с трудом, но дает газообразный азот и воду.
4НХ 3 + 3O 2 + тепло → 2N 2 + 6H 2 O
Однако при использовании катализатора и при правильных температурных условиях аммиак реагирует с кислородом с образованием оксида азота NO, который окисляется до диоксида азота NO 2 и используется в промышленном синтезе азотной кислоты.
Аммиак легко растворяется в воде с выделением тепла. NH 3 + H 2 O ⇌ NH 4 + + OH − Эти водные растворы аммиака являются основными и иногда называются растворами гидроксида аммония (NH 4 OH). Однако равновесие таково, что 1,0-молярный раствор NH 3 дает только 4,2 миллимоля гидроксид-иона. Гидраты NH 3 · H 2 O, 2NH 3 · H 2 O и NH 3 · 2H 2 O существуют и, как было показано, состоят из молекул аммиака и воды, связанных межмолекулярными связями. водородные связи.
Жидкий аммиак широко используется в качестве неводного растворителя. Щелочные металлы, а также более тяжелые щелочноземельные металлы и даже некоторые внутренние переходные металлы растворяются в жидком аммиаке, образуя растворы синего цвета. Физические измерения, в том числе исследования электропроводности, свидетельствуют о том, что этот синий цвет и электрический ток обусловлены сольватированным электроном. металл (дисперсный) ⇌ металл(NH 3 ) x ⇌ M + (NH 3 ) x + e − (NH 3 ) y Эти растворы являются отличными источниками электронов для восстановления других химических соединений. По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 е − (NH 3 ) у ⇌ e 2 (NH 3 ) 7 у 7
Большинство солей аммония также легко растворяются в жидком аммиаке.
металл (дисперсный) ⇌ металл(NH 3 ) x ⇌ M + (NH 3 ) x + e − (NH 3 ) y Эти растворы являются отличными источниками электронов для восстановления других химических соединений. По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 е − (NH 3 ) у ⇌ e 2 (NH 3 ) 7 у 7
Большинство солей аммония также легко растворяются в жидком аммиаке.
Вода и воздух — это все, что вам нужно для производства аммиака — одного из самых важных химических веществ в мире
Джейк Джейкобс, The Conversation
Более зеленые удобрения идут к вам. Предоставлено: Джеймс Т.М. Товилл, CC BY-SA.
Предоставлено: Джеймс Т.М. Товилл, CC BY-SA.Исследователи разработали метод получения аммиака просто из воздуха и воды. Он не только более энергоэффективен, чем столетний процесс Габера-Боша, который в настоящее время используется во всем мире, но и более экологичный.
Аммиак – состоит из трех частей водорода и одной части азота (или NH 3 ) – оказала огромное влияние на общество. По оценкам, без массового производства этого химического вещества треть из нас не выживет. Это связано с тем, что его основное использование — производство удобрений, которые помогли повысить урожайность и поддерживать большую популяцию.
Разработанный в 1909 году процесс Габера-Боша, который часто называют самым важным изобретением 20-го века, включает нагревание очищенных газообразных азота и водорода при очень высокой температуре и давлении в присутствии железного катализатора. Необходимо наличие катализатора, который не участвует в реакции, но снижает энергетический порог реакции. Несмотря на это, производство аммиака – около 140 млн тонн в 2012 году – потребляет почти 2% мировых энергоресурсов.
Необходимо наличие катализатора, который не участвует в реакции, но снижает энергетический порог реакции. Несмотря на это, производство аммиака – около 140 млн тонн в 2012 году – потребляет почти 2% мировых энергоресурсов.
Помимо больших энергетических потребностей для достижения условий реакции, текущий метод производства неэффективен, поскольку для него требуется газообразный водород, который получают путем переработки природного газа. Побочным продуктом процесса является углекислый газ. Стюарт Лихт и его коллеги из Университета Джорджа Вашингтона считали, что они могли бы добиться большего успеха, если бы нашли способ использовать воду вместо природного газа в качестве источника водорода.
Предыдущие попытки объединить воду (состоящую из двух частей водорода и одной части кислорода) с воздухом (который состоит из 78% азота) для образования аммиака были менее успешными. Решение Лихта состояло в том, чтобы пропускать влажный воздух через смесь крошечных частиц оксида железа и расплавленных химикатов (состоящих из гидроксидов натрия и калия), которые были поражены электричеством.
Любая химическая реакция представляет собой обмен электронами между атомами. В этом случае эти электроны необходимы, чтобы отделить водород от воды, а затем соединиться с азотом. «При подаче электричества оксид железа захватывает электроны, позволяя воде и воздуху напрямую реагировать с образованием аммиака», — сказал Лихт.
Этот метод утверждает, что использует только две трети энергии процесса Габера-Боша. Наряду с устранением необходимости производить водород из природного газа общие выбросы снижаются довольно значительно. Весь процесс также происходит в более мягких условиях, не требующих температуры 450°C и давления, в 200 раз превышающего атмосферное, как в процессе Габера-Боша.
Это не все, что делает метод Лихта привлекательным. Часть энергии поступает с помощью другой технологии, разработанной Лихтом, которая называется солнечным термоэлектрохимическим производством или STEP. Он считается одним из самых эффективных солнечных элементов, используемых в настоящее время.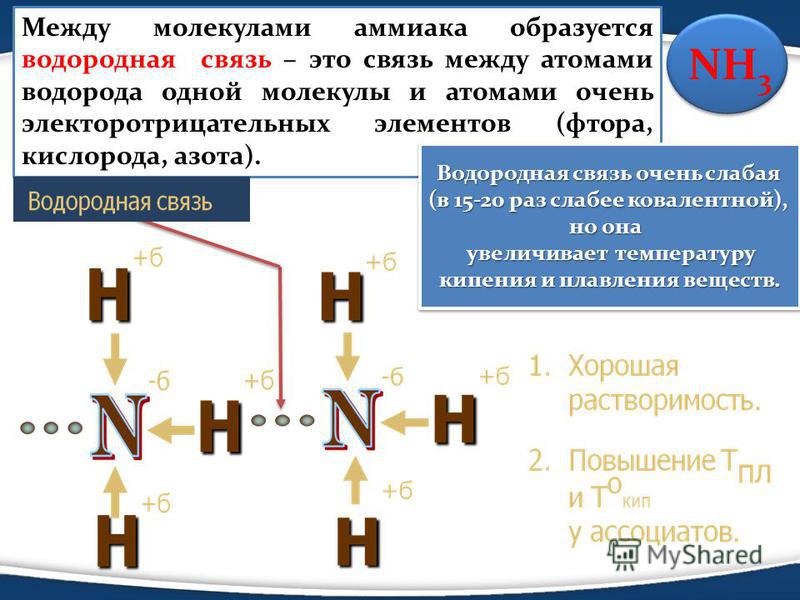 STEP при производстве аммиака приводит к производству водорода в качестве побочного продукта.
STEP при производстве аммиака приводит к производству водорода в качестве побочного продукта.
По словам Дэвида Фермина, профессора электрохимии Бристольского университета, этот побочный продукт подойдет для водородных топливных элементов, еще одного популярного направления для энтузиастов чистой энергии. «Водород, полученный таким образом, значительно чище», — сказал он.
Однако одно дело — хвастаться успехами химического производства в лабораториях, и совсем другое — воспроизвести его в промышленных масштабах. Лихт признает, что есть возможности для улучшения, но он уверен, что это сработает. У Фермина есть предостережение, чтобы добавить: «Прежде чем переходить к полномасштабному масштабированию, потребуется лучшее понимание механизма этой сложной реакции переноса нескольких электронов».
Но даже с методом Лихта, как указывает Фермин, мы далеки от того, чтобы воспроизвести естественную эффективность преобразования азота из воздуха в полезные химические вещества, что делают азотфиксирующие бактерии. «Что действительно примечательно, так это то, что природа делает это невероятно эффективно при низких температурах», — добавил Фермин.
«Что действительно примечательно, так это то, что природа делает это невероятно эффективно при низких температурах», — добавил Фермин.
И все же, если что-то более эффективное сможет заменить процесс Габера-Боша, это снизит затраты энергии на производство одного из самых важных химических веществ в мире и приведет к заметному сокращению глобальных выбросов CO 2 .
Узнать больше
Ученые обнаружили канал, используемый катализатором для производства аммиака, жизненно важного для пищевых и топливных культур
Дополнительная информация: «Синтез аммиака с помощью N2 и паровой электролиз в суспензиях расплавленных гидроксидов наноразмерного Fe2O3», S. Licht et al. Science, www.sciencemag.org/lookup/doi/ … 1126/science.1254234
Источник: Разговор
Эта история опубликована с разрешения The Conversation (под Creative Commons-Attribution/Без производных).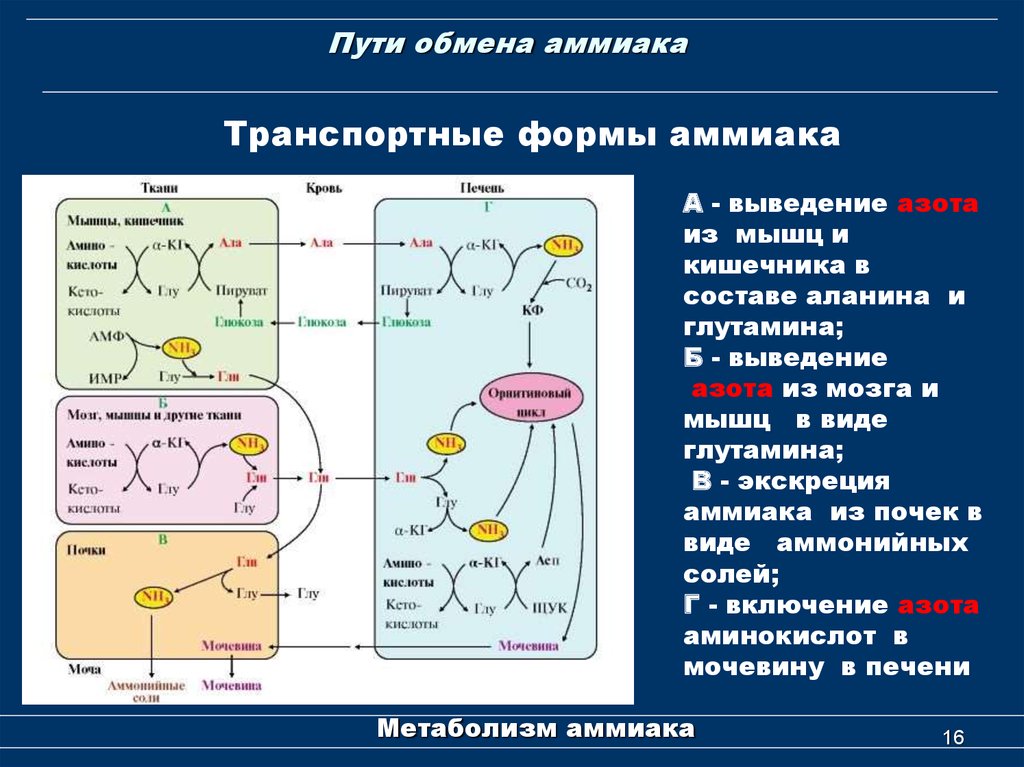
Цитата : Вода и воздух — это все, что вам нужно для производства аммиака — одного из важнейших химических веществ в мире (8 августа 2014 г.) получено 2 октября 2022 г. с https://phys.org/news/2014-08-air-ammoniaone-world-important-chemicals.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Безводный аммиак: управление рисками
Название
(AE1149, пересмотрено в сентябре 2021 г.)
Файл
Файл публикации:
AE1149 — Безводный аммиак: управление рискамиРезюме
Безводный аммиак потенциально может стать одним из самых опасных химических веществ, используемых сегодня в сельском хозяйстве. Он используется и хранится под высоким давлением, что требует специально разработанного и обслуживаемого оборудования. Те, кто работает с безводным аммиаком, должны быть обучены точному соблюдению процедур обращения с ним.
Он используется и хранится под высоким давлением, что требует специально разработанного и обслуживаемого оборудования. Те, кто работает с безводным аммиаком, должны быть обучены точному соблюдению процедур обращения с ним.
Ведущий автор
Ведущий автор:
Джон Новацки, специалист по сельскохозяйственным машинам
Доступность
Доступность:
Только Интернет
Разделы публикаций
Введение
Химия безводного аммиака
Характеристики безводного аммиака
Давление при хранении
Уровни воздействия на организм человека
Взаимосвязь между температурой и давлением
Температура/давление00003
Безводная
Каустическая природа
Типы воздействия
Кожа
Глаза
Легкие легкие
Призывы к воде + вода + вода
Транспортировка в медицинское оборудование
Uncondoldled
оборудование для Anhymy -Amyyy -Amyyy -Amyyy -Amyyy -Amyyy -Amyyy -Amyyy -Amyyy -Amyyy -Ampemy -Ampemy.
Защитное оборудование для хранилищ сыпучих материалов
Контроль безопасности заправочного бака
Выпускные клапаны
Шланг заправочного бака
Заправочный бак
Датчики и клапаны медсестры
Медсестра.
Правила для замков вспомогательных резервуаров и контейнеров для хранения безводного аммиака
Краткое изложение
Ссылки
Введение
Безводный аммиак используется в качестве удобрения в Северной Дакоте больше, чем любой другой источник азотных удобрений. Безводный аммиак классифицируется как опасное вещество. Большинство аварий с безводным аммиаком происходит из-за неконтролируемых выбросов. Немногие проблемы возникают, когда аммиак обрабатывается и применяется по назначению. Большинство неконтролируемых выбросов происходит из-за неправильных процедур, небрежности или неподготовленности рабочих или неисправного оборудования. По закону требуется наличие защитного оборудования при работе с безводным аммиаком или его применении. Ношение защитного снаряжения значительно снижает вероятность травм от выброса аммиака. Бесчисленные тонны безводного аммиака вносятся каждый год без проблем; безопасные процедуры и качественное оборудование работают.
Ношение защитного снаряжения значительно снижает вероятность травм от выброса аммиака. Бесчисленные тонны безводного аммиака вносятся каждый год без проблем; безопасные процедуры и качественное оборудование работают.
Безводный аммиак может стать одним из самых опасных химикатов, используемых сегодня в сельском хозяйстве. Он используется и хранится под высоким давлением, что требует специально разработанного и обслуживаемого оборудования. Те, кто работает с безводным аммиаком, должны быть обучены точному соблюдению процедур обращения с ним.
Химия безводного аммиака
Аммиак представляет собой химическое соединение, используемое в качестве удобрения, поскольку оно богато азотом. Его химическая формула – Nh4, что означает, что он состоит из одного атома азота и трех атомов водорода на молекулу. Поскольку атомные массы азота и водорода неодинаковы, весовое соотношение составляет 82,5% азота к 17,5% водорода. Безводный означает, что аммиак не содержит воды. Это отличает его от растворов аммиак/вода.
Характеристики безводного аммиака
Запах
Безводный аммиак представляет собой прозрачный бесцветный газ при стандартных условиях температуры и давления и имеет очень характерный запах. Запах является самой сильной характеристикой безопасности продукта. При концентрации всего 50 частей на миллион (ppm) один запах говорит о том, что находится в воздухе. Обычно запах отталкивает человека от этого места. Концентрация более 5000 частей на миллион выводит человека из строя, так что побег становится невозможным и возникает удушье.
Давление для хранения
Безводный аммиак представляет собой жидкость при сжатии или охлаждении. Он хранится под давлением, чтобы предотвратить испарение, поэтому для использования может быть доступен большой объем. Один кубический фут безводного аммиака в жидком состоянии дает 855 кубических футов газообразного аммиака. Резервуары для розничного хранения и питающие резервуары для безводного аммиака сконструированы таким образом, чтобы выдерживать внутреннее давление не менее 250 фунтов на квадратный дюйм (psi).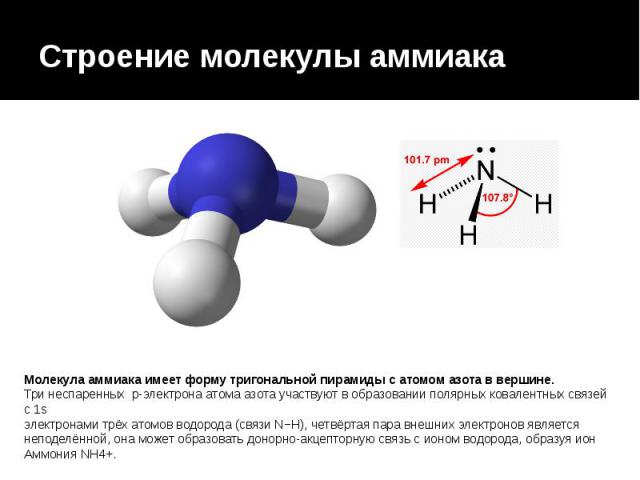 Резервуары терминала охлаждают аммиак до минус 28 градусов по Фаренгейту. При этой температуре давление хранения составляет менее 1 фунта на кв. дюйм.
Резервуары терминала охлаждают аммиак до минус 28 градусов по Фаренгейту. При этой температуре давление хранения составляет менее 1 фунта на кв. дюйм.
Уровни воздействия и организм человека
| Экспозиция (частей на миллион) | Воздействие на организм | Допустимая экспозиция |
|---|---|---|
| 50 частей на миллион | Обнаружено большинством людей | Отсутствие повреждений от длительного или многократного воздействия |
| 134 частей на миллион | Раздражение носа и горла | Максимальная экспозиция восемь часов |
| 700 частей на миллион | Кашель, сильное раздражение глаз, может привести к потере зрения | Максимальная экспозиция один час |
| 1700 частей на миллион | Серьезное повреждение легких, смерть без лечения | Воздействие не допускается |
| 2000 частей на миллион | Пузыри на коже и ожоги в течение нескольких секунд | Воздействие не допускается |
| 5000 частей на миллион | Удушье в течение минут | Воздействие не допускается |
Взаимосвязь между температурой и давлением
При высвобождении безводного аммиака при сжатии в резервуаре для хранения (200 фунтов на кв. дюйм) в атмосферу (0 фунтов на кв. дюйм) температура падает со 100 F до минус 28 F. При этой температуре аммиак обморожение вызывает ожоги кожи человека при контакте. Одежда фактически примерзает к коже. Поскольку безводный аммиак хранится под высоким давлением, внезапный разрыв может привести к выбросу аммиака на расстояние от 10 до 20 футов от точки выброса.
дюйм) в атмосферу (0 фунтов на кв. дюйм) температура падает со 100 F до минус 28 F. При этой температуре аммиак обморожение вызывает ожоги кожи человека при контакте. Одежда фактически примерзает к коже. Поскольку безводный аммиак хранится под высоким давлением, внезапный разрыв может привести к выбросу аммиака на расстояние от 10 до 20 футов от точки выброса.
Воспламеняемость
| градусов Фаренгейта | Давление (psi) |
|---|---|
| -28 Ф | 0 фунтов на кв. дюйм |
| 0 Ф | 16 фунтов на кв. дюйм |
| 32 Ф | 48 фунтов на кв. дюйм |
| 60 Ф | 93 фунт/кв. дюйм |
| 100 Ф | 200 фунтов на кв. дюйм |
Безводный аммиак обычно не считается воспламеняющимся опасным продуктом, поскольку его температура воспламенения превышает 1560 градусов по Фаренгейту, а смесь аммиака и воздуха должна содержать от 16% до 25% паров аммиака для воспламенения.
Несмотря на сложность воспламенения такой смеси, никогда не приваривайте емкости или трубопроводы, которые не были полностью обеззаражены и очищены от всего аммиака и его солей. Помните, никогда не сваривайте закрытый контейнер любого типа; все контейнеры должны быть полностью очищены и вентилированы. Нагревайте только открытые контейнеры, включая все трубопроводы. Сварка должна выполняться только сварочной фирмой с сертификацией типа «R» в соответствии с Кодексом века Северной Дакоты.
Безводный
Безводный аммиак не содержит воды. Безводный — это греческое слово, означающее «без воды». Безводный аммиак имеет очень сильное сродство к воде. Требуется большое количество воды, чтобы нейтрализовать его едкое воздействие на влажные участки тела. Когда безводный аммиак контактирует с водой, он образует гидроксид аммония. Живая ткань быстро обезвоживается, а клетки разрушаются при контакте. Безводный аммиак поражает любую влажную часть тела: глаза, уши, нос, горло, бронхи, легкие, любую влажную кожу. Любая ткань, содержащая влагу, подвергается химическому сжиганию.
Любая ткань, содержащая влагу, подвергается химическому сжиганию.
Caustic Nature
При контакте безводного аммиака с водой образуется щелочь, которая химически сжигает ткани животных. Химическое вещество проникает в ткани тела, если оно не разбавлено большим количеством воды. Безводный аммиак чрезвычайно губителен для тканей животных. По мере прогрессирования химического ожога кожа превращается в липкое, липкое вещество. Кожа, которая химически сожжена аммиаком, на самом деле погибает и не способна зажить или заменить себя. Поврежденная ткань должна быть удалена хирургическим путем, чтобы заживление могло продолжаться. Результаты часто обезображивают.
Типы воздействия
Кожа
Безводный аммиак вызывает замерзание и химический ожог, если кожа и одежда влажные. Минусовая температура выходящего безводного аммиака примораживает одежду к телу. Не пытайтесь снимать примерзшую к коже одежду. Сначала его нужно разморозить, иначе кожа пострадавшего может быть оторвана.
Едкая природа безводного аммиака вызывает ожоги кожи и тканей, подобные ожогам от тепла. Не наносите мази, кремы или мази любого рода на травму. Горение каустика можно остановить только разбавлением большим количеством воды.
Глаза
Глаза постоянно омываются влагой. Безводный аммиак будет искать эту влагу. Ожоги приведут к повреждению глаз, например, к катаракте, глаукоме, и, возможно, к необратимой потере зрения и обезображиванию.
Если глаза подверглись воздействию безводного аммиака, их необходимо немедленно и постоянно промывать водой, а пострадавшего следует немедленно доставить к врачу. Каждый, кто работает с безводным аммиаком, должен всегда носить с собой бутылку пресной воды на 6 или 8 унций. Этого небольшого количества воды хватит только на то время, пока рабочий сможет добраться до большего количества воды, но это может привести к разнице между слепотой и зрением.
Вначале может потребоваться принудительное открытие век жертвы после облучения. Аммиак, оставшийся под веками, необходимо смыть водой, иначе он продолжит вызывать ожоги глаза и связанных с ним тканей.
Аммиак, оставшийся под веками, необходимо смыть водой, иначе он продолжит вызывать ожоги глаза и связанных с ним тканей.
Легкие
При низких концентрациях запах безводного аммиака обычно заставляет незащищенного рабочего покинуть место происшествия. При более высоком уровне концентрации (см. Таблицу 2) рабочий может не убежать, не вдохнув опасной дозы. Вся дыхательная система очень влажная, поэтому безводный аммиак будет естественным образом притягиваться к этой части тела. При вдыхании концентрированного уровня безводного аммиака он быстро обжигает дыхательную систему. Пострадавшему может быть слишком больно, чтобы дышать. Дыхательная система по существу может быть парализована из-за боли.
Спасатели, оказывающие первую помощь, могут быть не в состоянии вылечить серьезное ингаляционное воздействие. Медицинские работники могут дать кислород для облегчения дыхания после прибытия на место происшествия. Поддержание адекватного дыхания пострадавшего до доставки в медицинское учреждение может быть затруднено.
Защита органов дыхания чрезвычайно важна, но также ограничена доступным оборудованием. Респиратор с двумя картриджами эффективен только при уровнях воздействия менее 300 частей на миллион. Респираторы канистрового типа могут быть эффективны в течение более длительного времени при более высоких концентрациях, но без защиты кожи ходить через облако аммиака, как правило, не рекомендуется. Автономный
дыхательный аппарат (SCBA), который подает воздух для дыхания, и герметичный защитный костюм химзащиты необходимы для работы в облаке вытекающего безводного аммиака. Что-либо меньшее не защитит человека в достаточной степени в этой ситуации.
Вызов первой помощи Вода + Вода + Вода
Немедленно начните оказание первой помощи, если кто-то подвергается воздействию безводного аммиака. Химическое ожоги начинаются мгновенно, и со временем травма становится хуже. Лечение заключается в промывании пораженных участков тела большим количеством воды.
Одной короткой промывки недостаточно. Поддерживайте постоянный поток воды над пораженным участком(ами) до тех пор, пока пострадавшему не будет оказана медицинская помощь. Воды, поставляемой с каждым питательным резервуаром или другим контейнером, будет недостаточно. Пять галлонов, вытекающих ручьем размером с карандаш, будут длиться примерно семь минут. Дополнительную воду следует перевозить на каждом тракторе, используемом в полевых работах, и на каждом автомобиле полевой поддержки. Соберите как можно больше воды и продолжайте промывать, пока принимаются меры для транспортировки пострадавшего в медицинское учреждение. Не используйте воду повторно; он не принесет облегчения, так как уже впитал безводный аммиак.
Поддерживайте постоянный поток воды над пораженным участком(ами) до тех пор, пока пострадавшему не будет оказана медицинская помощь. Воды, поставляемой с каждым питательным резервуаром или другим контейнером, будет недостаточно. Пять галлонов, вытекающих ручьем размером с карандаш, будут длиться примерно семь минут. Дополнительную воду следует перевозить на каждом тракторе, используемом в полевых работах, и на каждом автомобиле полевой поддержки. Соберите как можно больше воды и продолжайте промывать, пока принимаются меры для транспортировки пострадавшего в медицинское учреждение. Не используйте воду повторно; он не принесет облегчения, так как уже впитал безводный аммиак.
Транспортировка в медицинское учреждение
Принять меры для транспортировки пострадавшего к врачу или в больницу сразу после воздействия. Во время подготовки к транспортировке можно оказать первую помощь, но как можно скорее доставьте пострадавшего к врачу. Сообщите в больницу, что пострадавшего перевозят. Оказание первой помощи следует продолжать во время транспортировки.
Оказание первой помощи следует продолжать во время транспортировки.
Неконтролируемые выбросы
Облака безводного аммиака подвержены непредсказуемости движения воздуха; они изменят направление так же быстро, как ветер. Облака аммиака могут быть почти невидимы в некоторых атмосферных условиях, но они выглядят как белые облака, когда атмосфера влажная. Дождь поглотит аммиак и удалит его из воздуха.
Безводный аммиак тяжелее воздуха и оседает в низинах окружающего ландшафта, например, в дорожных канавах, болотах и долинах. Людей в районах, находящихся под угрозой, необходимо предупредить о выбросе и рекомендовать покинуть этот район до тех пор, пока выброс не будет взят под контроль и район не будет считаться безопасным для повторного входа. Эти решения должны приниматься аварийным персоналом, например, местной пожарной службой. Животные и домашний скот должны быть удалены из угрожаемой зоны после того, как в первую очередь позаботятся о людях. Большинство животных сделают все возможное, чтобы покинуть это место задолго до того, как концентрация аммиака станет достаточно высокой, чтобы причинить им сильный дискомфорт.
Средства защиты от безводного аммиака
Из-за серьезности воздействия безводного аммиака средства индивидуальной защиты должны содержаться в хорошем состоянии. Это включает в себя невентилируемые очки; резиновые перчатки; респиратор; прочная рубашка с длинными рукавами; и длинные штаны.
Защитные очки и перчатки должны храниться в контейнере для защитного снаряжения, установленном на каждом питающем баке и доступном с земли. Наличие другого комплекта на тракторе – отличная идея. Подходящие перчатки изготовлены из резины, непроницаемы для аммиака и имеют длинные манжеты, которые следует отвернуть назад, чтобы предотвратить стекание капель по руке, когда руки подняты. Посадка должна быть достаточно свободной для легкого снятия, но достаточно плотной для хорошей защиты.
Аварийное снаряжение (только для эвакуации) включает противогаз, защитный костюм или плащ и резиновые сапоги.
Защитные очки должны быть закрыты, чтобы безводный аммиак не попал в глаза. Только защитные очки невентилируемого типа минимизируют воздействие аммиака на глаза. Очки с вентиляцией пестицидного типа не подходят , поскольку аммиак может проходить через непрямые вентиляционные отверстия. Ни в коем случае нельзя использовать защитные очки с открытой вентиляцией.
Только защитные очки невентилируемого типа минимизируют воздействие аммиака на глаза. Очки с вентиляцией пестицидного типа не подходят , поскольку аммиак может проходить через непрямые вентиляционные отверстия. Ни в коем случае нельзя использовать защитные очки с открытой вентиляцией.
Респиратор, оснащенный картриджами с безводным аммиаком, одобренный Национальным институтом безопасности и гигиены труда (NIOSH), предназначен только для низких уровней воздействия, не превышающих 300 частей на миллион. Этот тип респиратора не способен защитить человека от сильного воздействия.
Одежда должна быть прочной и из плотной ткани. Легкие и тонкие ткани не замедляют и не препятствуют прохождению безводного аммиака. Манжеты и воротник одежды должны быть плотно закрыты, чтобы ограничить попадание безводного аммиака.
Пять галлонов свежей чистой воды должны храниться в аварийном резервуаре для воды на питающем баке и доступном с земли в соответствии с Кодексом века Северной Дакоты. Еще 5 галлонов должны храниться на тракторе для использования, когда вода в питающем баке может быть затруднена или заканчивается. Эту воду следует менять ежедневно, чтобы она оставалась чистой. Грязная вода не может течь через шланг резервуара, препятствуя лечению воздействия.
Еще 5 галлонов должны храниться на тракторе для использования, когда вода в питающем баке может быть затруднена или заканчивается. Эту воду следует менять ежедневно, чтобы она оставалась чистой. Грязная вода не может течь через шланг резервуара, препятствуя лечению воздействия.
Каждый работник должен носить с собой пластиковую бутылку с пульверизатором на 6 или 8 унций в кармане рубашки для первой промывки глаз. Его следует использовать немедленно, и он предназначен для того, чтобы дать жертве время добраться до запаса объемом 5 галлонов.
Защитное оборудование для бестарных хранилищ
Для бестарного хранения безводного аммиака требуется дополнительное защитное оборудование. Дождевой костюм и два противогаза канистрового типа требуются по закону Кодекса века Северной Дакоты. Они защитят вас только в местах с низкой концентрацией аммиака. Респиратор картриджного типа не одобрен для использования на складе сыпучих материалов.
В случае крупной утечки позвоните в местную пожарную службу. В пожарной части есть автономные дыхательные аппараты (SCBA) и защитные костюмы. Устройства SCBA подают воздух для дыхания, а не просто фильтруют имеющийся воздух. Защитные костюмы герметизированы, чтобы не допустить попадания безводного аммиака.
В пожарной части есть автономные дыхательные аппараты (SCBA) и защитные костюмы. Устройства SCBA подают воздух для дыхания, а не просто фильтруют имеющийся воздух. Защитные костюмы герметизированы, чтобы не допустить попадания безводного аммиака.
Резервуар для воды объемом не менее 150 галлонов чистой воды должен быть доступен на складе, чтобы человек мог погрузиться в воду, если он подвергнется воздействию безводного аммиака. Минимум 150-галлонный резервуар для воды будет соответствовать этому требованию.
Поддерживайте информационные наклейки на оборудовании в актуальном состоянии. На наклейках указано, что делает каждый компонент системы, и указаны вода для оказания первой помощи, другое защитное оборудование и защитные процедуры.
Храните руководство по эксплуатации установки для хранения сыпучих материалов в легкодоступном месте для справки при обращении с аммиаком. При необходимости просмотрите инструкции.
Проверка безопасности заправочного бака
Выпускные клапаны
Выпускной клапан используется для выпуска или слива безводного аммиака под давлением из закрытого шланга или клапана.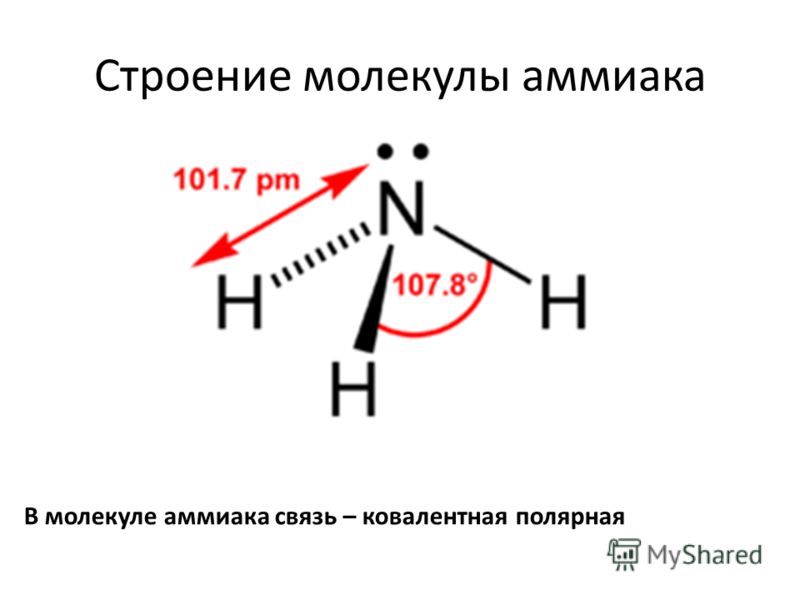
Выпускной клапан
Открытие выпускного клапана приведет к медленному выпуску безводного аммиака под давлением, чтобы свести к минимуму риск внезапного выброса и воздействия. Спускные клапаны следует открывать медленно. Всегда располагайтесь против ветра или против ветра от выпускного клапана, который нужно открыть. Никогда не отсоединяйте шланг заправочного резервуара, не спустив его предварительно с помощью выпускного клапана. Спускные клапаны используются в нескольких процессах обращения с безводным аммиаком.
Шланг заправочного бака
Шланг заправочного бака следует проверять ежедневно. Он должен поддерживаться в безопасном состоянии, потому что он перекачивает безводный аммиак под высоким давлением из заправочного резервуара на инструментальную планку аппликатора. Несмотря на то, что шланг защищен переливным клапаном в клапане отбора жидкости на питающем баке, шланг должен быть в хорошем состоянии, чтобы предотвратить неконтролируемый выброс.
КОНТРОЛЬНЫЙ СПИСОК БЕЗОПАСНОСТИ ДЛЯ ШЛАНГА ЗАПРАВОЧНОГО БАКА
Проверьте шланг заправочного бака по всем следующим пунктам.
- Порезы или ссадины
- Мягкие пятна/выпуклости
- Пузырящиеся/рыхлые слои
- Перегиб/сплющивание
- Соскальзывание муфты/шланга
- Тип фурнитуры (неподходящие металлы)
- Устаревший шланг
Если присутствует какой-либо из пунктов контрольного списка, следует заменить шланг заправочного резервуара.
Шланг заправочной цистерны должен быть изготовлен из разрешенных материалов и иметь оплетку, например вискозу, нейлон/кевлар или нержавеющую сталь. Шланг из вискозы годен в течение двух лет с даты изготовления, шланг из нейлона/кевлара годен в течение четырех лет с даты изготовления, а шланг из нержавеющей стали годен в течение шести лет с даты изготовления.
Шланг медсестры. Шланг заправочного бака должен иметь этикетку, на которой указаны следующие элементы: тип шланга (например, «НЕЙЛОН»), рабочее давление (например, «350 PSI MAX WP»), дата изготовления («1991») и идентификационный номер производителя. (например, «TFI-167-DE2»).
(например, «TFI-167-DE2»).
Шланг заправочного бака всегда должен быть «запаркован» или присоединен к «парковочному» штуцеру Acme на заправочном баке, когда он не используется в течение сезона. Не наматывайте шланг на любой край, который позволяет шлангу стать плоским. В межсезонье шланг следует хранить в вертикальном положении, свисая с плеча муфты, в прохладном, сухом месте.
Большинство поломок шланга происходит в пределах 12 дюймов от конца шланга из-за изгиба шланга при подсоединении к заправочному баку или аппликатору. Выбирайте шланговые фитинги, которые обеспечат наибольшую поддержку и сведут к минимуму такое изгибание. Внимательно осмотрите шланг перед подсоединением, чтобы найти проблемы, которые могут привести к выходу шланга из строя.
Резервуар медсестры
Бак должен соответствовать рекомендациям по проектированию, предоставленным Американским национальным институтом стандартов (ANSI). Резервуар и все его фитинги, включая сварные швы, фитинги, манометры, шланги, предохранительные клапаны и дозирующие устройства, должны выдерживать минимальное рабочее давление 250 фунтов на квадратный дюйм.
Бак для аппликатора и клапаны. Манометр находится в верхней части бака на одном конце. Рядом с ним находится предохранительный предохранительный клапан, за которым следуют клапан отвода жидкости, паровой клапан, фиксированный указатель уровня жидкости и клапан заполнения жидкостью. Поплавковый указатель уровня жидкости находится на боковой стороне резервуара.
Заправочный бак и клапаны. Клапан отвода жидкости с присоединенным шлангом находится в верхней части бака на одном конце. Рядом с i находится клапан заполнения жидкостью, за которым следуют манометр, фиксированный клапан уровня жидкости, паровой клапан и поплавковый датчик уровня жидкости. Предохранительный клапан находится на другом конце в верхней части бака, а слив в нижней части бака.
Резервуар должен быть окрашен в серебристый или белый цвет для снижения температуры и давления, возникающих в результате солнечного нагрева. Поверхностные дефекты, такие как ржавчина, вмятины и выбоины, снижают целостность резервуара как сосуда высокого давления и недопустимы. Кодекс Северной Дакоты века указывает, что менее 10% поверхности могут быть подвержены коррозии или отсутствовать краска.
Кодекс Северной Дакоты века указывает, что менее 10% поверхности могут быть подвержены коррозии или отсутствовать краска.
Шланг заправочного бака должен иметь «парковочный фитинг» Acme, на котором можно «стоять», когда он не используется. Фитинг должен быть установлен в таком положении, чтобы исключить натяжение шланга, когда он «припаркован».
Резервуар должен иметь правильную маркировку с каждой стороны и с зеленым ромбом вокруг слов DOT (Министерство транспорта) «НЕГОРЮЧИЙ ГАЗ», а также с каждой стороны и заканчиваться буквами «Безводный аммиак» высотой не менее 2 дюймов. На баке должны быть инструкции по технике безопасности и оказанию первой помощи. Все клапаны должны быть идентифицированы для работы с жидкостью или паром.
Законодательство Северной Дакоты требует, чтобы на дорогах общественного пользования на цистернах для безводного аммиака, пустых или полных, отображался либо знак медленно движущегося транспортного средства (SMV), либо вращающийся или мигающий желтый свет. Для любого транспортного средства или буксируемого прицепа/фургона со знаком SMV разрешена скорость не более 25 миль в час. Поэтому цистерны-заправщики безводного аммиака нельзя буксировать со скоростью, превышающей 25 миль в час.
Для любого транспортного средства или буксируемого прицепа/фургона со знаком SMV разрешена скорость не более 25 миль в час. Поэтому цистерны-заправщики безводного аммиака нельзя буксировать со скоростью, превышающей 25 миль в час.
Комплект защитного снаряжения, включающий перчатки и защитные очки, должен быть прикреплен к резервуару и доступен с земли. Резервуар для аварийной воды также должен быть присоединен к питающему резервуару и заполнен 5 галлонами чистой пресной воды. Воду следует менять не реже одного раза в день, поскольку она может поглощать аммиак из окружающей среды.
КОНТРОЛЬНЫЙ СПИСОК БЕЗОПАСНОСТИ ПОДАЮЩЕГО БАКА
Проверьте заправочный бак, чтобы определить, все ли следующие элементы в порядке.
- Краска
- Ржавчина
- Вмятины
- Долото
- Парковочный штуцер для шланга
- Наклейки DOT
- Наклейки с безводным аммиаком
- Таблички безопасности
- Наклейки для оказания первой помощи
- Наклейки с маркировкой клапана
- Медленно движущийся знак
- Комплект безопасности (перчатки, очки)
- Вода для оказания первой помощи
Манометры и клапаны заправочного бака
Необходимо регулярно проводить плановое техническое обслуживание, чтобы убедиться, что датчики и клапаны заправочного бака пригодны для эксплуатации. Степень опасности увеличивается по мере старения деталей. Перед каждым использованием необходимо проводить визуальный осмотр.
Степень опасности увеличивается по мере старения деталей. Перед каждым использованием необходимо проводить визуальный осмотр.
Срок службы некоторых компонентов питающего резервуара ограничен временем. Срок службы не может быть продлен. Используйте контрольный список, чтобы вести точную инвентаризацию, когда детали необходимо заменить. При обнаружении дефекта компонента его необходимо отремонтировать или заменить.
КОНТРОЛЬНЫЙ СПИСОК БЕЗОПАСНОСТИ ДЛЯ КЛАПАН ПИТАТЕЛЬНОГО РЕЗЕРВУАРА И ДАТЧИКА
Проверьте следующие детали питающего резервуара, чтобы убедиться, что они в порядке.
- Клапан отбора жидкости (замена через 5 лет)
- Перепускной клапан (замена через 5 лет)
- Клапан заполнения жидкостью (замена через 5 лет)
- Манометр
- Клапан возврата пара (замена через 5 лет)
- Поплавковый указатель уровня жидкости
- Гидростатический предохранительный клапан
- Выпускные клапаны
- Клапан сброса давления/предохранительный (замена через 5 лет)
- Каркас для клапанов/манометров
- Слив бака
Если какие-либо элементы контрольного списка не в порядке, их следует заменить.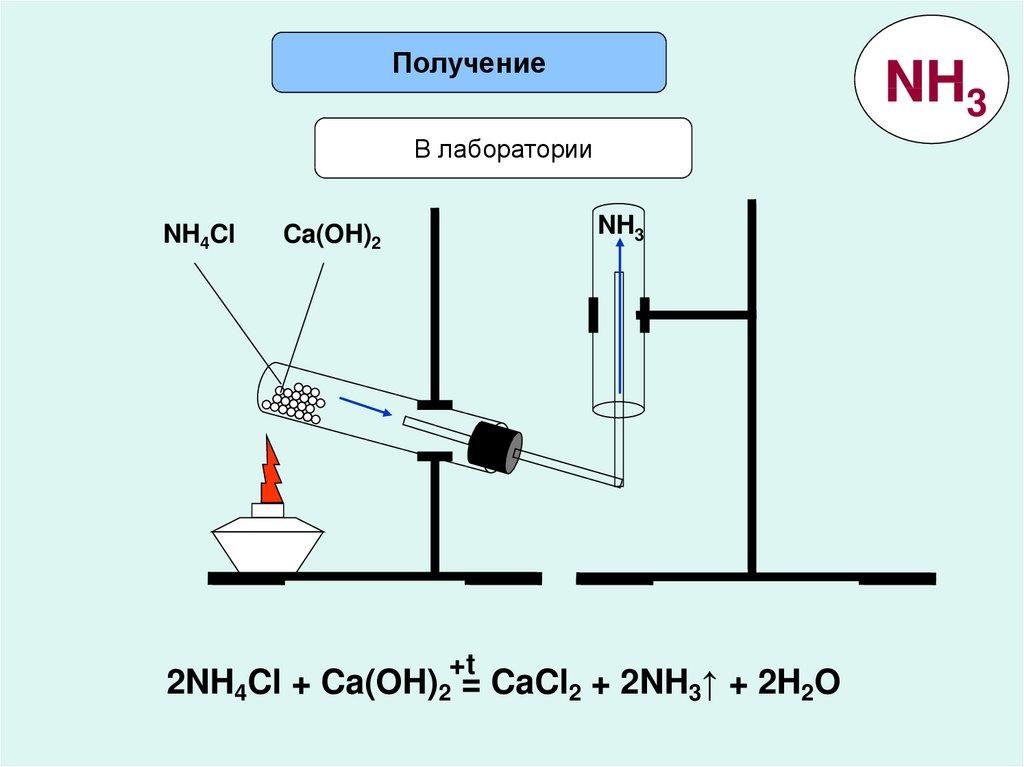
Клапан для отвода жидкости соединяет шланг заправочного бака с внутренней частью заправочного бака для удаления аммиака. Впускное отверстие для этого клапана достигает дна бака, так что жидкий аммиак будет откачиваться до тех пор, пока бак не станет почти пустым. Он содержит перепускной клапан, предотвращающий слишком быстрое вытекание безводного аммиака из резервуара в случае разрыва шланга питающего резервуара. Переливной клапан подлежит замене через пять лет.
Перепускной клапан
Клапан заполнения жидкостью используется при заполнении питающего резервуара из хранилища. Он имеет перепускной клапан, предотвращающий вытекание безводного аммиака обратно из питающего резервуара в случае разрыва шланга. Этот клапан подлежит замене в течение пяти лет.
Манометр показывает внутреннее давление в питающем баке. На это внутреннее давление влияет количество и температура безводного аммиака в резервуаре. Манометр не имеет ограничения по сроку службы, поэтому его необходимо заменять только тогда, когда он не работает должным образом.
Фиксированный указатель уровня жидкости представляет собой выпускной клапан с трубкой, уходящей в бак на глубину, при которой бак будет заполнен жидкостью на 85%.
Стационарный уровнемер жидкости
Клапан должен быть частично открыт при наполнении бака, чтобы из него вытекал или выплескивался жидкий безводный аммиак , когда бак заполнен на 85 %. Манометр точен только в том случае, если бак находится на одном уровне. Не продолжайте заполнять бак после того, как клапан выпустит жидкий безводный аммиак.
Клапан возврата паров используется при заполнении питающего резервуара на складе сыпучих материалов. По мере того, как жидкий безводный аммиак переносится в питающий резервуар, пары из вспомогательного резервуара передаются в резервуар для хранения. Паровой клапан имеет перепускной клапан (требуется замена через пять лет). Переливной клапан предотвращает выброс паров безводного аммиака из питающего резервуара, если паровой клапан выходит из строя.
Гидростатический предохранительный клапан следует использовать везде, где может скапливаться безводный аммиак в любой секции трубопроводов жидкости или пара системы.
Гидростатический предохранительный клапан
Он открывается при давлении 365 фунтов на квадратный дюйм, чтобы сбросить избыточное давление из-за расширения жидкости.
Поплавковый указатель уровня жидкости показывает уровень жидкого безводного аммиака в резервуаре.
Поплавковый датчик
Фиксированный указатель уровня жидкости следует использовать для определения 85% полного уровня при заполнении резервуара вместо поплавкового указателя уровня жидкости.
Предохранительный клапан также известен как предохранительный клапан. Этот клапан находится в верхней части бака и предотвращает повышение избыточного давления в баке, вызванное переполнением или расширением от тепла.
Клапан сброса давления
Клапан открывается прямо в атмосферу, когда давление в резервуаре достигает 250–265 фунтов на квадратный дюйм, и закрывается, когда внутреннее давление падает ниже 250 фунтов на квадратный дюйм. Его необходимо заменять каждые пять лет, если у него неметаллические седла, и каждые пять лет проводить испытания вместо замены, если у него металлические седла. Ремонт может выполняться только ремонтной организацией с действующим сертификатом авторизации «VR» от Национального совета инспекторов котлов и сосудов под давлением. Этот клапан должен иметь защитный колпачок, чтобы предотвратить повреждение от влаги и коррозии. Предохранительный клапан не регулируется, и его следует заменить, если он не работает.
Его необходимо заменять каждые пять лет, если у него неметаллические седла, и каждые пять лет проводить испытания вместо замены, если у него металлические седла. Ремонт может выполняться только ремонтной организацией с действующим сертификатом авторизации «VR» от Национального совета инспекторов котлов и сосудов под давлением. Этот клапан должен иметь защитный колпачок, чтобы предотвратить повреждение от влаги и коррозии. Предохранительный клапан не регулируется, и его следует заменить, если он не работает.
Вращающийся манометр, установленный на конце бака безводного аммиака, наливного бака, питающего бака или бака аппликатора , состоит из погружной трубки внутри бака и выпускного клапана.
Вращающийся манометр. Манометр включает в себя трубку со стрелкой на одном конце. Трубка поворачивается вместе со стрелкой. Рядом с стрелкой находится циферблатный индикатор, показывающий процентное содержание безводного аммиака в баке.
Этот датчик используется для определения фактического уровня безводного аммиака в баке. Он точен только в том случае, если бак стоит горизонтально. Индикатор показывает уровень жидкости в резервуаре, когда выпускной клапан открыт, а ручка повернута до точки, когда жидкость брызнет из выпускного клапана.
Он точен только в том случае, если бак стоит горизонтально. Индикатор показывает уровень жидкости в резервуаре, когда выпускной клапан открыт, а ручка повернута до точки, когда жидкость брызнет из выпускного клапана.
Обратные клапаны, входящие в состав хранилища наливных грузов, используются для контроля направления потока безводного аммиака при разгрузке автомобильной или железнодорожной цистерны, предотвращая обратный поток из наливной цистерны в грузовую или железнодорожную цистерну.
Обратный клапан
Поток в неправильном направлении приводит к защелкиванию клапана. Он открывается только при правильном направлении потока.
Аварийный запорный клапан — это другой клапан, отсутствующий на баке заправочной жидкости или аппликатора .
Клапан аварийного отключения. Клапан имеет тросовое крепление для дистанционного срабатывания, рабочий рычаг и тарельчатый клапан.
Он также является частью хранилища, используемого для остановки потока безводного аммиака, когда оператор объекта обнаруживает аварийную ситуацию и решает немедленно остановить перекачку безводного аммиака.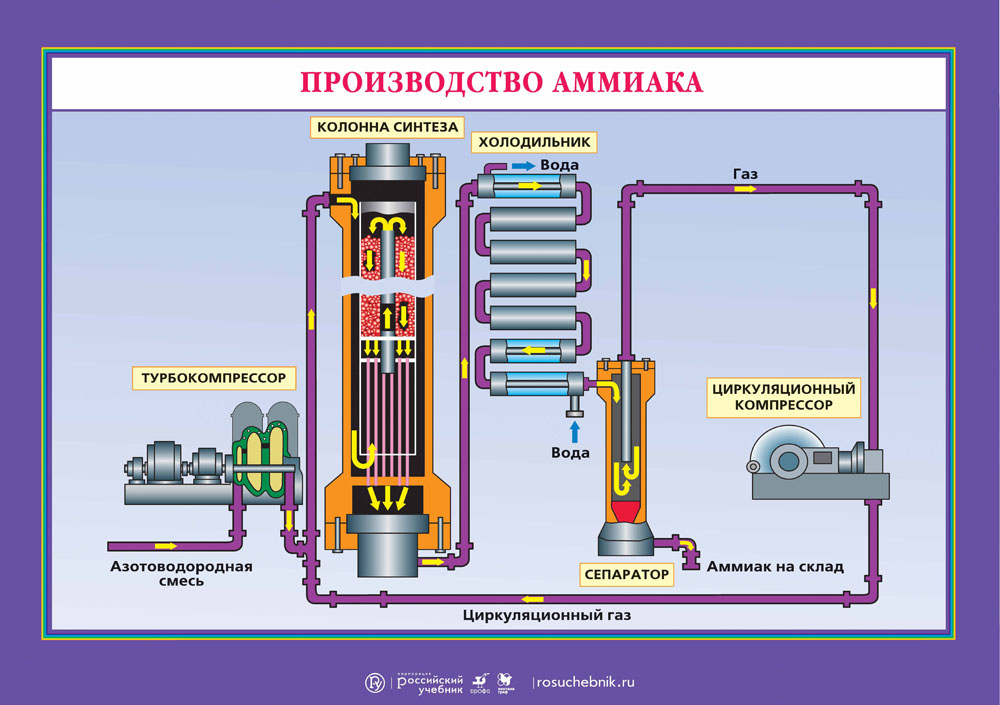 Этот клапан находится на стороне нагнетания перекачивающего насоса.
Этот клапан находится на стороне нагнетания перекачивающего насоса.
Каркас безопасности защищает манометры и клапаны в случае опрокидывания питающей цистерны. Каркас безопасности должен быть достаточно прочным, чтобы предотвратить повреждение датчиков и клапанов.
Ходовая часть питательного резервуара
Ходовую часть питательного резервуара следует проверять перед каждым использованием.
КОНТРОЛЬНЫЙ СПИСОК БЕЗОПАСНОСТИ ХОДОВОЙ МАШИНЫ РЕЗЕРВУАРА
Проверьте ходовую часть цистерны наполнителя, чтобы убедиться, что все следующие элементы в порядке.
- Сцепной палец и предохранительный зажим
- Страховочные цепи и крюки
- Затяжка гаек на колесах
- Давление в шинах
- Хорошие шины
- Прочная рама, без трещин
- Колеса свободного качения
- Правильное рулевое управление
- Защита бака
Использование предохранительного зажима на цапфе сцепного устройства при буксировке заправочных цистерн безводного аммиака по дороге и вне ее необходимо для вашей безопасности и безопасности окружающих. Предохранительный зажим не даст сцепному штифту вывернуться и высвободить питательный бак.
Предохранительный зажим не даст сцепному штифту вывернуться и высвободить питательный бак.
Всегда прикрепляйте страховочные цепи при буксировке заправочных цистерн безводного аммиака по дорогам общего пользования. Цепи безопасности требуются по закону Северной Дакоты. Предохранительный зажим не даст сцепному штифту вывернуться и высвободить питательный бак. Цепи помогают гарантировать, что транспортное средство, буксирующее питательную цистерну, сохранит контроль над питательной цистерной, если сцепной штифт выйдет из строя.
Проверяйте давление воздуха в шинах каждый раз, когда используется заправочный бак, и осматривайте их на наличие порезов, ушибов и износа протектора. Шины, используемые на цистернах-заборщиках, предназначены для движения на малой скорости, не превышающей 25 миль в час. Соблюдайте ограничения скорости для безводного аммиака как на дороге, так и вне ее.
Осматривайте раму фургона-цистерны перед каждым использованием. проверка на наличие трещин, разрывов сварных швов и погнутых элементов. Болты и гайки, которыми бак крепится к раме, особенно подвержены ослаблению или поломке.
Болты и гайки, которыми бак крепится к раме, особенно подвержены ослаблению или поломке.
Ступичные подшипники следует проверять и заменять ежегодно. Системы рулевого управления необходимо регулярно проверять и смазывать.
Компоненты аппликатора безводного аммиака
Разрывная муфта предназначена для предотвращения неконтролируемого высвобождения, когда заправочный бак выходит из аппликатора и шланг заправочного бака отделяется.
Разрывная муфта. Гнездовой соединитель закреплен в монтажном кронштейне. Стопорные шарики и уплотнительное кольцо расположены в месте соединения с охватываемой муфтой.
Подпружиненный клапан закрывается, когда муфта отделяется от основного корпуса, чтобы предотвратить вытекание безводного аммиака из шланга или аппликатора. Разрывная муфта устарела и имеет срок службы 3 года. Дата замены указана на муфте.
Выполните следующие действия, чтобы снова подсоединить разрывную муфту:
- Наденьте перчатки и защитные очки из аварийного комплекта на баке заправочной жидкости.
 Убедитесь, что аварийная вода доступна.
Убедитесь, что аварийная вода доступна. - Проверьте направление ветра. Всегда стойте против ветра при работе с аммиачным оборудованием, чтобы пары аммиака сдувались от вас.
- Поднимите шланг с земли и поместите его на бак или аппликатор, чтобы он не мешал при повторном присоединении заправочного бака и аппликатора.
- Выполните необходимый ремонт или замену сцепки и снова прикрепите заправочный бак к аппликатору, используя предохранительный зажим на сцепном штифте и страховочные цепи заправочного бака.
- Закройте клапан забора жидкости заправочного бака, клапан шланга заправочного бака и расходомер аппликатора. Незакрытие любого из этих клапанов может привести к опасному выбросу аммиака.
- Направьте конец шланга от себя и закройте клапан на конце шланга. Направьте выпускное отверстие от лица и медленно откройте выпускной клапан.
- Встаньте так, чтобы ваше лицо не касалось отверстия выпускного клапана на разъемной муфте. Медленно откройте выпускной клапан на разъемном соединителе.
 Держите выпускные клапаны открытыми, пока не будут выполнены все соединения. Жидкий аммиак в шланге может испаряться и создавать давление в шланге после закрытия клапанов шланга.
Держите выпускные клапаны открытыми, пока не будут выполнены все соединения. Жидкий аммиак в шланге может испаряться и создавать давление в шланге после закрытия клапанов шланга. - Откройте запорный клапан расходомера аппликатора, чтобы предотвратить повышение давления в системе расходомера аппликатора.
- После слива аммиака из шланга и корпуса разъемной муфты очистите конец шланга и фитинг разъемной муфты от грязи и мусора. Почва или мусор могут мешать работе системы измерения расхода аппликатора.
- Вставьте муфту с наружной резьбой (штуцер на конце шланга) обратно в муфту с внутренней резьбой блока разъемной муфты. Убедитесь, что соединители надежно закреплены.
- Закройте расходомер аппликатора и все открытые выпускные клапаны.
- Когда будете готовы, откройте клапан забора жидкости из питающего бака и клапан на конце шланга. Если все соединения затянуты и не протекают, замените перчатки и защитные очки в аварийном комплекте бака заправочной емкости.

Следуйте инструкциям для вашего предохранительного клапана, если они отличаются от инструкций, перечисленных выше. Однако никогда не изменяйте письменные инструкции, изменяя или исключая шаги.
Средства безопасности следует проверять каждый раз перед использованием оборудования в полевых условиях.
КОНТРОЛЬНЫЙ СПИСОК БЕЗОПАСНОСТИ КОМПОНЕНТОВ АППЛИКАТОРА
Проверьте ходовую часть заправочного бака, чтобы убедиться, что все следующие элементы в порядке.
- Быстроразъемное соединение (срок службы 3 года)
- Штифт предохранительной сцепки
- Цепь безопасности прикреплена
- Клапан запорного механизма и элементы управления
- Состояние ножа аппликатора
- Ножи не подключены
- Все фитинги герметичны
- Трубки низкого давления в хорошем состоянии (без порезов и т. д.)
- Надежно свернутые трубки низкого давления
- Отсутствие провисов в витках труб низкого давления
- Отсутствие перегибов в трубках низкого давления
- Коллектор безопасный и установленный уровень
- Регулятор работает нормально
- Экран регулятора чистый
Всегда используйте сцепной штифт с предохранительным зажимом, чтобы быть уверенным, что заправочный бак не отсоединится от аппликатора, а аппликатор не отсоединится от трактора.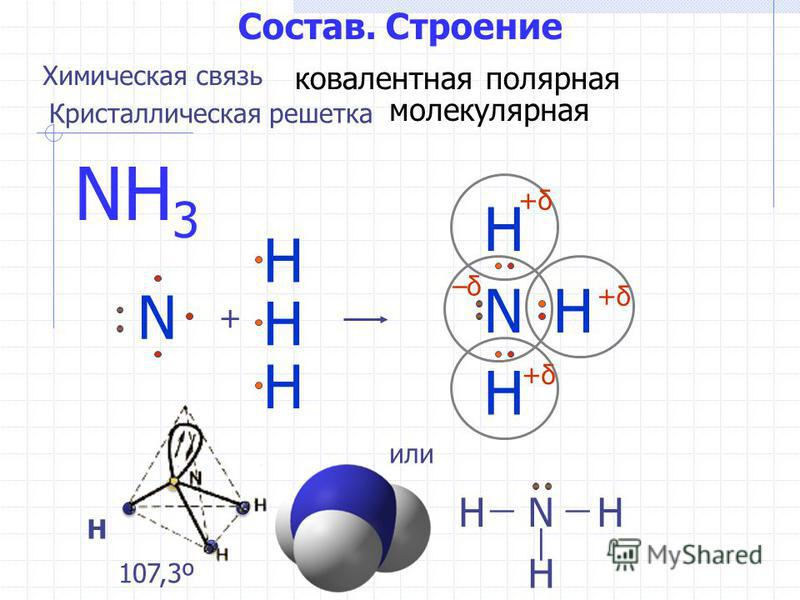 Используйте страховочные цепи при перемещении оборудования по дорогам общего пользования.
Используйте страховочные цепи при перемещении оборудования по дорогам общего пользования.
Состояние ножей аппликатора важно как для безопасности, так и для качества нанесения. Ножи в плохом состоянии могут привести к частым остановкам для очистки и отключения, что увеличивает воздействие безводного аммиака. Засоренные ножи могут задерживать аммиак под давлением, который высвобождается при очистке ножа.
Провисшие выпускные шланги низкого давления являются источником воздействия безводного аммиака, поскольку безводный аммиак в прогибе будет течь к ножу аппликатора и высвобождаться при подъеме машины из земли. Все трубки низкого давления на аппликаторе должны быть одинаковой длины для равномерной подачи к ножам. Дополнительные шланги можно свернуть в спираль и надежно закрепить на раме, чтобы уменьшить провисание.
При отсоединении дозирующих экранов закройте клапан для отвода жидкости на заправочном баке и шланговый клапан на аппликаторе, откройте выпускной клапан на стороне аппликатора отводного клапана заправочного бака и поверните аппликатор, чтобы стравить систему распределения. Оставьте систему открытой, пока экран не будет очищен и заменен.
Оставьте систему открытой, пока экран не будет очищен и заменен.
Правила безопасности на транспорте
Правила буксировки по шоссе:
- Буксировать не более двух переносных цистерн за одним транспортным средством.
- Ограничение скорости 25 миль в час.
- Общая длина всей транспортной единицы не может превышать 75 футов.
- Танки-медсестры можно перевозить только по дорогам общего пользования между восходом и заходом солнца.
- Эмблема медленно движущегося транспортного средства (SMV) или зажженный вращающийся или мигающий желтый свет должны отображаться на задней части буксируемого санитарного танка.
- Цепи безопасности должны использоваться, если цистерны-заправщики буксируются со скоростью более 15 миль в час.
- Резервуары должны быть обозначены спереди, сзади и с обеих сторон словами «БЕЗВОДНЫЙ АММИАК» буквами высотой не менее 2 дюймов.
- Резервуары должны иметь таблички спереди, сзади и с обеих сторон с одобренными Министерством транспорта (DOT) табличками «НЕГОРЮЧИЙ ГАЗ».

- Табличка DOT «НЕГОРЮЧИЙ ГАЗ» (наклейки «1005») также должна быть на заправочном баке.
В случае аварии при транспортировке безводного аммиака к разливу или утечке следует приближаться с подветренной стороны, когда это возможно. Чтобы свести к минимуму образование газового облака, воду следует распылять на точку сброса, а не только на бак. Если вам нужна экстренная помощь, позвоните по бесплатному номеру 1-800-472-2121 или 911.
Правила безопасного поведения в полевых условиях
- Всегда имейте под рукой 8-унциевую бутыль с водой при работе с любым оборудованием для работы с безводным аммиаком.
- Надевайте перчатки и защитные очки при подсоединении или отсоединении заправочных емкостей и аппликаторов.
- Всегда имейте при себе запасной комплект из перчаток, защитных очков, респиратора с утвержденным картриджем и 5 галлонов пресной воды при подаче или транспортировке заправочных баков с безводным аммиаком.
- Всегда работайте с наветренной стороны от оборудования безводного аммиака.

- Переносите шланг питающей цистерны за корпус клапана или муфту, а не за колесо клапана или рукоятку управления.
- Очистите разъемы шланга/аппликатора перед их подсоединением.
- Вручную затяните вентиль; чрезмерная затяжка может повредить клапан или уплотнения.
- Следуйте рекомендуемой процедуре подключения и отключения заправочных баков и аппликаторов.
Частные стационарные хранилища
Стационарные хранилища, не используемые для розничной продажи или отпуска безводного аммиака, должны иметь те же средства безопасности, что и коммерческие стационарные хранилища. Требования основаны на вместимости объекта, независимо от того, ведется ли розничная продажа.
Необходимое оборудование для обеспечения безопасности
На объектах хранения безводного аммиака требуются следующие предметы:
- Погрузочная платформа, поскольку восхождение или стояние на колесах заправочных емкостей не разрешено при заполнении заправочных емкостей
- Аварийный душ или открытый резервуар с водой, вмещающий не менее 150 галлонов воды для полного погружения тела
- Огнетушитель
- Телефон или FM-радио с двусторонней связью
Средства индивидуальной защиты
В соответствии с Законом Северной Дакоты об безводном аммиаке следующие пять предметов средств индивидуальной защиты должны быть легко доступны на месте хранения:
- Два полнолицевых противогаза с запасным аммиаком
- Одна пара непроницаемых для аммиака защитных перчаток
- Одна пара невентилируемых очков, соответствующих спецификациям ударопрочности ANSI Z87.
 1
1 - Одна пара непроницаемых защитных сапог
- Один «плащ», костюм от дождя, непроницаемый для аммиака
Операторы складов безводного аммиака должны быть обучены безопасным процедурам эксплуатации, а обучение должно быть задокументировано подписанными формами с указанием типа обучения, даты обучения, лиц, прошедших обучение, и лица, проводящего обучение. Эти формы должны храниться не менее трех лет и быть доступными для ознакомления в учреждении в обычные рабочие часы.
Фермерские перегрузочные сооружения
Сельскохозяйственные производители могут перекачивать безводный аммиак только из грузовых танков в питающие танки при соблюдении следующих требований безопасности:
- Транспортная цистерна должна иметь полную актуальную сертификацию и маркировку.
- Перед началом процесса перекачки необходимо использовать противооткатные колодки соответствующего размера на транспортном и вспомогательном резервуарах.
- На транспортной цистерне должны находиться следующие предметы: 1) 5-галлонный резервуар с чистой водой, 2) непроницаемые для аммиака перчатки, 3) два полнолицевых респиратора с баллонами с аммиаком и невентилируемые очки.

- Следующие предметы должны быть на заправочных баках: 1) 5-галлонный резервуар с чистой водой, 2) юридическая наклейка, иллюстрирующая пошаговый процесс переноса аммиака, и 3) юридическая наклейка, объясняющая процедуры оказания первой помощи при воздействии к безводному аммиаку.
- Процесс передачи должен производиться на твердой, хорошо подготовленной, ровной поверхности в светлое время суток на территории собственника или грузополучателя;
К перегрузочным сооружениям применяются следующие минимальные расстояния отступа:
- 50 футов от любого прилегающего участка или любой магистрали или железнодорожной магистрали
- 450 футов от любого жилого дома или общественного собрания
- 750 футов от любой институциональной резиденции
- Одна миля от любой черты города
Владельцы транспортных цистерн должны предоставить письменное уведомление совету окружных уполномоченных о намерении перелить безводный аммиак из любой транспортной цистерны в питательные цистерны в конкретном округе.
Правила для замков вспомогательных резервуаров и контейнеров для хранения безводного аммиака
Законодательное собрание Северной Дакоты приняло следующие правила в качестве пилотного проекта по запиранию резервуаров для безводного аммиака в нескольких округах Северной Дакоты. Пилотный проект координируется Страховой комиссией Северной Дакоты, Инспекционным управлением по безводному аммиаку, Капитолий штата, пятый этаж, 600 East Boulevard Ave., Bismarck, ND 58505-0320. Эти правила включены в эту публикацию в качестве рекомендаций для всех, кто работает с безводным аммиаком в сельском хозяйстве. Дополнительную информацию можно получить, связавшись с Инспекционным отделом по безводному аммиаку по телефону 701-328-0440 или по электронной почте на адрес [email protected].
- Владелец или оператор хранилища безводного аммиака не может заполнять питающий резервуар или резервуар для аппликатора, если резервуар не оборудован одобренным запорным устройством.

- Если заправочный резервуар безводного аммиака или резервуар для аппликатора не пуст, владелец или оператор хранилища безводного аммиака не может хранить без присмотра заправочный резервуар или резервуар для аппликатора на объекте, если на резервуаре не установлено одобренное запорное устройство.
- Если заправочный резервуар для безводного аммиака или резервуар для аппликатора не пуст, лицо, владеющее резервуаром за пределами хранилища безводного аммиака, должно установить на резервуар одобренное запирающее устройство, если резервуар остается без присмотра на ночь.
- Если запорное устройство не является неотъемлемой частью клапана для отвода жидкости, лицо, перевозящее заправочный бак или бак для аппликатора, должно снять запорное устройство во время транспортировки.
- Владелец или оператор хранилища безводного аммиака должен присутствовать при заборе заправочного резервуара или резервуара для аппликатора на хранилище безводного аммиака, если только резервуар не пуст или если на резервуаре не установлено утвержденное запорное устройство.

- Лицо, имеющее заправочный бак или бак для аппликатора, не может сдавать бак на складе безводного аммиака, если владелец или оператор отсутствует, за исключением случаев, когда бак пуст или если на 9 не установлено утвержденное запорное устройство.0225 танк.
- Запрещается перекачивать безводный аммиак из транспортного средства для доставки безводного аммиака в заправочную цистерну или аппликаторную цистерну, если цистерна не оборудована одобренным запорным устройством.
- Контейнер для хранения должен иметь одобренные запорные устройства, установленные на запорных клапанах основного контейнера, когда хранилище остается без присмотра, если только контейнер не пуст.
Резюме
Безводный аммиак — удобрение, обычно используемое в сельском хозяйстве Северной Дакоты. Риск работы с ним высок из-за его сильного сродства к воде, едкой природы, высокого давления и очень низкой температуры, создаваемой при сбросе давления. Едкая природа безводного аммиака вызывает серьезные химические ожоги.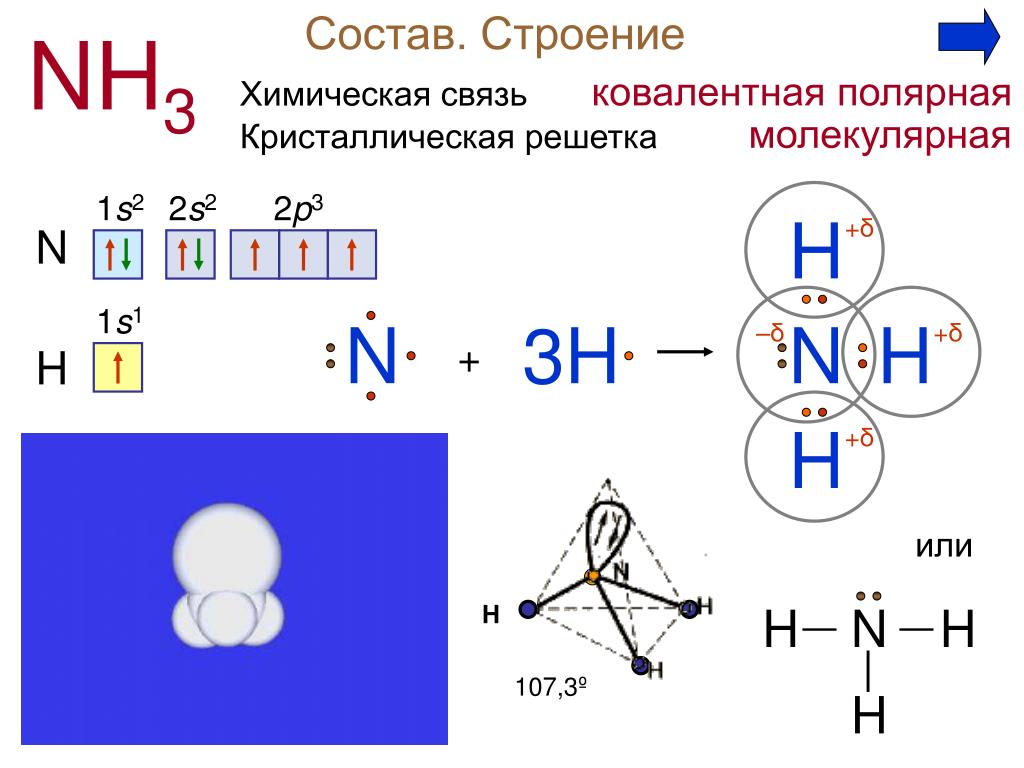 Чрезвычайно низкая температура вызывает обморожение и замораживание тканей.
Чрезвычайно низкая температура вызывает обморожение и замораживание тканей.
Промывка водой является лучшей и единственной первой помощью при контакте с зараженным. Воздействие на глаза и дыхательную систему представляет наибольшую проблему при оказании первой помощи. Пострадавший всегда должен быть доставлен к профессиональной медицинской помощи как можно скорее. Продолжайте промывать экспозицию во время транспортировки.
Многие функции безопасности должны быть встроены в систему обращения с безводным аммиаком и его применения. Срок службы некоторых функций безопасности ограничен законами штата, поскольку эти функции не подлежат ремонту в полевых условиях и требуют для их обслуживания обученных технических специалистов. Целью этих ограничений срока службы является поддержание этих деталей в хорошем рабочем состоянии и минимизация риска отказа.
Хранение безводного аммиака в больших контейнерах на ферме представляет опасность, аналогичную хранению на коммерческих объектах. Необходимость в конкретном оборудовании и процедурах обеспечения безопасности одинакова, независимо от местонахождения объекта. Все хранилища для сыпучих материалов имеют специальное необходимое оборудование для обеспечения безопасности и процедуры.
Необходимость в конкретном оборудовании и процедурах обеспечения безопасности одинакова, независимо от местонахождения объекта. Все хранилища для сыпучих материалов имеют специальное необходимое оборудование для обеспечения безопасности и процедуры.
Ссылки
Ахерин, Р., Л. Шульц, 1984. Безопасное использование безводного аммиака на ферме, Образовательный пакет AG-EP-2192, Служба распространения сельскохозяйственных знаний, Университет Миннесоты.
Американский национальный институт стандартов, 1981. Требования безопасности при хранении и обращении с безводным аммиаком, публикация K61.
Безопасность безводного аммиака, 1990. Ассоциация производителей удобрений и химикатов Айовы.
Досс, Х.Дж., 1998. Предотвращение ожогов аммиаком и способы их лечения, Расширение Мичиганского государственного университета, Мичиганский государственный университет.
Кодекс штата Северная Дакота, статья 7-12, главы с 7-12-01 по 7-12-01-08, Регламент по безводному аммиаку.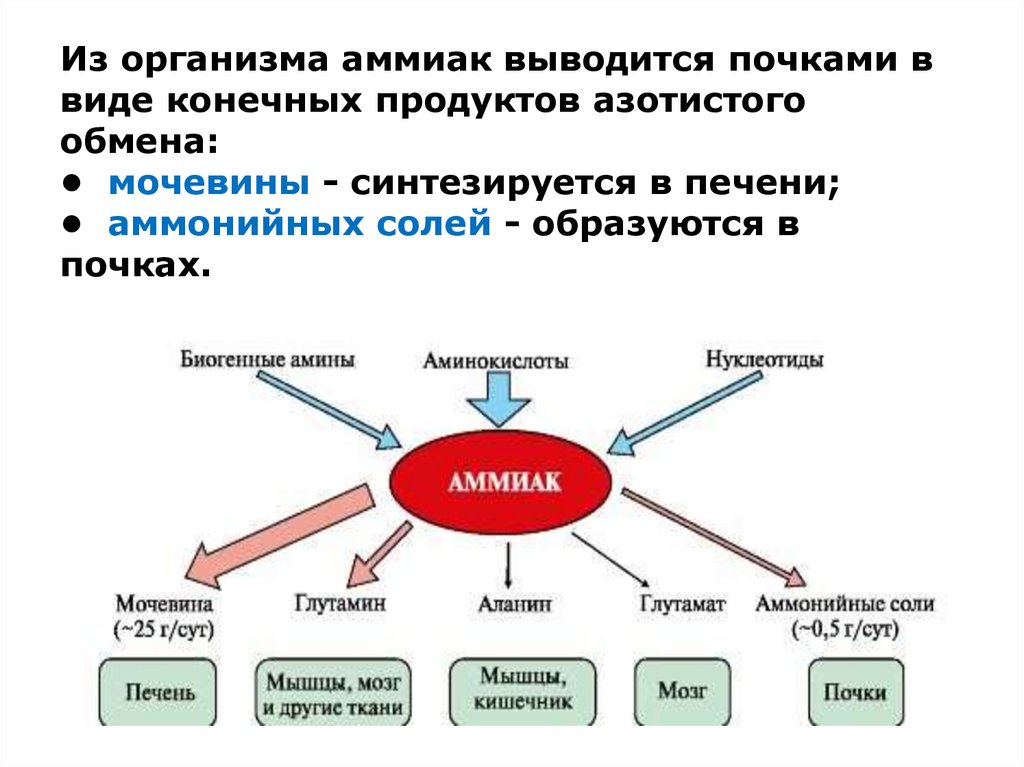
Кодекс штата Северная Дакота, глава 19-20.2, разделы с 19-20.2-01 по 19-20.2-10, Предприятия по производству безводного аммиака.
Институт удобрений, 1982 г. Руководство по внешнему визуальному осмотру емкостных резервуаров для безводного аммиака и резервуаров для внесения.
Grisso, R.D., D. Morgan and R.D. Schnieder, 1994. Безопасное использование безводного аммиака в сельском хозяйстве, EC94-738-B, Кооперативное расширение Университета Небраски, Университет Небраски.
Schutske, J.M., 1998. Безопасное использование безводного аммиака на ферме, Служба распространения знаний штата Миннесота, Миннесотский университет.
Шваб, К.В., М. Ханна и Л. Миллер, 2002 г. Будьте осторожны с безводным аммиаком, Расширение университета, Университет штата Айова.
NDCC 28-32-02 Глава 19-20.2 Предприятия по производству безводного аммиака. Действует с 1 апреля 2004 г.
Безопасное использование безводного аммиака в сельском хозяйстве
Безводный
аммиак является одним из наиболее эффективных и широко используемых источников
азота для роста растений.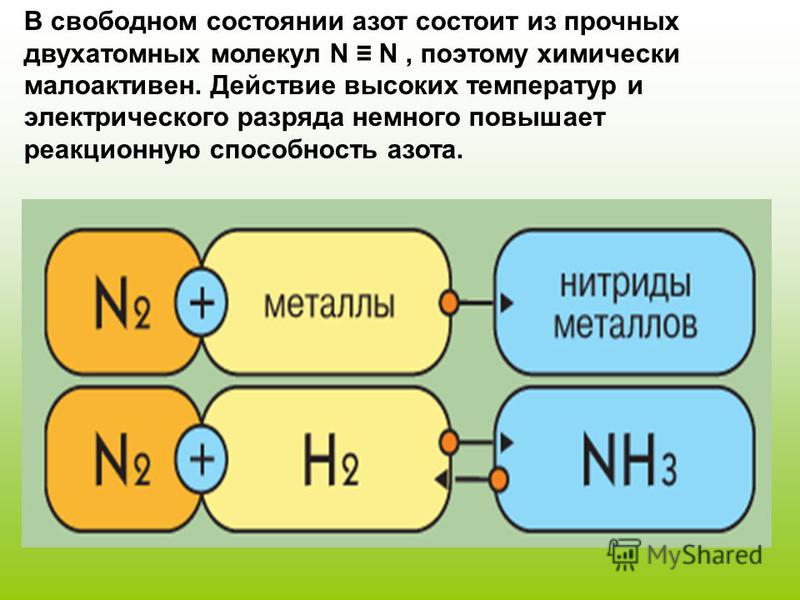 Преимущества аммиака
относительно простое применение и доступность привели
к его более широкому использованию в качестве удобрения на фермах в Миссури.
Преимущества аммиака
относительно простое применение и доступность привели
к его более широкому использованию в качестве удобрения на фермах в Миссури.
Безводный аммиак также имеет недостатки, особенно при обращении с ним. Он должен храниться и обрабатываться под высоким давлением, что требует специально разработанное и хорошо обслуживаемое оборудование. Рабочие также должны быть обучены обращаться с этим продуктом и следовать строгие рабочие процедуры для обеспечения безопасности оператора.
Что
представляет собой безводный аммиак (Nh4), и почему с ним так рискованно обращаться?
Это химическое вещество, состоящее из одной части азота (N) и трех
частей водорода (h4). Физические свойства этого удобрения
сделать его одним из самых потенциально опасных химических веществ на
ферма.
Безводный значит без воды. Следовательно, при безводном аммиаке и влага вступают в контакт, они быстро соединяются. Когда впрыскивается в почву, жидкий аммиак расширяется в газообразный и легко поглощается почвенной влагой. Сходным образом, жидкость или газ, контактирующие с тканями тела, особенно глаза, кожа и дыхательные пути — вызовет обезвоживание, разрушение клеток и тяжелые химические ожоги. Жертвы разоблачены даже небольшие количества аммиака требуют немедленной обработки во избежание необратимых травм.
| Таблица 1. Концентрация паров безводного аммиака. | ||
| миллионных долей (детали за миллион) | процентов по объему | Эффекты на теле человека |
| 5 | 0,005 | Обнаруживаемый
почти всеми лицами. Некоторые люди жалуются на раздражение носа.
через 5 минут Некоторые люди жалуются на раздражение носа.
через 5 минут |
| 134 | 0,0134 | Мост люди испытывают сухость и раздражение носа, горла и глаза. |
| 700 | 0,07 | Кашель. Сильное раздражение глаз, если его не лечить, может привести к частичному или полная потеря зрения. |
| 1700 | 0,17 | Серьезный повреждение легких, смерть без лечения. |
| 2000 | 0,2 | Бернс
и волдыри на коже после нескольких секунд воздействия. |
| 5000 | 0,5 | Смерть от удушья в течение нескольких минут. |
безводный аммиак имеет встроенный фактор безопасности — вы не можете дышать Это. Никто не может добровольно оставаться в концентрации безводного газообразный аммиак, достаточно сильный, чтобы повредить нос, горло, легкие, глаза или кожу. Когда люди получают ожоги или повреждения глаз от продукт, это из-за внезапного выпуска его, где жертва незащищен и не может убежать. В таблице 1 приведены примеры воздействие различных концентраций паров безводного аммиака на теле человека.
Под
атмосферная температура и давление, безводный аммиак
бесцветный газ с резким резким запахом. Для использования в качестве
сельскохозяйственное удобрение, спрессованное в жидкость
напоминающий воду. В жидком состоянии под давлением он
хранится в специально изготовленных резервуарах, достаточно прочных, чтобы выдерживать
внутреннее давление минимум 250 фунтов на квадратный дюйм
(пси). При повышении температуры наружного воздуха температура
безводного аммиака увеличивается, вызывая давление паров
в загар, чтобы увеличить. Например, при 60°F давление
93 фунта на квадратный дюйм, а при 100 ø F давление составляет почти 200 фунтов на квадратный дюйм.
Для использования в качестве
сельскохозяйственное удобрение, спрессованное в жидкость
напоминающий воду. В жидком состоянии под давлением он
хранится в специально изготовленных резервуарах, достаточно прочных, чтобы выдерживать
внутреннее давление минимум 250 фунтов на квадратный дюйм
(пси). При повышении температуры наружного воздуха температура
безводного аммиака увеличивается, вызывая давление паров
в загар, чтобы увеличить. Например, при 60°F давление
93 фунта на квадратный дюйм, а при 100 ø F давление составляет почти 200 фунтов на квадратный дюйм.
Аммиак
вызывает коррозию некоторых металлов и их сплавов, таких как медь
и цинк. Нельзя использовать оцинкованные трубы и латунные фитинги.
с оборудованием, используемым для хранения или применения аммиака. Контейнеры
должны быть изготовлены из высокопрочной стали или другого подходящего материала
а арматура должна быть сделана из черного железа.
Контейнеры
должны быть изготовлены из высокопрочной стали или другого подходящего материала
а арматура должна быть сделана из черного железа.
НЕСЧАСТНЫЕ СЛУЧАИ АММИАК БЕЗВОДНЫЙ
Срок своим свойствам и способу хранения в безводном аммиак может создать опасную ситуацию при случайном попадании вышел. Ниже приведены некоторые примеры неправильного использования безводных аммиак и его оборудование, которые могут привести к несчастным случаям:
- Наполнение резервуары сверх рекомендуемой вместимости.
- Стук случайно открыть клапан на конце шланга.
- Переезд
бак аппликатора перед отсоединением заправочных шлангов
из санитарного бака.

- Вентиляция клапан сброса давления, когда человек находится в линии нагнетания.
- Разрушение перекачивающего шланга, особенно старого или неправильно использовавшегося.
- Сбой прокачать шланговое соединение перед отсоединением.
- Разрыв шланга низкого давления из-за повышения давления при работе ножей затыкать.
- Освобождение аммиак, когда ножи отключены от сети.
- Опрокидывание аппликатор или заправочный бак во время транспортировки или в полевых условиях.
Все
вышеперечисленных аварийных ситуаций может привести к травмам, обширным
материальный ущерб или и то, и другое.
Для минимизации вероятность несчастного случая, примите меры, чтобы все оборудование находится в отличном рабочем состоянии. Убедитесь, что все сельскохозяйственные работники обращение с аммиаком или его применение прошли специальное обучение техническое обслуживание и эксплуатация оборудования, надлежащие средства индивидуальной защиты оборудование и неотложная помощь.
ЗАЩИТА ОПЕРАТОРА
Четный соблюдая все меры предосторожности, вы можете стать жертвой случайного выделение аммиака. Простая защита может предотвратить серьезные последствия если использовать постоянно.
Лицо
щит или защитные очки, резиновые перчатки и прочную одежду с длинными рукавами.
рубашка рекомендуется как минимальная защита для операторов
рутинная работа с аммиаком. Носите перчатки и защитные очки
всякий раз, когда вы работаете или эксплуатируете безводное оборудование
или погрузочно-разгрузочные шланги.
Носите перчатки и защитные очки
всякий раз, когда вы работаете или эксплуатируете безводное оборудование
или погрузочно-разгрузочные шланги.
Это важно носить правильно подобранные очки или лицевой щиток при работе с аммиаком. Маска для лица поможет предотвратить вы от вдыхания прямого выброса аммиака, а также уменьшить возможное воздействие на глаза. Обычные очки не дают адекватная защита. Никогда не носите контактные линзы во время работы с аммиаком. Аммиак может попасть под линзы и вызвать необратимое повреждение глаз, прежде чем вы сможете снять линзы и промойте глаза водой.
Свободный крой
резиновые перчатки с расширенной манжетой рекомендуются для работы с
безводный аммиак. Поверните расширенную манжету вниз, чтобы аммиак
не стекает по рукаву, когда вы поднимаете руки. Ты
может снять перчатки, которые свободно сидят в случае чрезвычайной ситуации.
Ты
может снять перчатки, которые свободно сидят в случае чрезвычайной ситуации.
Вы можно дополнительно защитить руки от брызг, надев сверхпрочный одежду, такую как комбинезоны или рабочие рубашки, которые закрывают руки. Тонкие классические рубашки или рубашки с короткими рукавами не обеспечивают удовлетворительного защита.
Если вы
хранить большое количество безводного аммиака на своей ферме, вы
потребуются дополнительные средства защиты. Держите два дождевика
или плащи и противогазы с аммиачным канистровым фильтром
доступен для аварийной работы. Защита от канистры
фильтр ограничен, и вы должны использовать его только в низких концентрациях
аммиака. Если произошла серьезная утечка, позвоните в местную пожарную службу. отделение помощи. Пожарные имеют соответствующую подготовку
и оборудование, в том числе автономный дыхательный аппарат
и защитный костюм для устранения крупных утечек аммиака, где
вероятно присутствуют высокие концентрации аммиака.
отделение помощи. Пожарные имеют соответствующую подготовку
и оборудование, в том числе автономный дыхательный аппарат
и защитный костюм для устранения крупных утечек аммиака, где
вероятно присутствуют высокие концентрации аммиака.
руководство по эксплуатации оборудования для безводного аммиака должно включать инструкции по надлежащим процедурам и средствам защиты использовать при работе с аммиаком. Ознакомьтесь с этой информацией перед эксплуатации оборудования.
ПЕРВАЯ ПОМОЩЬ = ВОДА + ВОДА + ВОДА
Каждый
второй критичен, когда кого-то обрызгивают жидким аммиаком
или поглощен концентрированными парами. Воздействие безводного аммиака
может быть вредным при попадании на кожу и в глаза или при
вдохнул или проглотил. При попадании аммиака на кожу или в глаза
повреждение тканей происходит быстро. Немедленная промывка открытых
область тела с водой имеет решающее значение.
При попадании аммиака на кожу или в глаза
повреждение тканей происходит быстро. Немедленная промывка открытых
область тела с водой имеет решающее значение.
Правила требуют, чтобы все сельскохозяйственные транспортные средства, используемые для перевозки безводного аммиака, иметь при себе контейнер, наполненный не менее чем 5 галлонами воды. Эта вода должна быть легко доступна для промывания глаз. и кожи в случае воздействия. Вы должны изменить воду ежедневно, чтобы убедиться, что у вас есть чистый запас.
Безопасность
специалисты рекомендуют держать второй 5-галлонный контейнер
воды на тракторе. Это обеспечивает еще один источник воды
для оказания первой помощи в случае, если тракторист не может добраться до
емкость для воды на баке медсестры или аппликатора. Вам следует
также носите с собой заполненную водой пластиковую жидкость для промывания глаз объемом от 6 до 8 унций.
бутылка в кармане рубашки. Он обеспечивает немедленную поставку
воды в случае аварии. Цель глаза
бутылка для промывания предназначена для удаления излишков аммиака из глаз в
первые несколько секунд, пока вы или пострадавший не сможете добраться до
больший запас воды для продолжения промывки.
Вам следует
также носите с собой заполненную водой пластиковую жидкость для промывания глаз объемом от 6 до 8 унций.
бутылка в кармане рубашки. Он обеспечивает немедленную поставку
воды в случае аварии. Цель глаза
бутылка для промывания предназначена для удаления излишков аммиака из глаз в
первые несколько секунд, пока вы или пострадавший не сможете добраться до
больший запас воды для продолжения промывки.
Когда
пострадавший подвергся воздействию безводного аммиака, переместите его или
ее в безопасное место и немедленно промойте открытые участки
водой не менее 15 минут. Удалить загрязненный
одежду, как только вы ее разморозите. (Помните,
минусовая температура безводного аммиака может привести к замерзанию
одежду до кожи под ней.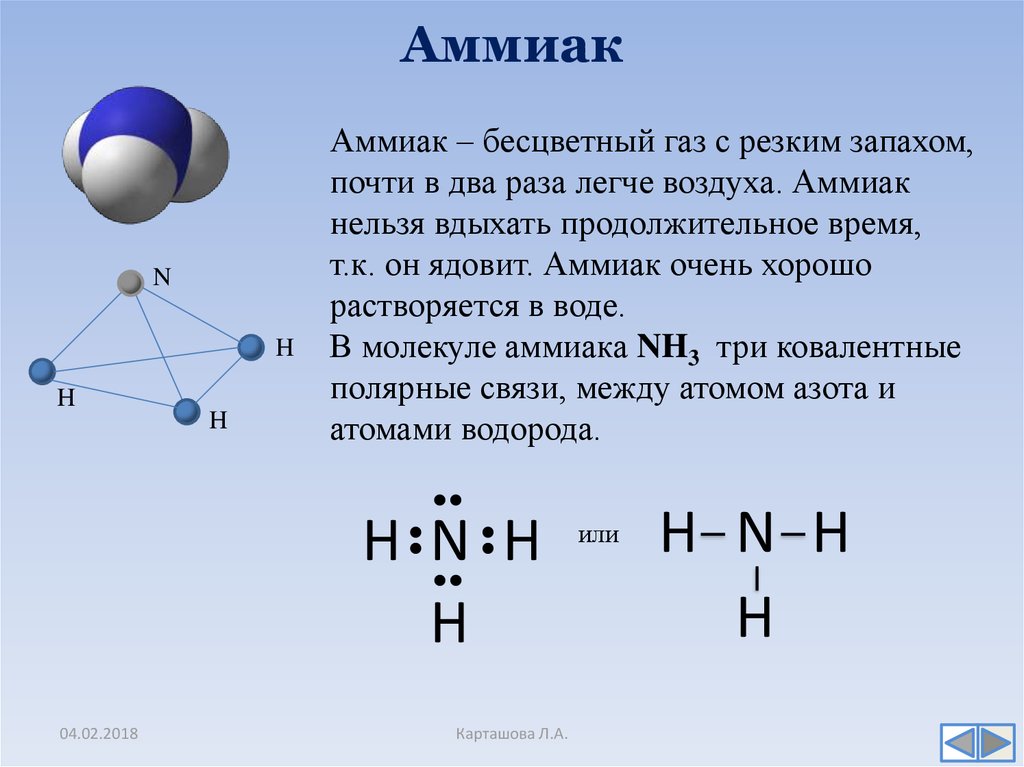 Если вы снимаете одежду перед тем, как
разморозьте его водой для полоскания, это может привести к обширному повреждению кожи.)
Если вы снимаете одежду перед тем, как
разморозьте его водой для полоскания, это может привести к обширному повреждению кожи.)
Не применять мази, кремы или мази. Они не остановят разрушение действие на кожу. Обратитесь к врачу сразу после чрезвычайной ситуации лечение первой помощи.
Четный при попадании небольшого количества аммиака в глаза промойте их немедленно водой в течение 15 минут или более. Держите веки открывать во время полива, чтобы обеспечить контакт воды со всеми частями глаза. Немедленная первая помощь важна, чтобы избежать частичного или полная потеря зрения. Опять же, проконсультируйтесь с врачом после того, как дали неотложная скорая помощь.
Аммиак
пары легко обнаруживаются из-за их резкого запаха,
даже в низких концентрациях. Вдыхание аммиака может вызвать раздражение
дыхательных путей и легких. В высоких концентрациях аммиак
в сочетании с влагой в легких может повредить легкие
слизистой оболочки и снижают способность легких переносить кислород в
кровоток.
Вдыхание аммиака может вызвать раздражение
дыхательных путей и легких. В высоких концентрациях аммиак
в сочетании с влагой в легких может повредить легкие
слизистой оболочки и снижают способность легких переносить кислород в
кровоток.
Когда человек вдохнул аммиак, переместите его в безопасное место. экспозиции к низким концентрациям аммиака в течение короткого периода времени может не требовать лечения. Воздействие более высоких концентраций может вызвать судорожный кашель и респираторные спазмы. Предоставлять сердечно-легочная реанимация, если пострадавший не дышит. Получите медицинскую помощь как можно скорее.
В случае
проглотили аммиак, немедленно обратитесь к врачу.
Дайте пострадавшему, если он в сознании и в состоянии, выпить большое количество
воды для разбавления химиката. Не вызывайте рвоту, если
пострадавший находится в шоке или без сознания. Если возникает рвота,
держите голову ниже бедер, чтобы предотвратить рвоту
попадание в легкие.
Не вызывайте рвоту, если
пострадавший находится в шоке или без сознания. Если возникает рвота,
держите голову ниже бедер, чтобы предотвратить рвоту
попадание в легкие.
КОНТЕЙНЕР И СИСТЕМА ТРЕБОВАНИЯ
специально изготовленное и спроектированное оборудование под давлением должно соответствовать руководящим принципам, предусмотренным американскими национальными стандартами Институт в публикации K61.1-1981, Требования безопасности для хранение и обращение с безводным аммиаком. Все запчасти и контакты поверхности должны выдерживать минимальное рабочее давление 250 фунтов на квадратный дюйм. Сюда входят сварные швы, предохранительные клапаны, манометры, фитинги, шланги и дозирующие устройства.
Все
емкости, используемые для хранения аммиака, должны быть окрашены в белый цвет
или серебро.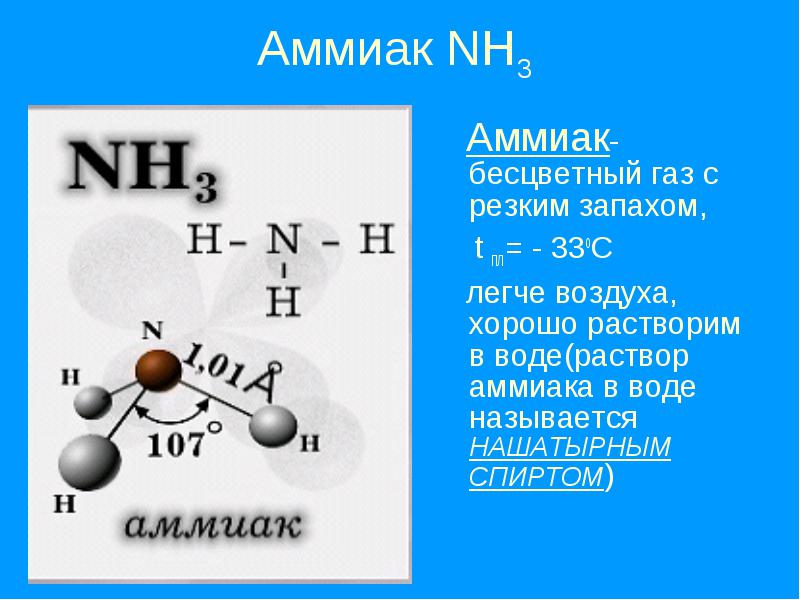 Светлые цвета отражают тепло, и это помогает сохранить
понижение температуры и давления внутри бака во время прогрева
погода.
Светлые цвета отражают тепло, и это помогает сохранить
понижение температуры и давления внутри бака во время прогрева
погода.
ОБСЛУЖИВАНИЕ БЕЗВОДНЫЙ ОБОРУДОВАНИЕ ДЛЯ АММИАКА
Хранить
оборудование безводного аммиака в хорошем состоянии. Будьте начеку
за дефекты в баках-медсестрах, независимо от того, владеете ли вы ими
или сдать их в аренду. Проводите периодические осмотры и ремонтируйте или заменяйте
оборудование. Жертвы аварии одинаково травмированы независимо от
кому принадлежит танк. Следующие процедуры технического обслуживания
взяты из руководств, рекомендованных Институтом удобрений.
Чтобы получить полную копию подробных инструкций, напишите по адресу: The
Институт удобрений, 1015 18-я улица, северо-запад, Вашингтон, округ Колумбия, 20036.
Ежедневно осмотр. Ежедневно проводите краткий осмотр бака и шлангов. Ищите проблемы с:
- Шланги — Проверьте на наличие порезов, мягких мест, выпуклостей, перегибов, уплощения или проскальзывание на муфте.
- Шины — Проверьте правильность надувания, порезов, атмосферных воздействий, износа и затяжка болтов крепления колес.
Каждый
когда вы заполняете заправочный бак, проверьте датчик уровня жидкости
и манометр. Манометры должны работать нормально
и будьте последовательны в своих показаниях. Не используйте резервуары для медсестер
с неисправными датчиками. Для ремонта или замены неисправных манометров
бак должен быть опорожнен, а давление в баке упало до нуля
прежде чем неисправные части могут быть удалены.
Немедленно ремонт. Некоторые ситуации требуют немедленного ремонта или замена. Любая утечка в запорном клапане для жидкости или пара требует ремонта или замены клапана. Если авария вызывает вмятину, выемку, трещину или другие повреждения бака, которые может привести к отказу, осмотрите бак и, при необходимости, отремонтируйте его перед повторным вводом в эксплуатацию. Сертифицированный сварщик должен выполнять любой сварочный ремонт бака и сварных швов должны быть подвергнуты гидростатическим испытаниям в соответствии со стандартами ASME. Перевернутый танк или столкновение танка с другой сельскохозяйственной техникой являются примерами причин для проверки.
Годовой осмотр. Не реже одного раза в год проверяйте эти элементы осторожно и при необходимости отремонтируйте или замените:
Шланги. Выложите шланг прямо и внимательно осмотрите его на наличие:
Выложите шланг прямо и внимательно осмотрите его на наличие:
- разрезы обнажение армирующей ткани
- мягкий пятна или выпуклости
- вздутие или свободное внешнее покрытие
- необычный жестокое обращение, такое как изгиб или сплющивание транспортным средством
- проскальзывание шланга на любом соединении
- латунь или медные фитинги или хомуты водяного шланга
- шланги более 1/2 дюйма Н.Д. не отмечены следующей информацией:
- «Безводный Аммиак»
- ххх psig (максимальное рабочее давление)
- Производитель название или товарный знак
- Год производства
| Оплетка материал | От дата установки |
| Район | 2 | лет
| Нейлон/кевлар | 4 | лет
| Нержавеющая сталь сталь | 6 лет |
Немедленно
замените шланги, которые показывают эти дефекты. Шланги, подверженные воздействию безводного
аммиак теряет силу. Вы должны заменить их в соответствии с
следующий график независимо от видимых повреждений:
Шланги, подверженные воздействию безводного
аммиак теряет силу. Вы должны заменить их в соответствии с
следующий график независимо от видимых повреждений:
ПЕРЕДАЧА АММИАКА
Большинство аварии с аммиаком связаны с неправильным обращением. Читать руководство пользователя и следуйте инструкциям. Не оставляйте во время процедура передачи. Проконсультируйтесь с вашим дилером, если вы не уверены о правильной процедуре. Спрашивайте инструкции при аренде или заимствование оборудования. Обсудите процедуры с сельскохозяйственными работниками прежде чем позволить им обращаться с оборудованием для обеспечения их безопасности.
Когда
заполняя бак медсестры или аппликатора, будьте хорошо знакомы
с оборудованием и процедурами до любой передачи. Потому что
большинство аварий происходит при перекачке аммиака, это очень
важно носить защитный щиток для лица или очки и
резиновые перчатки, когда вы участвуете в этой процедуре.
Потому что
большинство аварий происходит при перекачке аммиака, это очень
важно носить защитный щиток для лица или очки и
резиновые перчатки, когда вы участвуете в этой процедуре.
Будьте уверены 5-галлонный контейнер наполнен чистой водой.
Парк питательная цистерна на ровном месте, с подветренной стороны от заправки операция. Поместите его рядом с операцией, чтобы устранить любые нагрузка на шланг. Избегайте работы рядом с любыми препятствиями, которые затруднит эвакуацию, например, заборы, здания или канавы. Заблокируйте колеса, чтобы не допустить движущийся. Серьезная ситуация могла сложиться, если танк сдвинулся с места. и шланг порвался во время операции заполнения.
Раньше
подсоединяя шланг, убедитесь, что муфта и соединения
очищены от грязи и других посторонних материалов. Визуально проверьте
чтобы убедиться, что нити не повреждены. Это уменьшит
вероятность утечки аммиака при подаче давления.
Визуально проверьте
чтобы убедиться, что нити не повреждены. Это уменьшит
вероятность утечки аммиака при подаче давления.
Рабочие следует нести наливной шланг за корпус клапана или муфту, не клапаном. Это снижает вероятность того, что клапан открытие колеса и распыление аммиака. Помните клапанное колесо и фитинг предназначены для закрывания только ручным давлением. Не используйте гаечный ключ — он может повредить фитинг.
Если вы используете компрессор для перекачки аммиака, следуйте рекомендациям инструкции в руководстве оператора. Поддерживать давление пара На 5-10 фунтов ниже в заполненном баке, чтобы сохранить вперед поток.
Не
переполнить бак медсестры или аппликатора. Следите за жидкостью
уровня, открыв выпускной клапан 85-процентного заполнения. Белый
туман появится, когда он достигнет этого уровня. В рамках
нормальная процедура загрузки, проверьте поплавковый датчик уровня жидкости
точность путем сравнения с фиксированным указателем уровня жидкости.
Важно заполнить только до 85 процентов или меньше
общая вместимость бака по жидкости. Так как наружная температура
увеличивается, температура жидкости увеличивается, а
жидкость расширяется, в результате чего давление пара в баке
увеличивать. Если бак переполнен и паровое пространство отсутствует
доступный предохранительный клапан может выйти из строя, что приведет к
танк разорваться или взорваться.
Следите за жидкостью
уровня, открыв выпускной клапан 85-процентного заполнения. Белый
туман появится, когда он достигнет этого уровня. В рамках
нормальная процедура загрузки, проверьте поплавковый датчик уровня жидкости
точность путем сравнения с фиксированным указателем уровня жидкости.
Важно заполнить только до 85 процентов или меньше
общая вместимость бака по жидкости. Так как наружная температура
увеличивается, температура жидкости увеличивается, а
жидкость расширяется, в результате чего давление пара в баке
увеличивать. Если бак переполнен и паровое пространство отсутствует
доступный предохранительный клапан может выйти из строя, что приведет к
танк разорваться или взорваться.
После
заправка завершена, закрепите шланг в
место хранения для транспортировки. Совершите последнюю прогулку по
медсестра или бак для аппликатора, чтобы убедиться, что все шаги были выполнены.
взятый.
Совершите последнюю прогулку по
медсестра или бак для аппликатора, чтобы убедиться, что все шаги были выполнены.
взятый.
Профилактика и меры предосторожности Работа против ветра! Работа с наветренной стороны машин, клапан на конце шланга, выпускной клапан клапан, муфта или заглушенные аппликаторные трубки. Это дает преимущество быстро уйти, если безводный аммиак внезапно высвободится. Спланируйте путь отступления. Знай, куда бежать.
Ручка
клапана с осторожностью! Клапаны брать за корпус клапана или за
муфта, а не рукоятка клапана. Ручка клапана может
случайно повернуть и открыть. Если бросить шланг с концом
клапан над баком, он может открыться при попадании в бак и
открутить до конца. Все баки оснащены избыточным
клапаны потока, которые срабатывают автоматически при разрыве шланга.
Клапан с небрежным обращением, который частично открыт, не может
обеспечить достаточный поток для активации перепускного клапана и
весь бак с аммиаком мог вытечь. Прикрепите концевую муфту
к заглушке, предусмотренной при транспортировке или неиспользовании
шланг.
Все баки оснащены избыточным
клапаны потока, которые срабатывают автоматически при разрыве шланга.
Клапан с небрежным обращением, который частично открыт, не может
обеспечить достаточный поток для активации перепускного клапана и
весь бак с аммиаком мог вытечь. Прикрепите концевую муфту
к заглушке, предусмотренной при транспортировке или неиспользовании
шланг.
Уважение
давление! Необходимо сбросить давление с муфты с помощью
выпускной клапан перед отсоединением муфты. Прокачать
медленно сбросьте давление, а затем немедленно отсоедините муфту.
В теплый день оставив стяжку подключенной на пять на 10
минут после прокачки позволяет аммиаку в шланге восстановиться
давление. В холодные дни резиновые уплотнители становятся жесткими и могут не
уплотнить полностью. Образовавшаяся утечка может разбрызгивать безводный
паров аммиака при открытии вентиля бака. Это также может создать
облако пара, ограничивающее доступ к оборудованию для повторного включения
клапан.
Образовавшаяся утечка может разбрызгивать безводный
паров аммиака при открытии вентиля бака. Это также может создать
облако пара, ограничивающее доступ к оборудованию для повторного включения
клапан.
Проверить Ваш безопасный резервуар для воды! Проверить эту подачу воды (не менее 5 литров) в день. Он может замерзнуть в холодную погоду или стать слишком жарко, чтобы безопасно промывать глаза в теплые солнечные дни.
Изменить вода еженедельно . Может поглощать аммиак из воздуха. и загрязняться. Проведение запаса воды на обоих резервуарах и трактор дает дополнительную защиту.
Проверить
аппликаторные трубки! При удалении грязи из засоренного аппликатора
трубки, обращайтесь с ней так, как если бы она содержала безводный аммиак под давлением. Они часто делают. Это может вызывать особую озабоченность, когда вы
работа среди ножей аппликатора безводного аммиака.
Возможно, вы не сможете двигаться достаточно быстро, чтобы избежать острого
дымит без травм.
Они часто делают. Это может вызывать особую озабоченность, когда вы
работа среди ножей аппликатора безводного аммиака.
Возможно, вы не сможете двигаться достаточно быстро, чтобы избежать острого
дымит без травм.
Выйти сообщение! Сотрудники должны знать о деятельности друг друга график при применении безводного аммиака. Просроченный оператор возможно попал в аварию. Авария с повреждением глаз оставляет оператор беспомощен и застрял. Проверьте, видите ли вы операторов остановился в поле на необычный период времени, когда условия являются нормальными, и оборудование должно двигаться.
ДОРОЖНАЯ БЕЗОПАСНОСТЬ
Буксировка
питательный резервуар представляет проблемы, потому что безводный аммиак
опасный материал. Авария с санитарным танком на трассе
может привести к серьезным травмам, дорогостоящему ремонту и ответственности.
Авария с санитарным танком на трассе
может привести к серьезным травмам, дорогостоящему ремонту и ответственности.
Медсестра цистерны вместимостью 3000 галлонов или менее, установленные для перевозки, считаются «орудия земледелия», когда они используются исключительно для сельскохозяйственных целей. Медицинские баки должны иметь слова «безводный аммиак» большими зелеными буквами и негорючий газ табличка с надписью «негорючий» или «1005» с обеих сторон и на каждом конце бака. Баки аппликатора должны содержать такая же маркировка, по крайней мере, на задней части контейнера. Автомобилисты на трассе без труда опознают бак с аммиаком по этим маркировкам.
Все
санитарные цистерны должны быть надежно прикреплены к транспортному средству
потянув их. Используйте дышло, сцепной штифт, предохранительный зажим и
цепь безопасности. Перед каждой поездкой по шоссе проверяйте палец сцепного устройства,
предохранительный зажим и предохранительную цепь, чтобы убедиться, что они надежно закреплены.
Используйте дышло, сцепной штифт, предохранительный зажим и
цепь безопасности. Перед каждой поездкой по шоссе проверяйте палец сцепного устройства,
предохранительный зажим и предохранительную цепь, чтобы убедиться, что они надежно закреплены.
Медсестра Вагоны-цистерны спроектированы таким образом, чтобы плавно следовать по пути тягач. Танки медсестры могут перевернуться или столкнуться с другое транспортное средство, если вагон-цистерну заносит из стороны в сторону. Убедитесь, что ваша цистерна правильно подключена. Также сделать Убедитесь, что гайки крепления колеса затянуты, а шины в хорошем состоянии. форма и правильно надуты.
Когда
буксируя загруженную цистерну медсестры, двигайтесь со скоростью 30 миль в час или
меньше. Вероятность серьезной аварии возрастает при
более высокие скорости, потому что вам может не хватать тормозной способности
безопасно управлять вагоном. Перевозка более одного загруженного
резервуар для медсестер является нарушением закона штата Миссури.
Вероятность серьезной аварии возрастает при
более высокие скорости, потому что вам может не хватать тормозной способности
безопасно управлять вагоном. Перевозка более одного загруженного
резервуар для медсестер является нарушением закона штата Миссури.
Потому что шины для сельскохозяйственных орудий предназначены для движения на малых скоростях, дайте достаточно времени, чтобы добраться до пункта назначения. При буксировке на скорости 25 миль в час или менее отображать знак медленно движущегося транспортного средства на вагон.
Состояние
закон имеет дополнительные требования к буксировке санитарного танка или
бак аппликатора ночью. Вы должны отобразить два красных отражателя,
виден сзади, в крайних правой и левой проекциях
прицепной единицы. Если тормоз и поворотник горят
тягач затенен, необходимо затормозить и включить фары
на баке медсестры или аппликатора.
Если тормоз и поворотник горят
тягач затенен, необходимо затормозить и включить фары
на баке медсестры или аппликатора.
ДРУГИЕ ПРИМЕНЕНИЯ ДЛЯ АММИАК БЕЗВОДНЫЙ
В помимо использования в качестве азотного удобрения безводный аммиак имеет другие цели в хозяйстве. Используется с повышенной влажностью. зерна для контроля роста плесени. При использовании с зерном используйте те же меры предосторожности, что и при применении его в качестве удобрения. Те же опасности существуют при работе с аммиаком под давлением.
Безводный
аммиак также используется для добавления небелкового азота в кукурузный силос.
Аммиак находится под давлением до охлаждающего реактора в
это приложение. Носите защитную маску или очки и резину
перчатки вместе со сверхпрочной одеждой, в том числе с длинными рукавами
рубашки, при подсоединении и отсоединении аммиачного шланга
и подгонка.
Носите защитную маску или очки и резину
перчатки вместе со сверхпрочной одеждой, в том числе с длинными рукавами
рубашки, при подсоединении и отсоединении аммиачного шланга
и подгонка.
ОБЗОР
Безводный
аммиак, пожалуй, самый опасный химикат на ферме.
С ним можно безопасно обращаться, если следовать надлежащим процедурам.
Обязательно носите средства индивидуальной защиты и предоставьте
много чистой воды для оказания первой помощи. Держите оборудование в хорошем состоянии
состоянии и соблюдайте надлежащие процедуры при перекачке аммиака.
При транспортировке аммиака по шоссе двигайтесь с безопасной скоростью
и используйте предохранительную цепь и предохранительный зажим на сцепном штифте. По
следуя рекомендуемым процедурам, вы можете уменьшить вероятность
несчастный случай.
ССЫЛКИ
- Институт удобрений, Руководство по внешнему визуальному осмотру для баков-дозаторов безводного аммиака и аппликаторов, 1982.
- Американский Национальный институт стандартов, Inc., Требования безопасности по хранению и обращению с безводным аммиаком, Публикация К61.1-1981.
- Ахерин, Роберт и Ли Шульц, Безопасное использование безводного аммиака на Ферма, Образовательный пакет AG-EP-2192, Расширение сельскохозяйственных знаний Служба, Миннесотский университет, 1984 г.
- Национальный
Совет по безопасности, безопасное обращение с безводным аммиаком, авария
Бюллетень профилактики 699.
 41-11.
41-11.
Публикация №: GO1920
Этот документ опубликовано Университетским расширением, Университет Миссури-Колумбия, Колумбия, Миссури 65211. Дата публикации: октябрь. 1993.
Дэвид Э. Бейкер, факультет сельскохозяйственной инженерии, университет Расширение, Университет Миссури-Колумбия, Колумбия, МО 65211.
Отказ от ответственности и информация о воспроизведении: Информация в NASD не представляет политику NIOSH. Информация, включенная в NASD появляется с разрешения автора и/или правообладателя. Более
Все, что нужно знать об аммиаке (Nh4)
Аммиак (NH 3 ) является распространенным загрязнителем воздуха. Несмотря на то, что он не включен во многие стандартные рекомендации по качеству воздуха, такие как Всемирной организации здравоохранения. 0224 , мы в Breeze Technologies считаем жизненно важным, чтобы за вами следили. Таким образом, наши датчики откалиброваны для измерения аммиака, и он входит в наш индекс качества воздуха (AQI) . Читайте дальше, чтобы узнать, почему.
0224 , мы в Breeze Technologies считаем жизненно важным, чтобы за вами следили. Таким образом, наши датчики откалиброваны для измерения аммиака, и он входит в наш индекс качества воздуха (AQI) . Читайте дальше, чтобы узнать, почему.
Что такое аммиак?
Аммиак (NH 3 ) представляет собой соединение, состоящее из молекул азота и водорода. Это бесцветный газ с резким запахом, обладающий реакционной способностью: он образует вторичные твердые частицы (PM 2,5 ) в сочетании с другими загрязняющими веществами в атмосфере. Это происходит посредством процесса, называемого зародышеобразованием, когда газообразные молекулы аммиака конденсируются с образованием жидких или твердых частиц, взвешенных в атмосфере.
Реакции, в которых образуются вторичные твердые частицы с использованием аммиака:
- SO 2 окисляется до серной кислоты (H 2 SO 4 ) и реагирует с NH 3 с образованием сульфата аммония (2(6NH 900) ) 2 СО 4 )
- NO x окисляется до азотной кислоты (HNO 3 ) и реагирует с NH 3 с образованием нитрата аммония (NH 4 NO 3 ).

В заключение, сульфат аммония ((NH 4 ) 2 SO 4 ) и нитрат аммония (NH 4 NO 3 ) представляют собой вторичные твердые частицы, образующиеся в результате реакции аммиака (NH 3 ) с другими загрязняющими веществами.
Каковы источники аммиака?
Основными источниками аммиака являются сельскохозяйственные процессы, особенно при производстве удобрений и управлении отходами животноводства. Навоз животных, который естественным образом содержит NH 3 , смешивается с другими непригодными органическими веществами, такими как сено и стоки воды, с образованием суспензии. Эту смесь оставляют до тех пор, пока она не превратится в натуральное удобрение. Газы, которые выделяются во время этого процесса, естественным образом включают аммиак. Следовательно, NH 3 концентрации резко возрастают весной из-за этих видов сельскохозяйственной деятельности. Подсчитано, что от 80% до 95% выбросов аммиака в развитых странах являются результатом деятельности сельского хозяйства, которое затем вступает в реакцию с вышеупомянутыми H 2 SO 4 из SO 2 и HNO 3 из NO x . для создания ПМ. Фактически, до 58% твердых частиц в европейских городах образуется из аммиака, используемого в сельском хозяйстве.
для создания ПМ. Фактически, до 58% твердых частиц в европейских городах образуется из аммиака, используемого в сельском хозяйстве.
Причины NH 3 9 внутри помещений0027 включают сигаретный дым, чистящие средства и строительные материалы.
Какое воздействие на здоровье оказывает аммиак?
Аммиак раздражает глаза, нос, горло и дыхательные пути при вдыхании в небольших количествах из-за своей коррозионной природы. В больших количествах NH 3 ядовит и может оказывать негативное воздействие на дыхательную систему, включая снижение функции легких.
Настоящая проблема связана с PM 2,5 , образованным аммиаком, который связан со снижением функции легких, пневмонией, нерегулярным сердцебиением, сердечными приступами, инсультами и такими заболеваниями, как астма, бронхит, эмфизема, хроническая обструктивная болезнь легких, и рак легких. 9 вечера0026 2,5 особенно смертоносен из-за своего небольшого размера, что позволяет ему проникать глубоко в дыхательную и кровеносную системы, вызывая поражение легких, сердца и головного мозга.
Каково воздействие аммиака на окружающую среду?
Аммиак загрязняет и способствует эвтрофикации и подкислению наземных и водных экосистем. При использовании в качестве удобрения азот из NH 3 может проникать в почву и повышать ее кислотность, тем самым влияя на рост растений. Кроме того, NH 3 можно смыть в близлежащие водоемы. Он токсичен для водных видов; накопление загрязняющих веществ в их телах приводит к смерти. Увеличение азота также вызывает чрезмерный рост водорослей, которые затем блокируют свет и лишают растения необходимых им питательных веществ, что приводит к их гибели.
Такие растения, как лишайники и мхи, особенно чувствительны к изменениям уровня азота. Даже незначительное увеличение может привести к их гибели. Это влияет на окружающую дикую природу, выживание которой зависит от этих видов.
Как можно уменьшить выбросы аммиака?
Для снижения уровня аммиака можно принять простые меры, но они должны быть введены на национальном уровне. Это включает в себя ограничение внесения удобрений, закрытие навозных ям, использование резервуаров для производства удобрений, меры по предотвращению загрязнения воды, а также посадку деревьев и живых изгородей для поглощения части газа. Однако эти меры эффективны только при надлежащем контроле. Отслеживание изменений уровней выбросов аммиака поможет оценить успех этих действий. И в Breeze Technologies у нас есть идеальное решение. Как сказано в самом начале, мы считаем NH 3 является основным загрязнителем воздуха, в отличие от стандартов ВОЗ и даже ЕС. Наши компактные и недорогие датчики легко развернуть в сельской инфраструктуре, а данные, собираемые в режиме реального времени, образуют эффективную сеть контроля качества воздуха, работающую в нашем экологическом облаке Breeze. Свяжитесь с нами сегодня, чтобы сделать чистый воздух реальностью для всех!
Это включает в себя ограничение внесения удобрений, закрытие навозных ям, использование резервуаров для производства удобрений, меры по предотвращению загрязнения воды, а также посадку деревьев и живых изгородей для поглощения части газа. Однако эти меры эффективны только при надлежащем контроле. Отслеживание изменений уровней выбросов аммиака поможет оценить успех этих действий. И в Breeze Technologies у нас есть идеальное решение. Как сказано в самом начале, мы считаем NH 3 является основным загрязнителем воздуха, в отличие от стандартов ВОЗ и даже ЕС. Наши компактные и недорогие датчики легко развернуть в сельской инфраструктуре, а данные, собираемые в режиме реального времени, образуют эффективную сеть контроля качества воздуха, работающую в нашем экологическом облаке Breeze. Свяжитесь с нами сегодня, чтобы сделать чистый воздух реальностью для всех!
Зеленый аммиак: возможности стучат | Аргус Медиа
Опубликовано 28 мая 2020 г.
Автор Натали Какиш, эксперт в предметной области, Аммиак
Многие организации видят реальное будущее для аммиака как топлива. В качестве источника энергии аммиак имеет в девять раз большую энергию, чем литий-ионные батареи, и в 1,8 раза более энергоплотный, чем жидкий водород, а аммиак легче транспортировать, чем жидкий водород.
В качестве источника энергии аммиак имеет в девять раз большую энергию, чем литий-ионные батареи, и в 1,8 раза более энергоплотный, чем жидкий водород, а аммиак легче транспортировать, чем жидкий водород.
Почему об этом говорят?
«Зеленый аммиак» — это термин, который в наши дни все чаще можно услышать в аммиачной промышленности и судоходных кругах. Интерес к нему вызван глобальными усилиями по сокращению выбросов углерода в ближайшие десятилетия. В то время как одна тонна обычного или «коричневого» аммиака выбрасывает две тонны CO2, при производстве зеленого аммиака он будет производиться из возобновляемых источников энергии с нулевым выбросом углерода.
Мировое производство аммиака в настоящее время составляет 180 млн т/год, но его потенциальное использование в качестве источника энергии и энергоносителя может привести к росту спроса на него до многомиллиардного рынка для использования в различных областях. В настоящее время аммиак является одним из основных видов топлива, рассматриваемых морским сектором, чтобы позволить судоходной отрасли достичь новых целей по сокращению выбросов CO2, предложенных к 2030 и 2050 годам. Аммиак также серьезно рассматривается как средство хранения возобновляемой энергии для отложенного использования, а также как перевозчик водорода.
Аммиак также серьезно рассматривается как средство хранения возобновляемой энергии для отложенного использования, а также как перевозчик водорода.
Широкое использование аммиака в этих секторах может быть жизнеспособным только в том случае, если резко сократить выбросы CO2, связанные с его фактическим производством. Это потребует значительных новых инвестиций в новые технологии и, исходя из текущих цен на возобновляемые источники энергии, роста эксплуатационных расходов.
Зеленый аммиак в качестве судового топлива
Вслед за введением IMO 2020, который наложил ограничение на выбросы морской серы, следующим важным нормативным изменением для судоходной отрасли является резкое сокращение выбросов CO2 судами. Первоначальная стратегия ИМО в отношении этих усилий предусматривает сокращение выбросов CO2 на 40 процентов к 2030 году и на 70 процентов к 2050 году по сравнению с уровнями 2008 года.
Несмотря на то, что повышение эффективности и замена углеводородного топлива могут иметь большое значение для достижения цели к 2030 году, в морской отрасли складывается консенсус в отношении того, что для выполнения требований IMO традиционные ископаемые виды топлива больше не будут пригодны для использования в качестве бункеровочного топлива. топлива после крайнего срока 2050 года. В качестве замены рассматривается ряд источников энергии, в том числе водород и аммиак. Особое распространение аммиак получает как при сжигании в качестве судового топлива, так и в топливных элементах на кораблях. Аммиак имеет значительные преимущества перед водородом, поскольку его значительно легче хранить и обрабатывать, а также он считается более безопасным способом транспортировки самого водорода. Кроме того, плотность энергии аммиака примерно на 80 процентов выше, чем у жидкого водорода.
топлива после крайнего срока 2050 года. В качестве замены рассматривается ряд источников энергии, в том числе водород и аммиак. Особое распространение аммиак получает как при сжигании в качестве судового топлива, так и в топливных элементах на кораблях. Аммиак имеет значительные преимущества перед водородом, поскольку его значительно легче хранить и обрабатывать, а также он считается более безопасным способом транспортировки самого водорода. Кроме того, плотность энергии аммиака примерно на 80 процентов выше, чем у жидкого водорода.
Ряд предприятий уже находится в стадии реализации, чтобы проверить жизнеспособность аммиака в секторе судоходства, задолго до пределов ИМО. В начале этого года малайзийский судовладелец MISC, Samsung Heavy Industries (SHI), Lloyd’s Register и MAN Energy Solutions объявили об объединении усилий для разработки танкера, работающего на аммиаке. В то время как норвежская нефтяная компания Equinor заключила партнерское соглашение с фирмой морских технологий Eidesvik, чтобы к 2024 году переоборудовать судно Viking Energy для работы на аммиаке.
Nordic Innovation объявила о финансировании ряда экологически чистых морских проектов, в том числе Nordic Green Ammonia Powered Ships (NoGaps), в число партнеров которого входят судовладелец Lauritzen Kosan и Yara International, и планирует спустить на воду судно, работающее на аммиаке, к 2025 году.
Интерес со стороны морского сектора также не ограничивается сухогрузами. Операторы пассажирского круизного лайнера Color Fantasy, курсирующего между Осло, Норвегия, и Килем, Германия, планируют испытать аммиачное топливо. Датская компания Haldor Topsoe находится в процессе составления отчета для судостроительной и эксплуатирующей промышленности, в котором будет изложено пошаговое руководство относительно того, что потребуется для принятия аммиака в качестве судового топлива. Ожидается также, что в нем будут освещены уже существующие объекты снабжения аммиаком, такие как резервуары для хранения аммиака в потенциальных бункерных портах. Ожидается, что доклад будет опубликован позднее в этом году.
Продолжение поста ниже.
Похожие материалы
- Отчет о стратегии Argus по зеленому аммиаку
- Услуги Argus по составлению отчетов о ценах: Argus Аммиак | Аргус Морское топливо
- Подкасты Argus о зеленом аммиаке
- Вебинары Argus по зеленому аммиаку
- Блоги Argus о зеленом аммиаке
- Информационный документ Argus: «Зеленый переход» для создания рынка «зеленого аммиака» объемом 1 миллиард тонн
- Argus Green Amonia Live Conference
Зеленый аммиак – проблемы производства
В отличие от обычного аммиака, который обычно производится с использованием природного газа в качестве сырья, зеленый аммиак производится с использованием солнечной/ветровой/гидроэнергии для производства электроэнергии, которая затем подается в электролизер для извлечения водорода из воды, а азот отделяется от воздуха с помощью разделения воздуха. Ед. изм.
Ед. изм.
В качестве источника энергии аммиак обладает в девять раз большей энергией, чем литий-ионные батареи, и в 1,8 раза более плотной энергией, чем жидкий водород. Аммиак легче транспортировать, чем жидкий водород, используя существующие технологии и инфраструктуру. Вот почему многие организации видят реальное будущее для аммиака как топлива, которое можно использовать не только непосредственно в качестве источника энергии, но и как топливо, которое может быть подвергнуто крекингу из-за содержащегося в нем водорода, где водород требуется в качестве источника энергии.
Электролизер на основе аммиака, использующий возобновляемую энергию, не является новой концепцией, но в настоящее время разрабатываются технологии, позволяющие значительно повысить его энергоэффективность. В начале 1900-х годов норвежская компания Norsk Hydro производила аммиак на основе гидроэлектроэнергии. В настоящее время проводятся серьезные исследования по разработке зеленого аммиака под руководством организаций в Северо-Западной Европе, при этом Япония также играет заметную роль.
В настоящее время крупных заводов по производству зеленого аммиака нет, но производители и технологические компании начинают прокладывать путь к более экологичному подходу. Вполне вероятно, что любые новые заводы по производству экологически чистого аммиака необходимо будет строить в странах, где имеется избыток солнечной, ветровой или гидроэнергии, а в идеале – комбинация как минимум двух из этих ресурсов, чтобы смягчить проблемы с перебоями и минимизировать эксплуатационные расходы. В идеале эти площадки должны быть близки к рынкам конечных пользователей, и такие страны, как Австралия, выделяются в качестве вероятных местоположений, исходя из потенциала возобновляемых источников энергии и близости к рынку конечных пользователей в Восточной Азии.
Продолжение поста ниже.
Хотите узнать больше о водороде для транспорта?Электронное топливо — жидкое и газообразное топливо, получаемое из возобновляемых источников энергии, — может стать существенной альтернативой электрификации транспорта с целью сокращения выбросов парниковых газов.
Прочтите информационный документ Argus об электронном топливе
Разработки в области технологии зеленого аммиака
Существующие лидеры в области технологий производства аммиака ищут способы использования возобновляемых источников энергии для производства аммиака, одновременно решая важнейшие вопросы максимального повышения энергоэффективности и снижения капитальных затрат и эксплуатационных расходов.
Одна из этих компаний, Haldor Topsoe, разработала систему электролиза твердых оксидов, которая работает на возобновляемых источниках энергии и может производить исходный газ для синтеза аммиака без необходимости установки воздухоразделительной установки, что значительно снижает капитальные затраты. Несмотря на то, что система находится на стадии пилотного проекта, она также будет потреблять на 10% меньше энергии, чем обычная установка по производству аммиака, работающая на газе, что поможет решить проблему непомерно высоких эксплуатационных расходов для установок по производству аммиака, работающих на возобновляемых источниках энергии. Наряду со значительными первоначальными затратами, необходимыми для строительства завода, одной из основных проблем, с которыми сталкивается индустрия зеленого аммиака, является высокая стоимость и ограниченное предложение возобновляемой энергии по сравнению с широко распространенным и дешевым природным газом. В Европе текущие затраты на энергию означают, что стоимость производства одной тонны зеленого аммиака примерно на 200-300 процентов выше, чем у обычного аммиака. Предполагается, что в более долгосрочной перспективе падение цен на возобновляемые источники энергии приведет к тому, что стоимость производства зеленого аммиака снизится на 50-150% по сравнению с обычным аммиаком. Увеличение стоимости углерода в Европе может еще больше уравнять правила игры. Необходимость максимизировать энергоэффективность и снизить затраты на возобновляемые источники энергии станут ключевыми факторами в развитии зеленого аммиака.
Наряду со значительными первоначальными затратами, необходимыми для строительства завода, одной из основных проблем, с которыми сталкивается индустрия зеленого аммиака, является высокая стоимость и ограниченное предложение возобновляемой энергии по сравнению с широко распространенным и дешевым природным газом. В Европе текущие затраты на энергию означают, что стоимость производства одной тонны зеленого аммиака примерно на 200-300 процентов выше, чем у обычного аммиака. Предполагается, что в более долгосрочной перспективе падение цен на возобновляемые источники энергии приведет к тому, что стоимость производства зеленого аммиака снизится на 50-150% по сравнению с обычным аммиаком. Увеличение стоимости углерода в Европе может еще больше уравнять правила игры. Необходимость максимизировать энергоэффективность и снизить затраты на возобновляемые источники энергии станут ключевыми факторами в развитии зеленого аммиака.
Признавая, что переход к зеленому аммиаку остается долгосрочной задачей, директор по исследованиям и разработкам Haldor Topsoe Пэт Хан говорит, что важно сделать первые шаги. Haldor Topsoe в настоящее время переходит от этапа исследований к этапу разработки в рамках этих первых шагов, и пилотная установка, основанная на технологии твердооксидного электролиза, уже механически завершена. Пилотный проект, финансируемый датским консорциумом, имеет производительность по сырому аммиаку 180 т/год. Следующим шагом после этой демонстрационной установки будет доведение технологии твердооксидного электролизера до коммерческой стадии. На будущих этапах Хальдор Топсе надеется предложить традиционным газовым установкам возможность добавления твердооксидной или другой электролизной технологии к существующим установкам, чтобы они могли перемещать часть (возможно, сначала 10%, которая может поэтапно) их выхода на производство зеленого аммиака. В этой гибридной конфигурации нет необходимости строить новый завод, поскольку производители могут использовать свои существующие мощности, добавляя только новый электролизер для частичного перехода на «зеленую» технологию.
Haldor Topsoe в настоящее время переходит от этапа исследований к этапу разработки в рамках этих первых шагов, и пилотная установка, основанная на технологии твердооксидного электролиза, уже механически завершена. Пилотный проект, финансируемый датским консорциумом, имеет производительность по сырому аммиаку 180 т/год. Следующим шагом после этой демонстрационной установки будет доведение технологии твердооксидного электролизера до коммерческой стадии. На будущих этапах Хальдор Топсе надеется предложить традиционным газовым установкам возможность добавления твердооксидной или другой электролизной технологии к существующим установкам, чтобы они могли перемещать часть (возможно, сначала 10%, которая может поэтапно) их выхода на производство зеленого аммиака. В этой гибридной конфигурации нет необходимости строить новый завод, поскольку производители могут использовать свои существующие мощности, добавляя только новый электролизер для частичного перехода на «зеленую» технологию.
Этот подход может представлять особый интерес для западноевропейских производителей, которые могут извлечь выгоду из доступных возобновляемых источников энергии, которые позволяют им производить зеленый аммиак с наименьшими затратами. Хотя за последние 30 лет в Западной Европе было построено несколько новых традиционных заводов по производству аммиака, сама Европа, вероятно, станет основным двигателем производства зеленого аммиака. В рамках программы ЕС по климату и энергетике на период до 2030 года государства-члены ЕС должны стремиться к сокращению выбросов парниковых газов не менее чем на 40 процентов к 2030 году (по сравнению с 1990).
Хотя за последние 30 лет в Западной Европе было построено несколько новых традиционных заводов по производству аммиака, сама Европа, вероятно, станет основным двигателем производства зеленого аммиака. В рамках программы ЕС по климату и энергетике на период до 2030 года государства-члены ЕС должны стремиться к сокращению выбросов парниковых газов не менее чем на 40 процентов к 2030 году (по сравнению с 1990).
Yara International взяла на себя обязательство сократить выбросы CO2 на 10 процентов к 2025 году и стремится к экологически нейтральному производству к 2050 году. Производитель имеет твердые планы заменить 10 процентов своего производства аммиака на юге Норвегии экологически чистым производством к 2022 году и полностью преобразовать к производству зеленого аммиака на своем заводе в Порсгрунне к 2050 году. Yara заключила партнерское соглашение с местной фирмой Nel Hydrogen, чтобы помочь ей достичь цели по сокращению выбросов углерода.
Даже компании, специализирующиеся на нефти и газе, вовлекаются в процесс производства зеленого аммиака. Компания KBR из Техаса разрабатывает решение K-GreeN, чтобы предложить клиентам полностью экологичный завод по производству аммиака: от электролизера до аммиака или дополнительный электролизер, для которого не требуется воздухоразделительная установка или контур синтеза.
Компания KBR из Техаса разрабатывает решение K-GreeN, чтобы предложить клиентам полностью экологичный завод по производству аммиака: от электролизера до аммиака или дополнительный электролизер, для которого не требуется воздухоразделительная установка или контур синтеза.
Ряд небольших организаций, занимающихся производством экологически чистого аммиака в Западной Европе и США, работают над инновационными способами кардинально изменить весь процесс производства аммиака. Некоторые из этих новых технологий полностью отходят от традиционного процесса Габера-Боша. Исландская компания Atmonia работает над катализатором, который работает при атмосферном давлении и не требует отдельного производства водорода в своем процессе, а использует непосредственно воду. Электрокаталитический процесс не выделяет CO2, а технология Atmonia позволяет работать с перерывами, при относительно небольших затратах, связанных с остановкой и возобновлением производства. «Это большое преимущество при использовании возобновляемых источников энергии, таких как солнечная и ветровая, для производства», — говорит генеральный директор Atmonia Гудбьорг Рист. В настоящее время компания создает прототип катализатора, который первоначально будет производить жидкий аммиак для использования в качестве удобрения на месте, «но конечной целью будет производство безводного аммиака», — говорит Рист.
В настоящее время компания создает прототип катализатора, который первоначально будет производить жидкий аммиак для использования в качестве удобрения на месте, «но конечной целью будет производство безводного аммиака», — говорит Рист.
В США компания Starfire Energy из Колорадо разрабатывает модульные системы для производства безуглеродного аммиака. Организация признала растущую потребность в возобновляемом топливе, которое можно хранить и использовать в транспортных и тепловых приложениях, и считает аммиак идеальным топливом.
Starfire Energy отошла от традиционной системы производства Haber-Bosch и разработала систему, которая требует более низкого давления, чем обычный аммиак. Компания разработала аммиачный реактор, который может напрямую реагировать на изменения мощности ветра и солнца и не использует ископаемое топливо в производственном процессе. Компания начала с прототипа реактора Rapid Ramp Nh4 производительностью 3 кг/сутки, а теперь построила систему производительностью 10 кг/сутки, которая станет основой для ее модульной пилотной системы производительностью 100 кг/сутки.


 С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование). Например, приятный аромат приобретают астры[16]
Например, приятный аромат приобретают астры[16] 21.by
21.by — М.: Высшая школа, 2001.
— М.: Высшая школа, 2001. 08 грамм. Для практического применения его надо сжижать (-252 градуса), тогда его плотность увеличивается до примерно 70 грамм на литр. Сравните с 780 граммами на литр для бензина. В итоге бак на 100 литров водорода в криогенном состоянии (под -252 градусами) будет содержать примерно в 3 раза меньше энергии, чем бензиновый.
08 грамм. Для практического применения его надо сжижать (-252 градуса), тогда его плотность увеличивается до примерно 70 грамм на литр. Сравните с 780 граммами на литр для бензина. В итоге бак на 100 литров водорода в криогенном состоянии (под -252 градусами) будет содержать примерно в 3 раза меньше энергии, чем бензиновый. Таким образом получается относительно дешевый водород, одна проблема, на выходе мы имеем СО2. Весь цикл оказывается таковым, что проще было просто сжечь метан, получили бы меньше выхлопов углекислого газа. Сейчас более 75% объемов производства водорода делается таким образом. Большая надежда нефтегазовой отрасли состоит в том, чтобы делать водород именно таким образом и объявлять себя зелеными. Некоторые из нефтяников и газовиков на этом фоне хотят развивать технологии улавливания СО2 из результатов производства водорода и закачивания его обратно в пласт откуда взяли метан. Теоретически мы можем это СО2 там заблокировать на миллионы лет. Но возможно он все равно будет оттуда утекать.
Таким образом получается относительно дешевый водород, одна проблема, на выходе мы имеем СО2. Весь цикл оказывается таковым, что проще было просто сжечь метан, получили бы меньше выхлопов углекислого газа. Сейчас более 75% объемов производства водорода делается таким образом. Большая надежда нефтегазовой отрасли состоит в том, чтобы делать водород именно таким образом и объявлять себя зелеными. Некоторые из нефтяников и газовиков на этом фоне хотят развивать технологии улавливания СО2 из результатов производства водорода и закачивания его обратно в пласт откуда взяли метан. Теоретически мы можем это СО2 там заблокировать на миллионы лет. Но возможно он все равно будет оттуда утекать.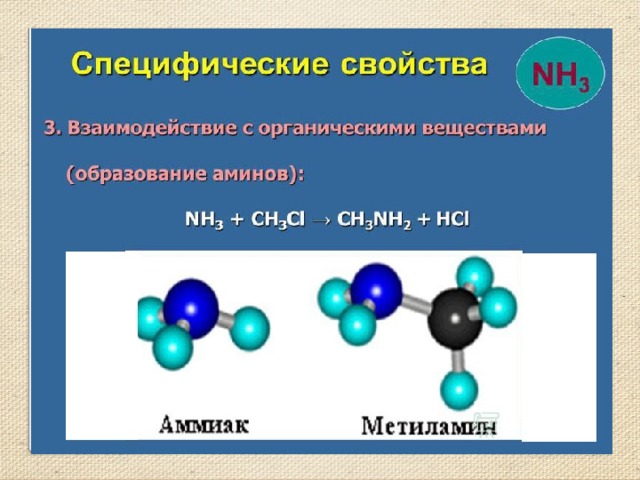 Если электричество было добыто с низким углеродным следом, то и водород такой будет с низким углеродным следом.
Если электричество было добыто с низким углеродным следом, то и водород такой будет с низким углеродным следом.
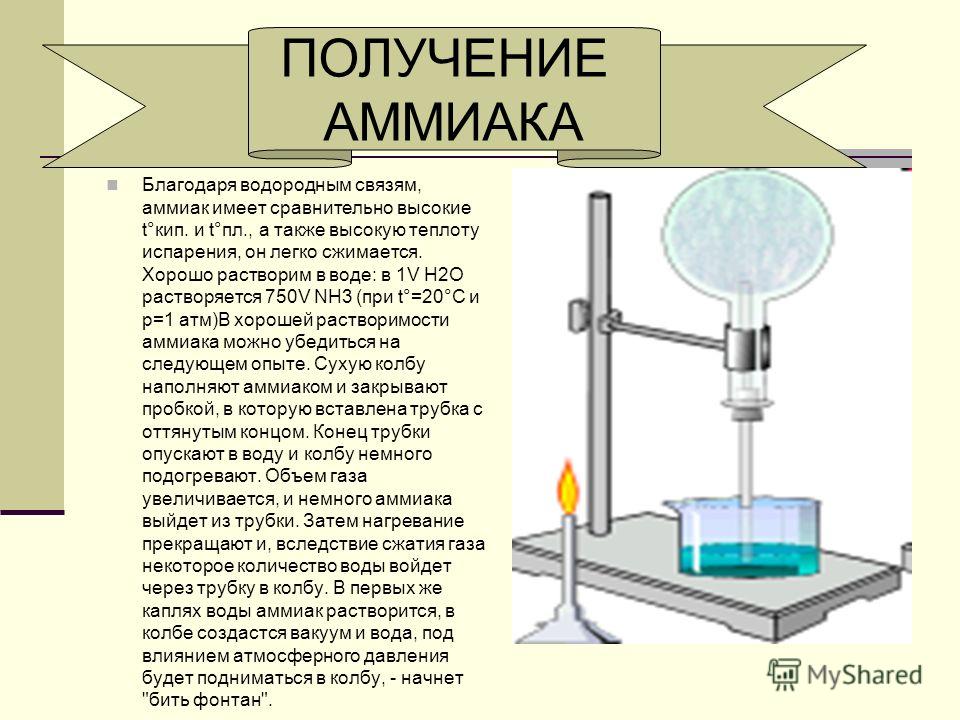
 В итоге все это базируется на зеленом способе производитель электроэнергию. Но с другой стороны, если будет много дешевой энергии, то и процесс Хабер-Бош можно организовать на зеленой энергии, а стабильность снабжения обеспечить батареями. Стартап получил 2.65 млн австралийских долларов на развитие проекта и идеи в марте 2021 года.
В итоге все это базируется на зеленом способе производитель электроэнергию. Но с другой стороны, если будет много дешевой энергии, то и процесс Хабер-Бош можно организовать на зеленой энергии, а стабильность снабжения обеспечить батареями. Стартап получил 2.65 млн австралийских долларов на развитие проекта и идеи в марте 2021 года. Это еще один признак большого изменения в индустрии. В рамках этого проекта Yara планирует сделать аммиак доступным для судов топливом к 2024 году.
Это еще один признак большого изменения в индустрии. В рамках этого проекта Yara планирует сделать аммиак доступным для судов топливом к 2024 году. Убедитесь, что аварийная вода доступна.
Убедитесь, что аварийная вода доступна. Держите выпускные клапаны открытыми, пока не будут выполнены все соединения. Жидкий аммиак в шланге может испаряться и создавать давление в шланге после закрытия клапанов шланга.
Держите выпускные клапаны открытыми, пока не будут выполнены все соединения. Жидкий аммиак в шланге может испаряться и создавать давление в шланге после закрытия клапанов шланга.


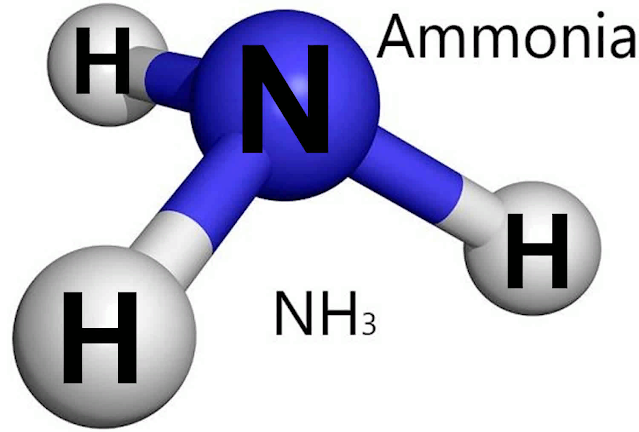 1
1