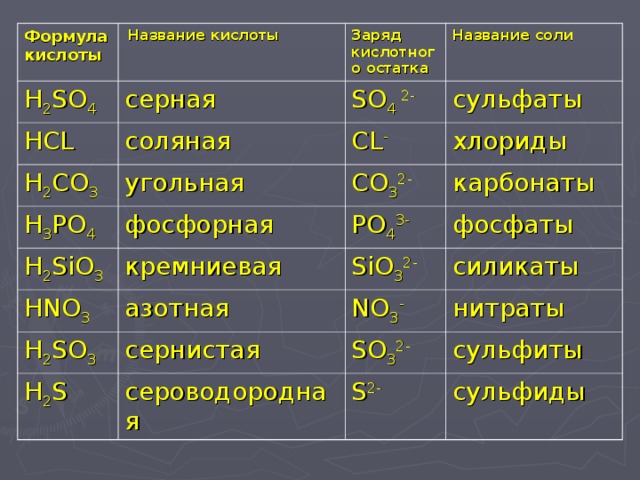
1) Оксид натрия 2) серная кислота 4) вода 8) соляная кислота 16) гидроксид бария 32) гидроксид натрия
Какие оксиды образуются при окислительном обжиге пирита? Укажите номер или сумму условных номеров, под которыми расположены формулы этих веществ.
1) FeO 2) CO2 4) SO3 8) Fe2O3 16) SO2
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые можно использовать для осушки углекислого газа.
1) P2O5 2) H2SO4 4) NaOH 8) Ca(OH)2 16) CaO
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые можно получить из оксида меди (II) в одну стадию.

1) Сu(NO3)2 2) Cu 4) CuSO4 8) Cu(OH)2 16) CuCl2 .
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, для которых справедливы следующие характеристики – являются при обычных условиях твердыми веществами, нерастворимы в воде, взаимодействуют как с кислотами, так и со щелочами.
1) СаO 2) ZnO 4) SO3 8) PbO 16) Ag2O
Состав обычного стекла часто выражают формулой в виде оксидов: Na2O·CaO·6SiO2. Какую массу оксида кремния в граммах необходимо взять для получения стекла массой 1кг?
Чему равна массовая доля элемента железа (в %) в оксиде железа (III)?
Установите формулу одного из оксидов марганца, количественный состав которого задан следующим соотношением: m(Mn) : m(O) = 1 : 1,02.
 В ответе укажите общее число
атомов в молекуле этого оксида.
В ответе укажите общее число
атомов в молекуле этого оксида.
ОСНОВАНИЯ
Напишите эмпирические и графические формулы гидроксидов калия, магния, алюминия, хрома (III), цинка. В ответе укажите число гидроксидов, обладающих амфотерными свойствами.
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, являющихся гидроксидами, растворимыми в воде.
16) NH4OH 32) LiOH.
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, являющихся щелочами.
1) Mg(OH)2 2) Fe(OH)3 4) Ba(OH)2 8) KOH
16) NH4OH 32) LiOH.
Укажите номер или сумму условных номеров, под которыми перечислены способы получения оснований.
1) Взаимодействие основания с кислотой 2) взаимодействие активного металла с водой 4) взаимодействие основных оксидов с водой 8) взаимодействие солей со щелочами
16) Электролиз водных растворов солей 32) взаимодействие амфотерных оксидов с водой.
Укажите номер или сумму условных номеров, под которыми расположены группы металлов, все из которых реагируют с водой с выделением водорода (без нагревания).
1) Mg, Ca 2) Fe, Na 4) Ba, Rb 8) K, Cs 16) Pb, Ca
32) Li, Rb.
Чему равна сумма коэффициентов в уравнении реакции раствора гидроксида бария с оксидом хлора (V)?
Какие продукты могут образоваться при взаимодействии оксида серы (IV) с раствором гидроксида калия? Укажите номер или сумму условных номеров, под которыми расположены формулы этих веществ.

1) К2S 2) K2
34. Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, все из которых способны в водных растворах реагировать с гидроксидом алюминия.
1) Mg(OH)2, CaCl2 2) RbOH, HNO3 4) BaCl2, H2SO4
8) KOH, HCl 16) H2SiO3, KNO3 32) LiOH, RbCl.
Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, все из которых способны реагировать в водном растворе с гидроксидом цинка.

1) MgCl2, Ca(OH)2 2) RbOH, HNO3 4) Ba(OH)2, H2SO4
8) KOH, HCl 16) H2SO3, KNO3 32) NaNO3, RbOH.
36. Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, все из которых способны реагировать в водном растворе с гидроксидом натрия.
1) PbCl2, CuSO4 2) RbOH, HNO3 4) Al2O3, CO2
8) Cl2, HCl 16) Si, Al 32) Cr2O3, Cl2O7
37
Укажите номер или сумму условных номеров,
под которыми расположены названия
веществ, способных реагировать и с
гидроксидом магния и гидроксидом хрома
(III).
Реакции ионного обмена
1. Реакции ионного обмена идут до конца, если: выпадает осадок, выделяется газ, образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не раскладывают.
Давайте порассуждаем вместе
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + H2SO4 = BaSO4 + 2HCl
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
3) 3BaCl2 + Al 2(SO4)3 = 3BaSO4 + 2AlCl3
4) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3
Ответ: уравнению №2, т.
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
2. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca(OH)2 + CO2 + CaCO3 + H2O
3) Ca(HCO
3)2 = CaCO3 + CO2 + H2O 4) CaO + CO2 = CaCO3
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3 выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
Ответ: №4, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
Ответ: №3, т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
5. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl—
2) Cu2+ и S2-
3) Al3+ и SO42-
4) Zn2+
и NO3—
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4
2) H2SO4 и Ba(OH)2
3) HNO3 + Ba(OH)2
4) HCl + Ba(OH)2
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) NH4Cl
2) CuCl2
3) ZnSO4
4) H3PO4
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + h3O
выделяется газ аммиак
Вопрос Видео: Использование данных титрования сильной кислоты и сильного основания для расчета концентрации основания
Стенограмма видео
В таблице ниже показаны результаты титрования 0,02 дециметра в кубе гидроксида бария 0,2 моля соляная кислота. Используя результаты в таблице и исключая любые аномалии, определить концентрацию гидроксида бария. Дайте ответ с точностью до двух знаков после запятой места.
Глядя на данные, мы видим
что для титрования один и титрования три требуются очень похожие объемы соляной
кислота.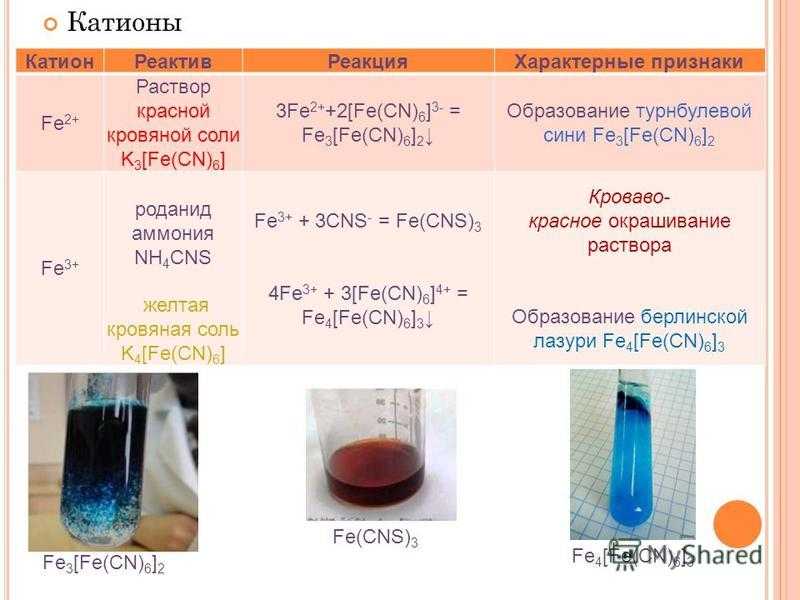 Однако требуется второе титрование.
еще более 10 миллилитров соляной кислоты. Эти данные не согласуются с
два других испытания, и их следует сбрасывать со счетов как аномалию. Затем мы можем взять объем HCL
раствор добавляют при первом и третьем титровании и находят средний объем
HCL. Выполнение расчета дает нам
средний объем 61,5 миллилитров.
Однако требуется второе титрование.
еще более 10 миллилитров соляной кислоты. Эти данные не согласуются с
два других испытания, и их следует сбрасывать со счетов как аномалию. Затем мы можем взять объем HCL
раствор добавляют при первом и третьем титровании и находят средний объем
HCL. Выполнение расчета дает нам
средний объем 61,5 миллилитров.
Далее мы можем написать сбалансированный химическое уравнение между гидроксидом бария и соляной кислотой. Мы видим, что реакция гидроксид бария, основание, с соляной кислотой, кислотой, дает хлорид бария — соль — и вода. Будьте осторожны и убедитесь, что химическое уравнение уравновешивается добавлением соответствующих коэффициентов перед продолжением на с остальной частью проблемы.
Затем вспомните ключевое уравнение для
решение задач титрования: 𝑛 равно 𝑐𝑣, где 𝑛 представляет количество в молях,
𝑐 — концентрация в молях на литр, а 𝑣 — объем в литрах.
Мы можем сделать стол в соответствии с значения, указанные в вопросе, с переменными нашего ключевого уравнения. Мы также запишем молярное соотношение кислоты и основания. Для этого титрования требуется 0,02 кубических дециметров гидроксида бария. Напомним, что один дециметр в кубе равен то же, что один литр. Затем мы можем добавить наш объем к таблица с единицей измерения литров вместо дециметров в кубе. Раствор гидроксида бария был титруют 0,2-молярным раствором соляной кислоты. Мы можем добавить эту концентрацию к нашу таблицу в соответствующем поле, признавая, что молярный и моль на литр эквивалентные единицы.
Мы также знаем средний объем
соляной кислоты, используемой в эксперименте. Объем указан в миллилитрах, но
необходимо преобразовать в литры, чтобы литры и единицы концентрации
отменить при решении. Знайте, что 1000 миллилитров
эквивалентно одному литру. Мы можем умножить 61,5
миллилитров на один литр на 1000 миллилитров. Единица миллилитров отменится,
что дает нам объем 0,0615 л. В конечном итоге мы хотим решить
для концентрации гидроксида бария.
Знайте, что 1000 миллилитров
эквивалентно одному литру. Мы можем умножить 61,5
миллилитров на один литр на 1000 миллилитров. Единица миллилитров отменится,
что дает нам объем 0,0615 л. В конечном итоге мы хотим решить
для концентрации гидроксида бария.
Теперь, когда заданные значения заполнены в таблице, мы готовы решить проблему. Мы можем заменить нашу соляную концентрацию кислоты и объем в ключевое уравнение для определения количества молей соляной кислоты 0,0123 моль. Теперь, когда мы знаем количество молей используемой кислоты, мы можем определить количество молей основания, используемого в титрование.
Глядя на наш сбалансированный химический
уравнение, мы можем видеть, что молярное отношение гидроксида бария к соляной кислоте
это один к двум. Поскольку молярное соотношение не равно
один, нам нужно будет выполнить расчет для преобразования молей соляной кислоты
в моли гидроксида бария. Начнем этот процесс с
моль соляной кислоты. Затем умножаем это значение на
молярное отношение, записанное в виде дроби с молями соляной кислоты в знаменателе
так что единицы сокращаются. Выполняем расчет и
определите, что количество молей гидроксида бария равно 0,00615 моль.
Начнем этот процесс с
моль соляной кислоты. Затем умножаем это значение на
молярное отношение, записанное в виде дроби с молями соляной кислоты в знаменателе
так что единицы сокращаются. Выполняем расчет и
определите, что количество молей гидроксида бария равно 0,00615 моль.
Далее мы можем переставить наш ключ уравнение, которое нужно решить для концентрации гидроксида бария. Мы можем заменить наш барий количество и объем гидроксида и определить концентрацию гидроксида бария до быть 0,3075 моль. Но вопрос задает нам ответ округляется до двух знаков после запятой. Округление нашего ответа соответствующим образом дает нам конечную концентрацию 0,31 мол.
Для следующей реакции 30,3 грамма соляной кислоты реагируют с 61,0 граммом гидроксида бария.
Химические лимитирующие реагенты
Татьяна Александровна
спросил 17. 03.18
03.18соляная кислота (водн.) + гидроксид бария (водн.) хлорид бария (водн.) + вода (л)
Какое максимальное количество хлорида бария может образоваться? грамм
Что такое ФОРМУЛА лимитирующего реагента?
Какое количество избыточного реагента остается после завершения реакции? грамм
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: ЛучшиеНовыеСамыеСтарые
Дж. Р. С. ответил 17.03.18
Репетитор
5,0 (141)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Сначала напишите сбалансированное уравнение реакции: 2HCl(водн. ) + Ba(OH)2(водн.) ==> BaCl 2 (водн.) + 2H 2 O(л)
) + Ba(OH)2(водн.) ==> BaCl 2 (водн.) + 2H 2 O(л)
Затем найдите ограничивающий реагент. Это проще всего сделать, сравнив количество молей HCl с количеством молей Ba(OH) 2 и разделив каждое значение на коэффициент в сбалансированном уравнении.
>> Моль HCl = 30,3 г x 1 моль/36,5 г = 0,830 моль HCl (деленное на 2 = 0,415 моль)
>> моль Ba(OH) 2 = 61,0 г x 1 моль/171 г = 0,357 моль с Ba(OH) 2 9 0064 (деленное на 1 = 0,357 моль)
Поскольку 0,357 меньше 0,415, Ba(OH) 2 является предельным.
Максимальное количество BaCl 2 , которое может образоваться (в граммах), определяется количеством Ba(OH) 2
0,357 моль Ba(OH) 2 x 1 моль BaCl 2 / родинка Ва(ОН) 2 = 0,357 моль BaCl 2 может образоваться
Масса = 0,357 моль BaCl 2 x 208 г/моль = 74,2 грамма BaCl
Формула лимитирующего реагента Ba(OH) 2
Количество избыточного реагента (HCl) определяется следующим образом:
0,357 моль Ba(OH) 2 = Прореагировало 0,714 моль HCl.


 В ответе укажите общее число
атомов в молекуле этого оксида.
В ответе укажите общее число
атомов в молекуле этого оксида.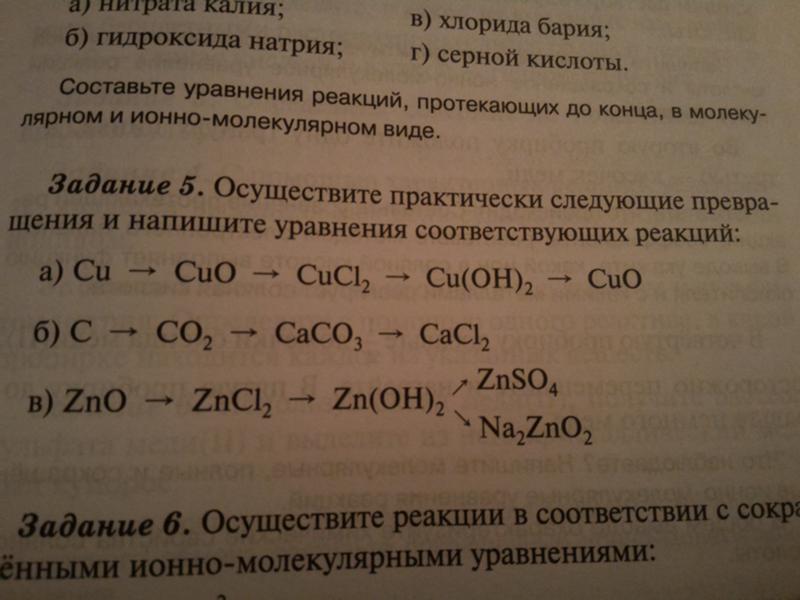

 к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O