Хромовый ангидрид
Главная / Химическое сырье / Хромовый ангидрид — CrO3
%D
%d.%M.%y
%h~:~%m
Хромовый ангидрид (триоксид хрома, трёхокись хрома, оксид хрома IV), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + H2O → H2CrO4,
или дихромовая кислота (при избытке CrO
2CrO3 + H2O → H2Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + H2O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»). Окисляет иод, серу, фосфор, уголь, например:
4CrO3 + 3S → 2Cr2O3 + 3SO2↑.
Получение
Получают действием H2SO4 на дихромат натрия Na2Cr2
O7 (реже дихромат калия K2Cr2O7).Na2Cr2O7 + H2SO4 → 2CrO3 + Na2SO4 + H2O
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Хромовый ангидрид
Оптовые поставки по России и странам СНГ
Узнать стоимость
Синонимы: Оксид хрома (VI), Трёхокись хрома, Хромовая кислота, Chromic anhydride
Формула: CrO3
CAS: 1333-82-0
Код ТН ВЭД: 2819100000
Стандарт: ГОСТ 2548-77
Описание:
По внешнему виду хромовый ангидрид технический представляет собой чешуйки или гранулы малиново-красного цвета.
Применение:
Хромовый ангидрид технический используют в производстве:
- Металлического хрома высокой чистоты
- Сверхтвердых материалов
- Электролитического хрома
- Катализаторов
- Литья в составе формовочных и стержневых смесей
- Для процессов хромирования, хроматирования и пассивирования
- Для процессов травления и других целей
ГОСТ 2548-77
Оставить заявку
| Технические характеристики | Марка А | Марка Б | Марка В |
|---|---|---|---|
| Массовая доля хромового ангидрида (CrO3), % не менее | 99,7 | 98,8 | 98,0 |
| Массовая доля веществ, нерастворимых в воде, % не более | 0,02 | 0,05 | Не нормируется |
| Массовая доля сульфатов (SO4), % не более | 0,06 | 0,18 | Не нормируется |
| Массовая доля натрия (Na), % не более | 0,05 | Не нормируется | Не нормируется |
Упаковка:
- Хромовый ангидрид упаковывают в:
- Неокрашенные металлические барабаны, нетто 50 кг (сертифицированные в соответствии с требованиями ООН)
- Металлические барабаны со съемным верхним днищем, нетто 250 кг (сертифицированные в соответствии с требованиями ООН)
- Металлические барабаны со съемным верхним днищем, нетто 50 кг (сертифицированные в соответствии с требованиями ООН)
Хранение:
Хромовый ангидрид хранят в закрытых складских помещениях в неповрежденной упаковке. Гарантийный срок хранения хромового ангидрида — год со дня изготовления.
Гарантийный срок хранения хромового ангидрида — год со дня изготовления.
Транспортировка:
Хромовый ангидрид перевозят всеми видами транспорта в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
Техника безопасности:
Работающие с хромовым ангидридом должны быть обеспечены специальной одеждой, средствами индивидуальной защиты ног и рук, средствами индивидуальной защиты органов дыхания, лица и глаз.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Введите ваше имя
Введите ваш телефон
Нажимая кнопку «Получить бесплатную консультацию», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Узнать стоимость», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Оставить заявку», Вы соглашаетесь с условиями Политики конфиденциальности.
Окисление хромовой кислотой — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15384
Одним из реагентов, обычно используемых для окисления в органической химии, является хромовая кислота.
Хромовая кислота, H 2 CrO 4 , является сильной кислотой и реагентом для окисления спиртов до кетонов и карбоновых кислот. По вполне приземленным причинам, в первую очередь из соображений безопасности и удобства, хромовую кислоту, как правило, производят в реакционном сосуде по мере необходимости (путем добавления кислоты к источнику хрома), а не разливают из бутылки.
Вот тут-то и начинаются проблемы. Выбор источника хрома для производства H 2 CrO 4 от очень похоже на выбор любимой марки бутилированной воды. Помимо упаковки, они почти все одинаковые. Однако в зависимости от того, какой у вас учебник или инструктор, вы можете увидеть несколько разных способов сделать это, и это может быть очень запутанным.
Ключевым моментом является то, что Na 2 CrO 4 (хромат натрия), Na 2 Cr 2 O 7 (дихромат натрия), K 2 CrO 2 Cr 2 O 7 (дихромат калия) и CrO 3 (триоксид хрома) похожи в одном важном отношении: когда они объединяются с водной кислотой, каждый из них образует H 2 CrO 4 и, в конечном счете, H 2 CrO 4 , который отвечает за важные химические процессы. К сожалению, я редко вижу объяснение этого момента в учебниках. Я помню, что это вызвало у меня некоторое замешательство, когда я проходил курс. Присутствующие ионы K или Na являются просто зрителями.
К сожалению, я редко вижу объяснение этого момента в учебниках. Я помню, что это вызвало у меня некоторое замешательство, когда я проходил курс. Присутствующие ионы K или Na являются просто зрителями.
После образования H
Он делает это за счет присоединения кислорода спирта к хрому, что делает его хорошей уходящей группой; основание (наиболее вероятным виновником является вода) может затем удалить протон из углерода, образуя новую π-связь и разрывая связь O-Cr.
Из-за своей высокой токсичности хромовая кислота практически не используется в лабораториях органической химии за пределами лабораторий для студентов. Есть гораздо более полезные реагенты для выполнения этих преобразований.
Авторы
Oxidation by Chromic Acid распространяется под лицензией CC BY-NC-SA 4. 0, автор, ремикс и/или куратор LibreTexts.
0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Книга или Раздел
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Хромовая кислота
Уксусная кислота — Sciencemadness Wiki
Уксусная кислота (или Этановая кислота ) представляет собой органическое соединение с химической формулой CH 3 COOH . Это бесцветная жидкость, которая в неразбавленном виде называется ледяной уксусной кислотой .
Это бесцветная жидкость, которая в неразбавленном виде называется ледяной уксусной кислотой .
Уксус содержит приблизительно 4-8% уксусной кислоты по объему, и его характерный запах и вкус обусловлены уксусной кислотой. Хотя концентрированная уксусная кислота классифицируется как слабая кислота, она вызывает коррозию и может повредить кожу.
Содержимое
- 1 Недвижимость
- 1.1 Физический
- 1.2 Химическая
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 ссылок
- 6.1 Соответствующие темы Sciencemadness
Свойства
Физические свойства
Уксусная кислота представляет собой прозрачную бесцветную жидкость при комнатной температуре с немного более высокой вязкостью, чем вода, затвердевающая при температуре около 10 °C и кипящая при 117–118 °C. вкус. Уксусная кислота представляет собой полярный протонный растворитель, подобный этанолу и воде, но в отличие от воды уксусная кислота может растворять не только полярные соединения, такие как неорганические соли и сахара, но и неполярные соединения, такие как масла, и такие элементы, как сера и йод. Он легко смешивается с другими полярными и неполярными растворителями, такими как вода, хлороформ и гексан. С высшими алканами (начиная с октана) уксусная кислота больше не смешивается полностью, и ее смешиваемость продолжает снижаться с более длинными н-алканами.
вкус. Уксусная кислота представляет собой полярный протонный растворитель, подобный этанолу и воде, но в отличие от воды уксусная кислота может растворять не только полярные соединения, такие как неорганические соли и сахара, но и неполярные соединения, такие как масла, и такие элементы, как сера и йод. Он легко смешивается с другими полярными и неполярными растворителями, такими как вода, хлороформ и гексан. С высшими алканами (начиная с октана) уксусная кислота больше не смешивается полностью, и ее смешиваемость продолжает снижаться с более длинными н-алканами.
Эта растворяющая способность и смешиваемость уксусной кислоты делают ее широко используемым промышленным химикатом, например, в качестве растворителя при производстве диметилтерефталата.
Химическая
Уксусная кислота вступает в химические реакции, типичные для карбоновой кислоты. При обработке стандартным основанием он превращается в ацетат металла и воду:
- CH 3 COOH + MOH → CH 3 COOM + H 2
С супероснованиями (например, литийорганическими реагентами) может быть дважды депротонировано с получением LiCH 2 CO 2 Li. Восстановление уксусной кислоты дает этанол.
Восстановление уксусной кислоты дает этанол.
При нагревании выше 440 °C (824 °F) уксусная кислота разлагается с образованием метана и двуокиси углерода или кетена и воды:
- CH 3 COOH → CH 4 + CO 2
- CH 3 COOH → CH 2 CO + H 2 O
Уксусная кислота вызывает умеренную коррозию металлов, включая магний, железо и цинк, образуя газообразный водород и ацетаты металлов.
- Mg + 2 CH 3 COOH → Mg(CH 3 COO) 2 + H 2
- Fe + 2 CH 3 COOH → Fe(CH 3 COO) 2 + H 2
- Zn + 2 CH 3 COOH → Zn(CH 3 COO) 2 + H 2
При смешивании с достаточным количеством окислителя, обычно с перекисью водорода, уксусная кислота может непосредственно реагировать с менее реакционноспособным металлов (таких как медь) для получения ацетата, хотя для продолжения процесса потребуется добавить больше перекиси водорода. Ацетат меди можно получить таким образом. Ацетаты также можно получить из уксусной кислоты и соответствующего карбоната или гидроксида, как в популярной реакции с пищевой содой:
Ацетат меди можно получить таким образом. Ацетаты также можно получить из уксусной кислоты и соответствующего карбоната или гидроксида, как в популярной реакции с пищевой содой:
- NaHCO 3 + CH 3 COOH → CH 3 COONa + CO 2 + H 2 O
Поскольку алюминий пассивирует кислотоупорную пленку, алюминий образует кислотостойкую пленку. для транспорта уксусной кислоты.
Уксусная кислота будет реагировать со спиртами в присутствии катализатора, такого как серная кислота, с образованием сложных эфиров:
- CH 3 COOH + R-OH → CH 3 C(=O)O-R + H 2 O
Уксусная кислота реагирует с хлордегидратирующими агентами, такими как трихлорид/пентахлорид фосфора, тионилхлорид, сульфурилхлорид или фосген, с образованием ацетилхлорида:
- 3 CH 3 COOH + PCl 3 → CH 3 COCl + 3 HCl + H 3 PO 4
- 5 CH 3 COOH + PCl 5 → CH 3 COCl + 5 HCl + H 3 PO 4
- 2 CH 3 COOH + SOCl 2 → CH 3 COCl + HCl + SO 2
- 2 CH 3 COOH + SO 2 Cl 2 → CH 3 COCl + 2 HCl + SO 2
- 2 CH 3 COOH + COCl 2 → CH 3 COCl + 2 HCl + CO 2
Доступность
Хотя его дистиллированная форма уксуса является наиболее доступной из-за низкой концентрации уксусной кислоты, и большое количество места, которое он требует, другие источники необходимы для эффективного использования в качестве реагента.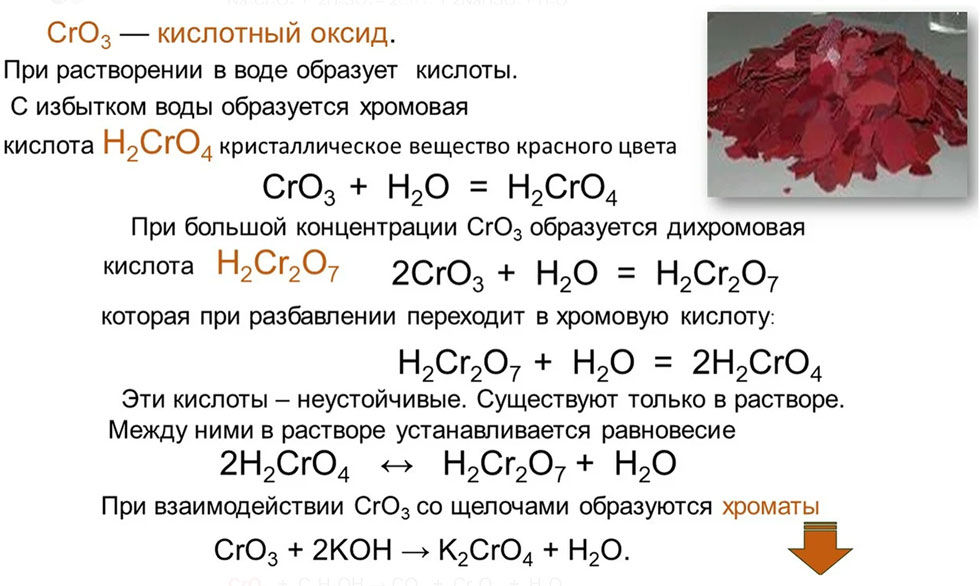 Хорошим источником пищевой уксусной кислоты является уксусная эссенция, которая имеет концентрацию уксусной кислоты от 20 до 80%, в зависимости от марки, и ее можно найти во многих магазинах, хотя в некоторых странах ее стало трудно найти в последние годы.
Хорошим источником пищевой уксусной кислоты является уксусная эссенция, которая имеет концентрацию уксусной кислоты от 20 до 80%, в зависимости от марки, и ее можно найти во многих магазинах, хотя в некоторых странах ее стало трудно найти в последние годы.
Уксусная кислота также используется в фотографических стоп-ваннах, которые состоят из высокой концентрации забуференной уксусной кислоты, часто с включенным индикатором pH. Их можно удалить перегонкой. Ледяную уксусную кислоту также можно приобрести у онлайн-поставщиков по скромным ценам.
Уксусная кислота также продается в некоторых магазинах пчеловодов в различных концентрациях, таких как 60%, 80% и 100%.
Дистиллированный уксус не является дистиллированной уксусной кислотой. При производстве дистиллированного уксуса дистиллируются исходные ингредиенты, а НЕ конечный продукт. В продукте присутствуют значительные количества органических загрязнителей, которые, как можно наблюдать, разлагаются при нагревании. Ацетат натрия, приготовленный из пищевой соды и дистиллированного уксуса и вываренный досуха, имеет тенденцию быть коричневым, а не чисто белым.
Ацетат натрия, приготовленный из пищевой соды и дистиллированного уксуса и вываренный досуха, имеет тенденцию быть коричневым, а не чисто белым.
Подготовка
Один из наиболее распространенных синтезов уксусной кислоты включает подкисление избытка ацетатной соли с получением уксусной кислоты. Этот несколько непрактичный метод требует добавления концентрированной серной кислоты к безводному ацетату кальция или ацетату натрия с последующей второй перегонкой над безводной гигроскопичной солью для удаления воды. Ацетатную соль в этом методе легко получить путем соединения домашнего уксуса с основанием и последующей кристаллизацией прореагировавшего раствора, но это очень утомительный процесс для получения больших количеств кислоты.
Проекты
- Получение эфиров ацетата, таких как метилацетат и этилацетат
- Сделать ацетат натрия или кальция
- Удаление ржавчины
- Стерилизация ульев
- Кулинария (уксус, пищевой)
Обращение
Безопасность
Разбавленная уксусная кислота, она же уксус, раздражает нос и рот, а ледяная уксусная кислота вызывает коррозию.
