Гидролиз солей — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Гидролиз солей
Дмитриенко О. ВГидролизом соли называется взаимодействие
ионов соли с водой,
в результате которого изменяется рН среды.
В процессе гидролиза соли в водном растворе
появляется избыток катионов Н+ или анионов
ОН-
ГИДРОЛИЗ – это реакция обмена между
некоторыми солями и водой приводящая к
образованию слабого электролита.
4. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
Окраскалакмусов
ой бумаги
Среда
Ионы
Раствор щелочи
Синяя
Щелочная
ОН-
Раствор кислоты
Красная
Кислотная
Н+
Дистиллированная
вода
Бесцветная
Нейтральная
Н+ = ОН-
В зависимости от силы исходной кислоты и исходного
основания, образовавших соль, выделяют 4 типа солей.

1. Соли, образованные катионом сильного основания и
анионом слабой кислоты. Они подвергаются гидролизу по
аниону.
К таким солям относятся: Na2CO3, Na2S, K2SO3, Ch4COOK, NaCN,
Ba(NO2)2 и т. д.
Их растворы имеют щелочную реакцию среды, рН > 7.
Лакмус в таких растворах синий,
фенолфталеин приобретает малиновую окраску,
метилоранж — жёлтый.
Na2S ↔ 2Na+ + S2S2- + h3O ↔ HS- + OHNa2S + h3O ↔ NaHS + NaOH
6. Механизм гидролиза карбоната натрия
h3ONa2CO3
H+ + Oh3Na+ + CO32-
2Na+ +CO32- +HOH
HCO3- +2Na+ +OH-
7. CO32- +HOH HCO3- +OH- Na2CO3 +h3O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая соль.
CO32- +HOHHCO3- +OHNa2CO3 +h3O NaHCO3 +NaOH
Одним из продуктов данной обменной реакции
является кислая соль.
Сформулируем вывод:
Раствор соли, образованной
________________, имеет__________реакцию,
так
как
в
растворе
избыток
________________.
8.
 Схема гидролиза карбоната натрияNa2CO3
Схема гидролиза карбоната натрияNa2CO3NaOH
сильное основание
[OH]-
h3CO3
>
слабая кислота
[H]+
(что сильней того и больше!)
Щ е л о ч н а я среда
2. Cоли, образованные катионом слабого основания и
анионом сильной кислоты. Они подвергаются гидролизу
по катиону.
К таким солям относятся: ZnCl2, FeCl3, CuCl2, Nh5I, Al2(SO4)3 и
др..
Их растворы имеют кислую реакцию среды, рН < 7.
Лакмус и метилоранж в таких растворах имеют красный цвет,
фенолфталеин не изменяет окраски.
FeCl2 ↔ Fe2+ + 2ClFe2+ + h3O ↔ (FeOH)+ + H+
FeCl2 + h3O ↔ FeOHCl + HCl
10. Механизм гидролиза хлорида алюминия
H 2OAlCl3
H+ + OH-
Al3+ + 3Cl-
Al3+ +3Cl- +HOH
Al Oh3+ +H+ + 3Cl-
11. Al3+ + HOH AlOh3+ + H+ AlCl3 + h3O AlOHCl2 + HCl Одним из продуктов данной обменной реакции является основная соль.
Al3+ + HOHAlCl3 + h3O
AlOh3+ + H+
AlOHCl2 + HCl
Одним из продуктов данной обменной реакции
является основная соль.

Сформулируем вывод:
Раствор соли, образованной
________________, имеет
_____________реакцию, так как в растворе
избыток___________________.
12. Схема гидролиза хлорида алюминия
AlCl3Al(OH)3
слабое основание
[OH]-
HCl
<
сильная кислота
[H]+
(что сильней того и больше!)
К и с л а я среда
3. Соли, образованные катионом слабого основания и
анионом слабой кислоты. Они подвергаются гидролизу по
катиону и по аниону одновременно.
К таким солям относятся: Ch4COONh5, (Nh5)2S, Nh5CN.
Реакция среды их растворов может быть нейтральной, слабо
щелочной или слабо кислотной в зависимости константы
диссоциации образующихся продуктов.
Ch4COONh5 ↔ Ch4COO- + Nh5+
Ch4COO- + Nh5+ + h3O ↔ Ch4COOH + Nh5OH
Ch4COONh5 + h3O ↔ Ch4COOH + Nh5OH
КД (СН3СООН) = КД (Nh5OН) , поэтому рН раствора =7
4. Соли, образованные катионом сильного основания и
анионом сильной кислоты не подвергаются гидролизу.

К таким солям относятся: NaCl, K2SO4, NaNO3.
Их растворы имеют нейтральную реакцию среды, рН = 7.
Окраска индикаторов в таких растворах не изменяется.
14. Механизм гидролиза хлорида натрия
h3ONaСl
H+ + OHNa+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Данная соль гидролизу не подвергается.
15. NaCl + Н2О =
Сформулируем вывод:Раствор соли, образованной__________________,
имеет________________________реакцию, так как в
растворе__________________________________.
16. Схема гидролиза карбоната натрия
NaClNaOH
HCl
сильное основание
[OH]-
сильная кислота
=
[H]+
Н е й т р а л ь н а я среда
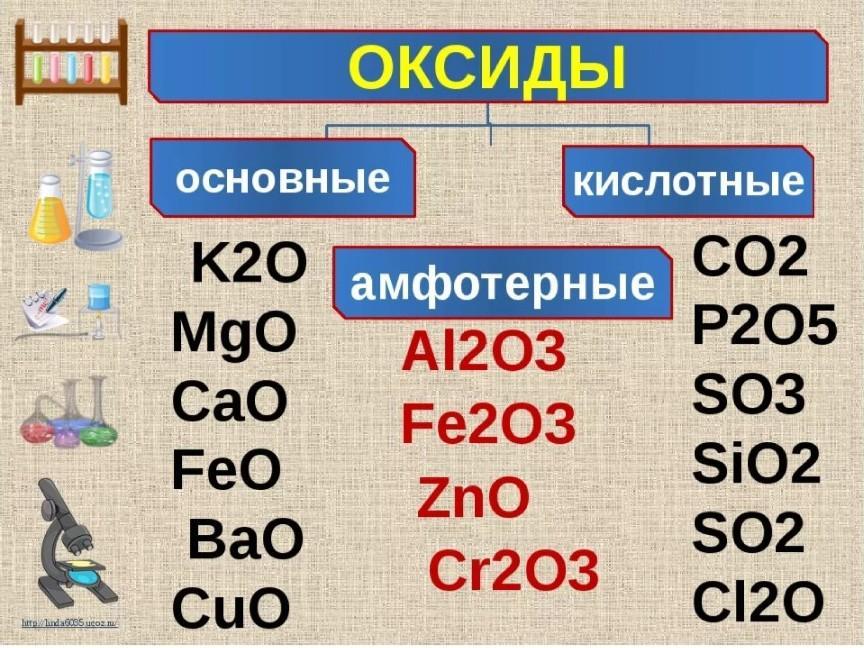
17. Самостоятельно заполните таблицу
Названиесоли
Уравнение гидролиза
Среда
раствора
Карбона
т калия
CO32- + HOH
K2CO3+ h3O
щелочн синяя
Нитрат
железа
(II)
Fe2+ + HOH
FeOH+ + H+
Fe(NO3)2 + h3O
FeOHNO3 +
HNO3
кислотн красная
Хлорид
бария
Ba2+ + 2Cl- + HOH
Ba2+ + 2Cl- + HOH
BaCl2 + h3O =
нейтр
HCO3- +OHKHCO3 + KOH
Окраска
лакмусово
й бумаги
бесцветн
ая
Необратимый гидролиз
Для большинства солей гидролиз обратимый процесс.

Однако есть соли, продукты гидролиза которых выводятся из
сферы реакции, и гидролиз становится необратимым.
Такими солями являются: Al2S3, (Nh5)2S, Fe2(CO3)3, (Nh5)2SiO3
В уравнениях необратимого гидролиза солей ставится знак
равенства:
Al2S3 + 6h3O = 2Al(OH)3↓+ 3h3S↑.
Необратимому гидролизу подвергаются также бинарные
соединения:
Mg3N2, CaC2, Р2S5
Запишите гидролиз бинарных соединений самостоятельно
English Русский Правила
Гидролиз солей
Download 1.19 Mb.
|
1 2 3 4
Bog’liq
Gidroliz soley
4Ishlab chiqarishning sanitariyasi va gigiyenasi, 3Ishlab chiqarishda sodir bo‘ladigan baxtsiz xodisalar va kasb kasalliklari, 1,2,3 test jismoniy tarbiya, 9.
- Bu sahifa navigatsiya:
- ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- Механизм гидролиза карбоната натрия
| Гидролиз солей Гидролизом соли называется взаимодействие ионов соли с водой,в результате которого изменяется рН среды. В процессе гидролиза соли в водном растворе появляется избыток катионов Н+ или анионов ОН-ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей. 
К таким солям относятся: Na2CO3, Na2S, K2SO3, Ch4COOK, NaCN, Ba(NO2)2 и т. д. Их растворы имеют щелочную реакцию среды, рН > 7. Лакмус в таких растворах синий, фенолфталеин приобретает малиновую окраску, метилоранж — жёлтый. Na2S ↔ 2Na+ + S2- S2- + h3O ↔ HS- + OH- Na2S + h3O ↔ NaHS + NaOH h3O H+ + OH- Na2CO3 2Na+ + CO32-2Na+ +CO32- +HOH HCO3- +2Na+ +OH-Download 1.19 Mb. Do’stlaringiz bilan baham: |
1 2 3 4
Ma’lumotlar bazasi mualliflik huquqi bilan himoyalangan ©fayllar.org 2023
ma’muriyatiga murojaat qiling
[Решено] Как сбалансировать эти уравнения AgNO3 + CuCl2 —-> AgCl +.
 ..
..Получите больше от подписки*
- Доступ к более чем 100 миллионам учебных ресурсов по конкретным курсам
- Круглосуточная помощь опытных наставников по более чем 140 предметам
- Полный доступ к более чем 1 миллиону решений для учебников
*Вы можете изменить, приостановить или отменить в любое время
Вопрос от Alak24
Как сбалансировать эти уравнения
AgNO3 + CuCl2 —-> AgCl + Cu(NO3)2
Ca + HOH —-> CaO +h3
KClO3 ——> KCl + O2
Наука Химия ХИМИЯ 131
Ответ и объяснение
Решено проверенным экспертом
Ответил проф. Мбадала
Мбадала
а. Fusce dui lectus, congue vel laore
lestie consequat, ult
lestie consequat, ultri
, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet a
Разблокируйте полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответДругой ответ
Ответил преподаватель
a. Fusce dui lectus, congue vel laore
lestie consequat, ult
cing elit. Nam lacinia p
, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet a
Разблокируйте полный доступ к Course Hero
Ознакомьтесь с более чем 16 миллионами пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы просмотреть ответ
Другой ответ
Донец Аликет.
лести консекват, ульта
лести консекват, ультра
sum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoree
Получите полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответ
Другой ответ
Ответил Elena_simpsonf
a. Fusce dui lectus, congue vel laore
lestie consequat, ult
cing elit. Nam lacinia p
а. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lac
Разблокировать полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответ
Почему na2co3 является основным? Объяснено Sharing Culture
Последнее обновление: 03 января 2023 г.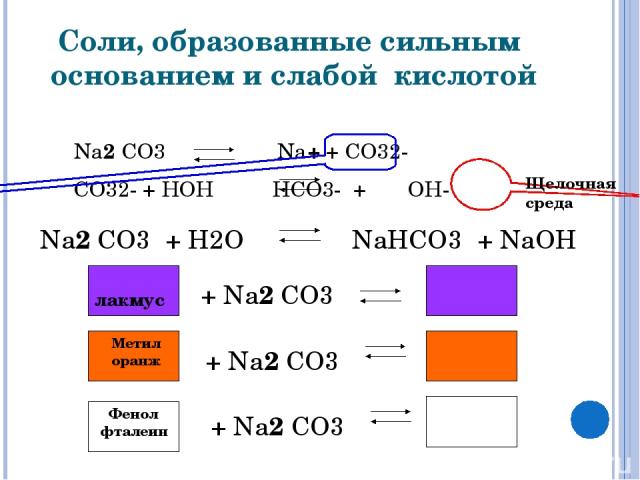
Это вопрос, который время от времени задают наши эксперты. Теперь у нас есть полное подробное объяснение и ответ для всех, кто заинтересован!
Вопрос задан: Д-р Руби Циманн
Оценка: 4,6/5 (1 голос)
Водный раствор карбоната натрия (Na 2 CO 3 ) является основным по своей природе из-за наличия большего количества гидроксид-ионов, образующихся в результате гидролиза карбонат-ионов (CO 3 2 + H 90 2 O → HCO 3 – + OH – ). Присутствие меньшего количества ионов водорода и большего количества ионов OH – повышает уровень pH раствора Na 2 CO 3 .
Почему na2co3 является основной солью?
Полный ответ:
— Карбонат-ион является нуклеофилом, поэтому он легко реагирует с протонами с образованием угольной кислоты, h3CO3. — Теперь мы знаем, что гидроксид натрия является сильным основанием, а угольная кислота — слабой кислотой. — Следовательно, карбонат натрия является основной солью , потому что это соль, полученная из слабой кислоты и сильного основания .
— Теперь мы знаем, что гидроксид натрия является сильным основанием, а угольная кислота — слабой кислотой. — Следовательно, карбонат натрия является основной солью , потому что это соль, полученная из слабой кислоты и сильного основания .
Почему na2co3 более щелочной, чем NaHCO3?
Ответ: В водном растворе карбоната натрия существует два иона натрия, тогда как в водном растворе гидрокарбоната натрия существует один ион. Наличие большего количества ионов металлов в водном растворе карбоната натрия делает его основным, чем водный раствор бикарбоната натрия.
Почему Na2CO3 является слабым основанием?
Он остается недиссоциированным, потому что угольная кислота является слабой кислотой . … Поэтому из-за присутствия дополнительных ионов ОН – , образующихся при гидролизе, раствор становится основным. Химическое соединение с молекулярной формулой Na 2 CO 3 представляет собой карбонат натрия.
Какой из них является более основным Na2CO3 или NaHCo3?
Ответ: Na2CO3 более щелочной , а NaHCO3 более кислый.
Является ли Na2CO3 кислотным, щелочным или нейтральным (растворенным в воде)?
Является ли nahco3 основным?
Как мы знаем, бикарбонат натрия является основной солью в природе , и его значение pH лежит в пределах 8 – 9. Таким образом, когда NaHCO 3 добавляют к раствору сильной кислоты, он образует натриевую соль и угольную соль. кислота. Углекислота — это двухосновная кислота, имеющая химическую формулу H9.0118 2 СО 3 .
Является ли Na2CO3 слабым основанием?
Карбонаты получают в результате реакции между угольной кислотой (водным диоксидом углерода) и основанием (или щелочью). Они имеют формулу Mx(CO3)y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями , и они окрашивают лакмусовую бумагу в синий цвет.
Какой тип реагента представляет собой Na2CO3?
Использование карбоната натрия (Na 2 CO 3 )
Используется в качестве смягчителя воды – жесткая вода , состоящий из ионов магния и кальция, осаждается карбонатом. В качестве лабораторного реагента для стандартизации кислот и в качестве аналитического реагента.
В качестве лабораторного реагента для стандартизации кислот и в качестве аналитического реагента.
Почему карбонат натрия является первичным эталоном?
Карбонат натрия безводный может использоваться в качестве первичного стандарта. … Карбонат натрия коммерчески доступен в качестве аналитического реагента чистотой 99,9%, который содержит немного воды. Следовательно, прежде чем можно будет использовать твердый карбонат натрия, воду необходимо удалить путем нагревания.
Является ли Na2CO3 кислотой или основанием?
Na 2 CO 3 представляет собой основную соль со значением pH, близким к 11, полученную нейтрализацией сильного основания (NaOH) слабой кислотой (H 2 CO 3 ). Водный раствор карбоната натрия (Na 2 CO 3 ) является основным по своей природе из-за большего количества гидроксид-ионов, образующихся в результате гидролиза карбонат-ионов (CO 3 2 — + H 2 O → ХСО 3 – + OH – ).
Является Na2CO3 растворимым или нерастворимым?
, поэтому в Na2CO3 карбонаты нерастворимы , но щелочные металлы являются исключением из этого правила , а натрий Na является щелочным металлом , поэтому карбонат натрия Na2CO3 будет растворим .
Является ли nh4 слабой базой?
Аммиак является типичным слабым основанием . Сам аммиак, очевидно, не содержит ионов гидроксида, но он реагирует с водой с образованием ионов аммония и ионов гидроксида.
Является ли Nh4 основой?
Аммиак, Кh4, представляет собой по основанию Льюиса и имеет одинокую пару. Он отдаст электроны соединениям, которые их примут. Донорство аммиака к акцептору электронов или кислоте Льюиса. … Основание Льюиса — это вещество, которое образует ковалентную связь, отдавая пару электронов.
Почему водные растворы NaHCO3 и Na2Co3 являются основными по своей природе?
Ответ: Потому что NaHCo3 и Na2Co3 являются продуктами реакции NaOH с h3CO3 . Гидроксид натрия для волос является сильным основанием, а угольная кислота является слабой кислотой, из-за чего основной эффект больше, и, следовательно, бикарбонат натрия и карбонат натрия являются основными по своей природе и в водном растворе.
Гидроксид натрия для волос является сильным основанием, а угольная кислота является слабой кислотой, из-за чего основной эффект больше, и, следовательно, бикарбонат натрия и карбонат натрия являются основными по своей природе и в водном растворе.
Какова основная соль NaHCO3?
Также мы знаем, что гидрокарбонат натрия (NaHCO3) является основной солью, потому что он состоит из слабой кислоты и сильного основания . Нагрев пищевой соды; перекристаллизация карбоната натрия дает стиральную соду. Это также основная соль.
Что происходит, когда в воду добавляют Na2CO3?
Когда вы помещаете карбонат натрия (Na2CO3) в воду, он производит 2 иона натрия и один ион карбоната (CO3 с зарядом 2-) . Углекислота (h3CO3) является слабой кислотой и не хочет распадаться. … И если он возьмет водород из воды (h3O), останется ион гидроксида (OH-).
Подвергается ли гидролизу Na2CO3?
Na⁺ + HCO₃⁻ + HOH ↔ Na⁺ + OH⁻ + H₂CO₃ — натрий заканчивается, остаются: HCO₃⁻ + HOH ↔ OH⁻ + H₂CO₃, в свою очередь H₂CO₃ распадается на СО₂ и Н₂О.