Хлорметан, Ch4Cl, химические свойства, получение, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Метиленхлорид — популярный промышленный растворитель
Метиленхлорид — органическое соединение, производное метана. Синонимы названия: метилен хлористый, дихлорметан, ДХМ. Формула Ch3Cl2.
Впервые был синтезирован в 1840-м году: в лаборатории соединили газообразный хлор с хлористым метилом и выдерживали смесь на свету. Для массового производства дихлорметан получают химическим синтезом из метана, выделенного из коксовых газов, и газообразного хлора. Другой метод: получение хлорметила из метанола и соляной кислоты, с последующим хлорированием.
Свойства
Подвижная прозрачная жидкость без цвета, летучая, с характерным резким, сладковатым запахом эфира. В воде растворяется слабо, хорошо — в орг. растворителях. При растворении в горячей воде разрушается, разлагаясь на соляную кислоту и формальдегид. Малотоксичен по сравнению с другими растворителями.
Вступает в реакцию с хлором, с получением хлороформа. Реагирует и с другими галогенами: йодом, бромом. Взаимодействует со спиртовым и водным растворами аммиака. В результате реакции с водным аммиаком получается муравьиная и соляная кислоты и метиламин. Вступает в реакции с ароматическими углеводородами, например, с бензолом.
Реагирует и с другими галогенами: йодом, бромом. Взаимодействует со спиртовым и водным растворами аммиака. В результате реакции с водным аммиаком получается муравьиная и соляная кислоты и метиламин. Вступает в реакции с ароматическими углеводородами, например, с бензолом.
Очень бурно реагирует (вплоть до взрыва) со щелочными металлами.
| Вытяжной шкаф ВА-102, комплектация «Стандарт» | Метиленхлорид (дихлорметан) «хч» 1000 мл |
Меры предосторожности
Реактив токсичен, плохо горит, но горение поддерживает; смеси с воздухом взрывоопасны. Обладает канцерогенным действием.
Проглатывание реактива и длительное вдыхание паров или аэрозолей приводит к раздражению слизистых глаз и органов дыхания, отравлению, головокружению и головным болям, обморокам, диарее, заболеваниям печени и поджелудочной железы. Тяжелое отравление может привести к остановке дыхания. Длительное воздействие вещества на кожу может вызвать химический ожог.
При работе с метиленхлоридом следует использовать средства защиты: очки, резиновые перчатки (не нитриловые и не латексные), одежду с длинными рукавами, респиратор. В лабораториях все эксперименты проводят в вытяжном шкафу.
Хранят реактив обычно в стальных контейнерах или бочках. Допускается хранение вне помещения, под навесом. Предпочтительнее в прохладных, вентилируемых, сухих складах.
Перевозить ДХМ можно любыми видами транспорта, контейнеры и транспорт маркируются символом опасности Xn (вредное вещество).
Применение
Реагент гораздо менее токсичен, чем другие органические растворители, легко удаляется, отличается невысокой стоимостью, поэтому широко используется во многих сферах промышленности, включая пищепром и фармацевтику.
- В химпроме используется для производства синтетических полимеров, например, полиуретановых пен (вспениватель), поролона, синтетических волокон; форм из пластмассы.
- Для получения химических продуктов, производных от дихлорметана.

- Как промышленный растворитель для очистки и обезжиривания металлических поверхностей; входит в состав аэрозольных красок; для склеивания акрилового стекла и различных пластиков, исключая полиэтилен и полипропилен; растворитель жиров, смол, битумов.
- В пищепроме — растворитель при экстракциях, например, для получения кофеина из зерен кофе, хмеля.
- В фармацевтике для изготовления аскорбиновой кислоты.
- В лабораторной практике для проведения анализов качества воды на наличие в ней бензола, аммиака, нитритов и нитратов, хлора, токсичных металлов и многих других вредных примесей. В хроматографии.
- Входит в состав некоторых хладагентов.
- Для снятия старых лаков и красок с любых поверхностей.
- В фотоделе — для обработки фото-и и кинопленок.
Метилендихлорид — основы химии — полезная информация
Наименование продукта : Метилендихлорид
Синонимы: Дихлорметан; Фреон 30; Метиленхлорид; хлоруглерод; метилен бихлорид; Дихлорид метана, ДХМ.
О продукте: DCM, органическое соединение, представляет собой бесцветную летучую жидкость со сладким запахом. Смешивается с различными растворителями. Его летучесть делает его полезным в качестве растворителя в различных химических процессах. Он используется в самых различных промышленных приложениях. ДХМ является наименее токсичным соединением из простых хлоруглеводородов и не воспламеняется. Он даже используется в пищевой промышленности для удаления кофеина из кофе и чая.
Идентификационные характеристики продукта:
Номер CAS: 75-09-2
H.S. Код : 200-838-9
Химическая формула: CH3CL2
Химические свойства:
Точка плавления: -97 C
Точка болирующего : Малорастворимый
Плотность паров: 2,9
Краткая история: Соединение было впервые получено французским химиком Анри Виктором Рено в 1840 году.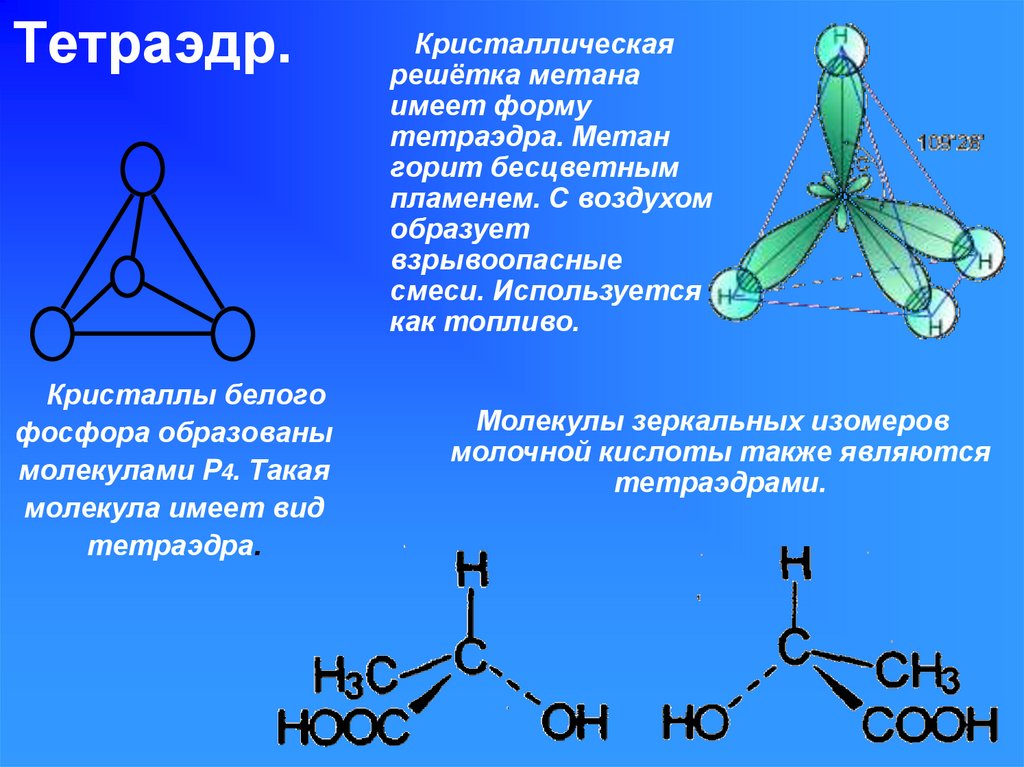 Он получил ДХМ, выделив его из смеси хлорметана и хлора, подвергался воздействию солнечных лучей.
Он получил ДХМ, выделив его из смеси хлорметана и хлора, подвергался воздействию солнечных лучей.
Использование :
Используется как растворитель краски и обезжириватель.
Используется для производства пленочных покрытий
Используется в фармацевтической промышленности.
Используется для удаления термосвариваемых этикеток в текстильной промышленности.
Используется для приготовления ароматизаторов для пищевой промышленности и производства напитков.
Используется в качестве послеуборочного фумиганта для зерна и фруктов.
Используется в качестве пропеллента для аэрозольных баллончиков.
Производственный процесс : Когда метилхлорид или метан обрабатывают газообразным хлором при температуре 400–500 °C, образуется метилендихлорид. Помимо ДХМ, этот процесс также приводит к получению хлористого метила, хлороформа и четыреххлористого углерода, разделенных перегонкой.
Помимо ДХМ, этот процесс также приводит к получению хлористого метила, хлороформа и четыреххлористого углерода, разделенных перегонкой.
Ch5 + Cl2 → Ch4Cl + HCl
CH4CL+ CL2 → CH3CL2+ HCL
CH3CL2+ CL2 → CHCL3+ HCL
CHCL3+ CL2 → CCL4+ HCL
Остановка с нами на
FINDER
.
Select ProductAcetic AcidAcetoneAcrylonitrileBase Oil (N 70)Base Oil (SN 500)Butyl AcetateButyl Acrylate MonomerC9CyclohexanoneEthylene DichlorideFormaldehyde(37%)ISO Propanol Maleic Anhydride Melamine (Commercial)MethanolMethyl Ethyl KetoneMethyl Isobutyl KetoneMethylene Di ChlorideMixed XyleneMono Ethylene GlycolN — ButanolN — HexaneN — PropenolOrtho XylenePhenolPhthalic Anhydride Мономер стиролаТолуолМономер винилацетата
Расстояние между портами
Select International PortТерминал Алжира (Алжир)Терминал Алжира (Алжир)Терминал Аннабы (Алжир)Арзев (Алжир)Терминал Арзев EI-Джедид (Алжир)Терминал Бахия Бланка (Аргентина)Терминал Бандар-Аббас (Иран)Терминал Бандар-Хомейни (Иран)Бандар-Махшахр ( Иран)Бандар-Тахери (Иран)Терминал Беджая (Алжир)Бени-Саф (Алжир)Чабахар (Иран)Черчелл (Алжир)Колло (Алжир)Терминал Сайрус (Иран)Деллис (Алжир)Джен-Джен (Алжир)Дуррес ( Албания )Фао ( Ирак)Газауэт (Алжир)Хор-аль-Зубайр (Ирак)Хоррамшехр (Иран)Терминал острова Киш (Иран)Рас-Бахрган (Иран)Саранда (Албания)Шенджин (Албания)Терминал Умм-Каср (Ирак)Валона (Албания)Влера (Албания)Юаньцзян (Китай) Терминал Задар (Хорватия) Терминал Зарате (Аргентина) Терминал Зеебгругге (Бельгия) Терминал Чжанцзяган (Китай) Терминал Чжанчжоу (Китай) Чжапу (Китай) Терминал Чжэньцзян (Китай) Чжичэн (Китай) Терминал Чжуншань (Китай) Чжоушань (Китай) Терминал Чжухай (Китай)Чжучжоу (Китай)
Метиленхлорид | 75-09-2
Описание
Метиленхлорид (дихлорметан (ДХМ)) представляет собой летучую бесцветную жидкость со сладким запахом, которая используется в качестве растворителя для многих применений, включая покрытие фотопленок, в аэрозольных составах и в процессах окраски, где желательна высокая летучесть, и в качестве обычного «вспенивателя» для синтетических пен. Эта летучесть может привести к высоким концентрациям в плохо проветриваемых помещениях. Метиленхлорид использовался в качестве пропеллента для лака для волос, но это использование было прекращено в 1919 г.89. Это мощный растворитель, который эффективно растворяет эфиры целлюлозы, жиры, масла, смолы и каучук.
Эта летучесть может привести к высоким концентрациям в плохо проветриваемых помещениях. Метиленхлорид использовался в качестве пропеллента для лака для волос, но это использование было прекращено в 1919 г.89. Это мощный растворитель, который эффективно растворяет эфиры целлюлозы, жиры, масла, смолы и каучук.
ДХМ является наиболее водорастворимым и одним из наименее токсичных из хлорметанов, с преимущественным токсическим эффектом угнетения ЦНС, выражающимся в виде наркоза. Сообщаемые системные эффекты после несмертельного воздействия метиленхлорида включают головную боль, головокружение, ступор, раздражительность, онемение, психомоторные расстройства и повышение уровня карбоксигемоглобина в крови. Быстрое удаление из зоны воздействия обычно приводит к полному выздоровлению. Метиленхлорид слегка раздражает кожу, а его всасывание через кожу не считается серьезной угрозой для здоровья человека. Зрительный контакт может быть болезненным, но вряд ли приведет к серьезной травме. Адаптация к парам хлористого метилена происходит при повторном контакте, что снижает способность обнаруживать воздействие.
Химические свойства
Метиленхлорид, хлорированный растворитель, представляет собой летучую бесцветную жидкость со сладким запахом. Его часто называют дихлорметаном. Метиленхлорид имеет множество промышленных применений, таких как снятие краски, очистка металла и обезжиривание.
Метиленхлорид не встречается в природе в окружающей среде. Хлористый метилен используется как промышленный растворитель и как растворитель для краски. Его также можно найти в некоторых аэрозолях и пестицидах, и он используется в производстве фотопленки.
Использование
Метиленхлорид используется в качестве растворителя, особенно там, где требуется высокая летучесть. Это хороший растворитель для масел, жиров, восков, смол, битума, каучука и ацетата целлюлозы, а также полезное средство для удаления краски и обезжиривателя. Он используется в средствах для удаления краски, в пропеллентных смесях для аэрозольных баллончиков, в качестве растворителя пластмасс, в качестве обезжиривающего агента, в качестве экстрагирующего агента в фармацевтической промышленности и в качестве вспенивателя в пенополиуретанах. Его растворяющие свойства иногда увеличиваются путем смешивания с метанолом, нефтяным бензином или тетрахлорэтиленом.
Его растворяющие свойства иногда увеличиваются путем смешивания с метанолом, нефтяным бензином или тетрахлорэтиленом.
Метиленхлорид является активным ингредиентом многих средств для удаления краски, включая промышленные средства для удаления краски и коммерческой мебели, средства для удаления краски в домашних условиях и продукты, используемые для обслуживания самолетов. Это химическое вещество обладает уникальной способностью проникать, образовывать пузыри и снимать самые разнообразные лакокрасочные покрытия. Составы химикатов широко используются как в проточных, так и в погружных (погружных) резервуарах при ремонте мебели. Для технического обслуживания военных и коммерческих самолетов часто требуется продукт на основе метиленхлорида для проверки поверхности на наличие повреждений.
С середины 1990-х годов хлористый метилен заменил 1,1,1-трихлорэтан в рецептурах негорючих клеев для промышленного применения, включая изготовление обивочной пены. Он обеспечивает клейкие составы с прочными, мгновенными характеристиками склеивания и эффективностью при экстремальных температурах и влажности.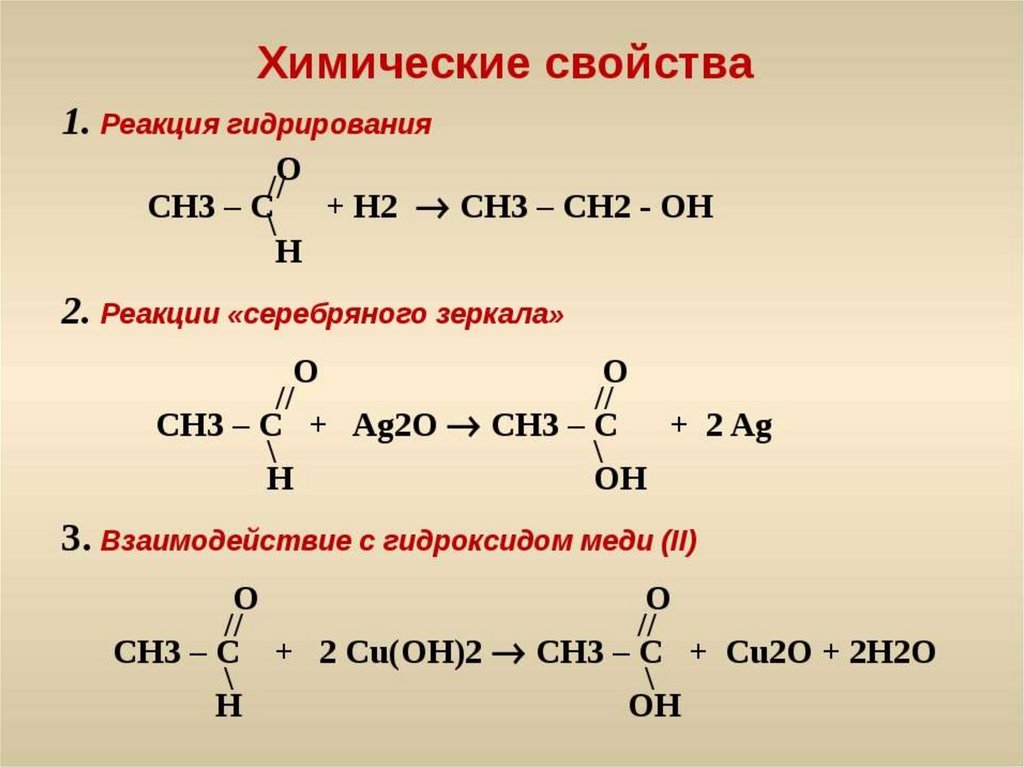 При применении пенопласта использование метиленхлорида исключает возможность образования жестких швов и обеспечивает полное соответствие требованиям к воспламеняемости мягкой мебели.
При применении пенопласта использование метиленхлорида исключает возможность образования жестких швов и обеспечивает полное соответствие требованиям к воспламеняемости мягкой мебели.
Метиленхлорид используется в аэрозолях в качестве сильного растворителя, подавителя воспламеняемости, подавителя давления паров и понизителя вязкости. Текущие аэрозольные применения метиленхлорида включают аэрозольные краски и смазочные материалы.
Хлористый метилен является ведущим вспомогательным вспенивающим агентом, используемым в производстве плит эластичных пенополиуретанов для производства мебели и постельных принадлежностей. Метиленхлорид используется в качестве экстрагента при извлечении и очистке широкого спектра материалов, включая масла, жиры и воски. Химическое вещество используется для декофеинизации кофе и чая, экстракции живицы из различных специй и для экстракции хмеля. Как и в случае с покрытиями для таблеток, в готовом продукте практически не остается химических веществ.
Подготовка
Метиленхлорид получают в результате хлорирования метана, в ходе которого могут образовываться другие производные хлорированного метана. Оксид пропилена, циклогексан и/или 2-метил-2-бутен добавляют в качестве стабилизаторов. Чистота зависит от количества С2 и высших углеводородов в метане и степени хлорирования. Могут присутствовать небольшие количества некоторых других хлорированных соединений. Метиленхлорид обычно извлекают из процессов экстракции, и несколько сортов обычно встречаются в торговле. Метиленхлорид стабилен в сухом виде, но гидролизуется в присутствии воды.
Оксид пропилена, циклогексан и/или 2-метил-2-бутен добавляют в качестве стабилизаторов. Чистота зависит от количества С2 и высших углеводородов в метане и степени хлорирования. Могут присутствовать небольшие количества некоторых других хлорированных соединений. Метиленхлорид обычно извлекают из процессов экстракции, и несколько сортов обычно встречаются в торговле. Метиленхлорид стабилен в сухом виде, но гидролизуется в присутствии воды.
Опасность для здоровья
Когда метиленхлорид попадает в организм человека, он влияет на работу мозга, например, неспособность концентрироваться. При достаточно высоком уровне он может перестать дышать. При более низких уровнях воздействие метиленхлорида вызывает головокружение, усталость, головные боли и тошноту. Метиленхлорид распадается на другие химические вещества в организме, такие как окись углерода. Кроме того, хлористый метилен может вытеснять кислород в рабочей среде из-за высокого давления паров. Контакт кожи с метиленхлоридом вызывает жжение и покраснение кожи.
Контакт кожи с метиленхлоридом вызывает жжение и покраснение кожи.
Несовместимость
Хлористый метилен реагирует с сильными окислителями, едкими веществами, химически активными металлами, такими как порошки алюминия и магния, калием, натрием и концентрированной азотной кислотой.
Физические свойства
Распространенным синонимом хлористого метилена является дихлорметан.
Метиленхлорид — бесцветная жидкость со сладковатым запахом.
Химическая формула хлористого метилена – Ch3Cl2, молекулярная масса – 84,93 г/моль.
Давление паров хлористого метилена составляет 349 мм рт.ст. при 20 °C, а коэффициент октанол/вода (log K ow ) равен 1,30.
Метиленхлорид имеет порог запаха 250 частей на миллион (ppm).
Хлористый метилен мало растворим в воде и негорюч.
Использование
Хлористый метилен преимущественно используется в качестве растворителя в средствах для снятия краски и смывках; в качестве технологического растворителя при производстве лекарств, фармацевтических препаратов и пленочных покрытий; в качестве растворителя для очистки и отделки металлов в производстве электроники; и в качестве агента при вдувании уретановой пены.
Метиленхлорид также используется в качестве пропеллента в аэрозолях для таких продуктов, как краски, автомобильные товары и спреи от насекомых.
Он используется в качестве растворителя для экстракции масляных смол специй, хмеля и для удаления кофеина из кофе. Однако из-за опасений по поводу остаточного растворителя большинство декофеинаторов больше не используют метиленхлорид.
Метиленхлорид также одобрен для использования в качестве послеуборочного фумиганта для зерна и клубники и в качестве градуирующего агента для цитрусовых.
Подготовка
Метиленхлорид был впервые получен Рено в 1840 году путем хлорирования метиленхлорида на солнечном свете. Он стал важным промышленным химикатом во время Второй мировой войны. В настоящее время для производства метиленхлорида используются два коммерческих процесса — гидрохлорирование метанола и прямое хлорирование метана (Rossberg et al., 19).86; Холбрук, 1993).
Преобладающий метод производства метиленхлорида использует в качестве первой стадии реакцию хлористого водорода и метанола с получением метилхлорида. Затем избыток хлористого метила смешивают с хлором и вступают в реакцию с образованием метиленхлорида с хлороформом и четыреххлористым углеродом в качестве побочных продуктов. Эту реакцию обычно проводят в газовой фазе термически, но ее также можно проводить каталитически или фотолитически. При низкой температуре и высоком давлении жидкофазный процесс способен обеспечить высокую селективность по метиленхлориду (Rossberg et al., 19).86; Холбрук, 1993).
Более старый и в настоящее время менее используемый метод производства метиленхлорида включает прямую реакцию избытка метана с хлором при высоких температурах (400–500°C) или при несколько более низких температурах либо каталитически, либо фотолитически. Метилхлорид, хлороформ и четыреххлористый углерод также образуются как побочные продукты (Rossberg et al., 1986; Holbrook, 1993).
Мировое производство метиленхлорида увеличилось с 93 тысяч тонн в 1960 году до примерно 570 тысяч тонн в 1919 году.80 (Edwards et al., 1982) и, как полагают, все еще составляет несколько сотен тысяч тонн. Производство в Соединенных Штатах неуклонно снижалось с 1981 по 1993 год, о чем свидетельствуют следующие цифры (тыс. тонн): 1981 г. — 404; 1984, 275; 1987, 234; 1990, 209; 1993, 160 (анон., 1994, 1997). Общее количество, произведенное в Западной Европе, колебалось от 331 500 тонн в 1986 г. до 254 200 тонн в 1991 г. (ВОЗ, 1996).
Опасность для здоровья
Хлористый метилен преимущественно используется в качестве растворителя. Острые (краткосрочные) последствия вдыхания метиленхлорида у людей в основном связаны с воздействием на нервную систему, включая снижение зрительных, слуховых и двигательных функций, но эти эффекты обратимы после прекращения воздействия. Последствия хронического (длительного) воздействия хлористого метилена предполагают, что центральная нервная система (ЦНС) является потенциальной мишенью у людей и животных. Данные о людях неубедительны в отношении метиленхлорида и рака. Исследования на животных показали увеличение случаев рака печени и легких, а также доброкачественных опухолей молочной железы после вдыхания метиленхлорида.
Данные о людях неубедительны в отношении метиленхлорида и рака. Исследования на животных показали увеличение случаев рака печени и легких, а также доброкачественных опухолей молочной железы после вдыхания метиленхлорида.
Химическая реактивность
Активно реагирует с активными металлами (литий, натрий, калий) и сильными основаниями (трет-бутоксид калия) (Sax, 1984)
Промышленное использование
Метиленхлорид был предложен и уже используется в коммерческих целях в качестве заменителя хлорфторуглеродных вспомогательных пенообразователей. Метиленхлорид очень летуч (температура кипения 39.8°С) и инертен в полиуретанообразующих смесях. Однако метиленхлорид считается канцерогеном и оказывает другие вредные воздействия на рабочих, подвергающихся его воздействию. Соответственно, концентрация хлористого метилена в воздухе внутри установки по производству пеноматериала должна поддерживаться на низком уровне. Американская конференция государственных специалистов по промышленной гигиене рекомендует, чтобы рабочие не подвергались воздействию более 50 частей на миллион этого химического вещества, в то время как допустимый предел воздействия Управления по охране труда и здоровья составляет 500 частей на миллион. Поддержание уровня метиленхлорида на заводе по производству пеноматериала ниже 50 частей на миллион может потребовать дополнительного вентиляционного оборудования, что повлечет за собой увеличение затрат. Кроме того, это химическое вещество является признанным загрязнителем окружающей среды, и как федеральное правительство, так и правительства штатов начинают ограничивать выбросы этого химического вещества заводами, которые его используют. Таким образом, в ближайшем будущем установки, использующие метиленхлорид в качестве вспомогательного пенообразователя, могут столкнуться со значительными дополнительными расходами на установку скрубберов или аналогичного оборудования для удаления метиленхлорида из воздуха и/или других газов, выбрасываемых с установки.
Американская конференция государственных специалистов по промышленной гигиене рекомендует, чтобы рабочие не подвергались воздействию более 50 частей на миллион этого химического вещества, в то время как допустимый предел воздействия Управления по охране труда и здоровья составляет 500 частей на миллион. Поддержание уровня метиленхлорида на заводе по производству пеноматериала ниже 50 частей на миллион может потребовать дополнительного вентиляционного оборудования, что повлечет за собой увеличение затрат. Кроме того, это химическое вещество является признанным загрязнителем окружающей среды, и как федеральное правительство, так и правительства штатов начинают ограничивать выбросы этого химического вещества заводами, которые его используют. Таким образом, в ближайшем будущем установки, использующие метиленхлорид в качестве вспомогательного пенообразователя, могут столкнуться со значительными дополнительными расходами на установку скрубберов или аналогичного оборудования для удаления метиленхлорида из воздуха и/или других газов, выбрасываемых с установки. Кроме того, Калифорния недавно предложила, чтобы выбросы хлористого метилена в этом штате облагались высоким налогом на «загрязнение», и другие штаты, вероятно, последуют аналогичному курсу.
Кроме того, Калифорния недавно предложила, чтобы выбросы хлористого метилена в этом штате облагались высоким налогом на «загрязнение», и другие штаты, вероятно, последуют аналогичному курсу.
Потенциальное воздействие
Основным путем воздействия метиленхлорида на человека является вдыхание окружающего воздуха.
Профессиональное и потребительское воздействие метиленхлорида в воздухе помещений может быть намного выше, особенно при окраске распылением или другом использовании аэрозолей. Люди, работающие в этих местах, могут вдохнуть химическое вещество или оно может попасть на кожу.
Хлористый метилен был обнаружен в пробах поверхностных и подземных вод, взятых на полигонах опасных отходов, а также в питьевой воде в очень низких концентрациях.
хранилище
Перед работой с метиленхлоридом вы должны пройти обучение по правильному обращению с ним и его хранению.

