Свойства и применение меди.
Медь отличается высокими электропроводностью, теплопроводностью, пластичностью, температурой плавления, коррозионной стойкостью, отличной обрабатываемостью давлением в холодном и горячем состоянии, хорошими литейными свойствами и удовлетворительной обрабатываемостью резанием. Благодаря этим ценным качествам медь используют в электротехнике, различных отраслях машиностроения, радиоэлектронике и приборостроении.
| Марка | Сu (не менее) | Примеси (не более) | ||||||||||||
| Bi | Sb | As | Fe | Ni | Pb | Sn | S | O2 | Zn | P | Ag | Всего | ||
| ||||||||||||||
| M00 | 99,99 | 0,0005 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,002 | – | 0,001 | 0,001 | – | 0,01 |
| М0 | 99,95 | 0,001 | 0,002 | 0,002 | 0,004 | 0,002 | 0,004 | 0,002 | 0,004 | 0,02 | 0,004 | 0,002 | 0,003 | 0,05 |
| М0б | 99,97 | 0,001 | 0,002 | 0,002 | 0,004 | 0,002 | 0,004 | 0,002 | 0,004 | 0,001 | 0,003 | 0,002 | 0,003 | 0,03 |
| Ml | 99,90 | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,05 | 0,005 | – | 0,003 | 0,1 |
| Mlp | 99,90 | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,01 | 0,005 | 0,04 | 0,003 | |
| М2 | 99,70 | 0,002 | 0,005 | 0,01 | 0,05 | 0,2 | 0,01 | 0,05 | 0,01 | 0,07 | – | – | – | 0. 3 3 |
| М2р | 99,70 | 0,002 | 0,005 | 0.01 | 0,05 | 0,2 | 0,01 | 0,05 | 0,01 | 0,01 | – | 0,04 | – | 0,3 |
| МЗ | 99,50 | 0,003 | 0,05 | 0,01 | 0,05 | 0,2 | 0,05 | 0,05 | 0,01 | 0,08 | – | – | – | 0,5 |
| МЗр | 99,50 | 0,003 | 0,05 | 0,05 | 0,05 | 0,2 | 0,03 | 0,05 | 0,01 | 0,01 | – | 0,04 | – | 0,5 |
| М4 | 99,0 | 0,005 | 0,2 | 0,2 | 0,1 | – | 0,3 | – | 0,02 | 0,15 | – | – | – | 1,0 |
| АМФ | Остальное | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,05 | 0,005 | 0,03-0,16 | 0,003 | 0,1 |
Согласно ГОСТ 859-66 промышленность выпускает медь десяти марок в виде катодов, вайербасов, слитков и полуфабрикатов (листов, полос, лент, прутков, труб, проволоки, поковок). Из этих полуфабрикатов готовят обработкой давлением и резанием всевозможные детали. Медь является хорошим материалом для фасонных отливок.
Из этих полуфабрикатов готовят обработкой давлением и резанием всевозможные детали. Медь является хорошим материалом для фасонных отливок.
Медь также широко применяют для защитных коррозионностойких покрытий. Для электролиза чаще используют медные аноды из специальной меди АМФ.
Особености выплавки меди
При плавлении меди в ней может растворяться некоторое количество кислорода в виде закиси меди. Примеси кислорода несколько снижают электропроводность и пластичность меди в горячем и холодном состоянии, а также могут привести к «водородной болезни».
В изделиях, содержащих закись меди, при нагреве в водороде образуются трещины и пузыри, из-за чего резко снижаются их прочность и пластичность. «Водородная болезнь» возникает вследствие того, что при нагреве водород быстро диффундирует в медь, и, соединяясь с кислородом, образует пары воды. Эти пары из-за незначительной скорости диффузии создают высокое давление, что и приводит к образованию
упомянутых дефектов в меди.
В ряде случаев производят дополнительное раскисление жидкой меди. Один из наиболее эффективных и употребляемых раскислителей — фосфор (0,01-0,05%). Расплавленную медь также предохраняют от насыщения серой, примеси которой ухудшают ее механические свойства.
Технологические свойства
Высокая теплопроводность и электропроводность меди затрудняют ее электросварку (точечную или роликовую), особенно в виде массивных изделий. Тонкие медные детали и полуфабрикаты можно сваривать электродами из вольфрама и молибдена. Предварительное лужение соединяемых поверхностей облегчает сварку. Легче осуществить сварку встык, но для этого необходимы трансформаторы большой мощности. Детали толщиной более 2 мм можно сваривать нейтральным ацетилено-кислородным пламенем, при этом необходимо предохранять их от окисления и загрязнения. Наиболее надежный способ соединения медных изделий — пайка твердыми и мягкими припоями.
Медь отлично штампуется, но при этом необходимо помнить, что в отожженном состоянии она отличается значительной анизотропией механических свойств, вызывающей образование фестонов при глубокой вытяжке. Для уменьшения фестонов листовую (ленточную) медь следует готовить по особому технологическому процессу. Чистовая обработка резанием мягкой меди ввиду ее большой вязкости затруднена. Для деталей, изготавливаемых резанием, рекомендуется применять нагартованную (твердую) медь. Химический состав меди см. ГОСТ 13938.0-68; 13938.12-68; 13938.13-69.
Склонность к «водородной болезни» (ГОСТ 15471-70) определяют путем отжига образцов в виде пластин в водороде при 825-875° С (40 мин), последующего визуального осмотра и испытания на перегиб. Испытание проволоки на растяжение см. ГОСТ 10446-63, а на перегиб — ГОСТ 1579-63. Механические свойства плоского проката в условиях растяжения см. ГОСТ 1497-73, ГОСТ 11701-66, а на изгиб — ГОСТ 14019-68.
Основное количество меди используют для приготовления сплавов. В технической литературе медные сплавы разделяют на три группы: латуни, бронзы и медно-никелевые сплавы.
В технической литературе медные сплавы разделяют на три группы: латуни, бронзы и медно-никелевые сплавы.
Полуфабрикаты из меди поставляют в мягком (отожженном), полутвердом (обжатие 10-30%) и твердом (обжатие более 35%) состоянии.
Медь
|
Медь |
|
|---|---|
| Атомный номер |
29 |
| Внешний вид простого вещества |
пластичный металл золотисто-розового цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
63,546 а. е. м. (г/моль) |
| Радиус атома |
128 пм |
|
Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 3d 10 4s1 |
| Химические свойства | |
| Ковалентный радиус |
117 пм |
| Радиус иона |
(+2e) 72 (+1e) 96 пм |
|
Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал |
+0,337 В/ +0,521 В |
| Степени окисления |
2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность |
8,96 г/см³ |
| Молярная теплоёмкость |
24,44[1]Дж/(K·моль) |
| Теплопроводность |
401 Вт/(м·K) |
| Температура плавления |
1356,6 K |
| Теплота плавления |
13,01 кДж/моль |
| Температура кипения |
2840 K |
| Теплота испарения |
304,6 кДж/моль |
| Молярный объём |
7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки |
3,615 Å |
| Отношение c/a | — |
| Температура Дебая |
315 K |
| Cu | 29 |
| 63,546 | |
| 3d104s1 | |
| Медь | |
Медь —элемент побочной подгруппы первой группы, четвертого периода периодической системы химических элементов Д.
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век). Латинское название элемента происходит от названия острова Кипр (лат. Cuprum), на котором добывали медь.
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн. ) → Cu2+(водн.) + Cu(тв.)
) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4].
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортера CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азыATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[5]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей. [источник не указан 226 дней]
[источник не указан 226 дней]
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[6] (агентство подчеркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т.. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Мировое производство меди в 2007 году составляло15,4 млн т, а в 2008 году — 15,7 млн т.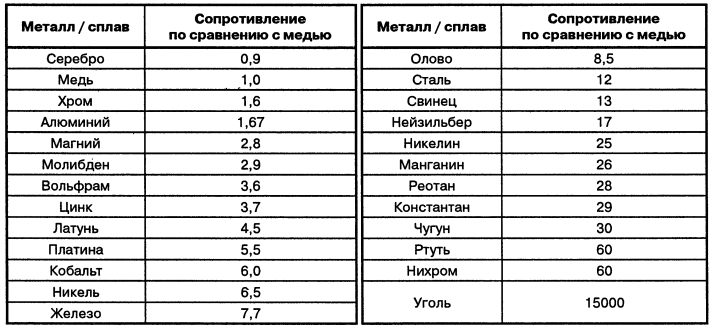 Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причем, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Однажды нашли самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO + (CuOH)2CO2 (t°) → 3CO2 + 2Cu + H2O.
Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
металл — Почему медь лучше проводит электричество, чем кальций?
спросил
Изменено 1 год, 3 месяца назад
Просмотрено 395 раз
$\begingroup$
Как бы мы сравнили электропроводность между медью и кальцием? Я понимаю, что электропроводность металла зависит от количества делокализованных электронов для этого металла. Однако в случае меди, которая может терять различное число электронов, как мы можем сравнить электропроводность с электропроводностью кальция?
Однако в случае меди, которая может терять различное число электронов, как мы можем сравнить электропроводность с электропроводностью кальция?
- металлы
- переходные металлы
- периодические тенденции
- проводимость
- электрические свойства
$\endgroup$
4
$\begingroup$
Сравнение проводимостей должно начинаться с некоторых данных, а затем вы начинаете заниматься объяснениями. В противном случае вы делаете предсказания — нет, не предсказания — домыслы. Сначала получите некоторые данные, затем сравните, предположите, выдвиньте гипотезу, предскажите, проверьте предсказания, повторите.
Что касается электропроводности, то существуют таблицы (https://www.angstromsciences.com/elements-electrical-conductivity), а на снимке экрана ниже показаны электропроводности от никеля и цинка (медь в скобках) до более проводящих элементов. , включая кальций, и к серебру, наиболее проводящему элементу.
, включая кальций, и к серебру, наиболее проводящему элементу.
Море электронов не одинаково гладко для всех элементов и не одинаково глубоко. Полупроводники обладают интересной проводимостью, и существуют теории, объясняющие такое поведение (https://en.wikipedia.org/wiki/Electrical_resistivity_and_conductivity), но кажется, что сравнивать проводимости очень проводящих элементов сложнее.
Интересно, что проводимость меди не сильно зависит от того, полностью ли она отожжена (очень мягкая) или холоднотянута (полностью твердая) (https://www.thoughtco.com/table-of-electrical-resistivity-conductivity). -608499). Легирование меди оказывает гораздо большее влияние на проводимость.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Гибридные пленки из медных нанопроволок и графена с повышенной стойкостью к окислению и электропроводностью для гибких датчиков деформации
Гибридные пленки медных нанопроволок и графена с повышенной стойкостью к окислению и электропроводностью для гибких датчиков деформации†
Ю Чжу, ‡ аб Юген Ху,‡ ак Пенгли Чжу, * и Дао Чжао, и Сяньвэнь Лян, и Ронг Солнце * и и Цзин-пинг Вонг от
Принадлежности автора
* Соответствующие авторы
и Шэньчжэньские институты передовых технологий Китайской академии наук, Шэньчжэнь 518055, Китай
Электронная почта: pl.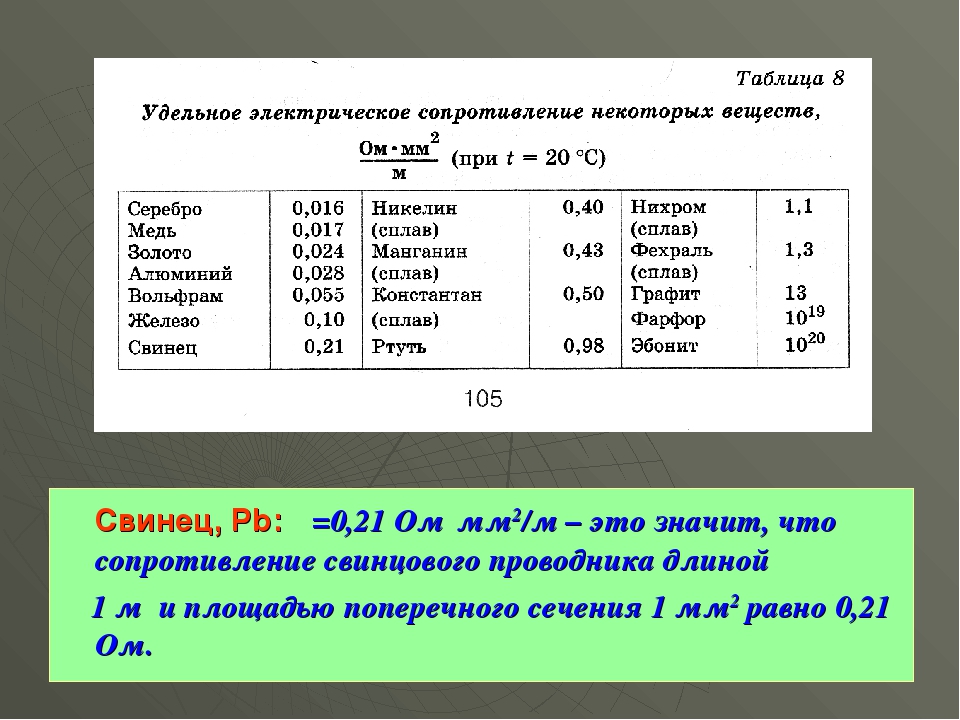 [email protected]
[email protected]
б Институт нанотехнологий и науки, Китайский университет науки и технологий, Сучжоу 215123, Китай
с Шэньчжэньский колледж передовых технологий Университета Китайской академии наук, Шэньчжэнь 518055, Китай
д Факультет электронной инженерии, Китайский университет Гонконга, Гонконг, Китай
и Школа материаловедения и инженерии Технологического института Джорджии, Атланта, Джорджия 30332, США
Аннотация
rsc.org/schema/rscart38″> Медные нанопроволоки (CuNW) чрезвычайно склонны к окислению, что сильно ограничивает их практическое применение, несмотря на то, что они недороги, распространены и обладают высокой электропроводностью. Здесь разработан простой и новый метод для облегчения окисления CuNW путем внедрения CuNW в листы вододиспергируемого модифицированного графена (WGP) для формирования однородной гибридной проводящей пленки с использованием простого процесса вакуумной фильтрации. Пленки CuNW и WGP обладают электропроводностью 3,19? С добавлением WGP для образования гибридной пленки CuNWs-WGP электропроводность CuNW дополнительно улучшается до 3,02 × 10 4 См·м −1 благодаря синергетическому эффекту CuNW и WGP. . Гибридные пленки CuNWs-WGP демонстрируют превосходную антиоксидантную стабильность даже после пребывания на воздухе в течение 8 недель без какого-либо явного окисления. Затем, используя эту проводящую гибридную пленку, был изготовлен гибкий датчик деформации PDMS/CuNWs–WGP/PDMS с многослойной структурой.

