Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

В природе хром встречается в виде следующих соединений.
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III — Cr 2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III, реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.

Оксид хрома III реагирует как с растворами щелочей, образуя комплексные соли, так и с кислотами.
Cr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + NaOH + H2O = Na3[Cr(OH)6] (нет прокаливания — в водном растворе, гексагидроксохромат натрия)
Cr2O3 + HCl = CrCl 3 + H2O (сохраняем степень окисления)

Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI — CrO
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» :)
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа III до II.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа II проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа II распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа II приобретают коричневый цвет из-за окисления до железа III.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом III калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа III проявляют амфотерные свойства. Оксид и гидроксид железа III реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа III — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа III с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа VI — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
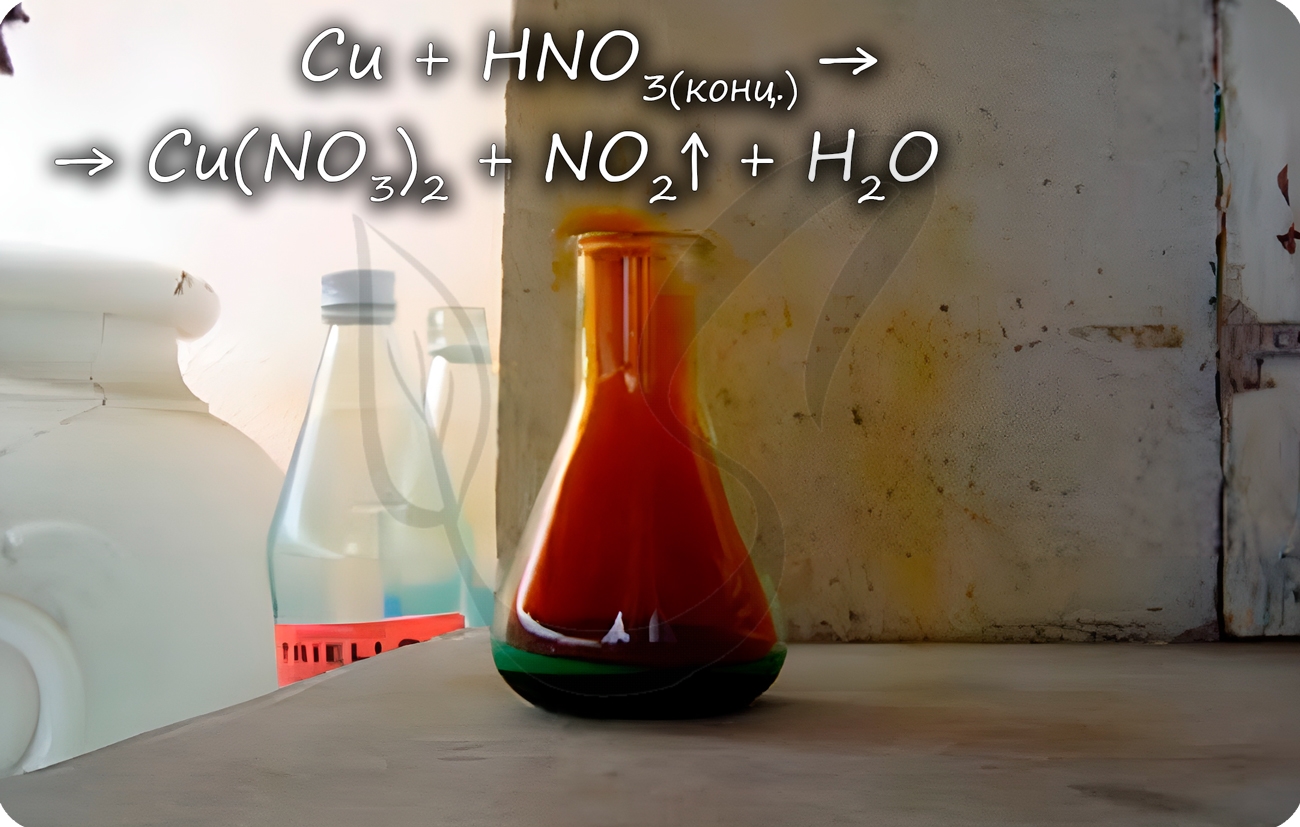
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
Гидроксид меди II — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II — (CuOH)2CO3)
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Хром — общая характеристика элемента, химические свойства хрома и его соединений
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.
Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O → Cr2O3 + 3H2
Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3H2O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(NH4)2Cr2O7 –t°→ Cr2O3 + N2+ 4H2O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2H2O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Сr(ОН)3 + ЗН+ = Сr3+ + 3H2O
Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2H2O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3 →(120oC –H2O) СrO(ОН) →(430-10000С –H2O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(NH3 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+H2 SO4(30%)=K2Cr2O7 +K2SO4 +H2O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8H2O+4KCl
2K2CrO4+2H2O+3H2S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8H2O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7H2O+2KCl (кипячение)
K2Cr2O7(т)+2H2SO4(96%) ⇌2KHSO4+2CrO3+H2O (“хромовая смесь”)
K2Cr2O7+KOH (конц ) =H2O+2K2CrO4
Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7H2O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +H2O
Cr2O72- +H2O +3H2S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72- (разб.) +H2O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7H2O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4 (30%) = К2Cr2O7 + К2SO4 + Н2O
Оксид хрома(VI) — это… Что такое Оксид хрома(VI)?
Хромовый ангидрид, сохраняемый герметично.Окси́д хро́ма(VI) (трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Свойства
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + H2O → H2CrO4,
или дихромовая кислота (при избытке CrO3):
2CrO3 + H2O → H2Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + H2O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»). Окисляет йод, серу, фосфор, уголь, например:
4CrO3 + 3S → 2Cr2O3 + 3SO2↑.
Получение
Получают действием H2SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Na2Cr2O7 + H2SO4 → 2CrO3 + Na2SO4 + H2O
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,1 г.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, и исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
См. также
ЕГЭ. Правила составления окислительно-восстановительных реакций (хром)
7. Химические свойства соединений хрома с точки зрения изменения степеней окисления
Правило7.1. В зависимости от среды хроматы и дихроматы переходят друг в друга:
1. В кислой среде хроматы (желтого цвета) превращаются в дихроматы (оранжевого цвета):
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
2. В щелочной среде дихроматы превращаются в хроматы:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
В кислой среде без восстановителя выпадает осадок CrO3 (темно-красные кристаллы, растворимые в воде):
K2Cr2O7 + 2H2SO4(к) → 2CrO3 + 2KHSO4 + H2O
3. Термическое разложение дихромата калия также приводит к образованию хромата:
K2Cr2O7 → K2CrO4 + Cr2O3 + O2
Правило 7.2. В реакциях соединний Cr+3 с избытком щелочи образуются гексагидроксохроматы(III):
Cr2(SO4)3 + 6KOH → 2Cr(OH)3 + 3K2SO4 или в избытке щелочи:
Cr2(SO4)3 + 12KOH → 2Na3[Cr(OH)6] + 3K2SO4
Правило7.3. Хроматы металлов являются сильными окислителями, восстанавливаясь в реакциях до ст. ок. +3:
2K2CrO4 + 3H2S + 2H2O → 2Cr(OH)3 + 3S + 4KOH
2K2CrO4 + 3NaNO2 + 5H2O → 2Cr(OH)3 + 3NaNO3 + 4KOH
Правило 7.4. Дихроматы металлов также являются сильными окислителями, восстанавливаясь в реакциях также до ст. ок. +3:
Восстановление дихроматов до Cr+3 в кислой среде:
K2Cr2O7 + 14HCl(конц.) → 3Cl2 + 2CrCl3 +2KCl + 7H2O
K2Cr2O7 + 14HI → 3I2 + 2CrI3 + 2KI + 7H2O
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
K2Cr2O7 + 3K2SO3 + 4H2SO4 → Cr2(SO4)3 + 4K2SO4 + 4H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Na2Cr2O7 + 6CrCl2 + 14HCl → 8CrCl3 + 2NaCl + 7H2O
Na2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + Na2SO4 + 7H2O
K2Cr2O7 + 3Na2S + 7H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 3Na2SO4 + 7H2O
K2Cr2O7 + 3(NH4)2S + 7H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 3(NH4)2SO4 + 7H2O или
4K2Cr2O7 + 3(NH4)2S + 16H2SO4 → 4Cr2(SO4)3 + 4K2SO4 + 3(NH4)2SO4 + 16H2O
K2Cr2O7 + 3SO2 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O
K2Cr2O7 + 3H2O2 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
4K2Cr2O7 + 3PH3 + 16H2SO4 → 4Cr2(SO4)3 + 4K2SO4 + 3H3PO4 + 16H2O
K2Cr2O7 + NH3 + H2SO4 → K2SO4 + Cr2(SO4)3 + N2 + H2O
Если окислять нечего, то изменения степени окисления не происходит:
K2Cr2O7 + H2SO4(конц.) → 2CrO3 + K2SO4 + H2O
Восстановление дихроматов до Cr+3 в нейтральной среде:
K2Cr2O7 + 3Na2SO3 + 4H2O → 2Cr(OH)3 + 3Na2SO4 + 2KOH
K2Cr2O7 + 3H2S + H2O → 2Cr(OH)3 + 3S + 2KOH
K2Cr2O7 + 3(NH4)2S + H2O → 2Cr(OH)3 + 3S + 6NH3 + 2KOH
Восстановление дихроматов углеродом:
2K2Cr2O7 + 3С → 2Cr2O3 + 2K2CO3 + CO2
Оксид хрома (VI) также является сильным окислителем:
2CrO3 + 3KNO2 + 3H2SO4 → Cr2(SO4)3 + 3KNO3 + 3H2O
Правило 7.5. Соединения Cr+3 (зеленого цвета) окисляются сильными окислителями в щелочной среде до хроматов с Cr+6 (желтого цвета):
2K3[Cr(OH)6] + 3Cl2 + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Cr(NO3)3 + O3 + 10KOH → 2K2CrO4 + 6KNO3 + 5H2O
Cr2(SO4)3 + 6KMnO4 + 16KOH → 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2CrCl3 + KClO3 + 10KOH → 2K2CrO4 + 7KCl + 5H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 +
ЕГЭ. Цвета соединений
Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок нерастворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
Окисление хромовой кислотой — Chemistry LibreTexts
Одним из реагентов, обычно используемых для окисления в органической химии, является хромовая кислота. После расшифровки этот реагент легко использовать. Тем не менее, существует огромное количество различных способов, которыми учебники (и преподаватели) показывают его использование в реакции.
Хромовая кислота, \ (H_2CrO_4 \), является сильной кислотой и реагентом для окисления спиртов до кетонов и карбоновых кислот.По причинам, главным образом, связанным с безопасностью и удобством, хромовая кислота, как правило, производится в реакционном сосуде по мере необходимости (путем добавления кислоты к источнику хрома), а не из бутылки.
Вот где начинаются проблемы. Выбор источника хрома для производства \ (H_2CrO_4 \) очень похож на выбор любимой марки бутилированной воды. Если не считать упаковки, они практически все одинаковые. Однако в зависимости от того, какой у вас учебник или инструктор, вы можете увидеть несколько разных способов сделать это, и это может сбивать с толку.
Ключевым моментом является то, что \ (Na_2CrO_4 \) (хромат натрия), \ (Na_2Cr_2O_7 \) (дихромат натрия), \ (KCrO_4 \) (хромат калия), \ (K_2Cr_2O_7 \) (дихромат калия) и \ (CrO_3 \) (триоксид хрома) похожи в одном решающем отношении: когда они объединяются с водной кислотой, каждый из них образует \ (H_2CrO_4 \), и, в конечном итоге, именно \ (H_2CrO_4 \) участвует в важной химии. К сожалению, я редко вижу объяснение этого момента в учебниках. Помню, это вызывало у меня некоторое замешательство, когда я проходил курс.Присутствующие ионы K или Na — просто зрители.
После образования \ (H_2CrO_4 \) его реакции довольно просты: он превращает первичные спирты (и альдегиды) в карбоновые кислоты, а вторичные спирты в кетоны.
Это достигается за счет добавления кислорода спирта к хрому, что делает его хорошей уходящей группой; основание (наиболее вероятная причина — вода) может затем удалить протон из углерода, образуя новую π-связь и разрывая связь O-Cr.
Из-за своей высокой токсичности хромовая кислота, как правило, очень мало используется в лаборатории органической химии за пределами студенческих лабораторий, и для проведения этих преобразований доступно гораздо больше полезных реагентов.
,Хромовая кислота, h3CrO4 — Master Organic Chemistry
H 2 CrO 4 (Хромовая кислота, также известная как протонированная форма K 2 Cr 2 O 7 / Na 2 Cr5 O 7 / K 2 CrO 4 / Na 2 CrO 4 ) В качестве реагента в органической химии
В явной пробке для Руководства по реагентам, каждую пятницу в обозримом будущем здесь I будет профилировать другой реагент, который обычно встречается в Org 1 / Org 2.
Хромовая кислота (H 2 CrO 4 ) эквивалентна K 2 Cr 2 O 7 + H 2 SO 4 (среди других комбинаций)
всех реагентов Я сталкиваюсь в качестве репетитора по органической химии, я не уверен, что есть такой, который заставляет меня рвать волосы больше, чем хромовая кислота. У меня не так много волос, поэтому я не говорю это легкомысленно.
Дело не в том, что это особо хитрый реагент. На самом деле, после расшифровки это довольно просто.
Сложность в том, что учебники (и инструкторы) по-разному используют его в реакции.
Вот в чем дело: Хромовая кислота, H 2 CrO 4 , — сильная кислота и реагент для окисления спиртов до кетонов и карбоновых кислот. По довольно банальным причинам, главным образом из-за безопасности и удобства, хромовая кислота, как правило, производится в реакционном сосуде по мере необходимости (путем добавления кислоты к источнику хрома), а не из бутылки.
И вот тут-то и начинаются проблемы. Выбор источника хрома для производства H 2 CrO 4 очень похож на выбор любимой марки бутилированной воды. Если не считать упаковки, они практически все одинаковые. Однако в зависимости от того, какой у вас учебник или инструктор, вы можете увидеть несколько разных способов сделать это, и это может сбивать с толку.
Ключевым моментом является то, что Na 2 CrO 4 (хромат натрия), Na 2 Cr 2 O 7 (дихромат натрия), K 2 CrO 4 (хромат калия), K 2 Cr 2 O 7 (дихромат калия) и CrO 3 (триоксид хрома) схожи в одном решающем отношении: в сочетании с водной кислотой каждый из них образует H 2 CrO 4 , и, в конечном итоге, именно H 2 CrO 4 выполняет важную химию.К сожалению, я редко вижу объяснение этого момента в учебниках. Помню, это вызывало у меня некоторое замешательство, когда я проходил курс. Присутствующие ионы K или Na — просто зрители.
H 2 CrO 4 В качестве реагента для окисления спиртов
После образования H 2 CrO 4 его реакции довольно просты: он превращает первичные спирты (и альдегиды) в карбоновые кислоты и вторичные спирты к кетонам.
Окисление первичных спиртов до карбоновых кислот с помощью хромовой кислоты: как это работает
Это происходит за счет добавления кислорода спирта к хрому, что делает его хорошей уходящей группой; основание (наиболее вероятной причиной является вода) может затем удалить протон из углерода, образуя новую π-связь и разрывая связь O-Cr.
Хотел бы я вам сказать, что преодоление этой путаницы в конечном итоге полезно из-за огромной полезности H 2 CrO 4 в качестве реагента. Фактически, из-за своей высокой токсичности хромовая кислота, как правило, очень мало используется в лаборатории органической химии за пределами студенческих лабораторий. Есть гораздо более полезные реагенты для проведения этих превращений.
П.С. Вы можете прочитать о химии хромовой кислоты и более чем 80 других реагентах в бакалавриате по органической химии в руководстве по реагентам для органической химии, доступном здесь в виде загружаемого PDF-файла .
(Advanced) Ссылки и дополнительная литература
Основными окислителями, используемыми для этого преобразования, являются Cr (VI) и Mn (VII), как показано ниже. В первых двух ссылках используется KMnO 4 .
- Синтез модельного депсипептидного сегмента лузопептинов (BBM 928), сильнодействующих противоопухолевых и антиретровирусных антибиотиков
Марко А. Чуфолини и Шанкар Сваминатан
Tetrahedron Letters Volume 30, Issue 23,73 1989-30
DOI: 10.1016 / S0040-4039 (00) 99393-6
Стадия f в синтезе ( Схема 1 ) представляет собой окисление первичного спирта до карбоновой кислоты с использованием KMnO 4 . - Стереоконтролируемое добавление к эквиваленту пенальдовой кислоты: асимметричный -β-гидрокси-L-глутаминовая кислота
Филип Гарнер
Tetrahedron Letters Том 25, выпуск 51, 1984 , 5855-5858 9000
DOI : 10.1016 / S0040-4039 (01) 81703-2
Заключительная стадия ( г , 6 -> 7) в синтезе в этой статье — это окисление первичного спирта до карбоновой кислоты с использованием KMnO 4 .Окисление Джонса, в котором используется хромовая кислота (CrO 3 в H 2 SO 4 ), является распространенным методом окисления первичных спиртов до карбоновых кислот. Недостатком, конечно же, является производство стехиометрических количеств хромовых отходов. - Исследования ацетиленовых соединений. Часть XIV. Исследование реакций легкодоступного этинилэтиленового спирта, пент-2-ен-4-ин-1-ола
Сэр Ян Хейлброн, Э. Р. Х. Джонс и Ф. Сондхаймер
J.Химреагент Soc., 1947, 1586-1590
DOI: 10.1039 / JR9470001586 - Улучшенная процедура окисления алкинолов до алкиновых кислот
C. Holland and N. W. Gilman
Synth. Commun. 1974 , 4 , 203-210
DOI: 10.1080 / 00397917408062073 - Полезные процедуры окисления спиртов с участием дихромата пиридиния в апротонных средах
E.J. Кори, Грег Шмидт
Tetrahedron Letters Том 20, выпуск 5, 1979 , 399-402
DOI : 10.1016 / S0040-4039 (01) 93515-4
Нобелевский лауреат профессор Э. Дж. Кори (Гарвард) показывает, что PDC (дихромат пиридиния) в ДМФА может использоваться для окисления первичных спиртов до карбоновых кислот.
Reagent Friday: PCC (Pyridinium Chlorochromate)
Pyridinium Chlorochromate (PCC), полезный окислитель для спиртов в органической химии
В явной пробке для Руководства по реагентам каждую пятницу я профилирую различные реагенты, которые обычно встречаются в Org 1 / Org 2. Только что вышла версия 1.2 с множеством исправлений и новым индексом страниц.
Для чего он используется: PCC — это более мягкая версия хромовой кислоты.По сути, он окисляет спирты на одну ступень лестницы окисления: от первичных спиртов до альдегидов и от вторичных спиртов до кетонов . В отличие от хромовой кислоты PCC не окисляет альдегиды до карбоновых кислот.
Подобно или то же самое, что и: CrO 3 и пиридин (реагент Коллинза) также окисляют первичные спирты до альдегидов.
Окисление первичных спиртов до альдегидов хлорхроматом пиридиния (PCC) и окисление вторичных спиртов до кетонов
Вот два примера действия PCC.Если вы добавите один эквивалент PCC к любому из этих спиртов, вы получите окисленную версию. Побочные продукты (выделены серым цветом) — это Cr (IV), а также гидрохлорид пиридиния.
Нужно быть осторожным с количеством воды, присутствующей в реакции. Если присутствует вода, она может добавляться к альдегиду, чтобы получить гидрат, который, если бы он присутствовал, мог быть дополнительно окислен вторым эквивалентом ОКК. Это не проблема кетонов, поскольку не существует H, непосредственно связанного с C.
Механизм окисления первичных спиртов до альдегидов хлорхроматом пиридиния
Как это работает? Подобные реакции окисления на самом деле являются реакцией отщепления.Мы переходим от одинарной связи углерод-кислород к двойной связи углерод-кислород. [См .: Демистификация окисления спирта] Реакция элиминирования может происходить, потому что мы помещаем хорошую уходящую группу на кислород, а именно хром, который будет вытеснен, когда соседняя связь C-H будет разорвана основанием.
Первый шаг — это воздействие кислорода на хром с образованием связи Cr-O. Во-вторых, протон на (теперь положительном) ОН передается одному из атомов кислорода хрома, возможно, через посредство соли пиридини.Затем хлорид-ион замещается в реакции, напоминающей реакцию 1,2-элиминирования, с образованием так называемого хроматного эфира .
Двойная связь C-O образуется, когда основание удаляет протон на углероде, соседнем с кислородом. [в сторону: я нарисовал основу как Cl (-), хотя, безусловно, есть и другие виды, которые также могут действовать здесь как основания (например, спирт). Здесь также возможно использовать пиридин в качестве основания, хотя в этих кислых условиях будут присутствовать только очень низкие концентрации депротонированной формы.] Электроны из связи CH движутся, чтобы сформировать связь CO, и в процессе разрывают связь O-Cr, и Cr (VI) становится Cr (IV) в процессе (обозначено здесь как O = Cr (OH) 2) ,
Примечания из реальной жизни : Если вы в конечном итоге используете PCC в лаборатории, не забудьте добавить молекулярные сита или целит или другое твердое вещество на дно колбы, потому что в противном случае вы получите неприятную коричневую смолу, которая является настоящая большая боль, чтобы убрать. Токсичность и беспорядок, связанные с хромом (как это популяризовала эта женщина), стимулировали разработку других альтернатив, таких как TPAP, IBX, DMP и множество других полезных реагентов, о которых вы обычно не узнаете до аспирантуры.
П.С. Вы можете прочитать о химии PCC и более чем 80 других реагентах в бакалавриате по органической химии в «Руководстве по реагентам для органической химии», доступном здесь в виде загружаемого PDF-файла .
(Advanced) Ссылки и дополнительная литература
- Хлорхромат пиридини. Эффективный реагент для окисления первичных и вторичных спиртов до карбонильных соединений
E.J. Кори, Дж. Уильям Саггс
Tetrahedron Letters Том 16, выпуск 31, 1975 г., страницы 2647-2650
DOI: 10.1016 / S0040-4039 (00) 75204-X
Оригинальная статья лауреата Нобелевской премии профессора Э. Дж. Кори об использовании хлорхромата пиридиния в качестве мягкого окислительного реагента в органическом синтезе. - История открытия PCC была довольно случайной, как объяснил профессор Саггс в этом сообщении в блоге: https://blogs.sciencemag.org/pipeline/archives/2005/10/11/the_old_stuff#comment-2123
- Хлорхромат пиридиния: универсальный окислитель в органическом синтезе
Piancatelli, A. Scettri, M.Д’Аурия
Синтез 1982 ; 1982 (4): 245-258
DOI: 10.1055 / s-1982-29766
Обзор приложений PCC в органическом синтезе. Включает обсуждение механизма. - Кинетика и механизм окисления спиртов хлорхроматом пиридиния
Банерджи Калян К.
Бюл. Химреагент Soc. Япон. 1978 , 51 (9), 2732
DOI: 10.1246 / bcsj.51.2732
Хорошее исследование механизма окисления PCC, включающее вероятный механизм реакции. - Стехиометрия окисления первичных спиртов хлорхроматом пиридиния. Доказательства двухэлектронного изменения
Герберт К. Браун, К. Гунду Рао и Сурендра У. Кулькарни
The Journal of Organic Chemistry 1979 44 (15), 2809-2810
DOI : 1021 / jo01329a051
В этой статье Нобелевский лауреат Х.К. Браун доказывает, что окисление PCC включает перенос 2 электронов от Cr к подложке. Следовательно, не нужно использовать избыток PCC — 1 эквивалент работает нормально. - СИНТЕЗ 1,2: 4,5-ДИ-О-ИЗОПРОПИЛИДЕН-D-эритро-2,3-ГЕКСОДИУЛО-2,6-ПИРАНОЗЫ. ВЫСОКОЭНАНТИОСЕЛЕКТИВНЫЙ КЕТОНОВЫЙ КАТАЛИЗАТОР ДЛЯ ЭПОКСИДАЦИИ
Yong Tu, Michael Frohn, Zhi-Xian Wang и Yian Shi
Org. Synth. 2003 80 , 1
DOI: 10.15227 / orgsyn.080.0001
В этой испытанной методике из Organic Syntheses используется PCC для изготовления хирального кетонового катализатора для асимметричного эпоксидирования, известного как «эпоксидирование Ши» по имени его создателя, профессора Яна Ши (штат Колорадо).
Уравновешивание окислительно-восстановительных реакций ионно-электронным методом
У вас есть уравнение окислительно-восстановительного потенциала, которое вы не знаете, как сбалансировать? Помимо простой балансировки рассматриваемого уравнения, эти программы также предоставят вам подробный обзор всего процесса балансировки с помощью выбранного вами метода.
- Ионно-электронный метод (также называемый методом полуреакции)
- Метод изменения окислительного числа
- Метод агрегатных окислительно-восстановительных видов (или метод ARS) — Новое в periodni.com [1]
ионно-электронным методом
В ионно-электронном методе (также называемом методом полуреакции) окислительно-восстановительное уравнение разделено на два полууравнения — одно для окисления, а второе для восстановления. Каждую из этих полуреакций уравновешивают отдельно, а затем объединяют для получения сбалансированного окислительно-восстановительного уравнения.
Введите уравнение химической реакции и нажмите «Отправить» (например: mn2 ++ bio3- + h + = mno4- + bi3 +).
Правила набора уравнений
- Пробелы не имеют значения, например Cu SO 4 равен CuSO4
- Все типы круглых скобок верны, например K3 [Fe (CN) 6]
- Чтобы ввести виды заряда, просто введите их как есть, например Hg2 +, Hg22 + или Hg2 ^ 2 +
- Чтобы ввести знак уравнения, вы можете использовать символы «=», «->» или «→».
- Уравнение можно писать строчными буквами. Если элементы в химической формуле правильно написаны с заглавной буквы, преобразователь смарт-корпуса оставит их так, как вы ввели.
Почему необходимо сбалансировать химические уравнения?
Сбалансированное химическое уравнение точно описывает количества реагентов и продуктов в химических реакциях. Закон сохранения массы гласит, что масса не создается и не разрушается в ходе обычной химической реакции.Это означает, что химическое уравнение должно иметь одинаковое количество атомов каждого элемента с обеих сторон уравнения. Также сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне. Когда эти два условия выполняются, уравнение считается сбалансированным.
Руководство по уравновешиванию окислительно-восстановительных уравнений
- Шаг 1. Запишите несбалансированное уравнение
- Шаг 2. Разделите окислительно-восстановительную реакцию на половину реакции.
- а) Назначьте степени окисления для каждого атома
- б) Определите и запишите все окислительно-восстановительные пары в реакции .
- c) Объединить эти окислительно-восстановительные пары в две полуреакции
- Шаг 3.Сбалансируйте атомы в каждой половине реакции
- а) Уравновесить все остальные атомы, кроме Н и О
- б) Уравновесить атомы кислорода с H 2 O
- c) Уравновесить атомы водорода с помощью H +
- d) В базовой среде добавьте по одному OH — с каждой стороны на каждые H + .
- Шаг 4. Уравновесить расходы с помощью e —
- Шаг 5: Сделайте усиление электронов эквивалентным потере электронов в полуреакциях
- Шаг 6: сложите половину реакции
- Шаг 7: Упростите уравнение
- Наконец, убедитесь, что элементы и заряды сбалансированы.
Пример уравнения окислительно-восстановительного потенциала
Ионное уравнение против молекулярного вида
Когда уравнение записано в молекулярной форме, программа будет иметь проблемы с балансировкой атомов в полуреакциях (шаг 3.). Этого можно избежать, записав уравнение в ионной форме.
Разные решения
- KSCN + 4I 2 + 4H 2 O → KHSO 4 + 7HI + ICN
- SCN — + 5I 2 + 4H 2 O → HSO 4 — + 8I — + CN — + 2I + + 7H +
