Химия — 9
Получение. Угольную кислоту получают растворением углекислого газа в воде:
Физические свойства. Угольная кислота существует только в растворе. Она очень непрочная и сразу распадается, как только образуется. Ее раствор бесцветный, со слабым кислым вкусом.
Химические свойства. Угольная кислота обладает общими свойствами кислот: она реагирует с активными металлами, основными оксидами и основаниями, образуя нормальные и кислые соли:
H2CO3 + Mg → MgCO3 + H2↑
H2CO3 + CaO → CaCO3 + H2O
H2CO3 + 2NaOH → Na2CO3
H2CO3 + NaOH → NaHCO3 + H2O
Специфические свойства угольной кислоты связаны с ее непрочностью и
очень слабыми кислотными свойствами. В водном растворе диссоцирует незначительно:
В водном растворе диссоцирует незначительно:
По этой причине угольная кислота окрашивает лакмусовую бумагу в розовый цвет, а не красный. Угольная кислота вытесняет метакремниевую кислоту из ее солей.
Соли угольной кислоты. Угольная кислота как двухосновная кислота образует два ряда солей – карбонаты и гидрокарбонаты.
Получение. Карбонат кальция встречается в природе.
В промышленности из карбонатов, главным образом, производят безводную соду Na2CO3, кристаллическую соду Na2CO3·10H2O и пищевую соду NaHCO3. Их получают, в основном, в следующей последовательности:
При пропускании смеси газов NH3 и CO2 через холодный раствор NaCl,
образуется осадок плохо растворимого, в холодной воде, гидрокарбоната
натрия. При прокаливании последного образуется безводная сода:
При прокаливании последного образуется безводная сода:
При растворении безводной соды в воде и последующего выпаривания раствора выделяется кристаллическая сода:
При насыщении раствора соды диоксидом углерода образуется
Na2CO3 + H2O + CO2 → 2NaHCO3 пищевая сода
Физические свойства. Карбонаты – твердые, кристаллические вещества. Кроме карбонатов натрия, калия и аммония, остальные карбонаты в воде нерастворимы. Гидрокарбонаты относительно лучше растворимы, чем карбонаты. Однако гидрокарбонат натрия хуже растворим, чем Na2CO3.
Химические свойства. Карбонаты обладают общими свойствами солей и
специфическими свойствами.
Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельно
ИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41
Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
РЕПЕТИТОРА И
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ ОБРАЗОВАНИИ У ВСЕХ РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ ЭТО НЕОБХОДИМО
376598 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
уже сделали свой выбор
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки. Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Наталья Борисовна Карасева
«
Мы восторге от репетитора. Наталья Борисовна грамотный педагог, она любит свою профессию, любит учеников. Занятия с сыном (2 класс), он находится на домашнем обучении, проходят по скайпу в комфортной обстановке. Репетитор умеет заинтересовать ребенка и выстраивает занятие с учетом его способностей, доступно объясняя предметы русский язык и математику. По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
«
Елена Васильевна
Клиентам
- Репетиторы по математике
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
- ChemSchool
-
PREPY.
 RU
RU
- Class
14.2: Кислоты – свойства и примеры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47554
Цели обучения
- Изучить свойства кислот.
Многие любят пить кофе. Чашка первым делом с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Известковые отложения накапливаются через некоторое время и замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и запустить цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости. Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости. Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень распространены в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть они проводят электрический ток. Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде.

- Кислоты имеют кислый вкус. Лимоны, уксус и кислые леденцы содержат кислоты.
- Кислоты изменяют цвет некоторых кислотно-щелочных индикаторов. Двумя распространенными индикаторами являются лакмус и фенолфталеин. Синий лакмус в присутствии кислоты становится красным, а фенолфталеин обесцвечивается.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции одинарного замещения, как показано ниже:
\[\ce{Zn} \left( s \right) + \ce{H_2SO_4} \left( aq \right) \rightarrow \ce{ZnSO_4} \left( aq \right) + \ce{H_2} \left (г \справа) \label{eq1} \] - Кислоты реагируют с основаниями с образованием соединения соли и воды. При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.

Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что список оснований немного сложнее). Ниже приведен неполный список некоторых распространенных кислот, а также некоторые химические формулы:
Имя химика | Общее имя | Использование |
|---|---|---|
| соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота — HCl | .Применяется при очистке (рафинировании) металлов, при уходе за плавательными бассейнами и для бытовой уборки. |
| серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений.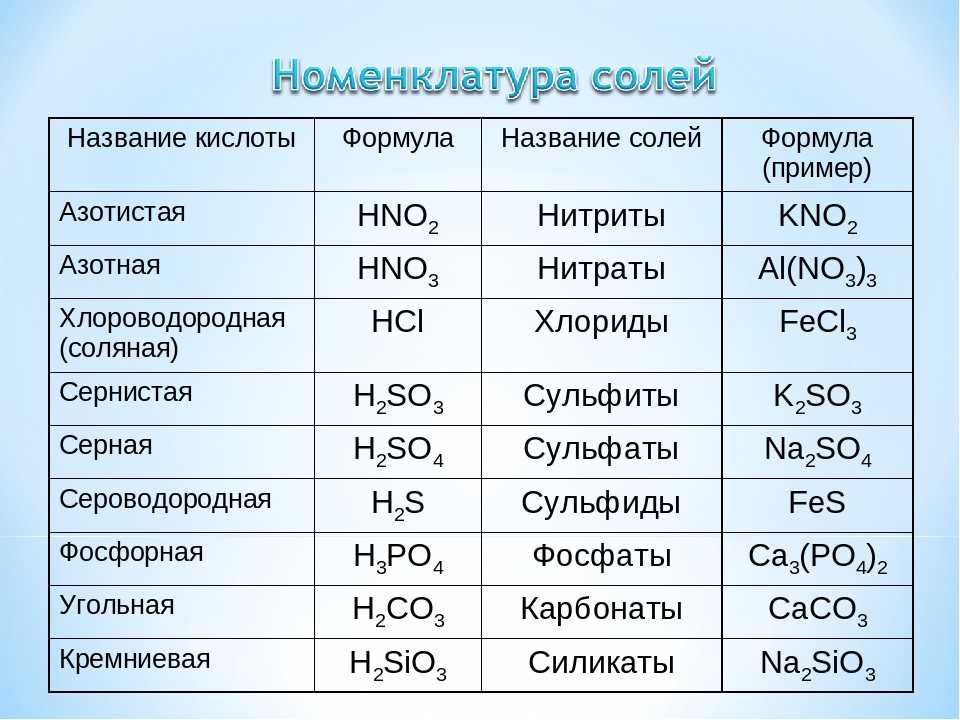 | |
| азотная кислота, HNO 3 | Используется в производстве удобрений, взрывчатых веществ и при добыче золота. | |
| уксусная кислота, углеводороды 2 H 3 O 2 | уксус | Основной ингредиент уксуса. |
| угольная кислота, H 2 CO 3 | отвечает за шипение в газированных напитках | В качестве ингредиента газированных напитков. |
| лимонная кислота, C 6 H 8 O 7 | Используется в пищевых продуктах и пищевых добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
| ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 )CO 2 H | аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
Соляная кислота
Соляная кислота представляет собой коррозионную сильную минеральную кислоту, которая используется во многих отраслях промышленности. Бесцветный, очень резкий раствор хлороводорода (HCl) в воде. Соляную кислоту обычно получают обработкой \(\ce{HCl}\) водой. 9{-} (aq) } \nonumber \]
Таким образом, соляную кислоту можно использовать для получения хлоридных солей. Соляная кислота является сильной кислотой, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота представляет собой сильно коррозионную сильную минеральную кислоту с молекулярной формулой \(\ce{h3SO4}\). Серная кислота является двухосновной кислотой и имеет широкий спектр применения, включая использование в бытовых кислотных очистителях канализации, [] в качестве электролита в свинцово-кислотных батареях и в различных чистящих средствах. Это также центральное вещество в химической промышленности.
Рисунок \(\PageIndex{1}\): Капли концентрированной серной кислоты быстро разлагают кусок хлопчатобумажного полотенца при обезвоживании. (CC BY-SA 3.0; Токсичный Уокер). Поскольку гидратация серной кислоты термодинамически выгодна (и сильно экзотермична) и ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень мощным обезвоживающим свойством, удаляя воду (\(\ce{h3O}\)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло, пар. Серная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов с образованием газообразного водорода (уравнение \ref{Eq1}).
Серная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов с образованием газообразного водорода (уравнение \ref{Eq1}).
\[\ce{M + h3SO4 → M(SO4) + h3 } \label{Eq1} \]
Азотная кислота
Азотная кислота (\(\ce{HNO3}\)) является высококоррозионной минеральной кислотой а также обычно используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем взаимодействия диоксида азота (\(\ce{NO_2(g)}\)) с водой.
\[\ce{3 NO2(г) + h3O (ж)→ 2 HNO3 (г) + NO(г)} \номер \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации Кислота и природа металла. Разбавленная азотная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет \(\ce{h3}\) газ):
\[\ce{Mg + 2 HNO3 → Mg(NO3)2 + h3 } \номер \]
\[\ce{Mn + 2 HNO3 → Mn(NO3)2 + h3 } \номер \]
\[\ce{Zn + 2 HNO3 → Zn(NO3)2 + h3 } \номер \]
Азотная кислота является коррозионно-активной кислотой и сильным окислителем. Главной опасностью, которую он представляет, является химический ожог, так как он осуществляет кислотный гидролиз белков (амид) и жиров (эфир), что приводит к разложению живой ткани (Рисунок \(\PageIndex{2}\)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином 9.0030 Рисунок \(\PageIndex{2}\): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Главной опасностью, которую он представляет, является химический ожог, так как он осуществляет кислотный гидролиз белков (амид) и жиров (эфир), что приводит к разложению живой ткани (Рисунок \(\PageIndex{2}\)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином 9.0030 Рисунок \(\PageIndex{2}\): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
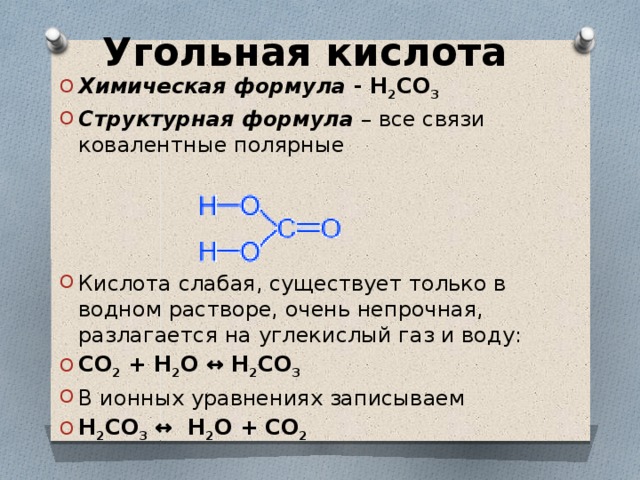
Углекислота
Углекислота — это химическое соединение с химической формулой \(\ce{h3CO3}\), а также это название, которое иногда дается растворам диоксида углерода в воде (газированная вода), поскольку такие растворы содержат небольшое количество \(\ce{h3CO3(водн.)}\). Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии угольная кислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к появлению многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота является полипротонной кислотой, в частности, она является двухосновной, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда двуокись углерода растворяется в воде, она находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\[\ce{CO2 + h3O <=> h3CO3} \nonumber \]
Реакция может быть подталкивает к тому, чтобы реагенты генерировали \(\ce{CO2(г)}\) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рис. \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\(\ce{HCO2H}\)) является простейшей карбоновой кислотой и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравьиный» происходит от латинского слова formica, обозначающего муравья, что указывает на его раннюю изоляцию путем перегонки тел муравьев. Муравьиная кислота широко встречается в природе в виде формиата сопряженного основания.
Лимонная кислота
Лимонная кислота (\(\ce{C6H8O7}\)) представляет собой слабую органическую трикарбоновую кислоту, которая естественным образом содержится в цитрусовых. Ион цитрата является промежуточным звеном в Цикл TCA (цикл Кребса), центральный метаболический путь животных, растений и бактерий. Поскольку это одна из самых сильных пищевых кислот, лимонная кислота в основном используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Ион цитрата является промежуточным звеном в Цикл TCA (цикл Кребса), центральный метаболический путь животных, растений и бактерий. Поскольку это одна из самых сильных пищевых кислот, лимонная кислота в основном используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспаления. Аспирин в виде листьев ивы использовался для улучшения здоровья в течение как минимум 2400 лет.
Рисунок \(\PageIndex{5}\): Шарико-стержневая модель молекулы аспирина. (Общественное достояние; Бен Миллс).Аспирин представляет собой белое кристаллическое слабокислотное вещество.
Резюме
Был дан краткий обзор ключевых аспектов некоторых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов.
Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов.
Взносы и ссылки
14.2: Acids-Properties and Examples распространяется под лицензией CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- автор@Генри Эгнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/
Получение и свойства угольной кислоты
10 Минуты
10 Протокол
7-10 классы
Ученики
Также является частью:
Набор для учащихся Кислоты, основания, соли цифровой, TESS advanced Chemistry
Артикул № 25302-88Д | Тип: Набор
Набор для учащихся Кислоты, основания, соли, TESS advanced Chemistry
Артикул № 25302-88 | Тип: Набор
Время доставки: 3-4 недели
Принцип
Углекислота может быть получена действием сильных кислот на карбонат кальция и пропусканием полученного углекислого газа в воду.
Углекислота легко распадается на углекислый газ и снова воду. В этом опыте студенты готовят углекислоту на основе мрамора и изучают ее свойства.
Цели обучения
- Получение и свойства угольной кислоты
Преимущества
- Простое преподавание и эффективное обучение с помощью интерактивных экспериментов PHYWE-Software
- Эксперимент является частью полного набора решений с экспериментами по темам кислот, щелочей и солей, соответствующих международной учебной программе: охвачены все темы
Название устройства
Артикул №
Количество
Опорная база, переменная
Арт. 02001-00
1
Опорный стержень, нержавеющая сталь, разной длины | Длина: 370 мм
Арт. 02059-00
1
Проволочная сетка с керамическим покрытием, 160 x 160 мм
Арт. 33287-01
33287-01
1
Промывочный флакон, 250 мл, пластик
Артикул № 33930-00
1
Стакан, боро, низкий | Объем: 250 мл
Артикул № 46054-00
1
Колба Эрленмейера, с пробкой, 250 мл SB 29
Арт. MAU-EK17082306
1
Мерный цилиндр, высокий, ПП, 500 мл | Объем: 50 мл
Артикул № 46287-01
1
Стеклянная трубка, прямоугольная.
Артикул № MAU-10030703
1
Капельная воронка с капельным наконечником, 50 мл
Арт. 36912-00
1
Защитные очки, прозрачное стекло
Арт. 39316-00
1
Резиновая пробка 26/32, 2 отверстия 7 мм
Арт. 39258-02
1
Резиновый шланг | диаметр: 6 мм
Артикул № 39282-00
1
Пипетка с резиновой грушей
Арт. 64701-00
64701-00
1
Головка бобышки
Арт. 02043-00
2
Универсальный зажим
Арт. 37715-01
2
Кольцо с выступом, т.е. д. = 10 см
Артикул № 37701-01
1
Бутановая горелка с картриджем, 220 г
Арт. 32180-00
1
Глицерин, 250 мл
Артикул № 30084-25
1
Мрамор, шт. 1000 г
Арт. 30140-70
1
Соляная кислота 37 %, 1000 мл
Арт. 30214-70
1
Вода дистиллированная 5 л
Арт. 31246-81
1
Жидкий индикатор ph2-13 UNISOL113
Арт. 47014-02
1
Имя
Имя файла
Размер файла
Тип файла
(en) Руководство по экспериментам
P7158300E .pdf
Размер файла 0,55 МБ
(DE) Versuchsbeschrebung
P7158300_DE .PDF
Размер файла 2.44 MB
(ES
. Мб
Бесплатная доставка от 300,- €
Nach oben
Legal
- Контакт
- общие положения и условия
- Декларация о конфиденциальности
- Выходные данные
Служба
- Обзор Услуги
- Загрузки
- Каталоги
- Вебинары и видео
- Связаться со службой поддержки клиентов
Компания
- О нас
- Политика качества
- Безопасность в классе
Обратите внимание:
* Цены указаны с учетом НДС.

 RU
RU


 ck12.org/c/chemistry/
ck12.org/c/chemistry/