Химические свойства щелочных металлов и щелочноземельных
4.3
Средняя оценка: 4.3
Всего получено оценок: 400.
4.3
Средняя оценка: 4.3
Всего получено оценок: 400.
Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу периодической таблицы входят щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
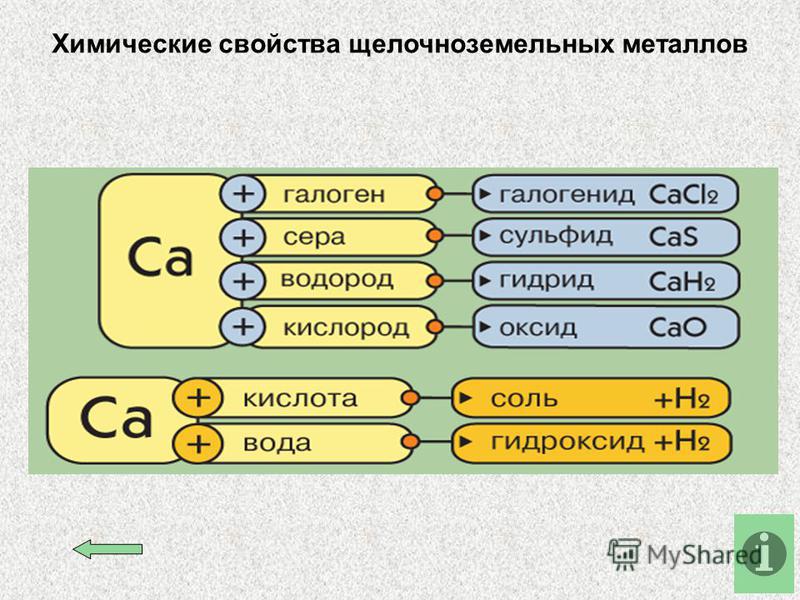
Химические свойства щелочных металлов представлены в таблице.
Реакция | Особенности | Уравнение |
С кислородом | Быстро окисляются на воздухе. | – 4Li + O2 → 2Li2O; – 2Na + О2 → Na2O2; – Rb + O2 → RbO2 |
С азотом | Реагирует только литий при комнатной температуре | 6Li + N2 → 2Li3N |
С галогенами | Реакция проходит бурно | 2Na + Cl2→ 2NaCl |
С неметаллами | При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды | – 2K + S → K2S; – 2Na + H 2 → 2NaH; – 2Cs + 5P → Cs2P5; – Rb + Si → RbSi; – 2Li + 2C → Li2C2 |
С водой | Спокойно реагирует только литий. | 2Na + 2H2O → 2NaOH + H2↑ |
С кислотами | С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот | – 2Na + 2HCl → 2NaCl + H2; – 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O; – 10Na + 12HNO3 (разб) → N2 + 10NaNO3 + 6H2O |
С аммиаком | Образуют амины | 2Li + 2NH3 → 2LiNH2 + H2↑ |
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
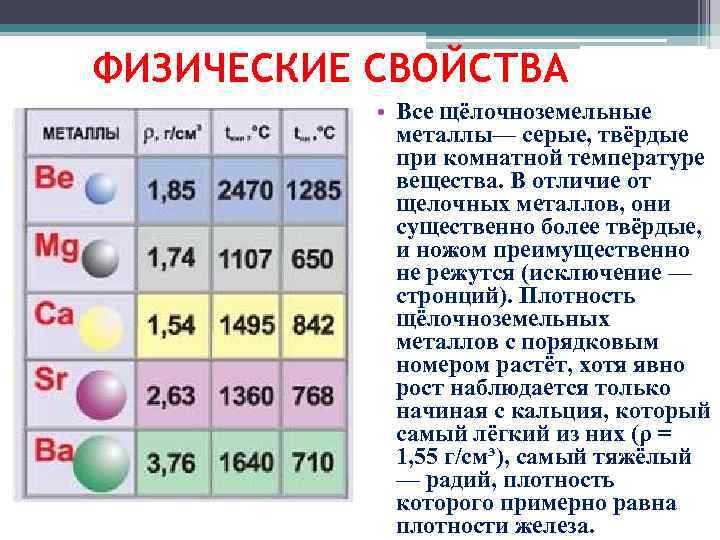
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см3).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
Реакция | Особенности | Уравнение |
С кислородом | Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются | 2Mg + O2 → 2MgO |
С водородом | При высокой температуре образуют гидриды | Sr + H2 → SrH2 |
С галогенами и неметаллами | Реагируют при нагревании | – Be + Cl2 → BeCl2; – Mg + S → MgS; – 3Ca + 2P → Ca3P2; – 3Ca + N2 → Ca3N2 – Ba + 2C → BaC2 |
С водой | При комнатной температуре | Mg + 2H2O → Mg(OH)2 + H2 |
С кислотами | Реагируют все металлы с образованием солей | 4Ca + 10HNO3 (конц. |
Со щелочами | Реагирует только бериллий | Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
Замещение | Замещают менее активные металлы в оксидах. Исключение – бериллий | 2Mg + ZrO2 → Zr + 2MgO |
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
Рис. 3. Качественная реакция.Что мы узнали?
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Лидия Маслова
5/5
Сергей Ефремов
3/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 400.
А какая ваша оценка?
Получение щелочноземельных металлов.
Сначала
получают окиси или хлориды Э. ЭО получают
прокаливанием ЭСО3,
а ЭС12 действием соляной кислоты на ЭСО3.
Все щелочноземельные металлы можно
получить алюмотермическим восстановлением
их окисей при температуре 1200 оС
по примерной схеме: 3ЭО + 2Al
= Al2O3 +
3Э. Процесс при этом ведут в вакууме во
избежании окисления Э. Кальций (как и
все остальные Э) можно получить
электролизом расплава СаСl2 с
последующей перегонкой в вакууме или
термической диссоциацией СаС2.
Ва и Sr
можно получить пиролизом Э2N3,
Э(NH3
Процесс при этом ведут в вакууме во
избежании окисления Э. Кальций (как и
все остальные Э) можно получить
электролизом расплава СаСl2 с
последующей перегонкой в вакууме или
термической диссоциацией СаС2.
Ва и Sr
можно получить пиролизом Э2N3,
Э(NH3
Особенности щелочноземельных металлов.
Кальций имеет атомный номер 20 и атомный вес 40,08. Стронций — 38 и 87,62. Барий — 56 и 137,33. Радий 88 и 226,02. Э характеризуются наибольшим сходством между собой, т.к. для них характерна не только групповая и типовая аналогия, но и слоевая. В основном состоянии Э нульвалентны и имеют структуру ns2. возбуждение до двухвалентного состояния может идти по схемам: ns2nsnp или ns2ns(n-1)d. Потенциалы ионизации и ОЭО представлены ниже:
Ca | Sr | Ba | Ra | |
I1 | 6,11 | 5,69 | 5,21 | 5,28 |
I2 | 11,87 | 11,03 | 10,00 | 10,14 |
ОЭО | 1,04 | 0,99 | 0,97 | 0,97 |
Как
видно из таблицы ОЭО элементов различаются
незначительно. В целом от Са к Ва немного
возрастает химическая активность
щелочноземельных металлов (свойства
радия изучены не лучшим образом, ввиду
малой распространенности и радиоактивности).
Во многих отношениях Э напоминают
щелочные металлы. И те и другие — химически
активны, не проявляют комплексообразовательной
способности. Их гидроокиси – сильные
основания, а гидриды – солеобразные
вещества.
В целом от Са к Ва немного
возрастает химическая активность
щелочноземельных металлов (свойства
радия изучены не лучшим образом, ввиду
малой распространенности и радиоактивности).
Во многих отношениях Э напоминают
щелочные металлы. И те и другие — химически
активны, не проявляют комплексообразовательной
способности. Их гидроокиси – сильные
основания, а гидриды – солеобразные
вещества.
Физические свойства щелочноземельных металлов.
Са
и его аналоги представляют собой
серебристо-белые металлы. Кальций из
них самый твердый. Стронций и особенно
барий значительно мягче кальция. Все
щелочноземельные металлы пластичные,
хорошо поддаются ковке, резанью и
прокатке. Кальций при обычных условиях
кристаллизуется в ГЦК-структуре с
периодом а=0,556 нм (КЧ=12), а при температуре
выше 464оС
в ОЦК-стуктуре. Са образует сплавы с Li,
Mg,
Pb, Cu, Cd, Al,
Ag, Hg. Стронций имеет ГЦК – структуру;
при температуре 488 оС
стронций претерпевает полиморфное
превращение и кристаллизуется в
гексагональной структуре. Он парамагнитен.
Барий кристаллизуется в ОЦК структуре.
Са и Sr
способны образовывать между собой
непрерывный ряд твердых растворов, а в
системах Са-Ва и Sr-Ba
появляются области расслаивания. В
жидком состоянии стронций смешивается
с Ве, Hg, Ga, In, Sb, Bi, Tl, Al, Mg, Zn,
Sn, Pb.
С последними четырьмя Sr
образует интерметаллиды. Электропроводность
щелочноземельных металлов с повышением
давления падает, вопреки обратному
процессу у остальных типичных металлов.
Ниже приведены некоторые константы для
щелочноземельных металлов:
Он парамагнитен.
Барий кристаллизуется в ОЦК структуре.
Са и Sr
способны образовывать между собой
непрерывный ряд твердых растворов, а в
системах Са-Ва и Sr-Ba
появляются области расслаивания. В
жидком состоянии стронций смешивается
с Ве, Hg, Ga, In, Sb, Bi, Tl, Al, Mg, Zn,
Sn, Pb.
С последними четырьмя Sr
образует интерметаллиды. Электропроводность
щелочноземельных металлов с повышением
давления падает, вопреки обратному
процессу у остальных типичных металлов.
Ниже приведены некоторые константы для
щелочноземельных металлов:
Са | Sr | Ba | Ra | |
Атомный радиус, нм | 0,197 | 0,215 | 0,221 | 0,235 |
Радиус иона Э2+, нм | 0,104 | 0,127 | 0,138 | 0,144 |
Энергия
кр. | 194,1 | 164,3 | 175,8 | 130 |
, г\см3 | 1,54 | 2,63 | 3,5 | 5,5-6 |
Тпл.,оС | 852 | 770 | 710 | 800 |
Ткип.,оС | 1484 | 1380 | 1640 | 1500 |
Электропроводность (Hg=1) | 22 | 4 | 2 | |
Теплота плавления ккал\г-атом | 2,1 | 2,2 | 1,8 | |
Теплота испарения ккал\г-атом | 36 | 33 | 36 | |
Удельная
теплоемкость, Дж\(кг. | 624 | 737 | 191,93 | 136 |
Сжижаемость Па-1.10-11 | 5,92 | 8,36 |
8.5.2: Химические свойства щелочноземельных металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 199692
Щелочноземельные металлы являются хорошими восстановителями, склонными к образованию степени окисления +2.
Щелочноземельные металлы склонны образовывать катионы +2. Как видно из рисунка \(\sf{\PageIndex{2}}\), Щелочноземельные металлы обладают большими отрицательными стандартными потенциалами восстановления M 2+/0 , которые сильно благоприятствуют катиону +2. Потенциалы восстановления Са 2+ , Sr 2+ и Ва 2+ до металла ~ -3 В даже близки к щелочным металлам.
Как видно из рисунка \(\sf{\PageIndex{2}}\), Щелочноземельные металлы обладают большими отрицательными стандартными потенциалами восстановления M 2+/0 , которые сильно благоприятствуют катиону +2. Потенциалы восстановления Са 2+ , Sr 2+ и Ва 2+ до металла ~ -3 В даже близки к щелочным металлам.
Подобно щелочным металлам, Ca, Sr и Ba растворяются в жидком аммиаке с образованием растворов, содержащих сольватированные электроны, хотя они не так хорошо изучены, как растворы щелочных металлов.
В отличие от щелочного металла, все щелочноземельные металлы реагируют с кислородом с образованием оксидов формулы MO, хотя пероксиды более тяжелых щелочноземельных металлов могут образовываться путем осаждения катиона металла из раствора в фазе с источником пероксидного аниона (O 2 2-). 9{2+}~~+~~H_2(г)~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~(M~=~Be~and~Mg)} \nonumber \]
9{2+}~~+~~H_2(г)~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~(M~=~Be~and~Mg)} \nonumber \]
\[\sf{M(s)~~+~~H_2O(g)~~\overset{ высокий~T,~P}{\longrightarrow}~MO(s)~~+~~H_2(g)~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~(M~=~Be~and~Mg)} \nonumber \]
Предположительно Ca, Sr, Ba и Ra будут реагировать так же, хотя из-за их более высокой реактивность реакция, скорее всего, будет бурной.
Как и другие оксиды металлов, содержащие металлы с низкой степенью окисления, оксиды щелочноземельных металлов являются основными. Оксиды более тяжелых щелочноземельных металлов реагируют с водой с образованием гидроксидов. 9-~~\rightarrow~MX_2~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be,~Mg, Ca,~Sr ,~Ba,~и~предположительно~Ra;X~=~F,~Cl,~Br,~I)} \nonumber \]
\[\sf{M(OH)_2~~+~~2~ HX~~\стрелка вправо~MX_2~~+~~2~H_2O~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~= ~Mg, Ca,~Sr,~Ba,~и~предположительно~Ra; X~=~F,~Cl,~Br,~I)} \nonumber \]
\[\sf{MO~~+~ ~2~HX~~\стрелка вправо~MX_2~~+~~H_2O~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~ =~Mg, Ca,~Sr,~Ba,~и~предположительно~Ra; X~=~F,~Cl,~Br,~I)} \nonumber \]
Более тяжелые щелочноземельные металлы (от Mg до Ba ) также восстанавливают водород с образованием гидридов.
\[\sf{M(s)~~+~~H_2(g)~~\rightarrow~MH_2~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~и~предположительно~Ra)} \nonumber \]
Как обсуждалось в разделе 8.2 .1. Химические свойства водорода, эти гидриды щелочноземельных металлов являются ионными солями гидрид-иона. Таким образом они реагируют с водой и другими электрофилами.
\[\sf{MH_2(s)~~+~~H_2O(l)~~\rightarrow~M(OH)_2~~+~~H_2(g)~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~и~предположительно~Ra)} \nonumber \]
потребление воды в этой реакции является основанием для использования гидрида кальция в качестве осушителя органических растворителей.
В отличие от более тяжелых щелочноземельных металлов, бериллий не реагирует напрямую с водородом, и образующийся гидрид, хотя и остается нуклеофильным, действует как полярный ковалентный гидрид и относительно медленно гидролизуется.
Двухвалентные катионы щелочноземельных металлов поляризуют анионы
Классический пример способности катионов щелочноземельных металлов поляризовать анионы включает разложение карбонатов металлов. Карбонаты и нитраты щелочных металлов термически разлагаются с выделением CO 2 и смесь NO 2 и O 2 соответственно.
Карбонаты и нитраты щелочных металлов термически разлагаются с выделением CO 2 и смесь NO 2 и O 2 соответственно.
\[\sf{MCO_3(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~CO_2(g)} \nonumber \]
\[\sf{M (NO_3)_2(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~2~NO_2(g)~~+~~O_2(g)} \nonumber \]
Комплексные факторы управляют разложением нитратов, но, как показано в таблице \(\sf{\PageIndex{1}}\), разложение карбонатов щелочноземельных металлов показывает, что при движении вниз по группе разложение карбонатов требует все более высоких температур.
Таблица \(\sf{\PageIndex{1}}\). Температуры разложения карбонатов щелочноземельных металлов
| Карбонат | Середина диапазона разложения 2 (К) |
| BeCO 3 | не сообщается; нестабилен при комнатной температуре (298 K) |
| MgCO 3 | 903 |
| CaCO 3 | 953 |
| СРКО 3 | 1178 |
| БаСО 3 | 1316 |
Типичное объяснение этой тенденции связано с механизмом разложения карбонатов, изображенным на схеме \(\sf{\PageIndex{II}}\).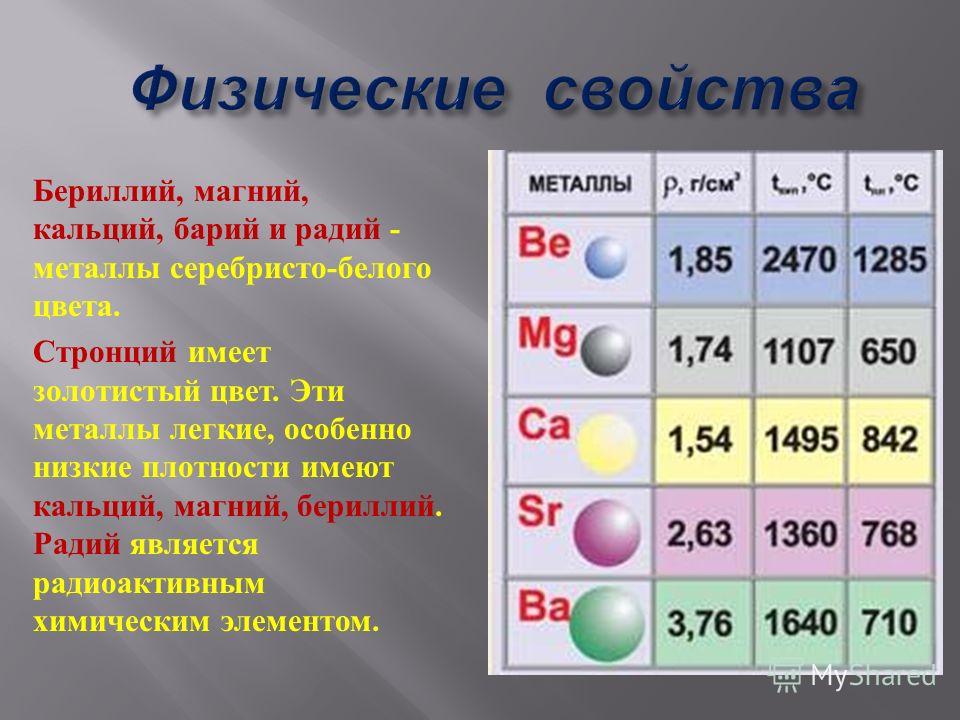 По мере того, как катион щелочноземельного металла становится больше при переходе от Be к Ba, его способность поляризовать карбонатный анион уменьшается, что затрудняет образование оксида.
По мере того, как катион щелочноземельного металла становится больше при переходе от Be к Ba, его способность поляризовать карбонатный анион уменьшается, что затрудняет образование оксида.
Схема \(\sf{\PageIndex{I}}\). Модели, объясняющие, как катионы щелочноземельных металлов способствуют разложению карбонатов. (A) Ионная модель, в которой накопление отрицательного заряда стабилизируется за счет взаимодействия между дикатионом и одним из атомов кислорода карбоната. (B) Полуковалентное представление того же взаимодействия, теперь изображаемое как связь M=O (что не следует понимать как подразумевающее, что такая связь действительно существует).
Упражнение \(\PageIndex{1}\)
Сульфаты щелочноземельных металлов подвергаются реакциям разложения, сходным с реакциями разложения карбонатов и нитратов.
- Напишите реакцию разложения, которая включает выделение одного молекулярного газа из сульфата с образованием оксида.
- Расположите сульфаты щелочноземельных металлов в порядке возрастания температуры разложения.

- Ответить
1. Сульфаты разлагаются с выделением SO 3 по реакции
\[\sf{MSO_4(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~SO_3(g)} \nonumber \]
Обратите внимание, что другим возможным режимом разложения является
.\[\sf{MSO_4(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~ {\textstyle \frac{1}{2}}~O_2(g)~ ~+~~SO_2(g)} \номер\]
Однако эта реакция не та, о которой просит подсказка, поскольку она включает выделение двух разных молекулярных газов (O 2 и SO 2 ).
2. Ожидаемый порядок разложения сульфатов щелочноземельных металлов вместе с известными температурами разложения составляет 9.{\circ}C}{SrSO_4}~<~BaSO_4~<~RaSO_4} \nonumber \]
Бериллий и в меньшей степени магний образуют полярные высококовалентные соединения.
Химия магния и бериллия демонстрирует опасность чрезмерно строгого разделения элементов на металлы, неметаллы и металлоиды. Это связано с тем, что и Be, и Li могут образовывать соединения со значительным ковалентным характером, и, как можно было ожидать, учитывая их относительную малочисленность электронов, они имеют много общего с металлоидами B и Al 13-го ряда с дефицитом электронов.
Это связано с тем, что и Be, и Li могут образовывать соединения со значительным ковалентным характером, и, как можно было ожидать, учитывая их относительную малочисленность электронов, они имеют много общего с металлоидами B и Al 13-го ряда с дефицитом электронов.
Что касается Mg, то влияние ковалентности очевидно из структур реактивов Грингарда Mg форм на реакцию между металлом и алкилгалогенидами.
\[\sf{Mg(s)~~+~~R-X~~\overset{THF, каталитический~I_2}{\longrightarrow}~R-Mg-X} \nonumber \]
Реакция зависит от присутствие донорных эфиров основания Льюиса, таких как Et 2 O или ТГФ, которые координируют Mg 2+ , завершая его координационную сферу, давая тетраэдрические комплексы, подобные изображенным на схеме \(\sf{\PageIndex{II}} \).
Схема \(\sf{\PageIndex{II}}\). Структура мономерного реактива Гриньяра «RMgX» в растворе ТГФ.
Подобно молекулярным соединениям, реагенты Грингарда вступают в реакции замещения лиганда в растворе в соответствии с равновесием Шленка.
\[ \nonumber \]
Они также образуют кластеры, в которых неподеленные пары галогенов используются для соединения нескольких центров Mg, как показано комплексом на схеме \(\sf{\PageIndex{III}}\).
Схема \(\sf{\PageIndex{II}}\). (A) Галогены, такие как Cl, могут связывать несколько металлических центров через свои неподеленные пары, что позволяет образовывать виды, подобные (B) «(RMgCl) 2 (MgCl 2 ) 2 «. Перерисовано из ссылок 4 и 5.
Степень ковалентности еще больше в случае бериллия, который с радиусом всего 113 Å и валентными электронами, которые испытывают эффективный ядерный заряд Слейтера +1,95 атомных единиц заряда, имеет значительная способность поляризовать близлежащие базы Льюиса. В результате бериллий имеет тенденцию образовывать полярные ковалентные связи, а не ионные.
Поскольку бериллий обладает только двумя валентными электронами, его соединения также имеют тенденцию к дефициту электронов, и распространены мостиковые связи Be-X-Be.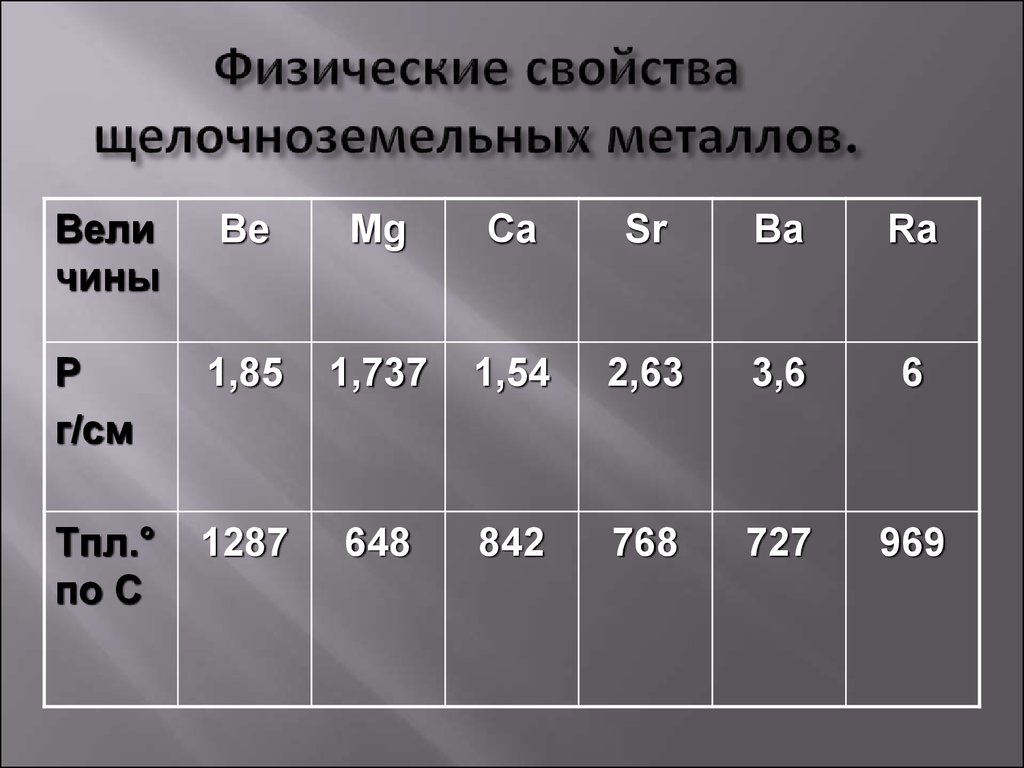 Таким образом, в жидком аммиаке Be образует соединения с мостиковыми связями Be-N-Be, подобные тетрамерному кластеру, показанному на схеме \(\sf{\PageIndex{III}}\).
Таким образом, в жидком аммиаке Be образует соединения с мостиковыми связями Be-N-Be, подобные тетрамерному кластеру, показанному на схеме \(\sf{\PageIndex{III}}\).
Схема \(\sf{\PageIndex{III}}\). Тетрамерный кластер Be, образованный в жидком аммиаке. Перерисовано из ссылки 6.
Рисунок \(\sf{\PageIndex{2}}\). При более высоких температурах полимерные цепи диссоциируют на Be 2 димеры Cl 4 и мономеры BeCl 2 . Рисунок \(\sf{\PageIndex{2}}\). (A) Структура BeCl 2 , состоящая из (B) полимерных цепей соединенных ребрами тетраэдров BeCl 4 . Структура BeCl 2 составлена Беном Миллсом — собственная работа, общественное достояние, commons.wikimedia.org/w/inde…?curid=4759802, который воспроизвел ее на основе данных рентгеновского излучения, опубликованных в Rundle, RE;Lewis. , П.Х. J. Chem. физ. 1952 , 20(1) : 132-134. Одной из особенно примечательных структур является структура основного ацетата бериллия, в которой центральный кислород связывает четыре атома Be, как показано на схеме \(\sf{\PageIndex{IV}}\) вместе с Be 4 (NO 3 ) 6 O, который, как считается, имеет аналогичную структуру.
Схема \(\sf{\PageIndex{IV}}\). (A) Структура основного ацетата бериллия, Be 4 (OAc) 6 O, (B) в котором центральный тетраэдр OBe 4 описан, чтобы было легче видеть, что структура состоит из OBe 4 6+ тетраэдр, в котором ребра Be—Be связаны мостиковыми ацетатными лигандами. Цинк образует аналогичную структуру и (C) структуру Be 4 (NO 3 ) 6 O постулируется как аналог основного ацетата бериллия с мостиковыми нитратными лигандами вместо ацетатов.
Рисунок \(\sf{\PageIndex{3}}\). Рисунок \(\sf{\PageIndex{3}}\). (A) Структура BeH 2 , состоящая из (B) сети тетраэдров BeH 4 , связанных 3-центровыми 2-электронными связями Be-H-Be. Структура BeH 2 составлена Беном Миллсом — собственная работа, общественное достояние, commons.wikimedia.org/w/inde…?curid=3930832, который воспроизвел его на основе рентгеновских данных, опубликованных Smith, GS; Джонсон, королевский адвокат; Смит, округ Колумбия; Кокс, Д. Э.; Снайдер, Р.Л.; Чжоу, RS; Залкин А. Solid State Communications 1988, 67(5), 491-494.
Э.; Снайдер, Р.Л.; Чжоу, RS; Залкин А. Solid State Communications 1988, 67(5), 491-494.Гидрид бериллия даже образует аддукт с двумя BH 3 , образуя структуру, в которой центральный Be связан с концевыми группами BH 2 3-центровыми 2-электронными связями Be-H-B, как показано на схеме. \(\sf{\PageIndex{V}}\). 7
Схема \(\sf{\PageIndex{V}}\). Образование аддукта между BeH 2 и двумя BH 3 (в виде B 2 H 6 ).
Ссылки и примечания
1. Petrocelli, A.W. Супероксиды. В Химической энциклопедии Ван Ностранда, Г. Д. Консидайн (ред.). Wiley, 2005. doi:10.1002/0471740039.vec2421
2. Средняя точка диапазона разложения MgCO 3 , CaCO 3 , SrCO 3 и BaCO 3 рассчитаны на основе данных, представленных Maitra, S., Chakrabarty, N., & Pramanik, J.. Cerâmica 2008 , 54 (331), 268-272.
3. Температуры разложения BeSO 4 , MgSO 4 , CaSO 4 и SrSO 4 взяты из Massey, A.G., Main group chemistry. Э. Хорвуд: Нью-Йорк, 1990, с. 152.
4. Seyferth, D. Реагенты Гриньяра. Металлоорганика 2009, 28 (6), 1598-1605.
5. Тони, Дж.; Стаки, GDJ Organomet. хим. 1971 , 28, 5.
6. Мюллер, М.; Карттунен, А.Дж.; Бюхнер М.Р., Обнаружение Be 2+ в кислом жидком аммиаке и образование тетра- и октанядерных амидокластеров бериллия. Химическая наука 2020, 11 (21), 5415-5422.
7. Структуру BeB 2 H 8 также можно рассматривать как аддукт между Be 2+ и двумя лигандами BH 4 — .
Авторы и авторство
Стивен Контейкс, Вестмонтский колледж
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Знать о физическом и химическом поведении щелочноземельных металлов
Элементы, составляющие группу 2 современной периодической таблицы, известны как щелочноземельные металлы. Щелочноземельные металлы представляют собой атомы, s-подоболочка которых заполнена двумя валентными электронами. [Благородный газ] ns2 — это их электронная конфигурация в целом. Их также называют металлами второй группы, потому что они находятся во втором столбце периодической таблицы.
Members of Alkaline Earth Metals Include:
Beryllium
Magnesium
Calcium
Strontium
Barium
Radium
The physical and chemical properties of the элементы этой группы очень похожи. В этой статье будет подробно изучено физическое и химическое поведение щелочноземельных металлов.
В этой статье будет подробно изучено физическое и химическое поведение щелочноземельных металлов.
Физические и химические свойства
Атомный и ионный радиусы
Из-за заряда и добавления электрона на один и тот же энергетический уровень ионный и атомный радиусы уменьшаются вниз по столбцу таблицы Менделеева, делая их меньше, чем щелочные металлы, и больше, чем другие атомы того же возраста .
Оба s-электрона могут быть потеряны в щелочноземельных элементах, что делает их дважды положительными катионами. Радиус катионного атома меньше, чем у нейтрального атома. Ионные радиусы продолжают увеличиваться по мере продвижения вниз по колонке.
Энергия ионизации
Щелочноземельные элементы могут отдавать все свои валентные электроны для формирования октета конфигурации благородного газа. В результате они имеют две энергии ионизации:
Первая энергия ионизации
Энергия, необходимая для отрыва первого электрона от нейтрального атома, известна как первая энергия ионизации щелочноземельных металлов. Из-за меньших радиусов и того, что электроны удерживаются более высоким ядерным зарядом, он больше, чем у атома щелочного металла. Электроны отрываются от полностью заполненной и, следовательно, стабильной подоболочки.
Из-за меньших радиусов и того, что электроны удерживаются более высоким ядерным зарядом, он больше, чем у атома щелочного металла. Электроны отрываются от полностью заполненной и, следовательно, стабильной подоболочки.
Вторая энергия ионизации
Вторая энергия ионизации, необходимая для второго электрона от катиона в щелочноземельных металлах, будет выше, чем первая энергия ионизации атома, но ниже, чем вторая энергия ионизации любого щелочного металла. Несмотря на сильную энергию ионизации, оба электрона могут быть удалены, так как атом:
Принимает конфигурацию благородного газа.
Из-за плотной упаковки атомов или ионов в твердых телах меньший размер и более высокий заряд помогают преодолеть более высокую энергию ионизации за счет увеличения энергии решетки.
Из-за большей сольватации жидкости имеют более высокую энергию гидратации.

Таким образом, все щелочноземельные элементы во второй группе являются двухвалентными электроположительными металлами с установленной степенью окисления 2. Крошечному атому бериллия потребуется наибольшая энергия ионизации, чтобы удалить валентный электрон.
Валентный электрон защищен внутренними электронами по мере увеличения размера атома, что облегчает его удаление с меньшими затратами энергии. В результате с увеличением атомного номера или размера энергия ионизации уменьшается.
Реакционная способность щелочноземельных металлов
Энергия ионизации обратно пропорциональна восстановительной способности. Предполагается, что при переходе от бериллия к барию восстановительная способность увеличивается по мере уменьшения энергии ионизации в колонке.
При переходе от бериллия к барию восстановительный потенциал снижается, что свидетельствует о повышении восстановительной способности. Из-за более высокой энергии ионизации щелочноземельные металлы являются более слабыми восстановителями, чем щелочные металлы.
Цвет пламени
Энергия, необходимая для электронного перехода между доступными энергетическими уровнями в щелочноземельных металлах, находится в видимом спектре. В результате все металлы, кроме бериллия и магния, приобретают в пламени отчетливую окраску, которая отражает спектр их излучения или поглощения и может быть использована для их идентификации при нагревании.
Точки плавления и кипения
Точки плавления и кипения щелочноземельных металлов выше, чем у щелочных металлов из-за их меньшего размера и сильной металлической связи в плотноупакованной системе. За исключением магния, температуры плавления и кипения щелочноземельных металлов уменьшаются в порядке от бериллия к барию.
Физическое и химическое поведение щелочноземельных металлов
В этом подразделе обсуждаются основные характеристики соединений щелочноземельных металлов, а также их общие характеристики.
Гидриды
Бериллий не реагирует напрямую с водородом.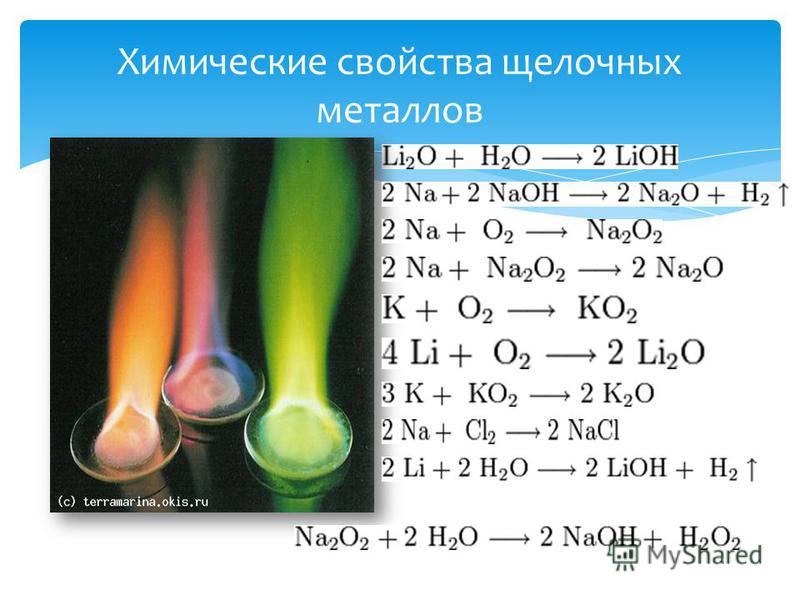 Замена хлорида бериллия алюмогидридом лития дает гидрид бериллия.
Замена хлорида бериллия алюмогидридом лития дает гидрид бериллия.
2BeCl2 + LiAlh5 → 2Beh3 + LiCl + AlCl3
Бериллий и магний образуют ковалентные гидриды, в которых два атома металла связаны с каждым водородом. «Банановая связь» — это тип молекулы, в которой три центра имеют всего два общих электрона.
Гидриды металлов образуются при взаимодействии кальция, стронция и бария с водородом. Ионы гидридов генерируются гидридами металлов.
M + h3 → 2Mh3 → M+ + 2 H-
Водород образуется, когда гидриды бурно реагируют с водой. Водород производится с использованием гидрида кальция под названием «Гидролит».
Cah3 + 2h3O → Ca(OH)2 + h3
Реакция щелочноземельных металлов с водой
Также при более высоких температурах бериллий не реагирует с водой. Магний только образует гидроксиды и выделяет водород при взаимодействии с горячей водой. Магний получает защитный слой своего оксида, который защищает его от дальнейшего воздействия молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Карбиды
За исключением бериллия, щелочноземельные металлы и их оксиды реагируют с углеродом с образованием карбидов. Карбиды используются в качестве источника газообразного ацетилена, потому что они реагируют с водой, образуя его.
Оксиды
Бериллий реагирует с кислородом только при температуре выше 600°C. Магний и стронций образуют оксиды при воздействии кислорода, а барий образует пероксиды.
Ковалентные оксиды BeO и MgO в большей степени, чем ионные оксиды. Амфотерный оксид бериллия, слабоосновный оксид магния и основной оксид кальция, в то время как другие оксиды являются основными.
Гидроксиды
Гидроксиды образуются при взаимодействии оксидов с водой. От бериллия к барию меняется основной характер и термическая устойчивость гидроксидов.
Карбонаты
Карбонаты образуются при взаимодействии гидроксидов с диоксидом углерода.
M(OH)2 + CO2 → MCO3+ h3O
Бикарбонаты растворимы в воде и встречаются только в растворе. В воде карбонаты устойчивы и нерастворимы. Растворимость карбонатов уменьшается от Be к Ba. Карбонаты разлагаются в бикарбонаты в присутствии углекислого газа. От Be к Ba ионный характер и термическая устойчивость карбонатов возрастают.
Сульфат
Сульфат бериллия, в отличие от сульфатов щелочных металлов, растворим в воде. Энергия гидратации сульфата бериллия увеличивается по мере уменьшения его размера и плотности заряда, что приводит к увеличению растворимости. Растворимость других сульфатов уменьшается от BeSO4 до BaSO4 по мере увеличения энергии решетки и уменьшения энергии гидратации (из-за увеличения размера).
Нитраты
Нитраты получают реакцией азотной кислоты с соответствующими оксидами, гидроксидами и карбонатами. Нитраты растворимы в воде. Нитрат бериллия при нагревании превращается в нитрит, в то время как другие нитраты превращаются в оксиды, выделяя коричневые пары диоксида азота.
2M(NO3)2 → 2MO + 4 NO2 + O2
Галогениды
Оба галогена реагируют с щелочноземельными металлами от кальция до бария с образованием сильных ионных галогенидов с определенной кристаллической структурой. От фтора к йоду реакционная способность снижается. Из-за сильной поляризации небольшого ковалентного иона на электронном облаке аниона галогена, как следует из закона Фаяна, галогениды бериллия имеют более ковалентную связь.
Галогениды бериллия существуют в виде отдельных молекул в газовой фазе и образуют цепочки Be-X в твердой фазе.
Фториды нерастворимы в воде. Растворимость других галогенидов уменьшается по мере увеличения размера ионов, например, от Mg2+ до Ba2+. В твердом состоянии галогениды гигроскопичны и содержат кристаллизационную воду (CaCl2.6h3O). Дегидратирующие агенты включают конденсированные галогениды.
Реакция щелочноземельных металлов с жидким аммиаком
Щелочноземельные металлы, включая щелочные металлы, образуют катионы и электроны, сольватированные аммиаком. Решение является восстановительным, электропроводным и парамагнитным. Видимая область поглощает сольватированные электроны, окрашивая раствор в синий цвет. Бронза – цвет сконденсированного раствора. Он разлагается на амид, аммиак и водород после длительного периода времени.
Решение является восстановительным, электропроводным и парамагнитным. Видимая область поглощает сольватированные электроны, окрашивая раствор в синий цвет. Бронза – цвет сконденсированного раствора. Он разлагается на амид, аммиак и водород после длительного периода времени.
Комплекс щелочноземельных металлов
Щелочноземельные металлы представляют собой комплексы меньшего размера. Бериллий связывается с моно-, ди- и тетрадентатными лигандами с образованием различных комплексов.
Применение щелочноземельного металла
Бериллий в основном используется в военных целях, хотя он также имеет и другие применения. Бериллий является легирующей примесью p-типа в некоторых полупроводниках, используемых в электронике, а оксид бериллия является высокопрочным электрическим изолятором и проводником тепла. Бериллий также используется в механике, когда требуются жесткость, легкий вес и стабильность размеров в широком диапазоне температур из-за его легкости и других свойств.

Магний имеет широкий спектр применения. У него есть преимущества перед другими материалами, такими как алюминий, но из-за горючести магния он больше не используется широко. Магний часто сплавляют с алюминием или цинком для создания продуктов с лучшими свойствами, чем чистые металлы. Магний используется в различных промышленных процессах, включая производство железа и стали, а также производство титана.
Кальций имеет широкий спектр применения. Его использование в качестве восстановителя при извлечении других металлов из руды, например урана, является одним из многих его применений. Он также используется для раскисления сплавов и используется в производстве многих металлических сплавов, в том числе алюминиевых и медных сплавов. Кальций также используется в производстве сыра, строительных растворов и цемента.
Стронций и барий используются реже, чем более легкие щелочноземельные металлы, но они все же полезны.
 Чистый стронций используется при изучении активации нейротрансмиттеров в нейронах, а карбонат стронция часто используется в производстве красных фейерверков. Радиоактивный стронций-90 используется в РИТЭГах, использующих теплоту его распада. Барий используется в вакуумных трубках для извлечения газов, а сульфат бария используется в различных отраслях промышленности, включая нефтяную промышленность.
Чистый стронций используется при изучении активации нейротрансмиттеров в нейронах, а карбонат стронция часто используется в производстве красных фейерверков. Радиоактивный стронций-90 используется в РИТЭГах, использующих теплоту его распада. Барий используется в вакуумных трубках для извлечения газов, а сульфат бария используется в различных отраслях промышленности, включая нефтяную промышленность.
Знаете ли вы?
Из-за своего небольшого размера, самой высокой силы ионизации, высокой электроположительной природы и лучшей поляризующей природы бериллий имеет более ковалентную природу. Свойства бериллия отличают его от других щелочноземельных металлов.
Среди щелочноземельных металлов это самый твердый.
За исключением очень высоких температур, не вступает в реакцию с водой.
Бериллий имеет самые высокие температуры плавления и кипения.


 Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2)
Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2) Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются
Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются ) → 4Ca(NO3)2 + N2O + 5H2O
) → 4Ca(NO3)2 + N2O + 5H2O решетки, мкДж\кмоль
решетки, мкДж\кмоль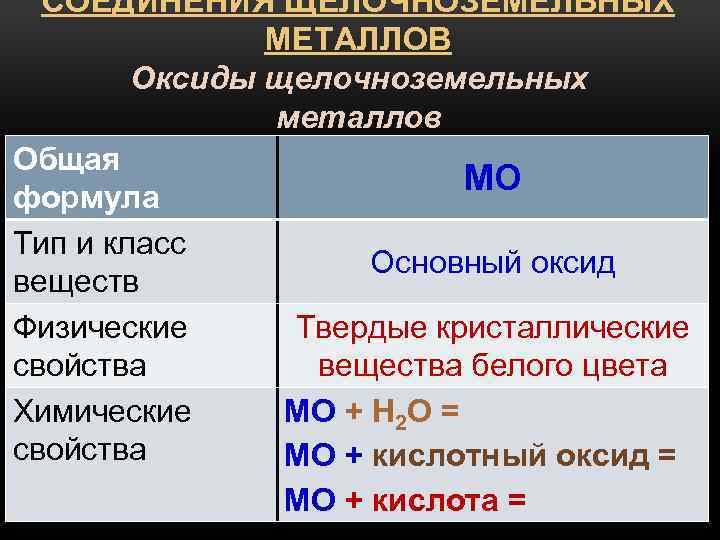 К)
К)


 Чистый стронций используется при изучении активации нейротрансмиттеров в нейронах, а карбонат стронция часто используется в производстве красных фейерверков. Радиоактивный стронций-90 используется в РИТЭГах, использующих теплоту его распада. Барий используется в вакуумных трубках для извлечения газов, а сульфат бария используется в различных отраслях промышленности, включая нефтяную промышленность.
Чистый стронций используется при изучении активации нейротрансмиттеров в нейронах, а карбонат стронция часто используется в производстве красных фейерверков. Радиоактивный стронций-90 используется в РИТЭГах, использующих теплоту его распада. Барий используется в вакуумных трубках для извлечения газов, а сульфат бария используется в различных отраслях промышленности, включая нефтяную промышленность.