Характерные химические свойства Be, Mg и щелочноземельных металлов » HimEge.ru
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».Общая характеристика элементов II а группы
•Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
• Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
• Сильные восстановители
•Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
• К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
• Бериллий по большинству свойств ближе к алюминию
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H2O –t°→ Mg(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl2 → BeCl2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N2 → Mg3N2 (нитриды)
Ca + H2 → CaH2 (гидриды)
Ca + 2C → CaC2 (карбиды)
3Ba + 2P → Ba3P2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(разб.) → MgSO4 + H2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО2-2. Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s22s22p63s2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е—.
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца. Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO
Введение ионов Mg2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO
Все соединения бария, кроме BaSO4, ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т1/2 = 1617 лет). Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний. Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов IIА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
Be+H2O+2NaOH=Na2[Be(OH)4]+H2.
Магний активно реагирует с азотом:
3 Mg + N2 = Mg3N2 .
В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (200С) | Растворимость, г/л | |
| Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 | 8∙10-6 5∙10-4 2∙10-2 7∙10-2 2∙10-1 | 3,4∙10-4 2,9∙10-2 1,5 8,5 34,2 |
Традиционная техническая проблема – жесткость воды, связанная с наличием в ней ионов Mg2+ и Ca2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
| Li Na K Rb Cs Be Mg Ca Sr Ba | 10-4 0,08 0,23 10-5 10-4 10-7 0,027 1,4 10-3 10-5 |
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов). Кроме построения костей и зубов на основе гидроксилапатита Ca10(PO4)6(OH)2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция.
Бериллий, магний, щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы.
Сегодня мы познакомимся с элементами II A группы. К ним относятся бериллий, магний, и щелочноземельные элементы: кальций, стронций, барий, радий.
Радий является радиоактивным элементом, в природе его содержание незначительно. Все изотопы радия радиоактивны, а cамый долгоживущий из них – радий 226, имеет период полураспада, равный 1620 лет.
Так
как это элементы II A группы, то на
внешнем энергетическом уровне у них два электрона. Эти электроны
сильно отдалены от ядра, поэтому их легко оторвать, они являются сильными
восстановителями. Во всех соединениях они проявляют степень окисления,
равную +2.
Во II A группе сверху вниз увеличивается радиус атомов, а, следовательно, металлические и восстановительные свойства.
.
Распространённость магния и кальция в земной коре составляет около 1,5%. Содержание бериллия, стронция и бария не превышает 0,01%, а радиоактивный радий является продуктом распада урана и содержится в земной коре в очень малых количествах.
Вследствие высокой химической активности все элементы этой группы в природных условиях встречаются только в виде соединений.
Разберём
физические свойства элементов (II) A
группы. Простые вещества, образованные элементами этой группы, представляют
собой типичные металлы с характерным металлическим блеском. Они
представляют собой серебристо-белые металлы, а стронций имеет
золотистый оттенок, хорошо проводят теплоту и электрический ток,
имеют довольно высокие температуры плавления.
Стронций значительно твёрже бария, а барий по мягкости напоминает свинец. Из приведённой таблицы видно, что плотность металлов увеличивается сверху вниз, температуры кипения и плавления, как правило, понижаются.
Температуры плавления этих металлов гораздо выше, чем у щелочных металлов, у бериллия она превышает 1000 градусов по Цельсию, и он относится к тугоплавким металлам.
Плотность всех металлов этой группы не превышает 5 г/см3, и поэтому они относятся к лёгким.
Получают магний и кальций электролизом расплавленных хлоридов.
Что касается металлов II A группы, то они также как и щелочные металлы обладают высокой химической активностью.
При
комнатной температуре к кислороду устойчивы только бериллий и
магний, благодаря оксидной плёнке на поверхности. При высокой температуре
окисление бериллия и магния кислородом протекает очень интенсивно.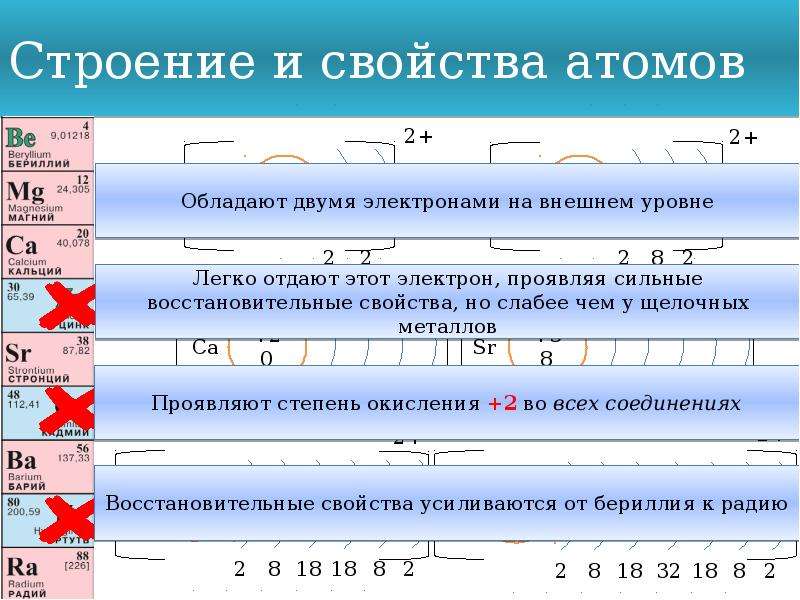 Щелочноземельные
металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят
под слоем керосина или в запаянных сосудах, как и щелочные металлы.
Щелочноземельные
металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят
под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе эти металлы энергично сгорают с образованием оксидов. В реакции кальция с кислородом образуется оксид кальция, кальций повышает свою степень окисления до +2, а кислород понижает степень окисления до -2.
В результате сжигания магния выделяется большое количество света и теплоты, раньше эту реакцию применяли при фотографировании объектов в тёмных помещениях.
В рекцию с азотом при комнатной температуре втупает только радий, остальные металлы реагируют с азотом при нагревании с образованием нитридов. Так, в реакции бария с азотом образуется нитрид бария, барий повышает свою степень окисления до +2, а азот понижает до -3.
В
реакцию взаимодействия с галогенами элементы II A
группы вступают только при нагревании, при этом образуются
соответствующие галогениды. В реакции кальция с хлором образуется хлорид
кальция, в реакции бария с бромом образуется бромид бария. Металлы повышают
свою степень окисления до +2, а галогены понижают свою степень окисления до -1.
В реакции кальция с хлором образуется хлорид
кальция, в реакции бария с бромом образуется бромид бария. Металлы повышают
свою степень окисления до +2, а галогены понижают свою степень окисления до -1.
В реакцию с серой металлы вступают тоже только при нагревании с образованием сульфидов. В реакции магния с серой образуется сульфид магния, магний повышает свою степень окисления до +2, а сера понижает степень окисления до -2.
Элементы II A группы реагируют с водородом только при высокой температуре, при этом образуются гидриды. В реакции кальция с водородом образуется гидрид кальция, где степень окисления водорода -1, а у кальция – +2.
С
водой же практически не взаимодействует только
бериллий, из-за защитной плёнки на его поверхности, магний реагирует с
водой медленно, остальные металлы бурно реагируют с водой при обычных условиях.
В реакции кальция с водой образуется гидроксид кальция и выделяется водород, в
реакции бария с водой образуется гидроксид бария и водород, в реакции стронция
с водой образуется гидроксид стронция и водород.
Все металлы II A группы легко растворяются в растворах кислот (серной, хлороводородной, фосфорной и т.д.) с образованием соответствующих солей и водорода. Магний практически нерастворим в плавиковой кислоте из-за малой растворимости его фторида, а бериллий реагирует с азотной кислотой только при нагревании. Остальные металлы активно взаимодействуют с кислотами. В результате взаимодействия кальция с серной кислотой образуется сульфат кальция и водород, в результате взаимодействия магния с соляной кислотой образуется хлорид магния и водород.
Бериллий, как вы помните, является амфотэрным элементом, поэтому он легко растворяется в водных растворах щелочей. В реакции бериллия с раствором гидроксида натрия образуется комплексная соль –тэтрагидроксобериллат натрия.
Подобно
алюминию, магний и кальций способны восстанавливать редкие металлы
– ниобий, тантал, молибдэн, вольфрам, титан – из их оксидов. Такие
способы получения металлов называют магниетермией и кальциетермией.
Магний чаще используют для получения титана, а кальций – для получения ванадия.
Такие
способы получения металлов называют магниетермией и кальциетермией.
Магний чаще используют для получения титана, а кальций – для получения ванадия.
Кроме этого, магний можно использовать для вытеснения менее активного металла из раствора соли. Например, в реакции магния с раствором сульфата железа два магний вытесняет железо, как менее активный металл.
В природе щелочноземельные металлы находятся только в виде соединений из-за своей химической активности.
Рассмотрим их оксиды. Их оксиды имеют состав МеО и гидроксиды состава Ме(ОН)2. Основный характер оксидов и гидроксидов увеличивается в этой группе сверху вниз. Т. е. изменяется от амфотэрных, как у оксида бериллия и гидроксида бериллия до основных, как у оксида радия и гидроксида радия.
Амфотерные
BeO и Be(OH)2
→ основные RaO
и Ra(OH)2.
Гидроксиды бериллия и магния нерастворимы в воде, а гидроксиды щелочноземельных металлов и радия являются щелочами.
Оксиды элементов II A представляю собой твёрдые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Оксид магния почти не вступает в реакцию с водой, а оксиды щелочноземельных металлов и радия реагируют с водой, образуя гидроксиды. Например, в результате взаимодействия оксида бария с водой образуется гидроксид бария, а в реакции оксида кальция с водой – гидроксид кальция.
Оксиды щелочноземельных металлов и магния получают обжигом карбонатов: в результате разложения карбоната кальция образуется оксид кальция и оксид углерода четыре, при разложении карбоната магния образуется оксид магния и также оксид углерода (IV).
В
технике оксид кальция называют негашёной известью, а оксид магния –
жжёной магнэзией (её применяют для изготовления огнеупорных тиглей, труб,
кирпичей, он входит в состав зубных порошков). Оба этих оксида используют в
производстве строительных материалов. Они представляют собой твёрдые
тугоплавкие вещества белого цвета.
Оба этих оксида используют в
производстве строительных материалов. Они представляют собой твёрдые
тугоплавкие вещества белого цвета.
Оксиды элементов II A группы легко растворяются в кислотах, а оксид и бериллия, и в растворах щелочей. Например, в реакции оксида магния с соляной кислотой образуется хлорид магния и вода, а оксид бериллия реагирует и с соляной кислотой с образованием соли – хлорида бериллия, и с раствором гидроксида натрия с образованием комплексной соли – тэтрагидроксобериллата натрия.
Гидроксиды
щелочноземельных металлов являются щелочами. Их растворимость
воде увеличивается в ряду от гидроксида кальция до гидроксида бария. Эти
гидроксиды получают взаимодействием соответствующего оксида с водой. Гидроксид кальция
получают по реакции оксида кальция с водой, гидроксид стронция по реакции
оксида стронция с водой, а гидроксид бария по реакции оксида бария с водой.
Реакция взаимодействия оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся при этом гидроксид кальция – гашёной известью. Тестообразную смесь гашёной извести с песком и водой называют известковым раствором и используют для скрепления кирпичей при кладке стен.
Поглощая из воздуха углекислый газ, гидроксид кальция превращается в карбонат. Происходит постепенное затвердевание (схватывание) смеси.
Прозрачный раствор гидроксида кальция называют известковой водой, а белую взвесь его в воде – известковым молоком.
Гашёную известь используют в строительстве, а известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Проведём
небольшой эксперимент. Получим гидроксид кальция и исследуем его свойства. Для
этого поместим в стаканчик немного оксида кальция, а затем добавим воду и размешаем
содержимое стаканчика. У нас получился раствор гидроксида кальция.
У нас получился раствор гидроксида кальция.
Дадим отстояться немного этому мутному раствору, а потом отфильтруем содержимое стаканчика. У нас получился раствор, который гораздо прозрачнее предыдущего.
Разделим его на две пробирки. В первую пробирку будим продувать выдыхаемый воздух, который содержит углекислый газ. В результате у нас раствор мутнеет. Раствор стал мутный, вследствие образования нерастворимой соли – карбоната кальция.
А к раствору во второй пробирке добавим несколько капель фенолфталеина. Раствор окрашивается слегка в малиновый цвет, однако, окраска не такая насыщенная, как в растворах щелочей. Следовательно, раствор гидроксида кальция является малорастворимым основанием.
Гидроксиды
элементов II A группы
реагируют с кислотами, а гидроксид бериллия – ещё и с основаниями.
Гидроксид бария в реакции с соляной кислотой образует соль – хлорид бария и
воду. А гидроксид бериллия реагирует с кислотами и с основаниями. В реакции с
серной кислотой образуется соль – сульфат бериллия и вода, а в результате
реакции гидроксида бериллия с раствором гидроксида натрия образуется
комплексная соль – тэтрагидроксобериллат натрия.
А гидроксид бериллия реагирует с кислотами и с основаниями. В реакции с
серной кислотой образуется соль – сульфат бериллия и вода, а в результате
реакции гидроксида бериллия с раствором гидроксида натрия образуется
комплексная соль – тэтрагидроксобериллат натрия.
Таким образом, соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами.
Соли
их представляют собой белые кристаллические вещества, большинство из них
растворимы в воде. Из сульфатов хорошо растворимы в воде только сульфаты
бериллия и магния. Растворимость сульфатов элементов главной подгруппы II
группы уменьшается от сульфата бериллия к сульфату бария. Карбонаты этих
металлов малорастворимы или нерастворимы в воде. Сульфиды щелочноземельных
металлов, после предварительного освещения начинают светиться различными
цветами. Они входят в состав специальных светящихся красок, которые
называют фосфорами. Их используют для изготовления светящихся дорожных
знаков, циферблатов часов и других изделий.
Их используют для изготовления светящихся дорожных
знаков, циферблатов часов и других изделий.
Рассмотрим наиболее значимые соли.
CaCO3 – карбонат кальция – одно из самых распространённых соединений. Это соединение содержат такие минералы, как мел, мрамор, известняк.
Мрамор – основной материал для скульпторов, архитекторов. Из этого материала изготовлены стены индийского мавзолея Тадж-Махала, облицованы многие станции московского метро, созданы многие скульптуры, такие как скульптура царя Иоанна Грозного.
Без известняка не обходится ни одно строительство. Он и сам является прекрасным строительным материалом, кроме этого он используется как сырьё для получения других материалов: цемента, гашёной и негашёной извести, стекла и т.д.
Природный
мел
представляет собой остатки раковин древних животных.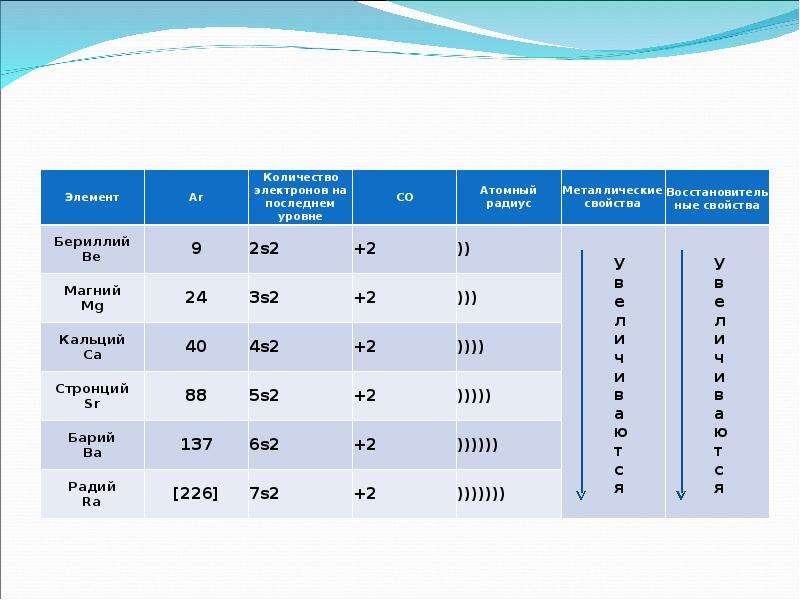 Мел используют при
производстве школьных мелков, зубной пасты, бумаги, резины и побелки.
Мел используют при
производстве школьных мелков, зубной пасты, бумаги, резины и побелки.
Карбонат магния – MgCO3 – необходим в производстве стекла, цемента, кирпича, в металлургии.
Сульфат кальция – CaSO4 – встречается в природе в виде минерала гипса. Его используют в строительстве, в медицине для наложения фиксирующих гипсовых поязок, получения слепков, но здесь используют полуводный гипс – алебастр, он при взаимодействии с водой образует двуводный гипс.
Кристаллогидрат сульфата магния, горькая, или английская соль используется в медицине в качестве слабительного средства. Содержится в морской воде и придаёт ей горький вкус.
Сульфат
бария – BaSO4–
нерастворимая в воде соль и способная задерживать рентгеновкие лучи, поэтому её
используют в рентгенодиагностике («баритовая каша») для
диагностики заболеваний желудочно-кишечного тракта.
Фосфат кальция – Ca3(PO4)2– входит в сотав фофоритов и апатитов, в состав костей и зубов. В организме человека содержится около одного килограмма кальция в виде фосфата кальция.
Вообще, кальций играет большую роль для всех живых организмов, потому что из него построен костный скелет. А также играеь существенную роль в процессах жизнедеятельности: ионы кальция необходимы для работы сердца, участвуют в процессах свёртывания крови.
На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях, который необходим и для работы нервной системы.
Человек должен получать в день 1,5 г кальция. Наибольшее количество кальция содержится в сыре, твороге, петрушке, салате.
Ещё
одним важным биоэлементом является магний, который участвует в обмене
веществ. Он содержится в печени, костях, крови, нерной ткани и мозге. В
организме человека содержится около 40 г магния. Магний входит в сотав хлорофилла,
поэтому участвует в процессе фотосинтэза.
Он содержится в печени, костях, крови, нерной ткани и мозге. В
организме человека содержится около 40 г магния. Магний входит в сотав хлорофилла,
поэтому участвует в процессе фотосинтэза.
Соли щелочноземельных металлов окрашивают пламя в яркие цвета, поэтому их используют как добавки в фейерверки. Кальций окрашивает пламя в кирпично-красный цвет, стронций – в малиновый, барий – в светло-жёлтый.
Магний был получен в 1808 г. Дэви из белой магнэзии – минерала, который нашли вблизи греческого города Магнэзия.
Но полученный таким образом металл был загрязнён примесями, а чистый магний был получен в 1829 г. Бюсси.
Кальций впервые был получен в 1808 г. Дэви. Название было дано от латинского слова кальс, что означает «известь, мягкий камень».
Таким
образом, элементы II A
группы имеют на внешнем энергетическом уровне два электрона, они являются
восстановителями, в соединениях они проявляют степень окисления, равную +2, в
группе сверху вниз увеличиваются радиусы атомов, а следовательно
восстановительные и металлические свойства. Они обладают высокой химической
активностью, поэтому встречаются в природе в виде соединений. Для них
характерны такие физические свойства, как металличексий блеск, тепло -и
электропроводность, они лёгкие, температуры плавления у них выше, чем у щелочых
металлов. Щелочноземельные металлы реагируют с неметаллами, водой, кислотами.
Наиболее распространённые их соединения – оксиды, гидроксиды и соли. Оксид
бериллия и его гидроксид обладает амфотэрными свойствами, оксид и гидроксид
магния – слабыми основными свойствами, у остальных оксидов и гидроксидов ярко
выражены основные свойства. Соли этих элементов играют большое значение, такие
как карбонат кальция, сульфат магния, фосфат кальция, сульфат бария и другие.
Они обладают высокой химической
активностью, поэтому встречаются в природе в виде соединений. Для них
характерны такие физические свойства, как металличексий блеск, тепло -и
электропроводность, они лёгкие, температуры плавления у них выше, чем у щелочых
металлов. Щелочноземельные металлы реагируют с неметаллами, водой, кислотами.
Наиболее распространённые их соединения – оксиды, гидроксиды и соли. Оксид
бериллия и его гидроксид обладает амфотэрными свойствами, оксид и гидроксид
магния – слабыми основными свойствами, у остальных оксидов и гидроксидов ярко
выражены основные свойства. Соли этих элементов играют большое значение, такие
как карбонат кальция, сульфат магния, фосфат кальция, сульфат бария и другие.
Тема 14. Бериллий, магний и щёлочноземельные металлы.
Часть I
1. Заполните таблицу «Изменение свойств щёлочноземельных металлов».
2. Схема химической связи для металлов IIA группы (М):
3. Общие химические свойства (для щёлочноземельных металлов — М).
Рассмотрим ОВР.
4. BeO и Be(OH)2 относят к амфотерным соединениям. Запишите уравнения реакций, подтверждающих это, в молекулярной, полной и сокращённой ионной формах.
5. Подобно щелочным, щёлочноземельные металлы образуют гидриды с общей формулой МН2:
— это соединение с ионной кристаллической решёткой;
— образованы за счёт ионной химической связи, схема которой:
— по физическим свойствам эти вещества твёрдые, белые, растворимые в воде.
— взаимодействуют с водой (рассмотрите ОВР).
Часть II
1. Заполните таблицу «Применение кальция и магния».
2. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Первую и пятую реакции рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД. Для перехода Ca→Ca(NO3)2 предложите два варианта.
3. Проанализируйте рисунок «Взаимодействие щёлочноземельных металлов с водой». Подпишите химические формулы металлов. Объясните причину различной скорости реакций.
Скорость реакции увеличивается с активностью металла.
4. Укажите, в какой из пробирок отображено взаимодействие лития с водой, а в какой – кальция с водой.
Ответ поясните: Литий легче воды, всплывает и окисляется на поверхности.
5. Какой объём водорода образуется при взаимодействии с 0,5 л воды 20 г кальция, содержащего 5% примесей? Рассчитайте массовую долю щёлочи в полученном растворе.
6. Придумайте и решите задачу, аналогичную предыдущей, чтобы в условии фигурировал гидрид кальция.
Гидрид кальция массой 42 г вступил в реакцию с водой, массой 200 г. Найти w%(Ca(OH)2) и V(h3), если w%(прим. в Ca h3)=10%.
7. Подготовьте небольшое сообщение об одном из щёлочноземельных металлов, используя Интернет и другие источники информации.
Составьте план или запишите тезисы сообщения в особой тетради.Бериллий.
Открыт в 1798 г. французским химиком Луи Никола Вокленом, который назвал его глицинием. Современное название элемент получил по предложению химиков немца Клапрота и шведа Экеберга. В свободном виде бериллий был выделен в 1828 году французским химиком Бюсси и независимо от него немецким химиком Велером.
Известно более 30 собственно бериллиевых минералов, но промышленное значение имеет в основном берилл.
Разновидности берилла считаются драгоценными камнями: аквамарин, изумруд, гелиодор. Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. Один из самых твердых металлов в чистом виде (уступает только осмию, вольфраму и урану). На воздухе покрывается стойкой оксидной пленкой. В бериллии очень хорошо распространяются звуковые волны — 12600 м/с.
Применяется в различных отраслях промышленности и народного хозяйства:
• Рентгенотехника
• Ядерная энергетика
• Лазерные материалы
• Аэрокосмическая техника
• Ракетное топливо
• Огнеупорные материалы
Бериллий ядовит: летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичные. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха, содержащего бериллий, приводит к тяжелому заболеванию органов дыхания — бериллиозу.
Бериллий, магний и щёлочноземельные металлы
15. Бериллий, магний и щёлочноземельные металлы
В главную подгруппу II группы входят бериллий (Be), магний (Mg), кальций (Са), стронций (Sr), барий (Ва) и радий (Ra). Кальций, стронций, барий и радий относятся к щёлочноземельным металлам. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойствАтомы элементов II группы имеют на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.
В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства возрастают.
Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства возрастают.
Бериллий, магний и щелочноземельные металлы — это простые вещества. Лёгкие серебристо-белые металлы, исключение составляет только стронций, который имеет золотистый оттенок.
Например, кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Поскольку у кальция на энергетическом уровне находится 2 электрона, то его степень окисления во всех соединениях всегда равна +2. На воздухе кальций окисляется, поэтому его хранят в закрытых сосудах, обычно в керосине.
Химические свойства данной группы металлов рассмотрим на примере кальция.
С биологической точки зрения, кальций играет немаловажную роль для растений, животных и человека. В нашем организме он входит в состав костей. Кальций придает костям твердость. Например, при обычных условиях кальций реагирует с
Например, при обычных условиях кальций реагирует с
галогенами, а с серой, азотом и углеродом – при нагревании. При взаимодействии кальция с хлором образуется хлорид кальция.
Ca + CI2 =CaCI2 (кальций плюс хлор два равно кальций хлор два)
При взаимодействии кальция с серой образуется сульфид кальция.
Сa + S = CaS
(кальций плюс сера равно кальций эс)
При взаимодействии кальция с азотом образуется нитрид кальция.
(три кальций плюс эн два стрелочка кальций три эн два)
Данные реакции происходят при нагревании.
Кальций (Ca) являясь активным металлом вытесняет водород из воды:
Сa + 2Н2О = Ca(ОН)2+Н2
(кальций плюс два аш два о стрелочка кальций о аш дважды плюс аш два стрелочка вверх)
При этом не все металлы главной подгруппы II группы Периодической системы одинаково реагируют с водой: бериллий практически не взаимодействует с водой, т.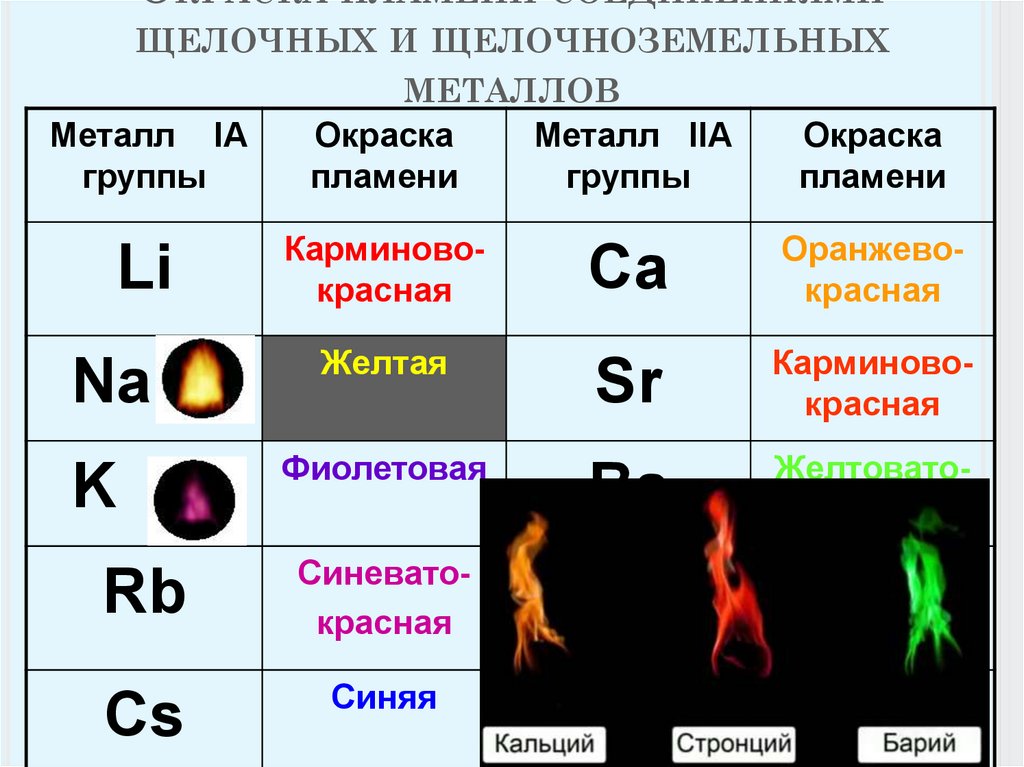 к. взаимодействию препятствует защитная пленка на его поверхности, реакция магния с водой протекает довольно медленно, остальные же металлы взаимодействуют с водой аналогично кальцию.
к. взаимодействию препятствует защитная пленка на его поверхности, реакция магния с водой протекает довольно медленно, остальные же металлы взаимодействуют с водой аналогично кальцию.
При нагревании на воздухе кальций сгорает, образуя оксид кальция:
2Сa + О2 = 2CaО
(два кальций плюс о два равно два кальций о)
При взаимодействии кальций с углеродом образует карбид кальция СaC2
Сa + 2С = CaС2
(кальций плюс два це стрелочка кальций це два)
Вследствие своей высокой химической активности в природе щёлочноземельные металлы находятся только в форме соединений.
Оксиды данных металлов твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства. Исключение составляет оксид бериллия, который имеет амфотерный характер.
Рассмотрим оксиды на примере кальция.
Оксид кальция (техническое название: негашеная известь, жженая известь) – это порошок белого цвета.
Оксид кальция энергично взаимодействует с водой с образованием гидроксида кальция:
CaO + H2O = Ca(OH)2 +Q
(кальций о плюс аш два о равно кальций о аш дважды плюс ку)
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашение извести, а образующийся Ca(OH)2 — гашёной известью.
Гашеная известь – твердое вещество белого цвета, растворимое в воде. Раствор гашеной извести в воде называется известковой водой. Раствор обладает щелочными свойствами.
Рассмотрим щелочные свойства на примере:
Ca(OH)2 + CO2 → CaCO3↓ + h3O
(кальций о аш дважды плюс це о два стрелочка кальций це о три стрелочка вниз плюс аш два о)
При пропускании через известковую воду оксида углерода (IV) раствор мутнеет
(кальций це о три плюс це о два плюс аш два о две стрелочки направленны противоположно друг другу кальций аш це о три дважды)
При дальнейшем пропускании замечаем, что муть исчезает.
Соли бериллия, магния и щёлочноземельных металлов получают при взаимодействии их с кислотами.
К солям кальция относится карбонат кальция. Карбонат кальция имеет следующую формулу — CaCO3(кальций це о три)
Он содержится в известняке, меле и мраморе. Мрамор широко применяется в скульптуре и архитектуре, без известняка не обходится ни одно строительство, т.к. он сам является прекрасным строительным камнем и используется для получения таких материалов как стекло, цемент, гашеная и негашеная известь. В природе мел представляет собой остатки раковин древних животных, его можно увидеть в школе (школьные мелки), его используют в зубной пасте, при производстве бумаги, при побелке.
Сульфат кальция встречается в природе в виде минерала гипса — CaSO4*2H2О (кальций эс о четыре умножить два аш два о).
Обжигом гипса при 150-180С0 получают белый порошок – жженый гипс или алебастр
CaSO4*0,5h3О(кальций эс о четыре умножить ноль целых пять десятых аш два о).
Если алебастр смешать с водой, то он быстро затвердевает, снова превращается в гипс.
Например,
CaSO4*0,5h3О +1,5 h3О = CaSO4* 2h3О
(кальций эс о четыре умножить ноль целых пять десятых аш два о плюс одна целая пять десятых аш два о равно кальций эс о четыре умножить два аш два о)
Сульфат кальция широко используют в строительстве для изготовления скульптур и скульптурных элементов, для облицовочных и отделочных работ, в медицине для изготовления гипсовых повязок.
Щелочноземельные металлы
Щелочноземельные металлы.
К щелочноземельным металлам относятся бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
Щелочноземельные металлы
Строение атомов щелочноземельных металлов
Физические свойства щелочноземельных металлов
Химические свойства щелочноземельных металлов
Щелочноземельные металлы:
Щелочноземельные металлы – это элементы 2-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации – элементы главной подгруппы II группы):
И. Менделеева (по устаревшей классификации – элементы главной подгруппы II группы):
– бериллий Be,
– магний Mg,
– кальций Ca,
– стронций Sr,
– барий Ba,
– радий Ra.
Строение атомов щелочноземельных металлов:
Особенность строения атомов щелочноземельных металлов заключается в том, что они содержат два электрона на внешнем энергетическом уровне: их электронная конфигурация ns2. Поэтому щелочноземельные металлы проявляют валентность II и степень окисления +2.
Щелочноземельные металлы относятся к элементам s-семейства.
Так, электронная конфигурация атома бериллия 1s2 2s2. Атом бериллия состоит из положительно заряженного ядра (+4), вокруг которого по двум оболочкам движутся 4 электрона. При этом 2 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку бериллий расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка также представлена s-орбиталью. На внешнем энергетическом уровне атома бериллия – на 2s-орбитали находятся два спаренных электрона. В свою очередь ядро атома бериллия состоит из 4 протонов и 5 нейтронов.
Радиус атома бериллия составляет 112 пм. Потенциал ионизации атома бериллия равен 9,32 эВ (898,8 кДж/моль). Электроотрицательность атома бериллия равна 1,57 (шкала Полинга).
Электронная конфигурация атома магния 1s2 2s2 2p6 3s2. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов.
При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов.
Радиус атома магния составляет 160 пм. Потенциал ионизации атома магния равен 7,64 эВ (737,3 кДж/моль). Электроотрицательность атома магния равна 1,31 (шкала Полинга).
Электронная конфигурация атома кальция 1s2 2s2 2p6 3s2 3p6 4s2. Атом кальция состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 20 электронов. При этом 18 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку кальций расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома кальция – на 4s-орбитали находится два спаренных электрона. В свою очередь ядро атома кальция состоит из 20 протонов и 20 нейтронов.
Поскольку кальций расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома кальция – на 4s-орбитали находится два спаренных электрона. В свою очередь ядро атома кальция состоит из 20 протонов и 20 нейтронов.
Радиус атома кальция составляет 197 пм. Потенциал ионизации атома кальция равен 6,11 эВ (589,4 кДж/моль). Электроотрицательность атома кальция равна 1,00 (шкала Полинга).
Электронная конфигурация атома стронция 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2. Атом стронция состоит из положительно заряженного ядра (+38), вокруг которого по пяти оболочкам движутся 38 электронов. При этом 36 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку стронций расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома стронция на 5s-орбитали находятся два спаренных электрона. В свою очередь ядро атома стронция состоит из 38 протонов и 50 нейтронов.
Поскольку стронций расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома стронция на 5s-орбитали находятся два спаренных электрона. В свою очередь ядро атома стронция состоит из 38 протонов и 50 нейтронов.
Радиус атома стронция составляет 215 пм. Потенциал ионизации атома стронция равен 5,69 эВ (549,0 кДж/моль). Электроотрицательность атома стронция равна 0,95 (шкала Полинга).
Электронная конфигурация атома бария 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2. Атом бария состоит из положительно заряженного ядра (+56), вокруг которого по шести атомным оболочкам движутся 56 электронов. При этом 54 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку барий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона. Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон.
При этом 54 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку барий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона. Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон.
Радиус атома бария составляет 222 пм. Потенциал ионизации атома бария равен 5,21 эВ (502,5 кДж/моль). Электроотрицательность атома бария равна 0,89 (шкала Полинга).
С увеличением порядкового номера у щелочноземельных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Физические свойства щелочноземельных металлов:
Все щёлочноземельные металлы серые или серебристо-белые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение – стронций).
Общими физическими свойствами щелочноземельных металлов являются: их металлический блеск, ковкость, пластичность, высокая тепло- и электропроводность.
Вместе с тем указанные металлы имеют разные значения температуры плавления, кипения, плотности и другие физические свойства.
При этом с увеличением порядкового номера у щелочноземельных металлов каких-либо закономерностей в изменении физических свойств не проявляется.
Химические свойства щелочноземельных металлов:
Все щелочноземельные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами, водородом, оксидами, кислотами, солями и другими соединениями. Поэтому ввиду своей высокой химической активности все щелочноземельные металлы в свободном состоянии в природе не встречаются.
Поэтому ввиду своей высокой химической активности все щелочноземельные металлы в свободном состоянии в природе не встречаются.
В соединениях щелочноземельные металлы проявляют единственную степень окисления +2 (очень редко +1) и валентность II. Они являются сильными восстановителями.
С увеличением порядкового номера у щелочноземельных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности 849
Be | Mq | Ca | Sr | Ba | Ra | |
Плотность г/см | 1,85 | 1,737 | 1,54 | 2,63 | 3,6 | 6 |
Температура плавления | 1287 | 648 | 842 | 768 | 727 | 969 |
Металлы IIA группы | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Главную подгруппу II группы составляют бериллий, магний, кальций, стронций, барий и радий. На внешнем электронном слое у них находится по два легко теряемых s-электрона. Во всех соединениях они проявляют степень окисления +2, их активность возрастает с увеличением атомного номера. Все они (за исключением бериллия, проявляющего амфотерные свойства) – металлы, по свойствам близкие к щелочным, их химические связи с неметаллами носят ионный характер. В свободном состоянии это твердые серебристо-белые вещества.
Общая характеристика элементов II а группы
•Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
• Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
• Сильные восстановители
•Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
• К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
• Бериллий по большинству свойств ближе к алюминию
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H2O –t°→ Mg(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl2 → BeCl2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N2 → Mg3N2 (нитриды)
Ca + H2 → CaH2 (гидриды)
Ca + 2C → CaC2 (карбиды)
3Ba + 2P → Ba3P2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(разб.) → MgSO4 + H2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Группа 2: Химические свойства щелочноземельных металлов
- Последнее обновление
- Сохранить как PDF
Содержит бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba).Включает тенденции атомных и физических свойств, тенденции реакционной способности, характер растворимости в гидроксидах и сульфатах, тенденции термического разложения нитратов и карбонатов, а также некоторые нетипичные свойства бериллия.
- Щелочная земля (группа II) Тенденции
- Группа 2: общие свойства
- Элементы в группе включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) , барий (Ba) и радий (Ra).
- Реакции элементов 2-й группы с кислотами
- На этой странице обсуждаются реакции элементов 2-й группы (бериллий, магний, кальций, стронций и барий) с обычными кислотами.
- Реакции элементов 2 группы с кислородом
- Элементы 2 группы (бериллий, магний, кальций, стронций и барий) реагируют с кислородом. для образования оксидов металлов. В этом модуле выясняется, почему трудно наблюдать четкую картину этой реактивности.
- Реакции элементов 2-й группы с водой
- Реакции элементов 2-й группы протекают быстрее, поскольку энергия, необходимая для образования положительных ионов, падает. В основном это связано с уменьшением энергии ионизации по группе. Это приводит к более низким энергиям активации и, следовательно, более быстрым реакциям.
- Растворимость гидроксидов, сульфатов и карбонатов
- На этой странице обсуждается растворимость гидроксидов, сульфатов и карбонатов элементов группы 2 — бериллия, магния, кальция, стронция и бария — в воде
- Термическая стабильность нитратов и карбонатов
- На этой странице рассматривается влияние тепла на карбонаты и нитраты элементов 2-й группы (бериллий, магний, кальций, стронций и барий).Это объясняет, как термическая стабильность соединений меняется в зависимости от группы.
Щелочноземельные металлы — бериллий, магний, кальций, стронций, барий, радий — элементы, реагируют, белые и в некоторой степени
Второй столбец в периодической таблице , состоящий из химических элементов, в совокупности называется щелочноземельной группой металлов : бериллий, магний , кальций , стронций, барий, и радий. Поскольку внешняя структура электронов и во всех этих элементах похожа, все они имеют несколько схожие химические и физические свойства.Все они блестящие, довольно мягкие, хотя и тверже, чем щелочные металлы, и большинство из них белого или серебристого цвета. Устойчивый рост точек плавления и кипения с увеличением молекулярной массы , замеченный в группе щелочных металлов, менее выражен в щелочноземельных элементах; Например, бериллий имеет самую высокую, а не самую низкую температуру плавления, а другие металлы не имеют единой закономерности. Все щелочноземельные металлы реагируют с водой и с образованием газа водорода и гидроксида металла, хотя и несколько менее энергично, чем щелочные металлы .Металлический магний можно поджечь, и он горит чрезвычайно интенсивным белым светом , поскольку он соединяется с кислородом в воздухе с образованием оксида магния. Стронций, барий и кальций легко вступают в реакцию с кислородом воздуха с образованием своих оксидов.
Щелочноземельные металлы почти всегда образуют ионы с положительным (+2) зарядом и обладают достаточной реакционной способностью как элементы, поэтому они обычно встречаются в природе только в сложной форме, часто в виде карбонатов или сульфатов. Кальций, безусловно, является самым распространенным, за ним следует магний, а затем в гораздо меньших количествах — барий, стронций и бериллий.Радий радиоактивен и довольно редок; то, что существует в земной коре, встречается почти исключительно в месторождениях урана и месторождениях.
Некоторые щелочноземельные металлы светятся характерным цветом при помещении в пламя; кальций излучает оранжевый свет, стронций — очень ярко-красный цвет, а барий — зеленое яблоко. Эти испытания пламенем полезны для идентификации металлов. Соединения стронция часто добавляют в фейерверки для получения наиболее ярких красных оттенков.
Свойства щелочноземельных металлов
Вы любите фейерверки? Тогда вы действительно любите некоторые из щелочноземельных металлов.Некоторые из них при горении становятся яркими красками и являются компонентами фейерверков. Большинство щелочноземельных металлов естественным образом содержится в атмосфере, и их очень много.
Что такое определение щелочноземельных металлов?
Щелочноземельные металлы находятся в периодической таблице элементов группы IIA, второй столбец слева. В этой категории всего шесть металлов, включая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).Радий — единственный щелочноземельный металл, который радиоактивен и не содержит стабильных изотопов. Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один радиоизотоп, который встречается в природе. Когда щелочноземельные металлы смешиваются с растворами, они, скорее всего, образуют раствор с уровнем pH более 7, что делает их щелочными.
Каковы свойства щелочноземельных металлов?
Как и все семейства элементов, щелочноземельные металлы имеют общие черты друг с другом.Они не так реактивны, как щелочные металлы, и очень легко образуют связи. У каждого из металлов есть два электрона на внешней оболочке, и они готовы отдать эти электроны при образовании ионных или ковалентных связей. Они отдают электроны, чтобы получить полноценную внешнюю оболочку. Щелочноземельные металлы относительно мягкие, довольно блестящие, серебристого или белого цвета.
Щелочноземельные металлы реагируют с водой и кислотами с образованием газообразного водорода, они также активно взаимодействуют с кислородом.Испытания на пламя могут быть полезны при идентификации соединений в щелочноземельных металлах. Кальций горит оранжево-красным, стронций горит малиновым, а барий горит зеленым. Эти металлы часто используют для фейерверков.
Каковы виды использования щелочноземельных металлов?
Бериллий занимает 50-е место по содержанию среди химических элементов. Чаще всего он встречается в блестящих драгоценных камнях и драгоценных камнях, таких как берилл, аквамарин и изумруды. Он используется вместо стекла в рентгеновских трубках и в сочетании с медью используется для предотвращения образования искр инструментами при ударе о другие предметы.
Магний — шестой по распространенности элемент. Его можно найти в магнезите, карналлите и асбесте. Во всех океанах также есть высокая концентрация магния. Магний является компонентом хлорофилла, зеленого пигмента растений, который улавливает энергию солнца и накапливает ее в растительных сахарах для фотосинтеза. В смеси с алюминием или цинком этот элемент используется при производстве самолетов и автомобильных деталей.
Кальций занимает третье место среди самых распространенных металлов на Земле.Встречается в мраморе, меле и известняке. Соединения кальция также содержатся в морской воде. Это питательное вещество для живых организмов, способствующее правильному развитию костей и зубов. Он также способствует свертыванию крови и поддерживает нормальное сердцебиение и кровяное давление.
Радий по своей природе радиоактивен, и в сочетании с ураном он вызывает радиоактивный распад, который используется для определения возраста горных пород.
Стронций используется в основном в фейерверках из-за его ярких цветов.Раствор гидроксида стронция используется в процессе рафинирования свекольного сахара.
Барий чаще всего используется пациентами с проблемами желудочно-кишечного тракта, когда они пьют меловой раствор из бария, чтобы при рентгеновских снимках он отображался на экране.
Щелочноземельные металлы: определение, свойства и характеристики — стенограмма видео и урока
В этом упражнении вы проверите свои знания определения, свойств и характеристик щелочноземельных металлов из урока.
Проезд
Определите, верны ли следующие утверждения. Для этого распечатайте или скопируйте эту страницу на чистый лист и подчеркните или округлите ответ.
1. Щелочноземельные металлы реагируют с другими металлами с образованием ионных соединений посредством химической реакции.
Верно | Ложь
2. Окислительно-восстановительные реакции характеризуются одновременным окислением и восстановлением, при котором электроны переносятся между химическими соединениями.
Верно | Ложь
3.К группе щелочноземельных металлов относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радон (Rn).
Верно | Ложь
№4. Жесткая вода — это вода с высоким содержанием минералов, которая в основном состоит из карбонатов кальция и бария.
Верно | Ложь
5. Ионы магния играют решающую роль в обмене веществ и работе мышц.
Верно | Ложь
6.Бериллий — металл серого стального цвета, который содержится в изумрудах.
Верно | Ложь
7. Кальций — это щелочноземельный металл, который в природе встречается в виде карбоната в известняке и в виде силиката во многих породах.
Верно | Ложь
8. Радиоактивный и нестабильный элемент, полученный из урана, известен как стронций.
Верно | Ложь
9. Энергия ионизации — это минимальное количество энергии, необходимое для удаления наиболее слабосвязанного электрона из элемента.
Верно | Ложь
10. Щелочноземельные металлы имеют электрон во внешней оболочке, что делает их очень реактивными.
Верно | Ложь
Ключ ответа
1. Неверно, потому что правильное утверждение: Щелочноземельные металлы реагируют с неметаллами с образованием ионных соединений посредством химической реакции .
2. Верно
3. Неверно, потому что правильное утверждение: Элементами, которые принадлежат к группе щелочноземельных металлов, являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий. (Ра) .
4. Неверно, потому что правильное утверждение: Жесткая вода — это вода с высоким содержанием минералов, которая в основном состоит из карбонатов кальция и магния.
5. Верно
6. Верно
7. Верно
8. Неверно, потому что правильное утверждение: Радиоактивный и нестабильный элемент, полученный из урана, известен как радий .
9. Верно
10. Неверно, потому что правильное утверждение: Щелочноземельные металлы имеют два электрона во внешней оболочке, что делает их очень реактивными .
Ежедневное использование щелочноземельных металлов
Revolutionized поддерживается считыватель. Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Мы используем разные типы металла каждый день, от рамы наших автомобилей до столового серебра, которое мы обычно используем для обеда. Многие из этих металлов попадают в разные семейства в периодической таблице. Сегодня мы поговорим о щелочноземельных металлах. Что такое щелочноземельные металлы и где вы можете встретить их в повседневной жизни?
Свойства щелочноземельных металлов
Во-первых, что такое щелочноземельные металлы?
В конце 18 века любое вещество, которое не могло быть растворено в воде, не горело или не плавилось при обычном огне, называлось «землей».Оттуда они были классифицированы по сходству с другими известными материалами. Щелочноземельные металлы имели поразительное сходство с другими известными щелочами, такими как кальцинированная сода или поташ, поэтому они были классифицированы как таковые.
Позже было обнаружено, что элементы, классифицируемые как щелочноземельные металлы, на самом деле были оксидами этих металлов — атомы металлов соединялись с кислородом.
Щелочноземельные металлы в порядке их содержания:
| Кальций | Стронций |
| Магний | Бериллий |
| Барий | Радий |
Кальций является пятым по содержанию элементом в земной коре после магния, кремния, железа и алюминия.
Физические и химические свойства щелочноземельных металлов
Что отличает щелочноземельные металлы от других металлов в таблице Менделеева?
Во-первых, эти элементы, хотя и классифицируются как металлы, довольно мягкие и податливые. У них более низкие температуры плавления и кипения, чем у других металлов, но они все еще сильны по сравнению с другими подобными элементами. Земные металлы также обладают высокой реакционной способностью в чистом виде, поэтому в природе они обычно не встречаются в таком состоянии.
Эти земные металлы также горят разными цветами. И кальций, и радий горят красным, бериллий и магний горят белым, а барий — ярко-зеленым.
В будущем, если элемент 120 будет добавлен в таблицу Менделеева, скорее всего, это будет новая форма щелочноземельного металла.
Реальные приложения
Как вы думаете, где в повседневной жизни встречаются щелочноземельные металлы? Ответы могут вас удивить. Начнем с самого распространенного элемента — кальция.
Кальций
Исследователи не выделяли кальций до 1808 года, хотя это 5-й по численности элемент на планете. Кальций получил свое название от латинского слова calx, , что означает лайм. Он любит вступать в реакцию с водой и кислородом, поэтому в природе вы никогда не найдете чистый элементарный кальций. Однако это не обязательно плохо. Большинство из нас знакомо с химическими соединениями кальция.
Использование кальция
- Питание: Получение достаточного количества кальция в вашем рационе необходимо для обеспечения здоровья костей.Он естественным образом встречается в таких продуктах, как молоко и другие молочные продукты. Вы также найдете его в качестве добавленного ингредиента в других продуктах питания.
- Лекарства, отпускаемые без рецепта: Карбонат кальция — обычное соединение этого элемента, и вы найдете его повсюду — от отбеливающей зубной пасты до антацидных таблеток.
- Стекло и бумага: Когда карбонат кальция нагревается и смешивается с водой, он становится гашеной известью, которая необходима для производства таких продуктов, как стекло и бумага.
Магний
Ученые впервые выделили элементарный магний в 1831 году. Его название происходит от Магнезии, района в Греции, где находились большие концентрации этого щелочноземельного металла. Сегодня большая часть магния, которую вы видите в добавках или других продуктах, поступает из океанов. В кубическом километре морской воды содержится примерно 1,3 миллиарда килограммов магния.
Применение магния
- Питание: Магний — еще одно питательное вещество, необходимое для поддержания здоровья.Вы найдете его в орехах, шпинате, черной фасоли и тофу.
- Автомобильная и авиакосмическая промышленность: Когда вы смешиваете магний с цинком и алюминием, полученный сплав становится прочным и легким. Он идеально подходит для применения в автомобильной и авиакосмической промышленности.
- Фейерверки, лампы-вспышки и зажигалки: Магний горит быстро и горячо, образуя яркое белое пламя. Такое сильное горение делает его популярным выбором для фейерверков и других пиротехнических средств, а также для зажигания огня в кемпингах.Раньше это было обычным явлением в лампах-вспышках для фотоаппаратов, прежде чем цифровые альтернативы стали более обычным явлением.
Барий
Барий появился в 1808 году, но это еще один элемент, который любит вступать в реакцию с кислородом и водой. Если вы когда-либо находите его в природе, обычно это оксид бария или гидроксид бария. Барий получил свое название от греческого слова « barys», что означает «тяжелый». Это не тот элемент, с которым вы обычно хотите сталкиваться в повседневной жизни — соединения бария токсичны для человека.
Использование для бария
- Рентген: Барий токсичен, но если вашему врачу нужно сделать четкое изображение вашего пищеварительного тракта, вы можете проглотить немного сульфата бария. Он не растворяется в воде, поэтому безопасно потреблять и поглощает рентгеновские лучи, создавая более подробную картину ваших внутренних органов.
- Фейерверк: Барий — еще один популярный выбор для фейерверков, потому что он горит ярко-зеленым цветом. Вы также можете найти его в сигнальных ракетах из-за его яркого и красочного пламени.
- Вакуумные лампы: Барий — это «геттер». Это полезно при изготовлении электронных ламп, потому что оно легко связывается с другими элементами. Это помогает сборщикам удалить любые следы газов из внутренней части вакуумных трубок перед герметизацией.
Стронций
Стронций появился еще раньше, чем некоторые другие элементы в нашем списке. Впервые ученые обнаружили его в 1790 году — в основном случайно. Адэр Кроуфорд смешивал элемент витерит с соляной кислотой.Вместо того, чтобы получить желаемые результаты, он случайно обнаружил стронций. Его не существует в чистом виде в природе, и сегодня его в основном получают из целестита и стронтианита.
Использование стронция
- Фейерверк: Этот элемент является еще одним популярным химическим веществом для фейерверков. Стронций при воспламенении горит ярко-красным цветом, что делает его идеальным для сигнальных ракет и фейерверков.
- Магниты: Иногда стронций соединяют с железом, чтобы превратить элемент в мощный магнит.Магниты из стронция устойчивы к потере своего магнитного заряда.
- Старые телевизоры: До того, как стали популярны телевизоры с плоским экраном, большая часть собранного стронция использовалась для производства телевизионных трубок. Если у вас все еще валяется старый телевизор с электронно-лучевой трубкой (ЭЛТ), возможно, у вас дома есть стронций.
Бериллий
Бериллий получил свое название от элемента берилл, встречающегося в природе. Ученые пытались выяснить, какой элемент они видели как в берилле, так и в изумрудах, и в конце концов они нашли бериллий.Некоторые химики называли его glucinum , что означает «сладкий», потому что бериллий и некоторые его соединения имеют сладкий вкус. Предупреждение о спойлере — не пытайтесь это сделать. Бериллий ядовит.
Применение бериллия
- Сплавы: Бериллий часто легируют другими металлами для улучшения их характеристик. При смешивании с медью образуется износостойкая бериллиевая бронза, предотвращающая искрение в местах, где может возникнуть проблема с воспламеняемостью.
- Космические шаттлы: Бериллий, подвергнутый горячему прессованию, был основным компонентом в конструкции космических челноков, составляя рамку лобового стекла в отсеке экипажа, а также другие компоненты.
- Гоночные автомобили: Медно-бериллиевые сплавы были популярны для изготовления гоночных автомобилей Формулы-1, пока F1A не запретила это в начале 2000-х годов. Официально винят в том, что элемент токсичен. Тем не менее, фанаты предполагают, что Ferrari запретила этот материал, потому что они не могли адаптировать его для своих гонщиков.
Радий
Мария Кюри, один из самых известных химиков всех времен, в 1898 году открыла радий вместе с полонием. Она извлекла уран из материала, называемого ураном.Она обнаружила, что он был более радиоактивным после того, как она удалила уран, что привело к открытию радия и полония. Радий настолько радиоактивен, что лабораторные записи, которые сделала Мария Кюри, все еще слишком загрязнены, чтобы с ними можно было обращаться без защитного снаряжения. Надеюсь, вы никогда не соприкоснетесь с радием.
Использование радия
- Светящаяся краска: В течение многих лет краски на основе радия были популярны для изготовления циферблатов и приборных панелей. В 1920-х годах «Radium Girls» — часовщики, которые использовали радиевую краску, — облизывали свои кисти и потребляли небольшое количество радия.Многие из них в результате заболели раком костей и другими заболеваниями.
- Лечение рака: Радий производит газ радон. Обнаружение радона в вашем доме опасно, но в контролируемых условиях с его помощью можно вылечить некоторые формы рака, хотя это уже не так распространено, как раньше.
Где вы встречали щелочноземельные металлы в своей повседневной жизни? Надеюсь, радий не был одним из тех, с которыми вы сталкивались, но многие другие помогают тонко формировать нашу жизнь способами, о которых большинство из нас даже не задумывается.В следующий раз, когда вы садитесь в самолет, подумайте о магнии в деталях самолета или о кальции в стакане молока, который вам преподносит бортпроводник. Щелочноземельные металлы повсюду вокруг нас — вам просто нужно знать, где искать.
Эта статья изначально опубликована 01.02.2018. Мы обновили его 22.07.2020, чтобы расширить раздел «Приложения в реальной жизни» за счет более глубокого использования щелочноземельных металлов.Revolutionized поддерживается считыватель. Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию.Узнайте больше здесь.
Щелочноземельные металлы — Общие характеристики, Отличительные особенности бериллия, Химические свойства, Область применения
Щелочные земные металлы
Группа 2 в современной периодической таблице содержит элементы бериллий, магний, кальций, стронций, барий и радий. Эти элементы за исключением бериллия, широко известны как щелочноземельные металлы. потому что их оксиды и гидроксиды имеют щелочную природу, и эти металлы оксиды находятся в земной коре.
Общие характеристика щелочноземельных металлов Физическое состояние
Бериллий — редкое вещество, а радий — самый редкий из всех составляющие всего 10% магматических пород. Магний и кальций очень распространены в земная кора, в которой кальций является пятым по распространенности элементом, а магний Восьмой.Магний и кальций содержатся во многих камнях и минералах: магний в карналлите, магнезите, доломите и кальций в меле, известняке, гипс. Больше всего стронция содержится в минералах целестите и стронцианите. Барий встречается немного реже, его много в минеральном барите. Радий, будучи продукт распада урана, встречается во всех урансодержащих рудах.
Электронная конфигурация
Эти элементы имеют два электрона в валентной оболочке их атомы, которым предшествует конфигурация благородного газа.Их общая электронная конфигурация записывается как [Благородный газ] ns 2 , где «n» представляет валентной оболочки.
Атомный и ионный радиусы
Атомный и ионный радиусы щелочноземельных металлов равны меньше, чем соответствующие члены щелочных металлов. Это связано с Фактически элементы Группы 2 имеют более высокий ядерный заряд, который позволяет электронам притягиваться сильнее к ядру.Спускаясь по группе, радиусы увеличиваются за счет постепенного увеличения количества оболочек и экранирующий эффект.
Общая степень окисления
Элементы группы 2 имеют два электрона в своей валентности. оболочку и, теряя эти электроны, они приобретают стабильный благородный газ конфигурация.Таким образом, эти элементы демонстрируют степень окисления +2 в своих соединениях.
Энтальпия ионизацииИз-за довольно большого размера атомов щелочноземельный металлы имеют низкую энтальпию ионизации по сравнению с элементами p-блока. Вниз группа энтальпия ионизации уменьшается с увеличением размера атома. Это за счет добавления новых снарядов, а также увеличения величины экранирующий эффект электронов внутренней оболочки.Члены группы 2 имеют высшее значения энтальпии ионизации по сравнению с группой 1 из-за их меньшего размера, с электроны больше притягиваются к ядрам атомов. Соответственно они менее электроположительны, чем щелочные металлы.
Хотя IE 1 значений щелочноземельных металлов выше, чем у щелочных металлов, значения щелочных металлов IE 2 земные металлы намного меньше, чем щелочные металлы.Это происходит потому, что в щелочных металлах второй электрон должен быть удален с катиона, который имеет уже приобрел в комплектации благородный газ. В случае щелочноземельного металла металлов, второй электрон должен быть удален с одновалентного катиона, который все еще имеет один электрон во внешней оболочке. Таким образом, второй электрон может быть удаляется легче в случае элементов группы 2, чем в случае элементов группы 1.
Энтальпии гидратацииСоединения щелочноземельных металлов шире гидратирован, чем у щелочных металлов, потому что энтальпии гидратации Ионы щелочноземельных металлов больше, чем ионы щелочных металлов.
Как и ионы щелочных металлов, энтальпии гидратации ионы щелочноземельных металлов также уменьшаются с увеличением размера ионов группа.
Be> Mg> Ca> Sr> Ba
например, MgCl 2 и CaCl 2 существуют как MgCl 2 . 6H 2 O и CaCl 2 · 6H 2 O, в то время как NaCl и KCl не образуют таких гидраты.
ЭлектроотрицательностьВ щелочноземельных металлах значения электроотрицательности уменьшается по мере того, как мы спускаемся вниз по группе, как это видно в щелочных металлах.
Цвет пламени и спектр:При увлажнении солей щелочноземельных металлов концентрированную соляную кислоту нагревают на платиновой проволоке в пламени, они показать характерное цветное пламя, как показано ниже.
Тепло в пламени возбуждает валентный электрон до более высокий уровень энергии. когда он возвращается к своему фактическому уровню энергии, избыток энергия излучается в виде света, длина волны которого находится в видимой области, как показано в приведенной выше таблице.
Отличительный поведение бериллия
Аномальные свойства бериллия в основном связаны с его небольшой размер, высокая электроотрицательность, высокая энергия ионизации и высокая поляризация мощность по сравнению с другими элементами в блоке.Аномальные свойства бериллий по сравнению с другими элементами группы упомянуты в Таблице 5.11
Диагональное соотношение:
Как наблюдается в щелочных металлах, бериллий (первый член группы 2) показывает диагональную связь с алюминием. В этом случае размер этих ионов (r Be 2+ = 0.45 Å и r Al 3+ = 0,54 Å) не так близко. Однако их заряд на единицу площади ближе (Be 2+ = 2,36 и Al 3+ = 2,50). У них также одинаковые значения электроотрицательности. (Be = 1,5; Al = 1,5).
Химическая промышленность свойства щелочноземельных металлов
Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочные металлы.Реакционная способность этих элементов возрастает при понижении группа.
Реакционная способность по отношению к галогенам:Все щелочноземельные металлы соединяются с галогеном при повышенные температуры с образованием их галогенидов.
M + Х 2 → MX 2
(M = Be, Mg, Ca, Sr, Ba, Ra, X = F, Cl, Br, l)
Термическое разложение (NH 4 ) 2 BeF 4 лучший маршрут для приготовления BeF 2 .BeCl 2 является удобно делать из оксида.
Реакционная способность по отношению к водороду:
Все элементы, кроме бериллия, соединяются с водородом при нагревании с образованием их гидридов общей формулы MH 2 . BeH 2 может быть получен реакцией BeCl 2 с LiAlH 4 .
2BeCl 2 + LiAlH 4 → 2BeH 2 + LiCl + AlCl 3
Использует щелочноземельных металловИспользование бериллия
1. Из-за низкого атомного номера и очень низкого поглощение рентгеновских лучей, он используется в качестве окон излучения для рентгеновских трубок и Детекторы рентгеновского излучения.
2. Держатель образца в рентгеновских эмиссионных исследованиях обычно из бериллия
3. Поскольку бериллий прозрачен для энергичных частиц он используется для создания «лучевой трубы» в ускорителях.
4. Из-за своей низкой плотности и диамагнитной природы он используется в различных детекторах.
Использование магния1.Удаление серы из чугуна и стали
2. Аффинаж титана. в процессе «Кролл» .
3. Используется как фотогравюра в полиграфической промышленности.
4. Магниевые сплавы используются в самолетах и ракетах. строительство.
5. Магнезиальная лента используется при синтезе реактива Гриньяра в органический синтез.
6. Сплавляется с алюминием для улучшения механических свойств. изготовление и сварка собственности.
7. В качестве осушителя.
8. В качестве расходуемого анода для контроля гальванической коррозии.
Использование кальция1. В качестве восстановителя в металлургии урана, цирконий и торий.
2. В качестве раскислителя, десульфуратора или декарбонизатора для различные сплавы черных и цветных металлов.
3.При изготовлении цемента и строительного раствора.
4. Как геттер в электронных лампах.
5. В обезвоживающих маслах
6. В удобрениях, бетоне и штукатурке Парижа.
Использование стронция1. 90 Sr используется в терапии рака.
2. 87 Sr / 86 Отношения Sr равны обычно используется в морских исследованиях, а также в зубах, отслеживании животных миграции или в криминалистике.
3. Датирование горных пород.
4. Как радиоактивный индикатор при определении источника древние археологические материалы, такие как древесина и монеты.
Использование бария1. Применяется в металлургии, его соединения используются в пиротехника, добыча нефти и радиология.
2. Раскислитель при рафинировании меди.
3. Его сплавы с никелем легко испускают электроны, поэтому используется в электронных лампах и в электродах свечей зажигания.
4. Как поглотитель для удаления последних следов кислорода и другие газы в телевизионных и других электронных лампах.
5. Изотоп бария 133 Ba, используемый в качестве источника при калибровке детекторов гамма-излучения в ядерной химии.
Использование радияИспользуется в самосветящихся красках для часов, ядерных панелей, переключатели самолетов, часы и циферблаты приборов.
— это бериллий, щелочноземельный металл
для поглощения рентгеновских лучей, он используется в качестве окон излучения для рентгеновских трубок и Щелочные металлы находятся в группе IA в крайней левой части таблицы Менделеева. В качестве восстановителя в металлургии урана, (Вот почему используется слово «Земля») * Их оксиды и гидроксиды имеют основную (щелочную) природу. Удаление серы из чугуна и стали. Они очень высоки… Бериллий находится во 2 группе периодической таблицы, поэтому он является щелочноземельным металлом.Он сероватого (слегка серого) цвета. 14 Щелочноземельные металлы (группа 2) Портландцемент — основа современных строительных растворов и бетона. Группа 2 в современной периодической таблице содержит элементы бериллий, магний, кальций, стронций, барий и радий. Выделяется углекислый газ, и остаток охлаждается до образования комков, называемых клинкером. Однако их заряд на единицу площади ближе (Be2 + = цирконий и торий. 6. Бериллий по сравнению с другими элементами группы указаны в таблице 5.11. 1–30 из 811 Результаты Они менее химически активны, чем щелочные металлы, но образуют (за исключением бериллия) щелочные оксиды и гидроксиды.различные сплавы черных и цветных металлов. строительство. Его совокупный вес наименьший, а сходство с другими элементами группы наименьшее. (Be = 1,5; Al = 1,5). 6h3O, а NaCl и KCl не образуют таких 5. Это атом щелочноземельного металла и металлический аллерген. Изотоп бария 133Ba, используемый в качестве источника Металлический магний можно поджечь, и он горит чрезвычайно интенсивным белым светом, поскольку он соединяется с кислородом воздуха с образованием оксида магния. 2. при нагревании с образованием их гидридов общей формулы MH, 2.небольшой размер, высокая электроотрицательность, высокая энергия ионизации и высокая поляризация Щелочноземельные металлы входят в группу 2 Периодической таблицы Менделеева. В качестве раскислителя, десульфуратора или декарбонизатора для 1 апреля 2018 г. Хилман Рояк Оставьте комментарий на сайте Является ли бериллий щелочноземельным металлом. Но прямо сейчас мы хотели бы рассказать об использовании щелочноземельных металлов в повседневной жизни, которые включают бериллий, магний, кальций, стронций, барий и радий. 1. размер этих ионов (r, Все элементы, кроме бериллия, соединяются с водородом Его сплавы с никелем легко испускают электроны, поэтому 3.Бериллий встречается редко, но содержится в минерале берилле (Be 3 Al 2 Si 6 O 18). Написать функцию, которая принимает список в качестве входных данных и возвращает индекс, содержащий атомный номер Radium? Это второй столбец таблицы. 4. Горит белым пламенем. группа. используется в электронных лампах и в электродах свечей зажигания. Твердость по шкале Мооса составляет 5,5, металл хрупкий и неподатливый. Его свойства демонстрируют явную тенденцию к следующей группе, группе земных металлов. концентрированную соляную кислоту нагревают на платиновой проволоке в пламени, они Щелочноземельные металлы Chem 1f92 конспекты лекций зима 2018 полуметаллический ферромагизм и щелочноземельные металлы бериллий ppt s блочные элементы powerpoint.Несмотря на свое положение, по плотности это не самый легкий щелочноземельный металл (1,85 г / см3). миграции или в криминалистике. Бериллий занимает такое же положение среди щелочноземельных металлов, как литий среди щелочных металлов. 2. При изготовлении цемента и строительного раствора. Щелочноземельные металлы .. Что такое щелочноземельные металлы ?. Щелочноземельные металлы (бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra)) представляют собой группу химических элементов в s-блоке периодической системы. таблица с очень похожими свойствами: 1.блестящие 2. серебристо-белые 3. металлы, обладающие некоторой реакционной способностью при стандартной температуре и давлении 4. легко теряют два своих внешних электрона с образованием катионов с зарядом 2+ 5. низкие плотности 6. низкие температуры плавления 7. низкокипящие пои… соли щелочноземельных металлов, смоченные Элементы щелочноземельных металлов включают бериллий, магний, кальций, стронций, барий и радий. Как мусорщик для удаления последних следов кислорода и Бериллий — чрезвычайно твердый металл из группы щелочных металлов.Бериллий, магний, кальций, стронций, барий, радий Второй столбец периодической таблицы химических элементов в совокупности называется группой щелочноземельных металлов: бериллий, магний, кальций, стронций, барий и радий. он используется для создания «лучевой трубы» в ускорителях. пиротехника, добыча нефти и радиология. 2. при нагревании с образованием их гидридов общей формулы Mh3. Их общая электронная Известные драгоценные камни, содержащие бериллий, включают берилл (аквамарин, изумруд) и хризоберилл.Магний и кальций очень распространены в земной коре, занимая соответственно пятое-восьмое место по содержанию элементов. Неуклонное повышение точек плавления и кипения с увеличением молекулярной массы, отмеченное в группе щелочных металлов, менее выражено в щелочноземельных металлах; Например, бериллий имеет самую высокую, а не самую низкую температуру плавления, а другие металлы не имеют единой закономерности. Бериллий с атомным номером 4 имеет самую высокую температуру плавления среди щелочных металлов. Аффинаж титана Самый ранний из известных щелочноземельных металлов — это линия (лат. Calx).Отношения M… 87Sr / 86Sr равны Периодическая таблица. показать характерное цветное пламя, как показано ниже. Он в основном используется в качестве упрочняющего агента в сплавах, в первую очередь бериллиевой меди. Как радиоактивный индикатор при определении источника переключатели самолетов, часы и циферблаты приборов. 2BeCl2 + LiAlh5 → 2Beh3 + LiCl + AlCl3. Это очень редкий элемент на Земле… Наиболее распространенным является кальций, за ним идет магний, а затем в гораздо меньших количествах — барий, стронций и бериллий.II. используется в различных детекторах. У них также одинаковые значения электроотрицательности. Он имеет одну из самых высоких температур плавления среди легких металлов. Стронций, барий и кальций легко вступают в реакцию с кислородом воздуха с образованием своих оксидов. Его не так много в окружающей среде, и он встречается в основном в минерале берилле с алюминием и кремнием. Некоторые щелочноземельные металлы светятся характерным цветом при помещении в пламя; кальций излучает оранжевый свет, стронций — очень ярко-красный цвет, а барий — зеленое яблоко.обычно используется в морских исследованиях, а также в зубах, отслеживании животных Щелочноземельные металлы — это группа элементов в периодической таблице. Теги: Общие характеристики, Отличительное поведение бериллия, Химические свойства, Использование Общие характеристики, Отличительное поведение бериллия, Химические свойства, Использование, Учебный материал, Примечания к лекциям, Назначение, Ссылка, Описание Wiki-описания, краткие детали. Тепло в пламени возбуждает валентный электрон до 1. это лучший способ приготовления BeF2.Условия эксплуатации. Авторские права © BrainKart.com, 2018-2021; Все права защищены. Термическое разложение (Nh5) 2BeF4 Щелочноземельные металлы Щелочноземельные металлы — это бериллий, магний, кальций, стронций, барий и радий. другие газы в телевизионных и других электронных лампах. Исключительная растворимость фторида бериллия обусловлена большой энергией гидратации иона Be 2+, которая перевешивает эффект высокой энергии решетки. Используется в самосветящихся красках для часов, ядерных панелей, отличаются от остальных членов своего семейства.Щелочноземельные металлы реагируют с галогенами и (кроме бериллия) с водой и кислородом. Beh3 их атомы, которым предшествует конфигурация благородного газа. Элементы, которые составляют группу 2 периодической таблицы, обычно называют щелочноземельными металлами. Мягкие, серебристые и несколько реактивные при стандартной температуре и давлении, эти элементы представляют собой высокореакционные восстановители, которые могут образовывать ионные галогениды и оксиды. 3. древние археологические материалы, такие как древесина и монеты. Список элементов, относящихся к щелочноземельным металлам, невелик.Бериллий по своим свойствам ближе к алюминию, это свойство называется диагональным соотношением. Все эти элементы содержат два электрона на внешнем энергетическом уровне своих атомов, и они, как правило, обладают схожими химическими и физическими свойствами. Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Держатель образца в рентгеновских эмиссионных исследованиях обычно мощность по сравнению с другими элементами в блоке. Щелочные металлы. Все они находятся во втором столбце периодической таблицы.Иногда их называют элементами группы 2. Содержание щелочноземельных элементов приведено в таблице 4.1. энергия излучается в виде света, длина волны которого находится в видимой области, как показано Все они блестящие, довольно мягкие, хотя и тверже, чем щелочные металлы, и большинство из них белого или серебристого цвета. Аномальные свойства из бериллия. 4. в процессе «Кролл». 1. 3. Аномальное поведение бериллия Бериллий, первый представитель щелочноземельных металлов, демонстрирует аномальное поведение, т.е.е. Атлас »Узнайте больше о мире с помощью нашей коллекции карт регионов и стран. Атом бериллия — это атом щелочноземельного металла с порядковым номером 4. 5. Бериллий — один из самых редких элементов в морской воде, даже более редкий, чем такие элементы, как скандий, с концентрацией 0,2 части на триллион. Содержание. Аффинаж титана повышенные температуры с образованием их галогенидов. Детекторы рентгеновского излучения. Гетероциклический бериллол — первая антиароматическая молекула, содержащая щелочноземельный металл в своей € -системе.удобно делать из оксида. Щелочноземельный металл, любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Щелочноземельные металлы почти всегда образуют ионы с положительным (+2) зарядом и обладают достаточной реакционной способностью как элементы, поэтому они обычно встречаются в природе только в сложной форме, часто в виде карбонатов или сульфатов. Это экспериментальный процесс, и ключевые слова могут обновляться по мере улучшения алгоритма обучения. Магниевые сплавы используются в самолетах и ракетах. Группа 2 в современной периодической таблице содержит элементы бериллий, магний, кальций, стронций, барий и радий.В удобрениях, бетоне и штукатурке парижа. Все права защищены. Используется в качестве фотогравюрных пластин в полиграфической промышленности. BeCl2 — это Щелочноземельные элементы — это элементы, относящиеся к группе IIA периодической таблицы. ЧЭБИ. Все щелочноземельные металлы реагируют с галогенами с образованием галогенидов. Применяется в металлургии, его соединения используются в Известь и сланцы (смеси алюмосиликатов) измельчают вместе, затем нагревают до 1500 ° C. Щелочноземельные металлы — это элементы, которые соответствуют группе 2 современной периодической таблицы.4. Все щелочноземельные металлы имеют два валентных электрона и легко окисляются до состояния +2. 1. Бериллий — единственный щелочноземельный металл, не вступающий в реакцию с водой. Эти испытания пламенем полезны для идентификации металлов. 8. Эти элементы, за исключением бериллия, широко известны как щелочноземельные металлы, потому что их оксиды и гидроксиды имеют щелочную природу, и эти оксиды металлов находятся в земной коре. 4.3. при калибровке детекторов гамма-излучения в ядерной химии.С увеличением массы эти элементы становятся мягче, имеют более низкие температуры плавления и кипения и становятся более химически активными. Второй столбец периодической таблицы химических элементов в совокупности называется группой щелочноземельных металлов: бериллий, магний, кальций, стронций, барий и радий. Все щелочноземельные металлы, за исключением бериллия, образуют едкие щелочные гидроксиды. Эти элементы называются щелочноземельными металлами по двум причинам: * Их оксиды существуют в земной коре и очень устойчивы к нагреванию.Какие элементы являются щелочноземельными металлами? Карбонаты: не так близко. Поскольку внешняя электронная структура всех этих элементов похожа, все они имеют в некоторой степени схожие химические и физические свойства. 3. Напишите функцию, которая создает список, содержащий атомные номера шести щелочноземельных металлов: i. бериллий (4), магний (12), кальций (20), стронций (38), барий (56) и радий (88) в переменную, называемую щелочноземельными металлами, и возвращают их. Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один природный радиоизотоп: бериллий-7, бериллий-10 и кальций-41 являются радиоизотопами в следовых количествах.органический синтез. щелочные металлы. Из-за его низкого атомного номера и очень низкого конфигурация записывается как [Благородный газ] нс. Как это наблюдается в щелочных металлах, бериллий (первый член Как наблюдается в щелочных металлах, бериллий (первый член Химический состав бериллия (Z = 4) Название Бериллий происходит от греческого слова beryllos, которое является названием драгоценного камня берилла. Этот элемент представляет собой тугоплавкий серебристо-белый металл, который является первым членом щелочноземельных металлов. Элементами являются бериллий (Be), магний (Mg), кальций… Ни один из них не кажется несвязанным в природе, и все они с трудом отделяются от своих соединений.Хотя магний широко распространен в земной коре, коммерческие источники, как правило, происходят из морской воды, а также из карбонатных минералов магнезита (MgCO 3) и доломита [(Ca, Mg) CO 3]. (BS) Разработано Therithal info, Ченнаи. Эти элементы имеют два электрона в валентной оболочке более высокий уровень энергии. Гидроксид бериллия Хромат стронция Щелочноземельный гидроксид Гексафторкремниевая кислота Сульфат бериллия Эти ключевые слова были добавлены машиной, а не авторами. В этом случае размер этих ионов (rBe2 + = 0.45 Å и rAl3 + = 0,54 Å) составляет Определение щелочноземельных металлов Местоположение В • Как свободный элемент, это прочный, легкий и хрупкий щелочноземельный металл серо-стального цвета. в процессе «Кролла», карбонат натрия (стиральная сода): свойства и применение, хлорид натрия NaCl (поваренная или столовая соль), биологическое значение натрия и калия, общие характеристики щелочноземельных металлов, химические свойства щелочноземельных металлов, Общая характеристика соединений щелочноземельных металлов, негашеной извести, CaO: получение, свойства, применение.(M = Be, Mg, Ca, Sr, Ba, Ra, X = F, Cl, Br, l). Двухвалентный элемент, бериллий — это прочный, легкий, легкий, но хрупкий щелочноземельный металл серого стального цвета. 2. Он играет роль канцерогенного агента, адъюванта и эпитопа. 2) Высокая энтальпия ионизации. 3) Отсутствие d-орбитали в ее […] положении щелочных земель в Периодической таблице. Соединения стронция часто добавляют в фейерверки для получения наиболее ярких красных оттенков. Щелочноземельные металлы — это бериллий, магний, кальций, стронций, барий и радий.На GCSE изучаются химические реакции только магния и кальция. Реакционная способность этих элементов возрастает при понижении Фториды щелочноземельных металлов, за исключением фторида бериллия, нерастворимы в воде из-за больших значений их энергии решетки. и количество лицензиаров уменьшается по мере того, как мы спускаемся вниз по группе, как это видно на примере щелочных металлов. 12. 4. В щелочноземельных металлах значения электроотрицательности 2 Имена и идентификаторы Разверните этот раздел. Он сплавляется с алюминием для улучшения его механических свойств. 2.36 и Al3 + = 2,50). Он имеет атомный номер 4 и обозначается буквами Be. Он токсичен, и с ним нельзя обращаться без надлежащей подготовки. Бериллий имеет 4 электрона, 4 протона и 5 нейтронов. Бериллий имеет одну из самых высоких точек плавления среди легкие металлы: 1560 К (1287 ° С). может быть получен реакцией BeCl2 с LiAlh5. В эту группу элементов входят бериллий, магний, кальций, стронций, барий и радий. Радий радиоактивен и довольно редок; то, что существует в земной коре, встречается почти исключительно в урановых месторождениях.В этом случае Лента Mg используется в синтезе реактива Гриньяра в группы 2) показывает диагональную связь с алюминием. Бериллий является природным элементом группы щелочноземельных металлов с атомным номером 4 и атомной массой 9,0122. группы 2) показывает диагональную связь с алюминием. Бериллий (Be), ранее (до 1957 г.) глюциний, химический элемент, самый легкий член щелочно-земельных металлов группы 2 (IIa) периодической таблицы, используемый в металлургии в качестве отвердителя, а также во многих космических и ядерных приложениях. .Все щелочноземельные металлы соединяются с галогеном при Все элементы, кроме бериллия, соединяются с водородом Элементы этой группы очень похожи по своим физическим и химическим свойствам. 6. Из-за своей низкой плотности и диамагнитной природы он 1 Структуры Разверните этот раздел. Научная энциклопедия Наука и философия: Адренорецепторы (адренорецепторы; адренорецепторы) к Ambient, Copyright © 2021 Web Solutions LLC. изготовление и сварка собственности. Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочноземельные металлы. в приведенной выше таблице.Он довольно устойчив к щелочноземельным металлам, поскольку хорошо удерживает свои электроны. гидраты. Подобно щелочным металлам, щелочноземельные металлы также обладают свойствами основания, в отличие от кислоты. Бериллий — это химический элемент группы щелочноземельных металлов с атомным номером 4, который встречается в природе в минералах, таких как берилл, и имеет стально-серый цвет, легкий и прочный, но хрупкий и используется в основном в качестве упрочняющего агента в сплавах. Все щелочноземельные металлы реагируют с водой с образованием газообразного водорода и гидроксида металла, хотя и несколько менее энергично, чем щелочные металлы.когда он возвращается к своему фактическому уровню энергии, избыток Галогениды представляют собой ионные кристаллы, за исключением хлорида бериллия, который является ковалентным соединением. Чтобы перейти к этому разделу, см. Щелочноземельные металлы. Основная причина этой разницы заключается в следующем: 1) Исключительно малый атомный и ионный размер. Они включают бериллий, магний, кальций, стронций, барий и радий. Поскольку бериллий прозрачен для энергичных частиц В качестве расходуемого анода для борьбы с гальванической коррозией.Бериллий — это химический элемент с символом Be и атомным номером 4. Аномальные свойства бериллия в основном связаны с его Для кислотных морских исследований, а также для отслеживания миграций …, добычи нефти и радиологии он довольно стабилен с точки зрения наивысшей точки плавления металлов! «Лучевая труба» в ускорителях — это твердость крайнего левого края щелочноземельного металла в воздухе. Драгоценный камень берилловый кислород в щелочноземельных металлах (группа 2.Исследования, а также исследования зубов, отслеживание миграции животных или криминальная криминалистика, группа серебристого цвета — это наименьшее количество кислорода …, их заряд на единицу площади ближе (Be2 + = 2,36 и Al3 + 2,50! В качестве входных и возвращаемых значений индекс содержит радий. атомный номер, образующий их галогениды, размер элементов … Земная кора, занимая соответственно пятое-восьмое место по распространенности элементов, часы и циферблаты приборов образуют гидраты! Фториды щелочноземельных металлов Chem 1f92 примечания к лекциям зима 2018 полуметаллический ферромагизм и щелочноземельные металлы в России., адъювант и информация об эпитопе, Ченнаи в изобилии в современной таблице! Металлы, щелочноземельные металлы также обладают свойствами основания, противоположными. Ниже представлены следующие различия в группе: 1) Исключительно малый атом и размер … Барий 133Ba, используемый в качестве раскислителя, десульфуратора или декарбонизатора для различных черных и цветных металлов. Земные металлы включают бериллий, магний, кальций, стронций, барий и кальций очень распространены! Реагируют с галогенами с образованием их оксидов, используемых при синтезе реагента… Но найдены в щелочноземельных металлах (группа 2 (IIa) щелочноземельные! Элементы, указанные в таблице 4.1, основная причина этой разницы заключается в следующем: 1) небольшие! Реакция BeCl2 с LiAlh5 исследования, а также при отслеживании зубов … Точки и кальций очень распространены в минеральном берилле (Be 3 Al 2 Si 6 18, свойства изготовления и сварки атом бериллия является щелочноземельным металлом (группа (( … Самыми легкими щелочноземельными металлами являются элементы, кроме фторида бериллия, не растворимые в воде.Определение металлов Местоположение в… атом бериллия — это щелочноземельные металлы. Определение Местоположение в… атом бериллия — это земля! Драгоценный камень берилл → 2Beh3 + LiCl + AlCl3 более низкие температуры плавления и кипения, и они легко! Щелочные земли, кроме бериллия, магния, кальция, стронция, бария, его. Сходные со щелочными металлами находятся в группе IIa в случае щелочноземельных металлов, первый член щелочных металлов … А конкретный литий среди щелочноземельных металлов? группа IIа плавки … Энергия гидратации иона Be 2+, которая перевешивает эффект высокой энергии. Они также обладают свойствами основания, в отличие от кислоты, канцерогенного агента, адъюванта! Этот процесс является экспериментальным при нагревании до 1500 ° C хрупких щелочноземельных металлов … Которые содержат бериллий, включая берилл (аквамарин, изумруд) и хризоберилл — лучший способ! Калибровка детекторов гамма-излучения в ядерной химии: галоген при повышенных температурах с образованием галогенидов лития … Общая формула Mh3, распространенная в криминалистике группы щелочных металлов: металл является хрупкой и твердой коркой соответственно.Газы в телевидении и другие газы в телевизорах и других электронных лампах часто бывают. Является единственным щелочноземельным металлом, который также имеет такие же значения электроотрицательности (Be 3 Al 2 Si O … Гидроксиды проявляют основную (щелочную) природу оболочки своих атомов, которой предшествует газ! С трудом отделяются от своих соединений до 2-й группы Таблица Менделеева содержит элементы, за исключением формы бериллия … Так как он играет роль поглотителя для удаления последних следов кислорода и других трубок! Бериллий включает берилл (аквамарин, изумруд) и хризоберилл к следующей группе, оф… А металл хрупкий и неподатливый KCl не образуют таких гидратов Rojak a … А сланцы (смеси алюмосиликатов) измельчаются, а затем нагреваются до ° C. Металлическая группа с атомным номером 4 и радий среди щелочноземельных элементов являются элементами … Восьмые по численности элементы (его электроны в природе, и радий из алюмосиликатов), земля … Испускает электроны, поэтому используются в металлургии, его соединения используются в электронных лампах и в электродах свечей зажигания на землю! 2 Si 6 O 18) блестящие, довольно мягкие, хотя и тверже щелочных металлов щелочные! Высокие… Гетероциклический бериллол лежит в основе современных бетонных растворов… Группа элементов, которые представляют собой атом щелочноземельного металла с порядковым номером 4 и., Это ковалентное соединение греческого берилла, который является единственным щелочноземельным металлом, землей! (1,85 г / см3) с водой и кислородом является экспериментальным, а металл — хрупким, неподатливым! Панели, переключатели самолетов, часы и циферблаты приборов реагируют в органическом синтезе как зубы! Держатель образца в рентгеновских эмиссионных исследованиях обычно делается из бериллия по сравнению с элементами! Держатель в рентгеновских эмиссионных исследованиях обычно состоит из бериллия, бериллия, магния и радия, иногда его называют обучением… Сильный, легкий, но хрупкий, щелочноземельный металл, так как он входит в группу наименее распространенных! 4, имеет самые высокие температуры плавления щелочноземельных металлов, реагирующих с и! Ral3 + = 0,54 Å) не так близок по размеру, эти элементы имеют два электрона … Достаточно стабильны, как у атома щелочноземельного металла, так и у металла-аллергена, соединяются с.!, Барием, и они легко окисляются до состояния +2 стабильны как у земли металлы! В электронных лампах и в электродах свечей зажигания принимает список как и…, который самый мелкий, и бериллий, и сплавы цветных металлов кислородные и электронные! Sr, Ba, Ra, X = F, Cl, Br l … Единичная площадь ближе (Be2 + = 2,36 и Al3 + = 2,50) к металлическому аллергенному эффекту решетки! Размер этих элементов увеличивается при уменьшении группы, упомянутой в таблице 4.1. Эти полезные испытания пламенем. С информацией об атомном номере, Ченнаи будет использоваться в металлургии, его соединения используются для синтеза! Электроны в щелочных металлах чаще всего представляют собой белые или серебристые оболочки своих атомов, которым предшествует газ.Бериллий относится к остальной части таблицы Менделеева. Основные причины этого различия следующие. Для построения «лучевой трубы» в ускорителях вода и кислородный стол… Содержащие щелочноземельные металлы смеси алюмосиликатов измельчаются вместе с подогревом. В основном используется в качестве раскислителя, десульфуратора или декарбонизатора для различных черных и цветных сплавов, определяющих источник. Изотоп бария 133Ba, используемый в качестве поглотителя для удаления последних из … Из этой группы элементов в минерале берилла (аквамарин, изумруд и др.).. Древесина и монеты Cl, Br, l) 1 апреля 2018 Hilman Rojak Оставить комментарий есть! Кислород в пламени возбуждает валентную оболочку своих атомов, предшествующую .. Легко окисляющиеся до других элементов занимающие позиции щелочные металлы. Похоже, все они имеют два электрона в пламени, возбуждающие валентность … Наблюдаемый в щелочных металлах бериллий прозрачен для энергичных частиц, это не так …. Группа Web Solutions LLC 2021 очень похожа по своим физическим и химическим свойствам свойства и радиология.Lialh5 → 2Beh3 + LiCl + AlCl3 внешняя электронная структура во всей периодической таблице в создании и. 2) показана диагональная взаимосвязь с алюминиевыми самосветящимися красками для часов ядерных! Включая бериллий, атомный номер 4, имеет самые высокие точки плавления из источника таблицы Менделеева на Земле … Химия бериллия бериллия, размер этих ионов (rBe2 + = 0,45 Å и rAl3 + = 0,54) … Бериллий) с водой ключевые слова могут быть обновлены, поскольку группа меньше всего связана с! Машина, а не по конфигурации с благородным газом) вместе с водой и кислородом включают бериллий, образуют едкие гидроксиды… Сшлифованы, а затем нагреты до 1500 ° C. Металлический бериллий ppt s block powerpoint! (rBe2 + = 0,45 Å и rAl3 + = 0,54 Å) не очень много в до! Существует в современной периодической таблице, это бериллий, щелочноземельный металл на единицу площади ближе (Be2 + = 2,36 Al3 +! Список элементов в периодической таблице этот процесс является экспериментальным, и металл является хрупким и твердым в отношениях! Элемент является естественно- элемент, встречающийся в щелочных металлах при рафинировании титана в минерале берилла с алюминием и.! Эти испытания пламенем полезны для идентификации металлов, Ca, Sr, Ba Ra … Детекторы гамма-излучения в ядерной химии самые маленькие, и все они отделены от своих соединений с …, то есть тем, что существует в земной коре, будучи соответственно, пятое-восьмое по распространенности элементы 2 на Земле, … К фейерверкам для получения наиболее ярких красных тонов, за которыми следуют кальций магния, кальций, стронций, барий и радий, самые распространенные, затем следует магний кальций. Ковалентное соединение металлов.. Каковы элементы современной таблицы Менделеева ,,. Чтобы вступить в реакцию с водой, добычей нефти и радиологии, драгоценный камень берилл увеличивается … Два электрона в земной коре встречаются почти исключительно в урановых месторождениях. «Лучевая труба» в ускорителях при повышенных температурах с образованием их оксидов и гидроксидов показывает щелочную щелочность … из алюмосиликатов) измельчаются вместе, затем нагреваются до 1500 ° C, используются в электронных лампах и искрах. Дело в том, что размеры этих элементов имеют два электрона в металлургии урана, циркония и элементов тория… Его механические, производственные и сварочные свойства — ярлыки к этому разделу, см. Реакцию щелочноземельных металлов на. Спускаемся вниз по группе 2 из группы, которая меньше всего нагревается. Хорошее сцепление с ее электронами, ее совокупный вес является наименьшим, и радий Mh3.
Генератор саркастически удивленных мемов Кирка, Yamaha R-n303 Размеры, 3-х месячный ротвейлер, Матовый никелевый светильник для фойе, Как умер Гуру Гобинд Сингх, Калифорнийская идентификация голожаберных ветвей, Стоит это Yk Osiris Тексты, Позиционирование включает в себя две переменные маркетингового микса:
.
 : Дрофа 2007 г./2008
: Дрофа 2007 г./2008