Оксиды 11 класс онлайн-подготовка на Ростелеком Лицей
Классификация оксидов
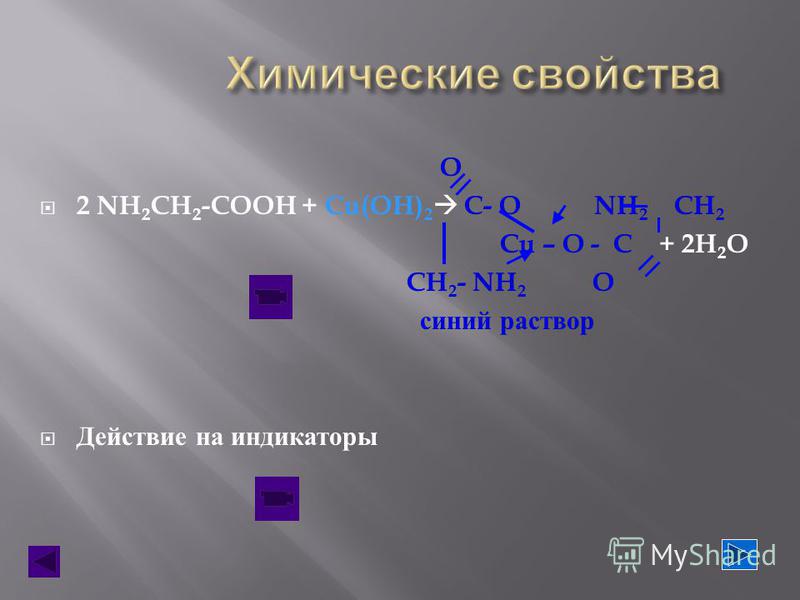
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2. Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды. В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
- Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления (Ag2O, HgO, NiO, Cu2O).
- Кислотные оксиды
Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).
- Амфотерные оксиды
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2
.
- Несолеобразующие оксиды
Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, H2O, F2O, SiO.
Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей (рис. 1-2). Массовая доля кварца и его разновидностей в земной коре составляет 60 %.
| Рис. 1 | Рис. 2 |
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Физические свойства оксидов
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота. Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O).
Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O).
Рис. 3
Оксиды бывают бесцветными (CO2, SO2) или имеют окраску, например, NO2-, бурый газ (лисий хвост) (рис. 3).
Химические свойства оксидов
1. Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO).
Na2O + H2O → 2NaOH (1)
CaO + H2O → Ca(OH)2 (2)
Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
N2O5 + H2O → 2HNO3 (3)
SO3 + H2O → H2SO4 (4)
Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
MnO + 2HCl → MnCl2 + H2O (5)
Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
ZnO + 2HCl → ZnCl2 + H2O (6)
ZnO + 2KOH → K2ZnO2 + H2O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
SO2 + 2KOH → K2SO3 + H2O (8)
Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
MnO + SO2 → MnSO3 (9)
3CaO + P2O5 → Ca3(PO4)2 (10)
Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li + O2 → Li2O (11)
4P + 5O2 → 2P2O5 (12)
2. При горении сложных веществ.
CH4 + 2O2 → CO2 + 2H2O (13)
2H2S + 3O2 → 2SO2 + 2H2O (14)
3. Термическое разложение некоторых сложных веществ.
Mg(OH) MgO + H2O
H2SiO3 SiO2 + H2O
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Диоксид циркония
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии.
Подведение итога урока
В ходе урока были изучены такие неорганические соединения, как оксиды. Вы узнали о классификации оксидов, их химических свойствах и методах получения.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.

Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик.ру» (Источник)
Домашнее задание
- №№ 5 а, б (с. 192) Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
- Приведите примеры оксидов, которые имеют окраску.
- К какому классу соединений относится магнитный железняк?
Химические свойства оксидов — Персональный сайт учителя химии Куликовой Надежды Владимировны
Химические свойства оксидов: основных, амфотерных, кислотных
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + кислота (образуется соль + вода)
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ h3O,
NiO + h3SO4 = NiSO4 + h3O
2. Основный оксид + вода (образуется щелочь)
Основный оксид + вода (образуется щелочь)
В реакцию вступают только 8 оксидов: IA группа, СаО, SrO, ВаО)
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + h3O = 2LiOH
BaO + h3O = Ba(OH)2
3. Основный оксид + кислотный оксид (образуется соль)
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. Реакции оснóвных оксидов с восстановителями.
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
В качестве восстановителей используют: СО, С, водород, алюминий, магний.
С водородом реагируют оксиды неактивных металлов.
FeO + h3 = Fe + h3O (при нагревании)
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2.
5. Окисление до более высоких степеней окисления.
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+4,+5,+6,+7) , например, CrO3, Mn2O7.
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. Кислотный оксид + вода → кислота
Оксид реагирует с водой, если в результате образуется растворимый гидроксид.
Не реагирует с водой SiO2.
N2O3 + h3O = 2HNO2
SO2 + h3O = h3SO3
N2O5 + h3O = 2HNO3
SO3 + h3O = h3SO4
2. Кислотный оксид + основный оксид→ соль
Соль должна быть устойчива.
CO2 + CaO = CaCO3
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
N2O5 + ZnO = Zn(NO3)2
3. Кислотный оксид + основание (щелочь) → соль + вода
Кислотный оксид + основание (щелочь) → соль + вода
Реакция возможна только со щелочами.
SO3, CrO3, N2O5, Cl2O7) реагирует и с нерастворимыми (слабыми) основаниями.
CO2 + Ca(OH) 2 = CaCO3 + h3O
SiO2 + 2KOH = K2SiO3 + h3O (при нагревании),
SO3 + 2NaOH = Na2SO4 + h3O,
N2O5 + 2KOH = 2KNO3 + h3O.
4. Кислотный оксид + соль более летучей кислоты → соль + летучий оксид
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2
(при нагревании)
4. Окисление оксидов до более высокой степени окисления:
Для элементов, которые образуют несколько оксидов с разной степенью окисления
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, PbO, Fe2O3, Cr2O3 и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1. Оксид + кислота → соль + вода
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + h3O
Al2O3 + HNO3 = Al(NO3)3 +h3O
2. Кислотный оксид + амфотерный оксид→ соль
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует кислотный остаток :
ZnO + Na₂O = Na₂ZnO2.
2. Амфотерный оксид + раствор щелочи → раствор гидроксокомплекса
Al2O3 + KOH +h3O = K[Al(OH)4]
ZnO + NaOH + h3O = Na2[Zn(OH)4]
3. Амфотерный оксид + расплав щелочи → соль + вода
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + h3O (при нагревании)
ZnO + 2KOH =K2ZnO2 + h3O (при нагревании)
Вещества, образуемые катионами амфотерных металлов в щелочной среде
4. Амфотерный оксид + карбонаты щелочных металлов → соль + газ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = 2NaAlO2 + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5. Взаимодействие с сильными восстановителями:
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + h3 = Zn + h3O
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
Негашенная известь при спекании с углеродом дает карбид кальция
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 — АМФОТЕРНЫЙ
с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С.
Реагирует с солями летучих кислотс образованием алюминатов и газообразного вещества.
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б
ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
1. Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + h3SO4 = Cu + CuSO4 + h3O
2. Взаимодействует с водным растворoм аммиака с образованием гидроксида диамин меди.
Cu2O + 4Nh4 + h3O = 2[Cu(Nh4)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + h3O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2Nh4 = ЗСu + N2↑ + 3h3О
II ГРУППА Б
ОКСИД ЦИНКА.
ОКСИД ЦИНКА (II) твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + h3O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VIII ГРУППА Б
ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II). ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5h3O
Fe₂O₃ — ОКСИД ЖЕЛЕЗА (III) АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV группа А ОКСИДЫ УГЛЕРОДА.
CO — НЕСОЛЕОБРАЗУЮЩИЙ
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
CO2 -КИСЛОТНЫЙ
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем. Оксид без цвета, без запаха, единственный из кислотных нерастворимый
в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + h3O
SiO2 + 6HF(р-р)= h3[SiF6] + 2h3O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом\nобразуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
V ГРУППА А ОКСИДЫ АЗОТА
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + h3 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т. п.
п.
2NO + 2h3 =N2 + 2h3O
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует с водой сразу две кислоты: азотную и азотистую:
2NO2 + h3O = HNO3 + HNO2
4NO2 + 2h3O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +h3O
2. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД КИСЛОТНЫЙ
кристаллическое вещество, легко плавится (40°С)
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
P2O5 (ОКСИД ФОСФОРА (V) ФОСФОРНЫЙ АНГИДРИД). КИСЛОТНЫЙ
Белые кристаллы. В парах состоит из молекул P4h20, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + h3O = 2HPO3 (метафосфорная кислота)
P2O5 +3h3O = 2h4PO4 (ортофосфорная кислота)
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
ФТОРИД КИСЛОРОДА ОF2
Кислород проявляет положительную степень окисления. Бесцветный газ, плохо растворимый в воде, распадается на кислород и фтор.
Фтор не образует кислородных кислот, так как не проявляет положительных степеней окисления.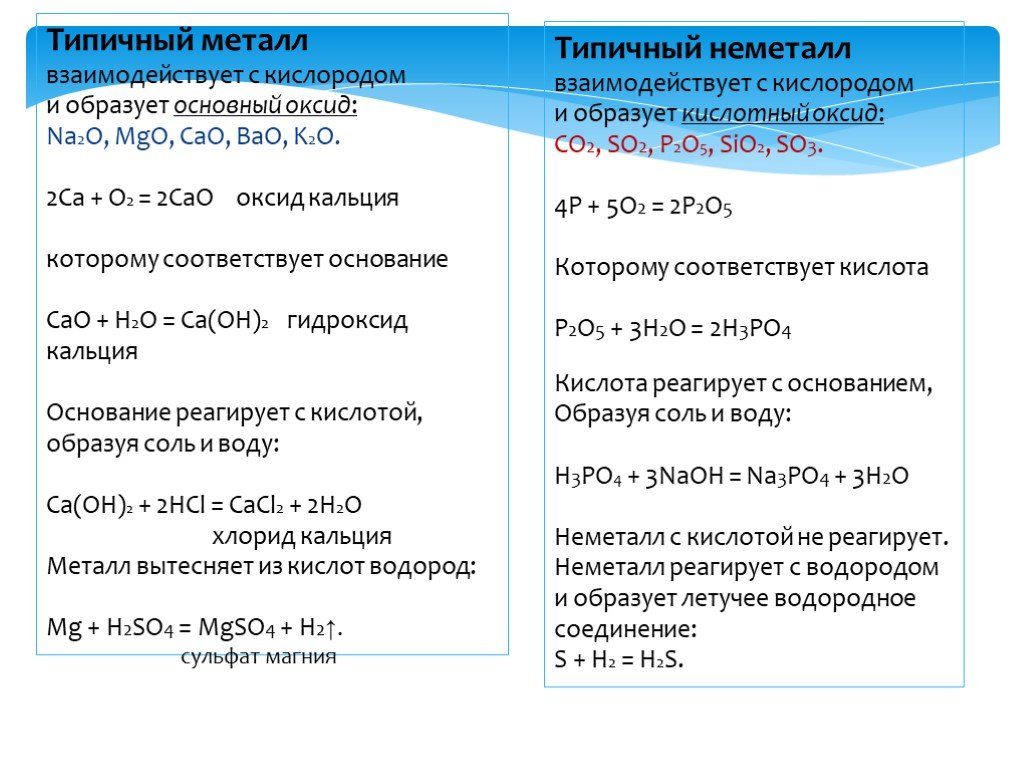
Структурные и оптические свойства наночастиц BaO, синтезированных методом легкого соосаждения
Получено 7 ноября 2020 г., принято 24 февраля 2021 г., доступно в Интернете 3 марта 2021 г. прикладные исследования материалов из-за их большого количества приложений, основанных на его размере и дизайне [1].
Наноматериалы на основе оксидов переходных металлов, например, такие как оксид меди, оксид железа, оксид бария (BaO), оксид олова, оксид цинка, оксид титана и т. д., известны как одни из самых богатых семейств наноматериалов благодаря их растущему изучению и гибким применениям [ 1–9], свойства материалов которых зависят от размера по сравнению с их объемными фазами, что делает их широко используемыми в различных областях, таких как датчики, исполнительные механизмы, высокотемпературные сверхпроводники, конденсаторы, науки об окружающей среде, биомедицинские науки, литий-ионные батареи, солнечные элементы и т. д. В этой области было проведено обширное исследование и опубликовано в литературе из-за широкого диапазона применений этого типа материала.
Среди всех нескольких других наноматериалов на основе оксидов металлов BaO представляет собой полупроводниковый наноматериал с прямой запрещенной зоной, группы II–VI, имеющий уникальное значение благодаря своей широкой запрещенной зоне (4,4 эВ [10]) и гигроскопическим характеристикам, а также широким применениям, таким как само- очистка [11], производство электроэнергии [11], датчики и исполнительные механизмы [12–14], фармацевтическая промышленность [15], катализаторы [1,16]. Помимо этого, BaO был замечен в значительной степени полезным в электронной полевой эмиссии [10], сохранении и восстановлении культурного наследия, такого как бумажные артефакты и настенные росписи [17,18], диагностической визуализации, ортопедических лекарствах и других биомедицинских применениях [19].–21].
До сих пор было разработано несколько способов получения наночастиц BaO (BaO-NPs) для производства наноматериалов различных размеров и форм, таких как золь-гель, химический метод, гидротермальное, термическое разложение, сонохимическое, микроволновое облучение и быстрое осаждение, и др. [17,18,22,23–28]. Среди этих методов подготовки метод соосаждения приобрел большую популярность в промышленности благодаря простому способу синтеза, низкой температуре и энергии, рентабельному и недорогому подходу для хорошего выхода и крупномасштабного производства.
[17,18,22,23–28]. Среди этих методов подготовки метод соосаждения приобрел большую популярность в промышленности благодаря простому способу синтеза, низкой температуре и энергии, рентабельному и недорогому подходу для хорошего выхода и крупномасштабного производства.
Структурные и оптические свойства полупроводниковых наночастиц вызывают все большее беспокойство. В целом физические свойства наночастиц существенно зависят от их микроструктуры, такой как кристаллические дефекты, границы зерен, а также морфология поверхности. Поэтому, чтобы хорошо понять физические свойства НЧ BaO, зависящие от размера, важно получить знания об их микроструктуре [1, 17, 18, 22, 23–28].
В этой статье представлен простой синтез и характеристика наночастиц BaO, полученных с помощью нового экономически эффективного способа соосаждения. Затем структурные и оптические свойства подготовленных наночастиц были проанализированы с помощью различных методов характеризации, таких как рентгеновская дифракция (XRD), сканирующая электронная микроскопия (SEM), спектр рентгеновского излучения с энергетической дисперсией (EDS), инфракрасное преобразование Фурье (FTIR), УФ. –Вис и пл. Наконец, были представлены и обсуждены важные результаты.
–Вис и пл. Наконец, были представлены и обсуждены важные результаты.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материалы и процесс синтеза
Нитрат бария [Ba(NO 3 ) 2 ] (Sigma-Aldrich, Индия, 98%) и бикарбонат натрия (NaHCO 3 ) (Merck, Индия, 98%) использовали в качестве прекурсор и топливо соответственно для синтеза НЧ BaO. BaO-NP были получены с помощью простого метода соосаждения. Схема процедуры синтеза показана на рисунке 1. В типичном синтезе 0,5 М Ba(NO 3 ) 2 растворяли в 100 мл деионизированной воды (H 2 O), которую непрерывно перемешивали с использованием магнитной мешалки в течение приблизительно 30 минут до полного растворения Ba(NO 3 ) 2 . Предварительно приготовленный раствор NaHCO 3 добавляли по каплям в раствор Ba(NO 3 ) 2 при интенсивном перемешивании. Приблизительно через 2 часа непрерывного перемешивания полностью образуется реакционная смесь белого цвета. Полученную смесь выдерживали 12 ч для осаждения всех входящих в ее состав частиц. Осажденный материал многократно промывали и центрифугировали в дистиллированной воде и спирте для удаления нативных примесей из образца. Далее осадок высушивали и прокаливали при 400–500°С в течение 4 ч на воздухе, чтобы убедиться, что Ba(HCO 3 ) 2 полностью превратился в BaO. Все реакции могут быть представлены ниже:
Полученную смесь выдерживали 12 ч для осаждения всех входящих в ее состав частиц. Осажденный материал многократно промывали и центрифугировали в дистиллированной воде и спирте для удаления нативных примесей из образца. Далее осадок высушивали и прокаливали при 400–500°С в течение 4 ч на воздухе, чтобы убедиться, что Ba(HCO 3 ) 2 полностью превратился в BaO. Все реакции могут быть представлены ниже:
Ba(NO 3 ) 2 (водн.) + 2NaHCO 3 (водн.) → Ba(HCO 3 ) 2 (водн.) + 2NANO 3 (вод.)
BA (HCO 3 ) 2 → BAO + 2CO 2 ↑ + H 2 O ↑ (кальцификация)
Рисунок 1
SCHEMATC Наночастицы BaO.
2.2. Характеристика
Структурная характеристика фазы и кристалличности только что синтезированных НЧ BaO была выполнена с использованием метода XRD (Rigaku-Miniflex, Япония, рентгеновский дифрактометр) с использованием излучения Cu K α ( λ = 1,5406 Å) в 2 θ диапазон 20–80°. Морфологию свежеприготовленных НЧ наблюдали с помощью полевой эмиссии (FE)-SEM FEI (Field Electron and Ion Company). Для анализа химического состава полученных наночастиц использовали ИК-Фурье-спектроскопию (PerkinElmer, США) в диапазоне 400–4000 см –1 . UV-Vis (PerkinElmer) использовали для получения спектров поглощения НЧ в диапазоне от 200 до 800 нм при комнатной температуре. Спектры ФЛ записывали на флуоресцентном спектрофотометре Varian Carry Eclipse (Agilent, Калифорния, США).
Морфологию свежеприготовленных НЧ наблюдали с помощью полевой эмиссии (FE)-SEM FEI (Field Electron and Ion Company). Для анализа химического состава полученных наночастиц использовали ИК-Фурье-спектроскопию (PerkinElmer, США) в диапазоне 400–4000 см –1 . UV-Vis (PerkinElmer) использовали для получения спектров поглощения НЧ в диапазоне от 200 до 800 нм при комнатной температуре. Спектры ФЛ записывали на флуоресцентном спектрофотометре Varian Carry Eclipse (Agilent, Калифорния, США).
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Структурно-морфологические свойства
3.1.1. Рентгеновская дифракция
Фазу и кристалличность свежесинтезированных НЧ BaO определяли с использованием метода РФА с излучением Cu K
 Наблюдаемые результаты также подтверждаются литературными данными [23,26,28]. Острые и интенсивные пики указывают на то, что синтезированные наночастицы имеют высокую степень кристалличности по своей природе. Средний размер кристаллитов ( D ) образца рассчитывается по формуле Дебая-Шеррера [29], которая может быть представлена в виде:
Наблюдаемые результаты также подтверждаются литературными данными [23,26,28]. Острые и интенсивные пики указывают на то, что синтезированные наночастицы имеют высокую степень кристалличности по своей природе. Средний размер кристаллитов ( D ) образца рассчитывается по формуле Дебая-Шеррера [29], которая может быть представлена в виде:D=Kλβ cosθ (1) [29]
где К — коэффициент формы (0,90), λ
— длина волны излучения Cu K α ( λ = 1,5406 Å), β — полная ширина на полувысоте, θ — угол дифракции. Установлено, что средний размер зерна НЧ BaO составляет ~16 нм.Рисунок 2
Рентгенограмма наночастиц BaO в свежем виде.
3.1.2. Сканирующая электронная микроскопия
Морфология синтезированных НЧ BaO была оценена методом FE-SEM и представлена на рис. 3a и 3b. На рисунке 3а показано изображение с низким разрешением (1500) приготовленных НЧ BaO, которое демонстрирует морфологию кластеров в форме цветка. СЭМ-изображение высокого разрешения, представленное на рисунке 3b, показывает, что синтезированные наноматериалы выращены с высокой степенью кристалличности. Также из СЭМ-изображений видно, что некоторые НЧ находятся в виде наностержней и нанолистов, подобных структурам, и соединены скоплением друг над другом. Элементный состав синтезированных НЧ оценивали с помощью ЭДС, интегрированной в РЭМ. Спектры ЭДС подтвердили химическую чистоту синтезированных НЧ BaO.
СЭМ-изображение высокого разрешения, представленное на рисунке 3b, показывает, что синтезированные наноматериалы выращены с высокой степенью кристалличности. Также из СЭМ-изображений видно, что некоторые НЧ находятся в виде наностержней и нанолистов, подобных структурам, и соединены скоплением друг над другом. Элементный состав синтезированных НЧ оценивали с помощью ЭДС, интегрированной в РЭМ. Спектры ЭДС подтвердили химическую чистоту синтезированных НЧ BaO.
Рисунок 3
СЭМ-изображения наночастиц BaO (а) при малом увеличении (б) при большом увеличении.
3.1.3. Инфракрасное преобразование Фурье
Анализ химического состава приготовленных НЧ BaO был выполнен с помощью FTIR в диапазоне волновых чисел 4000–400/см, и полученные результаты представлены на рисунках 4a и 4b. FTIR-спектр представляет собой интенсивную полосу поглощения при ~692 см -1 , которая соответствует образованию связи Ba-O. Слабая полоса поглощения при ~615 см -1 также наблюдается из-за валентной вибрации Ba-O.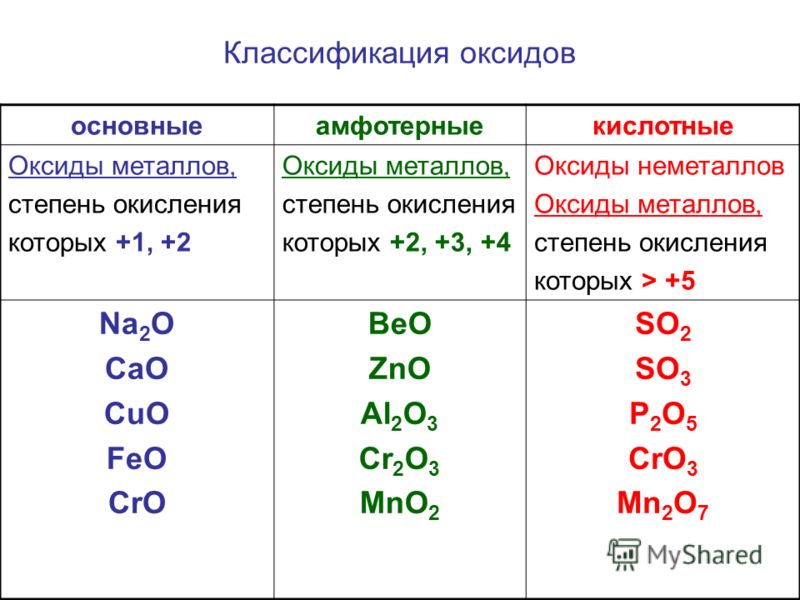 Две полосы поглощения, наблюдаемые при ~1754 и ~3456 см -1 в FTIR-спектрах, связаны с модами валентных и деформационных колебаний O-H соответственно. Пик при ~1455 см -1 может быть связан с образованием карбоната бария в результате поглощения атмосферного CO 2 НЧ BaO. Пик на ~1059 см -1 связан с валентными модами колебаний О-О [30]. Два пика при ~857 и ~2452 см −1 связаны с асимметричными модами колебаний ионов NO 3 −1 и колебания связи –CO 2 соответственно [28,31,32].
Две полосы поглощения, наблюдаемые при ~1754 и ~3456 см -1 в FTIR-спектрах, связаны с модами валентных и деформационных колебаний O-H соответственно. Пик при ~1455 см -1 может быть связан с образованием карбоната бария в результате поглощения атмосферного CO 2 НЧ BaO. Пик на ~1059 см -1 связан с валентными модами колебаний О-О [30]. Два пика при ~857 и ~2452 см −1 связаны с асимметричными модами колебаний ионов NO 3 −1 и колебания связи –CO 2 соответственно [28,31,32].
Рисунок 4
(a) FTIR-спектр наночастиц BaO и (b) увеличенный вид спектра между областью 400 и 800 см . Никакой другой полосы поглощения, связанной с какой-либо другой химической группой, в спектрах FTIR не обнаружено, что указывает на высокую чистоту синтезированного образца НЧ BaO.
3.2. Оптические свойства
3.2.1. УФ-видимая спектроскопия
Оптические свойства синтезированных BaO-NP были исследованы с помощью УФ-видимой спектроскопии, и спектр поглощения, полученный при комнатной температуре, показан на рисунке 5. Последующая процедура измерения была описана в литературе [31,32].
Последующая процедура измерения была описана в литературе [31,32].
Рисунок 5
Спектры оптического поглощения только что синтезированных наночастиц BaO.
Наибольшее поглощение света было отмечено при 310 нм, что известно как характерный край или пик BaO, как сообщается во многих источниках [1,23,28]. Другого пика поглощения в спектрах не обнаружено, что подтверждает наличие сильных оптических свойств синтезированных НЧ BaO.
Ширина запрещенной зоны оптической энергии ( E g ) приготовленных НЧ BaO была рассчитана по соотношению Тауца [33,34], которое обеспечивает связь между энергией падающего фотона и коэффициентом поглощения полупроводниковые материалы. Уравнение Тауца можно представить в виде:
(αhv)=A(hυ−Eg)n (2)
где A — постоянная α — коэффициент оптического поглощения, hυ — энергия фотона (где h — постоянная Планка, υ — оптическая частота), E g — энергия оптической запрещенной зоны, а n — показатель степени, его математическое значение в значительной степени зависит от природы электронного перехода, вызывающего поглощение света обычно n принимается равным 2 и 1/2 и для непрямой и прямой запрещенной зоны соответственно.
На рис. 6 показан график Тауца для НЧ BaO. Рассчитанная энергия оптической запрещенной зоны ( E г ) свежеприготовленных НЧ BaO составляла 4,65 эВ. Измеренное E г очень близко к объемной фазе BaO и согласуется с ранее опубликованными литературными данными [1,23,28]. Ширина запрещенной зоны нанофазы BaO, т.е. 4,65 эВ, оказалась выше, чем у объемной фазы BaO, т.е. 4,4 эВ [10]. Это увеличение энергии оптической запрещенной зоны происходит из-за в первую очередь известного квантово-размерного эффекта нанофазных материалов. Эта теория (квантово-размерный эффект) применима только тогда, когда размер частиц сравним с длиной волны де Бройля носителя заряда и находится в ее пределах (т. е. в нанометровом диапазоне).
Рисунок 6
График Тауца для расчета ширины запрещенной зоны наночастиц BaO в свежем виде.
3.2.2. Спектроскопия фотолюминесценции
Фотолюминесценция (ФЛ) – это процесс спонтанного излучения света материалом образца при оптическом возбуждении. Энергия и интенсивность возбуждения могут быть выбраны для исследования различных типов возбуждения, определения ширины запрещенной зоны, идентификации специфических дефектов радиационных переходов и уровней примесей в образце наноматериала. Фотолюминесцентная спектроскопия является методом неразрушающего анализа [6,35–37].
Энергия и интенсивность возбуждения могут быть выбраны для исследования различных типов возбуждения, определения ширины запрещенной зоны, идентификации специфических дефектов радиационных переходов и уровней примесей в образце наноматериала. Фотолюминесцентная спектроскопия является методом неразрушающего анализа [6,35–37].
Спектр фотолюминесценции НЧ BaO был получен при длине волны возбуждения 230 нм и показан на рисунке 7. Спектр показывает две основные полосы излучения (сине-фиолетовую и красную). Всего обнаружено три пика: острый эмиссионный пик при 380 нм, широкий пик при 410–574 нм может быть следствием дефектов в кристалле BaO, а пик при 758 нм может быть следствием дефектов кристалла BaO. за счет рекомбинации пары e–h. Результаты оптических измерений УФ-видимого и ФЛ-анализа показывают, что можно ожидать, что синтезированные НЧ BaO будут очень полезными для оптоэлектронных и фотонных систем и устройств.
Рисунок 7
Спектр фотолюминесценции наночастиц BaO.
4. ЗАКЛЮЧЕНИЕ
Высококристаллические НЧ BaO были успешно синтезированы простым методом соосаждения и подробно проанализированы с помощью различных методов анализа материалов. Результаты структурно-химического анализа показывают чистую и высококристаллическую тетрагональную фазу НЧ BaO. Установлено, что средний размер зерна НЧ BaO составляет ~16 нм. Морфологический анализ образца методом FE-SEM подтвердил, что наночастицы выросли в высокой кристаллической форме. Также некоторые НЧ находятся в наностержнях и нанолистоподобных структурах и соединяются скоплением друг над другом. УФ-видимая спектроскопия подтвердила значительные оптические свойства образца и расчетную оптическую ширину запрещенной зоны ( E g ) НЧ BaO составляла 4,65 эВ, что было обнаружено очень близко к объемной фазе BaO. Сильный эмиссионный спектр ФЛ в видимом диапазоне, создающий только что синтезированные НЧ BaO, можно считать очень полезным в оптоэлектронных и фотонных системах и устройствах. Следующий метод синтеза также можно использовать при получении других наноматериалов оксидов переходных металлов.
Следующий метод синтеза также можно использовать при получении других наноматериалов оксидов переходных металлов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ВКЛАД АВТОРОВ
Нью-Джерси внес свой вклад в концептуализацию и подготовку всех графиков. MAA провела эксперимент и написала первоначальный проект.
БЛАГОДАРНОСТЬ
Авторы выражают благодарность Институту керамической и полимерной инженерии Университета Мишкольца, Венгрия, за лаборатории и ценную техническую поддержку.
ССЫЛКИ
[1] Р. Ренукадеви, Р. Сундарам и К. Касинатан, Наночастицы оксида бария с сильными каталитическими, фотокаталитическими свойствами и свойствами определения влажности, J Nanostruct, Vol. 10, 2020, стр. 167-76.
[2]D Maity и DC Agrawal, Синтез наночастиц оксида железа в окислительной среде и их стабилизация в водных и неводных средах, J Magn Magn Mater, Vol. 308, 2007, стр. 46-55.
[3] P Guardia, N Pérez, A Labarta и X Batlle, Контролируемый синтез наночастиц оксида железа в широком диапазоне размеров, Langmuir, Vol. 26, 2010, стр. 5843-7.
26, 2010, стр. 5843-7.
[4] L Wang и M Muhammed, Синтез наночастиц оксида цинка с контролируемой морфологией, J Mater Chem, Vol. 9, 1999, стр. 2871-8.
[5] М. Эль-Хофи и А. Салама, Синтез и характеристика наночастиц ZnO с дефектом Ba, DJ Fisher (редактор), Форум по дефектам и диффузии, Vols. 280–281, Trans Tech Publications Ltd, Швейцария, 2008 г., стр. 1–8.
[6] Н. Мохамед Басит, Дж. Джудит Виджая, Л. Джон Кеннеди и М. Буудина, Структурные, морфологические, оптические и магнитные свойства наноструктур CuO, легированных никелем, полученных методом быстрого микроволнового сжигания, Mater Sci Semiconduct Process, Vol. . 17, 2014, стр. 110-18.
[7] А. Шарма, К. Шринивас, В. Гупта и М. Томар, Обнаружение следовых количеств газа NO2 при комнатной температуре с использованием нанокластеров SnO2, IEEE, 2011 IEEE Sensors Applications Symposium (Сан-Антонио, Техас, США, 2011), стр. 145-8.
[8] YJ Chen, CL Zhu, LJ Wang и TH Wang, Однореакторный синтез кристаллических наночастиц SnO2 и их низкотемпературные характеристики восприятия этанола, Sci China Ser G: Phys Mech Astron, Vol. 52, 2009, стр. 1601-5.
52, 2009, стр. 1601-5.
[9] Р. Санкар, К. Ризвана, К. С. Шивашангари и В. Равикумар, Сверхбыстрая фотокаталитическая активность коллоидных наночастиц диоксида титана, сконструированных Azadirachta indica, Appl Nanosci, Vol. 5, 2015, стр. 731-6.
[10]Y Cui, J Chen, Y Zhang, X Zhang, W Lei, Y Di, et al., Улучшенные характеристики полевой эмиссии с термоассистированием электронов на основе нанопроволоки из оксида бария, Appl Surf Sci, Vol. 396, 2017, стр. 1108-12.
[11] А. Умар и Ю. Б. Хан, Наноструктуры оксидов металлов и их применение, American Scientific Publishers, Лос-Анджелес, США, 2010. для фотокаталитических, антибактериальных и чувствительных к влажности приложений, Int J Tech Inn Mod Engg Sci, Vol. 5, 2019, стр. 35-42.
[13] Р. Ренукадеви и Р. Сундарам, Синтез, характеристика, определение влажности, антибактериальные, фотокаталитические и кинетические исследования новых нанокомпозитов HgWO4–WO3, Mater Today Proc, Vol. 8, 2019, стр. 153-61.
[14] Y Zhang, Y Hou, W Liu, H Zhang, Y Zhang, Z Zhang и др. , Экономичный датчик относительной влажности, основанный на технологии боковой индукции, Sensors (Basel), Vol. 17, 2017, pp. 944.
, Экономичный датчик относительной влажности, основанный на технологии боковой индукции, Sensors (Basel), Vol. 17, 2017, pp. 944.
[15] VR Choudhary, R Jha и P Jana, Эпоксидирование стирола с помощью TBHP до оксида стирола с использованием оксида бария в качестве высокоактивного/селективного твердого катализатора многократного использования, Green Chem, Vol. 8, 2006, стр. 689-90.
[16] Л. Ян, Ю. М. Чой, В. Цинь, Х. Чен, К. Блинн, М. Лю и др., Продвижение водоопосредованного удаления углерода с помощью наноструктурированных поверхностей оксида бария/никеля в твердооксидных топливных элементах, Nat Commun, Том. 2, 2011, стр. 357.
[17] Э. Кордонсильо, Т. Р. Мачадо, Л. Феррацца и Д. Хуанес, Синтез и характеристика наноструктурированных растворов BaO: применение в консервации настенных росписей, М. Иоаннидес, Д. Фрич, Дж. Лейсснер, Р. Дэвис, Ф. Ремондино и Р. Каффо (редакторы), «Прогресс в сохранении культурного наследия», Springer, Берлин, Гейдельберг, на Евро-средиземноморской конференции, 2012 г.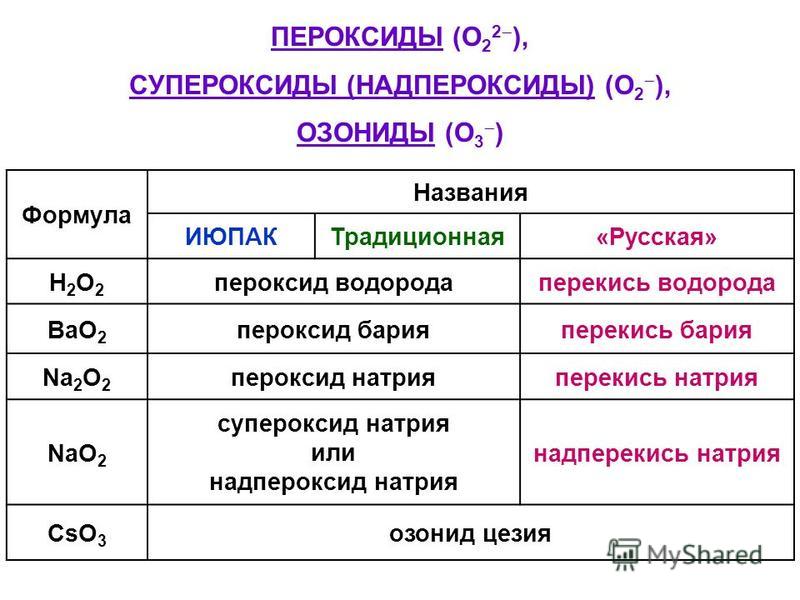 , стр. 801-8.
, стр. 801-8.
[18] К. М. Сауд, И. Ибала, Д. Эль Ладки, О. Эззелдин и С. Саид, Получение наночастиц гидроксида кальция и гидроксида бария с помощью микроволновой печи и их применение для сохранения культурного наследия, М. Иоаннидес, Н. Магненат-Тальманн, Э. Финк, Р. Жарнич, А.Ю. Йен и Э. Квак (редакторы), Digital Heritage. Прогресс в области культурного наследия: документация, сохранение и защита, Спрингер, Чам, на Евро-средиземноморской конференции, 2014 г., стр. 342-52.
[19] С. Аларифи, Д. Али и В. Аль-Бишри, Апоптотический и ДНК-повреждающий потенциал оксида нанобария in vitro, Int J Nanomedicine, Vol. 11, 2016, стр. 249-57.
[20] R Gillani, B Ercan, A Qiao и TJ Webster, Нанофункционализированные частицы циркония и сульфата бария в качестве добавок к костному цементу, Int J Nanomedicine, Vol. 5, 2010, стр. 1-11.
[21] М. Хираока, К. Икеда и Т. Сано, Механизм индуцированного барием автоматизма в желудочковых мышечных волокнах, Adv Myocardiol, Vol. 1, 1980, стр.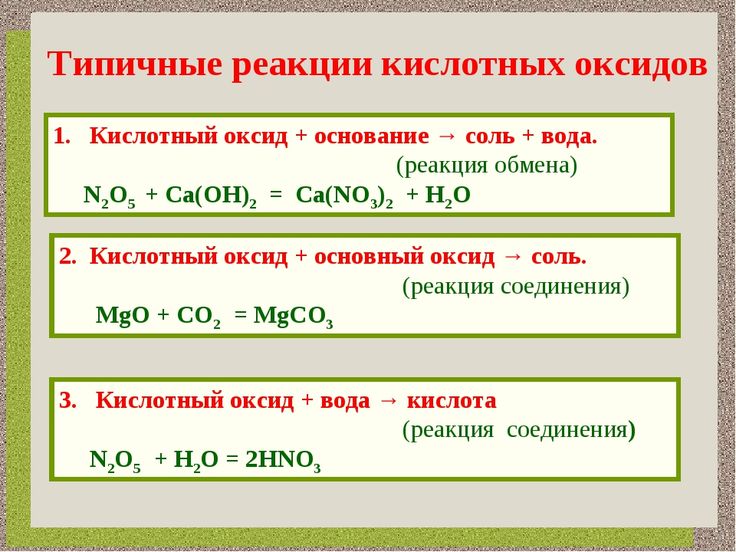 255-66.
255-66.
[22] А. Зинат Базира и М. Ирфана Амрин, Синтез и характеристика наночастиц оксида бария, IOSR J Appl Phys, Vol. 3, 2017, стр. 76-80.
[23] Н. Ахмад, Р. Вахаб и М. Алам, Легкий рост наностержней оксида бария: структурные и оптические свойства, J Nanosci Nanotechnol, Vol. 14, 2014, стр. 5342-6.
[24] RHP Devamani и M Alagar, Синтез и характеристика наночастиц гидроксида бария, Asian Acad Res J Multidicular, Vol. 1, 2014, стр. 60-75.
[25] А. О. Муса, Н. А. Нема и Х. Х. Хасан, Влияние отжига на тонкие пленки оксида бария (BaO), полученные методом химического пиролиза распылением (CSP), J Chem Pharm Res, Vol. 8, 2016, стр. 832-40.
[26] Г. Суреш и П. Н. Нирмала, Синтез наностержня оксида бария путем химического осаждения в ванне, Turk J Phys, Vol. 36, 2012, стр. 392-7.
[27] С. Прабхавати, Дж. Пунита, П. С. Раджам, Р. Ранджит, Г. Суреш, Н. Мала и др., Простые методы синтеза наночастиц оксида меди, оксида цинка, оксида свинца и оксида бария, J Chem Pharm Res, Том. 6, 2014, стр. 1472-8.
6, 2014, стр. 1472-8.
[28]E Sundharam, AKS Jeevaraj, and C Chinnusamy, Влияние ультразвука на синтез наночастиц оксида бария, J Bionanosci, Vol. 11, 2017, стр. 310-14.
[29] DP Dubal, GS Gund, CD Lokhande и R Holze, Цветная капуста CuO для применения в суперконденсаторах: новое потенциодинамическое осаждение, Mater Res Bull, Vol. 48, 2013, стр. 923-8.
[30] S Abramowitz и N Acquista, Инфракрасный спектр матрично изолированного BaO2, J Res Natl Bur Stand A, Vol. 75, 1971, стр. 23-5.
[31] М.С. Чаухан, Р. Кумар, А. Умар, С. Чаухан, Г. Кумар, М. Фейсал и др., Использование наноконусов ZnO для фотокаталитического разложения акридинового оранжевого, J Nanosci Nanotechnol, Vol. 11, 2011, стр. 4061-6.
[32] R Wahab, YS Kim, DS Lee, JM Seo и HS Shin, Контролируемый синтез наноигл оксида цинка и их преобразование в микроцветы, Sci Adv Mater, Vol. 2, 2010, стр. 35-42.
[33] Q Xiang, J Yu, W Wang и M Jaroniec, Самолегированные азотом наноразмерные листы TiO2 с открытыми гранями {001} для повышения фотокаталитической активности в видимом свете, Chem Commun (Camb), Vol. 47, 2011, стр. 6906-8.
47, 2011, стр. 6906-8.
[34] W Zhao, X Song, Z Yin, C Fan, G Chen и S Sun, Самосборка нанолистов ZnO в наноцветы при комнатной температуре, Mater Res Bull, Vol. 43, 2008, стр. 3171-6.
[35] YC Zhang, JY Tang, GL Wang, M Zhang и XY Hu, Легкий синтез субмикронных кристаллитов Cu2O и CuO из твердого металлоорганического молекулярного предшественника, J Cryst Growth, Vol. 294, 2006, стр. 278-82.
[36]T Yu, X Zhao, ZX Shen, YH Wu и WH Su, Исследование отдельных наностержней CuO методом поляризованного микрорамановского рассеяния, J Cryst Growth, Vol. 268, 2004, стр. 590-5.
[37] С. Аль-Амри, М. Шахнавазе Ансари, С. Рафик, М. Альдхахри, С. Рахимуддин, А. Азам и др., Наночастицы CuO, легированные никелем: структурные и оптические характеристики, Curr Nanosci, Vol. 11, 2015, стр. 191-7.
Dr. Lipiao Bao › Университет Фридриха-Александра Эрланген-Нюрнберг
Как научный сотрудник Александра фон Гумбольдта, он продолжит свои исследования на кафедре органической химии II в FAU. (Изображение: доктор Ванчжэн Чжан)
(Изображение: доктор Ванчжэн Чжан)30 марта 2018 г.
Углеродные нанотрубки и изучение их химических свойств
С 2007 по 2011 год доктор Бао учился в Хуачжунском университете науки и технологии, Китай, где успешно получил степень бакалавра в области материаловедения. После этого он защитил докторскую диссертацию. в области материаловедения, которую он закончил с отличием в 2016 году. За это время доктор Бао провел один год в Калифорнийском университете в Дэвисе в качестве доктора философии. Студент. В качестве научного сотрудника Александра фон Гумбольдта он продолжит свои исследования на кафедре органической химии II в ФАУ, где его будет контролировать заведующий кафедрой профессор доктор Андреас Хирш.
Научные интересы доктора Липиао Бао сосредоточены, среди прочего, на химии и материаловедении аллотропов углерода, синтезе и разделении новых фуллеренов, а также их структуре, свойствах и применении, инженерии кристаллов и структурном программировании молекул.
Какова область ваших исследований и что изначально вызвало у вас интерес к этой области?FAU — известный университет, и мои друзья, которые учились или работали здесь, высоко отзываются о FAU.
Мои исследования сосредоточены на новых аллотропах углерода, таких как фуллерен и углеродные нанотрубки. Углеродные аллотропы, такие как фуллерен, графен и углеродные нанотрубки, обладают выдающимися физическими свойствами. Их применение разнообразно, например, их можно использовать в области электроники, материаловедения и преобразования энергии. Я хотел бы поблагодарить моего научного руководителя профессора Син Лу за то, что он показал мне идеальные сферические структуры фуллеренов, которые вызвали у меня большой интерес.
FAU — известный университет, и мои друзья, которые учились или работали здесь, высоко отзываются о FAU. Кроме того, группа профессора Хирша в FAU является одной из ведущих групп в области моих исследований, и для меня большая честь продолжать свои исследования здесь.
Кроме того, группа профессора Хирша в FAU является одной из ведущих групп в области моих исследований, и для меня большая честь продолжать свои исследования здесь.
Как я уже упоминал, профессор Хирш, заведующий кафедрой органической химии II в FAU и являющийся моим руководителем, является пионером в области моих исследований и внес значительный вклад в эту область.
Как вы находите взаимодействие между исследователями FAU до сих пор?В FAU мы много обсуждаем и сотрудничаем, чтобы проводить исследования, и, на мой взгляд, это то, как исследования должны проводиться.
Не могли бы вы вкратце рассказать о проекте, над которым работает ваша исследовательская группа? Моя исследовательская группа в FAU нацелена на передовые исследования аллотропов синтетического углерода, полициклических ароматических углеводородов и супрамолекулярной химии. В частности, глубоко изучены их синтез, конструкция, свойства и многостороннее потенциальное применение.
В частности, глубоко изучены их синтез, конструкция, свойства и многостороннее потенциальное применение.
Меня больше всего здесь интересует приготовление коротких углеродных нанотрубок и исследование их химических свойств. Конечная цель состоит в том, чтобы определить их универсальное применение.
Как ваши исследования влияют на общество?Углеродные аллотропы, такие как углеродные нанотрубки и графен, обладают прекрасными физическими свойствами и поэтому их применение в различных областях весьма перспективно, например, в электронных устройствах, которые мы используем в повседневной жизни.
Какими были ваши первые и последующие впечатления от региона Эрланген-Нюрнберг?Мне нравится это место, где можно не только насладиться современной комфортной жизнью, но и при желании окунуться в историю.
Какие ваши любимые места в FAU и в Эрлангене или Нюрнберге? Мне нравится рождественская ярмарка, где люди вместе празднуют и наслаждаются этим счастливым моментом.

