Химические свойства амфотерных гидроксидов
Амфотерные гидроксиды обладают основными и кислотными свойствами, поэтому для них характерны химические взаимодействия перечисленные выше для кислот и оснований.
Упражнения
1. Среди перечисленных оксидов укажите основные и кислотные: а) оксид кальция; б) оксид серы (VI), в) оксид фосфора (V), г) оксид меди (II), д) оксид железа (II), е) оксид хрома (VI). Напишите формулы гидроксидов, соответствующих этим оксидам.
2. Напишите уравнения реакций между оксидом бария со следующими веществами: а) водой, б) оксидом углерода (IV), в) азотной кислотой, г) соляной кислотой.
3. Напишите уравнения реакций между оксидом серы (VI) и следующими веществами: а) оксидом лития, б) водой, в) оксидом алюминия, г) гидрокисдом натрия.
4.
С какими из перечисленных веществ может
реагировать гидроксид меди (II):
а) азотная кислота, б) кремниевая кислота,
в) хлорид натрия, г) серная кислота.
5. Составьте уравнения реакций в молекулярной и ионной формах между гидроксидом калия и следующими веществами: а) хлоридом железа (III), б) сульфатом меди (II), в) оксидом углерода (IV), г) оксидом фосфора (V), д) оксидом серы (VI).
6. Составьте уравнения реакций, соответствующих следующей цепочке превращений:
Ва → ВаО → Ва(ОН)2 → ВаСО3 → Ва(NО3)2
7. Напишите уравнения реакций между серной кислотой и следующими веществами: а) цинком, б) оксидом кальция, в) карбонатом магния, г) оксидом железа (III).
8. В трех пробирках имеются растворы веществ: соляной кислоты, серной кислоты, гидроксида натрия. Предложите способ, при помощи которого можно различить эти растворы.
ЛАБОРАТОРНАЯ РАБОТА
Свойства кислот и оснований
Приборы
и реактивы: 2 н.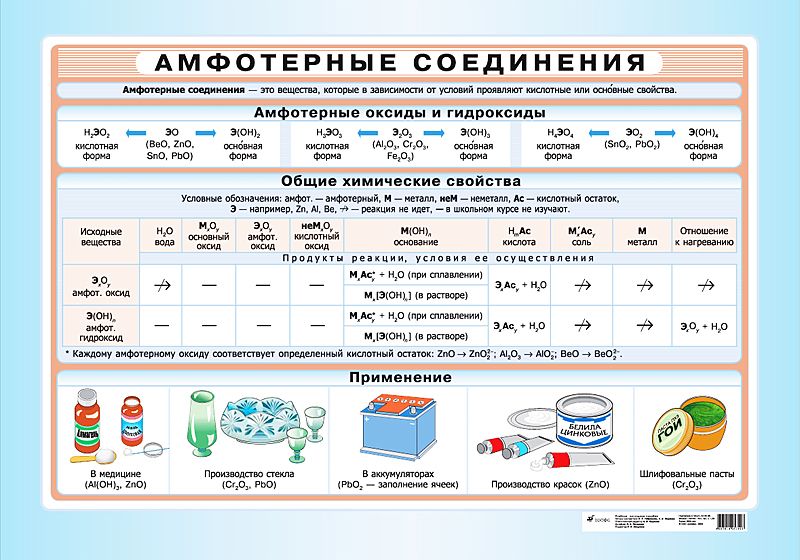
Опыт 1. Открытие катиона водорода в растворе.
В три пробирки налить по 1 мл раствора соляной кислоты. В одну из них добавить 3 – 4 капли лакмуса, в другую – 3 – 4 капли метилоранжа, в третью – столько же фенолфталеина. Отметить изменение окраски индикаторов. (Результаты внести в таблицу).
Опыт 2. Открытие гидроксид-иона в растворе.
В три пробирки налить по 1 мл раствора гидроксида натрия. Затем в каждую из них добавить по 3 – 4 капли растворов лакмуса, метилоранжа, фенолфталеина. Наблюдать изменение окраски индикаторов. (Результаты внести в таблицу.)
Индикатор | HCl | NaOH |
Лакмус | ||
Метилоранж | ||
Фенолфталеин |
Опыт
3. Солеобразование.
Солеобразование.
В фарфоровую чашку налить 1 мл раствора соляной кислоты и столько же по объему раствора гидроксида натрия. Смесь нагреть до полного испарения воды. Остается поваренная соль, убедиться можно по вкусу. Написать уравнение реакции в молекулярной и ионной формах.
Опыт 4. Амфотерность гидроксидов.
В 4 пробирки к 1 мл растворов солей железа (II), цинка, алюминия, меди добавить по каплям раствор гидроксида натрия. Полученные осадки гидроксидов разделить на две части и проверить их растворимость в минеральных кислотах и щелочах. Отметить какие гидроксиды растворяются только в кислотах, какие – в кислотах и щелочах. Составить уравнения реакций в молекулярной и ионной формах.
Получение и изучение химических свойств солей.
Вопросы для подготовки к занятию
1.
Классификация солей: средние, кислые,
основные, двойные, смешанные. Номенклатура.
Номенклатура.
2. Способы получения средних солей.
3. Способы получения основных и кислых солей.
4. Химические свойства.
Cоли
При взаимодействии соединений основного характера с соединениями кислотного характера образуются соли. По составу различают следующие типы солей: средние, кислые и основные соли.
Средняя соль – это продукт полного замещения ионов водорода в молекуле кислоты ионами металла или гидроксогрупп в молекуле основания кислотными остатками. Например, Na2S, CuSO4.
Амфотерные оксиды и гидроксиды — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства.
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
ТЕМА:
АМФОТЕРНЫЕ
ОКСИДЫ И
ГИДРОКСИДЫ
http://linda6035.ucoz.ru/
Вещества — «хамелеоны».
При добавлении к таким веществам кислоты,
они проявляют основные свойства, а при
добавлении к ним щелочи – кислотные
свойства.
Такая кислотно-основная двойственность
химических свойств получила название
«Амфотерность»
http://linda6035.ucoz.ru/
3. Амфотерность
способность соединений проявлятьлибо кислотные либо основные
свойства, в зависимости от того с чем
они реагируют.
http://linda6035.ucoz.ru/
Амфотерный характер носят оксиды
и гидроксиды большинства
переходных элементов и многих
элементов побочных подгрупп.
http://linda6035.ucoz.ru/
5. Амфотерные соединения
К амфотерным соединениям относятоксиды и гидроксиды некоторых
металлов
(в них металл чаще всего имеет
степень окисления +3, чуть реже +2).

http://linda6035.ucoz.ru/
6. Амфотерные оксиды
Из оксидов двойственными свойствамиобладают: оксид бериллия BeO, оксид
цинка ZnO, оксид алюминия Al2O3,
оксид олова(IV) SnO2, оксиды свинца
PbO, PbO2, оксид железа(III) Fe2O3, оксид
хрома (III) Cr2O3 и др.
http://linda6035.ucoz.ru/
7. Химические свойства амфотерных оксидов
При реакции с соляной кислотой оксида цинкаобразуются соль хлорид цинка и вода:
ZnO+2HCl=ZnCl2+h3O
Амфотерный оксид цинка в реакции со щелочью
гидроксидом калия образовал соль цинкат калия и
воду.
ZnO+2KOH=K2ZnO2+h3O
цинкат калия
http://linda6035.ucoz.ru/
8. Амфотерные гидроксиды
http://linda6035.ucoz.ru/Be(OH)2
— гидроксид бериллия
Al(OH)3
— гидроксид алюминия
Zn(OH)2
— гидроксид цинка
Fe(OH)3
— гидроксид железа(III)
9. Физические свойства амфотерных гидроксидов
Амфотерные гидроксиды– это нерастворимые в
воде твердые вещества,
как правило, белого
цвета
http://linda6035.
 ucoz.ru/
ucoz.ru/10. Химические свойства амфотерных гидроксидов
При реакции гидроксида цинка с солянойкислотой образуются соль хлорид цинка и
вода:
Zn(OH)2+2HCl=ZnCl2+2h3O
Амфотерный гидроксид цинка в реакции со
щелочью гидроксидом калия образовал соль
цинкат калия и воду.
Zn(OH)2+2KOH=K2ZnO2+2h3O
http://linda6035.ucoz.ru/
11. Задание
Закончите уравнения реакций:Cr(OH)3 + 6HCl = ?
Cr(OH)3 + NaOH = ?
http://linda6035.ucoz.ru/
12. Какие из групп веществ проявляют амфотерные свойства?
A. Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2B. Fe2O3, Al2O3, Fe(OН)3 , ZnO, Be(OН)2
C. SO3, Cl2O7, WO3, Н2SO4, Н2CrO4
http://linda6035.ucoz.ru/
13. Допишите уравнение реакции: Zn(OH)2 + 2NaOH в результате образуются
A.B.
C.
D.
http://linda6035.ucoz.ru/
Na2ZnO2 + 2h3O
Zn(OH)2 + Na2O
ZnSO4 + 2NaCl
Реакция не идет
http://linda6035.ucoz.ru/
Спасибо
за внимание!
http://linda6035.
 ucoz.ru/
ucoz.ru/http://linda6035.ucoz.ru/
English Русский Правила
Амфотерные гидроксиды — Портал продуктов группы РСС
Термин «гидроксиды» относится к группе неорганических соединений, состоящих из двух твердых частей: катиона металла, например натрия [Na + ], и аниона гидроксида [ОН — ]. Количество гидроксильных групп, существующих в молекуле, равно валентности металла, так как он сам имеет валентность –I.
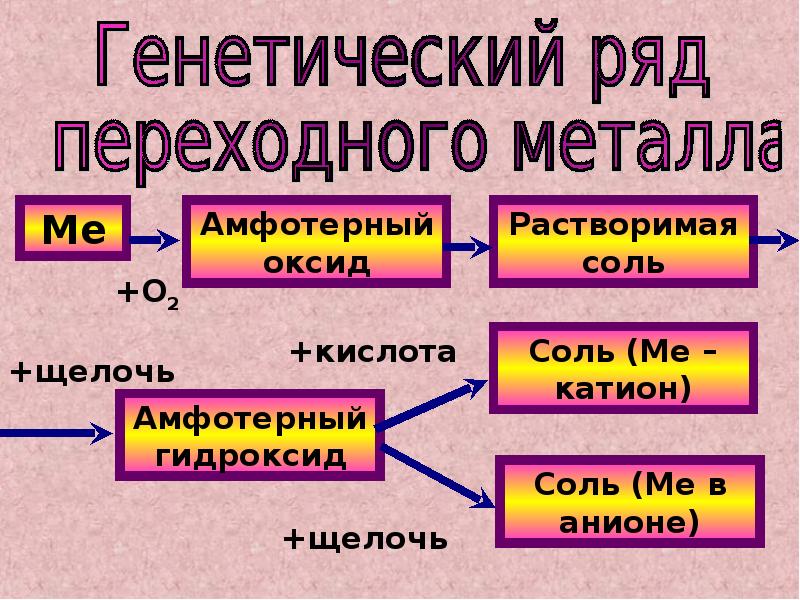
Амфотеризм Амфотеризм – разновидность химического гермафродитизма, который подразумевает, что все, что является амфотерным, может быть связано с проявлением признаков противоположной стороны, что в данном случае означает реакцию данного вещества как с кислотами, так и с с базами. Это означает, что такой гидроксид, помещенный в среду сильного основания, будет реагировать аналогично кислоте. Продуктом этой реакции будет соответствующая соль, кислотный радикал которой будет происходить от амфотерного гидроксида. С другой стороны, если соединение подвергается реакции в сильнокислой среде, оно будет вести себя как основание. Такая реакция будет направлена на получение соединения соли, где катионом будет металл, происходящий из нанесенного гидроксида.
С другой стороны, если соединение подвергается реакции в сильнокислой среде, оно будет вести себя как основание. Такая реакция будет направлена на получение соединения соли, где катионом будет металл, происходящий из нанесенного гидроксида.
Наиболее распространенными амфотерными гидроксидами являются гидроксид алюминия, гидроксид цинка, гидроксид хрома (III) и гидроксид меди (II). Однако их гораздо больше, например гидроксид бериллия, гидроксид свинца или гидроксид сурьмы. Вопреки тенденции такие соединения не являются кристаллическими. Они образуют коллоидные отложения, очень мало растворимые в воде.
Реакции амфотерных гидроксидовВ силу своей природы обсуждаемые соединения вступают в реакции как с сильными кислотами, так и с основаниями. Общее обозначение:
- Амфотерный гидроксид + кислота → соль + вода
- Амфотерный гидроксид + основание → гидроксокомплекс (соль)
В обоих случаях продуктами реакции являются соли, но в реакции с основаниями они представляют собой комплексы, в которых анион также включает металл, происходящий из гидроксида. Пример реакции гидроксида алюминия:
Пример реакции гидроксида алюминия:
- Al(OH) 3 + 3 HCl → AlCl 3 + 3H 2 O
- Al(OH) 3 + NaOH → Na[Al(OH) 4 ]
Самый простой способ определить местонахождение таких соединений в таблице Менделеева — это соотношение между природой оксидов и их положением в таблице. Кислотные свойства оксидов возрастают слева направо, поэтому особенно первая группа имеет склонность к основанию и образует такие оксиды, а продукты реакции с водой являются основными гидроксидами. В крайней правой части, кроме драгоценных газов, период включает некоторые элементы, ориентированные на кислые оксиды. Поскольку оксиды и, следовательно, амфотерные гидроксиды проявляют некоторые свойства каждого из них, можно ожидать, что они будут находиться где-то в промежуточных группах. Следует указать, что доли основных и кислотных признаков в амфотерных оксидах близки.
Начиная с группы 1: натрий при реакции с водой образует сильное основание, а магний, находящийся в следующей группе (2), при реакции с водой также дает основное гидроксид, который, однако, не так силен – это доказывает несколько более высокую долю кислотных свойств Mg по сравнению с Na. Другой элемент из группы 13 — алюминий, который проявляет еще иные свойства: при контакте с водой его оксид образует гидроксид, который является очень слабым основанием, но он также реагирует с сильными основаниями по тому же механизму, что и типичные кислоты. В группу 14 входят такие элементы, как кремний, оксид которого реагирует только с основаниями, а значит, его кислотные свойства преобладают над основными свойствами. Для сравнения, в соединении кислорода и алюминия доли этих свойств очень близки, что позволяет ему модифицировать и подстраивать свою реакцию на текущую среду. Аналогично в группах 15 и 16, где фосфор, например, образует кислотные оксиды и проявляет очень малую долю основных свойств, а следующий элемент (сера) их практически не имеет.
Положение элемента относительно группы указывает также на его электроотрицательность, которая растет вместе с уменьшением периодов. Для общего сведения неметаллический бор образует оксид, имеющий кислотный характер, тогда как алюминий, расположенный под ним, способен реагировать как с сильными основаниями, так и с сильными кислотами, а последующие элементы галлия, индия и таллия также образуют постоянно больше основных оксидов в соответствии с тенденцией силы металлического характера. Оксид таллия (Tl 2 О) уже является полностью основным, и его доля кислотных свойств в реакции незначительна.
Влияет ли электроотрицательность на характер соединений кислорода? Если мы посмотрим на амфотерные оксиды, то легко заметим, что разница в электроотрицательности элементов, из которых они состоят, колеблется в районе 1,4–2,0, а доли поляризованных и ионных ковалентных связей близки. На практике амфотерность соединения определяется путем электролитической диссоциации, и при такой одинаковой электроотрицательности между металлом и кислородом, а также для связи гидроксильной группы мы можем иметь два отдельных пути, аналогичных диссоциации сильное основание и кислота. Это означает, что в кислой среде они диссоциируют на катион металла и ОН – анионов, а если среда основная, то в металлический анион MOn n- и катионы H 3 O + .
На практике амфотерность соединения определяется путем электролитической диссоциации, и при такой одинаковой электроотрицательности между металлом и кислородом, а также для связи гидроксильной группы мы можем иметь два отдельных пути, аналогичных диссоциации сильное основание и кислота. Это означает, что в кислой среде они диссоциируют на катион металла и ОН – анионов, а если среда основная, то в металлический анион MOn n- и катионы H 3 O + .
Зависимость между степенью окисления элемента и его характером возрастает в сторону кислотности. Это означает, что чем ниже степень окисления, тем выше склонность элемента к щелочности. Для многовалентных веществ, таких как хром или марганец, можно наблюдать двунаправленный характер. Марганец с возможными валентностями II, III, IV, V, VI и VII демонстрирует широкий спектр свойств. Средняя валентность (IV) предполагает амфотеризм, более низкие валентности показывают основной характер, тогда как более высокие валентности показывают все более высокую долю кислотного характера. Так, оксид марганца в седьмой степени окисления при взаимодействии с водой будет давать довольно сильную кислоту (HMnO 4 ). Для сравнения взглянем на оксиды марганца и меди (входят в одну группу): оксид меди — CuO — расположен справа от марганца, проявляет более сильный кислотный характер. Однако, поскольку марганец склонен к изменению доли индивидуальных свойств, при степени окисления III (Mn 2 O 3 ) его кислотность уже близка к CuO.
Так, оксид марганца в седьмой степени окисления при взаимодействии с водой будет давать довольно сильную кислоту (HMnO 4 ). Для сравнения взглянем на оксиды марганца и меди (входят в одну группу): оксид меди — CuO — расположен справа от марганца, проявляет более сильный кислотный характер. Однако, поскольку марганец склонен к изменению доли индивидуальных свойств, при степени окисления III (Mn 2 O 3 ) его кислотность уже близка к CuO.
Определение амфотерности в химии.
(прилагательное)
Имеющие характеристики как кислоты, так и основания и способные вступать в реакцию как с тем, так и с другим; амфипротный.
(прилагательное)
Имеющие характеристики как кислоты, так и основания; способны как отдавать, так и принимать протон (амфипротоны).
(существительное)
Молекула, которая может действовать как кислота или основание в зависимости от ее химического окружения. Например, вода (H 2 O) амфотерна.
Растворимость амфотерных гидроксидов металлов
- Амфотерные гидроксиды металлов ведут себя как основания и кислоты, растворяясь в избытке щелочи.
- Оксиды и гидроксиды металлов группы 3 и выше, как правило, слабоосновные и в основном проявляют амфотерную природу.
- Амфотерное вещество — это вещество, которое может действовать как кислота или основание.
- Примером амфотерного соединения, которое не является амфипротонным, является ZnO, который может действовать как кислота, даже если у него нет протонов для передачи.
- Примером амфотерного и амфипротонного вещества является гидроксид бериллия (Be(OH)2):
Основные и амфотерные гидроксиды
- Некоторые гидроксиды металлов являются амфотерными или способны действовать как кислота или основание.
- Теперь мы рассмотрим амфотерные гидроксиды, то есть гидроксидные соли, которые могут действовать как кислота или основание, в зависимости от условий реакции.

- Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия Al(OH)3.
- Гидроксиды металлов с высокозаряженным центральным атомом металла могут быть амфотерными .
- Помимо алюминия, такие металлы, как цинк, олово, свинец и бериллий, также могут образовывать амфотерные оксиды или гидроксиды.
Кислоты и основания Бренстеда
- Вода является амфотерной , что означает, что она может действовать как кислота или основание.
Кислотно-основные свойства воды
- Это пример автопротолиза (что означает «самопротонирование»), и он иллюстрирует амфотерная природа воды (способность действовать как кислота и как основание).
Оксиды
- Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными .
- Металлы склонны к образованию основных оксидов, неметаллы склонны к образованию кислотных оксидов, а амфотерные оксиды образуются элементами вблизи границы между металлами и неметаллами (металлоидами).

Определение кислот и оснований Бренстеда-Лоури
- Обратите внимание, что вода амфотерна ; в зависимости от обстоятельств он может действовать как кислота или основание, отдавая или принимая протон.
Хром
- Гидроксид хрома(III) (Cr(OH)3) является амфотерным , растворяется в кислых растворах с образованием [Cr(h3O)6]3+, а в щелочных растворах с образованием [Cr(OH)6]3−.
Степени окисления азота
- Если один из алкильных заместителей состоит из длинной цепи, такой как C12h35, полученный аминоксид представляет собой амфотерное поверхностно-активное вещество , находит применение в шампунях и других мягких чистящих средствах.
Синтез аминокислот
- Поскольку аминокислоты являются амфотерными , разрешение также может быть достигнуто с использованием основного характера аминной функции.

- Поскольку аминокислоты являются амфотерными , разрешение также может быть достигнуто с использованием основного характера аминной функции.



