Кристаллическая сода | это… Что такое Кристаллическая сода?
Карбона́т на́трия — химическое соединение Na2CO3, натриевая соль угольной кислоты.
Содержание
|
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5% кристаллизационной воды) — кристаллическая сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая или пищевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | h3CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрон (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблана получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000°C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Na2SO4 + 2C → Na2S + 2CO2↑
Сульфид натрия реагирует с карбонатом кальция:
Na2S + СаСО3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
2NaCl + H2SO4 → Na2SO 4 + 2HCl↑
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20°C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160°C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
возвращают в производственный цикл.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского поселка Березники фирмой «Любимов, Сольве и Ко» в 1883 году.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует карбонат кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Хоу.
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017°С переходит в бесцветный ромбический Na
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а.е.м. | 286,14 а.е.м. |
| Температура плавления | 852°C (по другим источникам, 853°C) | 32°С |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см3 (при 20°C) | 1,446 г/см3 (при 17°C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
CO32- + H2O ↔ HCO3— + OH—
Первая константа диссоциации угольной кислоты равна 4,5·10-7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве синтетических моющих средств, эмалей, для получения ультрамарина. Также он применяется для умягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na 2B4O7, Na2HPO4.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. [1]
[1]
Ссылки
- Sodium carbonate CAS #: 497-19-8 — Online Informational Database of Chemicals from China англ.
Пищевые добавки
Пищевые красители E1xx | Консерванты E2xx | Антиокислители и регуляторы кислотности E3xx | Стабилизаторы, загустители и эмульгаторы E4xx | Регуляторы рН и вещества против слёживания E5xx | Усилители вкуса и аромата, ароматизаторы
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Карбонаты натрия Е500 — Медицинский портал про здоровье
Другое
Вещества относятся к ненастоящим разрыхлителям, имеют незначительную опасность. Е500 – элементы, которые используют в разных качествах. Сода препятствует комкованию. В жизни карбонат натрия именуют содой. По химическим составляющим это ни что другое, как обычные производные угольной кислоты.
Раствор чаще всего применяют при готовке блюд в виде карбоната натрия, гидрокарбоната, их смеси.
Краткие сведения
Название походит из латыни, от наименования растения. В прошлые века ее усердно получали из золы. Кальцинированная сода была создана в конце 18-го века Лебланом, однако пищевая – в 1861 г. Сольвэ.
Карбонат натрия кислота получается несколькими способами. Наиболее распространенный из них – методика Сольве. Так добывают более 90% всех объемов промышленного вещества. Для этого нужен хлорид натрия, аммиак.
Вещество получается в процессе кальцинирования (увеличение температурных значений). От этого оно именуется кальцинированным. Ряд стран получает из месторождений. Также изготавливается промышленным способом в тех регионах, где отсутствуют залежи минералов.
Методики синтеза
Используют «сухой» и «мокрый» способы. В основе процесса – карбонизация (присоединение углекислоты). Отмечают перекристаллизационные преображения. Методики отличаются готовкой раствора. При сухом – кальцинированные элементы растворяются водой, а при мокром применяют технический бикарбонат.
При сухом – кальцинированные элементы растворяются водой, а при мокром применяют технический бикарбонат.
Разложение вещества при постепенном возрастании температуры именуют декарбонизацией.
Содовые элементы раствора под влиянием диоксида углерода осаждаются. Чистая пищевая содовая часть отделяется, а маточные компоненты вновь идут на получение первичного раствора.
Главные свойства
| Традиционные наименования | Кальцинированная сода |
| Молекулярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см3 |
| Растворимость | 21,8 г/100 мл |
Масса уникальных характеристик определила ценную роль элемента для человека. Внешний облик являет собой бесцветные кристаллические элементы. Иногда встречаются формы порошкообразного элемента беловатого окраса.
По общеобразовательным качествам пищевой эмульгатор отличается немаленькой температурой плавления (853 градуса).
Вещество не теряет своей способности отменно растворяться в водных структурах (в отличие от этанола). Особенность кроется в способности поглощать углекислоту.
Применение
Массовая доля карбоната натрия довольно весомая в кондитерстве и в кулинарии в целом. Ведь вещество просто незаменимо при приготовлении выпечки. Зачастую Е500 входит как в готовую продукцию, так и в смеси.
Соду можно встретить в:
- колбасе;
- мясной продукции; ;
- продуктах, что содержат какао-порошок.
Сода также применяется в различных секторах промышленности. Больше всего ее применяют в стекольной промышленности, цветной металлургии, химическом производстве.
Особенности использования в кулинарии
Пищевая сода – незаменимый элемент добавки, который используется в составе изделий в роли разрыхлителя. Обнаружить ее возможно в сгущенном молоке, мармеладе, джеме, маргарине.
Взаимодействие карбоната натрия с продуктами используется во время приготовления брецелей и рулетов. Технология подобной нестандартной обработки разведенным щелочным веществом целиком оправдана. Так можно безопасно изменить кислотность продукции. В итоге это приводит к возникновению необычайно хрусткой корочки на поверхности продукции. Карбонат натрия — незаменимый элемент. Без него никогда не получится идеальная лапша. Все дело в том, что нежность содового элемента в рассоле сохраняет вкусовое качество макарон. Добавка используется при готовке шербета. Так действует карбонат и несильные кислотные элементы. При этом образуется углекислота из-за слюны.
Технология подобной нестандартной обработки разведенным щелочным веществом целиком оправдана. Так можно безопасно изменить кислотность продукции. В итоге это приводит к возникновению необычайно хрусткой корочки на поверхности продукции. Карбонат натрия — незаменимый элемент. Без него никогда не получится идеальная лапша. Все дело в том, что нежность содового элемента в рассоле сохраняет вкусовое качество макарон. Добавка используется при готовке шербета. Так действует карбонат и несильные кислотные элементы. При этом образуется углекислота из-за слюны.
Карбонат натрия серная кислота содержится в большинстве паст по уходу за ротовой полостью и зубными элементами. Это пенообразователь, абразив, который на время минимизирует кислотность во рту. Подобным образом предупреждаются многие недуги.
Влияние
По итогам численных мировых исследований, реакции карбоната натрия не причиняют никакого вреда клеткам организма. То есть вещество числится в категории неопасных добавок. Без передозировки никогда и никому не наносит вред.
Но определенный вред кислота карбоната все же несет.
Существуют доказанные факты, согласно которым чувствительный организм плохо переносит вещество. Возникает затруднение дыхания, обмороки.
В экспериментах показано, что формула данного вещества неблагоприятно влияет на печень и мозг живого организма. Длительное потребление продуктов с Е500 увеличивает риски появления аллергических реакций на руках и голове.
Карбонат натрия и соляная кислота – самые известные антагонисты. Об их противоположном влиянии ведомо давно. Существует даже старинный способ победить изжогу – размешать в воде соду. «Пожар» исчезнет в считанные минуты. Это никак не методика терапии. Методика действенно и скоро позволяет избавиться от изжоги на непродолжительный период. Переизбыток соды способен провоцировать рези, даже аллергические признаки.
На территории многих стран разрешено применение Е500 в качестве пищевой добавки.
Упаковка, транспортировка
Перемещают данное вещество любым транспортом, но исключительно в плотно закрытых объектах. Элемент совершенно безопасен, поскольку лишен даже минимальной токсичности. Сохраняется содовый элемент только в закрытых упаковках. Крайне важно не допустить присутствия влаги в данной структуре. На протяжении года истекает гарантийный срок на сохранение содового раствора. При этом общий срок пригодности не лимитирован.
Элемент совершенно безопасен, поскольку лишен даже минимальной токсичности. Сохраняется содовый элемент только в закрытых упаковках. Крайне важно не допустить присутствия влаги в данной структуре. На протяжении года истекает гарантийный срок на сохранение содового раствора. При этом общий срок пригодности не лимитирован.
Содовый элемент можно по праву назвать главным разрыхлителем при выпечке. Данное вещество при нагревании выделяет углекислоту. За счет этого тесто становится мягким, пушистым. Сода выступает как самостоятельное вещество для разрыхления либо в комплексном составе пекарского порошка. При этом важно не переусердствовать с дозировкой. Содовый элемент оставляет в готовом продукте довольно неприятный, но безвкусный привкус. Соду важно добавлять в муку, кислые компоненты – только в жидкость.
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
Содержание
Безопасность
Двууглекилый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. [1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00. [1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В РФ производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[2]
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
- ↑ 12ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[1]
Ссылки
Wikimedia Foundation . 2010 .
2010 .
Полезное
Смотреть что такое «Бикарбонат натрия» в других словарях:
бикарбонат натрия — двууглекислый натрий (NaHCO3) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы двууглекислый натрий EN bicarbonate of sodabaking soda … Справочник технического переводчика
бикарбонат натрия — кислый углекислый натрий … Cловарь химических синонимов I
Натриум бикарбоникум — Natrium bicarbonicum, Бикарбонат натрия, Сода — NaHCO3 натрия бикарбонат. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворяется в воде с образованием щелочных растворов. Практически не растворяется в спирте.В фармакотерапии используется парентерально для борьбы с… … Справочник по гомеопатии
Натрия гидрокарбонат — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Химическая формула Содержание… … Википедия
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
натрия бикарбонат — natrio hidrokarbonatas statusas T sritis chemija formulė NaHCO₃ atitikmenys: angl. backing soda; sodium bicarbonate; sodium hydrocarbonate; sodium hydrogen carbonate rus. натрий углекислый; натрия бикарбонат; натрия гидрокарбонат; пищевая сода… … Chemijos terminų aiškinamasis žodynas
натрия гидрокарбонат — natrio hidrokarbonatas statusas T sritis chemija formulė NaHCO₃ atitikmenys: angl. backing soda; sodium bicarbonate; sodium hydrocarbonate; sodium hydrogen carbonate rus. натрий углекислый; натрия бикарбонат; натрия гидрокарбонат; пищевая сода… … Chemijos terminų aiškinamasis žodynas
НАТРИЯ ГИДРОКАРБОНАТ — ( Natrii hydrocarbonas ). Синонимы: Натрий двууглекислый, Натрия бикарбонат, Сода двууглекислая, Natrium bicarbonicum, Natrium hydrocarbonicum, Sodium bicarbonate. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде … Словарь медицинских препаратов
Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде … Словарь медицинских препаратов
НАТРИЯ ГИДРОКАРБОНАТ — Natrii hydrocarbonas. Синонимы: натрия бикарбонат, сода двууглекислая. Свойства. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде (1:12) с образованием щелочных растворов (рН 5 % раствора 8,1), нерастворим в спи … Отечественные ветеринарные препараты
Натрия бикарбонат — натрия гидрокарбонат, двууглекислый натрий, NaHCO3, пищевая (или питьевая) Сода … Большая советская энциклопедия
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода (пищевая добавка E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Содержание
Безопасность
Двууглекислый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. [1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00. [1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
» width=»» height=»» /> » width=»» height=»» />
В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Кулинария
Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр. ). При применении в чистом виде важно соблюсти правильную дозировку, так как оставляет в продукте не безвкусный карбонат натрия.
). При применении в чистом виде важно соблюсти правильную дозировку, так как оставляет в продукте не безвкусный карбонат натрия.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, лечения больных почечной недостаточностью [2] [3] , а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В Российской Федерации производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» на предприятии «Сода» (г. Стерлитамак, Республика Башкортостан).
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
- ↑ 12ГОСТ 2156-76 «Натрий двууглекислый. Технические условия»
- ↑При болезни почек помогает сода
- ↑Improved Growth in Young Children with Severe Chronic Renal Insufficiency Who Use Specified Nutritional Therapy
| Гидрокарбонат натрия на Викискладе ? |
свойства и применение в быту —
Содержание
свойства и применение в быту
Что такое кальцинированная сода
Свойства вещества люди обнаружили очень давно. Сначала соду добывали в месторождениях, позже научились извлекать щелочь при сжигании отдельных видов водорослей. С развитием промышленности кальцинированную соду стали синтезировать в огромных количествах с применением технологии кальцинирования. Сырье нагревают до температуры, при которой из него выпаривается вода — этим карбонат натрия или кальцинированная сода отличается от гидрокарбоната натрия (пищевой соды).
Сначала соду добывали в месторождениях, позже научились извлекать щелочь при сжигании отдельных видов водорослей. С развитием промышленности кальцинированную соду стали синтезировать в огромных количествах с применением технологии кальцинирования. Сырье нагревают до температуры, при которой из него выпаривается вода — этим карбонат натрия или кальцинированная сода отличается от гидрокарбоната натрия (пищевой соды).
Кальцинированная сода применяется для уборки, чистки, стирки, обработки растений в саду
Кальцинированная сода имеет еще несколько названий: карбонат натрия, натриевая соль угольной кислоты, углекислый натрий. Иногда ее называют бельевой и технической содой. Химическая формула — Na2CO3.
Белый порошок или мелкие гранулы применяют для изготовления стекла, мыла, чистящих средств, в пищевой промышленности — как разрыхлитель и нейтрализатор кислотности (Е500).
В условиях доступа воздуха карбонат натрия легко впитывает влагу с поглощением диоксида углерода.
В результате сода комкуется и теряет рассыпчатость.
В реакции с кислотами происходит высвобождение углекислого газа, при нагревании Na2CO3 распадается на оксид натрия и углекислый газ.
Плюсы и минусы вещества
Плюсы кальцинированной соды в следующем.
- Отличное моющее и дезинфицирующее средство.
- Может применяться для ручной и машинной стирки белья.
- Удаляет накипь с посуды, труб, внутренних поверхностей стиральных машин.
- Хорошо очищает от жира и грязи посуду из любых материалов, кафель, сантехнику, кухонные плиты, линолеум и другие поверхности.
- Справляется с засорами в канализационных трубах.
- Удобряет и защелачивает почву, помогает удалить садовых вредителей.
Из минусов можно назвать такие свойства.
- Создает агрессивную щелочную среду, при попадании на кожу и слизистые может вызвать раздражение и ожог.
- Взрывоопасна при высокой концентрации в воздухе.
Общие понятия
Карбонат натрия в различной концентрации обладает как нейтральной, так и повышенной щелочной активностью. В отличие от пищевой соды, кальцинированная более агрессивна, у нее отсутствует нейтральная щелочная реакция, она непригодна для употребления в пищу, раздражает кожу, в определенном состоянии может вызвать химический ожог.
В отличие от пищевой соды, кальцинированная более агрессивна, у нее отсутствует нейтральная щелочная реакция, она непригодна для употребления в пищу, раздражает кожу, в определенном состоянии может вызвать химический ожог.
Едкий натрий или каустик – самая сильная щелочь, легко разъедает любую органику. В обращении с ним нужно быть осторожным, чтобы не получить химический ожог.
Использование
Кальцинированная сода продается в виде упакованного в пачки легкого белого порошка. И применяется не только для процесса стирки.
В частности она нашла применение в следующих случаях:
- Смягчение воды;
- Мытье пола;
- Быстро и дёшево удалить накипь;
- Отбеливание, вываривание и замачивание белья;
- Эффективной борьбы с плесенью, садовыми вредителями и сорняками;
- Дезинфекции и обеззараживания помещения;
- Снятия старой краски;
- Приготовления порошка для стирки, заменить ею CALGON;
- Прочистить забившиеся канализационные трубы;
Меры безопасности
Карбонат натрия – хороший жирорастворяющий и сильно обезвоживающий химический реагент. Важно научиться правильно его использовать.
Важно научиться правильно его использовать.
В агрессивно-концентрированном виде он способен к вызыванию химических ожогов. В обычном состоянии щиплет, жжет кожу при наличии ранок на ней и сильно иссушает ее.
Поэтому перед тем как применять кальцинированную соду (особенно – в горячем виде) необходимо надеть резиновые перчатки. А также соблюдать простые правила обращения с ней:
Не хранить вместе с пищевыми продуктами. Не использовать для смягчения воды для питья.
Кальцинированная соль хорошо впитывает в себя сырость. Хранить ее нужно в герметичной упаковке.
Следить за тем, чтобы коробка с содой была недоступна для детей и домашних животных, чтобы они не игрались с ней. При попадании кальцинированной соды внутрь (проглатывании) похода в поликлинику или к ветеринару не избежать.
Следует помнить, что чем выше температура раствора карбоната натрия, тем он агрессивнее воздействует на кожу, выше вероятность получить щелочной ожог.
Не вызывая взрыва или пожара, тем не менее кальцинированная сода очень неблагоприятна для организма (3-й класс опасности).
Карбонат кальция очень активен при взаимодействии с водой. Применять его в помещениях с повышенной влажностью не рекомендуется.
Также стоит обратить внимание на то, что соду нужно растворять в теплой воде.
Меры предосторожности
Кальцинированная сода токсична, и вызывает сильное отравление при попадании в организм. При использовании необходимо выполнять несколько простых правил:
- перед применением обязательно надевать резиновые перчатки;
- хранить в сухом помещении, отдельно от пищи и медикаментов;
- хранить в недоступном для детей месте;
- в случае попадания в глаза или рот требуется немедленно промыть их большим количеством воды;
- обязательно соблюдать требуемые пропорции.
Отличия пищевой и кальцинированной соды
Помню, как в детстве я часто наблюдала за генеральной уборкой, которую проводили каждую субботу мои мама и сестра. Мелкие поручения выполняла и я, но до чистки кафеля, раковины и ванной меня не допускали. Мне было обидно, потому что я хотела также потереть пятнышки волшебным белым порошком, который заставлял сверкать все поверхности. Но мне объясняли, что это может быть опасным. Только спустя годы я узнала что такое кальцинированная сода, а также о плюсах и минусах этого вещества.
Мелкие поручения выполняла и я, но до чистки кафеля, раковины и ванной меня не допускали. Мне было обидно, потому что я хотела также потереть пятнышки волшебным белым порошком, который заставлял сверкать все поверхности. Но мне объясняли, что это может быть опасным. Только спустя годы я узнала что такое кальцинированная сода, а также о плюсах и минусах этого вещества.
Прежде чем говорить о способностях карбоната натрия (другие названия: бельевая сода, карбонат натрия), стоит отметить основные различия между пищевой содой и кальцинированной. Оба вещества относятся к натриевым солям угольной кислоты, однако различаются водородными показателями.
Знание различий между пищевой и кальцинированной содой пригодится всем
Пищевая сода (NaHCO3) — безопасный продукт с pH равным 8, применяемый в кулинарии и быту. Может нанести вред здоровью только в случае приёма большого количества вещества внутрь.
Кальцинированная сода (Na2CO3) имеет водородный показатель pH-11, следовательно, является сильной щёлочью, способной вызвать аллергические реакции и ожоги.
Это вещество используется только в бытовых нуждах. В отличие от пищевой, карбонат натрия обладает более рыхлой структурой и стоит на 3-ей ступени в таблице классификации опасности.
Карбонат натрия в быту
Несмотря на то что пищевую соду часто используют как моющее средство, справиться с очень сильными загрязнениями может только карбонат натрия.
Чистка поверхностей
Зная секреты использования кальцинированной соды, можно существенно снизить финансовые затраты, потому что необходимость в покупке дорогих чистящих средств просто исчезнет или сведётся к минимуму.
Ванная комната
Вещество отлично справляется с различными загрязнениями: мыльными отложениями, известковым налётом, кожным салом, ржавчиной, мочевым камнем. Чтобы очистить поверхности ванны, душа и/или туалета, вам понадобится:
- 3 столовые ложки пищевой соды;
- 3 столовые ложки кальцинированной соды;
- 1/3 стакана жидкого отбеливателя;
- 1/3 стакана 9%-го столового уксуса;
- пульверизатор;
- губка.

Применение
- Смешайте оба типа соды в небольшой ёмкости, которую не используете для приготовления пищи;
- Ополосните нуждающиеся в очистке поверхности холодной водой;
- С помощью влажной губки нанесите приготовленную ранее смесь на поверхность ванны, раковины или унитаза и оставьте на 30 минут;
- В пульверизаторе смешайте отбеливатель и уксус;
- Разбрызгайте жидкость на поверхности поверх соды;
- После окончания реакции веществ, которая проявляется в появлении пены и шипении, смойте остатки чистящего продукта с поверхности, используя лейку или душевую насадку.
Карбонат натрия отлично очищает предметы ванной и туалета
Если на поверхностях остались небольшие пятна, их можно слегка потереть жёсткой стороной губки, после чего снова ополоснуть всё водой.
Кафельная плитка
Кальцинированную соду смешивают с водой в пропорции 2–3 столовые ложки вещества на 1 литр жидкости, наносят губкой на поверхности и оставляют на 5–10 минут. Очищенный кафель несколько раз протирают чистой влажной тканью.
Очищенный кафель несколько раз протирают чистой влажной тканью.
С помощью бельевой соды кафельная плитка засияет как новая
Я живу в местности с повышенной влажностью, поэтому постоянно приходится бороться с плесенью. Особой проблемой были чернеющие промежутки между плитками кафеля в ванной и на кухне. Перепробовав множество средств, пришла к выводу, что кальцинированная сода борется с этой бедой эффективнее всего. Чтобы привести стены в порядок, я наношу карбонат натрия на поражённые плесенью промежутки, предварительно смачивая их тёплой водой. Затем втираю порошок щёткой средней грубости и оставляю на 15–20 минут. После этого достаточно удалить остатки вещества чистой губкой и вытереть всё насухо.
Полы
В ведре горячей воды нужно развести 3 столовые ложки кальцинированной соды. После протирания полов полученным раствором, обязательно проводят ещё один этап мытья, на этот раз с чистой водой. Эта мера необходима для того, чтобы удалить остатки активного вещества. Данное средство подходит только для мытья покрытий из натурального камня, кафельной плитки или линолеума. Ни в коем случае нельзя наносить карбонат натрия на полы из натурального или крашеного дерева, ламинат, паркет.
Данное средство подходит только для мытья покрытий из натурального камня, кафельной плитки или линолеума. Ни в коем случае нельзя наносить карбонат натрия на полы из натурального или крашеного дерева, ламинат, паркет.
Кальцинированная сода не только очищает пол от грязи, но и дезинфицирует его
Газовая духовка и плита
Одним из ингредиентов для приготовления чистящего средства для ваших кухонных помощников является силикатный клей (жидкое стекло), приобрести который можно в магазинах с канцтоварами или хозяйственных магазинах.
Ингредиенты:
- 3 столовые ложки кальцинированной соды;
- 1 столовая ложка силикатного клея;
- 1/2 столовой ложки стирального порошка;
- 250 мл воды.
Изготовление и применение:
- Поместите все ингредиенты в подходящую по размеру ёмкость и тщательно перемешайте;
- Нанесите полученную смесь на загрязнённые поверхности плиты и духового шкафа, а также на решётки.
 Оставьте в таком виде на 15–30 минут;
Оставьте в таком виде на 15–30 минут; - Когда жир на поверхностях размягчится, удалите его, используя губку;
- Протрите поверхности чистой влажной тканью несколько раз, удаляя остатки соды.
Карбонат натрия отлично удаляет жир любой степени давности
Если поверхности плиты и духовки сильно загрязнены и очистить их с первого раза полностью не удалось, следует повторить манипуляции.
Снятие старой краски
В качестве своеобразного размягчителя старой краски используют смесь известкового раствора и карбоната натрия, приготовленную в пропорции 3:1. Средство наносится на окрашенную поверхность и оставляется на 15–20 минут. Примерно через четверть часа краска начинает собираться в комки, «творожиться» и легко снимается с помощью шпателя или лопаточки.
Бельевая сода является отличным средством для размягчения старой краски
Применение для бытовых нужд
В домашних условиях кальцинированная сода применяется не менее активно, чем в производстве.
Замачивание
Этот самый доступный по цене способ избавиться от сложных загрязнений использовали еще наши бабушки. На ведро воды потребуется примерно три столовые ложки соды. Для лучшего эффекта намыльте белье хозяйственным мылом и оставьте замачиваться на ночь. После стирки белье станет заметно белее.
После замачивания белье по-прежнему будет иметь серый оттенок, однако, после стирки белье вновь станет белоснежным.
Стирка в стиральной машине
В отделение для моющего средства при предварительной стирке засыпьте три столовые ложки едкого натра. Если белье очень грязное, дозу можно увеличить до пяти столовых ложек. Некоторые хозяйки предпочитают класть соду сразу в барабан стиральной машины. В общем, делайте так, как удобно вам.
Если вы используете недорогой стиральный порошок, то добавьте к нему 3 столовые ложки карбоната натрия. Это поможет вам лучше отстирать вещи, и сохранит их дольше.
С содой лучше всего отстирываются льняные полотенца, постельное белье и хлопчатобумажные вещи.
Чем выше температура воды, тем более эффективно будет работать сода.
Сода – вещество очень едкое, и, чтобы не навредить, нужно правильно его использовать. Так для стирки цветного белья вещество нужно растворить в теплой воде (30 – 40 градусов, не больше).
Также соду можно смешать со стиральным порошком в соотношении 1:1.
А чтобы смягчить воду в стиральной машине, в нее добавляют немного соды. Это не только поможет лучше отстирать вещи, но и избавит от неприятного запаха в машине.
Дополнительный эффект от использования карбоната натрия– вода смягчается и на внутренних деталях техники не образуется известковый налет.
Ручная стирка
Сразу отметим, что далеко не все ткани «рады» встрече с кальцинированной содой. Так, например, шерстяные или шелковые вещи стирать в бельевой соде не рекомендуют. Они станут более хрупкими и жесткими.
Ткани из 100%-ной синтетики не стоит помещать в содовый раствор.
Для ручной стирки можно приготовить специальный состав: к 500 г воды добавить полстакана хозяйственного мыла и поставить нагреваться, чтобы мыло полностью растворилось. Не доводя до кипения, раствор снять с огня. Затем к полученной смеси добавить полстакана буры и полстакана соды, и долить 2 литра воды. Снова поставить на огонь и прокипятить. После этого смесь остудить и можно использовать для ручной стирки.
Не доводя до кипения, раствор снять с огня. Затем к полученной смеси добавить полстакана буры и полстакана соды, и долить 2 литра воды. Снова поставить на огонь и прокипятить. После этого смесь остудить и можно использовать для ручной стирки.
11 удивительно полезных для здоровья свойств
Вполне возможно, что вы поставите еще одну коробку соды — в аптечку!
Полезные свойства соды
Уверен, что дома у вас найдется хотя бы коробочка пищевой соды. Может быть, в кладовой – для выпечки, в холодильнике — для впитывания запахов или под раковиной в кухне — для чистки.
Подписывайтесь на наш аккаунт в INSTAGRAM!
Но, возможно, вы не думали, что пищевую соду можно использоваться и в медицинских целях, поэтому вполне возможно, что вы поставите еще одну коробку соды — в аптечку.
Что же такое пищевая сода?
Это 100-процентный бикарбонат натрия, который используется в качестве разрыхлителя для выпечки. При смешивании пищевой соды с кислотой происходит реакция – появляются пузыри и выделяется углекислый газ, из-за чего тесто увеличивается в объеме.
При смешивании пищевой соды с кислотой происходит реакция – появляются пузыри и выделяется углекислый газ, из-за чего тесто увеличивается в объеме.
На протяжении всей истории есть свидетельства того, что многие цивилизации использовали виды пищевой соды при приготовлении хлеба и других блюд, которым нужно было подняться.
В своей естественной форме, пищевая сода – это нахколит, который входит в состав природной кристаллической соды. В ней содержится большое количество бикарбоната натрия, который использовался с древних времен. И нет, вам не нужен пекарный порошок без алюминия (не путайте с разрыхлителем), поскольку пищевая сода уже не содержит алюминия…
Так, египтяне использовали природную соду в качестве мыла с целью очищения. Но лишь в 1846 году д-р Остин Черч и Джон Дуайт начали производить и продавать соединение, которое сегодня мы знаем, как пищевую соду. В 1860-х гг пищевая сода уже упоминалась в опубликованных поваренных книгах, но по-прежнему была известна преимущественно, как кулинарная добавка. К 1920-м гг, однако, универсальность ее применения была расширена, и к 1930-м гг ее широко рекламировали, как «проверенное лечебное средство».
К 1920-м гг, однако, универсальность ее применения была расширена, и к 1930-м гг ее широко рекламировали, как «проверенное лечебное средство».
11 способов применять пищевую соду для здоровья
Сода — одно из наиболее доступных домашних средств. Помимо ее применения в случае незначительных травм, пищевая сода может стать частью вашего обычного ухода за собой.
1. Натуральный дезодорант
Если вы хотите избежать воздействия парабенов и алюминия, которые входят в состав многих дезодорантов и антиперспирантов, попробуйте смесь щепотки пищевой соды и воды.
Эта простая паста является эффективным и простым натуральным дезодорантом. Можете просто натереть подмышки небольшим количеством сухой пищевой соды.
2. Укусы насекомых и ожоги ядовитым плющом
Нанесите пасту, приготовленную из пищевой соды и воды, на места укусов насекомых, чтобы уменьшить зуд. Можно попробовать просто втереть сухой порошок в кожу.
Можно попробовать просто втереть сухой порошок в кожу.
Сода также эффективно справляется с зудящими высыпаниями и ожогами ядовитым плющом. Она помогает уменьшить незначительное раздражение кожи и зуд, нейтрализуя токсины и раздражающие вещества на поверхности кожи.
3. Изжога, диспепсия и язвенные боли
В большинство антацидов, которые продаются в аптеках, содержится та или иная форма бикарбоната. Пищевая сода сразу же нейтрализует желудочную кислоту, помогая облегчить изжогу, несварение и даже язвенные боли. Я лично рекомендовал этот способ многим людям, в том числе членам моей семьи, и сам удивлялся, насколько он удивительно эффективен.
Дозировка, как правило, составляет ½ чайной ложки соды, полностью растворенной в половине стакана воды. Принимать каждые два часа (но не более семи раз по ½ чайной ложки в течение 24 часов или трех раз по ½ чайной ложки, если вы старше 60 лет).
Пользуйтесь этим способом только в качестве разового (не постоянного) лечения и следите за тем, чтобы не потреблять чрезмерное количество соды – это может привести к серьезному нарушению баланса электролитов и кислотно-щелочного равновесия.
4. Ванночка для ног и скраб
Добавьте три столовые ложки пищевой соды в таз с теплой водой – у вас получится стимулирующая ванна для ног. Для дополнительного отшелушивания потрите ноги пастой из пищевой соды.
Пасту, приготовленную из трех частей пищевой соды и одной частью воды, можно использовать в качестве скраба для лица и тела. Это натуральное, недорогое и достаточно бережное средство, которое подходит для ежедневного использования.
5. Расслабляющая ванна
Пищевая сода и яблочный сидр обеспечат вам прекрасную ванну, как в салоне – в ней так приятно понежиться. В качестве бонуса – после нее отлично очищается ванна и слив!
6. Очищающее средство для рук
Очищающее средство для рук
Смешайте три части пищевой соды с одной частью воды – натуральное очищающее средство для рук готово! Оно соскребет грязь и нейтрализует запахи.
7. Удаление заноз
Добавьте столовую ложку пищевой соды в небольшой стакан воды и дважды в день опускайте в него пораженную область. Через пару дней такого лечения большинство заноз выйдут сами по себе.
8. Средство от солнечных ожогов
Добавьте ½ стакана пищевой соды в ванну с теплой водой и полежите в ней. Когда выйдете, не вытирайтесь – пусть кожа обсохнет на воздухе, а остатки соды принесут дополнительное облегчение.
Можно также добавить смесь пищевой соды и воды в прохладный компресс и прикладывать его непосредственно к обожженным областям.
9. Улучшение спортивных результатов
Бегуны на длинные дистанции давно практикуют «содовый допинг» или прием капсул с пищевой содой — перед забегом для повышения своих результатов. Считается, что эта мера аналогична углеводной нагрузке.
Считается, что эта мера аналогична углеводной нагрузке.
Также было установлено, что это повышает скорость у пловцов. Хотя я не рекомендую вам попробовать это дома, но это еще один пример преимуществ пищевой соды.
Исследователи отмечают:
«По сути, бикарбонат натрия – это щелочное вещество, которое повышает рН крови. Как представляется, оно уменьшает и компенсирует кислотность, появляющуюся в мышцах во время выполнения интенсивных анаэробных упражнений, в результате которых наиболее быстро вырабатывается молочная кислота, например, в процессе быстрого бега или плавания».
10. Паста для десен и зубов
Пищевая сода оказывает мягкое абразивное действие, помогая удалить зубной налет, полировать и чистить зубы, а также освежать дыхание. Одним из обзоров данных, полученных в результате пяти контролируемых клинических исследований, было установлено, что зубная паста, в состав которой входит пищевая сода, «значительно увеличила эффективность удаления зубного налета в процессе чистки зубов», чем чистка зубов пастой не содержащей соды.
Кроме того, пищевая сода обладает антибактериальными свойствами, благодаря которым она способна уничтожать бактерии Streptococcusmutans, которые в значительной степени отвечают за разрушение зубов. Чтобы получить невероятно эффективную пасту для зубов и десен, смешайте шесть частей пищевой соды и одну часть морской соли.
Поместите их в блендер и перемешивайте в течение 30 секунд, а затем переложите в контейнер для использования. Смочите кончик указательного пальца и нанесите небольшое количество смеси соли и соды на десны.
Начните с десен вверху – втирайте смесь на зубы и в десна вначале с внешней, а затем с внутренней стороны вверху, и с внешней, а затем с внутренней стороны внизу. Выплюньте излишки. Через 15 минут прополощите рот. Эта смесь невероятно эффективно уничтожает бактерии.
Тем не менее, в этой области следует проявить определенную осторожность, ведь многие считают, что пищевая сода слишком абразивна для зубной эмали.
11. Отбеливатель для зубов
Чтобы отбелить зубы естественным образом, разомните одну спелую ягоду клубники и смешайте ее с 1/2 чайной ложки пищевой соды. Нанесите смесь на зубы и оставьте на пять минут. Затем почистите зубы щеткой и прополощите.
Этот метод можно использовать не чаще одного раза в неделю, так как его чрезмерное применение потенциально может повредить зубную эмаль.
Как применять пищевую соду в качестве натурального очищающего средства
Если вам трудно поверить, что такое простое и недорогое средство, как пищевая сода, действительно способно очистить ваш дом, задумайтесь о следующем: именно пищевую соду использовали для очистки и восстановления внутренних медных стенок Статуи Свободы во время ее реставрации в 1986 г.
Она эффективно удалила грязь, не повредив медь – так что, наверное, подойдет и для вашего дома?
Перечислим одни из основных способов применения пищевой соды для очистки:
- Пищевой содой отлично отчищаются ванну и кухня.
 Насыпьте ее в емкость с крышкой из нержавеющей стали с отверстиями, с ее помощью, посыпьте поверхности содой и потрите. Можете добавить сюда пару капель вашего любимого эфирного масла. Масло лаванды и масло чайного дерева обладают мощными антибактериальными свойствами.
Насыпьте ее в емкость с крышкой из нержавеющей стали с отверстиями, с ее помощью, посыпьте поверхности содой и потрите. Можете добавить сюда пару капель вашего любимого эфирного масла. Масло лаванды и масло чайного дерева обладают мощными антибактериальными свойствами.
- Пищевая сода смешанная с яблочным уксусом, образует пузыристое соединение многоцелевого использования. Чтобы очистить слив, насыпьте в него соду, добавьте яблочный уксус и оставьте пузыриться в течение 15 минут, после чего промойте горячей водой. Это более безопасная альтернатива опасным очистителям канализации.
- Замочите кастрюли и сковородки в горячей воде с содой на 15 минут – теперь оттереть пригоревшую еду не составит труда.
- Пищевая сода отлично чистит решетку для гриля.
- Чтобы вымыть детские игрушки, приготовьте раствор из 4 столовых ложек пищевой соды и 1 л воды.

- Пищевую соду также можно использовать в качестве кондиционера для белья, чтобы отбелить вещи или сделать их цвет ярче (добавьте стакан соды в стиральную машину)
- Пищевая сода — натуральное чистящее средство для ковров. Посыпать ею ковры, оставьте на 15 минут, а затем почистите пылесосом.
- Чтобы серебро блестело и без токсичных серебряных средств для полировки, наполните раковину горячей водой, добавьте лист алюминиевой фольги и пищевую соду. Замочите в ней серебряные изделия, пока они не станут чистыми. Это простой и удобный способ очистить серебро.
- Насыпьте соду в свою обувь, чтобы убрать запах естественным образом.
- Если на кухне случайно вспыхнул жир, загасите пламя щепоткой соды
- Когда вы моете овощи и фрукты, посыпьте щетку содой, чтобы легче удалять грязь и остатки
- Чтобы устранить грязь в душе и ванной, используйте пасту из пищевой соды и воды.
 опубликовано econet.ru.
опубликовано econet.ru.
©Д-р Джозеф Меркола
Остались вопросы — задайте их здесь
P.S. И помните, всего лишь изменяя свое сознание — мы вместе изменяем мир! © econet
Это не шутка!! Половина лимона погруженного в пищевую соду. Это невероятно, что можно сделать для вашего тела всего за 5 минут!
Итак, сегодня мы расскажем вам, как вы можете воспользоваться их преимуществами в невероятном напитке.
С помощью этого напитка не существует никакого риска побочных эффектов, а также эти два компонента могут вызвать большие изменения в своем здоровье и теле. Так посмотрите, что происходит, когда вы пьете этот напиток ежедневно, результаты удивительны. Вы хотите знать больше? Продолжай читать…
Сода для выпечки широко используется для лечения различных частей тела, как внешние , так и внутренние. А лимон содержит большое количество витамина С и других свойствам, которые делают его незаменимым.
Преимущества сочетания выпечки соды и лимона:
1. защелачивающие
Смесь лимона и бикарбоната натрия обладает свойством подщелачивания организма. Это помогает нам, например , для борьбы с ацидозом , который может произойти , когда почки не удаляют достаточно кислот из организма , или когда организм вырабатывает слишком много кислоты. Это, отличное средство для почек, это облегчит их работу, а также помогает нам очищать наше тело и сжигать жир .
2. пищеварение
Вы уже знаете, многочисленные достоинства лимона, чтобы облегчить наше пищеварение. Если мы добавим немного пищевой соды, мы получим замечательную смесь, которая может заставить работать нашу пищеварительную систему работать гораздо лучше. Это хорошая анти-кислота, которая также борется с метеоризмом.
Другим достоинством является то, что он помогает бороться с гастроэзофагеальной рефлюксной функцией, благодаря соляной кислоте, которая идет вверх в пищевод из желудка. Благодаря бикарбонату натрия, мы преобразуем его.
Благодаря бикарбонату натрия, мы преобразуем его.
3. Очищение
Это удивительное средство может очистить нашу печень , а также может дать нам хорошую дозу витамина С, калия и антиоксидантов. Так что, не забудьте, начать свой день с этим лекарством , и вы почувствуете обновление и полную энергию на весь день.
Это средство также является отличным регулятором. Питьевая вода , которая богата бикарбонатом натрия позволит регулировать уровень плохого холестерина, тем самым улучшая нашу сердечно — сосудистую систему.
КАК ДЕЛАТЬ И ПРИНИМАТЬ:
Ингредиенты:
- 1 столовую ложку соды для выпечки.
- 1 стакан воды .
- Сок половины лимона.
Приготовление:
- Добавьте в чашку воды соду и добавьте лимонный сок.
- Хорошо перемешайте, а затем принимайте все сразу, но делайте это утром и натощак.
Помните, очень важно, чтобы пить этот напиток на пустой желудок, в течение целой недели. Затем сделайте отдых в течение двух недель подряд.
Это происходит потому, что кислотность лимона может быть несколько вредной, когда употребляется в избытке. Кроме того, этот напиток помогает бороться с началом опухолей, то, что имеет важное значение для борьбы с раком.
Сода вредна для мозга? (А чем хуже диетическая газировка?) | The Brink
Как сладкие, так и диетические напитки коррелируют с ускоренным старением мозга
Американцы любят сахар. По данным Министерства сельского хозяйства США, в 2016 году мы вместе потребили почти 11 миллионов метрических тонн его, большая часть из которых была в виде подслащенных сахаром напитков, таких как спортивные напитки и газированные напитки.
Новое исследование показывает, что избыток сахара — особенно фруктозы в сладких напитках — может повредить ваш мозг.Исследователи, использующие данные Фрамингемского исследования сердца (FHS), обнаружили, что люди, которые часто пьют сладкие напитки, с большей вероятностью будут иметь плохую память, меньший общий объем мозга и значительно меньший гиппокамп — область мозга, важную для обучения и памяти.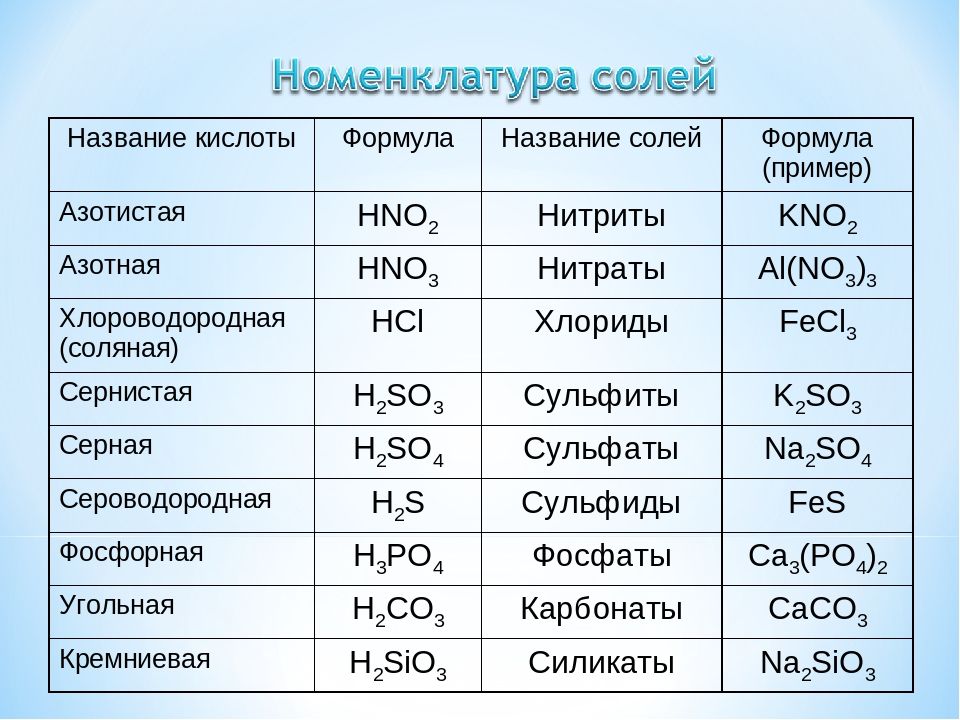
Но прежде чем вы бросите сладкий чай и перейдете к диетической газировке, есть еще кое-что: последующее исследование показало, что у людей, которые ежедневно пили диетическую газировку, вероятность развития инсульта и слабоумия почти в три раза выше, чем у тех, кто этого не делал.
Исследователи сразу же отмечают, что эти результаты, опубликованные отдельно в журналах Alzheimer’s & Dementia и Stroke , демонстрируют корреляцию, но не причинно-следственную связь. Хотя исследователи предостерегают от чрезмерного употребления диетической газировки или сладких напитков, необходимы дополнительные исследования, чтобы определить, как — или если — эти напитки действительно повреждают мозг, и какой ущерб может быть вызван основным сосудистым заболеванием или диабетом.
«Эти исследования не являются исчерпывающими, но это убедительные данные и очень сильное предположение», — говорит Судха Сешадри, профессор неврологии Медицинской школы Бостонского университета (MED) и преподаватель кафедры Альцгеймера в Бостонском университете. Центр болезней, который является старшим автором обеих статей.«Похоже, что в сладких напитках нет особых преимуществ, а замена сахара искусственными подсластителями не помогает».
Центр болезней, который является старшим автором обеих статей.«Похоже, что в сладких напитках нет особых преимуществ, а замена сахара искусственными подсластителями не помогает».
Мэтью Пейс — ведущий автор двух исследований, которые связывают повышенное потребление как сладких, так и искусственно подслащенных напитков с неблагоприятными воздействиями на мозг. Фото Сидни Скотта
«Может быть, нам нужно привыкнуть к старой доброй воде», — добавляет она.
Мэтью Пейс, сотрудник неврологического отделения MED и исследователь из FHS, который является ведущим автором обеих статей, говорит, что избыток сахара уже давно ассоциируется с сердечно-сосудистыми и метаболическими заболеваниями, такими как ожирение, болезни сердца и диабет 2 типа, но мало что известно о его долгосрочном воздействии на мозг человека.Он решил изучить сладкие напитки как способ изучения общего потребления сахара. «Сложно измерить общее потребление сахара в рационе, — говорит он, — поэтому мы использовали сладкие напитки в качестве косвенного показателя».
Для первого исследования, опубликованного 5 марта 2017 года в журнале Alzheimer’s & Dementia , исследователи изучили данные, в том числе результаты сканирования магнитно-резонансной томографии (МРТ) и результаты когнитивных тестов, примерно 4000 человек, включенных в Framingham Heart Study’s Offspring и Third- Поколения когорт.(Это дети и внуки первоначальных добровольцев FHS, набранных в 1948 году.) Исследователи изучали людей, которые употребляли более двух сладких напитков в день любого типа — газированные напитки, фруктовые соки и другие безалкогольные напитки — или более трех напитков в день. неделя только содовой. Среди этой группы с высоким потреблением они обнаружили несколько признаков ускоренного старения мозга, в том числе меньший общий объем мозга, плохую эпизодическую память и сокращение гиппокампа — все это факторы риска развития болезни Альцгеймера на ранней стадии. Исследователи также обнаружили, что более высокое потребление диетической газировки — по крайней мере, один раз в день — было связано с меньшим объемом мозга.
Во втором исследовании, опубликованном 20 апреля 2017 года в журнале Stroke , исследователи, используя данные только старшей когорты Потомков, специально изучали, перенесли ли участники инсульт или им был поставлен диагноз деменции из-за болезни Альцгеймера. После измерения потребления напитков добровольцами в трех точках в течение семи лет, исследователи затем наблюдали за добровольцами в течение 10 лет, ища доказательства инсульта у 2888 человек старше 45 лет и деменции у 1484 участников старше 60 лет.Здесь они, к удивлению, не обнаружили корреляции между потреблением сладких напитков и инсультом или деменцией. Однако они обнаружили, что у людей, которые выпивали хотя бы одну диетическую газировку в день, вероятность развития инсульта и слабоумия почти в три раза выше.
Хотя исследователи приняли во внимание возраст, курение, качество диеты и другие факторы, они не смогли полностью контролировать ранее существовавшие состояния, такие как диабет, который, возможно, развился в ходе исследования и является известным фактором риска деменции. Диабетики, как группа, в среднем пьют больше диетической соды, чтобы ограничить потребление сахара, и некоторая корреляция между потреблением диетической газировки и деменцией может быть связана с диабетом, а также с другими факторами риска для сосудов. Однако такие ранее существовавшие условия не могут полностью объяснить новые результаты.
Диабетики, как группа, в среднем пьют больше диетической соды, чтобы ограничить потребление сахара, и некоторая корреляция между потреблением диетической газировки и деменцией может быть связана с диабетом, а также с другими факторами риска для сосудов. Однако такие ранее существовавшие условия не могут полностью объяснить новые результаты.
«Было несколько удивительно, что потребление газированных напитков привело к таким результатам», — говорит Пазе, отмечая, что, хотя предыдущие исследования связывали потребление газированных напитков с риском инсульта, связь с деменцией ранее не была известна.Он добавляет, что исследования не делали различий между типами искусственных подсластителей и не учитывали другие возможные источники искусственных подсластителей. Он говорит, что ученые выдвинули различные гипотезы о том, как искусственные подсластители могут причинить вред, от преобразования кишечных бактерий до изменения восприятия сладкого мозгом, но «нам нужно больше работать, чтобы выяснить основные механизмы».
Изучите связанные темы:
2. Ткань /:
2.Ткань
Ткань — это группа клеток, работающих вместе для выполнения определенной работы. Гистолог — это тот, кто специализируется на изучении тканей. Клетки, из которых состоят ткани, содержат от 60 до 99% воды. В воде растворяются газы, жидкости и твердые вещества. Химические реакции, необходимые для правильного функционирования организма, гораздо легче протекают в водном растворе. Водный раствор и другие материалы, в которых купаются ткани, слегка соленые. Это вещество называется тканевой жидкостью.Следует отметить, что недостаточность тканевой жидкости называется обезвоживанием, а аномальное накопление этой жидкости вызывает состояние, называемое отеком.
Классификация тканей: 4 основные группы тканей:
1) эпителиальная ткань образует канны, покрывает поверхности и складки впадин;
2) соединительная ткань удерживает все части тела на месте. Это может быть жир, хрящ, кость или кровь. Кровь иногда считают разновидностью ткани, поскольку она содержит клетки и выполняет многие функции тканей. Однако; кровь имеет много других уникальных характеристик;
Однако; кровь имеет много других уникальных характеристик;
3) нервная ткань проводит нервные импульсы по всему телу;
4) мышечная ткань предназначена для силовых сокращений. Поверхность тела и трубок или проходов, ведущих к внешней стороне, и поверхность различных полостей тела выстланы клетками, которые близко расположены друг к другу; таким образом имеют небольшое количество межклеточного вещества. Этот подкладочный клеточный слой называется эпителием.Эпителиальный слой может состоять из одной или нескольких клеток. Когда он состоит из одного слоя, он называется простым эпителием; когда по толщине две и более клетки, она расслаивается. Природа и консистенция межклеточного вещества, матрицы, количество и расположение волокон служат основой для подразделения соединительной ткани на три основные группы: собственно соединительная ткань, хрящ и кость. В соединительной ткани межклеточное вещество мягкое; в хрящах он прочный, но гибкий и эластичный; в кости он жесткий из-за отложения соли кальция в матриксе. В многоклеточных организмах определенные клетки в значительной степени развивают свойства раздражительности и проводимости. Эти клетки образуют нервные ткани.
В многоклеточных организмах определенные клетки в значительной степени развивают свойства раздражительности и проводимости. Эти клетки образуют нервные ткани.
Нервная система высших животных характеризуется множеством клеточных форм и межклеточных связей, а также сложностью ее функционирования. Эта множественность и сложность — главная особенность, которая отличает нервные ткани от других тканей, которые по существу имеют одинаковую структуру и функцию.
Мышечная ткань состоит из удлиненных клеток, которые обладают способностью сокращаться или уменьшать свою длину.Это свойство сжатия в конечном итоге является молекулярным явлением и связано с присутствием белковых молекул. В организме встречаются следующие три типа мышечной ткани.
Гладкая мышечная ткань находится в листах или трубках, образующих стенки многих полых или трубчатых органов, например мочевого пузыря, кишечника кровеносных сосудов. Клетки, образующие эту ткань, представляют собой длинные веретены с центральным ядром овальной формы. Они обычно упакованы вместе со всей небольшой соединительной тканью между ними.
Они обычно упакованы вместе со всей небольшой соединительной тканью между ними.
Поперечно-полосатая мышечная ткань состоит из цилиндрических волокон, часто большой длины, в которых невозможно различить отдельные клетки. Многие маленькие ядра находятся в волокнах, лежащих прямо под поверхностью. Сердечная мышца по своему строению напоминает поперечно-полосатую, но по действию гладкая.
Новые слова
ткань
группа
работа
работа
специальный,
работа
вода
газ
жидкость
эпителиальный
слой мускулов
тело
гибкое
эластичное
ядро
гладкое
волокно
сердечное
a (an) ,.. ,,.
E. g. Это книга. Книга интересная ( ).
Это мясо. Мясо свежее ().
Это книги. Книги хорошие ().
,.
1. Это ручка красного цвета.
2. Это карандаши .. карандаши черные.
3. Это супчик суп вкусный.
4. Утром ем бутерброд и пью чай.
5. Она дала мне кофе и. кекс.. кофе был горячим и. торт был вкусным.
6. Любите мороженое?
7. Я вижу книгу в руке. Книга интересная?
8. Вчера купила мясо, масло и картофель.
9. Еще она купила торт, торт был очень вкусным. Мы ели торт с. чай.
10. Это сумка-мешок коричневого цвета.
11. Это сумка моей сестры.
12. А это моя сумка. Это желтое.
13. Это есть. дерево .. дерево зеленое.
14. Я вижу, мальчики играют.
15. Велосипед у меня черный. У моего друга нет велосипеда.
16. Наша комната большая.
17. Писали диктант, вчера диктант был длинным.
18. Имеет двух дочерей и сына. Ее сын — ученик.
19. У друга моего брата нет собаки.
20. Этот карандаш сломан. Дайте мне, пожалуйста, этот карандаш.
21. У нее мяч мяч большой.
22. Получил письмо от друга, вчера письмо было интересным.
Ответьте на вопросы.
1. Что такое ткань?
Что такое ткань?
2. Из чего сделаны ткани?
3. Сколько процентов воды содержат клетки?
4. Что растворяется в воде?
5. Какие реакции необходимы для правильного функционирования организма?
6. Какое вещество называется тканевой жидкостью?
7. Сколько групп входит в классификацию тканей?
8. Как называется клеточный слой подкладки?
9. Какие клетки образуют нервную ткань?
10.Где находится гладкая мышечная ткань?
Составьте собственные предложения, используя новые слова (10 предложений).
Найдите в тексте определенные и неопределенные артикли.
Найдите одно слово, значение которого немного отличается от других (,):
1) а) ткань; б) корпус; в) ручка;
2) а) вода; б) клетка; в) круг;
3) а) мышца; б) рука; в) холодный;
4) а) эластичный; б) гладкая; в) кирпич;
5) а) волокно; б) сердечная; в) линия.
Эргогенные средства Любое вещество (или пища), которое, как считается, улучшает работоспособность выше нормальных стандартов.
 Определение МОК: «Администрация или.
Определение МОК: «Администрация или.Презентация на тему: «Эргогенные средства. Любое вещество (или пища), которое, как считается, повышает эффективность человека по сравнению с обычными стандартами. Определение МОК:« Применение или »- стенограмма презентации:
1 Эргогенные средства Любое вещество (или пища), которое, как считается, улучшает работу человека по сравнению с нормой.Определение МОК: «Введение или использование веществ в любой форме, чуждых организму, или физиологических веществ в ненормальных количествах и ненормальными методами здоровыми людьми с исключительной целью достижения искусственного и несправедливого улучшения результатов в спорте».
2 Использование этих веществ и методы являются спорными.
Использование этих веществ и методов является спорным.Большое беспокойство вызывает количество спортсменов, использующих эргогенные средства. Тестирование на наркотики включено во многие спортивные программы, чтобы помочь сократить употребление этих веществ. Из-за этических нарушений, связанных с несправедливостью, которые приводят к конкуренции и могут возникнуть проблемы со здоровьем, использование этих веществ не может быть оправдано!
Из-за этических нарушений, связанных с несправедливостью, которые приводят к конкуренции и могут возникнуть проблемы со здоровьем, использование этих веществ не может быть оправдано!
3 Механические вспомогательные средства Тренировка на высоте
Тренировка в воде (вода) Мониторы сердечного ритма Компьютеры — анализ VO2 max, методика, результаты тестов и т. Д.Видеорегистраторы — анализ техники Буксировка шин — развитие силы Весы — развитие силы Гипоксические палатки — тренировка на высоте Носовые полоски Парашюты — развитие силы Спортивная одежда, обувь и снаряжение Оборудование для измерения времени Вибрационная тренировка Эластичный шнур (тянущий) — развивает скорость Эластичный шнур (удерживающий) — развивает сила Бег под гору (уклон от 3 ° до 5 °) — развивайте скорость Бег в гору (уклон от 5 ° до 10 °) — развивайте силу Беговые дорожки Жилеты с утяжелением (от 5% до 8% веса тела) — развивайте прочность Компрессионная одежда
4 Фармакологические средства Амфетамин Андростендион Анаболический стероид
Бета-блокатор Креатин Моногидрат Кофеин Холин Карнитин Хром Кленбутерол Дегидроэпиандростерон (ДГЭА) Гамма-гидроксимасляная кислота — ГГБ, Гидроксиметилбутират, ГМБ, сульфатин, сульфат натрия, магния, Фосфат, магния
5 Физиологические вспомогательные средства Иглоукалывание Тренировки на высоте Допинг крови Креатин
Молозиво EPO Лекарства на травах Гомеопатия Гормон роста человека Физиотерапия Спорт Массаж Сауна Ультрафиолетовые лучи
6 Пищевые добавки Свекольный сок (нитрат) Бикарбонат соды
Углеводы, содержащие кофеин, креатин, спортивные напитки
7 Центр психологической помощи Приветствие Гипноз Образы Медитация
Музыка Психология Расслабление Тай Чи
.
Posted in Разное
Пищевая сода — химическая формула, состав, получение
Пищевая сода (гидрокарбонат натрия) — кислая соль, состоящая из натрия и угольной кислоты. Выглядит как белый порошок, состоящий из мелких кристаллов. В качестве пищевой добавки встречается в кулинарии и пищевой промышленности. В виде растворов используется и в медицине.
Содержание
- 1 Химическая формула пищевой соды
- 1.1 Формула реакции пищевой соды и уксуса
- 1.2 Формула реакции пищевой соды и лимонной кислоты
- 2 Об истории открытия
- 3 Химический состав пищевой соды по ГОСТ
- 4 Калорийность пищевой соды
- 5 Растворимость соды в воде
- 6 Пищевая сода — это щелочь или кислота?
- 7 Как добывают пищевую соду?
- 8 Как хранить пищевую соду?
Химическая формула пищевой соды
Гидрокарбонат натрия имеет формулу NaHCO3, где Na — натрий, H — водород, CO — углерод.
Значение атомной массы — 84,00 а. е.
е.
Молярная масса вещества составляет 84,007 г/моль.
Плотность натрий двууглекислого составляет 2,16 г/см3.
Формула реакции пищевой соды и уксуса
NaHCO3 + Ch4COOH → Ch4COONa + CO2↑ + h3O
Формула реакции пищевой соды и лимонной кислоты
Н3С6Н5О7 + 3NaHCO3 → Na3C6H5O7 + 3CO2 + 3h3O
Об истории открытия
Впервые упоминания о соде появляются в воспоминаниях Диоскорида Педания — врача из Рима, который описал метод получения порошка с помощью упаривания вещества из озёрной воды.
Первая «искусственная» сода появилась только в XVIII веке. Для искусственного получения вещества в 1736 году химику Анри Дюамелю де Монсо понадобилось использовать метод кристаллизации.Впервые промышленным способом содовый порошок был получен в России. В основу промышленного получения легло открытие химика Эрика Лаксмана, установившего, что сода получается путем спекания древесного угля и природного сульфата натрия. Э. Лаксману удалось опробовать этот метод на заводе по производству стекла в Тальцинске. Но, метод не получил широкого распространения.
Но, метод не получил широкого распространения.
Более удачная попытка состоялась в 1791 году, когда французский химик Н. Лебман начал получать соду путем сплавления мела, смеси сульфата натрия и древесного угля. Было создано предприятие, дававшее 120 кг. содового порошка ежедневно.
Технология Лебмана с успехом применялась в Европе, а в 1864 году в России открылся первый завод такого типа. Это было барнаульское предприятие, созданное промышленником М. Прагом. Позже в России открылся крупный завод, дававший 20 000 тонн содового порошка ежегодно.
На новом предприятии производство велось по аммиачной технологии, которая была предложена и запатентована еще 1838—1840 годах. Аммиачный метод был более экономным и позволял получать соду более высокого качества, поэтому к 1916-1920 годам были закрыты все предприятия, работающие по технологии Лебмана.
Химический состав пищевой соды по ГОСТ
Сода, использующаяся в пищевой промышленности. Обозначается как добавка Е500.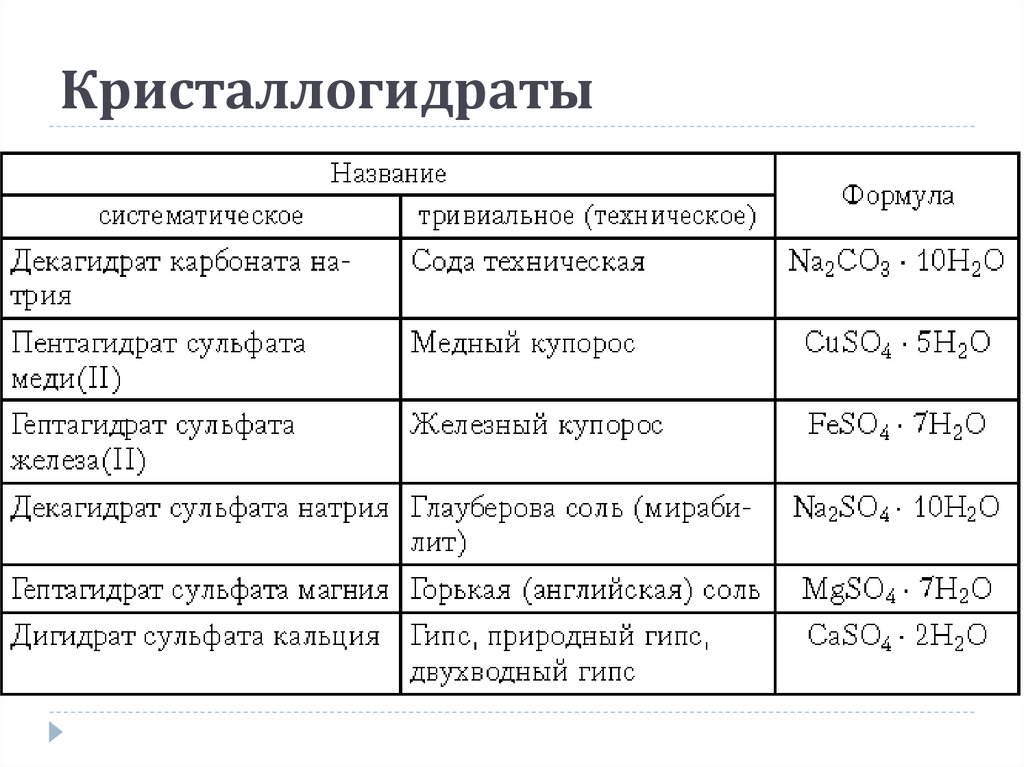 Согласно ГОСТ, 100 гр. пищевой соды состоит из:
Согласно ГОСТ, 100 гр. пищевой соды состоит из:
- Золы — 36,9 гр.
- Воды — 0,2 гр.
- Натрия — 24,7 гр.
- Селена — 0,2 мкг.
Смотрите также: что такое гидроксид натрия.
Калорийность пищевой соды
Натрий двууглекислый не содержит пищевых волокон, белков, жиров и углеводов. Калорийность на 100 гр. — 0 калорий.
Растворимость соды в воде
Бикарбонат натрия хорошо растворяется в воде, образуя другие химические соединения. В горячей воде он растворяется лучше, с холодной взаимодействует слабо.Готовый водный раствор обладает слабой щелочной реакцией. Водный содовый раствор является электролитом с хорошей токопроводимостью.
Пищевая сода — это щелочь или кислота?
Кислотность или щелочность любого раствора химического вещества вычисляется по значению показателя водорода (ph). К растворам с кислотной средой относятся растворы, имеющие pH 6 и ниже. Растворы с pH 8 и более высокими показателями относятся к растворам со щелочной средой.
У водного раствора гидрокарбоната натрия рН равен 9, поэтому он относится к слабой щелочи, способной к нейтрализации действия сильных кислот.
Чем отличается кальцинированная сода от пищевой смотрите в этой статье.
Как добывают пищевую соду?
Естественным способом пищевая сода добывается на берегах высохших содовых водоемов. В природе содовые образования содержатся в целой группе минералов. Самым распространенным считается трона — минерал, из которого содовый порошок получают после тщательной очистки, дробления и нагрева.Природное сырьё для получения соды состоит из обширной группы минеральных образований, содержащих углекислый натрий. Все сырье делится на две группы:
- Горные породы, содержащие необходимые минералы и подземные воды, обладающие высоким содержанием карбоната натрия.
- Содовые месторождения, содержащие залежи трона, натрона и галита. Рапные и высохшие озёра, на берегах которых образуются «содовые сугробы».
В России использование минералов для выщелачивания гидрокарбоната натрия прекратилось в 1971 году. Ранее соду добывали в шахтах, выщелачивая вещество раствором, который затем откачивался на поверхность.
Ранее соду добывали в шахтах, выщелачивая вещество раствором, который затем откачивался на поверхность.
На видео репортаж о том, как производят соду в современных условиях в Башкирской компании.
Сейчас содовый порошок получается с помощью аммиачно-хлоридного способа: через концентрат хлорида натрия, предварительно насыщенный аммиаком, пускают углекислый газ. Из полученного вещества химическим путем выделяют соду, а аммиак, остающийся от процесса выделения, возвращают обратно в производственный процесс.
Как хранить пищевую соду?
Большая часть «бытовых» упаковок с содой выпускается в картонных коробках, в которых содержится пакет с содовым порошком. Коробка должна находиться в сухом, прохладном месте и не подвергаться воздействию влаги и солнечных лучей.
Если упаковка открыта, хранить пищевую соду лучше в герметичной емкости — так вы убережете порошок от попадания влаги.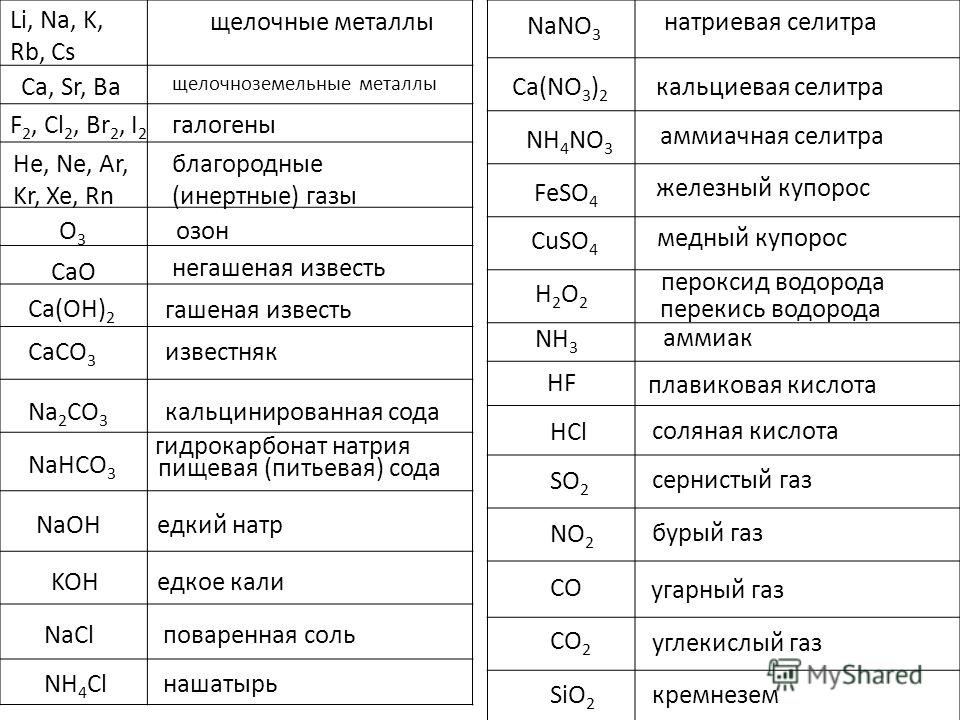 Срок хранения открытой упаковки — 6 месяцев, в запечатанной упаковке с соблюдением условий хранения содовый порошок хранится 18 месяцев.
Срок хранения открытой упаковки — 6 месяцев, в запечатанной упаковке с соблюдением условий хранения содовый порошок хранится 18 месяцев.
Смотрите далее: пищевая сода — применение в быту.
Кальцинированная сода — приминение в домашних условиях. Кальцинированная сода: свойства, применение в быту и огороде
Содержание
- Что такое кальцинированная сода
- История производства и применения соды
- Виды
- Особенности
- Свойства
- Нахождение в природе
- Получение
- Способ Леблана
- Промышленный аммиачный способ (способ Сольве)
- Способ Хоу
- Отличие от каустической и питьевой
- Польза и вред кальцинированной соды
- Применение кальцинированной соды в производстве
- Применение в быту
- Стирка, отбеливание и уход за стиральной машиной
- Борьба со стойкими пятнами
- Кипячение белья
- Гель для стирки
- Применение на кухне
- Пол
- Сантехника
- Содово-мыльная смесь
- Обработка уксусом и кальцинированной содой
- Как очистить старую ванну смесью из двух видов соды
- Удаление старой краски
- Применение в садоводстве
- Обработка растений
- Избавляемся от тли
- Омоложение розовых кустов
- Техническая сода от сорняков
- Спасаем калину с помощью кальцинированной содой
- Профилактическая обработка
- Что нельзя чистить кальцинированной содой?
- Меры безопасности
- Как хранится и транспортируется
- В завершение
- Отзывы
Что такое кальцинированная сода
Это одна из разновидностей карбоната натрия. Формула кальцинированной соды выглядит так: Na2CO3. Своим названием это вещество обязано растению, из золы которого его добывали – солянка содоносная. Иными словами, кальцинированная сода – это натриевая соль угольной кислоты. Внешне – это белый порошок из мелких и крупных кристаллов. Такой вид соды встречается и в подземных пластах, и в грунтовых растворах, а также в минералах морей и озер.
Формула кальцинированной соды выглядит так: Na2CO3. Своим названием это вещество обязано растению, из золы которого его добывали – солянка содоносная. Иными словами, кальцинированная сода – это натриевая соль угольной кислоты. Внешне – это белый порошок из мелких и крупных кристаллов. Такой вид соды встречается и в подземных пластах, и в грунтовых растворах, а также в минералах морей и озер.
Химическая формула кальцинированной соды — Na2CO3. Её называют также карбонатом натрия или натриевой солью угольной кислоты. Имеет белый цвет и выпускается в форме гранул или порошка.
История производства и применения соды
Еще древние египтяне использовали природную соду, извлеченную из озерных вод как моющее средство, и применяли ее для варки стекла. Кальцинированная сода в природе видится много, по большей части, в соляных пластах в виде подземных грунтовых рассолов, и рапы в соляных озерах. Карбонат натрия кроме этого видится в золе некоторых морских водорослей.
Принципиально важно! На земле известны более 60 месторождений кальцинированной соды. Большие запасы карбоната натрия сосредоточены: в Соединенных Штатах, Канаде, Мексике, ЮАР, Кении и др. Содовые озера видятся в Забайкалье и западной Сибири. Кроме этого огромной известностью пользуется озеро Натрон в Танзании.
Большие запасы карбоната натрия сосредоточены: в Соединенных Штатах, Канаде, Мексике, ЮАР, Кении и др. Содовые озера видятся в Забайкалье и западной Сибири. Кроме этого огромной известностью пользуется озеро Натрон в Танзании.
Карбонат натрия видится и в виде ряда минералов. В Соединенных Штатах природная сода образовывает более 40% потребности страны в этом ископаемом. На территории СНГ отсутствую большие месторождения бикарбоната натрия, исходя из этого из минералов кальцинированная сода не добывается, но первый промышленный метод получения этого порошка появился в России.
Принципиально важно! В 1764 году российский химик, швед по происхождению Эрик Густав Лаксман внес предложение получать соду спеканием природного сульфата натрия с древесным углем. В 1784 году на своем стекольном заводе Лаксман осуществил получение соды по своему способу, но, к сожалению, предстоящего развития данный метод не взял.
Сейчас производство карбоната натрия осуществляется 4 методами:
- На базе природной соды.

- Переработкой нефилинов.
- Аммиачным методом (из хлорида натрия).
- Карбонизацией гидроксида натрия.
Принципиально важно! Производство карбоната натрия из природного сырья отрасль относительно новая (появилась во второй половине 40-х годов). И сейчас это основной соперник аммиачного метода производства, за счет высокой экологической чистоты и большой экономической выгоды.
Виды
Поскольку кальцинированная сода – химическое вещество, применяемое не только в быту, но и промышленных целях, то она имеет определенный стандарт. Этот стандарт был принят еще в Советском Союзе и действует до наших дней. Согласно стандарту сода подразделяется на две марки, в зависимости от ее назначения:
- Марка А, внешне выглядит как белые гранулы. Используется для производства электровакуумного стекла.
- Марка Б, внешне похожа на белый порошок. Используется в хим. промышленности для производства синтетических моющих средств.
В рамках каждой марки делится на сорта: высший, средний и низший.
Известная рядовому потребителю кальцинированная сода относится к марке Б.
Особенности
Химическая формула кальцинированной соды — Na2CO3. Её называют также карбонатом натрия или натриевой солью угольной кислоты. Имеет белый цвет и выпускается в форме гранул или порошка.
Вещество не обладает характерным запахом и растворяется в воде. Кристаллы легко впитывают влагу и запахи. При этом углекислоты карбоната натрия могут выделять кислые соли.
Кальцинированную соду получают путем переработки минералов, а также в ходе аммиачно-содового процесса.
Свойства
Карбонат натрия легко вступает в химические реакции. Благодаря этой характеристике вещество активно применяют в промышленном производстве. Оно участвует в производстве красок, лаков и стекла.
Свойство кальцинированной соды смягчать воду и удалять сложные загрязнения сделало ее любимым чистящим средством многих хозяек.
Но не стоит пользоваться порошком, не зная правила применения.
Внимание! По воздействию на человека имеет третий класс опасности. Ошибки могут вызвать ожог или порчу вещей.
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
Вместе с троной в этой осадочной толще обнаружено много, ранее считавшихся редкими, минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблана получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000°C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида. Сульфид натрия реагирует с карбонатом кальция.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием. Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты. Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония Nh5HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20°C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160°C, при этом он переходит в карбонат натрия:
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции: возвращают в производственный цикл.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского поселка Березники в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует карбонат кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Хоу.
Отличие от каустической и питьевой
Все три вида соды отличаются друг от друга щелочной силой и свойствами, благодаря которым разнятся их сферы применения:
| Пищевая сода | 8,1 | Пищевые и бытовые цели. |
| Кальцинированная сода | 11 | Промышленность и бытовые нужды. |
| Каустическая сода | 13 | Промышленность (в пищевой сфере как E524). Сильная щелочь! В бытовых условиях применяется, но со строгим соблюдением мер предосторожности. |
Польза и вред кальцинированной соды
Сразу отметим, что карбонат натрия используется не только для бытовых нужд, его активно применяют и в промышленных масштабах. Среди изобилия полезных свойств этого соединения, выделим основные:
- помогает отбелить белье;
- удаляет даже жирные и въевшиеся пятна с одежды;
- прекрасно очищает от известкового налета ванну и раковины, а также унитаз и кафель;
- вполне подходит для мытья посуды;
- обладает дезинфицирующим эффектом;
- смягчает жесткую воду;
- способно удалять засоры в трубах;
- в сельскохозяйственной сфере при помощи соды борются с вредителями.
Применяется в основном на производстве и в качестве замены некоторым средствам бытовой химии. Однако, при множестве достоинств, есть и вполне ощутимые недостатки. И заключаются они, прежде всего, в опасности данного вещества. А для того, чтобы с таким «недостатком» бороться, достаточно лишь соблюдать определенные меры предосторожности:
Однако, при множестве достоинств, есть и вполне ощутимые недостатки. И заключаются они, прежде всего, в опасности данного вещества. А для того, чтобы с таким «недостатком» бороться, достаточно лишь соблюдать определенные меры предосторожности:
- не хранить соду в помещении с повышенной влажностью;
- аккуратно пользоваться. При попадании на кожу или на слизистую тщательно промыть проточной водой;
- нельзя хранить соду рядом с продуктами питания;
- сода не выносит прямых солнечных лучей, поэтому для того, чтобы сохранить ее полезные свойства, храните вещество в закрытых мешках в темных сухих помещениях;
- для того, чтобы отстирать трудновыводимые пятна, важно соблюдать дозировку и пропорции, иначе вещь можно испортить.
Соду необходимо хранить в сухом помещении, в закрытой емкости и не допускать детей к данному веществу.
Применение кальцинированной соды в производстве
Наверное, многие не задумываются над тем, насколько широко применяется кальцинированная сода в производстве. А между тем, многие отрасли просто не могли бы существовать без карбоната натрия.
А между тем, многие отрасли просто не могли бы существовать без карбоната натрия.
- С помощью соды изготавливают стекло, хрусталь и кафель.
- В черной металлургии ее применяют для удаления серы из железа.
- Для производства кобальта, никеля или алюминия (отрасль цветной металлургии) также необходим карбонат натрия.
- Сода входит в состав машинного масла.
- Производство хозяйственного и жидкого мыла не обходится без ее «участия».
- Бумажная промышленность активно использует соду для проклеивания картона, отбеливания бумаги и изготовления пергамента.
- Медицинская отрасль применяет соду для обработки медикаментов.
- В текстильной промышленности при «участии» карбоната натрия изготавливают шелк, отбеливают и окрашивают ткани.
Применение такого незамысловатого на первый взгляд вещества настолько разнообразно, что перечислить все отрасли и технологии не представляется возможным.
Применение в быту
Сфера применения очень широкая – мытье посуды, чистка сантехники (раковины, ванны, унитаза), очищение кухонных поверхностей, стирка, мытье полов, чистка стиральной машинки от накипи, удаление старой краски.
Чтобы полноценно воспользоваться универсальными свойствами кальцинированной соды, необходимо правильно приготовить раствор. Рецепты его приготовления отличаются в зависимости от того, для каких целей раствор будет использоваться.
Стирка, отбеливание и уход за стиральной машиной
Наиболее удобный и современный способ стирки белья – использование стиральной машинки. Однако многие хозяйки до сих пор стирают вещи, замачивая их в тазике или ванне. И при авторежиме, и при ручной стирке поможет усилить действие спирального порошка карбонат натрия.
- Авторежим. При стирке в стиральной машине необходимо добавить 3 столовых ложки кальцинированной соды, причём насыпать её нужно непосредственно в барабан с бельём. Если одежда сильно загрязнена, можно увеличить количество соды ещё на 1–2 ложки. Важно обратить внимание, что при такой методе стирки необходимо следить за температурным режимом – он должен быть в пределах от 50°С до 100°С.
- Ручная стирка. В ведре с горячей водой разводятся 3 столовых ложки карбоната натрия, раствор позволит усилить действие стирального порошка.
 Но следует помнить, что такой метод лучше не использовать при стирке деликатных тканей, поскольку это может привести к их порче.
Но следует помнить, что такой метод лучше не использовать при стирке деликатных тканей, поскольку это может привести к их порче.
Для замачивания одежды необходимо в 10 литрах тёплой (не горячей!) воды растворить 4 столовых ложки соды. В том случае, если вода слишком жёсткая, её можно смягчить, если добавить 2 столовых ложки карбоната натрия.
Известен интересный рецепт раствора, который подойдёт и для ручной, и для машинной стирки. В домашних условиях можно приготовить ароматный стиральный гель, который не только справится с сильными загрязнениями, но и избавит от необходимости использовать кондиционер для белья. К тому же может использоваться для замачивания, отбеливания и стирки вещей для новорожденных, требующих особенно деликатного подхода. Как следствие – ещё больше экономии в семейном бюджете.
Для приготовления геля потребуются:
- вода – 2 литра;
- хозяйственное мыло – 1 шт;
- кальцинированная сода – 150 гр;
- зелёный чай – 200 гр.

Воду закипятить. Мыло натереть стружкой, добавить к кипящей воде. Когда измельчённое хозяйственное мыло полностью растворится, насыпать соду, чистый зелёный чай (без добавок), перемешать и кипятить ещё в течение трёх минут. После этого снять кастрюлю с огня, добавить несколько капель любого ароматического масла, интенсивно перемешать. Гель готов к применению.
Для качественного отбеливания постельного белья, белой одежды, кухонных полотенец поможет раствор из 4 щепоток соды и стружки хозяйственного мыла. Оба компонента поместить в эмалированную посуду, которую нужно наполовину заполнить водой. Размешивать до тех пор, пока сода и мыло полностью не растворятся.
В воду с раствором поместить вещи, которые необходимо отбелить. Ёмкость поставить на медленный огонь, довести до кипения, после этого кипятить ещё в течение 20 минут. Для лучшего эффекта после кипячения в растворе вещи можно постирать в стиральной машинке.
Лёгкий в приготовлении содовый раствор позволит сделать одежду и постельное бельё не только кристально чистыми, но и ароматными в случае добавления ароматического масла.
Кальцинированная сода – отличное средство для ухода за стиральной машинкой. Одной из основных проблем при эксплуатации машин, в особенности работающих в режиме автомат, является появление накипи на деталях. Как следствие – возникновение неприятного запаха, быстрый износ техники.
Методика правильного ухода за стиральной машинкой:
- Подготовить раствор. Размешать соду с водой в пропорции 1:1.
- Обработать раствором барабан и резиновую манжетку. Данную процедуру нужно проводить в резиновых перчатках!
- Для того, чтобы раствор подействовал, необходимо выждать полчаса.
- С помощью губки устранить загрязнения вместе с содовым раствором.
- Включить машинку на режим быстрой стирки.
На последнем этапе процедуры быструю стирку нужно проводить без вещей!
Борьба со стойкими пятнами
Если на одежде остались трудновыводимые пятна от жира или бензина, используйте немного больше порошка кальцинированной соды, чем при обычной стирке. Например, чтобы отстирать сильнозагрязненные изделия при автоматической стирке, добавьте к обычному порошку 5 ст. ложек карбоната натрия.
Например, чтобы отстирать сильнозагрязненные изделия при автоматической стирке, добавьте к обычному порошку 5 ст. ложек карбоната натрия.
Кипячение белья
Улучшить эффект отбеливания поможет кипячение с технической содой. Процедура не только устранит загрязнения, но и продезинфицирует материал.
Способ применения:
- Для кипячения выбирайте емкость, изготовленную из металлов, которые не вступают в реакцию с веществом. Категорически не рекомендуется использовать алюминиевые и медные кастрюли.
- Перед процедурой обеспечьте доступ свежего воздуха в помещение, а во время процедуры старайтесь не вдыхать пары.
- В 10 л воды растворите 500 г порошка кальцинированной соды и 500 мл белизны.
- Сложите белье в кастрюлю и прокипятите в течение 40–60 минут.
После процедуры постирайте вещи обычным способом.
Гель для стирки
Из кальцинированной соды вы можете приготовить эффективный гель для ручной стирки. Помимо карбоната натрия вам потребуется:
- 2 ст.
 ложки глицерина;
ложки глицерина; - 100 г хозяйственного мыла;
- несколько капель эфирного масла.
Метод приготовления:
- Закипятите 2 л воды.
- Добавьте в жидкость хозяйственное мыло.
- Кипятите смесь, пока мыло полностью не растворится.
- Всыпьте 150 г натриевой соли.
- Прокипятите раствор 3 минуты.
- Снимите емкость с огня, и добавьте глицерин.
- На последнем этапе влейте в смесь эфирное масло и тщательно перемешайте.
Когда смесь полностью остынет, перелейте ее в красивый флакон и используйте вместо геля для ручной стирки.
Применение на кухне
При использовании карбоната натрия для мытья посуды нужно в литре воды развести 3 столовых ложки соды, тщательно размешать. Такой раствор позволит не только очистить посуду от загрязнений, но и отлично справится с жиром. После того, как посуда полностью помыта, её необходимо хорошенько прополоснуть в чистой проточной воде.
Кальцинированная сода хорошо справляется с накипью в чайниках, как обычных, так и электрических. Для этого достаточно пару ложек карбоната натрия насыпать в чайник, налить в него воду и прокипятить несколько раз. После этого нужно очень качественно промыть чистой водой.
Для этого достаточно пару ложек карбоната натрия насыпать в чайник, налить в него воду и прокипятить несколько раз. После этого нужно очень качественно промыть чистой водой.
Пол
С помощью раствора на основе кальцинированной соды можно мыть пол по всей квартире. В пяти литрах воды развести 4 столовых ложки карбоната натрия, хорошо вымыть пол, затем протереть ещё раз тряпкой, смоченной в чистой воде. Чтобы не осталось разводов, нужно насухо протереть всю очищенную поверхность.
Сантехника
Для очищения сантехники в литре воды развести 2 столовых ложки соды, после этого в полученном растворе смочить губку или мочалку, тщательно протереть загрязнённую поверхность. После достижения требуемого результата, необходимо тщательно промыть обработанную сантехнику чистой проточной водой. Затем протереть сухой тряпочкой, чтобы на поверхности не осталось разводов.
Содово-мыльная смесь
Для приготовления вам потребуется 100 г технической соды и столько же стружки хозяйственного мыла. Тщательно смешайте мыло с порошком. Добавьте в смесь немного воды до получения густой кашицы. Для аромата можно добавить в массу несколько капель ароматического масла.
Тщательно смешайте мыло с порошком. Добавьте в смесь немного воды до получения густой кашицы. Для аромата можно добавить в массу несколько капель ароматического масла.
Нанесите полученную смесь на сантехнику и оставьте для воздействия. Спустя 60 мин удалите чистящую массу тряпкой и ополосните поверхность.
Обработка уксусом и кальцинированной содой
Обработка сантехники осуществляется в 2 этапа. Изначально обработайте ванну, раковину или унитаз столовым уксусом. После этого посыпьте поверхность порошком кальцинированной соды. Подождите 15 минут, а затем потрите загрязнения губкой, и обмойте поверхность водой.
Как очистить старую ванну смесью из двух видов соды
Для подобной обработки вам потребуется не только кальцинированная, но и пищевая сода. Помимо этого подготовьте для процедуры немного воды, уксус и белизну.
Порядок действий:
- 2 вида соды смешайте в равных пропорциях и немного разбавьте водой до состояния кашицы.
- Нанесите вещество на поверхность ванной.

- Оставьте для воздействия на 10–15 минут.
- Тем временем соедините уксус с белизной в равном количестве.
- Нанесите хлорно-уксусную смесь на поверхность.
- Оставьте для воздействия на 30 минут.
- Смойте остатки моющих средств чистой водой.
Подобным способом вы можете очистить не только ванну, но и другую сантехнику: унитаз или раковину.
Удаление старой краски
С помощью содового раствора можно избавиться от старой краски, причём нанесенной не только на ровную, но и рельефную поверхность. При выполнении таких работ необходимо в обязательном порядке соблюдать меры предосторожности – надеть перчатки, защитную маску на лицо, очки. После окончания очистительных работ необходимо покинуть помещение и проветривать его не менее 12 часов.
Для приготовления раствора потребуются следующие компоненты:
- сода кальцинированная – 1 кг;
- известь гашеная – 900 гр;
- чистая вода – 4,5 л.
Поскольку раствор сильно пенится, необходимо подготовить его в ёмкости объёмом не менее 10 л.
В первую очередь в воде нужно растворить соду, затем нагреть до температуры не менее 60°. Помешивая смесь, постепенно добавлять небольшими порциями гашеную известь. Полученную смесь можно использовать на любых окрашенных поверхностях.
Применение в садоводстве
В садоводстве кальцинированная сода известна как защитник от мучнистой росы и серой гнили, капустного вредителя и тли.
Для защиты растений иногда используют раствор соды, но такое орошение уже не считается натуральным средством
Соду разводят из расчёта 2–4 столовые ложки на 10 литров воды. Этой смесью орошают растения три раза за сезон. Однако нужно понимать, что такой способ не является натуральным и может нанести вред растениям. Поэтому многие садоводы рекомендуют использовать для опрыскивания пищевую соду, а не кальцинированную.
Обработка растений
Мучнистая роса:
- Растворите две столовых ложки соды в ведре воды.
- Добавьте 40 грамм измельченного хозяйственного мыла, размешайте до полного растворения.

- В безветренный день без жары и дождя опрыскайте сад. Обработку можно проводить раз в неделю. Для профилактики полезно раз или два распылить раствор весной во время цветения.
Многолетние цветы:
- Четыре столовых ложки разведите в ведре воды.
- Периодически опрыскивайте растения в период цветения.
Чтобы устранить серую гниль, поливайте цветы раз в две недели раствором из столовой ложки соды на 10 литров воды.
Калиновый листоед:
- Измельчите брусок зеленого калийного мыла.
- Растворите мыльную стружку в ведре воды.
- Добавьте столовую ложку карбоната натрия.
- Обрабатывайте листья с тыльной стороны раз в неделю, пока болезнь не исчезнет.
Розовые кусты:
Омолодить розы можно таким составом:
- Вода — 5 литров.
- Кальцинированная сода — чайная ложка.
- Нашатырный спирт — половина чайной ложки.
- Соль Эпсома — чайная ложка.
Каждые 10 дней поливайте или опрыскивайте розы этим раствором.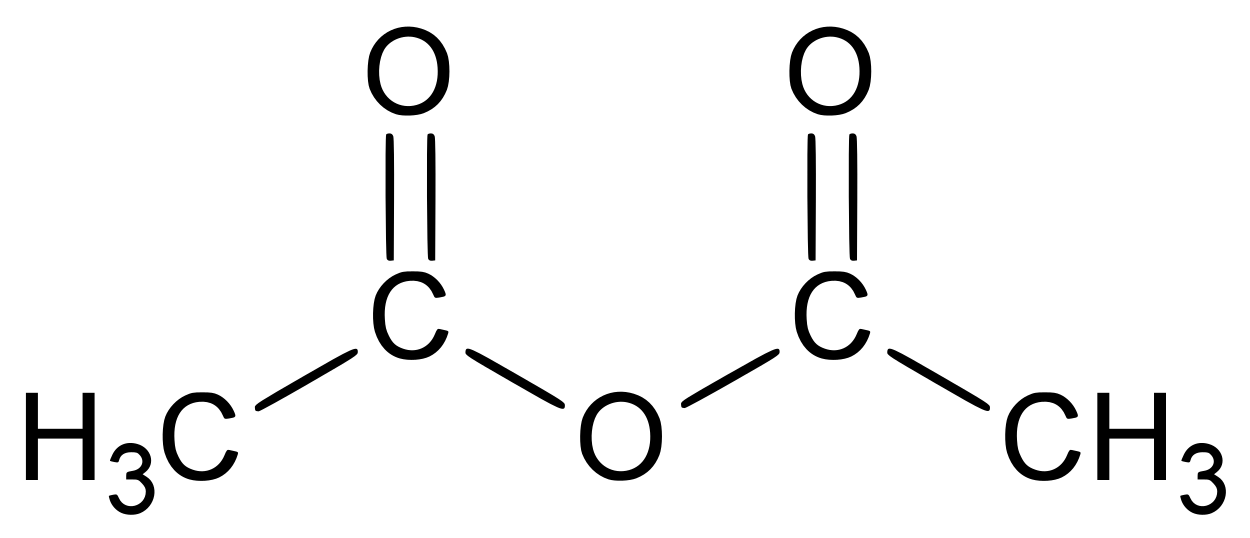 Если растение молодое, нашатырный спирт из рецепта исключите.
Если растение молодое, нашатырный спирт из рецепта исключите.
Если вы – заядлый дачник, наверняка знаете об использовании кальцинированной соды в саду и огороде
Избавляемся от тли
О том, что тлю можно извести содой быстро и эффективно, огородники знают давным-давно. Метод с доказанной эффективностью популярен еще потому, что попутно позволяет повысить урожайность и защищает растения от плесени и многих болезней. Содовым раствором можно обрабатывать цветы, плодовые деревья, ягодные кустарники, огородные и комнатные растения.
Щелочь в сочетании с мылом создает невыносимые для вредителей условия, но спастись бегством они не могут — мешает вязкий мыльный слой.
- Натрите хозяйственное (300 г) или дегтярное (100 г) мыло.
- Растворите мыло в теплой воде.
- Добавьте столовую ложку карбоната натрия на каждые два литра воды.
К этому составу можно добавить чайную ложку йода, чтобы ускорить восстановление поврежденных растений. Измельченный чеснок в содовом растворе надолго отпугнет тлю от вашего участка.
Не злоупотребляйте содово-мыльной обработкой, иначе листья в вашем саду пожелтеют и опадут раньше времени. Промежуток между обработками — не менее недели. Последнее опрыскивание — за три недели до сбора урожая.
Возможно, вам будет интересно: Пищевая сода для огорода или сада — незаменимый спасатель дачника
Омоложение розовых кустов
Приносит пользу карбонат натрия, являющийся экономически выгодным веществом, для проведения процедуры по омоложению кустов роз.
Алгоритм приготовления:
- Соединяют английскую соль с кальцинированной содой — по 2 ч. л.
- Добавляют к получившейся смеси нашатырный спирт — 1 ч. л.
- Наливают в ведро прохладную воду — 10 л.
- Растворяют в ней приготовленное на базе карбоната натрия ассорти без остатка.
Кусты чарующей розы опрыскивают через каждые 10 дней.
Техническая сода от сорняков
Справиться с сорняками на огороде бывает проще, чем изничтожить нежелательную растительность, упорно пробивающуюся между тротуарной плиткой, у стен дома и под забором. В данном случае вам не нужно беспокоиться о здоровье растений — полейте проблемные участки концентратом кальцинированной соды. Эффект возрастет, если для борьбы вы выберете жаркий и сухой день.
В данном случае вам не нужно беспокоиться о здоровье растений — полейте проблемные участки концентратом кальцинированной соды. Эффект возрастет, если для борьбы вы выберете жаркий и сухой день.
Спасаем калину с помощью кальцинированной содой
Сода кальцинированная, применение в огороде которой показывает успешные результаты, способна помочь в борьбе с калиновым листоедом – жуком, питающимся и развивающимся исключительно на калине. Огромный ущерб растению наносят перезимовавшие в коре молодых побегов грязно-серые личинки: вредители просто изрешечивают листья и способны полностью обглодать куст, лишив его зеленой массы.
Профилактическая обработка
С целью организации профилактических мероприятий, призванных предупредить появление вредителей или развитие заболеваний, в весенний период рекомендуется орошать кусты, травянистые растения, деревья экологически безопасным составом.
Приготовление бургундской жидкости:
- Отмеряют медный купорос — 70 г.

- Разводят в емкости, куда наливают 250 мл горячей воды.
- После процеживания переливают в прохладную воду — 5 л.
- Затем отмеряют кальцинированную разновидность соды — 80 г.
- Растворяют ее в слегка подогретой воде — 5 л.
Соединяют обе жидкости и применяют для опрыскивания.
Что нельзя чистить кальцинированной содой?
Карбонат натрия считается не пригодным к применению в следующих случаях:
- для стирки одежды из деликатных, тонких тканей: шелк, шерсть. Они станут грубыми и потеряют первоначальный вид;
- для стирки мембранных изделий, так как защитные качества этого материала будут полностью утрачены;
- для чистки посуды из алюминия;
- для мытья натяжных потолков и потолочных плиток из стекловолокна;
- для мытья деревянных полов, паркета или ламината.
Эти вещи и поверхности не переносят контакта с агрессивной щелочной средой.
Меры безопасности
Так как карбонат натрия является не таким безопасным, как пищевая сода, использовать его необходимо соблюдая определенные меры предосторожности:
- надевать хозяйственные прорезиненные перчатки, для того чтобы защитить эпидермис рук;
- хранить такое вещество вдали от лекарств и продуктов питания;
- выбрать такое место для хранения, где данную соду не достанет маленький ребенок;
- если вещество попало в глаза, нос либо ротовую полость, то их нужно очень хорошо промыть и обязательно для этого надо использовать проточную воду;
- использовать кальцинированную соду надо аккуратно, при этом обязательно соблюдайте рекомендуемые пропорции, для того чтобы избежать возможных неприятностей.

При выборе места для хранения такого вещества следует помнить, что оно впитывает влагу и углекислоту. В связи с этим длительное хранение карбоната натрия в открытой упаковке, может привести к тому, что он слежится, и уменьшится его объем.
Как хранится и транспортируется
Для хранения и транспортировки такого вида соды используют одноразовые мешки либо контейнеры, сделанные из полипропилена. Транспортировать данное вещество можно любым транспортным средством, однако при этом стоит учесть, чтобы на карбонат натрия не попадала жидкость либо прямые лучи солнца.
Надо следить за тем, чтобы во время хранения и транспортировки кальцинированной соды тара была надежно закрыта. Помещения для хранения выбирают с невысокой влажностью воздуха и с маленькими оконными проемами, что сделает возможность попадания на вещество прямых лучей солнца минимальной.
В завершение
Кальцинированная сода представляет уникальное химическое соединение, которое используется человечеством на протяжении многих лет не только во многих отраслях промышленности, но и в быту. Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Вряд ли кто-то задумывался над тем, что в производстве многих вещей, которые нас окружают, применяется кальцинированная сода. К тому же изготавливает ее из природного сырья. Многие чистящие и моющие средства, стиральные порошки и прочая дорогая бытовая химия, которая продается по высоким ценам, – это раствор кальцинированной соды, который был вида изменен и разбавлен определенными добавками.
Отзывы
Я соль покупаю для посудомоек, вместо таблетки сыплю кальцинированную соду, вместо ополаскивателя — уксус пищевой, который уже не надо разбавлять. Моет так же, как и с таблетками. А так вообще выгодно. Пачка кальцинированной соды у нас 20 р. стоит. У меня посуда чистая из посудомойки, и бокалы блестят. А раньше как содой и горчицей всё начищали до блеска? Я содой пользуюсь как раз для того, чтобы минимизировать химию в своём доме.
И уж точно не буду давать её в руки детям. ИМХО.
Торопова Олеся
В прошлом, кажется, году у меня было приключение с кошачьим калом на водительском сиденье, может кто помнит. Я использовала какой-то метод из интернета: точно помню, что там использовалась пищевая сода и перекись что ли. Погуглите — мне помог этот способ. А составы от запаха готовые не помогли.
Тропинка
Не отстирались пятна от чего? Ну хоть предположительно? «Босом» я стираю всегда, вообще всегда, ещё соду кальцинированную сыплю, не знаю зачем, наверное, смягчает воду… В общем, помогает до поры, потом всё же кипятить приходится или в этой байде замачивать. Благо что «Бос», что сода стоят не дороже 40 р.
КопАлёна
Теперь вы знаете о замечательном помощнике хозяйки — кальцинированной соде. И можете экономить на многих других дорогостоящих средствах бытовой химии.
Источники
- https://severdv.ru/sovety/sposoby-primeneniya-kalczinirovannoj-sody/
- https://Chistim-chistim.
 ru/khimicheskaya-formula-kaltsinirovannoy-sody/
ru/khimicheskaya-formula-kaltsinirovannoy-sody/ - https://GulliverOpt.ru/ubiraem/kalcinirovannaya-soda-formula-2.html
- https://SodaSovet.ru/kaltsinirovannaya-soda/
- https://DecorObot.ru/chistota-i-uyut/kalcinirovannaya-soda.html
- https://DecorObot.ru/chistota-i-uyut/kalcinirovannaya-soda-formula.html
- https://welady.ru/kaltsinirovannaya-soda
- https://domovod.guru/sredstva-dlya-chistki/soda-kaltsinirovannaya-primenenie.html
- https://TopSoda.ru/o-sode/vidy/kaltsinirovannaya-tehnicheskaya-soda
- https://soda-soda.ru/sad-i-ogorod/primenenie-kalcinirovannoi-sodi-v-sadu-ogorode-na-dache.html
- https://chistsovet.ru/uborka/kaltsinirovannaya-soda/
- https://InfoDoz.ru/uborka/formula-kalcinirovannoj-sody-v-himii.html
- https://MullerHall.ru/uborka-v-dome/kalcinirovannaya-soda-formula-2.html
Сода кальцинированная. Способы производства. Основные виды и применение — Студопедия
Поделись
Сода кальцинированная — карбонат натрия, безводный углекислый натрий, химическая формула –Na2CO3
В природе сода встречается в виде минералов: трона Na2CO3× NaHCO3×2H2O, сода (синонимы натрит и натрон) Na2CO3× 10 H2O и термонатрит Na2CO3·Н2O. Сода кристаллизуется в моноклинной системе, образует белые зернистые или порошковые массы, на воздухе быстро теряет воду. Плотность — 1420 (сода) кг/м3.
Сода кристаллизуется в моноклинной системе, образует белые зернистые или порошковые массы, на воздухе быстро теряет воду. Плотность — 1420 (сода) кг/м3.
Производство кальцинированной соды осуществляется аммиачным методом путем взаимодействия насыщенного водного раствора хлористого натрия и углекислого газа в присутствии аммиака с образованием бикарбоната натрия и последующей его кальцинацией.
NH3 + CO2 + h3O + NaCl → NaHCO3 + NH4Cl + Q
Предприятие производит соду тяжелую (марка А) и легкую (марка Б).
Основное сырье для получения технической кальцинированной соды:
Ø высококачественные известняки Крымского полуострова;
Ø экологически чистая рапа Сиваша;
Ø уголь – антрацит Донбасса;
Ø аммиачная вода, сернистые соединения с коксохимических и химических заводов Украины
В силу особенностей исходного сырья — соляной рапы очистка рассолов от солей жесткости производится в две стадии, что дает высокую степень чистоты рассолов и низкое содержание нерастворимых примесей в соде кальцинированной.
Путем обжига высококачественного известняка в шахтных печах происходит его разложение на углекислый газ и оксид кальция.
При насыщении очищенного рассола углекислым газом, с использованием аммиака в качестве катализатора, образуется бикарбонат натрия, который в паровых кальцинаторах при высокой температуре превращается в кальцинированную соду.
Соду тяжелую (марка А) на предприятии получают моногидратным способом из легкой соды. Тяжелая сода имеет такую химическую формулу как и легкая, но высокий насыпной вес и выпускается в гранулах. Это улучшает ее потребительские свойства, благодаря чему она пользуется преимущественным спросом на внешнем рынке.
Диоксид углерода получают обжигом известняка в печах при температуре 1100—1200 °С по реакции:
СаСО3 = СаО + СО2—Q.
Прокаливанием двууглекислого натрия при температуре 150—160°С получают кальцинированную соду согласно уравнению:
2NаНСОз = Nа2СОз + Н20 + С02—Q
Необходимый для технологического процесса аммиак регенерируют из полученного хлористого аммония, воздействуя гашеной известью:
2NН4С1 + Са(ОН)2 = 2NН3 + СаС12 + Н20 + Q
Отходом производства при данном способе является хлорид кальция, который имеет ограниченное применение. Вырабатываемая аммиачным способом сода под названием «Сода кальцинированная техническая» используется в качестве сырья при производстве бикарбоната натрия и каустической соды, широко применяется в мыловаренной, нефтяной, текстильной, лакокрасочной промышленности, при получении различных солей натрия, химических волокон, искусственной кожи, красителей, глинозема, при очистке воды и рассолов и в других отраслях промышленности, а также в быту в качестве моющего средства. В соответствии с ГОСТом кальцинированная сода, полученная аммиачным способом, должна содержать не менее 99% Na2СОз.
Вырабатываемая аммиачным способом сода под названием «Сода кальцинированная техническая» используется в качестве сырья при производстве бикарбоната натрия и каустической соды, широко применяется в мыловаренной, нефтяной, текстильной, лакокрасочной промышленности, при получении различных солей натрия, химических волокон, искусственной кожи, красителей, глинозема, при очистке воды и рассолов и в других отраслях промышленности, а также в быту в качестве моющего средства. В соответствии с ГОСТом кальцинированная сода, полученная аммиачным способом, должна содержать не менее 99% Na2СОз.
Нефелиновая руда п(Nа, К)2О-А12Оз•SiO2, служит сырьем для производства глинозема. Однако при комплексной переработке из нефелина получают цемент, соду и поташ.
Постоянная потребность в глиноземе обусловливает увеличение выпуска кальцинированной соды из нефелинового сырья. Из спекшейся массы, состоящей из смеси нефелина и известняка, выщелачиванием водой отделяют шлам силиката натрия, используемый при производстве цемента, а полученные растворы алюминатов натрия и калия, подвергая карбонизации, превращают в гидроксид алюминия и раствор соды и поташа:
2(Na,К) А1О2 + СО2 + ЗН2О = 2А1(ОН)з+ (Nа,К)2СО3.
Из полученных растворов путем выпаривания и сушки производят соду, поташ и их смесь. При переработке нефелиновой руды на 1 тонну глинозема получают около 1,6 тонн соды и поташа и до 10 тонн высококачественного цемента. Хотя в настоящее время более 75% кальцинированной соды производится аммиачным способом, получение соды из нефелина является более перспективным, так как при этом достигается безотходное использование сырья и снижение трудовых затрат на единицу продукции по сравнению с аммиачным способом. Однако по содержанию посторонних примесей эта сода менее качественна и содержит до 13% сульфата и карбоната калия.
Полученная «Сода кальцинированная техническая из нефелинового сырья» имеет насыпную массу около 1,0 т/м3 и применяется в стекольной и целлюлозно-бумажной промышленности, в черной и цветной металлургии и в других химических производствах, где посторонние примеси невредны.
Что такое каустическая сода? | The Chemistry Blog
За исключением, пожалуй, воды, немногие химические вещества имеют почти повсеместное промышленное применение, но едкий натр является одним из таких химических веществ. В этой статье мы исследуем, что такое каустическая сода, из чего она сделана, как она используется и какова ее химическая структура.
В этой статье мы исследуем, что такое каустическая сода, из чего она сделана, как она используется и какова ее химическая структура.
В этом посте:
О каустической соде
Едкий натр, который является таким же химическим веществом, как гидроксид натрия и также известен как щелочь, является сильным щелочным неорганическим соединением. Он используется либо в качестве реагента, либо в качестве ингредиента в самых разных продуктах.
Он является одним из наиболее широко используемых химических веществ в промышленных производственных процессах и входит в первую пятерку по объему производства в мире в год, составляющему более 70 миллионов тонн. Одна из причин этого заключается в том, что гидроксид натрия является побочным продуктом производства хлора.
Щелок известен уже тысячи лет, задолго до того, как он был идентифицирован химически. Археологические раскопки показывают, что еще в 2800 г. до н.э. мыло на основе щелочи использовалось вавилонянами, которые делали его, смешивая животный жир и золу в воде. Древние римляне использовали вулканический пепел для производства щелочи, которую они использовали в качестве чистящего средства.
Древние римляне использовали вулканический пепел для производства щелочи, которую они использовали в качестве чистящего средства.
Каустическая сода, как следует из ее названия, очень едкая, что означает, что она может легко сжигать, растворять или разъедать органические материалы, такие как кожа. Его едкие свойства делают его идеальным для растворения целлюлозы в растительных материалах и превращения их в целлюлозу для производства бумаги.
Из чего состоит каустическая сода?
Каустическая сода — это неорганическое химическое соединение, состоящее из натрия, кислорода и водорода. Его менее чистая форма, щелочь, представляет собой продукт древесной золы.
Щелок содержит много примесей, но его активный химический ингредиент такой же, как у более чистого едкого натра/гидроксида натрия, используемого в промышленности. Точное определение гидроксида натрия как отдельного щелочного соединения произошло почти через пять тысяч лет после первого использования щелочи в качестве ингредиента мыла.
Сила едкого натра как щелочного (основного) соединения может быть измерена двумя способами:
- Уровень pH – уровень pH раствора гидроксида натрия варьируется в зависимости от его концентрации в воде. Например, одномолярный раствор имеет значение pH 13. Это означает, что сила щелочности раствора гидроксида натрия напрямую зависит от того, сколько основания присутствует в растворе.
- Константа диссоциации — в отличие от уровня pH, константа диссоциации является более объективным способом измерения силы щелочного соединения, поскольку она не зависит от его концентрации. Константа диссоциации гидроксида натрия равна K б = 6,3 х 10 -1 . Это делает его сильным монопротеком. Монопротонное основание может реагировать только с одним протоном на молекулу.
Константа диссоциации кислоты или основания не имеет единицы измерения, потому что это просто отношение концентрации ионов одного моля этого вещества в растворе к молекулам соединения.
Следовательно, обобщенная формула для константы диссоциации основания может быть выражена как:
K b = [BH + ] [OH – ]/B
Где:
- K b – значение константы диссоциации
- BH + – концентрация положительных ионов
- OH – – концентрация отрицательных ионов
- B – исходная концентрация основания
Как обычно называют едкий натр?
Едкий натр на самом деле является одним из распространенных названий гидроксида натрия. Другое распространенное название соединения – щелочь.
Каустическая сода — это описательное название, основанное на ее промышленном применении, поскольку соединение является достаточно едким, чтобы растворять многие типы органических материалов, таких как белок и целлюлоза. С другой стороны, современное английское слово lye этимологически можно проследить до древнеанглийского слова lēag . Это от протогерманского laugō , которое происходит от протоиндоевропейского lewh , что означает «мыть».
Как видно из этимологии слова, оно подразумевает стирку или чистку, что неудивительно, если учесть тот факт, что щелочь использовалась в качестве чистящего средства с древних времен.
Структура каустической соды
Каустическая сода или гидроксид натрия имеет относительно простую молекулярную структуру (помните, что она состоит только из натрия, кислорода и водорода). В центре молекулы едкого натра находится атом кислорода.
Химическая структура едкого натраАтом натрия имеет ионную связь с атомом кислорода, а атом водорода имеет ковалентную связь с атомом кислорода. Это делает атом натрия положительно заряженным, а атом кислорода — отрицательно заряженным. Следовательно, гидроксид натрия представляет собой полярную молекулу. это означает, что он может растворяться и диссоциировать в воде, но не может делать то же самое в углеводородах.
Формула каустической соды
Каустическая сода химически известна как гидроксид натрия, что выражается химической формулой NaOH. Химическая формула вещества указывает пропорции атомов в молекулярном соединении. В этом случае на молекулу гидроксида натрия приходится один натрий, один кислород и один водород.
Химическая формула вещества указывает пропорции атомов в молекулярном соединении. В этом случае на молекулу гидроксида натрия приходится один натрий, один кислород и один водород.
На основе формулы также можно рассчитать молекулярную массу или молярную массу. Гидроксид натрия имеет молярную массу 39,9971 г моль-1. Молярная масса — одно из немногих свойств химического вещества, которое не нужно определять экспериментально. Другие свойства, такие как температура плавления и растворимость, определяются эмпирически.
Химическое название каустической соды
Каустическая сода, также известная как щелочь, химически известна как гидроксид натрия. Вы также можете услышать, что его называют гидратом натрия или содовым щелоком. Систематическое название соединения по ИЮПАК — оксиданид натрия.
Для чего используется каустическая сода?
Каустическая сода — широко распространенное химическое вещество, используемое в различных промышленных и бытовых целях. Сам по себе он обычно используется в качестве чистящего средства, но также используется в приготовлении различных продуктов, от моющих средств до лекарств. Это имеет решающее значение на многих этапах различных производственных процессов. Вот некоторые из наиболее распространенных применений каустической соды:
Это имеет решающее значение на многих этапах различных производственных процессов. Вот некоторые из наиболее распространенных применений каустической соды:
- Чистящие и дезинфицирующие средства – моющие средства, мыло для ванн и чистящие средства обычно содержат гидроксид натрия в качестве активного ингредиента.
- Фармацевтические препараты и лекарства — производство многих видов лекарств, таких как антихолестериновые препараты и обезболивающие, было бы невозможно без каустической соды. Это щелочное вещество служит реагентом для создания химических прекурсоров.
- Производство энергии – каустическая сода используется в производстве топливных элементов для хранения и производства электроэнергии.
- Водоподготовка – кислотность водоснабжения городов и других крупных населенных пунктов балансируется с помощью гидроксида натрия. Он также используется для производства гипохлорита натрия, который, в свою очередь, используется для дезинфекции воды.
- Пищевое производство – каустическая сода используется в пищевой промышленности, например, при консервировании пищевых продуктов.
 Он также используется для очистки тонкой кожуры фруктов, таких как помидоры, для консервирования. Он обладает консервирующими свойствами, которые предотвращают рост плесени и бактерий.
Он также используется для очистки тонкой кожуры фруктов, таких как помидоры, для консервирования. Он обладает консервирующими свойствами, которые предотвращают рост плесени и бактерий. - Древесина и изделия из бумаги – едкие свойства вещества делают его идеальным для растворения полимеров целлюлозы в древесине, превращения их в волокнистое вещество, которое можно перерабатывать в бумагу.
Как использовать каустическую соду
В домашних условиях вы можете использовать каустическую соду в качестве прочистного средства для растворения органических материалов, таких как волосы и животные жиры, которые забивают слив. Вы также можете использовать его, чтобы прочистить унитаз и почистить плитку. Убедитесь, что вы в безопасности, когда работаете с ним, и всегда используйте прочные перчатки, фартуки, защитные очки и маску для лица при использовании каустической соды в качестве чистящего средства.
Если вы хотите проявить творческий подход, попробуйте поэкспериментировать и сделать собственное мыло с использованием каустической соды, масла и ароматизаторов.
Отказ от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Химические вещества – формулы и торговые названия
Формулы и торговые названия некоторых распространенных химических веществ.
Sponsored Links
| Common used name, trade names | Chemical Name | Chemical Formula | |||
|---|---|---|---|---|---|
| acetone | acetone | (CH 3 ) 2 CO | |||
| acetylene | ацетилен | С 2 Н 2 | |||
| ammonia | ammonia | Nh4 | |||
| ammonium | ammonium hydroxide | NH 4 OH | |||
| aniline | aniline | C 6 H 5 NH 2 | |||
| Боксит | Гидратированные оксиды алюминия | AL 2 O 3 2H 2 O | calcium hypochlorite | CaCl (OCl) | |
| blue vitrol | copper sulfate | CuSO 4 5H 2 O | |||
| borax | sodium tetraborate | Na 2 B 4 O 7 10H 2 O | |||
| butter of zinc | zinc chloride | ZnCl 2 3H 2 O | |||
| cadmium sulfate | cadmium sulfate | CdSO 4 | |||
| calcium chloride | calcium chloride | CaCl 2 | |||
| carbide | calcium carbide | CaC 2 | |||
| carbolic acid | phenol | C 6 H 5 OH | |||
| двуокись углерода | двуокись углерода | CO 2 | |||
| carborundum | silicon carbide | SiC | |||
| caustic potash | potassium hydroxide | KOH | |||
| caustic soda | sodium hydroxide | NaOH | |||
| chalk | calcium carbonate | CaCo 3 | |||
| эфир | диэтиловый эфир | (C 2 H 5 ) 2 O | |||
| glycerine or glycerol | glycerine | C 3 H 5 (OH) 3 | |||
| graphite | crystaline carbon | C | |||
| green vitrol | ferrous sulfate | FeSO 4 7H 2 O | |||
| гипс | сульфат кальция | CaSO 4 2H 2 O | C 3 H 8 | ||
| hydrochloric acid | hydrochloric acid | HCl | |||
| hydrofluoric acid | hydrofluoric acid | HF | |||
| hydrogen sulfide | hydrogen sulfide | H 2 S | |||
| хлорид железа | хлорид железа | FeCl 2 4H 2 O | |||
| iron sulfide | ferrous sulfide | FeS | |||
| laughing gas | nitrous oxide | N 2 O | |||
| lead sulfide | lead sulfide | PbS | |||
| limestone | calcium carbonate | CaCO 3 | |||
| магнезия | оксид магния | MgO | |||
| болотный газ | 5 метан0146CH 4 | ||||
| minumum | plumbate | 2PbO PbO 2 | |||
| nitric acid | nitric acid | HNO 3 | |||
| phosphoric acid | ortho phosphoric acid | H 3 PO 4 | |||
| калий | карбонат калия | K 2 CO 3 | 1 бромид калия0146 | potassium bromide | KBr |
| potassium chlorate | potassium chlorate | KClO 3 | |||
| potassium chloride | potassium chloride | KCl | |||
| potassium chromate | potassium chromate | K 2 CrO 4 | |||
| цианид калия | цианид калия | KCN | |||
| potassium dichromate | potassium dichromate | K 2 Cr 2 O 7 | |||
| potassium ionide | potassium ionide | KI | |||
| prussic acid | hydrogen cyanide | HCN | |||
| негашеная известь | окись кальция | CaO | |||
| красная пруссия | ферроцианид калия | K 3 Fe(CN) 6 | |||
| salammoniac | ammonium chloride | NH 4 Cl | |||
| silver bromide | silver bromide | AgBr | |||
| silver nitrate | silver nitrate | AGNO 3 | |||
| гашеная известь | гидроксид кальция | Ca(OH) 2 | |||
| сода кальцинированная | 0146 | Na 2 CO 3 10H 2 O | |||
| sodium monoxide | sodium oxide | Na 2 O | |||
| soot | amorphous carbon | C | |||
| sulphuric acid | серная кислота | H 2 SO 4 | |||
| поваренная соль | хлорид натрия | NaCl | |||
| stannic oxide | SnO 2 | ||||
| trilene | trichlorethylene | C 2 HCl 3 | |||
| urea | urea | CO(NH 2 ) 2 | |||
| white lead | basic lead carbonate | 2PbCO 3 Pb(OH) 2 | |||
| white vitrol | zinc sulphate | ZnSO 4 7H 2 O | |||
| yellow prussiate of potassium | potassium ferrocyanide | K 4 Fe(CN) 6 3H 2 O | |||
| zinc blende | zinc sulphide | ZnS | |||
| цинк или китайский белый | оксид цинка | ZnO |
Рекламные ссылки
Добавляйте стандартные и настраиваемые параметрические компоненты, такие как балки с полками, пиломатериалы, трубопроводы, лестницы и т. д., в свою модель Sketchup с помощью Engineering ToolBox — расширения SketchUp, которое можно использовать с потрясающими, увлекательными и бесплатными программами SketchUp Make и SketchUp Pro. .Добавьте расширение Engineering ToolBox в свой SketchUp из хранилища расширений SketchUp Pro Sketchup!
д., в свою модель Sketchup с помощью Engineering ToolBox — расширения SketchUp, которое можно использовать с потрясающими, увлекательными и бесплатными программами SketchUp Make и SketchUp Pro. .Добавьте расширение Engineering ToolBox в свой SketchUp из хранилища расширений SketchUp Pro Sketchup!
Перевести
О программе Engineering ToolBox!
Мы не собираем информацию от наших пользователей. В нашем архиве сохраняются только электронные письма и ответы. Файлы cookie используются только в браузере для улучшения взаимодействия с пользователем.
Некоторые из наших калькуляторов и приложений позволяют сохранять данные приложений на локальном компьютере. Эти приложения будут — из-за ограничений браузера — отправлять данные между вашим браузером и нашим сервером. Мы не сохраняем эти данные.
Google использует файлы cookie для показа нашей рекламы и обработки статистики посетителей. Пожалуйста, прочитайте Конфиденциальность и условия Google для получения дополнительной информации о том, как вы можете контролировать показ рекламы и собираемую информацию.
AddThis использует файлы cookie для обработки ссылок на социальные сети. Пожалуйста, прочитайте AddThis Privacy для получения дополнительной информации.
Реклама в ToolBox
Если вы хотите рекламировать свои продукты или услуги в Engineering ToolBox, используйте Google Adwords. Вы можете настроить таргетинг на Engineering ToolBox с помощью управляемых мест размещения AdWords.
Citation
Эту страницу можно цитировать как
- Engineering ToolBox, (2011). Химические вещества – составы и торговые названия . [онлайн] Доступно по адресу: https://www.engineeringtoolbox.com/chemicals-formulas-trade-names-d_1758.html [дата обращения, мес. год].
Изменить дату доступа.
. .
закрыть
химическая формула. Химическая формула пищевой соды и ее применение
Пожалуй, на каждой домашней кухне есть сода – невзрачная коробочка с порошкообразным веществом. Хозяйки используют его как кулинарную добавку для выпечки. Однако сфера его применения настолько широка, что вещество смело можно назвать универсальным помощником человека. Но что такое сода? Каким образом он существует и как используется в повседневной жизни?
Однако сфера его применения настолько широка, что вещество смело можно назвать универсальным помощником человека. Но что такое сода? Каким образом он существует и как используется в повседневной жизни?
Наименования соды
Прежде чем перейти к химическим свойствам соды, стоит упомянуть, что ее название — «сода», вещество образовано от названия растения солянка сода, зола которого послужила источником соды добыча.
В химии сода — общее название солей угольной кислоты натрия:
- Na 2 CO 3 (карбонат натрия) — химическая формула кальцинированной соды;
- Нет данных 2 CO 3 · 10H 2 O — сода техническая;
- NaHCO 3 — сода пищевая. Это химическая формула пищевой соды;
- Na 2 CO 3 · H 2 O или Na 2 CO 3 · 7H 2 O – химическая формула кристаллической соды.
В быту, а также в химической промышленности существует несколько тривиальных названий вещества:
- сода пищевая;
- Сода питьевая;
- Бикарбонат натрия;
- Добавка Е500;
- Натрия декагидрат.

Эмпирическая формула
Химическая формула пищевой соды: NaHCO 3 . Это кислая соль угольной кислоты. Если сложить атомные веса всех составляющих ее элементов, то получим атомную массу соды, равную 84 а. E.
Способ его образования очень прост. Химическая формула пищевой соды представляет собой сложное взаимодействие гидроксида натрия с угольной кислотой:
NaOH + H 2 CO 3 = NaHCO 3 + H 2 O.
В области химии гидрокарбонат натрия представляет собой комплекс катиона натрия и бикарбонат-аниона. При введении этих элементов в организм они нормализуют кислотно-щелочной баланс, нейтрализуя избыток кислот, содержащихся в жидкой среде.
Сода кальцинированная
Химическая формула кальцинированной соды: Na2CO3. Кальцинированная сода представляет собой белое рыхлое вещество, которое может быть представлено в виде гранул (А) или порошка (Б).
Этот вид газировки имеет ряд особенностей, отличающих кальцинированную соду от пищевой.
- РН среды. И пищевая, и кальцинированная сода являются щелочами, но первая — слабая, с рН = 8, а вторая — сильная, с рН = 11. Химическая формула технической соды также указывает на характер среды.
- Область применения. Пищевая сода используется в пищевой промышленности, косметологии и медицине. Прокаленный используется как эффективное чистящее средство.
В домашнем хозяйстве с помощью кальцинированной соды можно:
- Стирайте, используя его в качестве стирального порошка;
- Мыть полы, но для ламината и паркета это средство не подойдет, так как может испортить покрытие;
- Устранение засоров труб;
- Для очистки изделий из фаянса.
При использовании кальцинированной соды нужно быть предельно осторожным, так как вещество очень токсично, относится к третьей группе вредных веществ.
Физические свойства пищевой соды
Бикарбонат натрия представляет собой порошкообразное вещество белого цвета. Это комплекс элементов натрия, водорода, углерода и кислорода.
Это комплекс элементов натрия, водорода, углерода и кислорода.
Плотность порошка 2,16 г/см 3 .
При значениях температуры +50 о -60 о С вещество начинает плавиться.
Бикарбонат натрия, или пищевая сода, представлен в виде молочного порошка. Он очень хорошо растворяется в воде. Не горит. Химическая формула питьевой соды такая же, как у пищи.
Раствор соды
Сода пищевая – это вещество, которое полностью растворяется в воде, образуя раствор соды. Применяется в гигиенических целях как средство для полоскания полости рта.
Химическая формула раствора соды следующая:
NaHCO 3 + H 2 O = H 2 CO 3 + NaOH.
Водный раствор соды слабощелочной.
бикарбонат натрия в водном растворе диссоциирует, образуя следующие ионы:
NA 2 CO 3 ↔ 2NA + + CO 3 2-
Propertes of Soda As ALKALI
7Properties of Soda As ALKALI
77779921.
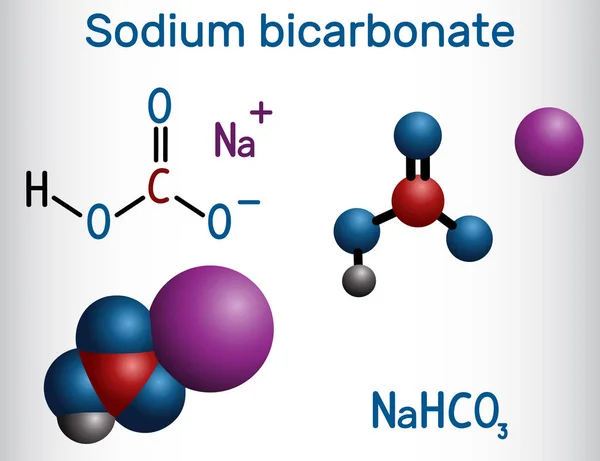 неоднократно, гидрокарбонат натрия является щелочным веществом. Этот факт влияет на использование соды как средства для нейтрализации повышенной кислотности организма, в частности желудка. Элементы, входящие в состав вещества, обладают безопасным действием.
неоднократно, гидрокарбонат натрия является щелочным веществом. Этот факт влияет на использование соды как средства для нейтрализации повышенной кислотности организма, в частности желудка. Элементы, входящие в состав вещества, обладают безопасным действием.Сода повышает эффективность работы почек, так как выделяемая моча имеет щелочную среду. Кроме того, он сохраняет в организме необходимое количество глутаминовой АК, что предотвращает появление каменных образований в почках.
Щелочная среда способствует лучшему усвоению некоторых витаминов группы В: В1, В4, В5, В6 и В12.
При употреблении соды для хорошего пищеварения ее смешивают с горячим молоком. Это способствует тому, что в тонком отделе кишечника сода взаимодействует с аминокислотами молока, в результате чего появляются натриевые соли аминокислот, имеющие щелочной характер. Эти аминокислоты намного лучше, чем сода, проникают в кровь, тем самым увеличивая щелочные запасы организма.
Сода каустическая
Химическая формула едкого натра: NaOH. Структурная формула: Na — O — H.
Структурная формула: Na — O — H.
Молекулярная масса вещества складывается из атомных масс, образующих его компоненты Na, O и H. Она равна 40.
Едкий каустик хорошо растворим в воде.
В промышленности по отношению к этому виду соды используются следующие наименования:
- натрия гидроксид;
- гидроксид натрия;
- Гидрат оксида натрия.
При работе с едким натром необходимо использовать элементы защитной одежды, так как при попадании на кожу оставляет сильные ожоги.
Сода в сочетании с уксусом
Химическая формула уксуса и соды представляет собой реакцию гашения, при которой образуются вода, углекислый газ и уксусная кислота.
Этот химический «опыт» сопровождается характерным шипением, что свидетельствует о начале «горения» соды.
Эту реакцию проводят в кулинарном деле, когда предполагается замесить тесто для выпечки. Уксус для этого берется в концентрации 9%. Аналогом кислоты может быть лимонный сок, яблочный или винный уксус.
Так зачем проводить эту реакцию при подготовке теста? Все дело в том, что углекислый газ, образующийся при разложении соды, дает пробу пышности.
Приготовление вещества
Когда-то из золы растения солянкой извлекали соду. В настоящее время основой для получения этого вещества является природный сульфат натрия. Реакция препарата выглядит следующим образом, где справа отображается химическая формула соды:
NA 2 SO 4 + 3C + 2 O 2 = 2NA 2 CO 3 + CO 2 + 2 SO 2 ;
CaCO 3 + C + Na 2 SO 4 = Na 2 CO 3 + 4CO + CaS.
Применение пищевой соды
Сода очень популярна в быту, и не только как кулинарный компонент. Но рассмотрим подробнее случаи, когда используется сода.
- Для начала стоит еще раз напомнить, что газировка — пищевой ингредиент в кулинарии. Его использование не случайно: при нагревании вещество способно выделять пары углекислого газа, что, в свою очередь, придает тесту воздушность.
 В данном случае сода выступает в роли разрыхлителя. А вот если купить пакетик с открывалкой для выпечки в магазине, то на упаковке в строке состава можно обнаружить наличие соды, которая обозначена как пищевая добавка Е500.
В данном случае сода выступает в роли разрыхлителя. А вот если купить пакетик с открывалкой для выпечки в магазине, то на упаковке в строке состава можно обнаружить наличие соды, которая обозначена как пищевая добавка Е500. - Используйте пищевую соду и для производства газированных напитков.
- Очень часто соду применяют в так называемой «народной» медицине. В этой области сода является панацеей практически от любых недугов, например, доказана ее эффективность при изжоге, кашле, при ангине, желудке, при повышенной температуре.
- Неплохо проявила себя сода и как чистящее средство. Вы можете использовать его для чистки сантехники, алюминиевых кастрюль, посуды, ковров, серебра и для стирки белья. Вещество обладает хорошим дезинфицирующим и противогрибковым средством.
- Многие женщины используют соду в косметических и гигиенических целях. Его можно использовать как скраб для кожи. Средство отлично избавит от огрубевшей кожи стоп, если использовать его для ножных ванночек.
 С ее помощью можно избавиться от запаха пота как в подмышках, так и в обуви.
С ее помощью можно избавиться от запаха пота как в подмышках, так и в обуви.
Поможет сода и при отбеливании зубов. Это недорогой, но эффективный способ. Порошок соды смешивают с зубной пастой или водой и мягкими движениями чистят зубы.
Каустическая сода: Применение
Использование этого вида соды должно сопровождаться определенными мерами безопасности, так как едкий натр является сильной щелочью, способной «разъедать» многие виды поверхностей.
Почему едкое средство в домашних условиях может быть полезным?
- Каустик прекрасно справляется с различными загрязнениями на посуде. Но стоит воздержаться от использования этого средства для изделий из алюминия и тефлона. А вот на остальные кастрюли, сковородки или выпечку — пожалуйста. Нагар, накипь, состарившиеся слои жира – со всем этим легко справится едкий нагар.
- Едкий натр может решить проблему засорения труб. Нужно просто засыпать гранулированное вещество в трубу и оставить на некоторое время, после чего промыть проточной водой.

Сода едкая, она же едкий натр, широко применяется на промышленном уровне в различных сферах производства.
- Строится. Здесь вещество используется для изготовления некоторых видов строительных материалов, а также служит дополнительным компонентом, укрепляющим фундаментальную основу конструкций.
- В пищевой промышленности. Каустическая сода также применима в производстве пищевых продуктов. Конечно, в этом случае он используется в слабой концентрации. С ее участием выпекают какао-порошок и шоколад, мороженое, карамель, хлеб, используют как добавку Е524.
- Текстильная промышленность. В этой области каустическая сода полезна для отбеливания тканей и для регенерации резиновых изделий.
- Химическая продукция: едкий натр применяют как нейтрализатор кислот, средство для очистки масла и продуктов на его основе. Производство технических масел также не может обойтись без добавления едкого натра. Кроме того, каустическая сода является хорошим катализатором некоторых химических реакций.

- Применяют едкий натр и для мыловарения при производстве различных видов мыла, шампуней и гелей.
Кальцинированная сода: использовать
Кальцинированную соду также называют бельевой. Специальные средства этого средства применялись еще в Советском Союзе, поэтому можно сказать: бельевая сода проверена временем.
Средство используется в следующих ситуациях:
- Во время стирки вещей.
- При очистке поверхностей плитки, керамики, фаянса.
- При устранении засора в трубах.
- Для устранения накипи в барабанах стиральных машин, а также на посуде.
- Для уничтожения вредных насекомых на огородах.
Из вышеизложенного напрашивается вывод: сода – универсальное средство, используемое в большинстве сфер как бытовой, так и производственной жизни.
Положительное качество вещества в том, что его можно приобрести за копейки.
Химия поп-музыки | Поговорим о науке
АВ
Химия 20 (2007 г. , обновление 2014 г.)
11
Блок B: Формы вещества: газы
, обновление 2014 г.)
11
Блок B: Формы вещества: газы
AB Химия 20 (2007 г., обновление 2014 г.) 11 Модуль C: Вещество в виде растворов, кислот и оснований
AB Химия 30 (2007 г., обновление 2014 г.) 12 Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
AB Наука о знаниях и трудоустройстве 10-4 (2006) 10 Модуль A: Исследование свойств материи
AB Наука о знаниях и трудоустройстве 20–4 (2006 г.) 11 Раздел A: Применение материи и химических изменений
АВ Наука о знаниях и трудоустройстве 8, 9 (пересмотрено в 2009 г.) 9 Модуль C: Химия окружающей среды
AB Наука 10 (2005 г., обновлено в 2015 г.) 10 Модуль A: Энергия и материя в химическом изменении
AB Наука 14 (2003 г., обновлено в 2014 г.) 10 Модуль A: Исследование свойств материи
AB Наука 20 (2007 г., обновлено в 2014 г.) 11 Блок A: химические изменения
AB Наука 24 (2003 г., обновлено в 2014 г.) 11 Модуль A: Применение вещества и химических изменений
AB
Наука 7-8-9(2003 г. , обновлено в 2014 г.)
9
Модуль C: Химия окружающей среды
, обновлено в 2014 г.)
9
Модуль C: Химия окружающей среды
BC Химия 11 (июнь 2018 г.) 11 Большая идея: материя и энергия сохраняются в химических реакциях.
до н.э. Химия 11 (июнь 2018 г.) 11 Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.
до н.э. Химия 11 (июнь 2018 г.) 11 Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
до н.э. Химия 12 (июнь 2018 г.) 12 Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
до н.э. Химия 12 (июнь 2018 г.) 12 Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
до н.э. Химия 12 (июнь 2018 г.) 12 Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
до н.э. Естествознание 10 класс (март 2018 г.) 10 Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
МБ Химия 11 класс (2006) 11 Тема 2: Газы и атмосфера
МБ Химия 11 класс (2006) 11 Тема 4: Решения
МБ Химия 12 класс (2013) 12 Тема 1: Реакции в водных растворах
MB Химия 12 класс (2013) 12 Тема 4: Химическое равновесие
МБ Химия 12 класс (2013) 12 Тема 5: Кислоты и щелочи
MB Старший 2 науки (2001) 10 Кластер 2: Химия в действии
NB Химия 111/112 (2009) 11 Блок 2: Стехиометрия
NB Химия 121/122 (2009) 12 Модуль 2: От решений к кинетике и к равновесию
NB
Химия 121/122 (2009 г.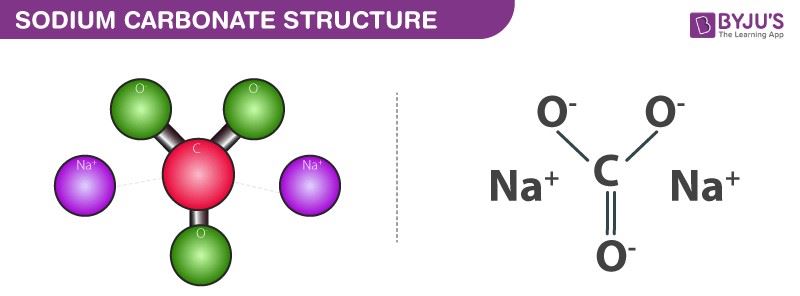 ))
12
Раздел 3: Кислоты и основания
))
12
Раздел 3: Кислоты и основания
NB Chimie 11e Année 52311/52312 (2007) (только на французском языке) 11 1. Matiere et liaisons
NB Chimie 11e Année 52311/52312 (2007) (только на французском языке) 11 3. Решения
Примечание. Chimie 11e Année 52311/52312 (2007) (только на французском языке) 11 4. Газ
НБ Наука 10 класс (2002) 10 Физические науки: химические реакции
NL Химия 2202 (2018) 11 Блок 1: Стехиометрия
NL Химия 2202 (2018) 11 Модуль 2: От структур к свойствам
Нидерланды Химия 3202 (2005) 12 Модуль 1: От кинетики к равновесию
NL Химия 3202 (2005) 12 Раздел 2: Кислоты и основания
NL Наука 1206 (2018) 10 Блок 2: Химические реакции
NL Наука 3200 (2005) 12 Блок 1: Химические реакции
NL Наука 7 класс (2013) 7 Блок 3: Смеси и растворы
NS Химия 12 (2009, 2019) 12 Кислоты и основания
NS Химия 12 (2009, 2019) 12 Решения, кинетика и равновесие
NS Наука 1 (2019) 1 Науки о жизни: потребности живых существ
NS Наука 10 (2012, 2019) 10 Физические науки: химические реакции
NT
Химия 20 (Альберта, 2007 г. , обновлено в 2014 г.)
11
Блок B: Формы вещества: газы
, обновлено в 2014 г.)
11
Блок B: Формы вещества: газы
NT Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль C: Вещество в виде растворов, кислот и оснований
NT Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) 12 Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
NT Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г.) 10 Модуль A: Исследование свойств материи
НТ Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.) 11 Модуль A: Применение материи и химических изменений
NT Наука о знаниях и трудоустройстве 9 (Альберта, редакция 2009 г.) 9 Модуль C: Химия окружающей среды
NT Science 10 (Альберта, 2005 г., обновлено в 2015 г.) 10 Модуль A: Энергия и материя в химическом изменении
NT Наука 14 (Альберта, 2003 г., обновлено в 2014 г.) 10 Модуль A: Исследование свойств материи
NT Science 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Блок А: Химические изменения
НТ
Наука 24 (Альберта, 2003 г. , обновлено в 2014 г.)
11
Модуль A: Применение вещества и химических изменений
, обновлено в 2014 г.)
11
Модуль A: Применение вещества и химических изменений
NU Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Блок B: Формы вещества: газы
NU Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль C: Материя в виде растворов, кислот и оснований
NU Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) 12 Модуль D: Химическое равновесие с акцентом на кислотно-основные системы
NU Наука о знаниях и трудоустройстве 10-4 (2006) 10 Модуль A: Исследование свойств материи
НУ Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.) 11 Модуль A: Применение вещества и химических изменений
NU Наука 10 (2005 г., обновлено в 2015 г.) 10 Модуль A: Энергия и материя в химическом изменении
NU Наука 14 (2003 г., обновлено в 2014 г.) 10 Модуль A: Исследование свойств материи
NU Science 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль A: химические изменения
NU
Наука 24 (Альберта, 2003 г., обновлено в 2014 г. )
11
Раздел A: Применение материи и химических изменений
)
11
Раздел A: Применение материи и химических изменений
ВКЛ. Химия, 11 класс, университет (СЧ4У) 11 Цепь C: Химические реакции
ON Химия, 11 класс, университет (СЧ4У) 11 Цепь E: растворы и растворимость
ON Химия, 11 класс, университет (СЧ4У) 11 Группа F: Газы и химия атмосферы
ON Химия, 12 класс, университет (СЧ5У) 12 Цепь E: Химические системы и равновесие
ON Естествознание, 10 класс, академический (SNC2D) 10 Цепь C: Химические реакции
ON Прикладные науки 10 класса (SNC2P) (2008 г.) 10 Цепь C: химические реакции и их практическое применение
ВКЛ. Наука, 12 класс, рабочее место (SNC4E) 12 Цепь C: Химические вещества в потребительских товарах
PE Химия 521А (проект 2021 г.) 11 Знание содержания: CK 2 .3
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 2 .1
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 2 .3
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 3.1, 3.2, 3.3
PE
Наука 421А (2019)
10
Знание содержания: CK 2.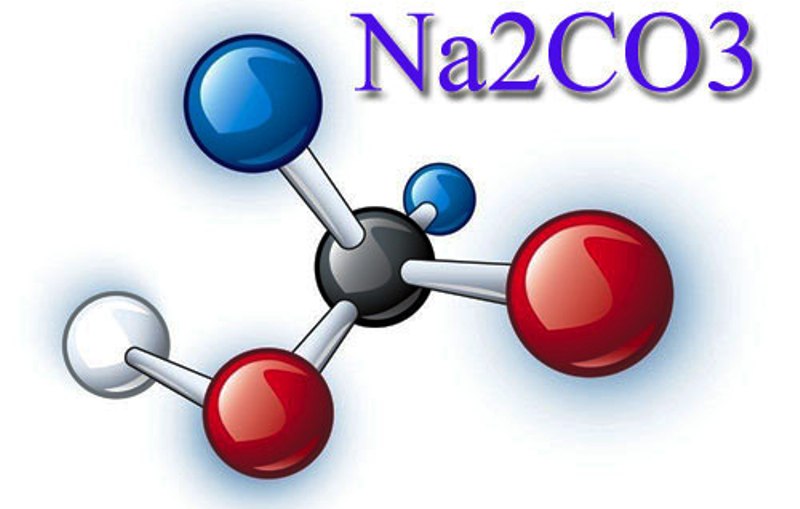 2
2
PE Наука 431A (без даты) 10 Модуль 2: Химические реакции
КК Прикладная наука и технологии Раздел III Материальный мир
КК Химия Раздел V Химическое равновесие
Контроль качества Химия Раздел V Газы
КК Экологические науки и технологии Раздел IV Материальный мир
КК Наука и технология Раздел I Материальный мир: Организация
QC Наука и технология Раздел II Материальный мир: Организация
QC Наука и технология Раздел III Материальный мир
КК Наука и технология Раздел IV Материальный мир
КК Наука и окружающая среда Раздел IV Материальный мир
SK Химия 30 (2016) 12 Химические равновесия
SK Физические науки 20 (2016) 11 Основы химии
YT Химия 11 (Британская Колумбия, июнь 2018 г.) 11 Большая идея: материя и энергия сохраняются в химических реакциях.
ЮТ
Химия 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.
ЮТ Химия 11 (Британская Колумбия, июнь 2018 г.) 11 Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
YT Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
ЮТ Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
ЮТ Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
ЮТ Наука, 10 класс (Британская Колумбия, июнь 2016 г.) 10 Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
Что такое кальцинированная сода (карбонат натрия)? | Часто задаваемые вопросы
24 Jun
Что такое кальцинированная сода (карбонат натрия)? Кальцинированная сода (карбонат натрия), Na 2 CO 3 . 10H 2 O, представляет собой промышленный химикат с формулой Na2CO3. Он также известен как стиральная сода, кальцинированная сода и кристаллы соды.
10H 2 O, представляет собой промышленный химикат с формулой Na2CO3. Он также известен как стиральная сода, кальцинированная сода и кристаллы соды.
Все формы представляют собой водорастворимые бесцветные соли без запаха, образующие в воде умеренно щелочные растворы.
Кальцинированная сода
Для чего используется кальцинированная сода (карбонат натрия)?
Карбонат натрия представляет собой очень полезное химическое соединение, которое применяется в следующих целях:
- В качестве чистящего средства, используемого в домашних условиях для таких задач, как стирка. Многие сухие мыльные порошки содержат в качестве ингредиента карбонат натрия.
- Используется для устранения временной и постоянной жесткости воды. Он регулярно используется в качестве смягчителя воды.
- Он используется для изготовления стекла, мыла и бумаги, среди прочего.
- Используется в производстве соединений натрия, таких как бура.

Какова химическая формула кальцинированной соды (карбоната натрия)?
Кальцинированная сода является обычным химическим соединением. Его химическая формула представлена как Na 2 CO 3 .10H 2 O.
Вредна ли кальцинированная сода (карбонат натрия) для жизни?
Кальцинированная сода практически безвредна. Однако карбонат натрия опасен только в том случае, если он находится в чрезвычайно концентрированном растворе или в твердой форме.
Где содержится кальцинированная сода (карбонат натрия)? Как выглядит кальцинированная сода (карбонат натрия)?
Традиционно его получают из золы растений, произрастающих на богатых натрием почвах. Зола этих богатых натрием растений заметно отличалась от золы древесины; которые изначально использовались для производства калия. Кроме того, процесс Solvay производит его в огромных количествах из хлорида натрия и известняка. Его получают в виде трех гидратов и в виде безводной соли. По внешнему виду это белое кристаллическое твердое вещество.
Кроме того, процесс Solvay производит его в огромных количествах из хлорида натрия и известняка. Его получают в виде трех гидратов и в виде безводной соли. По внешнему виду это белое кристаллическое твердое вещество.
Кальцинированная сода.
Каковы опасные последствия кальцинированной соды (карбоната натрия)?
- Кальцинированная сода является нетоксичным веществом. Однако раздражение, дерматит и ожоги могут возникнуть в результате прямого контакта с кожей или глазами, а также вдыхания порошка или кристаллов.
- Многократное воздействие может вызвать сухость кожи и растрескивание или отек тканей глаз. Также может наблюдаться слезотечение.
- Вдыхание пыли продукта может вызвать раздражение дыхательных путей. Проглатывание может вызвать раздражение желудочно-кишечного тракта, тошноту, рвоту и диарею.
Какие меры предосторожности необходимо принимать при обращении с кальцинированной содой (карбонатом натрия)?
Во избежание раздражения глаз, кожи и дыхательных путей следует принимать следующие меры предосторожности:
- Использовать только в хорошо проветриваемых помещениях.

- Следует хранить вдали от несовместимых продуктов.
- В пыльных условиях можно использовать пылезащитные очки.
- Следует использовать подходящие перчатки из неопрена или натурального каучука.
- Носите одежду с длинными рукавами или фартук.
- Для защиты ног следует носить резиновые сапоги.
Что произойдет, если кальцинированную соду (карбонат натрия) нагреть?
При нагревании кальцинированной соды при разложении образуется Na 2 CO 3 . При нагревании до 100°C он превращается в пищевую соду.
Растворима ли кальцинированная сода (карбонат натрия) ?
Карбонат натрия — слабое основание, растворимое в воде и диссоциирующее в растворе на ионы натрия (Na) и карбонат (CO3).
Где можно купить кальцинированную соду (карбонат натрия)?
Кальцинированная сода 99% доступна для продажи в Camachem. Выпускается в мешках по 25 кг. Camachem известна тем, что отправляет химические вещества из Китая клиентам в разные страны мира.
Выпускается в мешках по 25 кг. Camachem известна тем, что отправляет химические вещества из Китая клиентам в разные страны мира.
Кальцинированная сода
Сколько стоит кальцинированная сода (карбонат натрия)?
Цена на кальцинированную соду (карбонат натрия) оценивается в 315 долларов США за тонну. При этом цена варьируется в зависимости от себестоимости продукции. Вы можете воспользоваться бесплатной опцией котировки, чтобы получить котировку на желаемое количество.
Каков pH кальцинированной соды (карбоната натрия)?
Карбонат натрия является основным соединением. Вещество имеет значение pH 11,1.
Является ли кальцинированная сода (карбонат натрия) соединением электролита?
Кальцинированная сода может использоваться в качестве электролита в химии, и она особенно полезна, поскольку не вызывает коррозии анодов.
Может ли кальцинированная сода (карбонат натрия) выбрасываться в канализацию?
Кальцинированную соду нельзя смывать в канализацию. Химическое вещество может загрязнить реки или озера. Его следует утилизировать в соответствии с правилами, установленными местным органом по утилизации химических веществ.
Является ли кальцинированная сода (карбонат натрия) кислотной или основной?
Карбонат натрия является основным соединением. Его значение pH выше 7.
В чем разница между кальцинированной содой (карбонатом натрия) и бикарбонатом натрия?
Карбонат натрия используется для повышения общего pH вещества, тогда как бикарбонат натрия обычно используется для повышения общей щелочности вещества. Это небольшая разница, но она может быть существенной для некоторых веществ.
Это небольшая разница, но она может быть существенной для некоторых веществ.
Является ли пищевая сода соединением?
Химическое название пищевой соды – гидрокарбонат натрия. Его также называют бикарбонатом соды или бикарбонатом натрия.
Белое щелочное вещество со слегка соленым вкусом. Его история восходит к 4 миллионам лет назад, когда из-за засухи высохли соленые озера по всему миру, в результате чего образовались залежи троны.
Камень трона может быть переработан в кальцинированную соду, которая химически представляет собой карбонат натрия и встречается в природе. Он также используется для приготовления пищевой соды.
Является ли пищевая сода соединением? Да, пищевая сода — это соединение. Химическая формула пищевой соды записывается как NaHCO3. Это указывает на то, что одна молекула бикарбоната натрия образована комбинацией атомов четырех различных элементов, которые объединены в определенном соотношении, а именно. один атом натрия (Na), один атом водорода (H), один атом углерода (C) и три атома кислорода (O). Эти атомы химически связаны друг с другом и не могут быть разделены никаким физическим процессом.
Эти атомы химически связаны друг с другом и не могут быть разделены никаким физическим процессом.
Согласно химии, соединение – это вещество, образованное комбинацией двух или более различных типов атомов или ионов, которые химически связаны в определенных пропорциях.
Как видно выше, всем этим критериям соответствует пищевая сода, следовательно, это соединение.
Является ли пищевая сода смесью?
В соответствии с определением смеси представляют собой вещества, образованные смешиванием двух или более различных типов атомов или ионов.
Однако смеси отличаются от соединений, поскольку различные атомы или ионы в смеси не связаны ни химически, ни присутствуют в определенном соотношении.
Атомы по-прежнему проявляют свои индивидуальные свойства. Кроме того, компоненты смеси можно легко отделить друг от друга с помощью физических процессов.
Однако различные атомы химически связываются в определенных пропорциях, образуя молекулу пищевой соды. Кроме того, свойства пищевой соды отличаются от любого из ее основных элементов.
Кроме того, свойства пищевой соды отличаются от любого из ее основных элементов.
Следовательно, пищевая сода не является смесью.
Каким образом пищевая сода является соединением?
Мы уже обсуждали, что пищевая сода является соединением, но какие характеристики на самом деле делают ее соединением.
Атомы натрия, водорода, углерода и кислорода объединяются в соотношении 1:1:1:3 соответственно для образования одной молекулы пищевой соды.
Эти атомы теряют свои индивидуальные характеристики и вместе с другими атомами приобретают свойства, уникальные для пищевой соды.
Он не распадается на составляющие его элементы посредством простых физических процессов. Все это особенности соединения, поэтому пищевая сода является соединением.
Бикарбонат натрия представляет собой ионное соединение, в котором молекулы распадаются на отдельные ионы, а именно.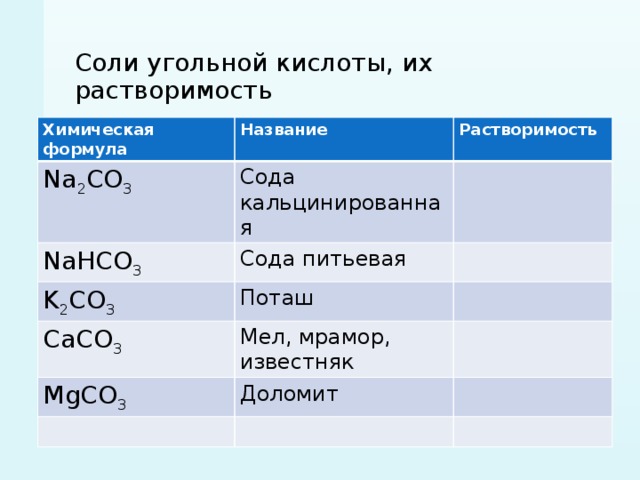 Na+ и HCO3- в водном растворе. Дальнейшее разбавление приводит к образованию ионов CO32-.
Na+ и HCO3- в водном растворе. Дальнейшее разбавление приводит к образованию ионов CO32-.
Поскольку образование ионов является свойством соединений. Поэтому пищевую соду по праву можно назвать составом.
Типы соединений
Соединения можно в целом разделить на две категории, а именно. молекулярные или ковалентные соединения и ионные соединения.
Ковалентные соединенияКак следует из названия, эти соединения образуются в результате образования ковалентной связи между различными атомами.
Эти атомы присутствуют в определенном соотношении, которое остается неизменным во всем веществе. Молекулы этих соединений электрически нейтральны и не диссоциируют в водном растворе.
Соединения, которые содержат в основном атомы углерода и водорода, называются органическими соединениями и в основном имеют ковалентную природу.
Некоторыми примерами ковалентных соединений являются Ch5, CO2 и т. д.
Они образуются из-за ионной связи между различными атомами молекулы. Они диссоциируют в водном растворе и являются хорошими проводниками тепла и электричества.
Соотношение атомов в этих соединениях определенное. Большинство неорганических соединений являются ионными. Примеры включают HCl, NaOH, NaHCO3 и т. д.
NaHCO3 является амфотерным соединением, т.е. может реагировать как со щелочью, так и с кислотой.
В водном растворе он может отдавать протон и реагировать как кислота, или может принимать протон и реагировать как основание.
Из чего состоит пищевая сода?
Как видно из химической формулы NaHCO3 пищевая сода представляет собой соединение четырех элементов, а именно. натрий, водород, углерод и кислород.
Атомы этих элементов соединяются в определенной пропорции 1:1:1:3 для образования одной молекулы бикарбоната натрия.
Молекула пищевой соды диссоциирует в водном растворе с образованием различных ионов. Как обсуждалось ранее, он может реагировать как как кислота, так и как основание, поэтому образующиеся ионы также различны.
Как обсуждалось ранее, он может реагировать как как кислота, так и как основание, поэтому образующиеся ионы также различны.
для щелочного раствора. Одна молекула разрывов пищевой соды следующим образом:
NAHCO3+H3O-> Na++H3CO3+OH-
, когда при реагировании в виде кислоты образуются следующие ионы:
Nahco3+образуются следующие ионы:
Nahco3+. h3O —> Na+ + CO3-2 + h4O+
Является ли пищевая сода гетерогенной смесью?
Гетерогенная смесь представляет собой смесь, в которой составляющие атомы распределены неравномерно, т. е. пропорция различных атомов не одинакова во всей смеси, что приводит к образованию различных фаз, которые не смешиваются.
Обычно фазы можно различить визуально. Также, как и в любой другой смеси, компоненты не связаны химически и легко разделяются.
Некоторыми примерами гетерогенных смесей являются овощной суп, масло в воде и т. д.
Молекулы бикарбоната натрия имеют определенную пропорцию всех соединяющихся атомов. Также здесь нет отдельных фаз.
Таким образом, пищевая сода определенно не является гетерогенной смесью.
Является ли пищевая сода однородной смесью?
В гомогенной смеси соединяющиеся атомы хотя и распределены равномерно, но не соединяются химически. Состав таких смесей определен и однороден.
Отдельные фазы могут отсутствовать, но индивидуальные свойства различных типов атомов остаются неизменными.
Из-за неспособности различных атомов образовывать химические связи между собой составляющие элементы могут быть разделены посредством физических процессов, таких как кипение.
Несколько примеров гомогенных смесей: соль в воде, сахар в воде и т. д.
Молекулы бикарбоната натрия напоминают гомогенные смеси, поскольку соединяющиеся атомы присутствуют в определенных и однородных пропорциях.
Однако, в отличие от гомогенных смесей, атомы в молекулах пищевой соды связаны химически и не могут быть разделены простыми физическими процессами.
Следовательно, пищевая сода тоже не является однородной смесью.
Свойства
Ниже перечислены несколько важных свойств пищевой соды:
• Пищевая сода также известна как бикарбонат натрия или гидрокарбонат натрия.
• Это порошкообразное вещество с моноклинной кристаллической структурой.
• Обозначается химической формулой NaHCO3.
• Молекулярная масса 84,0066 г/моль.
• Это негорючее и невзрывоопасное вещество.
• Имеет диапазон pH от 8 до 9 и значение pKa 6,3.
• Неагрессивная щелочь.
• Белое вещество без запаха.
• Плотность пищевой соды 2,20 г/см3.
• Температура кипения и плавления бикарбоната натрия составляет 851 °C и 50 °C соответственно.
• Он амфотерен по своей природе, т. е. может вести себя как кислота, так и как основание в водном растворе.
е. может вести себя как кислота, так и как основание в водном растворе.
• Показатель преломления пищевой соды составляет 1,583.
• Теплоемкость 87,6 Дж/моль·К и стандартная энтропия 101,7 Дж/моль·К. пищевая сода используется в хлебопекарной промышленности, где она используется при приготовлении хлеба, тортов и т. д. Здесь она работает как разрыхлитель, выделяющий углекислый газ и помогающий подняться хлебобулочным изделиям.
• Используется в пиротехнике, особенно в фейерверках под названием «черная змея», где в результате термического сгорания образуется пепел в форме змеи.
• Используется как фунгицид, пестицид и поглощает неприятные запахи.
• Он является основным компонентом огнетушителей, используемых при тушении электрического пожара, поскольку выделяет углекислый газ в присутствии тепла.
• Используется в качестве моющего средства для стирки, а также в качестве моющего средства для бассейнов, аквариумов и т. д., поскольку благодаря своей амфотерной природе уравновешивает pH.
• Антибактериальные свойства пищевой соды делают ее отличным чистящим средством для кухни.
• В лаборатории также используется для нейтрализации различных кислот, особенно в случае случайного разлива.
• Вместе с водой бикарбонат натрия действует как антацид и используется для лечения таких проблем, как кислотность и изжога.
• Пищевая сода также входит в состав дезодорантов и используется для поглощения неприятного запаха в холодильниках.
• Благодаря своим абразивным и противокариозным свойствам он также используется в средствах личной гигиены, таких как жидкости для полоскания рта.
• Используется в производстве косметики, средств для чистки полости рта и зубов и т. д.
• Также используется при полировке серебряных изделий.
• Пищевая сода также добавляется в качестве буферного агента в кормовые добавки для крупного рогатого скота.
Заключение
Пищевая сода представляет собой соединение, так как образуется в результате химической связи между различными типами атомов в определенных пропорциях.

 Обладает слегка щелочной … Научно-технический энциклопедический словарь
Обладает слегка щелочной … Научно-технический энциклопедический словарь Синонимы: Натрий двууглекислый, Натрия бикарбонат, Сода двууглекислая, Natrium bicarbonicum, Natrium hydrocarbonicum, Sodium bicarbonate. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде … Словарь медицинских препаратов
Синонимы: Натрий двууглекислый, Натрия бикарбонат, Сода двууглекислая, Natrium bicarbonicum, Natrium hydrocarbonicum, Sodium bicarbonate. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде … Словарь медицинских препаратов Она является хорошим разрыхлителем для теста. Содовым раствором можно снять зубную боль. Но это далеко не весь спектр применения этого «чудо»-вещества. На самом деле, без гидрокарбоната натрия трудно обойтись и в быту, и в кулинарии, и в медицине, и во многих других сферах деятельности.
Она является хорошим разрыхлителем для теста. Содовым раствором можно снять зубную боль. Но это далеко не весь спектр применения этого «чудо»-вещества. На самом деле, без гидрокарбоната натрия трудно обойтись и в быту, и в кулинарии, и в медицине, и во многих других сферах деятельности. Однако, как оказалось, на выходе получали не пищевую, а кальцинированную соду. Кроме того, в результате такой деятельности оставалось очень много токсичных отходов (сульфида кальция и хлороводорода), поэтому от него быстро отказались.
Однако, как оказалось, на выходе получали не пищевую, а кальцинированную соду. Кроме того, в результате такой деятельности оставалось очень много токсичных отходов (сульфида кальция и хлороводорода), поэтому от него быстро отказались. В воде порошок растворяется плохо и легко отделяется фильтрованием.
В воде порошок растворяется плохо и легко отделяется фильтрованием.

 Сода способствует усилению мочеотделения, чем уменьшает общий объем циркулирующей крови. Как результат уменьшается давление кровяного столба на стенки сосудов и немного падает артериальное давление.
Сода способствует усилению мочеотделения, чем уменьшает общий объем циркулирующей крови. Как результат уменьшается давление кровяного столба на стенки сосудов и немного падает артериальное давление. Гидрокарбонат натрия нейтрализует эти кислоты и проявляет умеренный антисептический эффект.
Гидрокарбонат натрия нейтрализует эти кислоты и проявляет умеренный антисептический эффект. Полосканиями горла раствором из соли и соды снимают воспаление гланд при ангине.
Полосканиями горла раствором из соли и соды снимают воспаление гланд при ангине. Потемневший картофель можно осветлить этим же способом.
Потемневший картофель можно осветлить этим же способом.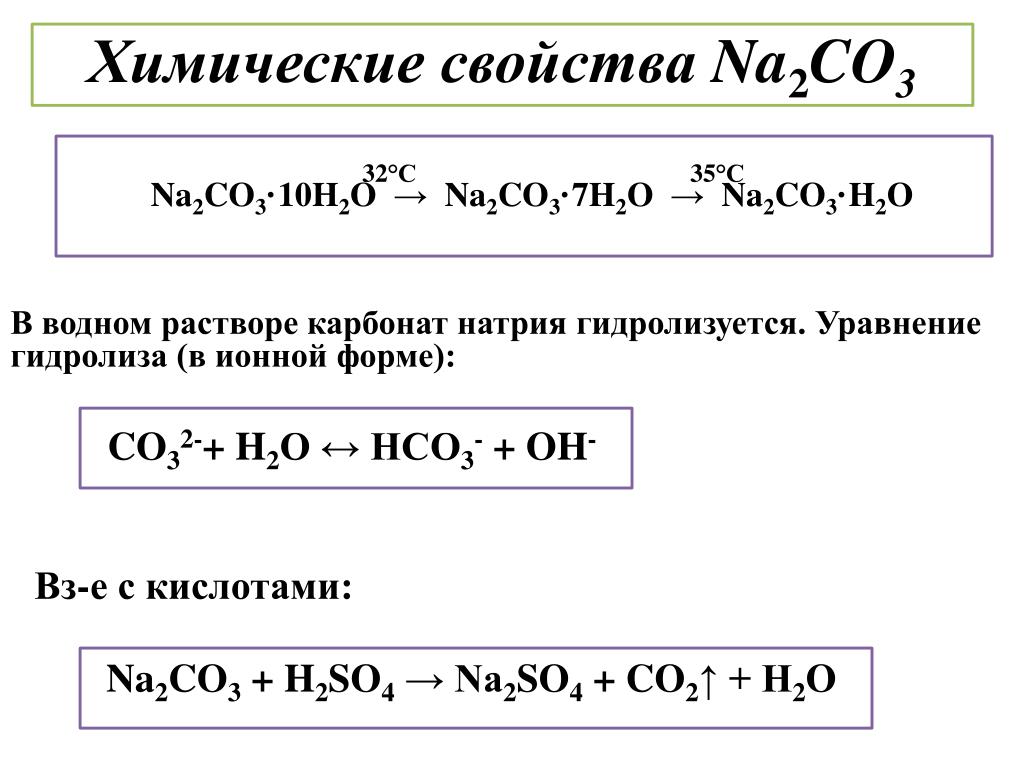 Меняя содержимое стакана по мере необходимости (раз в 1-2 месяца), можно навсегда избавиться от специфического «холодильного» запаха.
Меняя содержимое стакана по мере необходимости (раз в 1-2 месяца), можно навсегда избавиться от специфического «холодильного» запаха.
 Чтобы потерять до 2 кг за одну процедуру, можно наполнить ванну теплой водой и растворить в ней 0,5 кг морской соли и 0,3 кг обычной питьевой соды. Худеющему нужно погрузиться в такую ванну на 20 минут. При этом температура воды должна быть около 40°С. Содово-солевой раствор расслабляет мышцы, снимает усталость и нервное напряжение, очищает лимфатические сосуды, уменьшает отечность тканей. После ванной обтираться не следует: достаточно надеть теплый халат. Делать такие водные процедуры лучше перед сном.
Чтобы потерять до 2 кг за одну процедуру, можно наполнить ванну теплой водой и растворить в ней 0,5 кг морской соли и 0,3 кг обычной питьевой соды. Худеющему нужно погрузиться в такую ванну на 20 минут. При этом температура воды должна быть около 40°С. Содово-солевой раствор расслабляет мышцы, снимает усталость и нервное напряжение, очищает лимфатические сосуды, уменьшает отечность тканей. После ванной обтираться не следует: достаточно надеть теплый халат. Делать такие водные процедуры лучше перед сном.



 [1]
[1] А. Брокгауза и И.А. Ефрона
А. Брокгауза и И.А. Ефрона Химическая формула Содержание… … Википедия
Химическая формула Содержание… … Википедия В результате сода комкуется и теряет рассыпчатость.
В результате сода комкуется и теряет рассыпчатость.
 Оставьте в таком виде на 15–30 минут;
Оставьте в таком виде на 15–30 минут; Насыпьте ее в емкость с крышкой из нержавеющей стали с отверстиями, с ее помощью, посыпьте поверхности содой и потрите. Можете добавить сюда пару капель вашего любимого эфирного масла. Масло лаванды и масло чайного дерева обладают мощными антибактериальными свойствами.
Насыпьте ее в емкость с крышкой из нержавеющей стали с отверстиями, с ее помощью, посыпьте поверхности содой и потрите. Можете добавить сюда пару капель вашего любимого эфирного масла. Масло лаванды и масло чайного дерева обладают мощными антибактериальными свойствами. 
 опубликовано econet.ru.
опубликовано econet.ru.
 Но следует помнить, что такой метод лучше не использовать при стирке деликатных тканей, поскольку это может привести к их порче.
Но следует помнить, что такой метод лучше не использовать при стирке деликатных тканей, поскольку это может привести к их порче.
 ложки глицерина;
ложки глицерина;



 И уж точно не буду давать её в руки детям. ИМХО.
И уж точно не буду давать её в руки детям. ИМХО. ru/khimicheskaya-formula-kaltsinirovannoy-sody/
ru/khimicheskaya-formula-kaltsinirovannoy-sody/ Он также используется для очистки тонкой кожуры фруктов, таких как помидоры, для консервирования. Он обладает консервирующими свойствами, которые предотвращают рост плесени и бактерий.
Он также используется для очистки тонкой кожуры фруктов, таких как помидоры, для консервирования. Он обладает консервирующими свойствами, которые предотвращают рост плесени и бактерий. 0146
0146
 В данном случае сода выступает в роли разрыхлителя. А вот если купить пакетик с открывалкой для выпечки в магазине, то на упаковке в строке состава можно обнаружить наличие соды, которая обозначена как пищевая добавка Е500.
В данном случае сода выступает в роли разрыхлителя. А вот если купить пакетик с открывалкой для выпечки в магазине, то на упаковке в строке состава можно обнаружить наличие соды, которая обозначена как пищевая добавка Е500. С ее помощью можно избавиться от запаха пота как в подмышках, так и в обуви.
С ее помощью можно избавиться от запаха пота как в подмышках, так и в обуви.


