Ксилол — это… Что такое Ксилол?
КСИЛОЛ — (Xylol) LC6h5(Ch4)2], диметил бензол, существует в трех изомерах: орто [t° кипения 144,4°, уд. в. 0,880 при 20°/4°], мета [t° кипения 139°, уд. в. 0,864 (20о/4°Л, пара [t° кипения 138°, уд. в. 0,861… … Большая медицинская энциклопедия
КСИЛОЛ — (С6Н4(СН3)2), органическое химическое соединение, получаемое перегонкой каменноугольной смолы и нефти. Основное назначение растворитель. По химическому составу это диметилбензол, существующий в трех изометрических формах: орто , мета и параксилол … Научно-технический энциклопедический словарь
ксилол — сущ., кол во синонимов: 5 • ароматика (5) • диметилбензол (3) • добавка (40) • … Словарь синонимов
КСИЛОЛ — наиболее употребительный растворитель канадского бальзама. Применяется наряду с бензолом или денатурированным спиртом в смеси с амилацетатом при приготовлении шлифов или при вскрытии петрографических шлифов для иммерсионных целей. Геологический… … Геологическая энциклопедия
Ксилол — – химическое вещество, представляющее собой слабо пахнущую жидкость, получаемую при коксовании угля и нефтепереработке. Используется в лакокрасочной промышленности в качестве растворителя, в медицине как противолихорадочное средство, а… … Нефтегазовая микроэнциклопедия
ксилоліт — іменник чоловічого роду … Орфографічний словник української мови
ксилол — (ксило… + лат. ol(eum) масло) органическое соединение, углеводород ароматического ряда; бесцветная жидкость; содержится в коксовом газе, откуда его и выделяют; примен. как растворитель в производстве лаков, красок, мастик, фармацевтических… … Словарь иностранных слов русского языка
ксилол — ksilenas statusas T sritis chemija formulė (CH₃)₂C₆H₄ atitikmenys: angl. xylene rus. ксилол ryšiai: sinonimas – dimetilbenzenas … Chemijos terminų aiškinamasis žodynas
Ксилол — см. Углеводороды ароматические … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ксилол — ксилол, ксилолы, ксилола, ксилолов, ксилолу, ксилолам, ксилол, ксилолы, ксилолом, ксилолами, ксилоле, ксилолах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Ксилолы — Википедия
Материал из Википедии — свободной энциклопедии
Диметилбензо́лы или ксило́лы (от др.-греч. ξύλον «дерево») — углеводороды ароматического ряда, состоящие из бензольного кольца и двух метильных групп. Химическая формула — (СН3)2С6Н4. Ксилолы получают при коксовании угля или из нефти путём каталитического риформинга прямогонной бензиновой фракции. Применяются главным образом в качестве растворителей.
Открыты в 1850 году французским химиком Огюстом Кауром, выделившим ксилол из древесного спирта-сырца
Свойства
Бесцветные жидкости с характерным запахом. Малорастворимы в воде, хорошо растворяются в органических растворителях. Проявляют свойства ароматических соединений, легко алкилируются, хлорируются, сульфируются и нитруются.
Изомерия
Существуют три изомера: орто-, мета— и пара-ксилол.
| орто-, мета-, пара- изомерия ксилола: | ||
|---|---|---|
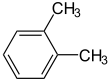 | 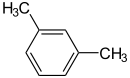 | 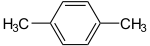 |
| орто-ксилол | мета-ксилол | пара-ксилол |
Абсолютный метод Кернера
Для определения качественного состава смеси орто-, мета— и пара-ксилолов используется метод абсолютной ориентации по Кернеру. Этот метод строится на определении числа возможных изомеров. После проведения реакции хлорирования на основании структуры пара-ксилола можно ожидать, что он даст лишь одно монохлорпроизводное; для орто-ксилола возможно два монохлорпроизводных, а для мета-ксилола — три монохлорпроизводных.
Метод Кернера требует очень много времени и на практике применяется к немногим ароматическим соединениям.
Применение
Применяются как растворители лаков, фаласов, мастик и др. Используют в синтезе красителей. Пара-ксилол применяется как сырьё для синтеза терефталевой кислоты — полупродукта для получения полиэтилентерефталата. Орто-ксилол используется в производстве диоктилфталатов и других эфиров фталевой кислоты — пластификаторов для ПВХ. Очистка ксилолов, используемых в качестве растворителей, аналогична очистке толуола с тем отличием, что они с водой образуют азеотропную смесь, но кипят при температуре много выше температуры её кипения, таким образом их можно очищать простой перегонкой.
Ксилол рекомендуют применять в качестве заполняющей жидкости термометров, предназначенных для работы в реакционных смесях подвергающихся СВЧ-излучению, т.к. он имеет весьма малые диэлектрические потери и не будет нагреваться от излучения. [4]
Примечания
- ↑ Быков Г. В. История органической химии: Открытие важнейших органических соединений. — М.: Наука, 1978. — С. 94. — 379 с.
- ↑ 1 2 1,2-диметилбензол. Мини-справочник по химическим веществам.
- ↑ Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. Москва: Мир, 1976. — 544 с.
- ↑ Microwave Dielectric Heating Effects in Chemical Synthesis — (102 refs.). — (MICHAEL, D.; MINGOS, P.; WHITTAKER, A. G.; Chem. Extreme Non-Classical Cond. (1997) 479-514; Chem. Dep., Imp. Coll. Sci., Technol. Med., South Kensington SW1 2AY, UK; EN) ( see page 499)
Ксилол
Ксилол (диметилбензол) — ароматический углеводород.
Купить ксилол (ГОСТ 9410-78) можно, заполнив форму заявки. Доставка по России, мелкий и крупный опт.
Различают три изомера, идентичных по составу, но отличающихся свойствами, что позволяет использовать раствор для различных типов лакокрасочной продукции. Наилучшей способностью к растворению характеризуется ортоксилол, параксилол обладает кислотными свойствами, хорошо обезжиривает, метаксилол влияет на возможность вступления веществ в химические реакции (катализатор). В зависимости от соотношения в составе изомеров ксилол нефтяной выпускается в двух марках – А и Б.
Ксилол входит в состав каменноугольной смолы, нефти и продуктов её ароматизации, содержится в продуктах перегонки сухого дерева, светильном и кокосовом газах, продуктах синтеза толуола из метилового спирта и бензола.
Технические характеристики
Ксилол является прозрачной жидкостью с характерным запахом нефтепродуктов, не содержащей воды и посторонних примесей. Цвет ярко не выражен, согласно ГОСТ 2706.1-74 не должен быть темнее раствора К2Cr2O7 (0,003 г в 1 дм воды).
Химическое соединение обладает хорошей растворимостью в растворителях органического происхождения. У обеих марок ксилола технические характеристики практически одинаковы.
Плотность ксилола составляет 0, 862 – 0,868 г/см3 при условии температурного режима +20 градусов за Цельсием, вязкость – 0,5.
Температура кипения вещества (зависимо от модификации) – от 138,3 до 144,4 °C, замерзания — -40 °C.
Массовая доля ароматических углеводородов в ксилоле составляет 99,6 %, испаряется раствор без остатка.
Ксилолы в промышленных условиях производят при переработке бензиновых фракций нефти (каталитический риформинг) либо в процессе коксования угля.
При выполнении работ, стоит помнить, что ксилол нефтяной токсичен при испарении, может вызывать химическое отравление. Целесообразно применять респиратор, резиновые перчатки, при появлении любых неприятных симптомов немедленно выйти на свежий воздух. Ксилол всех марок пожароопасен, важно соблюдать правила техники безопасности, использовать раствор вдали от возможных очагов возгорания, электричества. Для тушения допускается использование химической и воздушно-химической пены, мелкораспыленной воды.
Применение ксилолов
Главным образом ксилол применяется как растворитель — входит в состав растворителей 650, 649, Р-12, Р-24, Р-119 Э, Р-189, Р-197, Р-1166, РЛ-278, РЛ-298, РКБ-1, РКБ-2, РС-1, РС-2 и других.
С его использованием изготовляют типографическую краску, красители, инсектициды и ядохимикаты для сельскохозяйственных нужд. Применим ксилол нефтяной и в строительстве, изготовлении мебели, в медицине – для получения лекарственных средств. Марка А оптимизирована под бытовой растворитель, поэтому её используют для растворения лакокрасочной продукции, марка Б считается более функциональной, способной растворить эпоксид, акрил, винил, кремнийорганические полимеры, нитроцеллюлозу, меламин, каучук, мочевиноформальдегид. Это позволяет эксплуатировать её в узкоспециализированных работах – производстве садовых статуй, изготовлении красок, мастик и лаков в домашних условиях, заливке акриловых ванн.
Ксилол, в некоторой степени, можно считать универсальным растворителем, т.к. кроме использования для разбавления лакокрасочных материалов, он применяется еще для разведения смол и пластических масс (пластмасс).
Кроме того, ксилолы широко используются в химической промышленности. Из ксилолов, методом парофазного окислительного аммонолиза с введением катализаторов в систему, получают дицианобензолы (фталодинитрилы). Частичное окисление ксилолов (хромовой зеленью, перманганатом калия или азотной кислотой) синтезируют метилбензойные кислоты, которые при окислительном декабоксилировании трансформируются в крезолы. Из ксилолов изготавливают такие продукты, как ксилидины, фталевый ангидрид, терефталевую, изофталевую и фталевую кислоты, поли-п-ксилилен и др.
Применение ксилола в предпочтении автолюбителей, поскольку добавление такого раствора повышает октановое число бензина на 3-5 единиц, что экономично себя полностью оправдывает. На десять литров топлива добавляется сто миллилитров ксилола.
При выборе ксилола стоит обратить внимание на его состав, поскольку, кроме нефтяного, промышленностью выпускается и камнеугольный, внешний вид которых абсолютно идентичен. Необходимо помнить, что жидкость в таре должна быть прозрачной, без примесей. Именно их наличие свидетельствует о низком качестве раствора или окончании срока хранения, что составляет восемнадцать месяцев – через 500 — 525 дней осуществляется полураспад компонентов ксилола и изменение его химического состава, что делает ксилол не пригодным к применению.
 |
 |
…
КСИЛОЛЫ (диметилбензолы) (СН3)2С6Н4, мол. м. 106,16; бесцв. жидкости (табл. 1) с запахом бензола. Смешиваются с этанолом, диэтиловым эфиром, ацетоном, хлороформом, бензолом; р-римость в воде менее 0,015%.
Табл. 1. — СВОЙСТВА КСИЛОЛОВ Ксилолы-типичные ароматич. углеводороды; легко алкилируются, хлорируются, сульфируются, нитруются; легкость замещения уменьшается в ряду: м-ксилол >о-ксилол >п-ксилол. Из ксилолов производят ряд важных пром. продуктов. Так, частичным окислением ксилолов (НNО3, Сr2О3 или КМnО4) синтезируют толуиловые к-ты, превращающиеся при окислит. декарбоксилировании в крезолы, окислением о-ксилола в паровой фазе при 450-600’С (кат.-V2О5 на SiO2) — фталевый ангидрид. Глубоким окислением о-, м- или п-ксилолов действием HNO3 или О2 воздуха в жидкой фазе при 100-300°С и 4 МПа (кат.-бромиды Мn или Со) получают соотв. фталевую, изофталсвую и тсрсфталевую к-ты. Нитрованием смеси ксилолов получают смесь изомерных диметилнитробензолов, восстановлением к-рой синтезируют ксилидины. Пиролизом n-ксилола при 800-1000 °С получают поли-л-ксилилен. Ксилолы конденсируются с СН2О, образуя полимеры с мол. м. <1000. Парофазным окислит. аммонолизом ксилолов в присут. катализатора при 370-510 °С и 0,035-0,21 МПа получают фталодинитрилы. В пром-сти смеси изомерных ксилолов, т. наз. техн. ксилол, получают разл. способами (табл. 2). Табл. 2. СОСТАВ ТЕХНИЧЕСКОГО КСИЛОЛА, ПОЛУЧЕННОГО РАЗЛИЧНЫМИ СПОСОБАМИ, % по массе о-Ксилол чистоты выше 99% выделяют четкой ректификацией, м-ксилол чистоты выше 98%-экстракцией смесью HF и BF3, образующей с ним комплексы, а также сульфированном H2SO4 с послед. гидролизом полученной сульфокислоты; п-ксилол чистоты выше 99% выделяют адсорбцией на катионзамещенных цеолитах и низкотемпературной кристаллизацией (адсорбц. способы имеют лучшие технико-экономич. показатели). п-Ксилол можно получать также селективным алкилированием толуола метанолом в присут. сверхвысококремнеземных цеолитов. Ксилолы-р-рители лаков, красок, мастик, высокооктановая добавка к моторным топливам. Для ксилолов КПВ 3,0-7,6%, т. всп. 29 °С; для о-, м- и п-ксилолов т. самовоспл. 499, 563 и 564 °С соответственно. Ксилолы обладают наркотич. действием, аналогичным действию бензола и толуола; ПДК 50 мг/м3. Лит.: Сулнмов А. Д., Производство ароматических углеводородов из нефтяного сырья. М.. 1975; Kirk-Othmer encyclopedia, 3 ed., v. 24, N. Y.. 1984, p. 709 44. В. Я. Данюшевский.
Страница «КСИЛОЛЫ» подготовлена по материалам химической энциклопедии. |

|
Ксилол Википедия
Диметилбензо́лы или ксило́лы (от др.-греч. ξύλον «дерево») — углеводороды ароматического ряда, состоящие из бензольного кольца и двух метильных групп. Химическая формула — (СН3)2С6Н4. Ксилолы получают при коксовании угля или из нефти путём каталитического риформинга прямогонной бензиновой фракции. Применяются главным образом в качестве растворителей.
Открыты в 1850 году французским химиком Огюстом Кауром, выделившим ксилол из древесного спирта-сырца[1].
Свойства[ | ]
Бесцветные жидкости с характерным запахом. Малорастворимы в воде, хорошо растворяются в органических растворителях. Проявляют свойства ароматических соединений, легко алкилируются, хлорируются, сульфируются и нитруются.
Изомерия[ | ]
Существуют три изомера: орто-, мета— и пара-ксилол.
| орто-, мета-, пара- изомерия ксилола: | ||
|---|---|---|
 |  |  |
| орто-ксилол | мета-ксилол | пара-ксилол |
Абсолютный метод Кернера[ | ]
Для определения качественного состава смеси орто-, мета— и пара-ксилолов используется метод абсолютной ориентации по Кернеру. Этот метод строится на определении числа возможных изомеров. После проведения реакции хлорирования на основании структуры пара-ксилола можно ожидать, что он даст лишь одно монохлорпроизводное; для орто-ксилола возможно два монохлорпроизводных, а для мета-ксилола — три монохлорпроизводных.
Метод Кернера требует очень много времени и на практике применяется к немногим ароматическим соединениям.
Применение[ | ]
Применяются как растворители лаков, фаласов, мастик и др. Используют в синтезе
Ксилол Википедия
Диметилбензо́лы или ксило́лы (от др.-греч. ξύλον «дерево») — углеводороды ароматического ряда, состоящие из бензольного кольца и двух метильных групп. Химическая формула — (СН3)2С6Н4. Ксилолы получают при коксовании угля или из нефти путём каталитического риформинга прямогонной бензиновой фракции. Применяются главным образом в качестве растворителей.
Открыты в 1850 году французским химиком Огюстом Кауром, выделившим ксилол из древесного спирта-сырца[1].
Свойства
Бесцветные жидкости с характерным запахом. Малорастворимы в воде, хорошо растворяются в органических растворителях. Проявляют свойства ароматических соединений, легко алкилируются, хлорируются, сульфируются и нитруются.
Изомерия
Существуют три изомера: орто-, мета— и пара-ксилол.
| орто-, мета-, пара- изомерия ксилола: | ||
|---|---|---|
| орто-ксилол | мета-ксилол | пара-ксилол |
Абсолютный метод Кернера
Для определения качественного состава смеси орто-, мета— и пара-ксилолов используется метод абсолютной ориентации по Кернеру. Этот метод строится на определении числа возможных изомеров. После проведения реакции хлорирования на основании структуры пара-ксилола можно ожидать, что он даст лишь одно монохлорпроизводное; для орто-ксилола возможно два монохлорпроизводных, а для мета-ксилола — три монохлорпроизводных.
Метод Кернера требует очень много времени и на практике применяется к немногим ароматическим соединениям.
Применение
Применяются как растворители лаков, фаласов, мастик и др. Используют в синтезе красителей.
Пара-ксилол применяется как сырьё для синтеза терефталевой кислоты — полупродукта для получения полиэтилентерефталата.
Орто-ксилол используется в производстве диоктилфталатов и других эфиров фталевой кислоты — пластификаторов для ПВХ. Очистка ксилолов, используемых в качестве растворителей, аналогична очистке толуола с тем отличием, что они с водой образуют азеотропную смесь, но кипят при температуре много выше температуры её кипения; таким образом, их можно очищать простой перегонкой[3].
Ксилол рекомендуют применять в качестве заполняющей жидкости термометров, предназначенных для работы в реакционных смесях, подвергающихся СВЧ-излучению, так как он имеет весьма малые диэлектрические потери и не будет нагреваться от излучения[4].
Влияние на организм человека
Основной путь поступления ксилолов в организм человека — ингаляционный (через лёгкие при дыхании). Также ксилолы могут проникать в организм через кожу, в т.ч. неповреждённую (благодаря способности растворяться в липидах, они легко проникают в кровоток через подкожную жировую клетчатку). В лёгких поглощается до 65% ксилолов, поступающих в них с вдыхаемым воздухом (через кожу ксилолы поступают в организм только в случае непосредственного попадания на неё в жидком состоянии). Накапливаются, преимущественно, в паренхиматозных органах (печень), мышцах и жировой ткани. Большая часть ксилолов в организме подвергается биотрансформации (преимущественно в печени) в виде окисления до метилбензойных кислот и гидроксилирования ароматического ядра с образованием диметилфенолов. Метилбензойные кислоты реагируют с глицином (образуя метилгиппуровые кислоты) и выводятся из организма с мочой. Небольшая часть (5-6%) выводится из организма в неизменном виде через лёгкие с выдыхаемым воздухом.
При остром отравлении у человека наблюдаются возбуждение, чувство опьянения, раздражение слизистых оболочек глаз и дыхательных путей, нарушения работы сердечно-сосудистой, пищеварительной и дыхательной систем, потеря сознания. В случае продолжительного (хронического) воздействия происходит, в первую очередь, поражение печени, кроветворной и иммунной системы[5].
Охрана труда
Ксилолы токсичны[6][7]. ПДК ксилолов 150 мг/м3 (максимально-разовая) и 50 мг/м3 (среднесменная)[8]. А порог восприятия запаха может быть, например, 1370 мг/м3 [9]. Можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию ксилолов на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от ксилолов следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Примечания
- ↑ Быков Г. В. История органической химии: Открытие важнейших органических соединений. — М.: Наука, 1978. — С. 94. — 379 с.
- ↑ 1 2 [www.xumuk.ru/spravochnik/1315.html 1,2-диметилбензол]. Мини-справочник по химическим веществам.
- ↑ Гордон А., Форд Р. Спутник химика / Перевод на русский язык Розенберга Е. Л., Коппель С. И.. — Москва: Мир, 1976. — 544 с.
- ↑ Microwave Dielectric Heating Effects in Chemical Synthesis — (102 refs.). — (MICHAEL, D.; MINGOS, P.; WHITTAKER, A. G.; Chem. Extreme Non-Classical Cond. (1997) 479—514; Chem. Dep., Imp. Coll. Sci., Technol. Med., South Kensington SW1 2AY, UK; EN) (see page 499)
- ↑ А.Л. Бандман, Г.А. Войтенко, Н.В. Волкова и др. Вредные химические вещества. Углеводороды. Галогенпроизводные углеводородов. — Л.: Химия, 1990. — С. 159-163. — 732 с.
- ↑ МКХБ : МОТ. № 0084. о-Ксилол 1,2-Диметилбензол (рус.). www.ilo.org/dyn/icsc/ (2018). Дата обращения 10 ноября 2019. МОТ. № 0085. м-Ксилол 1,3-Диметилбензол (рус.). www.ilo.org/dyn/icsc/ (2018). Дата обращения 10 ноября 2019. МОТ. № 0086. п-Ксилол 1,4-Диметилбензол (рус.). www.ilo.org/dyn/icsc/ (2018). Дата обращения 10 ноября 2019.
- ↑ Видершайн Г.Я., Хесин Я.Е. Ксилолы // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1980. — Т. 12. Криохирургия — Ленегр. — 536 с. — 150 300 экз.
- ↑ (Роспотребнадзор). № 742. Диметилбензол (смесь 2-, 3-, 4-изомеров) (ксилол смесь изомеров) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 55. — 170 с. — (Санитарные правила).
- ↑ Johannes May. Odor Thresholds of Solvents for Assessment of Solvent Odors in the Air [Geruchsschwellen von Lösemitteln zur Bewertung von Lösemittelgerüchen in der Luft] (нем.) // Staub, Reinhaltung der Luft. — Düsseldorf: VDI-Verlag GmbH, 1966. — September (vol. 26 (H. 9). — S. 385–389. — ISSN 0039-0771., цитируется по: Office of Air Quality Planning and Standards. Reference Guide To Odor Thresholds For Hazardous Air Pollutants Listed In The Clean Air Act Amendments Of 1990 (англ.). — Research Triangle Park, North Carolina: United States Environmental Protection Agency, 1992. — 89 p. — (EPA600/R-92/047).
| Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист.Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
КСИЛОЛ — это… Что такое КСИЛОЛ?
КСИЛОЛ — (С6Н4(СН3)2), органическое химическое соединение, получаемое перегонкой каменноугольной смолы и нефти. Основное назначение растворитель. По химическому составу это диметилбензол, существующий в трех изометрических формах: орто , мета и параксилол … Научно-технический энциклопедический словарь
ксилол — сущ., кол во синонимов: 5 • ароматика (5) • диметилбензол (3) • добавка (40) • … Словарь синонимов
КСИЛОЛ — наиболее употребительный растворитель канадского бальзама. Применяется наряду с бензолом или денатурированным спиртом в смеси с амилацетатом при приготовлении шлифов или при вскрытии петрографических шлифов для иммерсионных целей. Геологический… … Геологическая энциклопедия
Ксилол — – химическое вещество, представляющее собой слабо пахнущую жидкость, получаемую при коксовании угля и нефтепереработке. Используется в лакокрасочной промышленности в качестве растворителя, в медицине как противолихорадочное средство, а… … Нефтегазовая микроэнциклопедия
ксилоліт — іменник чоловічого роду … Орфографічний словник української мови
Ксилол — Диметилбензолы (ксилолы) C6h5(СН3)2 углеводороды, ароматического ряда. Содержание 1 Свойства 2 Изомерия 3 Получение 4 Применение … Википедия
ксилол — (ксило… + лат. ol(eum) масло) органическое соединение, углеводород ароматического ряда; бесцветная жидкость; содержится в коксовом газе, откуда его и выделяют; примен. как растворитель в производстве лаков, красок, мастик, фармацевтических… … Словарь иностранных слов русского языка
ксилол — ksilenas statusas T sritis chemija formulė (CH₃)₂C₆H₄ atitikmenys: angl. xylene rus. ксилол ryšiai: sinonimas – dimetilbenzenas … Chemijos terminų aiškinamasis žodynas
Ксилол — см. Углеводороды ароматические … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ксилол — ксилол, ксилолы, ксилола, ксилолов, ксилолу, ксилолам, ксилол, ксилолы, ксилолом, ксилолами, ксилоле, ксилолах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Ксилол | химическое соединение | Britannica
Ксилол , любой из трех изомерных диметилбензолов [имеющих одинаковую химическую формулу, C 6 H 4 (CH 3 ) 2 , но разную молекулярную структуру], используемый в качестве растворителей, в качестве компонентов авиационного топлива, а также в качестве сырья для производства красителей, волокон и пленок. Три изомера, обозначенные орто ( o ), мета ( m ) и пара ( p ), структурно различаются только расположением метильных групп.Все три продукта получают из каменноугольного дистиллята и нефти в виде смеси, содержащей 50-60 процентов по объему м -ксилола и 20-25 процентов каждого из других изомеров. При фракционной перегонке смеси из менее летучего орто-изомера удаляются мета- и пара-изомеры, которые имеют очень похожие точки кипения. При охлаждении смеси мета и пара-изомеров большая часть p -ксилола кристаллизуется почти в чистой форме. Затем мета-изомер, основной компонент оставшейся жидкости, может быть очищен, используя его растворимость в смеси фтористоводородной кислоты и трифторида бора.Мета- и пара-ксилол подвергаются нитрованию и восстановлению с образованием ксилидинов, используемых в производстве красителей. Мета-изомер также превращается в тринитро- t -бутил- m -ксилол или ксилол-мускус, компонент духов. Окисление ксилолов дает монокарбоновые кислоты (толуиловые кислоты), а затем дикарбоновые кислоты (фталевые кислоты).
Подробнее по этой теме
химическая промышленность: ксилол
Встречаются три изомерных ксилола (изомерный означает, что они имеют точно такое же количество и вид атомов, но расположены по-разному)…
Коммерческая смесь ксилолов представляет собой бесцветную, невязкую, легковоспламеняющуюся, токсичную жидкость, не растворимую в воде, но смешивающуюся со многими органическими жидкостями. Ксилол обычно используется в качестве растворителя для лаков и резиновых цементов.
.3.5: Эмпирические формулы из анализа
Когда соединение, содержащее углерод и водород, подвергается горению с кислородом в специальном аппарате для сжигания, весь углерод превращается в CO 2 , а водород в H 2 O (Рисунок \ ( \ PageIndex {2} \)). Количество произведенного углерода может быть определено путем измерения количества произведенного CO 2 . Он улавливается гидроксидом натрия, и, таким образом, мы можем контролировать массу производимого CO 2 , определяя увеличение массы ловушки CO 2 .Точно так же мы можем определить количество H, произведенного из количества H 2 O, захваченного перхлоратом магния.
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом горения. Небольшой, тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода. Другие элементы, такие как металлы, можно определить другими методами.и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 , соответственно) определяются одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке \ (\ PageIndex {3} \), а типичный анализ горения проиллюстрирован в примерах \ (\ PageIndex {3} \) и \ (\ PageIndex {4} \).
Пример \ (\ PageIndex {3} \): горение изопропилового спирта
Какова эмпирическая формула для изопропилового спирта (который содержит только C, H и O), если при сгорании 0.Образец изопропилового спирта 255 г дает 0,561 г CO 2 и 0,306 г H 2 O?
Решение
По этой информации определите количество C и H в образце.
\ [(0.561 \; \ cancel {g \; CO_2}) \ left (\ dfrac {1 \; mol \; CO_2} {44.0 \; \ cancel {g \; CO_2}} \ right) = 0,0128 \; моль \; CO_2 \]
Поскольку один моль CO 2 состоит из одного моля C и двух молей O, если в нашем образце 0,0128 моль CO 2 , то мы знаем, что имеем 0.0128 моль C в образце. Сколько это граммов C?
\ [(0,0128 \; \ cancel {mol \; C}) \ left (\ dfrac {12.011 \; g \; C} {1 \; \ cancel {mol \; C}} \ right) = 0,154 \; грамм \; C \]
Как насчет водорода?
\ [(0.306 \; \ cancel {g \; H_2O}) \ left (\ dfrac {1 \; mol \; H_2O} {18.0 \; \ cancel {g \; H_2O}} \ right) = 0,017 \; моль \; H_2O \]
Так как один моль H 2 O состоит из одного моля кислорода и двух моль водорода, если у нас 0.017 моль H 2 O, тогда имеем 2 * (0,017) = 0,034 моль водорода. Поскольку водород составляет примерно 1 грамм / моль, в нашем исходном образце должно быть 0,034 грамма водорода .
Если сложить углерод и водород, мы получим:
0,154 грамма (C) + 0,034 грамма (H) = 0,188 грамма
Но мы знаем, что сожгли 0,255 грамма изопропилового спирта. «Недостающая» масса должна быть связана с атомами кислорода в изопропиловом спирте:
0.255 г — 0,188 г = 0,067 г кислорода
Сколько молей это кислород?
\ [(0,067 \; \ cancel {g \; O}) \ left (\ dfrac {1 \; mol \; O} {15.994 \; \ cancel {g \; O}} \ right) = 0,0042 \; моль \; O \]
Таким образом, всего имеем:
- 0,0128 моль Углерод
- 0,0340 моль Водород
- 0,0042 моль Кислород
Разделить на наименьшее молярное количество для нормализации:
- C = 3,05 атома
- H = 8.1 атом
- O = 1 атом
В пределах экспериментальной ошибки наиболее вероятной эмпирической формулой для пропанола будет \ (C_3H_8O \)
Пример \ (\ PageIndex {4} \): Горение нафалена
Нафталин, активный ингредиент одного вида нафталина, представляет собой органическое соединение, которое содержит только углерод и водород. Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Дано : масса пробы и масса продуктов сгорания
Запрошено : эмпирическая формула
Стратегия :
- Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходной пробе нафталина.
- Используйте эти массы и молярные массы элементов, чтобы вычислить эмпирическую формулу нафталина.
Решение :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль \ (\ ce {CO2} \). Точно так же 1 моль H 2 O образуется на каждые 2 моль атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны на основе этих соотношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицы молярной массы — граммы на моль, мы должны сначала преобразовать массу из миллиграммов в граммы:
\ [масса \, of \, C = 69.{−3}} = 1,250 \]
Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25: 1: C 1,25 H 1,0 . Поскольку соотношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что даст C 5 H 4 как эмпирическую формулу нафталина. Фактически, химическая формула нафталина C 10 H 8 , что согласуется с нашими результатами.
.3.4: Определение эмпирической и молекулярной формулы
Когда соединение, содержащее углерод и водород, подвергается сгоранию с кислородом в специальном аппарате для сжигания, весь углерод превращается в CO 2 , а водород в H 2 O (рис. \ (\ PageIndex {2} \)). Количество произведенного углерода может быть определено путем измерения количества произведенного CO 2 . Он улавливается гидроксидом натрия, и, таким образом, мы можем контролировать массу производимого CO 2 , определяя увеличение массы ловушки CO 2 .Точно так же мы можем определить количество H, произведенного из количества H 2 O, захваченного перхлоратом магния.
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом горения. Небольшой, тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода. Другие элементы, такие как металлы, можно определить другими методами.и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 , соответственно) определяются одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке \ (\ PageIndex {3} \), а типичный анализ горения проиллюстрирован в примерах \ (\ PageIndex {3} \) и \ (\ PageIndex {4} \).
Пример \ (\ PageIndex {3} \): горение изопропилового спирта
Какова эмпирическая формула для изопропилового спирта (который содержит только C, H и O), если при сгорании 0.Образец изопропилового спирта 255 г дает 0,561 г CO 2 и 0,306 г H 2 O?
Решение
По этой информации определите количество C и H в образце.
\ [(0.561 \; \ cancel {g \; CO_2}) \ left (\ dfrac {1 \; mol \; CO_2} {44.0 \; \ cancel {g \; CO_2}} \ right) = 0,0128 \; моль \; CO_2 \]
Поскольку один моль CO 2 состоит из одного моля C и двух молей O, если в нашем образце 0,0128 моль CO 2 , то мы знаем, что имеем 0.0128 моль C в образце. Сколько это граммов C?
\ [(0,0128 \; \ cancel {mol \; C}) \ left (\ dfrac {12.011 \; g \; C} {1 \; \ cancel {mol \; C}} \ right) = 0,154 \; грамм \; C \]
Как насчет водорода?
\ [(0.306 \; \ cancel {g \; H_2O}) \ left (\ dfrac {1 \; mol \; H_2O} {18.0 \; \ cancel {g \; H_2O}} \ right) = 0,017 \; моль \; H_2O \]
Так как один моль H 2 O состоит из одного моля кислорода и двух моль водорода, если у нас 0.017 моль H 2 O, тогда имеем 2 * (0,017) = 0,034 моль водорода. Поскольку водород составляет примерно 1 грамм / моль, в нашем исходном образце должно быть 0,034 грамма водорода .
Если сложить углерод и водород, мы получим:
0,154 грамма (C) + 0,034 грамма (H) = 0,188 грамма
Но мы знаем, что сожгли 0,255 грамма изопропилового спирта. «Недостающая» масса должна быть связана с атомами кислорода в изопропиловом спирте:
0.255 г — 0,188 г = 0,067 г кислорода
Сколько молей это кислород?
\ [(0,067 \; \ cancel {g \; O}) \ left (\ dfrac {1 \; mol \; O} {15.994 \; \ cancel {g \; O}} \ right) = 0,0042 \; моль \; O \]
Таким образом, всего имеем:
- 0,0128 моль Углерод
- 0,0340 моль Водород
- 0,0042 моль Кислород
Разделить на наименьшее молярное количество для нормализации:
- C = 3,05 атома
- H = 8.1 атом
- O = 1 атом
В пределах экспериментальной ошибки наиболее вероятной эмпирической формулой для пропанола будет \ (C_3H_8O \)
Пример \ (\ PageIndex {4} \): Горение нафалена
Нафталин, активный ингредиент одного вида нафталина, представляет собой органическое соединение, которое содержит только углерод и водород. Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Дано : масса пробы и масса продуктов сгорания
Запрошено : эмпирическая формула
Стратегия :
- Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходной пробе нафталина.
- Используйте эти массы и молярные массы элементов, чтобы вычислить эмпирическую формулу нафталина.
Решение :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль \ (\ ce {CO2} \). Точно так же 1 моль H 2 O образуется на каждые 2 моль атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны на основе этих соотношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицы молярной массы — граммы на моль, мы должны сначала преобразовать массу из миллиграммов в граммы:
\ [масса \, of \, C = 69.{−3}} = 1,250 \]
Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25: 1: C 1,25 H 1,0 . Поскольку соотношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что даст C 5 H 4 как эмпирическую формулу нафталина. Фактически, химическая формула нафталина C 10 H 8 , что согласуется с нашими результатами.
.3.5: Определение формулы соединения
Когда соединение, содержащее углерод и водород, подвергается сжиганию с кислородом в специальном аппарате для сжигания, весь углерод превращается в CO 2 , а водород в H 2 O (рис. \ (\ PageIndex {2} \)). Количество произведенного углерода может быть определено путем измерения количества произведенного CO 2 . Он улавливается гидроксидом натрия, и, таким образом, мы можем контролировать массу производимого CO 2 , определяя увеличение массы ловушки CO 2 .Точно так же мы можем определить количество H, произведенного из количества H 2 O, захваченного перхлоратом магния.
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом горения. Небольшой, тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода. Другие элементы, такие как металлы, можно определить другими методами.и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 , соответственно) определяются одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке \ (\ PageIndex {3} \), а типичный анализ горения проиллюстрирован в примерах \ (\ PageIndex {3} \) и \ (\ PageIndex {4} \).
Пример \ (\ PageIndex {3} \): горение изопропилового спирта
Какова эмпирическая формула для изопропилового спирта (который содержит только C, H и O), если при сгорании 0.Образец изопропилового спирта 255 г дает 0,561 г CO 2 и 0,306 г H 2 O?
Решение
По этой информации определите количество C и H в образце.
\ [(0.561 \; \ cancel {g \; CO_2}) \ left (\ dfrac {1 \; mol \; CO_2} {44.0 \; \ cancel {g \; CO_2}} \ right) = 0,0128 \; моль \; CO_2 \]
Поскольку один моль CO 2 состоит из одного моля C и двух молей O, если в нашем образце 0,0128 моль CO 2 , то мы знаем, что имеем 0.0128 моль C в образце. Сколько это граммов C?
\ [(0,0128 \; \ cancel {mol \; C}) \ left (\ dfrac {12.011 \; g \; C} {1 \; \ cancel {mol \; C}} \ right) = 0,154 \; грамм \; C \]
Как насчет водорода?
\ [(0.306 \; \ cancel {g \; H_2O}) \ left (\ dfrac {1 \; mol \; H_2O} {18.0 \; \ cancel {g \; H_2O}} \ right) = 0,017 \; моль \; H_2O \]
Так как один моль H 2 O состоит из одного моля кислорода и двух моль водорода, если у нас 0.017 моль H 2 O, тогда имеем 2 * (0,017) = 0,034 моль водорода. Поскольку водород составляет примерно 1 грамм / моль, в нашем исходном образце должно быть 0,034 грамма водорода .
Если сложить углерод и водород, мы получим:
0,154 грамма (C) + 0,034 грамма (H) = 0,188 грамма
Но мы знаем, что сожгли 0,255 грамма изопропилового спирта. «Недостающая» масса должна быть связана с атомами кислорода в изопропиловом спирте:
0.255 г — 0,188 г = 0,067 г кислорода
Сколько молей это кислород?
\ [(0,067 \; \ cancel {g \; O}) \ left (\ dfrac {1 \; mol \; O} {15.994 \; \ cancel {g \; O}} \ right) = 0,0042 \; моль \; O \]
Таким образом, всего имеем:
- 0,0128 моль Углерод
- 0,0340 моль Водород
- 0,0042 моль Кислород
Разделить на наименьшее молярное количество для нормализации:
- C = 3,05 атома
- H = 8.1 атом
- O = 1 атом
В пределах экспериментальной ошибки наиболее вероятной эмпирической формулой для пропанола будет \ (C_3H_8O \)
Пример \ (\ PageIndex {4} \): Горение нафалена
Нафталин, активный ингредиент одного вида нафталина, представляет собой органическое соединение, которое содержит только углерод и водород. Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Дано : масса пробы и масса продуктов сгорания
Запрошено : эмпирическая формула
Стратегия :
- Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходной пробе нафталина.
- Используйте эти массы и молярные массы элементов, чтобы вычислить эмпирическую формулу нафталина.
Решение :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль \ (\ ce {CO2} \). Точно так же 1 моль H 2 O образуется на каждые 2 моль атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны на основе этих соотношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицы молярной массы — граммы на моль, мы должны сначала преобразовать массу из миллиграммов в граммы:
\ [масса \, of \, C = 69.{−3}} = 1,250 \]
Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25: 1: C 1,25 H 1,0 . Поскольку соотношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что даст C 5 H 4 как эмпирическую формулу нафталина. Фактически, химическая формула нафталина C 10 H 8 , что согласуется с нашими результатами.
.