Ксилол — это… Что такое Ксилол?
КСИЛОЛ — (Xylol) LC6h5(Ch4)2], диметил бензол, существует в трех изомерах: орто [t° кипения 144,4°, уд. в. 0,880 при 20°/4°], мета [t° кипения 139°, уд. в. 0,864 (20о/4°Л, пара [t° кипения 138°, уд. в. 0,861… … Большая медицинская энциклопедия
КСИЛОЛ — (С6Н4(СН3)2), органическое химическое соединение, получаемое перегонкой каменноугольной смолы и нефти. Основное назначение растворитель. По химическому составу это диметилбензол, существующий в трех изометрических формах: орто , мета и параксилол … Научно-технический энциклопедический словарь
ксилол — сущ., кол во синонимов: 5 • ароматика (5) • диметилбензол (3) • добавка (40) • … Словарь синонимов
КСИЛОЛ — наиболее употребительный растворитель канадского бальзама. Применяется наряду с бензолом или денатурированным спиртом в смеси с амилацетатом при приготовлении шлифов или при вскрытии петрографических шлифов для иммерсионных целей.
Ксилол — – химическое вещество, представляющее собой слабо пахнущую жидкость, получаемую при коксовании угля и нефтепереработке. Используется в лакокрасочной промышленности в качестве растворителя, в медицине как противолихорадочное средство, а… … Нефтегазовая микроэнциклопедия
ксилоліт — іменник чоловічого роду … Орфографічний словник української мови
ксилол — (ксило… + лат. ol(eum) масло) органическое соединение, углеводород ароматического ряда; бесцветная жидкость; содержится в коксовом газе, откуда его и выделяют; примен. как растворитель в производстве лаков, красок, мастик, фармацевтических… … Словарь иностранных слов русского языка
ксилол — ksilenas statusas T sritis chemija formulė (CH₃)₂C₆H₄ atitikmenys: angl. xylene rus. ксилол ryšiai: sinonimas – dimetilbenzenas … Chemijos terminų aiškinamasis žodynas
Ксилол — см. Углеводороды ароматические … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Углеводороды ароматические … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ксилол — ксилол, ксилолы, ксилола, ксилолов, ксилолу, ксилолам, ксилол, ксилолы, ксилолом, ксилолами, ксилоле, ксилолах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Пара-ксилол, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металлt°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.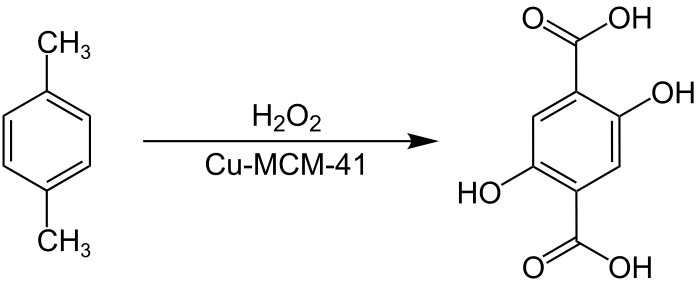
Чтобы получить подробное описание элемента, кликните по его названию.
Этилбензол, структурная формула, химические, физические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Мета-ксилол, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Октадиен-1,7-ин-4, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Октадиин-1,7, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
5-метилгептадиин-1,3, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ксилол — Энциклопедия Нового Света
Три изомера ксилола, каждый из которых имеет две метильные группы, присоединенные к бензольному кольцу. Атомы углерода в бензольном кольце пронумерованы от одного до шести, и каждая метильная группа обозначена прямой линией.Термин ксилол относится к группе из трех производных бензола, каждое из которых имеет две метильные функциональные группы, присоединенные к бензольному кольцу. Три члена группы являются изомерами и называются орто-, мета- и пара-ксилолом (или o -, m — и p -ксилол).Каждый ксилол представляет собой бесцветную жидкость со сладким запахом, которая легко воспламеняется. Они естественным образом встречаются в нефти и каменноугольной смоле и образуются во время лесных пожаров.
Группа ксилолов входит в топ-30 химических веществ, производимых в США по объему. Ксилолы являются растворителями и используются в качестве чистящих средств. Они содержатся в пестицидах, растворителях для красок, красках и лаках, а также используются в полиграфической, резиновой и кожевенной промышленности.
Они содержатся в пестицидах, растворителях для красок, красках и лаках, а также используются в полиграфической, резиновой и кожевенной промышленности.
Номенклатура
Изомеры o -, m — и p — определяют относительные положения присоединения двух метильных групп к атомам углерода в основной кольцевой структуре.Атом углерода в кольце, непосредственно связанный с метильной группой, считается первым положением, а затем подсчитываются другие атомы углерода в кольце по мере продвижения к точке присоединения следующей метильной группы. Таким образом, изомер o — получает название 1,2-диметилбензол в соответствии с системой, рекомендованной IUPAC (Международный союз чистой и прикладной химии). Аналогично, m — изомер имеет название IUPAC 1,3-диметилбензол, а p — изомер имеет название IUPAC 1,4-диметилбензол.
Известные характеристики
Ксилолы имеют очень похожие свойства, незначительно отличаясь от изомера к изомеру. Температура кипения для каждого изомера составляет около 140 ° C (284,00 ° F), а точка плавления находится между -47,87 ° C (-54,17 ° F) ( м -ксилола) и 13,26 ° C (55,87 ° F) ( p -ксилол). Плотность составляет около 0,87 кг / л (7,26 фунта / галлон США или 8,72 фунта / имп галлон), что указывает на то, что каждый ксилол менее плотен, чем вода. Ксилол в воздухе ощущается при 0.От 08 до 3,7 частей ксилола на миллион частей воздуха (частей на миллион) и можно почувствовать вкус воды в концентрации от 0,53 до 1,8 частей на миллион.
Температура кипения для каждого изомера составляет около 140 ° C (284,00 ° F), а точка плавления находится между -47,87 ° C (-54,17 ° F) ( м -ксилола) и 13,26 ° C (55,87 ° F) ( p -ксилол). Плотность составляет около 0,87 кг / л (7,26 фунта / галлон США или 8,72 фунта / имп галлон), что указывает на то, что каждый ксилол менее плотен, чем вода. Ксилол в воздухе ощущается при 0.От 08 до 3,7 частей ксилола на миллион частей воздуха (частей на миллион) и можно почувствовать вкус воды в концентрации от 0,53 до 1,8 частей на миллион.
С помощью окислителей, таких как перманганат калия (KMnO 4 ), метильная группа может быть окислена до карбоновой кислоты. Окисляя обе метильные группы до кислоты, o -ксилол образует фталевую кислоту, а p -ксилол образует терефталевую кислоту.
| Группа Ксилол | ||||
|---|---|---|---|---|
| Общие | ||||
| Общее название | Ксилолы | o -Ксилол | м -Ксилол | p -ксилол |
| Систематическое название | Диметилбензолы | 1,2-диметилбензол | 1,3-диметилбензол | 1,4-диметилбензол |
| Другие названия | Ксилолы | o -Ксилол; Ортоксилол | m -Ксилол; Метаксилол | p -Ксилол; Параксилол |
| Химическая формула | C 8 H 10 | |||
| УЛЫБКИ | Cc1c (С) cccc1 | Cc1cc (С) CCC1 | Cc1ccc (С) CC1 | |
| Молярная масса | 106. 16 г / моль 16 г / моль | |||
| Внешний вид | прозрачная бесцветная жидкость | |||
| Номер CAS | [1330-20-7] | [95-47-6] | [108-38-3] | [106-42-3] |
| Недвижимость | ||||
| Плотность и фаза | 0,864 г / мл, жидкость | 0,88 г / мл, жидкость | 0,86 г / мл, жидкость | 0,86 г / мл, жидкость |
| Растворимость в воде | практически не растворим | |||
| Растворим в неполярных растворителях, таких как ароматические углеводороды | ||||
| Точка плавления | -47.4 ° С (-53,3 ° F, 226 К) | -25 ° С (-13 ° F, 248 К) | -48 ° С (-54,4 ° F, 225 К) | 13 ° С (55,4 ° F, 286 К) |
| Температура кипения | 138,5 ° С (281,3 ° F, 412 К) | 144 ° С (291,2 ° F, 417 К) | 139 ° С (282,2 ° F, 412 К) | 138 ° С (280,4 ° F, 411 К) |
| Вязкость | 0,812 сП при 20 ° C (68 ° F) | 0,62 сП при 20 ° C (68 ° F) | ,34 сП при 30 ° C (86 ° F) | |
| Опасности | ||||
| Паспорт безопасности | Ксилолы [1] | o -Ксилол [2] | м -Ксилол [3] | p -Xylene [4] |
| Классификация ЕС | Вредно ( Xn ) | |||
| NFPA 704 | 3 2 0 | |||
| Температура вспышки | 24 ° С (75 ° F) | 17 ° С (63 ° F) | 25 ° С (77 ° F) | 25 ° С (77 ° F) |
| R / S заявление | R10, R20 / 21, R38: S2, S25 | |||
| Номер RTECS | ZE2450000 | ZE2275000 | ZE2625000 | |
| Страница дополнительных данных | ||||
| Структура и свойства | n , ε r и т. Д. Д. | |||
| Термодинамические характеристики | Фазовое поведение Твердое, жидкое, газовое | |||
| Спектральные данные | УФ, ИК, ЯМР, МС | |||
| Родственные соединения | ||||
| Связанные ароматические углеводороды | толуол, мезитилен, бензол, этилбензол | |||
| Родственные соединения | ксиленолы — виды фенолов | |||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | ||||
Приложения
Ксилолы используются в качестве растворителей в полиграфической, резиновой и кожевенной промышленности. p -Ксилол используется в качестве сырья при производстве терефталевой кислоты, которая является мономером, используемым для производства полимеров. Ксилолы также используются в качестве чистящих средств для стали, кремниевых пластин и интегральных схем. Они содержатся в пестицидах, растворителях для красок, красках и лаках. Смесь ксилола может быть заменена толуолом для разбавления лаков, когда желательно более медленное высыхание. Ксилол может присутствовать в небольших количествах в авиационном топливе и бензине. В исследованиях на животных ксилол (или смесь ксилолов) часто наносят мазками на уши кроликов, чтобы облегчить кровоток и сбор крови, хотя впоследствии эту область необходимо промыть спиртом, чтобы предотвратить воспаление.
Ксилолы также используются в качестве чистящих средств для стали, кремниевых пластин и интегральных схем. Они содержатся в пестицидах, растворителях для красок, красках и лаках. Смесь ксилола может быть заменена толуолом для разбавления лаков, когда желательно более медленное высыхание. Ксилол может присутствовать в небольших количествах в авиационном топливе и бензине. В исследованиях на животных ксилол (или смесь ксилолов) часто наносят мазками на уши кроликов, чтобы облегчить кровоток и сбор крови, хотя впоследствии эту область необходимо промыть спиртом, чтобы предотвратить воспаление.
Воздействие на здоровье
Ксилол поражает мозг. Высокие уровни в результате воздействия в течение коротких периодов (14 дней или меньше) или длительных периодов (более одного года) могут вызвать головные боли, нарушение координации мышц, головокружение, спутанность сознания и изменения чувства равновесия. Воздействие на людей высоких уровней ксилола в течение коротких периодов времени также может вызвать раздражение кожи, глаз, носа и горла; затрудненное дыхание; проблемы с легкими; замедленное время реакции; проблемы с памятью; дискомфорт в желудке; и, возможно, изменения в печени и почках. Это может вызвать потерю сознания и даже смерть на очень высоком уровне.
Это может вызвать потерю сознания и даже смерть на очень высоком уровне.
Исследования на нерожденных животных показывают, что высокие концентрации ксилола могут вызвать увеличение числа смертей и задержку роста и развития. Во многих случаях эти же концентрации также причиняют вред матерям. Пока неизвестно, вредит ли ксилол будущему плоду, если мать подвергается воздействию низких уровней ксилола во время беременности.
Помимо профессионального воздействия, основным путем контакта с людьми является загрязнение почвы из-за протекающих подземных резервуаров для хранения нефтепродуктов.Люди, контактирующие с почвой или грунтовыми водами, могут пострадать. Использование загрязненных грунтовых вод в качестве источника воды может привести к неблагоприятным последствиям для здоровья.
Другой распространенной формой воздействия ксилола на человека является использование определенных типов ручек, письменных и рисовальных инструментов и принадлежностей для рисования.
См.
 Также
ТакжеБанкноты
Список литературы
- Макмерри, Джон. 2004. Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс / Коул. ISBN 0534420052
- Моррисон, Роберт Т., и Роберт Н. Бойд. 1992. Органическая химия . 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-643669-2
- Solomons, T.W. Грэхем и Крейг Б. Фрайл. 2004. Органическая химия . 8-е изд. Хобокен, Нью-Джерси: Джон Вили. ISBN 0471417998
Внешние ссылки
Все ссылки получены 11 октября 2020 г.
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа.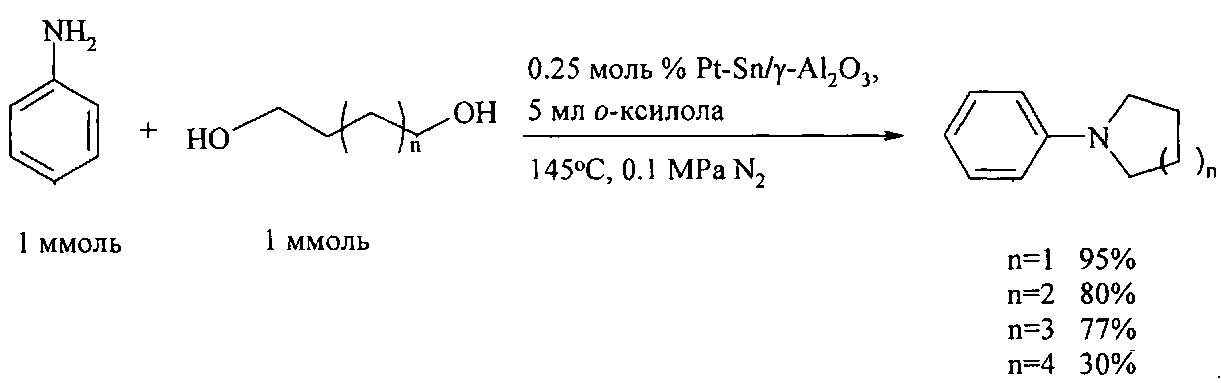 Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Что такое ксилол?
Ксилол технически не один, а три изомера диметилбензола, и может относиться к любой комбинации из трех. Изомеры ксилола — это бесцветные и легковоспламеняющиеся жидкости, которые используются во многих промышленных областях. Эти изомеры имеют одинаковую химическую формулу, и хотя все они также имеют центральное бензольное кольцо с двумя метильными группами, присоединенными в качестве заместителей, их химическая структура на самом деле немного отличается.
В чем содержится ксилол? Ксилол относится либо к одному из изомеров диметилбензола, либо к смеси изомерных соединений. Он естественным образом содержится в сырой нефти в небольшом количестве, около 0,5–1%, в зависимости от источника сырой нефти. В очень небольших количествах он также содержится в бензине и авиационном топливе.
Он естественным образом содержится в сырой нефти в небольшом количестве, около 0,5–1%, в зависимости от источника сырой нефти. В очень небольших количествах он также содержится в бензине и авиационном топливе.
В промышленных масштабах ксилол можно получить в процессе каталитического риформинга, а также путем карбонизации угля во время производства коксового топлива. С другой стороны, промышленное производство ксилолов осуществляется путем добавления метильных групп к толуолу и бензолу. Ксилолы лабораторного качества, используемые в коммерческих целях, содержат 40-65% м-ксилола и до 20% каждого о-ксилола, п-ксилола и этилбензола.
Каковы свойства ксилола?В зависимости от типа изомера и смеси изомеров физические и химические свойства ксилола различаются. Например, его температура плавления может составлять от -47,87 ° C для м-ксилола до 13,26 ° C для п-ксилола. Вот некоторые основные свойства различных изомеров:
1,2-диметилбензол (о-ксилол)
- Плотность и фаза: 0,88 г / мл, жидкость
- Точка кипения: 144 ° C
- Вязкость: 0.
 812 сП при 20 ° C
812 сП при 20 ° C - Температура вспышки: 17 ° C
1,3-Диметилбензол (м-ксилол)
- Плотность и фаза: 0,86 г / мл, жидкость
- Точка кипения: 139 ° C
- Вязкость: 0,62 сП при 20 ° C
- Температура вспышки: 25 ° C
1, 4-диметилбензол (п-ксилол )
- Плотность и фаза: 0,86 г / мл, жидкость
- Точка кипения: 138 ° C
- Вязкость: 0,34 сП при 30 ° C
- Температура вспышки: 25 ° C
Все эти изомеры полярны, что делает их практически не растворим в воде.Они также легко воспламеняются, потому что имеют относительно низкую температуру воспламенения. Точка воспламенения любой летучей жидкости — это минимально возможная температура, при которой ее пар может воспламениться от источника воспламенения, например от пламени свечи.
Какова химическая формула ксилола? Химическая формула ксилола (CH 3 ) 2 C 6 H 4 , и она одинакова для всех трех изомеров. Каждая молекула изомера имеет бензольное кольцо и две присоединенные к нему метильные группы.Основное различие между различными химическими структурами заключается в расположении метильных групп, как показано на диаграмме ниже:
Каждая молекула изомера имеет бензольное кольцо и две присоединенные к нему метильные группы.Основное различие между различными химическими структурами заключается в расположении метильных групп, как показано на диаграмме ниже:
Обозначения орто- (о-), мета- (м-) и пара- (р-) для ксилола описывают расположение двух метильных групп, то есть к каким атомам углерода бензольного кольца они присоединены.
Каковы применения ксилола?От использования в качестве прекурсоров при производстве пластиков из полиэтилентерефталата (ПЭТ) до лабораторных растворителей для удаления синтетических иммерсионных масел с объективов микроскопов, ксилолы находят широкий спектр промышленных и коммерческих применений:
- Полимерные предшественники
Пластиковые бутылки обычно изготавливают из экструдированного или формованного полиэтилентерефталата (ПЭТ).Пластичные полимеры и полиэфирные ткани получают из мономеров терефталевой кислоты и диметилтерефталата. Изомер 1,4-диметилбензол, также известный как п-ксилол, необходим для производства этих мономеров, поскольку он используется в качестве предшественника при производстве полимеров. Фактически, примерно 98% всего производимого п-ксилола используется таким образом.
Изомер 1,4-диметилбензол, также известный как п-ксилол, необходим для производства этих мономеров, поскольку он используется в качестве предшественника при производстве полимеров. Фактически, примерно 98% всего производимого п-ксилола используется таким образом.
Около половины всех производимых ксилолов используется в промышленном производстве пластмасс и полимерных тканей. Например, 1,2-диметилбензол, а.к.а. о-Ксилол используется в качестве предшественника фталевого ангидрида, который является еще одним важным химическим веществом, используемым в крупномасштабном производстве пластмасс, поскольку он снижает вязкость и увеличивает гибкость полимеров.
- Коммерческий растворитель
Ксилолы также используются в качестве растворителей и наиболее эффективны в этом применении, когда изомеры смешиваются вместе. При использовании в качестве растворителя в смесь также добавляют небольшое количество этилбензола.Этот вид растворителя бесцветен, легко воспламеняется и имеет сладкий запах.
Растворитель ксилола используется в различных отраслях промышленности, таких как полиграфия, производство резины и обработка кожи. Таким образом, он является важным компонентом чернил, резины и различных клеев. В качестве неполярной смеси растворитель ксилол также отлично растворяет неполярные вещества, такие как краски и лаки. Вот почему его часто используют в качестве разбавителя. Если вам нужно медленно сохнуть краске, можно даже использовать растворитель ксилол вместо толуола.Это делает его очень полезным при консервации и реставрации произведений искусства, когда он используется для проверки растворимости красок, используемых на произведениях искусства.
- Чистящее средство
Ксилол используется в качестве чистящего средства в различных областях, от стоматологии и электроники до нефтяной промышленности. Он очень полезен в качестве чистящего средства для стали и электронных компонентов, таких как интегральные схемы и кремниевые пластины, поскольку не повреждает поверхность, на которой используется. Ксилол также находит применение в стоматологии, где он используется для растворения гуттаперчи, материала для лечения корневых каналов.
Между тем в нефтяной промышленности ксилол используется в качестве компонента парафиновых растворителей для труб, забитых парафиновым воском. Его эффективность в растворении серы также делает его полезным ингредиентом в косметических продуктах для удаления излишков ушной серы или серы.
Ксилол вызывает коррозию?Хотя ксилолы являются эффективными растворителями с отличной растворяющей способностью, на самом деле они не вызывают коррозии. Коррозия — это химическая реакция, которая вызывает разрушение или образование новых соединений в результате окислительных процессов.Коррозионные вещества вызывают коррозию или окисление других веществ, включая металлы и органические соединения или биологические ткани.
Коррозионные вещества могут быть элементом, например кислородом в O 3 (то есть в форме озона), или соединениями, особенно кислотами, основаниями и ионными растворами. Хотя ксилолы могут растворять неполярные органические соединения, они обычно не вступают в химические реакции с другими веществами в нормальных условиях. Следовательно, ксилолы не считаются коррозионными.С другой стороны, они могут быть преобразованы в кислоты, такие как монокарбоновые кислоты (толуиловые кислоты) и дикарбоновые кислоты (фталевые кислоты) при окислении, которые являются едкими веществами.
Однако то, что он не вызывает коррозии, не означает, что ксилол неопасен. Как и другие углеводороды, ксилолы токсичны и опасны для здоровья. Если вы вдыхаете его пары в небольших количествах, вы можете почувствовать головокружение, тошноту, сонливость и головную боль. Если вы подверглись воздействию большого количества паров, серьезные симптомы включают сонливость, нарушение координации движений мышц, нерегулярное сердцебиение и потерю сознания.Если не будет оказана медицинская помощь, воздействие паров ксилола может быть даже смертельным.
Хотя ксилол не вызывает коррозии, он может быть опасен при проглатывании, вдыхании или контакте с кожей. Он также легко воспламеняется.Кроме того, жидкий ксилол может вызывать болезненное жжение на коже и повреждать глаза при контакте. Пары также вызывают легкое раздражение слизистых оболочек, глаз, легких и кожи. Не обнаружено никаких доказательств того, что ксилолы являются канцерогенными, несмотря на присутствие бензольной группы.Поэтому, хотя по определению это не вызывает коррозии, всегда соблюдайте меры предосторожности при обращении с ксилолом.
Структура, свойства, применение и побочные эффекты
C₈H₁₀
Ксилол — это ароматический углеводород, который широко используется в промышленности и медицинской технике в качестве растворителя. Это бесцветная и сладко пахнущая жидкость или газ, который естественным образом встречается в нефти, угле и древесной смоле и назван так, поскольку содержится в неочищенном древесном спирте. Он имеет химическую формулу C₆H₄ (CH₃) ₂ и называется диметилбензолом, поскольку он содержит шестиуглеродное кольцо, к которому присоединены две метильные группы.Он существует в трех различных изомерных формах, называемых орто-, мета- и пара-ксилолом. Ксилол является важным нефтехимическим продуктом, который производится в процессе каталитического риформинга и карбонизации угля при производстве коксового топлива. Он также встречается в сырой нефти в концентрациях от 0,5 до 1%, в зависимости от источника. Небольшие количества C₈H₁₀ также содержатся в бензине и авиационном топливе. В этой статье мы узнаем о том, что такое ксилол, о химической структуре ксилола, формуле ксилола, получении ксилола, свойствах ксилола и многом другом.
Что такое ксилол?
Ксилол — это органическое химическое соединение, которое также называют диметилбензолом или ксилолом. Это один из трех изомеров диметилбензола. Он состоит из центрального бензольного кольца, к которому присоединены две метильные группы в качестве заместителей. В 1850 году ксилол впервые выделил французский химик Огюст Каор. Ксилол представляет собой бесцветную, прозрачную и легковоспламеняющуюся жидкость, которую получают в результате каталитического риформинга, а также карбонизации угля.Он также встречается естественным образом в сырой нефти, бензине и авиационном топливе. Смесь ксилола немного жирная и имеет сладкий запах, который обычно встречается в качестве растворителя.
Ксилол, имеющийся в продаже, представляет собой бесцветную, легковоспламеняющуюся и невязкую токсичную жидкость. Не растворяется в воде, однако смешивается с некоторыми органическими жидкостями. На промышленном уровне ксилолы синтезируются путем метилирования толуола и бензола. Полученный ксилол состоит из 40-65% м-ксилола и примерно 20% о-ксилола, 20% п-ксилола и 20% этилбензола.
Структура ксилола
Давайте теперь посмотрим на молекулярную структуру ксилола.
[Изображение будет загружено в ближайшее время]
Ксилол существует в трех различных изомерных формах. Эти изомеры можно различить по обозначениям орто- (о-), мета- (м-) и пара- (р-), которые указывают, к каким атомам углерода (бензольного кольца) присоединены две метильные группы. Подсчитывая атомы углерода вокруг кольца, начиная с одного из атомов углерода кольца, связанных с метильной группой, и считая в сторону второй метильной группы, о-изомер имеет название IUPAC 1,2-диметилбензол, м-изомер равен 1. , 3-диметилбензол и п-изомер представляет собой 1,4-диметилбензол.Из трех изомеров п-изомер является наиболее востребованным в промышленности, поскольку он может быть окислен до терефталевой кислоты.
Давайте теперь посмотрим на физические свойства ксилола и химические свойства ксилола.
Свойства ксилола
Формула ксилола | C₆H₄ (CH₃) ₂ | |
Молекулярная масса ксилола | 106,16 г / моль | 9051 |
0.864 г / мл | ||
Температура кипения ксилола | 138,5 ° C | |
Температура плавления ксилола | −47,4 ° C |
Использование ксилола
Давайте сейчас посмотрите, для чего используется ксилол.
Ксилол используется в виде сырья при производстве волокон, пленок и красителей.
Используется в лабораториях для охлаждения реакционных сосудов.
Используется в виде клирингового агента.
Используется для разбавления густых лаков и красок.
Он использовался в качестве слезоточивого газа во время Первой мировой войны.
Побочные эффекты ксилола
Ксилол в большей степени влияет на мозг. Высокие уровни в результате воздействия в течение коротких периодов (14 дней или меньше) или длительных периодов (более одного года) могут вызвать головные боли, нарушение координации мышц, головокружение, спутанность сознания и нарушение чувства равновесия.Воздействие на людей высоких уровней ксилола в течение коротких периодов времени также может привести к раздражению кожи, глаз, носа и горла. Он также вызывает затрудненное дыхание, проблемы с легкими, замедленную реакцию, проблемы с памятью, дискомфорт в желудке и возможные изменения в печени и почек. Это также может вызвать потерю сознания и даже смерть на очень высоком уровне.
Исследования на нерожденных животных показывают, что более высокие концентрации ксилола могут вызвать увеличение числа смертей и задержку роста и развития.Во многих случаях эти же концентрации также приводят к ущербу для матери. Пока неизвестно, вредит ли ксилол будущему плоду, если мать подвергается воздействию низких уровней ксилола во время беременности.
Ксилол — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]
Обзор
Термин ксилолы относится к группе из 3 производных бензола, которая включает орто -, мета — и пара — изомеров диметилбензола.Изомеры o -, m — и p — определяют, к каким атомам углерода (основного бензольного кольца) присоединены две метильные группы. Подсчитывая атомы углерода от одного из углеродных атомов кольца, связанных с метильной группой, и считая в сторону углерода второго кольца, связанного с метильной группой, o — изомер имеет название IUPAC 1,2-диметилбензол. Изомер m — имеет название 1,3-диметилбензола по ИЮПАК. А p — изомер имеет название IUPAC 1,4-диметилбензол.
Это бесцветная жидкость со сладким запахом, очень легковоспламеняющаяся. Он естественным образом встречается в нефти и каменноугольной смоле и образуется во время лесных пожаров. Химические свойства немного отличаются от изомера к изомеру. Температура плавления составляет от -47,87 ° C (-54,17 ° F) ( м -ксилола) до 13,26 ° C (55,87 ° F) ( p -ксилола). Температура кипения каждого изомера составляет около 140 ° C (284 ° F). Плотность составляет около 0,87 кг / л (7,26 фунта / американский галлон или 8,72 фунта / имп галлон), и поэтому он менее плотен, чем вода.Ксилол в воздухе можно почувствовать при концентрации от 0,08 до 3,7 частей ксилола на миллион частей воздуха (ppm), а в воде можно почувствовать вкус от 0,53 до 1,8 частей на миллион.
Химическая промышленность производит ксилол из нефти. Это один из 30 крупнейших химических веществ, производимых в США по объему. Ксилол используется в качестве растворителя в полиграфической, резиновой и кожевенной промышленности. p -Ксилол используется в качестве сырья при производстве терефталевой кислоты, которая является мономером, используемым при производстве полимеров.Он также используется в качестве чистящего средства для стали и кремниевых пластин и стружки, пестицида [2], разбавителя для красок, а также в красках и лаках. Его можно заменить на толуол для разбавления лаков, если требуется более медленное высыхание. В небольших количествах он содержится в авиационном топливе и бензине. В исследованиях на животных его часто накладывают на уши кроликов, чтобы облегчить кровоток и сбор крови, хотя впоследствии эту область необходимо промыть спиртом, чтобы предотвратить воспаление.
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Ксилолы и его изомеры | ||||
|---|---|---|---|---|
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Общий | ||||
| Общее название | Ксилолы | o -Ксилол | м -Ксилол | p -ксилол |
| Систематическое название | Диметилбензолы | 1,2-диметилбензол | 1,3-диметилбензол | 1,4-диметилбензол |
| Другие названия | Ксилолы | o -Ксилол; Ортоксилол | m -Ксилол; Метаксилол | p -Ксилол; Параксилол |
| Химическая формула | C 8 H 10 | |||
| УЛЫБКИ | Cc1c (С) cccc1 | Cc1cc (С) CCC1 | Cc1ccc (С) CC1 | |
| Молярная масса | 106.16 г / моль | |||
| Внешний вид | прозрачная бесцветная жидкость | |||
| Номер CAS | [1330-20-7] | [95-47-6] | [108-38-3] | [106-42-3] |
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Характеристики | ||||
| Плотность и фаза | 0,864 г / мл, жидкость | 0,88 г / мл, жидкость | 0,86 г / мл, жидкость | 0,86 г / мл, жидкость |
| Растворимость в воде | практически не растворим | |||
| Растворим в неполярных растворителях, таких как ароматические углеводороды | ||||
| Точка плавления | -47.4 ° С (-53,3 ° F, 226 К) | -25 ° С (-13 ° F, 248 К) | -48 ° С (-54,4 ° F, 225 К) | 13 ° С (55,4 ° F, 286 К) |
| Температура кипения | 138,5 ° С (281,3 ° F, 412 К) | 144 ° С (291,2 ° F, 417 К) | 139 ° С (282,2 ° F, 412 К) | 138 ° С (280,4 ° F, 411 К) |
| Вязкость | 0,812 сП при 20 ° C (68 ° F) | 0,62 сП при 20 ° C (68 ° F) | ,34 сП при 30 ° C (86 ° F) | |
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Опасности | ||||
| Паспорт безопасности | Ксилолы | o -ксилол | м -Ксилол | p -Ксилол |
| Классификация ЕС | Вредно ( Xn ) | |||
| NFPA 704 | Шаблон: NFPA 704 | |||
| Температура вспышки | 24 ° С (75 ° F) | 17 ° С (63 ° F) | 25 ° С (77 ° F) | 25 ° С (77 ° F) |
| R / S заявление | Шаблон: R10, Шаблон: R20 / 21, Шаблон: R38: Шаблон: S2, Шаблон: S25 | |||
| Номер RTECS | ZE2450000 | ZE2275000 | ZE2625000 | |
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Страница дополнительных данных | ||||
| Структура и свойства | n , ε r и т. Д. | |||
| Термодинамические характеристики | Фазовое поведение Твердое, жидкое, газовое | |||
| Спектральные данные | УФ, ИК, ЯМР, МС | |||
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Родственные соединения | ||||
| Связанные ароматические углеводороды | толуол, мезитилен, бензол, этилбензол | |||
| Родственные соединения | ксиленолы — виды фенолов | |||
| Шаблон: заголовок Chembox align = «center» colspan = «5» | Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) Заявление об отказе от ответственности и ссылки в Infobox | ||||
Родственные соединения
Ксилолы являются исходным материалом для производства других химикатов.Например, хлорирование дает ксилилендихлоридов или 1,2-бис (хлорметил) бензол (опять же три возможных изомера). С помощью окислителей, таких как перманганат калия (KMnO 4 ), метильная группа может быть окислена до карбоновой кислоты. Окисляя обе метильные группы по направлению к кислоте, o -ксилол образует фталевую кислоту, тогда как p -ксилол образует терефталевую кислоту.
Воздействие на здоровье
Ксилол поражает мозг. Высокие уровни в результате воздействия в течение коротких периодов (14 дней или меньше) или длительных периодов (более 1 года) могут вызвать головные боли, нарушение координации мышц, головокружение, спутанность сознания и изменения чувства равновесия.Воздействие на людей высоких уровней ксилола в течение коротких периодов времени также может вызвать раздражение кожи, глаз, носа и горла; затрудненное дыхание; проблемы с легкими; замедленное время реакции; проблемы с памятью; дискомфорт в желудке; и, возможно, изменения в печени и почках. Это может вызвать потерю сознания и даже смерть в очень высоких дозах (см. Ингалянты).
Исследования на нерожденных животных показывают, что высокие концентрации ксилола могут вызвать увеличение числа смертей и задержку роста и развития.Во многих случаях эти же концентрации также причиняют вред матерям. Пока неизвестно, вредит ли ксилол будущему плоду, если мать подвергается воздействию низких уровней ксилола во время беременности.
Помимо профессионального воздействия, основным путем контакта с людьми является загрязнение почвы из-за протекающих подземных резервуаров для хранения нефтепродуктов. Люди, контактирующие с почвой или грунтовыми водами, могут пострадать. Использование загрязненных грунтовых вод в качестве источника воды может привести к неблагоприятным последствиям для здоровья.
Другой распространенной формой воздействия ксилола на человека является использование определенных типов ручек, инструментов для письма и рисования, бинго и принадлежностей для рисования.
См. Также
Внешние ссылки
cs: ксилен da: Ксилен de: Ксилол это: Ксилен lv: Ксилолс lt: Ксиленас nl: Xyleen нет: Ксилен fi: Ksyleeni sv: Ксилен
Шаблон: WikiDoc Sources
Шаблон: Jb1
Диэлектрик — Энциклопедия Нового Света
Различные типы конденсаторов. Каждый конденсатор включает пару проводящих пластин, разделенных диэлектриком.Диэлектрик , или электрический изолятор, представляет собой материал, обладающий высокой устойчивостью к прохождению электрического тока. Диэлектрические материалы могут быть твердыми, жидкостями или газами. К тому же вакуум — отличный диэлектрик.
Важным применением диэлектриков является разделение пластин конденсаторов. Способность конденсатора накапливать электрический заряд зависит от диэлектрика, разделяющего его пластины.
Пояснение
Когда диэлектрическая среда взаимодействует с приложенным электрическим полем, заряды перераспределяются внутри ее атомов или молекул.Это перераспределение изменяет форму приложенного электрического поля как внутри диэлектрической среды, так и в близлежащей области.
Когда два электрических заряда движутся через диэлектрическую среду, энергии и силы взаимодействия между ними уменьшаются. Когда электромагнитная волна проходит через диэлектрик, ее скорость уменьшается, а длина волны укорачивается.
Когда электрическое поле первоначально прикладывается к диэлектрической среде, течет ток. Полный ток , протекающий через реальный диэлектрик, состоит из двух частей: тока проводимости и тока смещения.В хороших диэлектриках ток проводимости будет крайне мал. Ток смещения можно рассматривать как упругую реакцию диэлектрического материала на любое изменение приложенного электрического поля. По мере увеличения величины электрического поля протекает ток смещения, и дополнительное смещение сохраняется как потенциальная энергия в диэлектрике. Когда электрическое поле уменьшается, диэлектрик высвобождает часть накопленной энергии в виде тока смещения. Электрическое смещение можно разделить на вклад вакуума и вклад диэлектрика:
- D знак равно ε0E + P = ε0E + ε0χE = ε0E (1 + χ), {\ displaystyle \ mathbf {D} = \ varepsilon _ {0} \ mathbf {E} + \ mathbf {P} = \ varepsilon _ { 0} \ mathbf {E} + \ varepsilon _ {0} \ chi \ mathbf {E} = \ varepsilon _ {0} \ mathbf {E} \ left (1+ \ chi \ right),}
, где P — поляризация среды, E — электрическое поле, D — плотность электрического потока (или смещение), а χ {\ displaystyle \ chi} — его электрическая восприимчивость.Отсюда следует, что относительная диэлектрическая проницаемость и восприимчивость диэлектрика связаны: εr = χ + 1 {\ displaystyle \ varepsilon _ {r} = \ chi +1}.
Диэлектрическая проницаемость
Диэлектрическая постоянная (или статическая диэлектрическая проницаемость) материала (при заданных условиях) является мерой степени, в которой материал концентрирует электростатические силовые линии. На практике она измеряется как «относительная диэлектрическая проницаемость», которая определяется как отношение количества электрической энергии, запасенной в изоляторе, когда на него накладывается статическое электрическое поле, по отношению к диэлектрической проницаемости вакуума (который имеет диэлектрическая проницаемость 1).
Относительная диэлектрическая проницаемость представлена как ε r (или иногда κ {\ displaystyle \ kappa}, K или Dk). Математически это определяется как:
- εr = εsε0 {\ displaystyle \ varepsilon _ {r} = {\ frac {\ varepsilon _ {s}} {\ varepsilon _ {0}}}}
, где ε s — статическая диэлектрическая проницаемость материала, а ε 0 — диэлектрическая проницаемость вакуума. Диэлектрическая проницаемость вакуума получается из уравнений Максвелла, связывая напряженность электрического поля E с плотностью электрического потока D .В вакууме (свободное пространство) диэлектрическая проницаемость ε составляет всего ε 0 , поэтому диэлектрическая проницаемость равна единице.
Разрешающая способность
Диэлектрическая проницаемость — это физическая величина, которая описывает, как электрическое поле влияет и на него влияет диэлектрическая среда, и определяется способностью материала поляризоваться в ответ на поле и, таким образом, уменьшать поле внутри материала. Таким образом, диэлектрическая проницаемость относится к способности материала передавать (или «разрешать») электрическое поле.
Это напрямую связано с электрической восприимчивостью. Например, в конденсаторе повышенная диэлектрическая проницаемость позволяет сохранять тот же заряд при меньшем электрическом поле (и, следовательно, меньшем напряжении), что приводит к увеличению емкости.
Диэлектрическая прочность
Термин диэлектрическая прочность может быть определен следующим образом:
- Для изоляционного материала диэлектрическая прочность — это максимальная напряженность электрического поля, которую материал может выдерживать без разрушения, то есть без нарушения своих изоляционных свойств.
- Для данной конфигурации диэлектрического материала и электродов электрическая прочность — это минимальное электрическое поле, вызывающее пробой.
Теоретическая диэлектрическая прочность материала является внутренним свойством объемного материала и зависит от конфигурации материала или электродов, к которым прикладывается поле. При пробое электрическое поле освобождает связанные электроны. Если приложенное электрическое поле достаточно велико, свободные электроны могут разогнаться до скоростей, которые могут высвободить дополнительные электроны во время столкновений с нейтральными атомами или молекулами в процессе, называемом лавинным пробоем.Пробой происходит довольно резко (обычно за наносекунды), что приводит к образованию токопроводящей дорожки и пробивному разряду через материал. В случае твердых материалов авария серьезно ухудшает или даже разрушает их изоляционные свойства.
Напряженность поля пробоя
Напряженность поля, при которой происходит пробой в данном случае, зависит от соответствующей геометрии диэлектрика (изолятора) и электродов, к которым прикладывается электрическое поле, а также от скорости увеличения, с которой прикладывается электрическое поле.Поскольку диэлектрические материалы обычно содержат мельчайшие дефекты, практическая диэлектрическая прочность будет составлять долю от собственной электрической прочности, наблюдаемой для идеального, бездефектного материала. Диэлектрические пленки имеют тенденцию демонстрировать большую диэлектрическую прочность, чем более толстые образцы из того же материала. Например, диэлектрическая прочность пленок диоксида кремния толщиной от нескольких сотен нм до нескольких микрон составляет приблизительно десять МВ / см. Многослойные тонкие диэлектрические пленки используются там, где требуется максимальная практическая диэлектрическая прочность, например, в высоковольтных конденсаторах и импульсных трансформаторах.
| Материал | Диэлектрическая прочность (МВ / м) |
|---|---|
| Воздух | 3 |
| кварцевый | 8 |
| титанат стронция | 8 |
| Неопреновый каучук | 12 |
| нейлон | 14 |
| Стекло Pyrex | 14 |
| Силиконовое масло | 15 |
| Бумага | 16 |
| бакелит | 24 |
| полистирол | 24 |
| тефлон | 60 |
Диэлектрики в конденсаторах с параллельными пластинами
Электроны в молекулах смещаются к положительно заряженной левой пластине.Затем молекулы создают левое электрическое поле, которое частично нейтрализует поле, созданное пластинами. (Воздушный зазор показан для наглядности; в реальном конденсаторе диэлектрик обычно находится в прямом контакте с пластинами.)Размещение диэлектрического материала между пластинами в конденсаторе с параллельными пластинами вызывает увеличение емкости пропорционально к , относительной диэлектрической проницаемости материала:
- C = kϵ0Ad {\ displaystyle C = {\ frac {k \ epsilon _ {0} A} {d}}}
- , где ϵ0 {\ displaystyle \ epsilon _ {0}} — диэлектрическая проницаемость свободного пространства, A, — площадь, покрываемая конденсаторами, а d — расстояние между пластинами.
Это происходит потому, что электрическое поле поляризует связанные заряды диэлектрика, создавая концентрации заряда на его поверхности, которые создают электрическое поле, противоположное (антипараллельное) полю конденсатора. Таким образом, данное количество заряда создает более слабое электрическое поле между пластинами, чем без диэлектрика, что снижает электрический потенциал. Рассматриваемый наоборот, этот аргумент означает, что в случае диэлектрика данный электрический потенциал заставляет конденсатор накапливать большую поляризацию заряда.
Приложения
Использование диэлектрика в конденсаторе дает несколько преимуществ. Самый простой из них заключается в том, что проводящие пластины можно размещать очень близко друг к другу без риска контакта. Кроме того, при воздействии очень сильного электрического поля любое вещество ионизируется и становится проводником. Диэлектрики более устойчивы к ионизации, чем сухой воздух, поэтому конденсатор, содержащий диэлектрик, может подвергаться более высокому рабочему напряжению. Слои диэлектрика обычно включают в производимые конденсаторы, чтобы обеспечить более высокую емкость в меньшем пространстве, чем конденсаторы, использующие только воздух или вакуум между их пластинами, и термин диэлектрик относится к этому применению, а также к изоляции, используемой в силовых и радиочастотных кабелях. .
Некоторые практические диэлектрики
Диэлектрические материалы могут быть твердыми, жидкими или газообразными. Кроме того, высокий вакуум также может быть полезным диэлектриком без потерь, даже если его относительная диэлектрическая проницаемость равна всего лишь единице.
Твердые диэлектрики, возможно, являются наиболее часто используемыми диэлектриками в электротехнике, а многие твердые тела являются очень хорошими изоляторами. Некоторые примеры включают фарфор, стекло и большинство пластмасс. Воздух, азот и гексафторид серы — три наиболее часто используемых газообразных диэлектрика.
- Промышленные покрытия, такие как парилен, создают диэлектрический барьер между подложкой и окружающей средой.
- Минеральное масло широко используется в электрических трансформаторах в качестве жидкого диэлектрика и для охлаждения. Диэлектрические жидкости с более высокими диэлектрическими постоянными, такие как касторовое масло для электротехнического качества, часто используются в высоковольтных конденсаторах, чтобы предотвратить коронный разряд и увеличить емкость.
- Поскольку диэлектрики сопротивляются потоку электричества, поверхность диэлектрика может сохранять скрученных лишних электрических зарядов.Это может произойти случайно при трении диэлектрика (трибоэлектрический эффект). Это может быть полезно, как в генераторе Ван де Граафа или электрофоре, или может быть потенциально разрушительным, как в случае электростатического разряда.
- Специально обработанные диэлектрики, называемые электретами, могут сохранять избыточный внутренний заряд или «замораживать» поляризацию. Электреты имеют полупостоянное внешнее электрическое поле и являются электростатическим эквивалентом магнитов. Электреты находят множество практических применений в быту и промышленности.
- Некоторые диэлектрики могут создавать разность потенциалов при воздействии механического напряжения или изменять физическую форму, если к материалу приложено внешнее напряжение. Это свойство называется пьезоэлектричеством. Пьезоэлектрические материалы — еще один класс очень полезных диэлектриков.
- Некоторые ионные кристаллы и полимерные диэлектрики обладают спонтанным дипольным моментом, который может быть изменен внешним приложенным электрическим полем. Такое поведение называется сегнетоэлектрическим эффектом.Эти материалы аналогичны поведению ферромагнитных материалов во внешнем магнитном поле. Сегнетоэлектрические материалы часто имеют очень высокую диэлектрическую проницаемость, что делает их весьма полезными для конденсаторов.
См. Также
Список литературы
- Boettcher, Карл Йохан Фридрих. 1980. Теория электрической поляризации: диэлектрическая поляризация . Elsevier Science. ISBN 0444415793
- Рамбл, Джон (ред.). 2017. CRC Справочник по химии и физике , 98-е изд.Бока-Ратон: CRC Press. ISBN 978-1498784542
- Фон Хиппель, Артур Р. 1994. Диэлектрики и волны . Печать по запросу Artech. ISBN 978-08038
Внешние ссылки
Все ссылки получены 8 мая 2018 г.
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 Лицензия (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Ксилол | Encyclopedia.com
Термин «ксилол» относится к любому из трех изомеров производных бензола , которые имеют одну и ту же химическую формулу, C 6 H 4 (CH 3 ) 2 , но различаются по своей молекулярной структура. Они используются в качестве растворителей, добавок для повышения октанового числа авиационного топлива , а также в качестве сырья при производстве волокон, пленок, красителей и других синтетических продуктов. Из-за их высокой летучести они классифицируются как ароматических углеводородов (летучие соединения, содержащие только атомов углерода и атомов водорода ).Фракции ксилола были впервые выделены из угля и смолы в середине девятнадцатого века в Германии. Каменноугольная смола — это густой жидкий продукт карбонизации или деструктивной перегонки угля, процесса, в котором уголь нагревается без воздуха до температуры выше 1600 ° F (862 ° C). Бензол и толуол , два ароматических углеводорода, подобные ксилолу, образуются в одном процессе. Каменноугольная смола оставалась источником ксилола до тех пор, пока промышленный спрос не превысил предложение. Позже были разработаны методы получения ксилола из нефтепереработки , и сегодня нефть является основным источником.
Три изомерных ксилола классифицируются по расположению метильных (CH 3 ) групп, замещающих атомы водорода в бензольном кольце. В каждом случае метильные группы заменяют два атома водорода, присоединенных к шестиуглеродному бензольному кольцу, но структура и химические свойства каждого изомера зависят от того, какие атомы водорода заменяются. Орто-ксилол (о-ксилол) имеет метильные группы на двух соседних атомах углерода в структуре бензольного кольца, тогда как в мета-ксилоле (м-ксилоле) метилсодержащие атомы углерода разделены водородсодержащим углеродом.В пара-ксилоле (п-ксилоле) два водородсодержащих углерода разделяют метилсодержащие атомы углерода, размещая метильные группы на противоположных концах молекулы. Орто-ксилол, наименее летучая из трех форм, служит сырьем для производства покрытий и пластиков . Пара-ксилол используется для производства полиэфиров. Мета-ксилол, менее полезный, чем другие формы, используется для изготовления покрытий, пластмасс и красителей. Промышленная смесь ксилола в виде бесцветной, легковоспламеняющейся, невязкой, токсичной жидкости используется в качестве растворителя для лаков и цементов каучук .Эмульгированный ксилол использовался как экономичный и эффективный способ борьбы с водными сорняками в ирригационных системах , но концентрации необходимо тщательно контролировать, чтобы не нанести вред растениям и рыбе, подвергающимся воздействию остатков.
Летучесть ксилола приводит к его легкому улету в атмосферу . Если не принять меры, его пары вскоре проникают в воздух лабораторий, где он используется. Хотя его растворимость в воде весьма ограничена, ксилол (наряду с бензолом и толуолом) классифицируется как один из основных компонентов «водорастворимой» фракции нефти.Широкое использование ксилола в производстве привело к значительным выбросам химического вещества в воздух и воду в окружающей среде . На токсичность ксилола в воде влияют солености , температура и наличие других токсичных материалов. Он влияет на проницаемость клеток и действует как нейротоксин для рыб и других животных. При высоких концентрациях ксилола рыбы демонстрируют ряд поведенческих изменений, включая беспокойство (быстрое и беспорядочное плавание), потерю равновесия, паралич и смерть.Хотя каждая из трех форм ксилола может быть детоксифицирована микроорганизмами , пара-ксилол труднее детоксифицировать и, следовательно, представляет собой более постоянную угрозу.
[ Дуглас К. Пратт ]
РЕСУРСЫ
КНИГИ
Buikema, L., and A.C. Hendricks. Бензол, ксилол и толуол в водных системах: обзор . Вашингтон, округ Колумбия: Американский институт нефти, 1980.
Хэнкок, Э. Г., изд. Толуол, ксилолы и их промышленные производные .Амстердам; Нью-Йорк: Elsevier, 1982.
Parmeggiani, L., ed. Энциклопедия по охране труда . 3-е изд. Женева: Международное бюро труда, 1983.
Walsh, D. F., ed. Остатки эмульгированного ксилола в борьбе с водными сорняками и их влияние на радужную форель, Salmo gairdneri . Денвер, Колорадо: Министерство внутренних дел США [Бюро мелиорации, Инженерный и исследовательский центр, Отдел общих исследований, Отделение прикладных наук], 1977 г.
Environmental Encyclopedia Pratt, Douglas C.
Использование ксилола | Sciencing
Обновлено 29 ноября 2018 г. Ксилол и его соединения используются во многих отраслях промышленности, в медицине, в стоматологии и даже могут быть найдены в бытовых товарах. Люди должны проявлять осторожность с ксилолом из-за его риска вдыхания и раздражения.
TL; DR (слишком долго; не читал)
Ксилол — это летучий органический углеводород, используемый во многих отраслях промышленности, включая медицину, стоматологию и производство пластмасс.Ксилол используется в качестве растворителя, очищающего агента, смазки, предшественника полиэфира и многого другого.
Что такое ксилол?
Ксилол — бесцветная жидкость и пар. Ксилол не растворяется в воде и при смешивании будет плавать поверх более плотной воды. Легковоспламеняется при комнатной температуре. Он был назван в честь ксилонга, греческого слова, обозначающего дерево, потому что он был найден в неочищенном древесном спирте. Химическая формула ксилола: C 8 H 10 или, более конкретно (C 6 H 4 ) (CH 3 ) 2 .Другими синонимами ксилола являются диметилбензол, метилтолуол, ксилол и смешанные ксилолы. Структура ксилола состоит из двух метильных групп, присоединенных к шестиуглеродному кольцу. Существует три основных изомера ксилола: орто-ксилол, мета-ксилол и параксилол. Четвертый изомер — этилбензол. Мета-ксилол является основным компонентом ксилола товарного сорта. Параксилол находит широкое применение в полимерной промышленности.
Ксилол тяжелее воздуха. Это летучая жидкость, выделяющая свой газ. Отвратительно сладкий запах ксилола служит предупреждением о его токсичности.Этот запах может быть обнаружен при концентрации в воздухе до одной части на миллион (PPM)! Ксилол может реагировать с сильными кислотами и окислителями.
Использование ксилола
Ксилол является одним из основных химических веществ, производимых в США, и его обычно получают из сырой нефти. Есть много применений ксилола, как в чистом виде, так и в виде соединений. Он широко используется в нескольких отраслях промышленности, а также в стоматологии и медицине.
В гистологии ксилол используется для обработки и окрашивания тканей.Затем эти ткани можно использовать в микроскопии. Это помогает специалистам-гистопатологам, которые смотрят на ткани, чтобы определить наличие заболевания. При обработке ткани ткань должна быть погружена в среду (например, парафин), чтобы поддерживать ее и позволять разрезать без повреждения ткани. Затем фиксированная ткань обезвоживается, удаляя воду из ткани путем увеличения количества спирта. Однако алкоголь не смешивается с парафином (смешиваемое вещество может хорошо смешиваться с другим веществом). Ксилол хорошо смешивается с парафином.Причина, по которой ксилол так хорошо подходит для обработки тканей, заключается в том, что он делает ткани прозрачными, так что парафин может полностью покрыть ткань. А при подготовке слайдов для микроскопии ксилол может удалить весь оставшийся воск со слайдов. В этом случае он используется как клиринговый агент. Это помогает с окрашиванием предметных стекол, так что особенности ткани легче рассмотреть под микроскопом. Несмотря на то, что для обработки тканей предлагаются альтернативы ксилолу, он по-прежнему считается лучшим химическим веществом для обработки и окрашивания тканей.
Одно из основных применений ксилола — это смазка, поэтому он используется в моторном масле или тормозной жидкости. Сильные растворяющие свойства ксилола используются в печати, обработке резины и кожи. Ксилол является компонентом смазочных материалов в моторном масле, красках и разбавителях красок, полиролях, восках, антифризах, герметиках, клеях и даже бензине и сигаретах. Ксилол используется в клее. Ксилол также используется в качестве очистителя.
Ксилол также можно использовать в качестве добавок к пестицидам и дезинфицирующим средствам.
Обычное использование параксилола
Параксилол — один из трех изомеров ксилола. Это может быть получено путем кристаллизации и адсорбции. Использование параксилола включает исходное сырье для других веществ. Одно из основных применений параксилола — синтез полимеров. Это делает параксилол абсолютно необходимым для производства полиэтилентерефталата или ПЭТ. Параксилол используется для производства терефталевой кислоты или TPA; очищенная терефталевая кислота или PTA; и диметилтерефталат или ДМТ.Эти три химиката затем используются для производства ПЭТ. ПЭТ, в свою очередь, является основным ингредиентом различных пластиковых волокон и пленок. Он известен тем, что является основным компонентом пластиковых бутылок из-под газировки, бутылочек для моющих средств, бутылочек для различных бытовых чистящих средств и косметики. Используется в орографической пленке и рентгеновских снимках. Пищевая упаковка также может содержать ПЭТ, и она также служит компонентом полиэфирного волокна для таких вещей, как одежда и домашние ткани. Большим преимуществом ПЭТ является его универсальность, его относительная доступность, отсутствие растрескивания и его способность к переработке.
Поскольку одно из применений параксилола включает синтез ПТА, он также служит для получения других соединений, таких как циклогександиметанол, терефталоилхлорид и различных других полимеров. Постоянная универсальность параксилола обеспечивает его постоянный спрос.
Использование п-ксилол-2-сульфоновой кислоты
П-ксилол-2-сульфоновая кислота, также называемая 2,5-диметилбензолсульфоновой кислотой, представляет собой соединение серы, содержащее ксилол. Он указан как сульфоновая кислота и считается биохимическим веществом.П-ксилол-2-сульфоновая кислота растворима в этаноле. Выпускается в виде белого кристаллического порошка. У п-ксилол-2-сульфоновой кислоты не так много широкого применения. Основное применение п-ксилол-2-сульфоновой кислоты — это реагент для определения уровня холестерина в сыворотке.
Риски воздействия ксилола
Хотя ксилол используется во многих отраслях промышленности, он сопряжен со своими рисками для тех, кто работает в тесном контакте с этим химическим соединением. Дети больше страдают от ксилола, чем взрослые, поэтому необходимо проявлять особую осторожность, чтобы не допустить их воздействия.
Основные риски воздействия ксилола включают эффекты от вдыхания или контакта с кожей или глазами. Ксилол не классифицируется как канцероген. Ксилол считается депрессантом центральной нервной системы, что означает, что он замедляет работу центральной нервной системы. Вдыхание ксилола может вызвать головокружение, тошноту, обморок, головную боль и даже рвоту. Ухудшение зрения и трудности также могут быть результатом воздействия ксилола. Другие сильные симптомы могут включать тремор, сердечную аритмию и отек легких.
Хотя неясно, как ксилол приводит к токсичности для организма, ученые полагают, что это может быть из-за высокой растворимости жира. Таким образом, он может растворяться в липидах мембран нейронов и в результате влиять на нейронные белки. Для определения метода токсичности необходимы дополнительные исследования.
Ксилол также представляет опасность для кожи и глаз и считается раздражителем кожи. Кожа быстро впитывает его. Поскольку ксилол очень эффективно удаляет жиры, любой контакт с кожей будет иметь такой же эффект.Это может привести к высыханию и растрескиванию кожи и дерматиту.
Попадание ксилола в глаза может привести к повреждению роговицы. При работе с ксилолом крайне важно надевать защитные очки. Следует очень серьезно отнестись к любому проглатыванию через рот, быстро получив медицинскую помощь.
Более длительное воздействие ксилола увеличивает риск. Даже его запах может повлиять на основные органы. Лучшие защитные меры, которые вы можете предпринять в отношении ксилола, — это работать в хорошо вентилируемой среде, например, в вытяжном шкафу, который быстро выпускает воздух за пределы помещения; респираторную маску по мере необходимости; и носить подходящие защитные очки, перчатки, защитную одежду и фартуки.Облученных людей следует удалить из зоны заражения и обратиться за медицинской помощью. Поскольку ксилол тяжелее воздуха, он может скапливаться в карманах у земли.

 812 сП при 20 ° C
812 сП при 20 ° C