Химическое соединение — это… Что такое Химическое соединение?
Стереоскопическое изображение химического соединенияХими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами.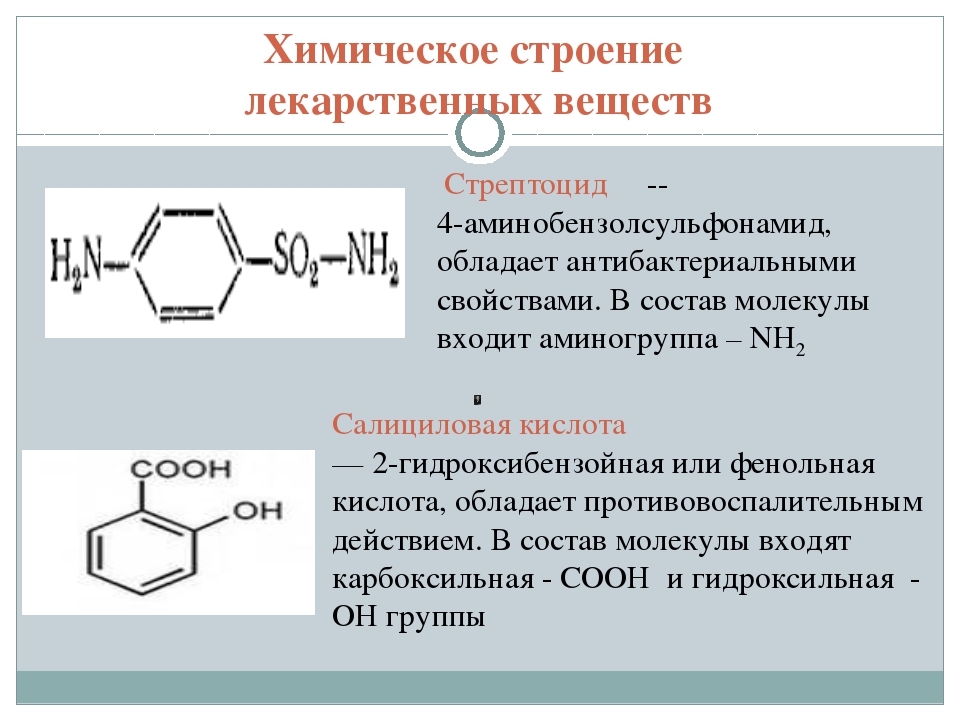
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].
Качественный и количественный состав
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.

Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов. Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900 , Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
- ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale».
 Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202. - ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
Химическое соединение — это… Что такое Химическое соединение?
Стереоскопическое изображение химического соединенияХими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат). [1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году [2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[3][4][5]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].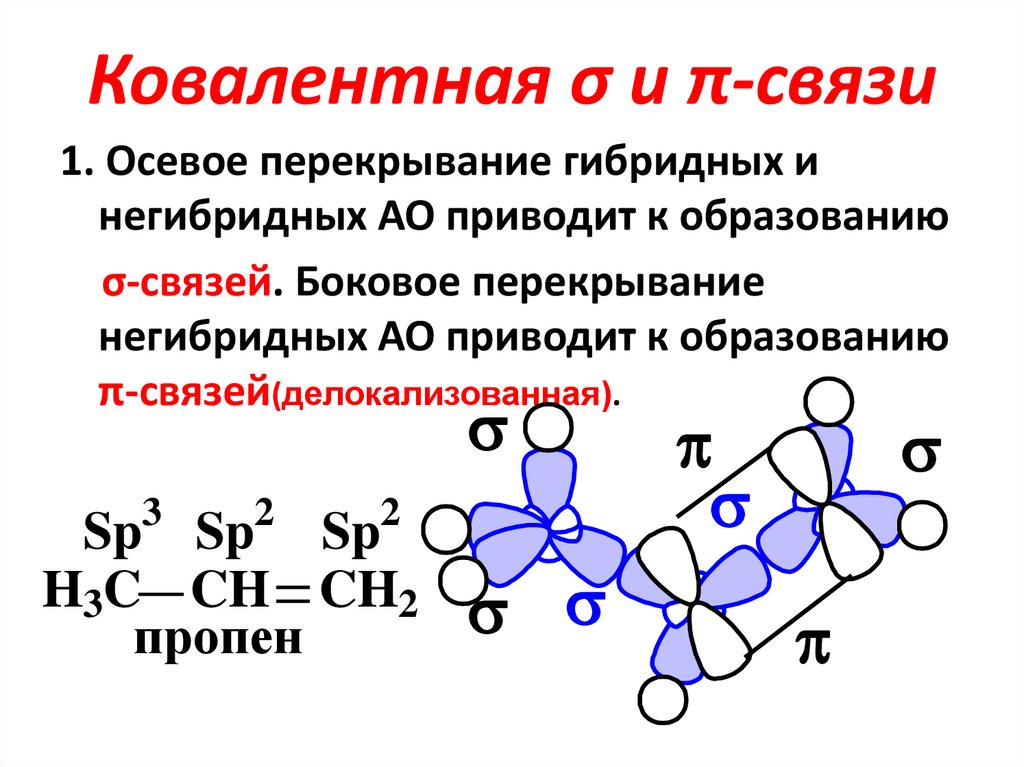
Качественный и количественный состав
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.
Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem.
 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012. - ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale». Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
- ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
Химическое соединение — это.
 .. Что такое Химическое соединение? Стереоскопическое изображение химического соединения
.. Что такое Химическое соединение? Стереоскопическое изображение химического соединенияХими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[3][4][5]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].
Качественный и количественный состав
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.
Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов.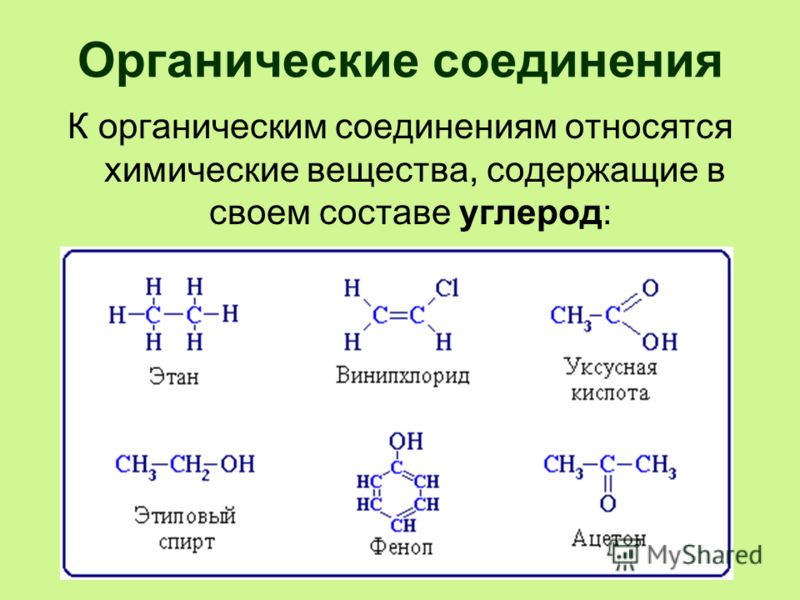 Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem.
 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012. - ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale». Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
- ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
Химическое соединение — это.
 .. Что такое Химическое соединение? Стереоскопическое изображение химического соединения
.. Что такое Химическое соединение? Стереоскопическое изображение химического соединенияХими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[3][4][5]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].
Качественный и количественный состав
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.
Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов. Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem.
 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012. - ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale». Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
- ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
Опасные и легковоспламеняющиеся вещества » Предметы запрещенные для пересылки » Посылка » Бизнес » Omniva
Взрывоопасные и взрывчатые вещества
Определение:
Любые химические соединения, смеси или средства, которые могут вызвать взрыв или использование которых сопровождается риском моментального разогревания и выделения газа. Все взрывчатые вещества запрещены.
Все взрывчатые вещества запрещены.
Пример:
нитроглицерин, пистоны, ракеты для салюта, зажигательные смеси, взрывчатка, осветительные ракеты, амуниция и т.д.Газы (сжатые, сжиженные или растворенные под давлением)
Определение:
Стабильные газы, которые не сжижаются под воздействием температуры окружающей среды, растворенные в растворителе под давлением. Запрещены:- сжатые и воспламеняющиеся газы: водород, этан, метан, пропан, бутан, зажигалки, газовые цилиндры для примусов, паяльные лампы и т.д.
- токсичные сжатые газы: хлор, фтор и др.
- невоспламеняющиеся сжатые газы: диоксид углерода, азот, неон, огнетушительные аппараты, в которых есть такие газы, и т.п.
- аэрозоли
ВОСПЛАМЕНЯЮЩИЕСЯ ЖИДКОСТИ
Определение:
Жидкости, смеси жидкостей или жидкости, в которых есть твердые частицы в виде раствора или суспензии, создающие горючие пары. Запрещены все жидкости, температура возгорания которых в закрытом сосуде ниже 55ºC.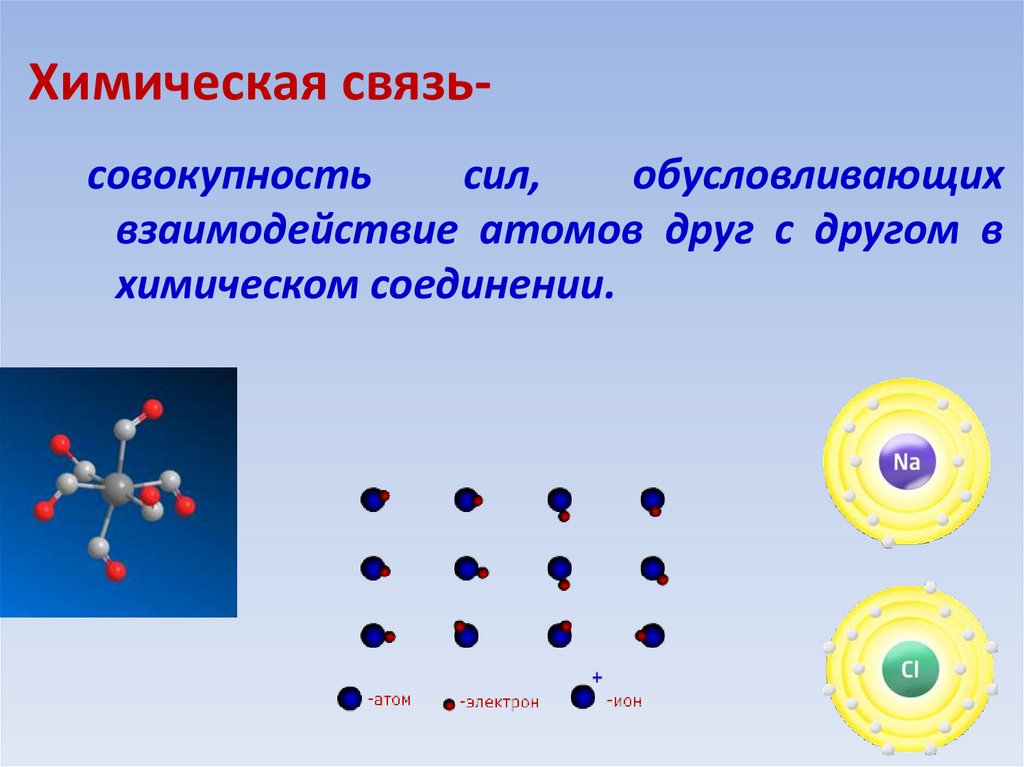
Пример:
ацетон, бензол, чистящие средства, бензин, горючее для зажигалок, растворители для красок и чистящие средства, керосин, растворители и т.п.ЛЕГКОВОСПЛАМЕНЯЮЩИЕСЯ ТВЕРДЫЕ ВЕЩЕСТВА
Определение:
Твердые материалы. причиной возгорания которых может быть трения, поглощения влаги, спонтанной химической реакции или тепло, удерживаемого в процессе обработки, или которые легко воспламеняется и горят.
Пример:
спички, карбид кальция, целлюлоза, вещества, содержащие нитрат, металлический магний, пленка на базе нитроцеллюлозы, фосфор, калий, натрий, гидрид натрия, порошок цинка, гидрид циркония и т.п.ОКСИДИРУЮЩИЕ ВЕЩЕСТВА И ОРГАНИЧЕСКИЕ ПЕРОКСИДЫ
Определение:
Эти вещества являются самовоспламеняемыми, хоть и не всегда, но они могут вызвать или способствовать воспламенению других веществ. Кроме этого, они могут взорваться, вызвать опасную реакцию, взаимодействовать с другими веществами и создавать угрозу для здоровья.
Пример:
броматы, хлораты, компоненты средств для ремонта изделий из стекловолокна, перхлораты, перманганаты, пероксиды и т.п.ТОКСИЧНЫЕ ВЕЩЕСТВА И ВЕЩЕСТВА, СПОСОБСТВУЮЩИЕ РАСПРОСТРАНЕНИЮ ИНФЕКЦИЙ, ДРУГИЕ МЕДИЦИНСКИЕ ВЕЩЕСТВА
Определение:
Вещества, которые после их заглатывания, вдыхания или соприкосновения с кожей могут вызвать смерть или повреждения. Вещества, содержащие микроорганизмы или их токсины, которые определенно или, возможно, могут способствовать распространению заболеваний.
Пример:
мышьяк, бериллий, цианид, фтор, водород, селенит, ртуть, ртутные соли, иприт, диоксид азота, патогенный материал, крысиный яд, сыворотка, вакцины и т.п.РАДИОАКТИВНЫЙ МАТЕРИАЛ
Определение:
Все материалы, специфическая активность которых выше 74 килобеккерелей на килограмм (0,002 микрокюри на грамм). Все радиоактивные материалы запрещены.
Пример:
распадающиеся вещества (уран 235 и т. п.), радиоактивные отходы, урановая руда или ториевая руда и т.п.
п.), радиоактивные отходы, урановая руда или ториевая руда и т.п.ЕДКИЕ ВЕЩЕСТВА
Определение:
Вещества, которые могут причинить серьезный вред, поскольку они оказывают химическое воздействие на живые ткани, товары или транспортное средство.
Пример:
хлорид алюминия, гидроксид натрия, едкая чистящая жидкость, средство для снятия/предотвращения ржавчины, едкое средство для снятия краски, электробатарейки, соляная кислота, азотная кислота, серная кислота и т.п.ДРУГИЕ ОПАСНЫЕ ВЕЩЕСТВА
Определение:
Вещества, создающие угрозу, которую невозможно классифицировать в соответствии с вышеуказанными категориями.
Пример:
асбест, сухой лед, магнетизированный материал с силой магнитного поля 0,159 А или выше на расстоянии 2,1 м от упаковки и т.п.Российские ученые нашли способ остановить развитие болезни Альцгеймера
https://ria.ru/20210719/urfu-1740609833.html
Российские ученые нашли способ остановить развитие болезни Альцгеймера
Российские ученые нашли способ остановить развитие болезни Альцгеймера — РИА Новости, 19. 07.2021
07.2021
Российские ученые нашли способ остановить развитие болезни Альцгеймера
Химические соединения, способные остановить дегенерацию нейронов при болезнях Альцгеймера, Паркинсона и других тяжелых патологиях головного мозга, синтезировали РИА Новости, 19.07.2021
2021-07-19T03:00
2021-07-19T03:00
2021-07-19T03:01
наука
екатеринбург
уральский федеральный университет
российская академия наук
навигатор абитуриента
университетская наука
россия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/07e5/07/09/1740611448_0:138:2650:1629_1920x0_80_0_0_83dd4b854b08bff867a69dc8db580b03.jpg
МОСКВА, 19 июл – РИА Новости. Химические соединения, способные остановить дегенерацию нейронов при болезнях Альцгеймера, Паркинсона и других тяжелых патологиях головного мозга, синтезировали ученые Уральского федерального университета имени первого Президента России Б. Н. Ельцина (УрФУ). Исследование опубликовано в журнале European Journal of Medicinal Chemistry.Болезни Альцгеймера и Паркинсона – заболевания головного мозга, при которых постепенная дегенерация нейронов приводит к утрате речи, памяти и мышления. Чаще всего ими страдают люди старше 65 лет. По данным ученых УрФУ, мировое число страдающих только от болезни Альцгеймера на 2010 год оценивалось в 35,6 млн человек, а к 2050 году прогнозируется рост до 115,4 млн.Эффективные препараты для профилактики и лечения недугов этого типа пока не созданы, отметили ученые. Существующие средства направлены лишь на подавление симптомов, но не могут остановить сам процесс нейродегенерации.Ученые УрФУ получили вещества, которые, по их словам, могут обеспечить прорыв в лечении нейродегенеративных патологий. Новые молекулы рядов индолил- и пирролилазинов активируют внутриклеточные механизмы борьбы с одной из главных причин «старческих» болезней мозга – избытком так называемых амилоидных структур, накапливающихся в мозге человека с возрастом.
Н. Ельцина (УрФУ). Исследование опубликовано в журнале European Journal of Medicinal Chemistry.Болезни Альцгеймера и Паркинсона – заболевания головного мозга, при которых постепенная дегенерация нейронов приводит к утрате речи, памяти и мышления. Чаще всего ими страдают люди старше 65 лет. По данным ученых УрФУ, мировое число страдающих только от болезни Альцгеймера на 2010 год оценивалось в 35,6 млн человек, а к 2050 году прогнозируется рост до 115,4 млн.Эффективные препараты для профилактики и лечения недугов этого типа пока не созданы, отметили ученые. Существующие средства направлены лишь на подавление симптомов, но не могут остановить сам процесс нейродегенерации.Ученые УрФУ получили вещества, которые, по их словам, могут обеспечить прорыв в лечении нейродегенеративных патологий. Новые молекулы рядов индолил- и пирролилазинов активируют внутриклеточные механизмы борьбы с одной из главных причин «старческих» болезней мозга – избытком так называемых амилоидных структур, накапливающихся в мозге человека с возрастом. «Наши соединения активируют синтез особых белков теплового шока и вызывают их накопление в клетке. Белки этого типа позволяют обезопасить нейрональную ткань от избытка токсичных амилоидов и защитить клетки от различных видов стресса, в том числе – протеотоксического стресса, характерного для нейродегенеративных заболеваний», – рассказала профессор кафедры органической и биомолекулярной химии УрФУ Ирина Утепова.Важные преимущества соединений из рядов индолил- и пирролилазинов – выгодная технология синтеза и низкая токсичность, отметили ученые.Полученные соединения были апробированы на клеточных моделях болезни Альцгеймера и вторичных повреждений после черепно-мозговых травм. В обоих случаях новые вещества продемонстрировали существенный терапевтический эффект, повышая выживаемость нейрональных клеток, сообщили авторы работы.Наиболее эффективное соединение было протестировано на живых тканях крыс с вторичными повреждениями после черепно-мозговых травм. По словам ученых, применение пирролилазина в реабилитационной терапии позволило животным избежать появления двигательных нарушений и дегенерации нейронов гиппокампа.
«Наши соединения активируют синтез особых белков теплового шока и вызывают их накопление в клетке. Белки этого типа позволяют обезопасить нейрональную ткань от избытка токсичных амилоидов и защитить клетки от различных видов стресса, в том числе – протеотоксического стресса, характерного для нейродегенеративных заболеваний», – рассказала профессор кафедры органической и биомолекулярной химии УрФУ Ирина Утепова.Важные преимущества соединений из рядов индолил- и пирролилазинов – выгодная технология синтеза и низкая токсичность, отметили ученые.Полученные соединения были апробированы на клеточных моделях болезни Альцгеймера и вторичных повреждений после черепно-мозговых травм. В обоих случаях новые вещества продемонстрировали существенный терапевтический эффект, повышая выживаемость нейрональных клеток, сообщили авторы работы.Наиболее эффективное соединение было протестировано на живых тканях крыс с вторичными повреждениями после черепно-мозговых травм. По словам ученых, применение пирролилазина в реабилитационной терапии позволило животным избежать появления двигательных нарушений и дегенерации нейронов гиппокампа. В исследовании приняли участие специалисты Института цитологии РАН и Института органического синтеза им. И.Я. Постовского Уральского отделения РАН. Научный коллектив продолжает исследования механизма действия новых соединений и ведет подготовку к их доклиническим испытаниям.
В исследовании приняли участие специалисты Института цитологии РАН и Института органического синтеза им. И.Я. Постовского Уральского отделения РАН. Научный коллектив продолжает исследования механизма действия новых соединений и ведет подготовку к их доклиническим испытаниям.
https://ria.ru/20200824/1576093964.html
https://ria.ru/20200226/1565208008.html
екатеринбург
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.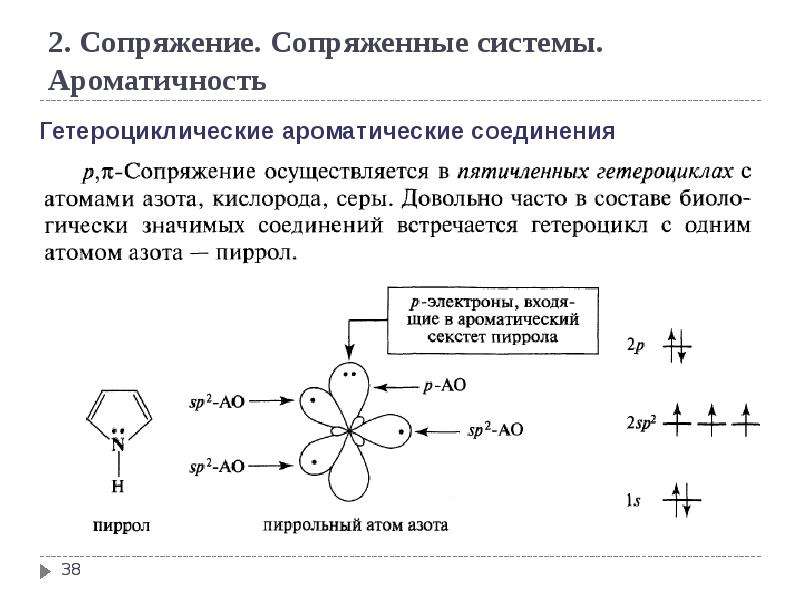 xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
екатеринбург, уральский федеральный университет, российская академия наук, навигатор абитуриента, университетская наука, россия
МОСКВА, 19 июл – РИА Новости. Химические соединения, способные остановить дегенерацию нейронов при болезнях Альцгеймера, Паркинсона и других тяжелых патологиях головного мозга, синтезировали ученые Уральского федерального университета имени первого Президента России Б. Н. Ельцина (УрФУ). Исследование опубликовано в журнале European Journal of Medicinal Chemistry.
Болезни Альцгеймера и Паркинсона – заболевания головного мозга, при которых постепенная дегенерация нейронов приводит к утрате речи, памяти и мышления. Чаще всего ими страдают люди старше 65 лет. По данным ученых УрФУ, мировое число страдающих только от болезни Альцгеймера на 2010 год оценивалось в 35,6 млн человек, а к 2050 году прогнозируется рост до 115,4 млн.
Эффективные препараты для профилактики и лечения недугов этого типа пока не созданы, отметили ученые. Существующие средства направлены лишь на подавление симптомов, но не могут остановить сам процесс нейродегенерации.
24 августа 2020, 03:00НаукаУченые предложили лечить болезнь Альцгеймера очисткой нейронов от мусораУченые УрФУ получили вещества, которые, по их словам, могут обеспечить прорыв в лечении нейродегенеративных патологий. Новые молекулы рядов индолил- и пирролилазинов активируют внутриклеточные механизмы борьбы с одной из главных причин «старческих» болезней мозга – избытком так называемых амилоидных структур, накапливающихся в мозге человека с возрастом.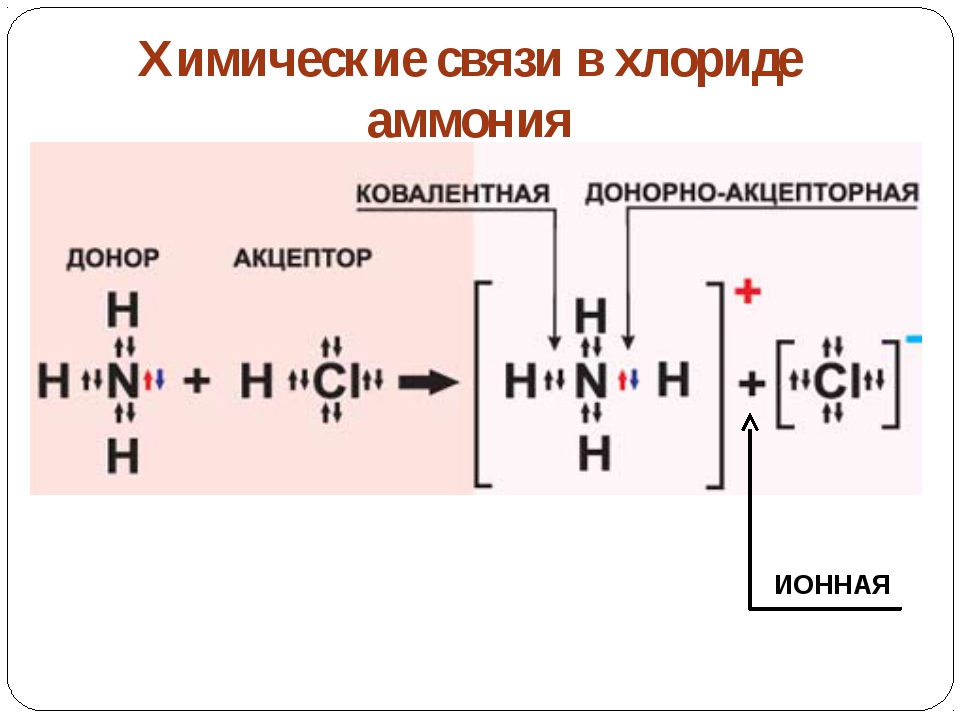
«Наши соединения активируют синтез особых белков теплового шока и вызывают их накопление в клетке. Белки этого типа позволяют обезопасить нейрональную ткань от избытка токсичных амилоидов и защитить клетки от различных видов стресса, в том числе – протеотоксического стресса, характерного для нейродегенеративных заболеваний», – рассказала профессор кафедры органической и биомолекулярной химии УрФУ Ирина Утепова.
Важные преимущества соединений из рядов индолил- и пирролилазинов – выгодная технология синтеза и низкая токсичность, отметили ученые.
© Фото : пресс-служба УрФУРабота в химической лаборатории
1 из 3
Работа в химической лаборатории
© Фото : пресс-служба УрФУРабота в химической лаборатории
2 из 3
Работа в химической лаборатории
© Фото : пресс-служба УрФУРабота в химической лаборатории
3 из 3
Работа в химической лаборатории
1 из 3
Работа в химической лаборатории
2 из 3
Работа в химической лаборатории
3 из 3
Работа в химической лаборатории
Полученные соединения были апробированы на клеточных моделях болезни Альцгеймера и вторичных повреждений после черепно-мозговых травм. В обоих случаях новые вещества продемонстрировали существенный терапевтический эффект, повышая выживаемость нейрональных клеток, сообщили авторы работы.
В обоих случаях новые вещества продемонстрировали существенный терапевтический эффект, повышая выживаемость нейрональных клеток, сообщили авторы работы.
Наиболее эффективное соединение было протестировано на живых тканях крыс с вторичными повреждениями после черепно-мозговых травм. По словам ученых, применение пирролилазина в реабилитационной терапии позволило животным избежать появления двигательных нарушений и дегенерации нейронов гиппокампа.
В исследовании приняли участие специалисты Института цитологии РАН и Института органического синтеза им. И.Я. Постовского Уральского отделения РАН. Научный коллектив продолжает исследования механизма действия новых соединений и ведет подготовку к их доклиническим испытаниям.
26 февраля 2020, 09:22НаукаУченые нашли регуляторы кровоснабжения, которые помогут при гипертонииОткрытое образование — Неорганическая химия: введение в химию элементов
Вы растеряны? Утонули в море фактического материала по химии элементов? Хотите уметь предсказывать их свойства? Понять, каких реакций от них можно ожидать? Тогда этот курс для Вас.
На основании периодического закона Д.И. Менделеева и современных представлениях о периодичности Вы научитесь: систематизировать материал; понимать сходство и отличие химических элементов в зависимости от их положения в Периодической системе; предсказывать химические свойства элементов и их соединений. Цель курса: привить обучающимся навыки анализа и предсказания свойств химических соединений с позиций Периодического закона Д.И. Менделеева.
Форма обучения заочная (дистанционная). Еженедельные занятия будут включать просмотр тематических видеолекций, изучение дополнительных материалов и выполнение тестовых заданий с автоматизированной проверкой результатов, тестирование по пройденному материалу. Для получения сертификата необходимо выполнить все задания, тесты и написать финальный экзамен.
Курс рассчитан на бакалавров 1 курса, успешно освоивших курс общей химии в рамках образовательной программы бакалавриата по направлению химия.
Занятие 1. Периодический закон. История открытия Периодического закона. Попытки систематизации элементов(Деберейнер, Ньюлендс, де Шанкуртуа, Мейер). Формулировка ПЗ Менделеева. Структура Периодической системы.Основные закономерности. Правило четности, диагональное сходство. Предсказание свойств, пустые ячейки. Сравнение экасилициума и германия. Признание ПЗ. Современные представления принципа периодичности. Связь ПЗ со строением атома, современная формулировка ПЗ. Формы Периодической Системы элементов – Менделеева, Сиборга, Бора. Плюсы и минусы. Развитие Периодического закона. Типические элементы, концепция кайносимметрии. Гипервалентные связи.
Занятие 2. Водород. Две элементарные частицы – протон и электрон. Самый распространенный элемент во Вселенной.Водород на Земле и в солнечной системе. Солнечный ветер. Уникальное электронное строение атома. Характеристики атома: потенциал ионизации, сродство к электрону. Изотопы водорода: протий, дейтерий, тритий. Ядерный синтез.Водородная бомба. Водород как простое вещество. Двухатомная молекула, ее характеристики: длина связи, энергия связи.Схема МО. Возможность существования h3+, h3-. Тяжелый водород (заметное отличие свойств, изотопный эффект). Орто и параводород. Получение молекулярного водорода. История открытия. Лабораторные способы. Примеси при получении водорода при реакции металлов с кислотами. Получение водорода в промышленности. Химические свойства молекулярного водорода. Водород как окислитель. Водород как восстановитель (экзотермичность, теплоноситель). Кинетическая инертность молекулярного водорода. Водород «в момент выделения». Опыт Марша. Бинарные соединения с водородом. От ионных к молекулярным гидридам. Схемы МО LiH и HF. Комплексные гидриды: катионные Nh5+, Ph5+, h4O+.Анионные: Bh5-, Alh5-, Al(Bh5)3. Кислотно-основные реакции бинарных водородных соединений. Неустойчивость гидридов в водных растворах. Конпропорционирование H+ + H- = h3.
Изотопы водорода: протий, дейтерий, тритий. Ядерный синтез.Водородная бомба. Водород как простое вещество. Двухатомная молекула, ее характеристики: длина связи, энергия связи.Схема МО. Возможность существования h3+, h3-. Тяжелый водород (заметное отличие свойств, изотопный эффект). Орто и параводород. Получение молекулярного водорода. История открытия. Лабораторные способы. Примеси при получении водорода при реакции металлов с кислотами. Получение водорода в промышленности. Химические свойства молекулярного водорода. Водород как окислитель. Водород как восстановитель (экзотермичность, теплоноситель). Кинетическая инертность молекулярного водорода. Водород «в момент выделения». Опыт Марша. Бинарные соединения с водородом. От ионных к молекулярным гидридам. Схемы МО LiH и HF. Комплексные гидриды: катионные Nh5+, Ph5+, h4O+.Анионные: Bh5-, Alh5-, Al(Bh5)3. Кислотно-основные реакции бинарных водородных соединений. Неустойчивость гидридов в водных растворах. Конпропорционирование H+ + H- = h3.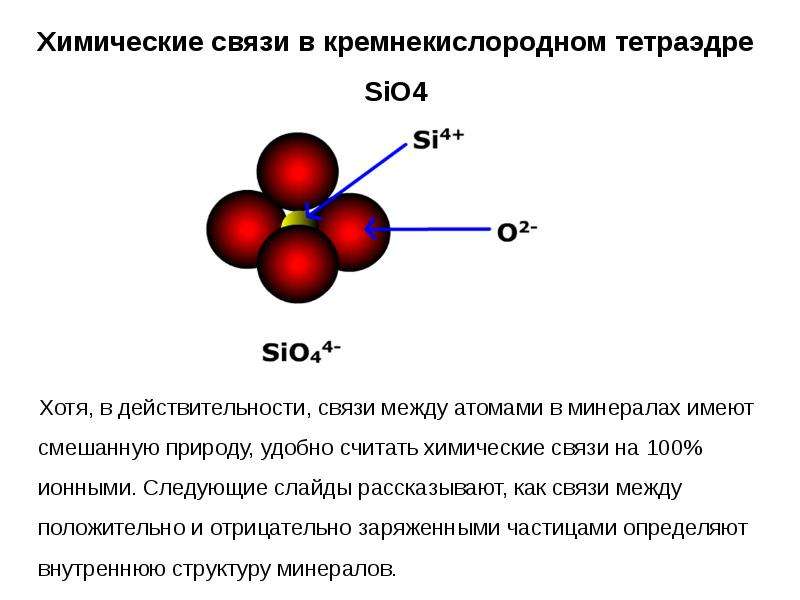 Водородные связи. Уникальность (размер) протона.Трехцентровое взаимодействие. Линейность фрагментов HF2-. Температуры кипения аммиака, HF, воды. Межмолекулярные водородные связи. Водородные связи в биологических системах: ДНК, РНК. Диводородные связи.Изоэлектронные этан и амминборан. Различие свойств (дегидрирование).
Водородные связи. Уникальность (размер) протона.Трехцентровое взаимодействие. Линейность фрагментов HF2-. Температуры кипения аммиака, HF, воды. Межмолекулярные водородные связи. Водородные связи в биологических системах: ДНК, РНК. Диводородные связи.Изоэлектронные этан и амминборан. Различие свойств (дегидрирование).
Занятие 3. Кислород. Кислород как простое вещество. История открытия, происхождение названия, содержание кислорода на Земле (аномально высокое содержание), физические свойства. Кислород как простое вещество. Электронное строение атома кислорода.Валентные возможности кислорода. Аллотропия кислорода. Озон. Строение молекулы, схема МО парамагнетизм. Кислород в биологических системах. Связывание молекулярного кислорода в комплексы. Опыты с жидким кислородом (горение сигареты, взрыв губки) и получение озона. Горение железа в кислороде и в озоне. Оксиды. Определение оксидов. Различные классификации оксидов. Оксиды как производные атома кислорода. Отсутствие кислорода в оксидах в степени окисления-1. Ионные оксиды. Местоположение в периодической системе. Особенности строения. Взаимодействие с водой.Молекулярные оксиды. Особенности строение и летучесть. Сложные оксиды. Соли кислородсодержащих кислот, как продукт взаимодействия двух оксидов. Промежуточные оксиды. ВТСП, магнитные свойства. Высокотемпературная керамика. Пероксиды. Устойчивость иона O22-. История открытия, общие свойства пероксидов. Пероксид водорода.Строение молекулы. Получение и свойства перекиси водорода. Пероксиды щелочных металлов как соли перекиси водорода.Пероксиды в органических соединениях. Необычные степени окисления кислорода. Ион кислорода O2- . Супероксиды,озониды. Соединения кислорода в положительных степенях окисления. Фториды кислорода. Ион О2+. Диоксигенил.
Ионные оксиды. Местоположение в периодической системе. Особенности строения. Взаимодействие с водой.Молекулярные оксиды. Особенности строение и летучесть. Сложные оксиды. Соли кислородсодержащих кислот, как продукт взаимодействия двух оксидов. Промежуточные оксиды. ВТСП, магнитные свойства. Высокотемпературная керамика. Пероксиды. Устойчивость иона O22-. История открытия, общие свойства пероксидов. Пероксид водорода.Строение молекулы. Получение и свойства перекиси водорода. Пероксиды щелочных металлов как соли перекиси водорода.Пероксиды в органических соединениях. Необычные степени окисления кислорода. Ион кислорода O2- . Супероксиды,озониды. Соединения кислорода в положительных степенях окисления. Фториды кислорода. Ион О2+. Диоксигенил.
Занятие 4. Вода. Строение молекулы воды. Электронное строение молекулы воды как фактор, определяющий тенденции к образованию водородных связей. Жидкая вода. Современные представления о структуре жидкой воды. Водные растворы.Образование растворов. Учение Д.И. Менделеева о растворах. Доказательства химической природы растворов. Гидратация.Гидратация одноатомных ионов и Периодический закон. Термохимия процессов гидратации и Периодический закон.Изменение растворимости солей в рамках групп Периодической системы. Взаимодействие воды с простыми и сложными(на примере оксидов) веществами. Взаимодействие воды с простыми веществами. Растворимость газообразных простых веществ в воде. Окислительно-восстановительное взаимодействие простых веществ с водой. Взаимодействие оксидов с водой. Влияние степени ионности оксида на продукты взаимодействия. Сила кислородсодержащих кислот. Правила Полинга. Изменение силы кислородсодержащих кислот по группе П.С. Изменение силы бескислородных кислот в группе П.С., его причины. Основания как продукт взаимодействия ионных оксидов с водой. Сила оснований и Периодический закон. Гидролиз – обменное взаимодействие веществ с водой. Гидратированные ионы как протолиты. Гидролиз как результат поляризации молекул воды в первой гидратной сфере: симбатность изменений ионизационных потенциалов, поляризующей способности и константы гидролиза в рамках групп П.
Учение Д.И. Менделеева о растворах. Доказательства химической природы растворов. Гидратация.Гидратация одноатомных ионов и Периодический закон. Термохимия процессов гидратации и Периодический закон.Изменение растворимости солей в рамках групп Периодической системы. Взаимодействие воды с простыми и сложными(на примере оксидов) веществами. Взаимодействие воды с простыми веществами. Растворимость газообразных простых веществ в воде. Окислительно-восстановительное взаимодействие простых веществ с водой. Взаимодействие оксидов с водой. Влияние степени ионности оксида на продукты взаимодействия. Сила кислородсодержащих кислот. Правила Полинга. Изменение силы кислородсодержащих кислот по группе П.С. Изменение силы бескислородных кислот в группе П.С., его причины. Основания как продукт взаимодействия ионных оксидов с водой. Сила оснований и Периодический закон. Гидролиз – обменное взаимодействие веществ с водой. Гидратированные ионы как протолиты. Гидролиз как результат поляризации молекул воды в первой гидратной сфере: симбатность изменений ионизационных потенциалов, поляризующей способности и константы гидролиза в рамках групп П. С. Гидролитическая полимеризация. Процессы оляции и оксоляции.Периодическая система форм гидроксокомплексов в растворе. Окислительно-восстановительные свойства воды. Вода как окислитель и как восстановитель. Общие правила запрета на существование окисленных (восстановленных) форм в водных растворах. Восстановительные потенциалы и Периодический закон. Вода как сырье для водородной энергетики.Актуальные проблемы: управление состоянием вещества в растворе как способ синтеза материалов с заданными свойствами.
С. Гидролитическая полимеризация. Процессы оляции и оксоляции.Периодическая система форм гидроксокомплексов в растворе. Окислительно-восстановительные свойства воды. Вода как окислитель и как восстановитель. Общие правила запрета на существование окисленных (восстановленных) форм в водных растворах. Восстановительные потенциалы и Периодический закон. Вода как сырье для водородной энергетики.Актуальные проблемы: управление состоянием вещества в растворе как способ синтеза материалов с заданными свойствами.
Занятие 5. s-элементы. Щелочные металлы. Общие свойства щелочных металлов. Нахождение в природе, основные соединения. Свойства атомов. Особенности изменения восстановительных потенциалов вниз по группе. Физические свойства. Взаимодействие натрия и калия с водой и кислородом. Щелочные металлы в отрицательных степенях окисления. Натриды и электриды. Элементы 2й группы. Общие свойства элементов 2й группы. Классификация элементов2й группы. Химия бериллия. Амфотерность соединений бериллия.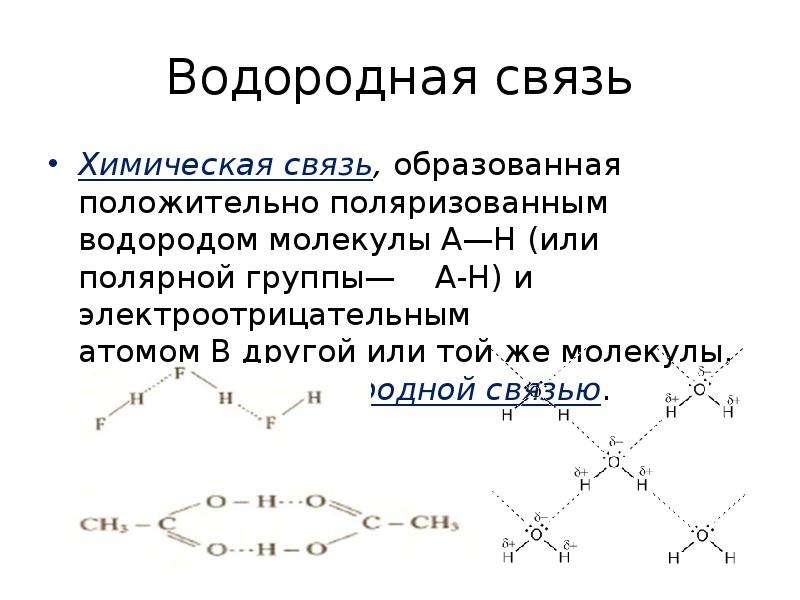 Комплексы бериллия. Взаимодействие магния и кальция с водой. Взаимодействие солей бериллия с кислотой и щелочью. Диагональное сходство. Причины возникновения.Особенности химии лития и магния. Литийорганические соединения. Реактивы Гриньяра. Роль натрия и калия, магния и кальция в биологических системах. Актуальные проблемы: Li-ионные аккумуляторы.
Комплексы бериллия. Взаимодействие магния и кальция с водой. Взаимодействие солей бериллия с кислотой и щелочью. Диагональное сходство. Причины возникновения.Особенности химии лития и магния. Литийорганические соединения. Реактивы Гриньяра. Роль натрия и калия, магния и кальция в биологических системах. Актуальные проблемы: Li-ионные аккумуляторы.
Занятие 6. 2p-элементы. Типические элементы у Д.И. Менделеева. Кайносимметрия 2р-элементов: в чем она проявляется: 1) 2р-орбитали 2) все элементы – неметаллы; 3) к.ч.≤4; 4) способность к образованию кратных связей; 5) специфика фтора и кислорода. Общая характеристика 2р-элементов. Способность к образованию σ и π-связей. Изменение размеров атомов,потенциалы ионизации, электронные конфигурации, сродство к электрону, ЭО. Нарастание неметаллических свойств при горизонтальном сопоставлении р-элементов. Образование σ и π-связей. Ранние и поздние элементы. Физические и химические свойства простых веществ. Тпл, кип. Агрегатное состояние Молекулы F2, N2 (схемы МО). Сопоставление химической активности поздних 2р-элеменnов. Ранние 2р-элементы: углерод, бор. Аллотропные модификации.Химические свойства. Водородные соединения 2р-элементов. Строение. Гибридизация. Изменение кислотно-основные свойств по периоду (от HF к Ch5). Особенности гидридов бора. Фториды бора и азота. Отношение к воде. CF4 — кинетическая инертность. Ионные и молекулярные фториды. Кислотно-основной характер. Фториды инертных газов. Электроноизбыточные связи. Оксиды 2р-элементов. Кратные связи в оксидах.Оксиды NO, СО, ВО в методе МО. Димеризация NO. Ион NO+.Оксид бора (BO)x, B2O3. CO2. NO2. Кислотно-основные свойства оксидов. Высшие кислородсодержащие кислоты h4BO3, h3CO3, HNO3, /HOF/. Особенности кислорода и фтора.Бориды, карбиды, нитриды. Состав. Свойства. Техническое использование.
Сопоставление химической активности поздних 2р-элеменnов. Ранние 2р-элементы: углерод, бор. Аллотропные модификации.Химические свойства. Водородные соединения 2р-элементов. Строение. Гибридизация. Изменение кислотно-основные свойств по периоду (от HF к Ch5). Особенности гидридов бора. Фториды бора и азота. Отношение к воде. CF4 — кинетическая инертность. Ионные и молекулярные фториды. Кислотно-основной характер. Фториды инертных газов. Электроноизбыточные связи. Оксиды 2р-элементов. Кратные связи в оксидах.Оксиды NO, СО, ВО в методе МО. Димеризация NO. Ион NO+.Оксид бора (BO)x, B2O3. CO2. NO2. Кислотно-основные свойства оксидов. Высшие кислородсодержащие кислоты h4BO3, h3CO3, HNO3, /HOF/. Особенности кислорода и фтора.Бориды, карбиды, нитриды. Состав. Свойства. Техническое использование.
Занятие 7. p-элементы. Общая характеристика р-элементов. Электронные конфигурации. Степени окисления. Правило четности и нечетности.Формы соединений. Увеличение к.ч. с появлением d-орбиталей. Возможности dπ- pπ перекрывания. Тенденции в изменении свойств простых веществ при движении вниз по группе. Характер изменения базовых характеристик (r, I, E,ЭО) по группе. Простые вещества. Физические и химические свойства. Тенденции в изменении свойств соединений при движении вниз по группе. Изменение устойчивости, кислотно-основных, окислительно-восстановительных свойств водородных соединений и их производных по группе. Кислородсодержащие гидратированные формы. Амфотерность.Кислоты поздних элементов. Состав, сила, окислительная способность. Соли. Вторичная периодичность. Электронное строение. Неустойчивость высших соединений брома, селена, мышьяка. Окислительные свойства соединений Tl(III), Pb(IV), Bi(V). Диагональное сходство. Кислород-хлор. Оксохлориды. Бор-кремний. Боросиликатные структуры. Стекла.Бериллий-алюминий. Амфотерность. Предсказание состава и свойствбинарных соединений. Например, Sn-Se, Pb-S, In-Br, S-F, S-Cl , Ge-O, Sn-O. Занятие 8. Введение в координационную химию. Теория Вернера, особенности строения координационных соединений.
Возможности dπ- pπ перекрывания. Тенденции в изменении свойств простых веществ при движении вниз по группе. Характер изменения базовых характеристик (r, I, E,ЭО) по группе. Простые вещества. Физические и химические свойства. Тенденции в изменении свойств соединений при движении вниз по группе. Изменение устойчивости, кислотно-основных, окислительно-восстановительных свойств водородных соединений и их производных по группе. Кислородсодержащие гидратированные формы. Амфотерность.Кислоты поздних элементов. Состав, сила, окислительная способность. Соли. Вторичная периодичность. Электронное строение. Неустойчивость высших соединений брома, селена, мышьяка. Окислительные свойства соединений Tl(III), Pb(IV), Bi(V). Диагональное сходство. Кислород-хлор. Оксохлориды. Бор-кремний. Боросиликатные структуры. Стекла.Бериллий-алюминий. Амфотерность. Предсказание состава и свойствбинарных соединений. Например, Sn-Se, Pb-S, In-Br, S-F, S-Cl , Ge-O, Sn-O. Занятие 8. Введение в координационную химию. Теория Вернера, особенности строения координационных соединений. Геометрия комплексов, примеры. Типы изомерии в координационной химии. Описание электронного строения координационных соединения. Теория кристаллического поля. Октаэдрическое и тетраэдическое расщепление орбиталей.Окраска и магнитные свойства комплексов. Высокоспиновые и низкоспиновые комплексы. Спектрохимический ряд.Эффект Яна-Теллера. Плоско-квадратные комплексы. Теория поля лигандов.
Геометрия комплексов, примеры. Типы изомерии в координационной химии. Описание электронного строения координационных соединения. Теория кристаллического поля. Октаэдрическое и тетраэдическое расщепление орбиталей.Окраска и магнитные свойства комплексов. Высокоспиновые и низкоспиновые комплексы. Спектрохимический ряд.Эффект Яна-Теллера. Плоско-квадратные комплексы. Теория поля лигандов.
Занятие 9. 3d-элементы. Свойства элементов и простых веществ. Легкие переходные элементы. Распространенность в природе. Основные минералы – сродство к кислороду и сродство к сере. Электронное строение атомов. Важнейшие характеристики элементов:ионизационный потенциал, сродство к электрону. 3d-элементы как кайносимметрики. Изменение плотности и температуры плавления простых веществ. Изменение высшей степени окисления в ряду легких переходных металлов и факторы, определяющие высшую степень окисления. Химические свойства простых веществ, закономерности их изменения в ряду 3d-элементов. Способы получения простых веществ, факторы, определяющие возможность их реализации. Соединения переменного состава. Причины их образования. Оксиды и гидроксосоединения. Формы оксо- и гидроксосоединений. Факторы, определяющие представительность плеяд этих соединений. Кислотно-основные свойства оксо-гидроксосоединений в ряду легких переходных элементов. Влияние положения элемента в П.С. и степени окисления металла на кислотно-основные свойства соединений. Окислительно-восстановительные свойства оксо-гидроксосоединений и их производных. Влияние среды. Ионы в водных растворах. Влияние степени окисления металла на форму существования ионов в водных растворах. Титанил- и ванадил-катионы. Гидролиз ионов железа. Галогениды 3d-металлов. Представительность плеяд галогенидов легких переходных металлов и факторы, ее определяющие. Влияние степени окисления металла на свойства галогенидов. Комплексы легких переходных металлов. Высокоспиновые и низкоспиновые октаэдрические комплексы, доминирование высокоспиновых.
Способы получения простых веществ, факторы, определяющие возможность их реализации. Соединения переменного состава. Причины их образования. Оксиды и гидроксосоединения. Формы оксо- и гидроксосоединений. Факторы, определяющие представительность плеяд этих соединений. Кислотно-основные свойства оксо-гидроксосоединений в ряду легких переходных элементов. Влияние положения элемента в П.С. и степени окисления металла на кислотно-основные свойства соединений. Окислительно-восстановительные свойства оксо-гидроксосоединений и их производных. Влияние среды. Ионы в водных растворах. Влияние степени окисления металла на форму существования ионов в водных растворах. Титанил- и ванадил-катионы. Гидролиз ионов железа. Галогениды 3d-металлов. Представительность плеяд галогенидов легких переходных металлов и факторы, ее определяющие. Влияние степени окисления металла на свойства галогенидов. Комплексы легких переходных металлов. Высокоспиновые и низкоспиновые октаэдрические комплексы, доминирование высокоспиновых.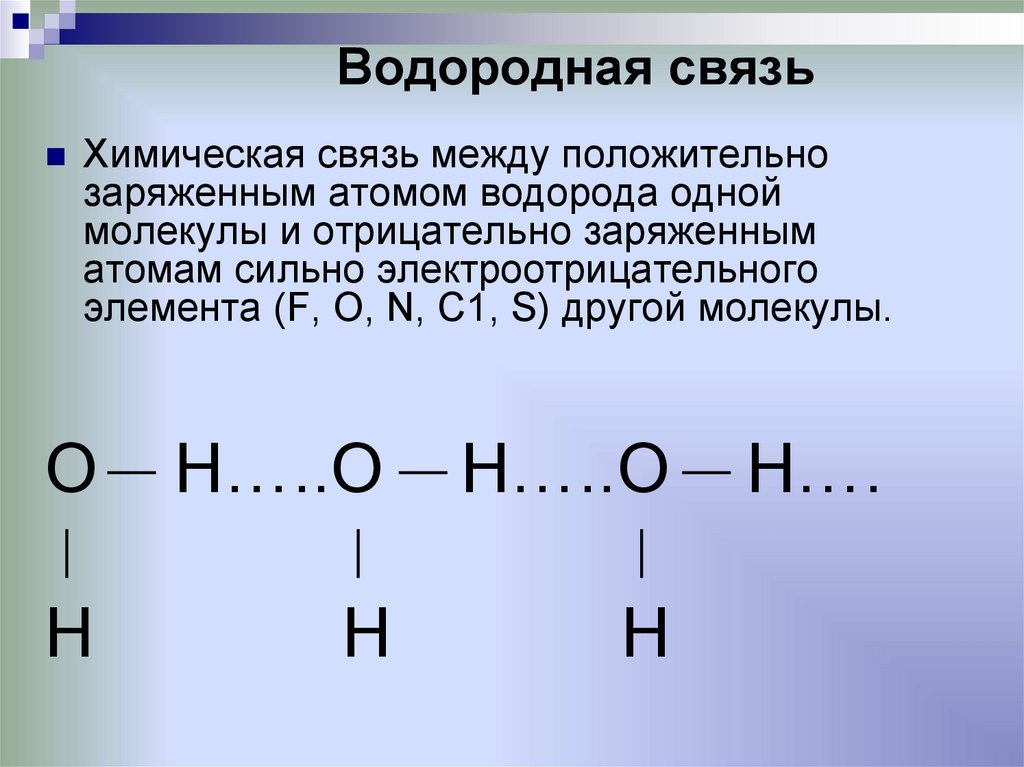 Конкуренция октаэдрических и тетраэдрических комплексов. Отражение ЭСКП на характеристиках высокоспиновых комплексов. Ряд Ирвинга-Вильямса. Горизонтальное сходство в ряду 3d-элементов. Комплексы 3d-металлов в биологических системах. Гемоглобин, другие металлокомплексы. Комплексы меди и перенос кислорода.
Конкуренция октаэдрических и тетраэдрических комплексов. Отражение ЭСКП на характеристиках высокоспиновых комплексов. Ряд Ирвинга-Вильямса. Горизонтальное сходство в ряду 3d-элементов. Комплексы 3d-металлов в биологических системах. Гемоглобин, другие металлокомплексы. Комплексы меди и перенос кислорода.
Занятие 10. 4,5d-элементы. Общая характеристика тяжелых металлов. Особенности электронного строения тяжелых d-металлов. Лантаноидное сжатие.Причины сходства в химическом поведении. Сравнение окислительное-восстановительных свойств и устойчивых степеней окисления тяжелых d-элементов с 3-d металлами. Триады хром-молибден-вольфрам, марганец-технеций рений.Стандартные восстановительные потенциалы. Сравнение поведения 3d и тяжелых металлов в водных растворах. Низкие степени окисления тяжелых d-элементов. Кластерообразование. Связь металл-металл. Структура кластерных каркасов. Образование изо- и гетерополианионов на примере хрома, молибдена и вольфрама. Анионы Кеггина, Доусона и Андерсена.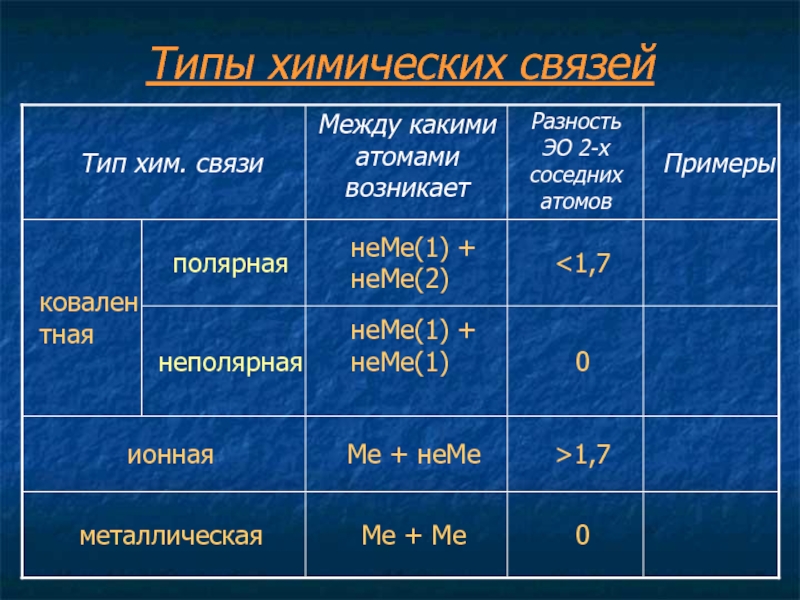 Влияние размера гетероатома на структуру аниона. Платиновые металлы. Особенное положение в периодической системе. Схожесть характеристик в триадах. Плоскоквадратные комплексы. Эффект транс-влияния. Актуальные проблемы: Комплексы Pd как катализаторы органических реакций.
Влияние размера гетероатома на структуру аниона. Платиновые металлы. Особенное положение в периодической системе. Схожесть характеристик в триадах. Плоскоквадратные комплексы. Эффект транс-влияния. Актуальные проблемы: Комплексы Pd как катализаторы органических реакций.
Занятие 11. f-элементы. Лантаноиды. Электронное строение. Кайносимметрия. Лантаноидное сжатие. Цериевая и иттриевая группа. Химия лантаноидов. Нахождение в природе. Получение и разделение лантаноидов. Реакционная способность простых веществ. Наиболее устойчивые степени окисления. Оксиды, гидроксиды, галогениды. Особенности химии Ce, Eu,Tb,Yb.Актиноиды. Электронное строение. Ураниды и кюриды. Изменение свойств по ряду 5f элементов. Химия актиноидов.Характерные степени окисления. Химия водных растворов. Иловые ионы. Особенности комплексов актиноидов (отсутствие связи М-М). Границы периодической системы. Синтез новых элементов.Сверхтяжелые элементы. Островок стабильности. Границы периодической системы. Сейчас полностью завершен 7 период(Og)! Актуальные проблемы: люминесцентные комплексы лантаноидов.
Сейчас полностью завершен 7 период(Og)! Актуальные проблемы: люминесцентные комплексы лантаноидов.
Занятие 12. Итоговое занятие. ПЗ в современной химии. Предсказание свойств и реакционной способности соединений. Разбор примеров: h3SO3 + h3SeO3; SnCl2 + Bi(NO3)3 + NaOH. Актуальные проблемы: химическое осаждение из газовой фазы.
Дисциплина участвует в формировании универсальных компетенций обучающихся по образовательным программам бакалавриата/специалитета, а также иных компетенций, предусмотренных образовательной программой.
3.1: Типы химических соединений и их формулы
Цели обучения
- Чтобы понять разницу между ковалентной и ионной связью.
Атомы во всех веществах, содержащих несколько атомов, удерживаются вместе за счет электростатических взаимодействий — взаимодействий между электрически заряженными частицами, такими как протоны и электроны. Электростатическое притяжение между противоположно заряженными видами (положительными и отрицательными) приводит к возникновению силы, которая заставляет их двигаться друг к другу, как притяжение между противоположными полюсами двух магнитов. Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительными, так и отрицательными) приводит к силе, которая заставляет их отталкивать друг друга, как и те же полюса двух магнитов. Атомы образуют химические соединения, когда притягивающие электростатические взаимодействия между ними сильнее, чем отталкивающие. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительными, так и отрицательными) приводит к силе, которая заставляет их отталкивать друг друга, как и те же полюса двух магнитов. Атомы образуют химические соединения, когда притягивающие электростатические взаимодействия между ними сильнее, чем отталкивающие. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные.В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, а лежат в спектре между этими крайностями. Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, которые редко встречаются в каких-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает объяснить, почему вещества с разными типами химических связей имеют очень разные свойства. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, которые представляют собой группы атомов, в которых одна или несколько пар электронов совместно используются связанными атомами. В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Примечание
Ионные соединения состоят из ионов с противоположными зарядами, удерживаемых вместе сильными электростатическими силами, тогда как пары электронов разделяются между связанными атомами в ковалентных соединениях.
Ковалентные молекулы и соединения
Так же, как атом — простейшая единица, обладающая фундаментальными химическими свойствами элемента, так и молекула — простейшая единица, обладающая фундаментальными химическими свойствами ковалентного соединения. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («двухатомных») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , и I 2 (часть (a) на рисунке \ (\ PageIndex {1} \)). Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые представлены как P 4 и S 8 (часть (b) на рисунке \ (\ PageIndex {1}) \)).
Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые представлены как P 4 и S 8 (часть (b) на рисунке \ (\ PageIndex {1}) \)).
Каждое ковалентное соединение представлено молекулярной формулой, которая дает атомный символ для каждого составляющего элемента в заданном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс пишется только в том случае, если количество атомов больше 1.Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как \ (H_2O \). Точно так же диоксид углерода, который содержит один атом углерода и два атома кислорода в каждой молекуле, записывается как \ (CO_2 \).
Рисунок \ (\ PageIndex {1} \): элементы, которые существуют как ковалентные молекулы. (a) Несколько элементов естественным образом существуют в виде двухатомных молекул, в которых два атома (E) соединены одной или несколькими ковалентными связями с образованием молекулы с общей формулой E2. (б) Некоторые элементы естественным образом существуют в виде многоатомных молекул, которые содержат более двух атомов.Например, фосфор существует в виде тетраэдров P4 — правильных многогранников с четырьмя треугольными сторонами — с атомом фосфора в каждой вершине. Элементная сера состоит из сморщенного кольца из восьми атомов серы, соединенных одинарными связями. Селен не показан из-за сложности его структуры.
(б) Некоторые элементы естественным образом существуют в виде многоатомных молекул, которые содержат более двух атомов.Например, фосфор существует в виде тетраэдров P4 — правильных многогранников с четырьмя треугольными сторонами — с атомом фосфора в каждой вершине. Элементная сера состоит из сморщенного кольца из восьми атомов серы, соединенных одинарными связями. Селен не показан из-за сложности его структуры. Ковалентные соединения, содержащие преимущественно углерод и водород, называются органическими соединениями. При представлении формул органических соединений принято писать сначала углерод, затем водород, а затем любые другие элементы в алфавитном порядке (например,g., CH 4 O — метиловый спирт, топливо). Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находятся в той же группе, перечислены, начиная с нижнего элемента и постепенно увеличиваясь, как в ClF. Однако по соглашению, когда неорганическое соединение содержит и водород, и элемент из групп 13-15, водород обычно указывается в формуле последним.Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до принятия этого соглашения, всегда сначала пишется с водородом: вода всегда пишется как H 2 O, а не как OH 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в другом месте.
Те, кто находятся в той же группе, перечислены, начиная с нижнего элемента и постепенно увеличиваясь, как в ClF. Однако по соглашению, когда неорганическое соединение содержит и водород, и элемент из групп 13-15, водород обычно указывается в формуле последним.Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до принятия этого соглашения, всегда сначала пишется с водородом: вода всегда пишется как H 2 O, а не как OH 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в другом месте.
Примечание
Для органических соединений: сначала напишите C, затем H, а затем остальные элементы в алфавитном порядке.Для молекулярных неорганических соединений: начните с крайнего левого элемента периодической таблицы; перечислить элементы в одной группе, начиная с нижнего элемента и далее.
Пример \ (\ PageIndex {1} \)
Напишите молекулярную формулу каждого соединения.
- Фосфорно-серное соединение, ответственное за воспламенение так называемых спичек в любом месте, имеет 4 атома фосфора и 3 атома серы на молекулу.
- Этиловый спирт, спирт для алкогольных напитков, имеет 1 атом кислорода, 2 атома углерода и 6 атомов водорода на молекулу.
- Фреон-11, когда-то широко использовавшийся в автомобильных кондиционерах и участвовавший в повреждении озонового слоя, имеет 1 атом углерода, 3 атома хлора и 1 атом фтора на молекулу.
Дано : идентичность присутствующих элементов и количество атомов в каждом
Запрошено : молекулярная формула
Стратегия :
A Определите символ для каждого элемента в молекуле. Затем идентифицируйте вещество как органическое или неорганическое соединение.
B Если вещество является органическим соединением, расположите элементы по порядку, начиная с углерода и водорода, а затем перечислите другие элементы в алфавитном порядке. Если это неорганическое соединение, перечислите элементы, начиная с самого левого в периодической таблице. Перечислите элементы в одной группе, начиная с нижнего элемента и постепенно увеличивая его.
Если это неорганическое соединение, перечислите элементы, начиная с самого левого в периодической таблице. Перечислите элементы в одной группе, начиная с нижнего элемента и постепенно увеличивая его.
C На основе предоставленной информации добавьте нижний индекс для каждого типа атомов, чтобы записать молекулярную формулу.
Решение :
а.
- A В молекуле 4 атома фосфора и 3 атома серы. Поскольку соединение не содержит в основном углерода и водорода, оно неорганическое.
- B Фосфор находится в группе 15, а сера — в группе 16. Поскольку фосфор находится слева от серы, он записывается первым.
- C Запись номера каждого типа атомов в виде правого нижнего индекса дает P 4 S 3 в качестве молекулярной формулы.
г.
- A Этиловый спирт содержит преимущественно углерод и водород, поэтому он является органическим соединением.

- B Формула органического соединения записывается сначала с числом атомов углерода, затем с числом атомов водорода, а остальные атомы в алфавитном порядке: CHO.
- C Добавление нижних индексов дает молекулярную формулу \ (\ ce {C2H6O} \).
г.
- A Фреон-11 содержит углерод, хлор и фтор.Его можно рассматривать либо как неорганическое соединение, либо как органическое соединение (в котором фтор заменил водород). Таким образом, формула для фреона-11 может быть записана с использованием любого из двух соглашений.
- B Согласно соглашению для неорганических соединений, углерод пишется первым, потому что он находится дальше слева в периодической таблице. Фтор и хлор находятся в одной группе, поэтому они перечислены, начиная с нижнего элемента и постепенно увеличиваясь: CClF. Добавление нижних индексов дает молекулярную формулу CCl 3 F.

- C Мы получаем ту же формулу для фреона-11, используя условные обозначения для органических соединений. Сначала записывается количество атомов углерода, затем количество атомов водорода (ноль), а затем другие элементы в алфавитном порядке, что также дает CCl 3 F.
Упражнение \ (\ PageIndex {1} \)
Напишите молекулярную формулу для каждого соединения.
- Закись азота, также называемая «веселящий газ», содержит 2 атома азота и 1 атом кислорода на молекулу.Закись азота используется в качестве мягкого анестетика при небольших хирургических вмешательствах и в качестве пропеллента в банках со взбитыми сливками.
- Сахароза, также известная как тростниковый сахар, имеет 12 атомов углерода, 11 атомов кислорода и 22 атома водорода.
- Гексафторид серы, газ, используемый для создания давления «негерметичных» теннисных мячей и в качестве хладагента в ядерных реакторах, содержит 6 атомов фтора и 1 атом серы на молекулу.

Ответ :
- N 2 O
- С 12 В 22 О 11
- SF 6
Представления молекулярных структур
Молекулярные формулы дают только элементный состав молекул.Напротив, структурные формулы показывают, какие атомы связаны друг с другом, а в некоторых случаях — примерное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Рисунок \ (\ PageIndex {2} \): молекулы, содержащие одинарные, двойные и тройные связи. Водород (H 2 ) имеет одинарную связь между атомами. Кислород (O 2 ) имеет двойную связь между атомами, обозначенную двумя линиями (=).Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару.
Структурная формула для H 2 может быть представлена как H – H, а формула для I 2 как I – I, где линия указывает на одну пару общих электронов, одинарную связь. Две пары электронов связаны двойной связью, что обозначено двумя линиями, например, O 2 означает O = O. Три электронные пары образуют тройную связь, которая обозначена тремя линиями, например, N 2 — это N≡N (рисунок \ (\ PageIndex {2} \)).Углерод уникален тем, что образует одинарные, двойные и тройные связи с самим собой и другими элементами. Число связей, образованных атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную тенденцию к образованию веществ, в которых они имеют одну, две, три и четыре связи с другими атомами соответственно (Таблица \ (\ PageIndex {1} \)).
| Атом | Количество облигаций |
|---|---|
| H (группа 1) | 1 |
| О (группа 16) | 2 |
| N (группа 15) | 3 |
| С (группа 14) | 4 |
Структурную формулу воды можно составить следующим образом:
Поскольку последняя аппроксимирует экспериментально определенную форму молекулы воды, она более информативна. Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записываются как плоские молекулы:
Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записываются как плоские молекулы:
Однако, как показано на рисунке \ (\ PageIndex {3} \), реальная трехмерная структура NH 3 выглядит как пирамида с треугольным основанием из трех атомов водорода. Структура CH 4 с четырьмя атомами водорода, расположенными вокруг центрального атома углерода, как показано на рисунке \ (\ PageIndex {3} \), является тетраэдрической: атомы водорода расположены в каждой второй вершине куба.Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома, образуя тетраэдр.
Рисунок \ (\ PageIndex {3} \): Трехмерные структуры воды, аммиака и метана. (а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. (c) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре.
(c) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре. Рисунки \ (\ PageIndex {3} \) — \ (\ PageIndex {3} \) иллюстрируют различные способы представления структур молекул. Должно быть ясно, что не существует единственного «лучшего» способа изобразить структуру молекулы; используемый метод зависит от того, какой аспект конструкции следует выделить и сколько времени и усилий потребуется. На рисунке \ (\ PageIndex {4} \) показаны некоторые из различных способов изобразить структуру немного более сложной молекулы: метанола. Эти представления сильно различаются по своему информационному содержанию.Например, молекулярная формула метанола (часть (а) на рисунке \ (\ PageIndex {4} \)) дает только номер каждого типа атомов; запись метанола в виде CH 4 O ничего не говорит о его структуре. Напротив, структурная формула (часть (b) на рисунке \ (\ PageIndex {4} \)) указывает, как атомы связаны, но при этом метанол выглядит так, как если бы он был плоским (а это не так).-Mandelic_acid_molecule_ball.png) Как модель с мячом и клюшкой (часть (c) на рисунке \ (\ PageIndex {4} \)), так и перспективный рисунок (часть (d) на рисунке \ (\ PageIndex {4} \)) показывают три вида размерная структура молекулы.Последнее (также называемое изображением клина и тире) — это самый простой способ нарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, с помощью клиньев и штрихов соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \ (\ PageIndex {4} \)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами. Кроме того, в модели заполнения пространства атомы на «передней стороне» молекулы могут закрывать атомы на «задней стороне».”
Как модель с мячом и клюшкой (часть (c) на рисунке \ (\ PageIndex {4} \)), так и перспективный рисунок (часть (d) на рисунке \ (\ PageIndex {4} \)) показывают три вида размерная структура молекулы.Последнее (также называемое изображением клина и тире) — это самый простой способ нарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, с помощью клиньев и штрихов соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \ (\ PageIndex {4} \)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами. Кроме того, в модели заполнения пространства атомы на «передней стороне» молекулы могут закрывать атомы на «задней стороне».”
 (б) Структурная формула показывает, какие атомы связаны. (c) Модель шара и палки показывает атомы как сферы, а связи как палочки. (d) Перспективный рисунок (также называемый изображением клина и тире) пытается показать трехмерную структуру молекулы. (e) Модель заполнения пространства показывает атомы в молекуле, но не связи.(е) Структурная формула в сжатом виде — это, безусловно, самый простой и распространенный способ представления молекулы.
(б) Структурная формула показывает, какие атомы связаны. (c) Модель шара и палки показывает атомы как сферы, а связи как палочки. (d) Перспективный рисунок (также называемый изображением клина и тире) пытается показать трехмерную структуру молекулы. (e) Модель заполнения пространства показывает атомы в молекуле, но не связи.(е) Структурная формула в сжатом виде — это, безусловно, самый простой и распространенный способ представления молекулы. Хотя структурная формула, шарообразная модель, перспективный рисунок и модель заполнения пространства предоставляют значительный объем информации о структуре молекулы, каждая из них требует времени и усилий. Следовательно, химики часто используют сжатую структурную формулу (часть (f) на рисунке \ (\ PageIndex {4} \)), в которой опускаются линии, представляющие связи между атомами, и просто перечисляются атомы, связанные с данным атомом рядом с ним.Несколько групп, присоединенных к одному и тому же атому, показаны в скобках с нижним индексом, указывающим количество таких групп. Например, конденсированная структурная формула метанола — CH 3 OH, что указывает на то, что молекула содержит звено CH 3 , которое выглядит как фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –CH 3 .Из-за простоты использования и содержания информации мы используем сжатые структурные формулы для молекул по всему тексту. Шариковые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а модели заполнения пространства используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Например, конденсированная структурная формула метанола — CH 3 OH, что указывает на то, что молекула содержит звено CH 3 , которое выглядит как фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –CH 3 .Из-за простоты использования и содержания информации мы используем сжатые структурные формулы для молекул по всему тексту. Шариковые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а модели заполнения пространства используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Пример \ (\ PageIndex {2} \)
Напишите молекулярную формулу для каждого соединения. Приведена сокращенная структурная формула.
- Монохлорид серы (также называемый дихлоридом дисеры) — это едкая желтая жидкость с неприятным запахом, которая используется при производстве синтетического каучука.
 Его сжатая структурная формула — ClSSCl.
Его сжатая структурная формула — ClSSCl. - Этиленгликоль — основной ингредиент антифриза. Его сжатая структурная формула: HOCH 2 CH 2 OH.
- Триметиламин — одно из веществ, отвечающих за запах испорченной рыбы. Его сжатая структурная формула: (CH 3 ) 3 N.
Дано : сжатая структурная формула
Запрошено : молекулярная формула
Стратегия :
- Определите каждый элемент в сжатой структурной формуле, а затем определите, является ли соединение органическим или неорганическим.
- При необходимости используйте условные обозначения органического или неорганического происхождения для перечисления элементов. Затем добавьте соответствующие индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Решение :
В молекулярной формуле перечислены элементы в молекуле и количество атомов в каждом.
- A Каждая молекула монохлорида серы имеет два атома серы и два атома хлора. Поскольку он не содержит в основном углерода и водорода, это неорганическое соединение. B Сера находится слева от хлора в периодической таблице, поэтому в формуле она записана первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 .
- A Подсчитав количество атомов в этиленгликоле, мы получим шесть атомов водорода, два атома углерода и два атома кислорода на молекулу. Соединение состоит в основном из атомов углерода и водорода, поэтому является органическим. B Как и все органические соединения, C и H записываются первыми в молекулярной формуле. Добавление соответствующих индексов дает молекулярную формулу C 2 H 6 O 2 .
- A Конденсированная структурная формула показывает, что триметиламин содержит три звена CH 3 , поэтому у нас есть один атом азота, три атома углерода и девять атомов водорода на молекулу.
 Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно правилам для органических соединений, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно правилам для органических соединений, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Упражнение \ (\ PageIndex {2} \)
Напишите молекулярную формулу для каждой молекулы.
- Хлороформ, который был одним из первых анестетиков и до недавнего времени использовался во многих сиропах от кашля, содержит один атом углерода, один атом водорода и три атома хлора.Его сжатая структурная формула — CHCl 3 .
- Гидразин используется в качестве топлива в реактивных двигателях космического корабля «Шаттл». Его сжатая структурная формула: H 2 NNH 2 .
- Путресцин — соединение с резким запахом, впервые выделенное из экстрактов гниющего мяса. Его сжатая структурная формула: H 2 NCH 2 CH 2 CH 2 CH 2 NH 2 .
 Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что существует четыре фрагмента CH 2 , связанных вместе.
Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что существует четыре фрагмента CH 2 , связанных вместе.
- Ответьте на
CHCl 3
- Ответ б
N 2 H 4
- Ответ c
С 4 В 12 Н 2
Ионные соединения
Вещества, описанные в предыдущем обсуждении, состоят из электрически нейтральных молекул; то есть количество положительно заряженных протонов в ядре равно количеству отрицательно заряженных электронов.Напротив, ионы — это атомы или сборки атомов, которые имеют общий электрический заряд. Ионы, которые содержат меньше электронов, чем протоны, имеют общий положительный заряд и называются катионами. И наоборот, ионы, которые содержат больше электронов, чем протонов, имеют общий отрицательный заряд и называются анионами. Ионные соединения содержат как катионы, так и анионы в соотношении, которое не приводит к отсутствию чистого электрического заряда.
Ионные соединения содержат как катионы, так и анионы в соотношении, которое не приводит к отсутствию чистого электрического заряда.
Примечание
Ионные соединения содержат как катионы, так и анионы в соотношении, которое дает ноль электрического заряда.
Рисунок \ (\ PageIndex {5} \): Ковалентная и ионная связь. (а) В молекулярном водороде (H 2 ) два атома водорода имеют два общих электрона, образуя ковалентную связь. (b) Ионное соединение NaCl образуется, когда электроны от атомов натрия переносятся на атомы хлора. Образующиеся ионы Na + и Cl — образуют трехмерное твердое тело, которое удерживается вместе за счет притягивающих электростатических взаимодействий. В ковалентных соединениях электроны распределяются между связанными атомами и одновременно притягиваются более чем к одному ядру.Напротив, ионные соединения содержат катионы и анионы, а не отдельные нейтральные молекулы. Ионные соединения удерживаются вместе за счет притягивающих электростатических взаимодействий между катионами и анионами. В ионном соединении катионы и анионы расположены в пространстве, чтобы сформировать расширенный трехмерный массив, который максимизирует количество притягивающих электростатических взаимодействий и минимизирует количество отталкивающих электростатических взаимодействий (рисунок \ (\ PageIndex {5} \)). Как показано в уравнении 3.1.1, электростатическая энергия взаимодействия между двумя заряженными частицами пропорциональна произведению зарядов на частицах и обратно пропорциональна расстоянию между ними:
В ионном соединении катионы и анионы расположены в пространстве, чтобы сформировать расширенный трехмерный массив, который максимизирует количество притягивающих электростатических взаимодействий и минимизирует количество отталкивающих электростатических взаимодействий (рисунок \ (\ PageIndex {5} \)). Как показано в уравнении 3.1.1, электростатическая энергия взаимодействия между двумя заряженными частицами пропорциональна произведению зарядов на частицах и обратно пропорциональна расстоянию между ними:
\ [\ text {электростатическая энергия} \ propto {Q_1Q_2 \ over r} \ label {3.1.1} \]
где
- \ (Q_1 \) и \ (Q_2 \) — электрические заряды на частицах 1 и 2, а
- \ (r \) — расстояние между ними.
Когда \ (Q_1 \) и \ (Q_2 \) оба положительны, что соответствует зарядам катионов, катионы отталкиваются друг от друга и электростатическая энергия положительна. Когда \ (Q_1 \) и \ (Q_2 \) оба отрицательны, что соответствует зарядам анионов, анионы отталкиваются друг от друга, и электростатическая энергия снова становится положительной. Электростатическая энергия отрицательна только тогда, когда заряды имеют противоположные знаки; то есть положительно заряженные виды притягиваются к отрицательно заряженным и наоборот. Как показано на рисунке \ (\ PageIndex {6} \), сила взаимодействия пропорциональна величине зарядов и уменьшается по мере увеличения расстояния между частицами. Эти энергетические факторы более подробно обсуждаются позже.
Электростатическая энергия отрицательна только тогда, когда заряды имеют противоположные знаки; то есть положительно заряженные виды притягиваются к отрицательно заряженным и наоборот. Как показано на рисунке \ (\ PageIndex {6} \), сила взаимодействия пропорциональна величине зарядов и уменьшается по мере увеличения расстояния между частицами. Эти энергетические факторы более подробно обсуждаются позже.
Примечание
Если электростатическая энергия положительна, частицы отталкиваются друг от друга; если электростатическая энергия отрицательна, частицы притягиваются друг к другу.
Одним из примеров ионного соединения является хлорид натрия (NaCl), образованный из натрия и хлора. При образовании химических соединений многие элементы имеют тенденцию приобретать или терять достаточно электронов, чтобы достичь того же количества электронов, что и ближайший к ним благородный газ в периодической таблице. Когда натрий и хлор вступают в контакт, каждый атом натрия отдает электрон, чтобы стать ионом Na + , с 11 протонами в его ядре, но только 10 электронами (как неон), и каждый атом хлора получает электрон, чтобы стать Cl – ион, с 17 протонами в ядре и 18 электронами (как аргон), как показано в части (b) на рисунке \ (\ PageIndex {5} \).Твердый хлорид натрия содержит равное количество катионов (Na + ) и анионов (Cl — ), что обеспечивает электрическую нейтральность. Каждый ион Na + окружен 6 ионами Cl —, а каждый ион Cl — окружен 6 ионами Na + . Из-за большого количества притягивающих взаимодействий Na + Cl — общая притягивающая электростатическая энергия в NaCl велика.
При образовании химических соединений многие элементы имеют тенденцию приобретать или терять достаточно электронов, чтобы достичь того же количества электронов, что и ближайший к ним благородный газ в периодической таблице. Когда натрий и хлор вступают в контакт, каждый атом натрия отдает электрон, чтобы стать ионом Na + , с 11 протонами в его ядре, но только 10 электронами (как неон), и каждый атом хлора получает электрон, чтобы стать Cl – ион, с 17 протонами в ядре и 18 электронами (как аргон), как показано в части (b) на рисунке \ (\ PageIndex {5} \).Твердый хлорид натрия содержит равное количество катионов (Na + ) и анионов (Cl — ), что обеспечивает электрическую нейтральность. Каждый ион Na + окружен 6 ионами Cl —, а каждый ион Cl — окружен 6 ионами Na + . Из-за большого количества притягивающих взаимодействий Na + Cl — общая притягивающая электростатическая энергия в NaCl велика.
В соответствии с тенденцией иметь такое же количество электронов, что и ближайший благородный газ, при образовании ионов элементы в группах 1, 2 и 3 имеют тенденцию терять один, два и три электрона, соответственно, с образованием катионов, таких как Na + и Mg 2 + .Тогда у них такое же количество электронов, как и у ближайшего благородного газа: неона. Точно так же K + , Ca 2 + и Sc 3 + имеют по 18 электронов, как и ближайший благородный газ: аргон. Кроме того, элементы в группе 13 теряют три электрона с образованием катионов, таких как Al 3 + , снова достигая того же количества электронов, что и ближайший к ним благородный газ в периодической таблице. Поскольку лантаноиды и актиниды формально принадлежат к группе 3, наиболее распространенным ионом, образованным этими элементами, является M 3 + , где M представляет собой металл. И наоборот, элементы в группах 17, 16 и 15 часто реагируют с получением одного, двух и трех электронов, соответственно, с образованием таких ионов, как Cl —, S 2- и P 3-. Такие ионы, которые содержат только один атом, называются одноатомными ионами. Заряды большинства одноатомных ионов, полученных от элементов основной группы, можно предсказать, просто взглянув на периодическую таблицу и посчитав, сколько столбцов находится в крайнем левом или правом углу. Например, барий (в Группе 2) образует Ba 2 + , чтобы иметь то же количество электронов, что и его ближайший благородный газ, ксенон; кислород (в группе 16) образует O 2-, чтобы иметь такое же количество электронов, что и неон; а цезий (в группе 1) образует Cs + , который имеет такое же количество электронов, как ксенон.Обратите внимание, что этот метод неэффективен для большинства переходных металлов, как обсуждалось в разделе 2.3. Некоторые общие одноатомные ионы перечислены в Таблице \ (\ PageIndex {2} \).
И наоборот, элементы в группах 17, 16 и 15 часто реагируют с получением одного, двух и трех электронов, соответственно, с образованием таких ионов, как Cl —, S 2- и P 3-. Такие ионы, которые содержат только один атом, называются одноатомными ионами. Заряды большинства одноатомных ионов, полученных от элементов основной группы, можно предсказать, просто взглянув на периодическую таблицу и посчитав, сколько столбцов находится в крайнем левом или правом углу. Например, барий (в Группе 2) образует Ba 2 + , чтобы иметь то же количество электронов, что и его ближайший благородный газ, ксенон; кислород (в группе 16) образует O 2-, чтобы иметь такое же количество электронов, что и неон; а цезий (в группе 1) образует Cs + , который имеет такое же количество электронов, как ксенон.Обратите внимание, что этот метод неэффективен для большинства переходных металлов, как обсуждалось в разделе 2.3. Некоторые общие одноатомные ионы перечислены в Таблице \ (\ PageIndex {2} \).
Примечание
элементов в группах 1, 2 и 3 имеют тенденцию образовывать ионы 1+, 2+ и 3+ соответственно; элементы в группах 15, 16 и 17 имеют тенденцию к образованию ионов 3–, 2– и 1– соответственно.
| Группа 1 | Группа 2 | Группа 3 | Группа 13 | Группа 15 | Группа 16 | Группа 17 |
|---|---|---|---|---|---|---|
Ли + литий | Be 2 + бериллий | N 3− нитрид (азид) | O 2− оксид | Ф. — фторид | ||
Na + натрий | мг 2 + магний | Al 3 + алюминий | П 3- фосфид | С 2− сульфид | Класс — хлорид | |
К + калий | Ca 2 + кальций | SC 3 + скандий | Ga 3 + галлий | As 3− арсенид | SE 2− селенид | руб. — бромид |
руб. + рубидий | Sr 2 + стронций | Y 3 + иттрий | В 3 + Индий | Те 2− теллурид | Я — йодид | |
CS + цезий | Ba 2 + барий | Ла 3 + лантан |
Пример \ (\ PageIndex {3} \)
Предскажите заряд самого обычного одноатомного иона, образованного каждым элементом.
- Алюминий
- , используемый в квантовых логических часах, самых точных часах в мире
- селен, из которого делают стекло рубинового цвета
- иттрий, используемый для изготовления свечей зажигания с высокими эксплуатационными характеристиками
Дано : элемент
Запрошено : ионный заряд
Стратегия :
A Укажите группу в периодической таблице, к которой принадлежит элемент. Основываясь на его расположении в периодической таблице, решите, является ли элемент металлом, который имеет тенденцию терять электроны; неметалл, который имеет тенденцию приобретать электроны; или полуметалл, который может делать то и другое.
B После обнаружения благородного газа, ближайшего к элементу, определите количество электронов, которое элемент должен получить или потерять, чтобы иметь такое же количество электронов, что и ближайший благородный газ.
Решение :
- A Алюминий — металл 13 группы; следовательно, он будет терять электроны. B Ближайший к алюминию благородный газ — неон. Алюминий потеряет три электрона с образованием иона Al 3 + , который имеет такое же количество электронов, как и неон.
- A Селен — неметалл группы 16, поэтому он будет иметь тенденцию приобретать электроны. B Ближайший благородный газ — криптон, поэтому мы прогнозируем, что селен получит два электрона, чтобы сформировать ион Se 2-, который имеет то же количество электронов, что и криптон.
- A Иттрий относится к группе 3, и элементы этой группы представляют собой металлы, которые имеют тенденцию терять электроны. B Ближайшим к иттрию благородным газом является криптон, поэтому прогнозируется, что иттрий потеряет три электрона с образованием Y 3 + , который имеет то же количество электронов, что и криптон.
Упражнение \ (\ PageIndex {3} \)
Предскажите заряд самого обычного одноатомного иона, образованного каждым элементом.
- Кальций, используемый для профилактики остеопороза
- йод, необходимый для синтеза гормонов щитовидной железы
- цирконий, широко используется в ядерных реакторах
Ответ :
- Ca 2 +
- Я —
- Zr 4 +
Физические свойства ионных и ковалентных соединений
Как правило, ионные и ковалентные соединения имеют разные физические свойства.Ионные соединения образуют твердые кристаллические вещества, плавящиеся при высоких температурах и устойчивые к испарению. Эти свойства проистекают из характерной внутренней структуры ионного твердого тела, схематически проиллюстрированной в части (а) на рисунке \ (\ PageIndex {8} \), который показывает трехмерный массив чередующихся положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением. . Напротив, как показано в части (b) на рисунке \ (\ PageIndex {8} \), большинство ковалентных соединений состоят из дискретных молекул, удерживаемых вместе сравнительно слабыми межмолекулярными силами (силами между молекулами), даже если атомы внутри каждой молекулы удерживаются вместе прочными внутримолекулярными ковалентными связями (силами внутри молекулы).Ковалентные вещества могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении, в зависимости от силы межмолекулярных взаимодействий. Ковалентные молекулярные твердые вещества имеют тенденцию образовывать мягкие кристаллы, которые плавятся при низких температурах и легко испаряются. Однако некоторые ковалентные вещества не являются молекулярными, а состоят из бесконечных трехмерных массивов ковалентно связанных атомов и включают некоторые из самых твердых известных материалов, например алмаз . Эта тема будет затронута в другом месте. Ковалентные связи, которые удерживают атомы вместе в молекулах, не затрагиваются, когда ковалентные вещества плавятся или испаряются, поэтому образуется жидкость или пар независимых молекул.Например, при комнатной температуре метан, основной компонент природного газа, представляет собой газ, состоящий из дискретных молекул CH 4 . Сравнение различных физических свойств ионных соединений и ковалентных молекулярных веществ приведено в Таблице \ (\ PageIndex {3} \).
| Ионные соединения | Ковалентные молекулярные вещества |
|---|---|
| твердые вещества | газы, жидкости или мягкие твердые вещества |
| высокие температуры плавления | низкая температура плавления |
| энергонезависимая | летучие |
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу.В таких случаях они обычно начинают с определения его эмпирической формулы, относительного числа атомов элементов в соединении, приведенного к наименьшим целым числам. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения количества присутствующих элементов. Разницу между эмпирической и молекулярной формулами можно проиллюстрировать на примере бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках.Молекулярная формула бутана: C 4 H 10 . Отношение атомов углерода к атомам водорода в бутане составляет 4:10, которое может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана: C 2 H 5 . Формульная единица — это абсолютная группа атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для обозначения их состава используются эмпирические формулы. Все соединения, ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительный и отрицательный заряды в формульной единице должны точно компенсировать друг друга. Если катион и анион имеют одинаковые заряды, например Na + и Cl —, то соединение должно иметь соотношение катионов к анионам 1: 1, а эмпирическая формула должна быть NaCl.Если заряды различаются по величине, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1: 1. В случае Mg 2 + и Cl —, например, необходимы два иона Cl — для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , что дает эмпирическую формулу MgCl 2 . Точно так же формула ионного соединения, содержащего ионы Na + и O 2-, — это Na 2 O.
Примечание
Ионные соединения не содержат дискретных молекул, поэтому для обозначения их состава используются эмпирические формулы.
Бинарные ионные соединения
Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой в виде аниона, называется бинарным ионным соединением. Одним из примеров является MgCl 2 , коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем пересечения зарядов: используйте абсолютное значение заряда на одном ионе в качестве индекса для другого иона.Этот метод схематически показан следующим образом:
Перекрестные сборы . Одним из способов получения индексов в эмпирической формуле является пересечение зарядов .
При пересечении сборов иногда необходимо уменьшить индексы до их простейшего отношения, чтобы написать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2 + и O 2-. Использование абсолютных значений зарядов на ионах в качестве нижних индексов дает формулу Mg 2 O 2 :
Это упрощает правильную эмпирическую формулу MgO.Эмпирическая формула содержит один ион Mg 2 + и один ион O 2-.
Пример \ (\ PageIndex {4} \)
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Ga 3 + и As 3-
- Eu 3 + и O 2-
- кальций и хлор
Дано : ионы или элементы
Запрошено : эмпирическая формула бинарного ионного соединения
Стратегия :
A Если не указано, определите ионные заряды на основе расположения элементов в периодической таблице.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. Уменьшить индексы до наименьших цифр
, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение
а. B Использование абсолютных значений зарядов на ионах в качестве индексов дает Ga3As3:
Сокращение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая электрически нейтральна [+3 + (−3) = 0].В качестве альтернативы мы могли бы распознать, что Ga 3 + и As 3- имеют заряды одинаковой величины, но противоположные знаки. Один ион Ga 3 + уравновешивает заряд одного иона As 3-, и соединение 1: 1 не будет иметь чистого заряда. Поскольку мы пишем индексы, только если число больше 1, эмпирическая формула — GaAs. GaAs — это арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
г. B Поскольку Eu 3 + имеет заряд +3, а O 2- имеет заряд -2, соединение 1: 1 будет иметь чистый заряд +1. Следовательно, мы должны найти кратные списаниям, которые отменяются. Мы перекрестно заряжаем, используя абсолютное значение заряда одного иона в качестве индекса для другого иона:
Нижний индекс для Eu 3 + равен 2 (из O 2-), а нижний индекс для O 2- равен 3 (из Eu 3 + ), что дает Eu 2 O 3 ; нижние индексы не могут быть далее уменьшены.Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (-2) = -6 для чистого заряда 0. Соединение Eu 2 O 3 является нейтральным. Оксид европия отвечает за красный цвет экранов телевизоров и компьютеров.
г. A Поскольку заряды на ионах не указаны, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы сформировать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для балансировки заряда на одном ионе Ca 2 + , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы перекрестно заряжать, используя абсолютное значение заряда для Ca 2 + в качестве индекса для Cl и абсолютное значение заряда для Cl — в качестве индекса для Ca:
Нижние индексы в CaCl 2 не подлежат дальнейшему уменьшению.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение — хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение \ (\ PageIndex {4} \)
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Li + и N 3-
- Al 3 + и O 2-
- литий и кислород
Ответ :
- Ли 3 Н
- Al 2 O 3
- Li 2 O
Многоатомные ионы
Многоатомные ионы — это группы атомов, которые несут суммарные электрические заряды, хотя атомы в многоатомном ионе удерживаются вместе теми же ковалентными связями, которые удерживают атомы вместе в молекулах.Подобно тому, как существует гораздо больше видов молекул, чем простых элементов, существует гораздо больше видов многоатомных ионов, чем одноатомных ионов. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомных анионов гораздо больше, чем многоатомных катионов; некоторые общие примеры находятся в Таблице \ (\ PageIndex {4} \).
| Формула | Имя Иона |
|---|---|
| NH 4 + | аммоний |
| CH 3 NH 3 + | метиламмоний |
| ОН — | гидроксид |
| O 2 2- | перекись |
| CN — | цианид |
| SCN — | тиоцианат |
| НЕТ 2 — | нитрит |
| НЕТ 3 — | нитрат |
| CO 3 2- | карбонат |
| HCO 3 — | гидрокарбонат или бикарбонат |
| СО 3 2- | сульфит |
| СО 4 2- | сульфат |
| HSO 4 — | гидросульфат или бисульфат |
| PO 4 3- | фосфат |
| HPO 4 2- | гидрофосфат |
| H 2 PO 4 — | дигидрофосфат |
| ClO — | гипохлорит |
| ClO 2 — | хлорит |
| ClO 3 — | хлорат |
| ClO 4 — | перхлорат |
| MnO 4 — | перманганат |
| CrO4 2 — | хромат |
| Cr 2 O 7 2- | дихромат |
| С 2 О 4 2- | оксалат |
| HCO 2 — | формиат |
| CH 3 CO 2 — | ацетат |
| C 6 H 5 CO 2 — | бензоат |
Метод, используемый для прогнозирования эмпирических формул для ионных соединений, содержащих одноатомные ионы, также может использоваться для соединений, содержащих многоатомные ионы.Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 — объединяются в соотношении 1: 1 с образованием KNO 3 (нитрата калия или селитры), основного ингредиента черного пороха. Точно так же Ca 2 + и SO 4 2- образуют CaSO 4 (сульфат кальция), который соединяется с различными количествами воды с образованием гипса и штукатурки Парижа. Многоатомные ионы NH 4 + и NO 3 — образуют NH 4 NO 3 (нитрат аммония), широко используемое удобрение и, в чужих руках, взрывчатое вещество.Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2 + и PO 4 3-; это основной компонент костей. Соединение электрически нейтрально, потому что ионы объединяются в соотношении три иона Ca 2 + [3 (+2) = +6] на каждые два иона [2 (−3) = −6], что дает эмпирическое значение формула Ca 3 (PO 4 ) 2 ; скобки вокруг PO 4 в эмпирической формуле указывают на то, что это многоатомный ион.Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильное число каждого атома в формульной единице, но при этом скрывается тот факт, что соединение содержит легко идентифицируемый PO 4 3- ионы.
Пример \ (\ PageIndex {5} \)
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Na + и HPO 4 2-
- Катион калия и анион цианида
- Катион кальция и анион гипохлорита
Дано : ионы
Запрошенный : эмпирическая формула для ионного соединения
Стратегия :
A Если он не указан, определите заряд одноатомного иона по его положению в периодической таблице.Используйте таблицу \ (\ PageIndex {4} \) «Общие многоатомные ионы и их имена», чтобы найти заряд многоатомного иона.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. При написании эмпирической формулы сократите индексы до наименьших целых чисел.
Решение :
а. B Поскольку HPO 4 2- имеет заряд -2, а Na + имеет заряд +1, эмпирическая формула требует, чтобы два иона Na + уравновешивали заряд многоатомного иона, давая На 2 ГПО 4 .Нижние индексы сокращаются до наименьших чисел, поэтому эмпирическая формула: Na 2 HPO 4 . Это соединение представляет собой гидрофосфат натрия, который используется для придания текстуры плавленому сыру, пудингам и быстрым завтракам.
г. A Катион калия — K + , а анион цианида — CN —. B Поскольку величина заряда на каждом ионе одинакова, эмпирическая формула — KCN. Цианид калия очень токсичен, и одно время его использовали как крысиный яд.Однако это использование было прекращено, потому что слишком много людей были случайно отравлены.
г. A Катион кальция — Ca 2 + , а анион гипохлорита — ClO —. B Два иона ClO — необходимы для уравновешивания заряда одного иона Ca 2 + , давая Ca (ClO) 2 . Нижние индексы не могут быть далее уменьшены, поэтому эмпирическая формула Ca (ClO) 2 . Это гипохлорит кальция, «хлор», используемый для очистки воды в плавательных бассейнах.
Упражнение \ (\ PageIndex {5} \)
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Ca 2 + и H 2 PO 4 —
- Катион натрия и анион бикарбоната
- Катион аммония и сульфат-анион
Ответ :
- Ca (H 2 PO 4 ) 2 : дигидрофосфат кальция является одним из ингредиентов разрыхлителя.
- NaHCO 3 : бикарбонат натрия содержится в антацидах и разрыхлителе; в чистом виде продается как пищевая сода.
- (NH 4 ) 2 SO 4 : сульфат аммония является обычным источником азота в удобрениях.
Сводка
- Есть два принципиально разных типа химических связей (ковалентные и ионные), которые заставляют вещества иметь очень разные свойства.
- Состав соединения представлен эмпирической или молекулярной формулой, каждая из которых состоит по крайней мере из одной формульной единицы.Авторы
Атомы в химических соединениях удерживаются вместе притягивающими электростатическими взаимодействиями, известными как химические связи. Ионные соединения содержат положительно и отрицательно заряженные ионы в соотношении, которое приводит к нулевому общему заряду. Ионы удерживаются вместе в регулярном пространственном расположении за счет электростатических сил. Большинство ковалентных соединений состоят из молекул, групп атомов, в которых одна или несколько пар электронов разделяются, по крайней мере, двумя атомами, образуя ковалентную связь.Атомы в молекулах удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, разделяемыми ядрами. Молекулярная формула ковалентного соединения дает типы и количество присутствующих атомов. Соединения, которые содержат преимущественно углерод и водород, называются органическими соединениями, тогда как соединения, которые состоят в основном из элементов, отличных от углерода и водорода, являются неорганическими соединениями. Двухатомные молекулы содержат два атома, а многоатомные молекулы — более двух.Структурная формула указывает на состав, приблизительную структуру и форму молекулы. Одинарные связи, двойные связи и тройные связи представляют собой ковалентные связи, в которых одна, две и три пары электронов, соответственно, разделяются между двумя связанными атомами. Атомы или группы атомов, обладающие чистым электрическим зарядом, называются ионами; они могут иметь либо положительный заряд (катионы), либо отрицательный заряд (анионы). Ионы могут состоять из одного атома (одноатомные ионы) или нескольких (многоатомные ионы). Заряды на одноатомных ионах большинства элементов основной группы можно предсказать, исходя из местоположения элемента в периодической таблице.Ионные соединения обычно образуют твердые кристаллические вещества с высокими температурами плавления. Ковалентные молекулярные соединения, напротив, состоят из дискретных молекул, удерживаемых вместе слабыми межмолекулярными силами, и могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении.
Эмпирическая формула дает относительное количество атомов элементов в соединении, приведенное к наименьшим целым числам. Формульная единица представляет собой абсолютную группу, представленную эмпирической формулой соединения, ионного или ковалентного.Эмпирические формулы особенно полезны для описания состава ионных соединений, которые не содержат легко идентифицируемых молекул. Некоторые ионные соединения встречаются в виде гидратов, которые содержат определенное соотношение слабосвязанных молекул воды, называемых водами гидратации.
Химические соединения — Chemistry LibreTexts
Химические соединения обычно можно разделить на две широкие группы: молекулярные соединения и ионные соединения. Молекулярные соединения включают атомы, соединенные ковалентными связями, и могут быть представлены множеством формул.Ионные соединения состоят из ионов, связанных ионной связью, и их формулы обычно записываются с использованием степеней окисления.
Молекулярные соединения состоят из атомов, которые удерживаются вместе ковалентными связями. Эти связи образуются, когда электроны делятся между двумя атомами. Концепция химических формул была создана для простого описания многих характеристик молекулярных соединений. Нормальная химическая формула включает в себя такие факторы, как то, какие элементы находятся в молекуле и сколько в ней атомов каждого элемента.Число атомов каждого элемента обозначается нижним индексом, небольшим числом, которое пишется слева от элемента.
\ [CH_3COOH \]
В предыдущей формуле индекс «3» означает, что в молекуле присутствуют три атома водорода.
Другие типы формул используются для отображения более подробных характеристик молекул.
Эмпирическая формула представляет пропорции атомов в молекуле. Он дает важную информацию о молекуле, поскольку отображает соотношение атомов, присутствующих в молекуле.Однако его ограничения существуют в том смысле, что он не представляет точное количество атомов, присутствующих в молекуле, как это делает молекулярная формула. В определенных ситуациях молекулярная формула и эмпирическая формула могут совпадать, но в других ситуациях молекулярная формула является кратным соотношению атомов, указанных в эмпирической формуле. Поскольку эмпирические формулы могут быть получены из молекулярных формул, молекулярные формулы обычно более полезны, чем эмпирические формулы.
Эмпирические vs.молекулярные соединения
C 5 H 7 O — это возможная эмпирическая формула, поскольку соотношение 5: 7: 1 не может быть далее упрощено. В этом конкретном случае эмпирическая формула также может быть молекулярной формулой, если на молекулу приходится ровно 5 атомов углерода, 7 атомов водорода и 1 атом кислорода. Однако другая возможная молекулярная формула для той же самой молекулы — C 10 H 14 O 2 , потому что, хотя присутствует 10 атомов углерода, 14 атомов водорода и 2 атома кислорода, соотношение 10: 14: 2 может можно упростить до 5: 7: 1, уступив место той же эмпирической формуле.Кроме того, C 10 H 14 O 2 — не единственная возможность молекулярной формулы для этой молекулы; любая формула с такими же относительными пропорциями этих атомов, которая может быть упрощена до соотношений 5: 7: 1, является возможной молекулярной формулой для этой молекулы. При предоставлении адекватной информации эмпирическая формула и молекулярная формула могут быть определены количественно.
Структурная формула написана для обозначения деталей связывания отдельных атомов.Более конкретно, он разъясняет, какие типы связей существуют, между какими атомами эти связи существуют, а также порядок связывания атомов в молекуле. Ковалентные связи обозначены линиями. Одинарная линия представляет одинарную связь, две линии представляют двойную связь, три линии представляют тройную связь и далее. Одинарная ковалентная связь возникает, когда два электрона разделяются между атомами, двойная возникает, когда четыре электрона разделяются между двумя атомами и т. Д. В этом смысле, чем больше количество связей, тем сильнее связь между двумя атомами.
Рисунок 1: Структурная формула уксусной кислоты, молекулярная формула которой CH 3 COOH.Краткая структурная формула — менее наглядный способ представления тех же характеристик, отображаемых структурной формулой. В формулах этого типа молекула записывается как молекулярная формула, за исключением того, что она указывает, где происходит связывание.
Рисунок 2: Структурная формула гексана. Обращаясь к структурной формуле и подчеркивая, где происходит связывание, можно установить сжатую структурную формулу: CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 .Все изображения, обсужденные до сих пор, не касались того, как показать трехмерную структуру молекулы. Двумя способами проиллюстрировать пространственную структуру являются использование модели шара и ручки, а также модели заполнения пространства.
Модель шара и палки использует шары для пространственного представления молекулы. Шарики — это атомы в молекуле, а палочки — это связи между определенными атомами.
Модель заполнения пространства — это также метод пространственного отображения молекулы и ее характеристик.Модель заполнения пространства показывает размеры атомов относительно друг друга.
Ионные соединения
Ионные соединения состоят из положительных и отрицательных ионов, соединенных ионными связями. Ионные связи обычно образуются, когда электроны переносятся от одного атома к другому, в результате чего отдельные атомы становятся заряженными частицами или ионами. Ионы могут быть одноатомными или многоатомными. Одноатомные ионы, такие как Cl —, состоят только из одного иона, в то время как многоатомные ионы, такие как NO 3 —, определяются как многоатомные ионы.Комбинация этих ионов, образующая соединение с нулевым зарядом, известна как формульная единица ионного соединения. Ионные соединения обычно имеют тенденцию к образованию кристаллизованных солей. Как правило, они имеют высокие температуры кипения / плавления и являются хорошими проводниками электричества. Формулы ионных соединений всегда пишутся сначала с катионом, а затем с анионом. Затем формула может быть дополнена со ссылкой на степени окисления присутствующих элементов.
Список литературы
- Петруччи, Ральф.Харвуд, Уильям. Селедка, Джеффри. Мадура, Джеффри. ОБЩАЯ ХИМИЯ Принципы и современные приложения 9-е издание. Macmillan Publishing co, Нью-Джерси. 1989.
- Сухоцкий, Дж. Концептуальная химия: понимание нашего мира атомов и молекул. 2-е изд. Соединенное Королевство: Бенджамин / Каммингс, 2003. .
Химический состав
2
Открытие нетоксичных полупроводников с прямой запрещенной зоной в ближнем инфракрасном диапазоне
Мар.23 февраля 2021 г. — Ученые обнаружили потенциально многообещающий инфракрасный светодиод и инфракрасный детектор. Это соединение, состоящее из кальция, кремния и кислорода, дешево в производстве и нетоксично. Многие из …
Химики используют синергетический эффект галлия
21 января 2021 г. — Химики продемонстрировали ценность «командной работы», успешно используя взаимодействие между двумя атомами галлия в новом соединении, чтобы разделить особенно прочную связь между ними…
Новые азотные продукты в воздухе
12 августа 2020 г. — Исследователи нашли способ объединить атмосферный азот с бензолом для получения химического соединения под названием анилин, который является предшественником материалов, используемых для производства различных синтетических …
В поисках светового материала будущего
1 мая 2020 г. — Исследователи узнали о многообещающем материале для органических светодиодов (OLED).Вещество обеспечивает высокий световой выход и будет недорогим в производстве в больших масштабах — …
Синтез дикарбоновых кислот и водорода одновременно из диолов
30 июля 2020 г. — Исследователи разрабатывают более безопасный и эффективный способ производства дикарбоновой кислоты. Используя иридиевый катализатор, связанный с бипиридонатным лигандом, исследователи смогли синтезировать дикарбоновые кислоты из …
Машинное обучение раскрывает состояния окисления кристаллических структур
6 июля 2021 г. — Инженеры-химики разработали модель машинного обучения, которая может прогнозировать степень окисления соединения — свойство, которое настолько важно, что многие химики утверждают, что его необходимо включить в…
Химия магния перевернулась
14 мая 2021 г. — Новые открытия произведут революцию во всей химии магния. Исследовательская группа обнаружила магний, который обычно имеет двойной положительный заряд в химических соединениях, в …
Наконец-то в бутылке
7 февраля 2019 г. — С момента открытия первого гомолептического комплекса карбонила металла более 130 лет назад ученые пытались получить дополнительные такие соединения, образованные из молекулы монооксида углерода и a…
Включение и выключение цвета пористого материала с помощью кислоты
8 февраля 2019 г. — Стабильный изменяющий цвет состав демонстрирует потенциал для электроники, датчиков и газа …
Новая роль воды в производстве возобновляемого топлива
1 апреля 2019 г. — Инженеры открыли новый подход к модернизации возобновляемого химического вещества, фурфурола с помощью воды, удвоение или утроение скорости …
элементов и соединений | Введение в химию
Цель обучения
- Различать элементы и соединения и изучать методы разделения
Ключевые моменты
- Элементы — это простейшие законченные химические вещества.Каждый элемент соответствует одной записи в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно снова разделить на их исходные компоненты.
Условия
- элемент: Любое одно из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- соединение: Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
- химическая связь: Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, которые обычно находятся в левой части таблицы Менделеева, это:
- часто проводит к электричеству
- податливый
- блестящий
- иногда магнитный.
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, которые можно найти в правой части таблицы Менделеева (справа от лестницы):
- обычно непроводящий
- не податливый
- матовый (не блестящий)
- немагнитный.
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (самым последним из них был идентифицирован ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются в природе на Земле. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Периодическая таблица Периодическая таблица Менделеева содержит 118 элементов, включая металлы (синий), неметаллы (красный) и металлоиды (зеленый).Водород и гелий — безусловно, самые распространенные элементы во Вселенной. Однако железо является самым распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной. Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. Темной материи не хватает протонов, нейтронов или электронов.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. Хотя 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые, относительно чистые минералы.Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два различных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl).Вода — еще один пример химического соединения. Два или более компонентов соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть:
- молекулярных соединений, удерживаемых ковалентными связями
- солей, удерживаемых ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями.
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, которые содержат только несколько атомов одного элемента, например H 2 или S 8 ).
Chemistry 1.2 Classification Matter (Part 2 of 3) — YouTube В этом видео обсуждаются чистые вещества, сравниваются элементы и соединения, а также химические изменения противопоставляются физическим изменениям. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Примеры соединений
СоединенияСоединение — это вещество, состоящее из двух или более химических элементов, атомы которых связаны вместе. Эти атомы химически связаны определенным образом и в определенных пропорциях, и вещества не могут быть легко разделены простыми физическими средствами.
Существует несколько различных типов соединений, включая бинарные, ионные, молекулярные, кислоты, катионы и анионы.Эти типы соединений имеют разные свойства и различный химический состав, но это категории, которые описывают потенциально миллионы различных химических соединений.
Примеры соединений:
1. Вода — формула: H 2 O = водород 2 + кислород
Два атома элемента водорода соединяются с одним атомом кислорода посредством ковалентной связи с образованием воды. Водород имеет слегка положительный заряд, а кислород — отрицательный, и поэтому он образует полярную молекулу.Воду можно расщепить обратно на водород и кислород посредством электролиза.
2. Перекись водорода — формула: H 2 O 2 = Водород 2 + кислород 2
Перекись водорода образуется, когда два атома водорода образуют связь с двумя связанными друг с другом атомами кислорода. Хотя у него всего на один атом кислорода больше, чем в молекуле воды (H 2 O), его свойства сильно отличаются.
3. Соль — формула: NaCl = натрий + хлор
В соли один атом натрия связывается с одним атомом хлора с образованием ионного соединения хлорида натрия.Соль довольно легко получить для коммерческого использования путем простого испарения морской воды, хотя его можно добывать и с земли. Хлорид натрия можно разделить на разные атомы с помощью электролиза.
4. Пищевая сода — формула: NaHCO 3 = натрий + водород + углерод + кислород 3
Бикарбонат натрия (пищевая сода) может быть получен в результате реакции диоксида углерода с водным раствором гидроксида натрия, в результате чего образуется карбонат натрия; затем он объединяется с молекулами диоксида углерода с образованием бикарбоната натрия.В природе он встречается в горячих источниках и других местах на земле, но его производят в промышленных масштабах.
5. Октан — Формула: C 8 H 18 = Углерод 8 + Водород 18
Октан — это углеводород, фактическая формула которого: CH 3 (CH 2 ) 6 CH 3 . Это низкомолекулярное соединение, что означает его высокую летучесть и воспламеняемость, что делает его идеально подходящим для производства бензина.
Примеры соединений
Что такое химическое соединение? — Определение и примеры — Видео и стенограмма урока
Типы химических соединений
Химические соединения состоят из элементов, которые соединяются вместе. Эти связи обычно являются ковалентными, ионными или металлическими.
Ионные связи образуются, когда два или более атома элемента соединяются вместе, когда один из элементов получает или теряет электроны. Ковалентные связи — это химические связи, которые образуются, когда два или более атома элемента разделяют электроны. Металлические связи образуются, когда ионы металлов притягиваются к электронам другого элемента.
Примеры химических соединений
Химические соединения можно найти в природе, а также в продуктах, которые мы находим у себя дома. Вы когда-нибудь видели ржавый металлический предмет, оставленный снаружи? Когда железо какое-то время подвергается воздействию атмосферы, оно начинает ржаветь. Материал, который мы обычно называем ржавчиной, на самом деле представляет собой химический состав оксида железа. Оксид железа образуется, когда железо в объекте реагирует с кислородом в атмосфере и образует ионные связи, которые приводят к химическому соединению.
Вероятно, у вас на кухне есть емкость с солью. Соль — очень важное химическое соединение. Нашему телу требуется регулировать уровень электролитов. Поваренная соль — это хлорид натрия, который образуется, когда атомы натрия и атомы хлора соединяются ионной связью. Это означает, что натрий теряет один электрон, а атом хлора получает один электрон, чтобы сформировать связь и создать химическое соединение.
Еще одно распространенное химическое соединение, которое нам всем необходимо — это вода.Вода — это химическое соединение, которое образуется при соединении двух атомов водорода с одним атомом кислорода. Эти атомы удерживаются вместе, потому что они разделяют электроны в результате ковалентной связи. Металлические связи также включают в себя разделение или взаимное притяжение электронов, благодаря чему атомы внутри любого металла удерживаются вместе.
Резюме урока
Химические соединения можно найти повсюду вокруг нас, и некоторые из них имеют решающее значение для нашей жизни, например поваренная соль и вода.Химическое соединение представляет собой химическую комбинацию двух или более элементов, которые обычно можно разбить на более простые вещества химическими методами и которые имеют свойства, отличные от свойств составляющих его элементов. Три наиболее распространенных типа связей включают ковалентные, ионные и металлические связи. Ионные связи образуются, когда два или более атома элемента соединяются вместе, когда один из элементов получает или теряет электроны. Ковалентные связи — это химические связи, которые образуются, когда два или более атома элемента разделяют электроны. Металлические связи образуются, когда ионы металлов притягиваются к электронам другого элемента. Ржавчина или оксид железа и поваренная соль являются отличными примерами ионных связей, а вода — отличным примером ковалентной связи. Металлические связи возникают, когда электроны разделяются или взаимно притягиваются между несколькими атомами внутри или между металлами, что в конечном итоге удерживает их вместе.
Изучение космоса химических соединений с помощью квантового машинного обучения
Киркпатрик П. и Эллис К. Химическое пространство. Природа 432 , 823 (2004).
CAS Google ученый
Маллард А. Путеводитель по галактике для фармацевтов. Nat. Новости 549 , 445 (2017).
Google ученый
Хуанг Б. и фон Лилиенфельд О. А. Эффективное точное масштабируемое и переносимое квантовое машинное обучение с расширениями.Препринт на arXiv https://arxiv.org/abs/1707.04146 (2017).
Oprea T. I. et al. в Molecular Interaction Fields (Wiley-VCH, 2006).
Бутина Д., Сегалл М. Д. и Франккомб К. Прогнозирование свойств ADME in silico: методы и модели. Drug Discov. Сегодня 7 , S83 – S88 (2002).
CAS PubMed Google ученый
Раджан, К.Материалы информатики. Mater. Сегодня 8 , 38–45 (2005).
CAS Google ученый
Hautier, G., Fischer, C.C., Jain, A., Mueller, T. & Ceder, G. Поиск отсутствующих в природе тройных оксидных соединений с использованием машинного обучения и теории функционала плотности. Chem. Матер. 22 , 3762–3767 (2010).
CAS Google ученый
Уорд, Л. и Волвертон, К. Атомистические расчеты и информатика материалов: обзор. Curr. Opin. Solid State Mater. Sci. 21 , 167–176 (2017).
CAS Google ученый
Шнайдер Г. Виртуальный просмотр: бесконечная лестница? Nat. Rev. Drug Discov. 9 , 273–276 (2010).
CAS PubMed Google ученый
фон Лилиенфельд, О.А. Взгляд из первых принципов на пространство химического соединения: получение строгого атомистического контроля молекулярных свойств. Внутр. J. Quantum Chem. 113 , 1676–1689 (2013).
Google ученый
Ван Ноорден, Р., Махер, Б. и Нуццо, Р. 100 лучших статей. Nat. Новости 514 , 550–553 (2014).
Google ученый
Франческетти А. и Зунгер А. Обратная задача зонной структуры нахождения атомной конфигурации с заданными электронными свойствами. Nature 402 , 60–63 (1999).
CAS Google ученый
Йоханнессон, Г. Х. и др. Комбинированная электронная структура и эволюционный поисковый подход к дизайну материалов. Phys. Rev. Lett. 88 , 255506 (2002).
PubMed Google ученый
Curtarolo, S. et al. Высокопроизводительный путь к проектированию вычислительных материалов. Nat. Матер. 12 , 191–201 (2013).
CAS PubMed Google ученый
Хафнер, Дж., Волвертон, К. и Седер, Г. К разработке вычислительных материалов: влияние теории функционала плотности на исследования материалов. MRS Bull. 31 , 659–668 (2006).
Google ученый
Hachmann, J. et al. Гарвардский проект чистой энергии: крупномасштабный вычислительный анализ и проектирование органических фотоэлектрических элементов в сети мирового сообщества. J. Phys. Chem. Lett. 2 , 2241–2251 (2011).
CAS Google ученый
Марзари, Н. Моделирование материалов: границы и проблемы. Nat. Матер. 15 , 381–382 (2016).
CAS PubMed Google ученый
Alberi, K. et al. Дорожная карта материалов по дизайну на 2019 год. J. Phys. D Прил. Phys. 52 , 013001 (2018).
Google ученый
ЛеКун Ю., Бенжио Ю. и Хинтон Г. Глубокое обучение. Природа 521 , 436–444 (2015).
CAS PubMed PubMed Central Google ученый
Шмидхубер Дж. Глубокое обучение в нейронных сетях: обзор. Neural Netw. 61 , 85–117 (2015).
PubMed Google ученый
Capper, D. et al. Классификация опухолей центральной нервной системы на основе метилирования ДНК. Природа 555 , 469–474 (2018).
CAS PubMed PubMed Central Google ученый
Klauschen, F. et al. Оценка лимфоцитов, инфильтрирующих опухоль: от визуальной оценки до машинного обучения. Семин. Cancer Biol. 52 , 151–157 (2018).
CAS PubMed Google ученый
Jurmeister, P. et al. Анализ профилей метилирования ДНК с помощью машинного обучения позволяет отличить первичный плоскоклеточный рак легких от метастазов в голове и шее. Sci. Transl Med. 11 , eaaw8513 (2019).
CAS PubMed Google ученый
Балди П., Садовски П. и Уайтсон Д. Поиск экзотических частиц в физике высоких энергий с помощью глубокого обучения. Nat. Commun. 5 , 4308 (2014).
CAS PubMed Google ученый
Ленгауэр Т., Сандер О., Сьерра С., Тилен А. и Кайзер Р. Прогнозирование использования корецепторов ВИЧ в биоинформатике. Nat. Biotechnol. 25 , 1407–1410 (2007).
CAS PubMed Google ученый
Бланкерц, Б., Томиока, Р., Лемм, С., Каванабе, М., Мюллер, К.-Р. Оптимизация пространственных фильтров для надежного однократного анализа ЭЭГ. Сигнал IEEE. Процесс. Mag. 25 , 41–56 (2008).
Google ученый
Perozzi, B., Al-Rfou, R. & Skiena, S. в Proc. ACM SIGKDD Int. Конф. Знание Discov. Data Mining , 701–710 (ACM, 2014).
Thrun, S. Burgard, W.И Фокс Д. Вероятностная робототехника (MIT Press, 2005).
Льюис М. М. Moneyball: Искусство выигрыша в несправедливой игре (Нортон, В. У., 2003).
Ферруччи, Д., Левас, А., Багчи, С., Гондек, Д. и Мюллер, Э. Т. Уотсон: без опасности! Artif. Intell. 199 , 93–105 (2013).
Google ученый
Silver, D. et al. Освоение игры в го с глубокими нейронными сетями и поиском по дереву. Природа 529 , 484–489 (2016).
CAS PubMed Google ученый
Lejaeghere, K. et al. Воспроизводимость при расчетах твердых тел по теории функционала плотности. Наука 351 , aad3000 (2016).
PubMed Google ученый
Рупп, М., фон Лилиенфельд, О. А. и Берк, К. Гостевая редакция: специальная тема по теоретической химии на основе данных. J. Chem. Phys. 148 , 241401 (2018).
PubMed Google ученый
Шнайдер В. Ф. и Го Х. Машинное обучение. J. Phys. Chem. A 122 , 879–879 (2018).
CAS PubMed Google ученый
фон Лилиенфельд, О. А. Квантовое машинное обучение в пространстве химических соединений. Angew. Chem. Int.Эд. 57 , 4164–4169 (2018).
Google ученый
Фриз, Дж. Г., Келли, Х. Р. и Батиста, В. С. Поиск катализаторов с помощью обратной схемы: искусственный интеллект, альпинисты и алхимики. Chem. Ред. 119 , 6595–6612 (2019).
CAS PubMed Google ученый
Ramakrishnan, R. et al. Большие данные соответствуют приближениям квантовой химии: подход Δ-машинного обучения. J. Chem. Теория вычисл. 11 , 2087–2096 (2015).
CAS PubMed Google ученый
Мардт А., Паскуали Л., Ву Х. и Ноэ Ф. Сети VAMPnets для глубокого изучения молекулярной кинетики. Nat. Commun. 9 , 5 (2018).
PubMed PubMed Central Google ученый
Рупп М., Ткаченко А., Мюллер К.-Р. & фон Лилиенфельд, О. А. Быстрое и точное моделирование энергий молекулярной атомизации с помощью машинного обучения. Phys. Rev. Lett. 108 , 058301 (2012).
PubMed Google ученый
Кортес К., Джекел Л. Д., Солла С. А., Вапник В. и Денкер Дж. С. в книге Advances in Neural Information Processing Systems . 327–334 (1994).
Ноэ, Ф. Машинное обучение для молекулярной динамики в долгосрочной перспективе.Препринт на arXiv https://arxiv.org/abs/1812.07669 (2018).
Ноэ, Ф., Олссон, С., Кёлер, Дж. И Ву, Х. Генераторы Больцмана: выборка состояний равновесия систем многих тел с глубоким обучением. Наука 365 , eaaw1147 (2019).
PubMed Google ученый
Fink, T., Bruggesser, H. & Reymond, J.-L. Виртуальное исследование маломолекулярной химической вселенной ниже 160 дальтон. Angew. Chem. Int. Эд. 44 , 1504–1508 (2005).
CAS Google ученый
Fink, T. & Reymond, J.-L. Виртуальное исследование химической вселенной до 11 атомов C, N, O, F: сборка 26,4 миллиона структур (110,9 миллиона стереоизомеров) и анализ новых кольцевых систем, стереохимии, физико-химических свойств, классов соединений и открытия лекарств. J. Chem. Инф. Модель. 47 , 342–353 (2007).
CAS PubMed Google ученый
Blum, L.C. & Reymond, J.-L. 970 миллионов малых молекул, похожих на лекарства, для виртуального скрининга в базе данных химической вселенной GDB-13. J. Am. Chem. Soc. 131 , 8732–8733 (2009).
CAS PubMed Google ученый
Ruddigkeit, L., van Deursen, R., Blum, L. & Reymond, J.-L.Перечисление 166 миллиардов органических малых молекул в базе данных химической вселенной GDB-17. J. Chem. Инф. Модель. 52 , 2684–2875 (2012).
Google ученый
Montavon, G. et al. Машинное обучение молекулярных электронных свойств в пространстве химических соединений. New J. Phys. 15 , 095003 (2013).
Google ученый
Рамакришнан Р., Драл П. О., Рупп М. и фон Лилиенфельд О. А. Квантовая химия: структуры и свойства 134 килограмм молекул. Sci. Данные 1 , 140022 (2014).
CAS PubMed PubMed Central Google ученый
Chmiela, S. et al. Машинное обучение точных энергосберегающих молекулярных силовых полей. Sci. Adv. 3 , e1603015 (2017).
PubMed PubMed Central Google ученый
Смит, Дж. С., Исаев, О. и Ройтберг, А. Е. ANI-1, Набор данных из 20 миллионов рассчитанных неравновесных конформаций для органических молекул. Sci. Данные 4 , 170193 (2017).
CAS PubMed PubMed Central Google ученый
Ong, S. et al. Материалы проекта. Материалы проекта http://materialsproject.org/ (2011).
Саал, Дж. Э., Кирклин, С., Aykol, M., Meredig, B. & Wolverton, C. Дизайн и открытие материалов с помощью функциональной теории высокой плотности: открытая база данных квантовых материалов (OQMD). JOM 65 , 1501–1509 (2013).
CAS Google ученый
Faber, F. A., Lindmaa, A., von Lilienfeld, O. A. & Armiento, R. Энергия машинного обучения 2 миллионов эльпасолита ( ABC 2 Д 6 ) кристаллов. Phys. Rev. Lett. 117 , 135502 (2016).
PubMed Google ученый
Барток А., Кермоде Дж., Бернштейн Н. и Чаньи Г. Машинное обучение универсального межатомного потенциала кремния. Phys. Ред. X. 8 , 041048 (2018).
Google ученый
Петтифор Д.Г. Строение бинарных соединений.I. Феноменологические структурные карты. J. Phys. C. Физика твердого тела. 19 , 285–313 (1986).
CAS Google ученый
Петтифор Д. Г. Структурные карты для псевдобинарных и тройных фаз. Mater. Sci. Technol. 4 , 675–691 (1988).
CAS Google ученый
Willatt, M. J., Musil, F. & Ceriotti, M.Оптимизация функций для атомистического машинного обучения приводит к построению периодической таблицы элементов на основе данных. Phys. Chem. Chem. Phys. 20 , 29661–29668 (2018).
CAS PubMed Google ученый
Фабер, Ф. А., Кристенсен, А. С., Хуанг, Б. и фон Лилиенфельд, О. А. Представление универсального квантового машинного обучения, основанное на алхимическом и структурном распределении. Дж.Chem. Phys. 148 , 241717 (2018).
PubMed Google ученый
Schütt, K. T., Sauceda, H. E., Kindermans, P.-J., Tkatchenko, A. & Müller, K.-R. SchNet – Архитектура глубокого обучения для молекул и материалов. J. Chem. Phys. 148 , 241722 (2018).
PubMed Google ученый
Bartók, A. et al.Машинное обучение объединяет моделирование материалов и молекул. Sci. Adv. 3 , e1701816 (2017).
PubMed PubMed Central Google ученый
Самптер Б. Г. и Ноид Д. В. Поверхности потенциальной энергии для макромолекул. Метод нейронной сети. Chem. Phys. Lett. 192 , 455–462 (1992).
CAS Google ученый
Хо, Т. С. и Рабитц, Х. Общий метод построения многомерных поверхностей потенциальной энергии молекул на основе расчетов ab initio . J. Chem. Phys. 104 , 2584–2597 (1996).
CAS Google ученый
Лоренц, С., Гросс, А. и Шеффлер, М. Представление многомерных поверхностей потенциальной энергии для реакций на поверхностях с помощью нейронных сетей. Chem. Phys. Lett. 395 , 210–215 (2004).
CAS Google ученый
Белер Дж. И Парринелло М. Обобщенное нейросетевое представление многомерных поверхностей потенциальной энергии. Phys. Rev. Lett. 98 , 146401 (2007).
PubMed Google ученый
Барток, А., Пейн, М.С., Кондор, Р. и Чаньи, Г. Потенциалы приближения Гаусса: точность квантовой механики без учета электронов. Phys. Rev. Lett. 104 , 136403 (2010).
PubMed Google ученый
Белер, Дж. Перспектива: возможности машинного обучения для атомистического моделирования. J. Chem. Phys. 145 , 170901 (2016).
PubMed Google ученый
Hansen, K. et al. Оценка и проверка методов машинного обучения для прогнозирования энергии молекулярной атомизации. J. Chem. Теория вычисл. 9 , 3404–3419 (2013).
CAS PubMed Google ученый
Рамакришнан Р. и фон Лилиенфельд О. А. Многие молекулярные свойства из одного ядра в химическом пространстве. CHIMIA 69 , 182–186 (2015).
CAS PubMed Google ученый
Pilania, G., Wang, C., Jiang, X., Раджасекаран, С. & Рампрасад, Р. Ускорение прогнозирования свойств материалов с помощью машинного обучения. Sci. Отчет 3 , 2810 (2013).
PubMed PubMed Central Google ученый
Schütt, K. et al. Как представить кристаллические структуры для машинного обучения: к быстрому предсказанию электронных свойств. Phys. Ред. B 89 , 205118 (2014).
Google ученый
Meredig, B. et al. Комбинаторный отбор новых материалов в неограниченном композиционном пространстве с помощью машинного обучения. Phys. Ред. B 89 , 094104 (2014).
Google ученый
Ward, L. et al. Включение атрибутов кристаллической структуры в модели машинного обучения энергий формаций с помощью мозаики Вороного. Phys. Ред. B 96 , 024104 (2017).
Google ученый
Се, Т. и Гроссман, Дж. С. Сверточные нейронные сети с кристаллическим графом для точного и интерпретируемого предсказания свойств материалов. Phys. Rev. Lett. 120 , 145301 (2018).
CAS PubMed Google ученый
Пайзер-Кнапп, Э. О., Ли, К. и Аспуру-Гузик, А. Уроки Гарвардского проекта чистой энергии: использование нейронных сетей для ускорения открытия материалов. Adv.Funct. Матер. 25 , 6495–6502 (2015).
CAS Google ученый
Йоргенсен, М. С., Ларсен, У. Ф., Якобсен, К. В. и Хаммер, Б. Исследование и эксплуатация в глобальной оптимизации атомистической структуры. J. Phys. Chem. A 122 , 1504–1509 (2018).
PubMed Google ученый
Chmiela, S., Sauceda, H.Э., Полтавский И., Мюллер К.-Р. & Ткаченко, А. sGDML: Построение точных и эффективных данных молекулярных силовых полей с использованием машинного обучения. Comput. Phys. Commun. 240 , 38–45 (2019).
CAS Google ученый
Хуанг Б. и фон Лилиенфельд О. А. Коммуникация: понимание молекулярных представлений в машинном обучении: роль уникальности и сходства целей. J. Chem. Phys. 145 , 161102 (2016).
PubMed Google ученый
Пронобис В., Ткаченко А. и Мюллер К.-Р. Многочастичные дескрипторы для предсказания молекулярных свойств с помощью машинного обучения: анализ парных и трехчастичных взаимодействий в молекулах. J. Chem. Теория вычисл. 14 , 2991–3003 (2018).
CAS PubMed Google ученый
Браун М. Л., Бухманн Дж. М. и Мюллер К. Р. О соответствующих измерениях в пространствах признаков ядра. J. Mach. Учиться. Res. 9 , 1875–1906 (2008).
Google ученый
фон Лилиенфельд, О. А., Рамакришнан, Р., Рупп, М. и Кнолл, А. Ряд Фурье функций радиального распределения атомов: молекулярный отпечаток для моделей машинного обучения квантово-химических свойств. Внутр. J. Quantum Chem. 115 , 1084–1093 (2015).
Google ученый
Кристенсен А. С., Фабер Ф. А. и фон Лилиенфельд О. А. Операторы в квантовом машинном обучении: свойства отклика в химическом пространстве. J. Chem. Phys. 150 , 064105 (2019).
PubMed Google ученый
Барток, А., Кондор, Р. и Чаньи, Г. О представлении химической среды. Phys. Ред. B 87 , 184115 (2013).
Google ученый
Хансен, К., Биглер, Ф., фон Лилиенфельд, О.А., Мюллер, К.-Р. & Ткаченко, А. Прогнозирование молекулярных свойств машинным обучением: точные многочастичные потенциалы и нелокальность в химическом пространстве. J. Phys. Chem. Lett. 6 , 2326–2331 (2015).
CAS PubMed PubMed Central Google ученый
Фабер Ф., Линдмаа А., фон Лилиенфельд О. А. и Армиенто Р. Представления кристаллической структуры для моделей машинного обучения энергий формации. Внутр. J. Quantum Chem. 115 , 1094–1101 (2015).
CAS Google ученый
Хо, Х. и Рупп, М. Унифицированное представление для машинного обучения молекул и кристаллов. Препринт на arXiv https://arxiv.org/abs/1704.06439 (2017).
Schütt, K. T., Arbabzadah, F., Chmiela, S., Müller, K. R. & Tkatchenko, A. Квантово-химические исследования из глубоких тензорных нейронных сетей. Nat. Commun. 8 , 13890 (2017).
PubMed PubMed Central Google ученый
Унке, О. Т. и Мьюли, М. Реактивная, масштабируемая и переносимая модель молекулярной энергии из нейросетевого подхода, основанного на локальной информации. J. Chem. Phys. 148 , 241708 (2018).
PubMed Google ученый
Зубатюк, Р., Смит, Дж. С., Лещинский, Дж. И Исаев, О. Точное и переносимое многозадачное предсказание химических свойств с помощью нейронной сети «атомы в молекулах». Sci. Adv. 5 , eaav6490 (2019).
PubMed PubMed Central Google ученый
Снайдер, Дж. К., Рупп, М., Хансен, К., Мюллер, К.-Р. И Берк К. Нахождение функционалов плотности с помощью машинного обучения. Phys. Rev. Lett. 108 , 253002 (2012).
PubMed Google ученый
Карлео Г. и Тройер М. Решение квантовой задачи многих тел с помощью искусственных нейронных сетей. Наука 355 , 602–606 (2017).
CAS PubMed Google ученый
Brockherde, F., Li, L., Tuckerman, M. E., Burke, K. & Müller, K.-R. Обход уравнений Кона – Шэма с помощью машинного обучения. Nat. Commun. 8 , 872 (2017).
PubMed PubMed Central Google ученый
Schütt, K., Gastegger, M., Tkatchenko, A., Müller, K.-R. И Маурер, Р. Объединение машинного обучения и квантовой химии с глубокой нейронной сетью для молекулярных волновых функций. Nat.Commun. 10 , 5024 (2019).
PubMed PubMed Central Google ученый
Фабрицио А., Грисафи А., Мейер Б., Чериотти М. и Корминбёф К. Обучение нековалентных систем с помощью электронной плотности. Chem. Sci. 10 , 9424–9432 (2019).
CAS PubMed PubMed Central Google ученый
Hermann, J., Schätzle, Z. & Noé, F. Решение электронного уравнения Шредингера с помощью глубокой нейронной сети. Препринт на arXiv https://arxiv.org/abs/1909.08423 (2019).
Pfau, D., Spencer, J. S. de A., Matthews, G. G. & Foulkes, W. M. C. Решение ab-initio многоэлектронного уравнения Шредингера с глубокими нейронными сетями. Препринт на arXiv https://arxiv.org/abs/1909.02487 (2019).
Behler, J. Построение многомерных потенциалов нейронной сети: обзор учебного пособия. Внутр. J. Quantum Chem. 115 , 1032–1050 (2015).
CAS Google ученый
Шапеев А. Тензорные потенциалы моментов: класс систематически улучшаемых межатомных потенциалов. Мультимасштабная модель. Simul. 14 , 1153–1173 (2016).
Google ученый
Соседа, Х. Э., Хмела, С., Полтавский, И., Мюллер, К.-Р. & Ткаченко, А. Молекулярные силовые поля с машинным обучением в градиентной области: построение и приложение к динамике малых молекул со связанными кластерными силами. J. Chem. Phys. 150 , 114102 (2019).
PubMed Google ученый
Deringer, V. L. et al. Вычислительная химия поверхности тетраэдрического аморфного углерода путем объединения машинного обучения и теории функционала плотности. Chem.Матер. 30 , 7438–7445 (2018).
CAS Google ученый
Каро, М. А., Аарва, А., Дерингер, В. Л., Чаньи, Г. и Лаурила, Т. Реакционная способность аморфных углеродных поверхностей: рационализация роли структурных мотивов в функционализации с использованием машинного обучения. Chem. Матер. 30 , 7446–7455 (2018).
CAS PubMed PubMed Central Google ученый
Chmiela, S., Sauceda, H.E., Müller, K.-R. & Ткаченко, А. К точному моделированию молекулярной динамики с машинным обучением силовых полей. Nat. Commun. 9 , 3887 (2018).
PubMed PubMed Central Google ученый
Смит, Дж. С., Исаев, О. и Ройтберг, А. Е. ANI-1: расширяемый потенциал нейронной сети с точностью DFT при стоимости вычислений силового поля. Chem. Sci. 8 , 3192–3203 (2017).
CAS PubMed PubMed Central Google ученый
Коллинз, К. Р., Гордон, Г. Дж., Фон Лилиенфельд, О. А. и Ярон, Д. Дж. Дескрипторы постоянного размера для точных моделей машинного обучения молекулярных свойств. J. Chem. Phys. 148 , 241718 (2018).
PubMed Google ученый
Чен, X., Йоргенсен, М.С., Ли, Дж. И Хаммер, Б. Атомные энергии из сверточной нейронной сети. J. Chem. Теория вычисл. 14 , 3933–3942 (2018).
CAS PubMed Google ученый
Пилания, Г., Губернатис, Дж. Э. и Лукман, Т. Модели машинного обучения с множественной точностью для точного прогнозирования запрещенной зоны твердых тел. Comput. Матер. Sci. 129 , 156–163 (2017).
CAS Google ученый
Заспель, Б., Хуанг, Х., Харбрехт и фон Лилиенфельд, О.А. Повышение качества моделей квантового машинного обучения с помощью многоуровневой комбинированной техники: пересмотр диаграмм Попла. J. Chem. Теория вычисл. 15 , 1546–1559 (2018).
Google ученый
Батра, Р., Пилания, Г., Уберуага, Б. и Рампрасад, Р.Слияние информации о разнообразии с машинным обучением: тематическое исследование энергий образования примесей в гафнии. ACS Appl. Матер. Интерфейсы 11 , 24906–24918 (2019).
CAS PubMed Google ученый
Рупп М., Рамакришнан Р. и фон Лилиенфельд О. А. Машинное обучение квантово-механических свойств атомов в молекулах. J. Phys. Chem. Lett. 6 , 3309–3313 (2015).
CAS Google ученый
Боту В. и Рампрасад Р. Адаптивная структура машинного обучения для ускорения ab initio молекулярной динамики. Внутр. J. Quantum Chem. 115 , 1074–1083 (2015).
CAS Google ученый
Якобсен, Т. Л., Йоргенсен, М. С. и Хаммер, Б. Машинное обучение на лету атомного потенциала в оптимизации структуры теории функционала плотности. Phys. Rev. Lett. 120 , 026102 (2018).
CAS PubMed Google ученый
Christensen, A. S. et al. QML: набор инструментов Python для квантового машинного обучения. GitHub https://github.com/qmlcode/qml (2017).
Schütt, K. et al. SchNetPack: набор инструментов глубокого обучения для атомистических систем. J. Chem. Теория вычисл. 15 , 448–455 (2018).
PubMed Google ученый
Alber, M. et al. iNN исследуйте нейронные сети! J. Mach. Учиться. Res. 20 , 1–8 (2019).
Google ученый
Lapuschkin, S. et al. Разоблачение предсказателей Умного Ганса и оценка того, чему на самом деле учатся машины. Nat. Commun. 10 , 1096 (2019).
PubMed PubMed Central Google ученый
Binder, A. et al. На пути к компьютерной флуоресцентной микроскопии: интегрированное прогнозирование морфологических и молекулярных профилей опухолей на основе машинного обучения. Препринт на arXiv https://arxiv.org/abs/1805.11178 (2018).
Gómez-Bombarelli, R. et al. Автоматический химический дизайн с использованием непрерывного представления молекул на основе данных. САУ Cent. Sci. 4 , 268–276 (2018).
PubMed PubMed Central Google ученый
Зунгер А. Обратный дизайн в поисках материалов с целевыми функциональными возможностями. Nat. Rev. Chem. 2 , 0121 (2018).
CAS Google ученый
Кун, С. и Бератан, Д. Н. Обратные стратегии молекулярного дизайна. J. Phys. Chem. 100 , 10595–10599 (1996).
CAS Google ученый
von Lilienfeld, O.А., Линс, Р. и Ротлисбергер, У. Подход с использованием вариационного числа частиц для рационального проектирования соединений. Phys. Rev. Lett. 95 , 153002 (2005).
Google ученый
Ван, М., Ху, X., Бератан, Д. Н. и Янг, В. Конструирование молекул путем оптимизации потенциалов. J. Am. Chem. Soc. 128 , 3228–3232 (2006).
CAS PubMed Google ученый
д’Авезак М. и Зунгер А. Определение атомной конфигурации с минимальной энергией на решетке: ламарковский поворот в дарвиновской эволюции. Phys. Ред. B 78 , 064102 (2008).
Google ученый
Bach, S. et al. О попиксельных объяснениях решений нелинейного классификатора путем послойного распространения релевантности. PLoS One 10 , e0130140 (2015).
PubMed PubMed Central Google ученый
Ribeiro, M. T., Singh, S. & Guestrin, C. in Proc. 22-я ACM SIGKDD Int. Конф. Знание Discov. Data Mining 1135–1144 (ACM, 2016).
Montavon, G., Samek, W. & Müller, K.-R. Методы интерпретации и понимания глубоких нейронных сетей. Цифровой сигнал. Процесс. 73 , 1–15 (2018).
Google ученый
Хиршфельд Ф. Л. Фрагменты связанных атомов для описания плотностей зарядов молекул. Теор. Чим. Acta. 44 , 129–138 (1977).
CAS Google ученый
Lee, A. A. et al. Биологическая активность лиганда прогнозируется путем очистки положительных и отрицательных химических корреляций. Proc. Natl Acad. Sci. США 116 , 3373–3378 (2019).
CAS PubMed Google ученый
Хом, У. Дипольная поляризуемость и энергия диссоциации связи. J. Chem. Phys. 101 , 6362–6364 (1994).
CAS Google ученый
Хом, У. Существует ли принцип минимальной поляризуемости в химических реакциях? J. Phys. Chem. A. 104 , 8418–8423 (2000).
Google ученый
Герлингс П., Де Профт Ф. и Лангенекер В. Концептуальная теория функционала плотности. Chem. Ред. 103 , 1793–1874 (2003).
CAS PubMed Google ученый
Deng, J. et al. в Proc. IEEE Conf. Comput. Распознавание образов зрения. 248–255 (IEEE, 2009).
Rohrbach, M., Amin, S., Andriluka, M. & Schiele, B.in Proc. IEEE Conf. Comput. Распознавание образов зрения. 1194–1201 (IEEE, 2012).
Schwaighofer, A., Schroeter, T., Mika, S. и Blanchard, G. Как мы можем ошибаться? Обзор подходов к машинному обучению и планок погрешностей. Расческа. Chem. Экран с высокой пропускной способностью. 12 , 453–468 (2009).
CAS PubMed Google ученый
Смит Р. К. Количественная оценка неопределенности: теория, реализация и приложения (SIAM, 2013).
Смит, Дж. С., Небген, Б., Любберс, Н., Исаев О. и Ройтберг А. Э. Меньше значит больше: выборка химического пространства при активном обучении. J. Chem. Phys. 148 , 241733 (2018).
PubMed Google ученый
Губаев К., Подрябинкин Е. В., Шапеев А. В. Машинное обучение молекулярных свойств: локальность и активное обучение. J. Chem. Phys. 148 , 241727 (2018).
PubMed Google ученый
Сугияма М. и Каванабе М. Машинное обучение в нестационарных средах: введение в адаптацию ковариатного сдвига (MIT Press, 2012).
Faber, F. A. et al. Ошибки предсказания моделей молекулярного машинного обучения ниже, чем ошибка гибридного ДПФ. J. Chem. Теория вычисл. 13 , 5255–5264 (2017).
CAS PubMed Google ученый
Рамакришнан, Р., Хартманн, М., Тапавича, Э. и фон Лилиенфельд, О. А. Электронные спектры от TDDFT и машинного обучения в химическом пространстве. J. Chem. Phys. 143 , 084111 (2015).
PubMed Google ученый
Pronobis, W., Schütt, K. T., Tkatchenko, A. & Müller, K.-R. Получение интенсивных и обширных молекулярных свойств DFT / TDDFT с помощью машинного обучения. Eur. Phys. J. B 91 , 178 (2018).
Google ученый
Grisafi, A. et al. Переносимая модель машинного обучения электронной плотности. САУ Cent. Sci. 5 , 57–64 (2019).
CAS PubMed Google ученый
Лоуренс, С. и Джайлз, К. Л. Доступность информации в Интернете. Природа 400 , 107 (1999).
CAS PubMed Google ученый
Лоуренс, С. и Джайлз, К. Л. Поиск во всемирной паутине. Science 280 , 98–100 (1998).
CAS PubMed Google ученый
Гинзбург И. и Хорн Д. в книге «Достижения в системах обработки нейронной информации» (ред. Джордан М. И., ЛеКун Ю. и Солла С. А.) 224–231 (MIT Press, 1994).
Богоески, М., Фогт-Маранто, Л., Такерман, М. Э., Мюллер, К.-Р. И Берк, К. Функционалы плотности с квантово-химической точностью: от машинного обучения до молекулярной динамики. Препринт на ChemRxiv https://doi.org/10.26434/chemrxiv.8079917.v1 (2019).
Smith, J. S. et al. Приближение к точности связанного кластера с потенциалом нейронной сети общего назначения с помощью трансферного обучения. Nat. Commun. 10 , 2903 (2019).
PubMed PubMed Central Google ученый
Улисси З. В., Сингх А. Р., Цай К. и Норсков Дж. К. Автоматическое обнаружение и построение фазовых диаграмм поверхности с использованием машинного обучения. J. Phys. Chem. Lett. 19 , 3931–3935 (2016).
Google ученый
Мейер, Б., Саватлон, Б., Хайнен, С., фон Лилиенфельд, О. А., Корминбёф, К. Машинное обучение встречается с сюжетами вулканов: открытие с помощью вычислений катализаторов кросс-сочетания. Chem.Sci. 9 , 7069–7077 (2018).
CAS PubMed PubMed Central Google ученый
Кори, Э. Дж., Випке, У. Т., Крамер, Р. Д. и Хоу, У. Дж. Компьютерный синтетический анализ. легкая человеко-машинная связь химической структуры с помощью интерактивной компьютерной графики. J. Am. Chem. Soc. 94 , 421–430 (1972).
CAS Google ученый
Herges, R. & Hoock, C. Планирование реакции: компьютерное открытие новой реакции элиминации. Наука 255 , 711–713 (1992).
CAS PubMed Google ученый
Szymkuć, S. et al. Компьютерное синтетическое планирование: конец начала. Angew. Chem. Int. Эд. 55 , 5904–5937 (2016).
Google ученый
Schwaller, T., Gaudin, D., Lanyi, C., Bekas & Laino, T. «Найдено в переводе»: прогнозирование результатов сложных реакций органической химии с использованием нейронных моделей последовательности-последовательности. Chem. Sci. 9 , 6091–6098 (2018).
CAS PubMed PubMed Central Google ученый
Сеглер, М. Х. С., Прейс, М. и Уоллер, М. П. Планирование химического синтеза с помощью глубоких нейронных сетей и символического ИИ. Природа 555 , 604–610 (2018).
CAS PubMed Google ученый
Лич, А. Р. Молекулярное моделирование: принципы и применение (Аддисон-Уэсли Лонгман, 1998).
Хелгакер Т., Йоргенсен П. и Олсен Дж. Теория молекулярной электронной структуры (Wiley, 2000).
Такерман М.Э. Статистическая механика: теория и молекулярное моделирование (Oxford Univ.Press, 2010).
Pozun, Z. D. et al. Оптимизация переходных состояний с помощью машинного обучения на основе ядра. J. Chem. Phys. 136 , 174101–174109 (2012).
PubMed Google ученый
Раппе, А. К., Касевит, К. Дж., Колвелл, К. С., Годдард, В. А. III и Скид, В. М. UFF, силовое поле с полной периодической таблицей для молекулярной механики и моделирования молекулярной динамики. Дж.Являюсь. Chem. Soc. 114 , 10024–10035 (1992).
Google ученый
Стюарт, Дж. Дж. П. Оптимизация параметров полуэмпирических методов. V: Модификация аппроксимаций NDDO и их применение к 70 элементам. J. Mol. Модель. 13 , 1173–1213 (2007).
CAS PubMed PubMed Central Google ученый
Стюарт, Дж.Дж. П. Оптимизация параметров для полуэмпирических методов VI: дополнительные модификации приближений NDDO и повторная оптимизация параметров. J. Mol. Модель. 19 , 1–32 (2013).
CAS PubMed Google ученый
Aradi, B., Hourahine, B. & Frauenheim, T. DFTB +, реализация метода DFTB на основе разреженных матриц. J. Phys. Chem. A 111 , 5678–5684 (2007).
CAS PubMed Google ученый
Мариенвальд, Х., Пронобис, В., Мюллер, К.-Р. & Накадзима, С. Жесткие границы возрастающих деревьев покрытия для динамической диверсификации. Препринт на arXiv https://arxiv.org/abs/1806.06126 (2018).
Gilmer, J., Schoenholz, S. S., Riley, F., Vinyals, O. & Dahl, G.E. in Proc. Int. Конф. Мах. Учиться. 1263–1272 (2017).
Nebgen, B. et al. Переносимое динамическое распределение молекулярного заряда с использованием глубоких нейронных сетей. J. Chem. Теория вычисл. 14 , 4687–4698 (2018).
CAS PubMed Google ученый
Эйкенберг, М., Экзархакис, Г., Хирн, М., Маллат, С. и Тири, Л.

 Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.


 Его сжатая структурная формула — ClSSCl.
Его сжатая структурная формула — ClSSCl. Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно правилам для органических соединений, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно правилам для органических соединений, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N. Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что существует четыре фрагмента CH 2 , связанных вместе.
Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что существует четыре фрагмента CH 2 , связанных вместе.