Гидрокарбонаты (мг/л) в питьевой бутилированной воде
, чтобы получить бонусные баллы
0Ваша корзина
Каталог товаров
- Комбо-наборы
- Вода питьевая
- Нурлы
- Вода минеральная
- Заповедник Здоровья
- Борская
- Кубай
- Пилигрим
- Безалкогольные напитки
- Тайфун
- Джуси
- Слапс
- Потому что
- Аскания
- Калинов Родник
- Квас
- Чай
- Иван чай
- Кулеры для воды
- Помпы для воды
- Подписка на воду
- Вода в школу
- Вода домой
- Акции и скидки
Новости
Статьи
Подпишитесь на новости
Гидрокарбонаты – это неорганические соли, диссоциирующие в воде на катионы металлов и анионы НСО3—. В связи с тем, что в анионе присутствует атом водорода, такие соли называются кислыми. В природной воде присутствуют в основном гидрокарбонаты кальция и магния. Карбонаты металлов относятся к средним или нормальным солям, характеризуются маленькой растворимостью. Концентрация карбонатов в растворе минимальна. Угольная кислота характеризуется слабокислыми свойствами. При обменных реакциях с водой соли угольной кислоты и щелочноземельных металлов образуют щелочную среду. Защелачивание организма вызывает неприятные последствия. Вследствие этого концентрация солей угольной кислоты регулярно контролируется.
Карбонаты металлов относятся к средним или нормальным солям, характеризуются маленькой растворимостью. Концентрация карбонатов в растворе минимальна. Угольная кислота характеризуется слабокислыми свойствами. При обменных реакциях с водой соли угольной кислоты и щелочноземельных металлов образуют щелочную среду. Защелачивание организма вызывает неприятные последствия. Вследствие этого концентрация солей угольной кислоты регулярно контролируется.
Применение карбонатов
Нормальные соли угольной кислоты и щелочноземельных металлов в виде природного сырья используются в строительном деле для производства цементов, вяжущих смесей. Известные ископаемые: известняк, магнезит, витерит применяются для получения огнеупорных материалов. Под действием воды и атмосферного углекислого газа средние соли угольной кислоты легко преобразуются в гидрокарбонаты. После нагревания карбонаты превращаются в оксиды, которые обладают высокой термоустойчивостью.
Соли угольной кислоты используются на химических производствах, в коммунальных хозяйствах для нейтрализации промышленных стоков, загрязненных кислотами.
Кислые и средние карбонаты щелочных металлов известны под названием сода. При хлебопечении, в кондитерском производстве, разлагаясь с выделением диоксида углерода, они разрыхляют тесто, улучшают качество изделий.
Содержание в воде. Методы контроля
Концентрация минеральных солей в питьевой воде оказывает существенное влияние на метаболизм в организме человека. Соли угольной кислоты определяют показатели щелочности. Сдвиг значения рН в сторону увеличения изменяет скорость и направление обменных процессов. Оптимальная концентрация гидрокарбонатов, которые долгое время называли бикарбонатами, для благополучного функционирования физиологических процессов составляет минимум 30 мг/л, максимум – 400 мг/л. Вода со значениями концентраций в указанном диапазоне считается полноценной.
В бутилированной воде допускается содержание гидрокарбонатов в верхнем пределе диапазона, 400 мг/л. Расфасованная вода высшей категории подвергается более глубокой очистке, характеризуется содержанием гидрокарбонатов, полностью соответствующим нормам полноценности, от 30 мг/л до 400 мг/л. Регламентируемые показатели зафиксированы в СанПиН 2.1.4.1116-02.
Регламентируемые показатели зафиксированы в СанПиН 2.1.4.1116-02.
Контроль концентраций солей угольной кислоты осуществляют по методикам ГОСТ 31957—2012, соответствующим международным подходам к определению щелочности. В основе определения лежит титриметрический метод, осуществляемый в два этапа. На первой стадии фиксируется точка оттитровывания карбонат-ионов при рН, равном 8,3. На втором этапе определяют общую щелочность при значении рН=4,5. Титрование можно контролировать по изменению цвета индикаторов или потенциометрически. Для фиксирования скачка значения рН на первой стадии используют фенолфталеин, на второй – метиловый оранжевый.
Расчет полученных показателей по формулам, приведенным в стандарте, позволяет получить полную информацию о содержании гидрокарбонатов в воде.
Влияние на здоровье человека
Для всех живых систем, в том числе организма человека, характерно постоянство среды. Это состояние называется гомеостазом, поддерживается естественными веществами буферного действия.
Изменение щелочности физиологических растворов: желудочного сока, лимфатической жидкости, крови и др, вызывает дисбаланс во всех метаболических процессах. В результате нарушается работа ферментов, ухудшается проницаемость мембран, наблюдаются комплексные изменения.
Возможные проявления могут наблюдаться в нарушениях работы пищевого тракта, сосудистой системы, слизистых оболочек и кожных покровов.
Источники загрязнения воды
Гидрокарбонаты – это естественные природные компоненты воды, попадающие туда из минералов, почвы. Избыточное содержание карбонатов может обнаруживаться в специфических геологических регионах, для которых характерна повышенная жесткость воды. Часто эти районы тесно прилегают к месторождениям известняка.
Техногенное повышение концентрации гидрокарбонатов может наблюдаться в местах расположения комплексов, производящих цемент, другие строительные материалы.
Защитить себя от всех рисков можно воспользовавшись службой доставки бутилированной воды.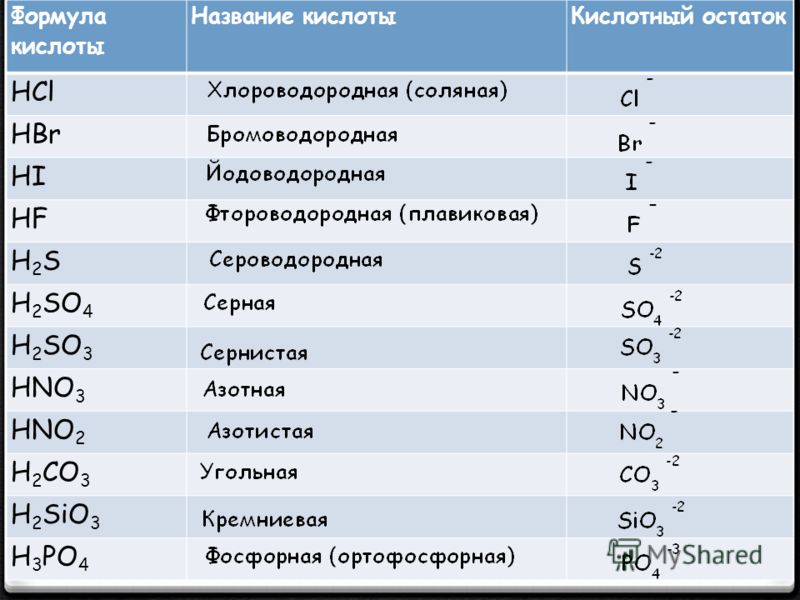 #ЗнайЧтоПьешь и будь здоров!
#ЗнайЧтоПьешь и будь здоров!
Популярные товары:
В наличии
В наличии
В наличии
Популярные темы блога
ЗдоровьеПитьевая водаДоставка водыКвасБеременностьНурлыАнализ водыДетиСахарВода 19лОбезвоживаниеВодопроводная водаХимический состав водыОкрошкаДиабетБизнесРецептыИван-чайВода НурлыКвас НурлыКешьюОбзор ценМагнийЧайАспартамМасалаЧерносливМедПомпы для водыМинеральная водаБразильский орехНовости НурлыТара 19лФильтры для воды
Принимаем заказы на сайте 24/7
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения
Вкл.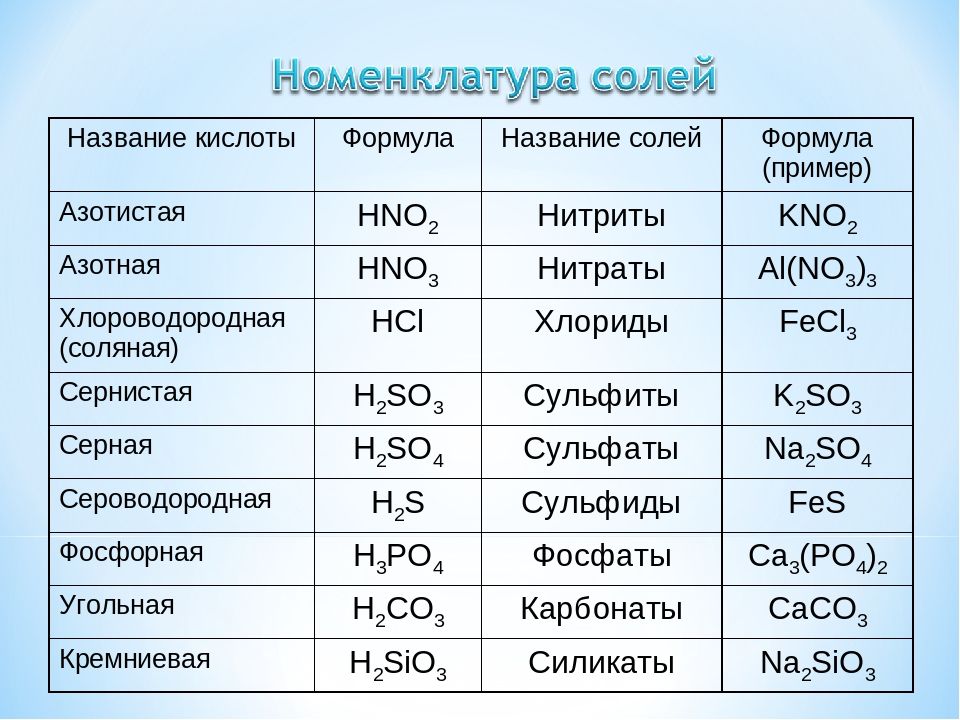 Выкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
7 фактов, которые должны знать новички! —
В этой статье мы должны обсудить HCO3-кислота или основание и подробные факты.
HCO3-кислота или основание здесь в центре внимания, это оксоанион углерода, называемый бикарбонатом. Бикарбонат является сопряженным основанием угольной кислоты. Обычно HCO3- ведет себя как основание, но в некоторых условиях может действовать и как кислота.
Конденсатор и емкость | Лучшие 2…
Пожалуйста, включите JavaScript
Конденсатор и емкость | Лучший 2022
В бикарбонатной структуре атом C присоединен двумя группами O и одной группой -OH. Оба атома O связаны двойной связью с атомом C, а группа OH присоединена одинарной связью, поэтому отрицательный заряд находится только на C. Этот отрицательный заряд играет важную роль в кислотно-щелочной химии бикарбоната.
Некоторые факты о HCO 3 – Бикарбонат – ковалентный молекулярный анион, центральный атом C – sp 2 гибридизован и, как правило, имеет слабоосновную природу.
В бикарбонате присутствуют две π-связи и две сигма-связи, а также отрицательный заряд. Он частично растворим в воде, но более растворим в любом органическом растворе. Наличие группы -ОН делает его основным, и благодаря наличию двух двойных связей мы можем рассчитать его pK a по шкале Полинга по формуле 8-5p, , где p — количество кетонового кислорода.
HCO3-кислота или основание в водеКислотно-основное поведение любых веществ в воде зависит от высокой энтальпии гидратации протона.
В воде ион бикарбоната реагирует с образованием слабой кислоты и иона гидроксида. Из-за образования сильноосновного гидроксида весь раствор является основным по своей природе и дает протон, образуя угольную кислоту. В равновесии концентрация гидроксид-иона выше, и тогда бикарбонат ведет себя как основание в воде.
HCO 3 – + H 2 O = H 2 CO 3 + OH –
9000 , поэтому основность раствора зависит от ОН – .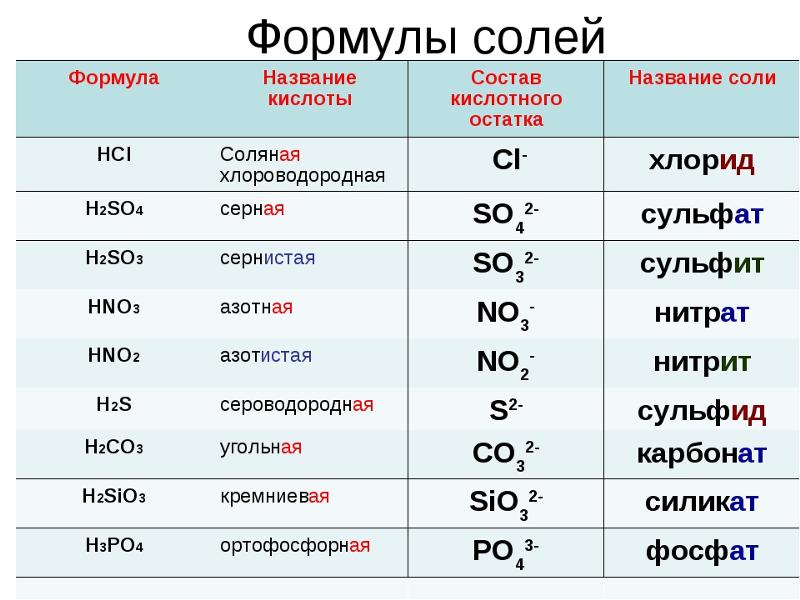
В 1923 году Бренстед и Лоури предложили концепцию кислотно-основных частиц, согласно их концепции, частицы, выделяющие протон, являются кислотами Бренстеда, и любые частицы склонны принимать протон в качестве основания Бренстеда.
Исходя из этого, мы можем заключить, что любые частицы, отдающие водород, будут кислотой Бренстеда, и аналогичным образом любые частицы, акцептор водорода, будут основанием Бренстеда.
Итак, мы сначала проверяем ион бикарбоната на его водородную донорную или принимающую природу, а затем классифицируем его по кислоте Бренстеда или основанию Бренстеда. В водном растворе проверяем HCO 3 – кислота или основание.
HCO 3 – + H 2 O = H 3 O + + CO 3 2-
Из приведенного выше уравнения видно, что когда бикарбонат реагирует с водой, он производит ион гидроксония, отдавая свой протон.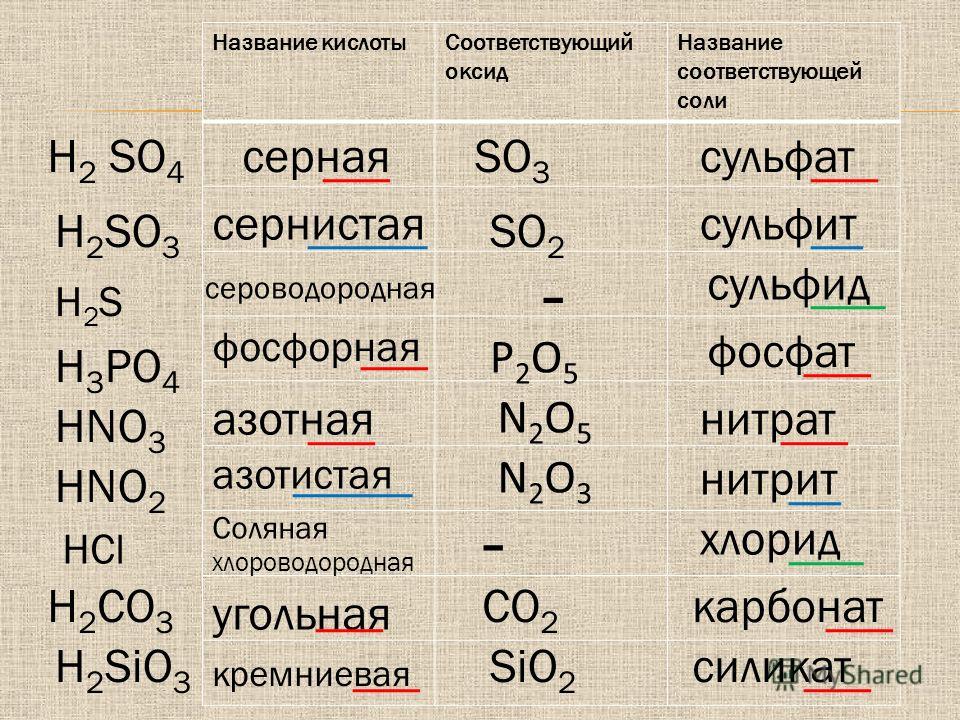 Итак, бикарбонат представляет собой кислоту Бренстеда, поскольку он отдает протон и также делает раствор кислым, поскольку ион гидроксония по своей природе более кислый.
Итак, бикарбонат представляет собой кислоту Бренстеда, поскольку он отдает протон и также делает раствор кислым, поскольку ион гидроксония по своей природе более кислый.
Льюис предложил теорию кислотно-основного характера любых веществ по их электронной структуре. По его словам, любое вещество, которое может принимать электроны или особенно неподеленные пары для образования ковалентной связи, называется кислотой Льюиса, а любое вещество, которое отдает пары электронов, точнее, неподеленные пары, для образования ковалентной связи, называется основанием Льюиса.
Итак, кислота Льюиса содержит пустую орбиталь для приема электронов, а основание Льюиса должно содержать неподеленные пары. Действительно, в кислотно-основной концепции Льюиса электроны переносят ВЗМО основания Льюиса на НВМО кислоты Льюиса.
Чтобы понять кислотно-основную концепцию бикарбоната по Льюису, мы должны рассмотреть наличие у него пустой орбитали или наличие неподеленных пар бикарбоната.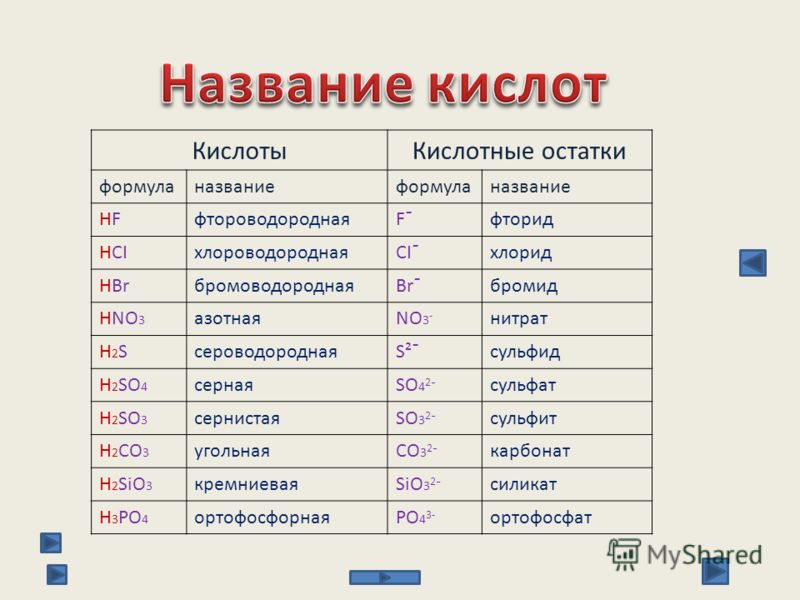 Прежде всего, мы должны проверить его резонансную структуру Льюиса.
Прежде всего, мы должны проверить его резонансную структуру Льюиса.
Из резонирующей структуры бикарбоната видно, что существует четыре пары неподеленных пар, доступных для бикарбоната, которые могут отдавать кислород в любое время только посредством резонанса, и отрицательный заряд над углеродом также передается. Нет свободных орбиталей, доступных для принятия электронов.
Суммирование веществ будет вести себя как основание Льюиса- Молекула имеет больше электронов, чем ее октет.
- Центральный атом должен быть неметаллическим или менее электроотрицательным
- Молекула или ион, которые способны отдавать пару электронов путем перегруппировки своих валентных электронов посредством резонанса.
- Имея делокализованную систему π электронов
- Центральный атом многих молекул может быть поляризуемым.
Все вышеуказанные критерии соответствуют бикарбонат-иону. Итак, бикарбонат ведет себя как основание Льюиса.
Итак, бикарбонат ведет себя как основание Льюиса.
Сопряженными кислотно-основными парами часто называют любые соединения, отличающиеся друг от друга степенью переносимости протонов .
Чем выше способность любого вида отдавать протон в определенной среде, тем выше будет его кислотность в этой конкретной среде. Опять же, мы можем сказать, что соответствующее сопряженное основание сильной кислоты является слабым по своей природе. Итак, соответствующая сопряженная кислота сильного основания является слабой по своей природе.
На кислотно-щелочной характер также влияет тип используемого растворителя. Потому что в определенной среде взаимодействие сопряженной кислотно-основной пары различно, и в зависимости от этого взаимодействия мы можем классифицировать природу сопряженной кислотно-основной пары.
Для ионов бикарбоната, сопряженных кислотных оснований следует рассматривать водную среду.
HCO 3 – легко принимает протон из воды и образует угольную кислоту, следует учитывать равновесие.
Бикарбонат в качестве сопряженного основанияВ приведенном выше уравнении мы видим, что равновесие больше смещено влево, поэтому образование угольной кислоты не так вероятно. Угольная кислота является слабой кислотой, поскольку она является органической кислотой, поэтому соответствующее ей основание, бикарбонат, является более основным по своей природе.
Таким образом, HCO 3 – является сильным сопряженным основанием.
Опять же, рассмотрим другую реакцию, где бикарбонат может отщеплять от себя протон, процесс не столь благоприятен, так как С здесь более отрицательно заряжен, и отщепление еще одного атома от этой молекулы более трудный процесс. Таким образом, равновесие всегда больше в обратном направлении.
Бикарбонат в виде сопряженной кислоты Здесь сценарий отличается от предыдущего.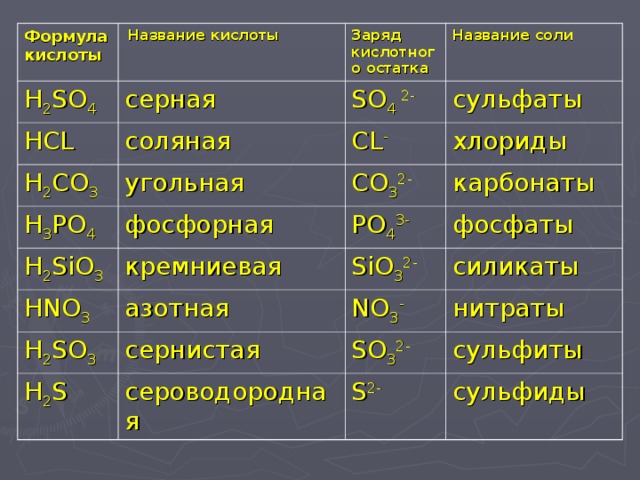 После отдачи протона бикарбонат переходит в карбонат-ион, а карбонат является более сильным основанием, чем сам бикарбонат. Таким образом, здесь образование сильного сопряженного основания означает, что бикарбонат является слабой кислотой.
После отдачи протона бикарбонат переходит в карбонат-ион, а карбонат является более сильным основанием, чем сам бикарбонат. Таким образом, здесь образование сильного сопряженного основания означает, что бикарбонат является слабой кислотой.
Таким образом, мы можем заключить, что бикарбонат может демонстрировать сопряженную кислотно-основную пару, где его сопряженным основанием является бикарбонат, который является сильным основанием, а сопряженной кислотой является угольная кислота, которая является слабой кислотой.
| Conjugate Acid | Conjugate Base |
| Bicarbonate ( HCO 3 – ) | Carbonate ( CO 3 2- ) |
| Carbonic Acid ( H 2 CO 3 ) | Bicarbonate ( HCO 3 – ) |
Вода по своей природе амфотерна, поэтому вода может вести себя как как кислота, так и как основание.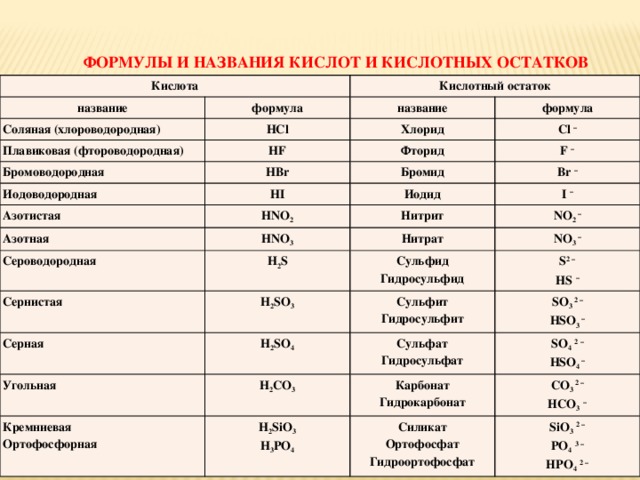
На самом деле любое вещество может вести себя как кислота или основание в зависимости от среды. Так, бикарбонат может действовать как кислота в присутствии сильного основания в водной среде. Когда бикарбонат реагирует с ионом гидроксида, который является более основным, чем бикарбонат, он вытягивает протон из бикарбоната, и бикарбонат ведет себя там как кислота.
Бикарбонат действует как кислотаБикарбонат отдает свой протон гидроксиду, первый становится ионом карбоната, а позже образует молекулу воды. Так, здесь бикарбонат ведет себя как кислота , сопряженным основанием которой является карбонат в присутствии гидроксид-иона.
Когда HCO 3 – является базовым?Бикарбонат ведет себя как основание независимо от природы среды.
В протонном растворителе бикарбонат легко принимает один протон и образует нейтральную частицу, которая является слабой кислотой. Таким образом, он обладает способностью удалять протоны из любого протонного растворителя или протонированных частиц.
Таким образом, он обладает способностью удалять протоны из любого протонного растворителя или протонированных частиц.
Здесь бикарбонат принимает протон от иона гидроксония и становится угольной кислотой, а затем превращается в воду. Таким образом, бикарбонат может вести себя как основание в присутствии любого протонированного растворителя или донора протонов, и бикарбонат может отщеплять этот протон.
Часто задаваемые вопросыЯвляется ли HCO3-Аррениус кислотой или основанием?
Согласно теории Аррениуса, вид, называемый кислотой, отдает H + ион и вид, называемый основанием, может отдавать ОН – ион.
HCO 3 – Может отдавать ион H + с образованием CO 3 2- (ион карбоната) и может отдавать OH – двуокись углерода с образованием иона CO 100 до 02). Таким образом, согласно теории Аррениуса, он может вести себя и как кислота, и как основание.
Таким образом, согласно теории Аррениуса, он может вести себя и как кислота, и как основание.
Но экспериментально он мягкий и простой по своей природе.
Между H 2 PO 4 – и HCO 3 – что проще и почему?Бикарбонат является более основным.
Для решения этого вопроса, мы должны рассмотреть часть сопряженной кислотно-щелочной теории. Дигидрофосфат является сопряженным основанием фосфорной кислоты, которая является сильной кислотой, поэтому его сопряженное основание слабее.
Но бикарбонат является сопряженным основанием угольной кислоты, которая является более слабой кислотой, поэтому его сопряженное основание будет сильным. Таким образом, бикарбонат является более основным, чем дигидрофосфат.
Сравните кислотно-основную природу CO 3 2- и HCO 3 2-. Согласно теории кислоты Бренстеда, вещество называется основанием по способности принимать протон или названной кислотой отдавать протон .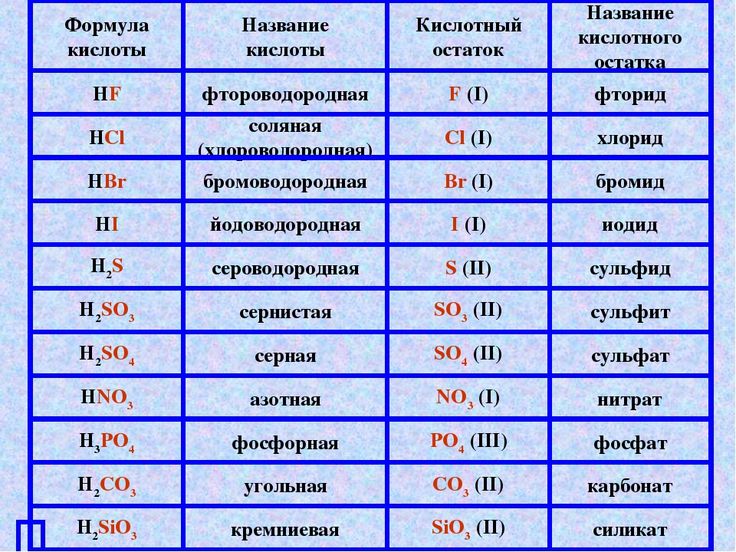
Карбонат имеет два отрицательных заряда, поэтому он принимает больше протонов, чем бикарбонат, а плотность отрицательного заряда также высока в карбонате, поэтому способность принимать протон для карбоната выше, чем у бикарбоната.
Итак, карбонат является более щелочным, чем бикарбонат.
Резюме
Из приведенного выше краткого обсуждения кислотно-основной природы бикарбоната мы можем заключить, что бикарбонат также является амфотерным по своей природе. Он может вести себя как как кислота, так и как основание в зависимости от природы среды и типа реакции. Кроме того, он может удовлетворять условию теории кислот и оснований Бренстеда и Льюиса.
Кислоты и другие материалы | Физика Фургон
Категория Выберите категориюО фургоне физикиЭлектричество и магнитыВсе остальноеСвет и звукДвижение вещейНовая и захватывающая физикаСостояния вещества и энергииКосмосПод водой и в воздухе
Подкатегория
ПоискЗадайте вопрос
Последний ответ: 22. 10.2007
10.2007
Q:
Я знаю, что кислоты вызывают коррозию, и т.д. они реагируют с карбонатами, основными и большинством металлов.
Но как они уничтожают другие материалы? Или не умеют? Это из-за их ионного заряда, который реагирует с другими элементами / соединениями / сложными веществами, или из-за их кислотной природы?
— Бернард (14 лет)
Singapore
A:
Кислоты — это химические вещества, которые разлагаются в воде (или другом растворителе) с образованием ионов водорода. Например:
HCl является кислотой, потому что в воде распадается с образованием ионов H+ и Cl-.
Однако ионы H+ реагируют со многими соединениями. Например, когда вы помещаете металл (скажем, медь) в кислоту с высокой концентрацией H+, два иона H+ захватывают пару электронов у металла, образуя молекулу водорода (h3). Заряженный ион металла (скажем, Cu++) перейдет в раствор, так как он потеряет часть своих электронов.
Таким образом, «кислотная природа» — это просто еще один способ сказать, что кислоты выделяют определенный ион (H+), который реагирует со многими другими веществами, заставляя их переходить в раствор.
Основания представляют собой соединения, образующие в воде ионы ОН-. Типичным примером является гидроксид натрия:
NaOH ——> Na+ + OH-
OH- и H+ реагируют с образованием воды.
Карбонаты (CO3—) на самом деле являются слабыми основаниями. Углекислота (h3CO3) распадается на H+ и HCO3- или на два H+ и CO3—. Фракции, найденные как h3CO3, HCO3- и CO3—, зависят от того, какова концентрация ионов H+, которая зависит как от того, сколько присутствует карбоната, так и от того, какие другие кислоты и основания находятся вокруг. Если есть много H+ (кислотный), он имеет тенденцию к рекомбинации с образованием h3CO3. Если мало (базового), то в основном будет СО3—.
CO3-2 и HCO3- — это то, что химики называют «сопряженным основанием слабой кислоты», поскольку угольная кислота является слабой кислотой (она не полностью распадается на H+ и HCO3-; часть соединения остается в виде h3CO3 в раствор)
Ионы типа CO3—, HCO3-, а также SO4—, PO4— и т.

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав