Гидрокарбонаты — это… Что такое Гидрокарбонаты?
Модель иона гидрокарбоната HCO3−Гидрокарбонаты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO3—. Устаревшие названия гидрокарбонатов: кислый углекислый, или двууглекислый.
Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.
Получение
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- А пищевую соду получают по так называемому аммиачно-хлоридному способу:
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- Гидролиз гидрокарбонат-иона происходит по схеме:
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует с щелочами:
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливает временную жёсткость воды[1].
Физиологическое действие
В организме гидрокарбонаты являются буферными веществами, регулирующими постоянство реакции крови[1].
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
- Ф.Н. Капуцкий, В.Ф.Тикавый Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г.П.Хомченко Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.
Примечания
- ↑ 1 2 [1]XuMuK.ru — гидрокарбонаты
См. также
dic.academic.ru
Слово ГИДРОКАРБОНАТ — Что такое ГИДРОКАРБОНАТ?
Слово гидрокарбонат английскими буквами(транслитом) — gidrokarbonat
Слово гидрокарбонат состоит из 13 букв: а а б г д и к н о о р р т
Значения слова гидрокарбонат. Что такое гидрокарбонат?
Гидрокарбонаты
Гидрокарбонаты — кислые соли угольной кислоты h3CO3. Формула аниона: HCO3-. Устаревшие названия гидрокарбонатов: кислый углекислый, или двууглекислый. Гидрокарбонаты щелочных металлов в воде растворимы.
ru.wikipedia.org
Гидрокарбонаты, бикарбонаты, двууглекислые соли, кислые соли угольной кислоты H₂CO₃, например NaHCO₃ (гидрокарбонат натрия). Г. получают действием CO₂ на карбонаты или гидроокиси в присутствии воды.
БСЭ. — 1969—1978
ГИДРОКАРБОНАТЫ (бикарбонаты) — кислые соли угольной кислоты Н2СО3, напр., питьевая сода NаНСО3.
Большой энциклопедический словарь
ГИДРОКАРБОНАТ НАТРИЯ
ГИДРОКАРБОНАТ НАТРИЯ (сода, NаНСО 3). Белая кристаллическая соль, которая разлагается в кислоте или при нагреве, с выделением углекислого газа, в связи с чем ее используют в составе пекарского порошка для придания пористости выпечным изделиям.
Научно-технический энциклопедический словарь
Гидрокарбонат натрия
НАТРИЯ ГИДРОКАРБОНАТ (Natrii hydrocarbonas). Синонимы: Натрий двууглекислый, Натрия бикарбонат, Сода двууглекислая, Natrium bicarbonicum, Natrium hydrocarbonicum, Sodium bicarbonate.
www.xumuk.ru
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета.
ru.wikipedia.org
Натрия гидрокарбонат Синонимы: сода питьевая Внешний вид: бесцветн. моноклинные кристаллы Брутто-формула (система Хилла): CHNaO3 Формула в виде текста: NaHCO3 Молекулярная масса (в а.е.м.)…
www.xumuk.ru
Гидрокарбонат кальция
Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови.
ru.wikipedia.org
Калия гидрокарбонат
Калия гидрокарбонат Внешний вид: бесцветн. моноклинные кристаллы Брутто-формула (система Хилла): CHKO3 Формула в виде текста: KHCO3 Молекулярная масса (в а.е.м.): 100,12 Температура разложения (в °C): 100 Плотность: 2,17 (20°C, г/см3) Еще по теме…
www.xumuk.ru
Натрия гидрокарбонат
НАТРИЯ ГИДРОКАРБОНАТ Страна-производительРоссия, Борисовский завод медицинских препаратов Беларусь, Вологодская фармфабрика Россия, Востоквит Россия, Московская фармацевтическая фабрика Россия, Новосибхимфарм Россия, Сода Россия, Солвей С.А.
Энциклопедия лекарственных препаратов
Натрия гидрокарбонат Показания: Повышенная кислотность желудочного сока, язвенная болезнь желудка и двенадцатиперстной кишки, метаболический ацидоз (в т.ч. при инфекциях, интоксикациях, сахарном диабете, в послеоперационном периоде)…
РЛС. — 2012
Натрия гидрокарбоната таблетки Показания: Повышенная кислотность желудочного сока, язвенная болезнь желудка и двенадцатиперстной кишки, метаболический ацидоз (в т.ч. при инфекциях, интоксикациях, сахарном диабете, в послеоперационном периоде)…
РЛС. — 2012
НАТРИЯ ГИДРОКАРБОНАТ ДЛЯ ИНЪЕКЦИЙ
НАТРИЯ ГИДРОКАРБОНАТ ДЛЯ ИНЪЕКЦИЙ Фарм-ГруппаАнтациды системного действия Международное названиеНатрия гидрокарбонат СинонимыНатрия бикарбонат, Натрия бикарбонат, Натрия гидрокарбонат СоставДействующее вещество — Натрия гидрокарбонат.
Энциклопедия лекарственных препаратов
Свечи с натрия гидрокарбонатом
Свечи с натрия гидрокарбонатом Показания: Повышенная кислотность желудочного сока, язвенная болезнь желудка и двенадцатиперстной кишки, метаболический ацидоз (в т.ч. при инфекциях, интоксикациях, сахарном диабете, в послеоперационном периоде)…
РЛС. — 2012
Свечи с натрия гидрокарбонатомДействующее вещество ›› Натрия гидрокарбонат (Sodium hydrocarbonate) Латинское название Suppositoria cum Natrio hydrocarbonatis АТХ:›› B05CB04 Натрия гидрокарбонат Фармакологическая группа…
Словарь медицинских препаратов. — 2005
Русский язык
Гидр/о/карбон/а́т.
Морфемно-орфографический словарь. — 2002
КАЛИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД (POTASSIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE)
КАЛИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД (POTASSIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE) Клинико-фармакологическая группа: Регистрационные №№: р-р д/инф. 5 г+1 г+4 г/1 л: фл. 200 мл, 400 мл — П №015749/01, 14.05.09.
Справочник лекарственных препаратов «Видаль»
КАЛИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД (POTASSIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE) Клинико-фармакологическая группа: Регистрационные №№: р-р д/инф. 5 г+1 г+4 г/1 л: фл. 200 мл, 400 мл — П №015749/01, 14.05.09.
Справочник лекарственных препаратов «Видаль»
КАЛИЯ ХЛОРИД + КАЛЬЦИЯ ХЛОРИД + МАГНИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД + ПОВИДОН-8000 (POTASSIUM CHLORIDE + CALCIUM CHLORIDE + MAGNESIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE + POVIDONE 8000)
КАЛИЯ ХЛОРИД + КАЛЬЦИЯ ХЛОРИД + МАГНИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД + ПОВИДОН-8000 (POTASSIUM CHLORIDE + CALCIUM CHLORIDE + MAGNESIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE + POVIDONE 8000)
Справочник лекарственных препаратов «Видаль»
КАЛИЯ ХЛОРИД + КАЛЬЦИЯ ХЛОРИД + МАГНИЯ ХЛОРИД + НАТРИЯ ГИДРОКАРБОНАТ + НАТРИЯ ХЛОРИД + ПОВИДОН-8000 (POTASSIUM CHLORIDE + CALCIUM CHLORIDE + MAGNESIUM CHLORIDE + SODIUM BICARBONATE + SODIUM CHLORIDE + POVIDONE 8000)
Справочник лекарственных препаратов «Видаль»
- гидроизопьезы
- гидроизотерма
- гидроинтегратор
- гидрокарбонат
- гидрокефалия
- гидрокопировальный
- гидрокортизон
wordhelp.ru
Гидрокарбонаты Википедия
Модель иона гидрокарбоната HCO3−Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3.
Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты щелочных металлов растворимы в воде. Также в воде хорошо растворимы гидрокарбонаты щёлочноземельных металлов, в отличие от карбонатов.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Применение
- 4 Физиологическое действие
- 5 Литература
- 6 Примечания
- 7 См. также
Получение[ | ]
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- CaCO3+h3O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
- Пищевую соду (гидрокарбонат натрия) получают по так называемому аммиачно-хлоридному способу:
- NaCl+Nh4+CO2+h3O→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NaCl+NH_{3}+CO_{2}+H_{2}O\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства[ | ]
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- 2NaHCO3→Na2CO3+h3O+CO2{\displaystyle {\mathsf {2NaHCO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O+CO_{2}}}}
ru-wiki.ru
Гидрокарбонаты — WiKi
Получение
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- CaCO3+h3O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
- NaCl+Nh4+CO2+h3O→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NaCl+NH_{3}+CO_{2}+H_{2}O\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- 2NaHCO3→Na2CO3+h3O+CO2{\displaystyle {\mathsf {2NaHCO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O+CO_{2}}}}
- Гидролиз гидрокарбонат-иона происходит по схеме:
- HCO3−+h3O⇄OH−+h3CO3{\displaystyle {\mathsf {HCO_{3}^{-}+H_{2}O\rightleftarrows OH^{-}+H_{2}CO_{3}}}}
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- HCO3−+OH−→CO32−+h3O{\displaystyle {\mathsf {HCO_{3}^{-}+OH^{-}\rightarrow CO_{3}^{2-}+H_{2}O}}}
- HCO3−+H+→h3O+CO2↑{\displaystyle {\mathsf {HCO_{3}^{-}+H^{+}\rightarrow H_{2}O+CO_{2}\uparrow }}}
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливают временную жёсткость воды[1].
Физиологическое действие
Литература
- Кнунянц И. Л. и др. т. 3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- Ф. Н. Капуцкий, В. Ф. Тикавый. Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г. П. Хомченко. Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.
Примечания
- ↑ 1 2 [1]XuMuK.ru — гидрокарбонаты
См. также
ru-wiki.org
Гидрокарбонаты — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
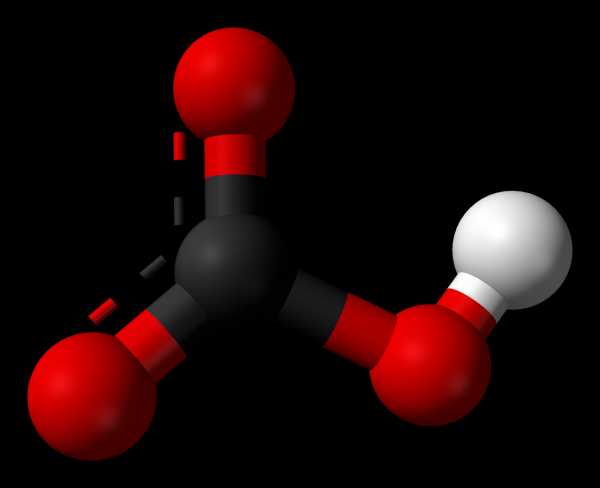
 Гидрокарбонаты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO3—.
Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO3—.
Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.
Получение
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- <math>\mathsf{CaCO_3 + H_2O + CO_2 \rightarrow Ca(HCO_3)_2}</math>
- А пищевую соду получают по так называемому аммиачно-хлоридному способу:
- <math>\mathsf{NaCl + NH_3 + CO_2 + H_2O \rightarrow NaHCO_3 + NH_4Cl}</math>
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- <math>\mathsf{2NaHCO_3 \rightarrow Na_2CO_3 + H_2O + CO_2}</math>
- Гидролиз гидрокарбонат-иона происходит по схеме:
- <math>\mathsf{HCO_3^- + H_2O \rightleftarrows OH^- + H_2CO_3}</math>
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- <math>\mathsf{HCO_3^- + OH^- \rightarrow CO_3^{2-} + H_2O}</math>
- <math>\mathsf{HCO_3^- + H^+ \rightarrow H_2O + CO_2\uparrow}</math>
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливают временную жёсткость воды[1].
Физиологическое действие
В организме гидрокарбонаты являются буферными веществами, регулирующими постоянство реакции крови[1].
Напишите отзыв о статье «Гидрокарбонаты»
Литература
- Кнунянц И. Л. и др. т. 3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- Ф. Н. Капуцкий, В. Ф. Тикавый. Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г. П. Хомченко. Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.
Примечания
- ↑ 1 2 [www.xumuk.ru/bse/674.html]XuMuK.ru — гидрокарбонаты
См. также
Отрывок, характеризующий Гидрокарбонаты
Было уже далеко за полдень; половина улицы была в тени, другая была ярко освещена солнцем. Алпатыч взглянул в окно и пошел к двери. Вдруг послышался странный звук дальнего свиста и удара, и вслед за тем раздался сливающийся гул пушечной пальбы, от которой задрожали стекла.Алпатыч вышел на улицу; по улице пробежали два человека к мосту. С разных сторон слышались свисты, удары ядер и лопанье гранат, падавших в городе. Но звуки эти почти не слышны были и не обращали внимания жителей в сравнении с звуками пальбы, слышными за городом. Это было бомбардирование, которое в пятом часу приказал открыть Наполеон по городу, из ста тридцати орудий. Народ первое время не понимал значения этого бомбардирования.
Звуки падавших гранат и ядер возбуждали сначала только любопытство. Жена Ферапонтова, не перестававшая до этого выть под сараем, умолкла и с ребенком на руках вышла к воротам, молча приглядываясь к народу и прислушиваясь к звукам.
К воротам вышли кухарка и лавочник. Все с веселым любопытством старались увидать проносившиеся над их головами снаряды. Из за угла вышло несколько человек людей, оживленно разговаривая.
– То то сила! – говорил один. – И крышку и потолок так в щепки и разбило.
– Как свинья и землю то взрыло, – сказал другой. – Вот так важно, вот так подбодрил! – смеясь, сказал он. – Спасибо, отскочил, а то бы она тебя смазала.
Народ обратился к этим людям. Они приостановились и рассказывали, как подле самих их ядра попали в дом. Между тем другие снаряды, то с быстрым, мрачным свистом – ядра, то с приятным посвистыванием – гранаты, не переставали перелетать через головы народа; но ни один снаряд не падал близко, все переносило. Алпатыч садился в кибиточку. Хозяин стоял в воротах.
– Чего не видала! – крикнул он на кухарку, которая, с засученными рукавами, в красной юбке, раскачиваясь голыми локтями, подошла к углу послушать то, что рассказывали.
– Вот чуда то, – приговаривала она, но, услыхав голос хозяина, она вернулась, обдергивая подоткнутую юбку.
Опять, но очень близко этот раз, засвистело что то, как сверху вниз летящая птичка, блеснул огонь посередине улицы, выстрелило что то и застлало дымом улицу.
– Злодей, что ж ты это делаешь? – прокричал хозяин, подбегая к кухарке.
В то же мгновение с разных сторон жалобно завыли женщины, испуганно заплакал ребенок и молча столпился народ с бледными лицами около кухарки. Из этой толпы слышнее всех слышались стоны и приговоры кухарки:
wiki-org.ru
Гидрокарбонат — Википедия
Модель иона гидрокарбоната HCO3−Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3.
Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты щелочных металлов растворимы в воде. Также в воде хорошо растворимы гидрокарбонаты щёлочноземельных металлов, в отличие от карбонатов.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Применение
- 4 Физиологическое действие
- 5 Литература
- 6 Примечания
- 7 См. также
Получение[ | ]
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- CaCO3+h3O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
- Пищевую соду (гидрокарбонат натрия) получают по так называемому аммиачно-хлоридному способу:
- NaCl+Nh4+CO2+h3O→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NaCl+NH_{3}+CO_{2}+H_{2}O\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства[ | ]
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- 2NaHCO3→Na2CO3+h3O+CO2{\displaystyle {\mathsf {2NaHCO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O+CO_{2}}}}
- Гидролиз гидрокарбонат-иона происходит по схеме:
- HCO3−+h3O⇄OH−+h3CO3{\displaystyle {\mathsf {HCO_{3}^{-}+H_{2}O\rightleftarrows OH^{-}+H_{2}CO_{3}}}}
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- HCO3−+OH
encyclopaedia.bid
ионы — Большая Энциклопедия Нефти и Газа, статья, страница 1
Гидрокарбонат-ионы
Cтраница 1
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы а из плазмы, сами переходят в плазму и переносятся ею к легким. [1]
Гидрокарбонат-ионы НСОд морских вод в значительной мере превращаются в карбонаты раковин моллюсков, скелеты кораллов и других морских организмов. Со временем осевшие на морском дне карбонаты образуют горные породы. Не подвергшиеся деструкции остатки наземной растительности образуют торф, который в ходе сложных геохимических процессов превращается в бурый уголь, затем в каменный уголь или нефть. Медленные процессы образования карбонатов и каустобиолитов выводят углеродсодержащие вещества из быстрого обмена с атмосферой и гидросферой, составляя приблизительно 2 % этого обмена. Но медленные геологические процессы снова вовлекают этот углерод в круговорот. [2]
При этом в реакцию вступают гидрокарбонат-ионы, как содержавшиеся в воде, так и образовавшиеся в первой стадии титрования из карбонат-ионов. В конечной точке титрования рН воды станет равным примерно 4, поэтому индикатором служит метиловый желтый или метиловый оранжевый. [3]
В первой точке эквивалентности образуются гидрокарбонат-ионы, расчет [ Н ] проводят аналогично расчету для случая титрования многоосновных кислот. [5]
Качественной реакцией на карбонат-ионы СО3 и гидрокарбонат-ионы НСОз являются их взаимодействие с более сильными кислотами; при этом выделяется углекислый газ с характерным шипением. [6]
Таким образом, в воде одновременно присутствуют гидрокарбонат-ионы, карбонат-ионы и свободная углекислота. [7]
Вследствие наличия в воде буферной системы ( гидрокарбонат-ионы и углекислота) с рН, близким к 7, рН воды при гидролизе коагулянтов практически не изменяется. [8]
Вследствие наличия в воде буферной системы ( гидрокарбонат-ионы и углекислота) с prL близким к 7, рН воды при гидролизе коагулянтов практически не изменяется. [9]
Анионами растворимых солей Са2 и Mg2 могут быть гидрокарбонат-ионы НСО3 -, сульфат-ионы SO42 — и реже хлорид-ионы СГ. Различают временную ( карбонатную) жесткость воды, обусловленную наличием в воде гидрокарбонатов кальция Са ( НСО3) 2 и магния Mg ( HCO3) 2, и постоянную жесткость воды, обусловленную наличием в воде сульфатов кальция и магния CaSO4, MgSO4, хлоридов кальция и магния СаС12, MgCl2 и других солей. [10]
Деление углекислоты на связанную и полусвязанную основано на том, что гидрокарбонат-ионы при кипячении воды. [11]
Качественной реакцией на к а р б о н а т — ионы СО — и гидрокарбонат-ионы НСОз является их взаимодействие с более сильными кислотами; при этом с характерным шипением выделяется: диоксид углерода. [12]
Присутствующие в почве гуминовые кислоты ( условно обозначенные как катионы оксония) связываются в безопасные и мало подверженные протолизу гидрокарбонат-ионы. При этом не создается вредного избытка щелочей ( перещелачивания почвы), что препятствует усвоению растениями фосфатных удобрений, в большинстве своем плохо растворимых в воде. [13]
Химическая экология природных вод. Химический состав и классификация природных вод. Макрокомпоненты: хлорид -, сульфат -, карбонат — и гидрокарбонат-ионы, катионы натрия, калия, магния, кальция. [14]
Следовательно, в растворе карбоната-аммония вместе с карбонат-ионами СОз, образующими с катионами второй группы нерастворимые в воде карбонаты, содержатся гидрокарбонат-ионы НСОз и анионы карбаминовой кислоты Nh3COO, которые не осаждают катионов второй группы. [15]
Страницы: 1 2
www.ngpedia.ru
