Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды | Презентация к уроку по химии (9 класс) на тему:
Слайд 1
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Урок №2
Слайд 2
Основные свойства Чем большим радиусом атома обладает химический элемент, тем он проявляет более сильные металлические свойства, и тем более сильными основными свойствами обладают его соединения. Основные свойства веществ проявляются во взаимодействии их с кислотами, кислотными оксидами, амфотерными оксидами и основаниями, а также некоторыми неметаллами (в определённых условиях).
Слайд 3
Li Li 2 O LiOH Na Na 2 O NaOH K K 2 O KOH Mg MgO Mg(OH) 2 Ca CaO Ca(OH) 2 Cr CrO Cr(OH) 2 Основные свойства проявляют оксиды ( М 2 О и МО) и гидроксиды металлов (МОН и М(ОН) 2 )в степени окисления +1 и + 2 ( за исключением Be и Zn )
Слайд 4
Кислотные свойства Чем меньше радиус атома химического элемента, тем он проявляет более сильные неметаллические свойства, и тем более сильными кислотными свойствами обладают его соединения. Кислотные свойства обратны основным
Кислотные свойства обратны основным
Слайд 5
P P 2 O 5 H 3 PO 4 S SO 3 H 2 SO 4 Cl 2 Cl 2 O 7 HClO 4 V V 2 O 5 HVO 3 Cr CrO 3 H 2 CrO 4 Кислотные свойства проявляют оксиды и гидроксиды неметаллов в степени окисления ≥+3 , а также оксиды и гидроксиды металлов в степени окисления ≥+5
Слайд 6
Амфотерные свойства Проявляют химические элементы, которые занимают промежуточное ( граничное ) положение между типичными металлами и типичными неметаллами, амфотерны и их соединения. Амфотерность заключается во взаимодействии данных веществ (оксидов, гидроксидов ) как с сильными основаниями (основными оксидами) так и кислотами (кислотными оксидами).
Слайд 7
Be BeO Be(OH) 2 Zn ZnO Zn(OH) 2 Al Al 2 O 3 Al(OH) 3 Fe Fe 2 O 3 Fe(OH) 3 Cr Cr 2 O 3 Cr(OH) 3 Mn MnO 2 Mn (OH) 4 Амфотерные свойства проявляют оксиды и гидроксиды металлов в степени окисления +3, +4, а также соединения Be и Zn .
Слайд 8
Основные свойства Na 2 O + 2HCl = 2NaCl + H 2 O Na 2 O + SO 2 = Na 2 SO 3 NaOH + HCl = NaCl + H 2 O Кислотные свойства P 2 O 5 + 6NaOH = 2Na 3 PO4 + 3H 2 O P 2 O 5 + 3Na 2 O = 2Na 3 PO 4 H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O Амфотерные свойства Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Слайд 9
У химических элементов, которые проявляют множество степеней окисления для нижних характерны основные свойства, для промежуточных – амфотерные , для высоких – кислотные. Например, Cr : Cr +2 O основный оксид Cr +2 (OH) 2 основание Cr +3 2 O 3 амфотерный оксид Cr +3 (OH) 3 амфотерное основание Cr +6 O 3 кислотный оксид H 2 Cr +6 O 4 кислота
Например, Cr : Cr +2 O основный оксид Cr +2 (OH) 2 основание Cr +3 2 O 3 амфотерный оксид Cr +3 (OH) 3 амфотерное основание Cr +6 O 3 кислотный оксид H 2 Cr +6 O 4 кислота
Слайд 10
Амфотерность Zn(OH) 2 Используя, выданные реактивы, получите гидроксид цинка и докажите его амфотерность путём проведения соответствующих химических реакций. Запишите в тетрадь уравнения проведённых химических реакций в молекулярном виде, а дома допишите их в полном и сокращённом ионном виде.
Слайд 11
Домашнее задание §2 , ответить на вопросы 1- 4 письменно. Дописать уравнения проведённых реакций в полном и сокращённом ионном виде.
Характеристика амфотерных соединений
Общая характеристика амфотерных гидроксидов
Теория:
Гидроксиды, или гидраты оксидов — вещества, которые образуются, либо могли бы образоваться, если бы соответствующие оксиды присоединили воду. Основным оксидам соответствуют основания, кислотным оксидам соответствуют кислоты, а амфотерным оксидам соответствуют амфотерные гидроксиды.
Обрати внимание!
Главной особенностью амфотерных гидроксидов является их двойственный характер: в кислотной среде они ведут себя как основания, а в щелочной среде они ведут себя как кислоты.
Амфотерными называют гидроксиды, которые взаимодействуют как с кислотами, так и с основаниями, образуя соли.
Названия амфотерных гидроксидов образуются так же, как названия оснований.
Амфотерный характер имеют, например, гидроксид цинка Zn(OH)2 и гидроксид алюминия Al(OH)3. Более полные сведения о гидроксидах, имеющих амфотерный характер, приведены ниже.
Примеры амфотерных гидроксидов
Степень окисления элемента, образующего гидроксид | Примеры гидроксидов |
+2 | Zn(OH)2 — гидроксид цинка, Be(OH)2 — гидроксид бериллия, Pb(OH)2 — гидроксид свинца(II), Sn(OH)2 — гидроксид олова(II) |
+3 | Al(OH)3 — гидроксид алюминия, Cr(OH)3 — гидроксид хрома(III) |
+4 | Mn(OH)4 — гидроксид марганца(IV), он же марганцовистая кислота h3MnO3 |
Физические свойства амфотерных гидроксидов
Амфотерные гидроксиды — твёрдые кристаллические вещества, практически нерастворимые в воде.
Гидроксид хрома(III) серо-зелёный, остальные амфотерные гидроксиды большей частью имеют белый цвет.
Химические свойства амфотерных гидроксидов
1. Амфотерные гидроксиды реагируют с кислотами, образуя соли.
Например, при взаимодействии гидроксида цинка с соляной кислотой образуются хлорид цинка и вода:
Zn(OH)2+2HCl→ZnCl2+2h3O.
При взаимодействии гидроксида алюминия с серной кислотой образуются сульфат алюминия и вода:
2Al(OH)3+3h3SO4→Al2(SO4)3+6h3O.
2. Амфотерные гидроксиды реагируют с растворами щелочей, образуя комплексные соли.
Например, при взаимодействии гидроксида цинка с раствором гидроксида натрия образуется тетрагидроксоцинкат натрия:
Zn(OH)2+2NaOH→Na2[Zn(OH)4].
При взаимодействии гидроксида алюминия с раствором гидроксида калия образуется тетрагидроксоалюминат калия:
Al(OH)3+KOH→K[Al(OH)4].
3. Амфотерные гидроксиды при нагревании разлагаются.
Например, при разложении гидроксида цинка образуются оксид цинка и вода:
Zn(OH)2→t°ZnO+h3O.
При разложении гидроксида алюминия образуются оксид алюминия и вода:
2Al(OH)3−→−t°Al2O3+3h3O.
Применение амфотерных гидроксидов
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:
лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.
Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
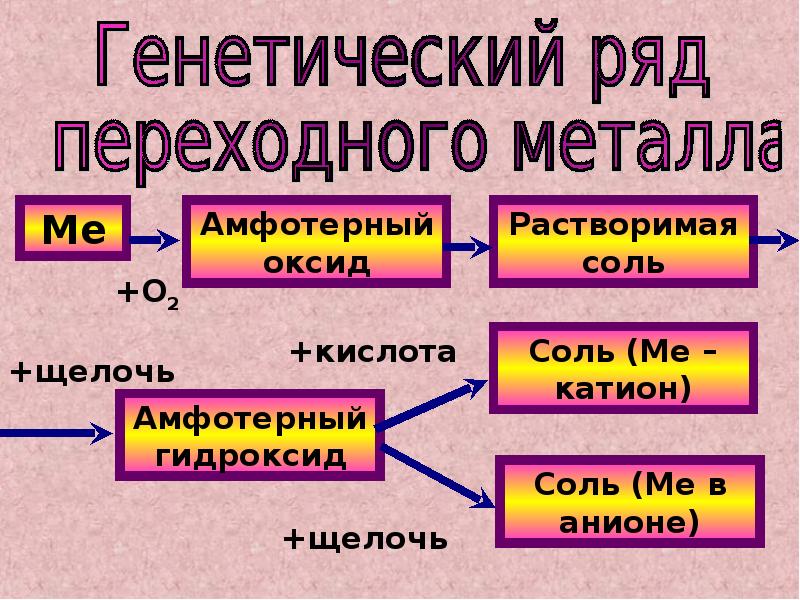
Получение амфотерных гидроксидов
1. Амфотерные гидроксиды получают так же, как нерастворимые в воде основания, то есть путём смешивания раствора соли соответствующего металлического элемента с раствором щёлочи.
Например, чтобы получить гидроксид цинка, следует раствор сульфата цинка смешать с раствором гидроксида натрия:
ZnSO4+2NaOH→Zn(OH)2+Na2SO4.
Видеофрагмент:
Получение и химические свойства гидроксида цинка |
Чтобы получить гидроксид алюминия, можно к раствору сульфата алюминия добавить раствор гидроксида калия:
Al2(SO4)3+6KOH→2Al(OH)3↓+3K2SO4.
2. Осадок гидроксида трёхвалентного металла (алюминия, хрома) образуется также при смешивании раствора соли этого металла с раствором карбоната:
2AlCl3+3Na2CO3+3h3O→2Al(OH)3↓+6NaCl+3CO2↑.
Сделать задания письменно, прислать фотографии до начала следующего урока.
1 Какое из веществ, формулы которых приведены, является амфотерным гидроксидом?
CsOH
Ba(OH)2
Al(OH)3
Co(OH)2
2 Какое из веществ, названия которых приведены, может взаимодействовать как с кислотами, так и с основаниями, образуя соли?
Это:
оксид меди(I)
серная кислота
гидроксид бария
гидроксид цинка
3 Напиши уравнение химической реакции, протекающей при взаимодействии гидроксида цинка с бромоводородной кислотой.
Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа.
Ответ:
4 Напиши уравнение химической реакции, протекающей при взаимодействии гидроксида алюминия с раствором гидроксида натрия.
Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа.
Ответ:
5 Напиши название амфотерного гидроксида (в именительном падеже), который, реагируя с h3SO4, образует BeSO4 и воду
6 Напиши уравнение химической реакции. Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа.
Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа.
7 Напиши уравнение химической реакции, протекающей при взаимодействии гидроксида свинца(II) с раствором гидроксида лития.
Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа:
Ответ:
8 Вычисли, какая масса гидроксида цинка может прореагировать с раствором, содержащим 2,94 г серной кислоты.
Промежуточные расчёты делай с точностью 2 знака после запятой, ответ впиши с такой же точностью.
Ответ: m(Zn(OH)2)= г.
9
Вычисли, какая масса гидроксида калия может прореагировать с 4,82 г гидроксида свинца(II).
Ответ: m(KOH)= г.
10 Какие реагенты нужно использовать, чтобы получить гидроксид цинка?
ZnCO3иNaOH
ZnSO4иh3O
ZnOиh3O
ZnCl2 иKOH
Напиши уравнение соответствующей реакции, вычисли, чему равна сумма коэффициентов, и введи эту сумму в качестве ответа.
Ответ: .
Электрохимическое удаление амфотерных ионов
1. Монтгомери М. А., Элимелех М., Водоснабжение и санитария в развивающихся странах: включая здоровье в уравнение. Окружающая среда. науч. Технол. 41, 17–24 (2007). [PubMed] [Google Scholar]
2. Richter B.D., et al.., Tapped Out: Как города могут обеспечить свое водное будущее? Водная политика 15, 335–363 (2013). [Google Scholar]
3. Дамания Р. и др., Неизведанные воды: новая экономика дефицита и изменчивости воды (Всемирный банк, Вашингтон, округ Колумбия, 2017 г.). [Академия Google]
4. Меконнен М. М., Хекстра А. Ю. Четыре миллиарда человек сталкиваются с острой нехваткой воды. науч. Доп. 2, e1500323 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Schewe J., et al.. Мультимодельная оценка нехватки воды в условиях изменения климата. проц. Натл. акад. науч. США. 111, 3245–3250 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Элимелех М.
7. Джонс Э., Кадир М., ван Влит М.Т., Смахтин В., Канг С.М. Состояние опреснения и производства рассола: глобальный взгляд. науч. Общая окружающая среда. 657, 1343–1356 (2019). [PubMed] [Google Scholar]
8. Корделл Д., Дрангерт Дж. О., Уайт С. История фосфора: глобальная продовольственная безопасность и пища для размышлений. Глоб. Окружающая среда. Изменять 19, 292–305 (2009). [Google Scholar]
9. Нир О., Сенгпиль Р., Весслинг М. Замыкание цикла: удаление и извлечение фосфора из разбавленных сточных вод с использованием кислотоустойчивых мембран. хим. англ. Дж. 346, 640–648 (2018). [Академия Google]
10. Fritzmann C., Löwenberg J., Wintgens T., Melin T., Современные технологии опреснения обратным осмосом. Опреснение 216, 1–76 (2007). [Google Scholar]
11. Вентен И. Г., Хойруддин, Применение обратного осмоса: перспективы и проблемы.
12. Раутенбах Р., Фоссенкаул К., Линн Т., Кац Т. Очистка сточных вод с помощью мембранных процессов. Новые разработки в области ультрафильтрации, нанофильтрации и обратного осмоса. Опреснение 108, 247–253 (1997). [Google Scholar]
13. Земан Л. Дж., Зидни А. Л. Микрофильтрация и ультрафильтрация: принципы и приложения (Марсель Деккер, Нью-Йорк, 2017). [Google Scholar]
14. Ван С. Л., Цуру Т., Того М., Накао С. И., Кимура С., Транспорт органических электролитов с электростатическими и стерическими эффектами через нанофильтрационные мембраны. Дж. Хим. англ. Японии 28, 372–380 (1995). [Google Scholar]
15. Гарба Ю., Таха С., Гондрексон Н., Доранж Г. Моделирование переноса ионов через нанофильтрационные мембраны. Дж. Член. науч. 160, 187–200 (1999). [Google Scholar]
16. Чайлдресс А. Э., Элимелех М. Связь производительности нанофильтрационной мембраны с зарядовыми (электрокинетическими) характеристиками мембраны. Окружающая среда. науч. Технол.
34, 3710–3716 (2000). [Google Scholar]
Окружающая среда. науч. Технол.
34, 3710–3716 (2000). [Google Scholar]
17. Zaldívar R. Загрязнение мышьяком питьевой воды и пищевых продуктов, вызывающее эндемическое хроническое отравление. Бейтр. Патол. 151, 384–400 (1974). [PubMed] [Google Scholar]
18. Ценг В. П., Эффекты и взаимосвязь доза-реакция рака кожи и болезни черноногих с мышьяком. Окружающая среда. Перспектива здоровья. 19, 109–119 (1977). [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Фариас С. С. и др.. Естественное загрязнение мышьяком и другими микроэлементами подземных вод Аргентинской Пампейской равнины. науч. Общая окружающая среда. 309, 187–199 (2003). [PubMed] [Google Scholar]
20. Ли И. П., Шеринс Р. Дж., Диксон Р. Л. Доказательства индукции зародышевой аплазии у самцов крыс под воздействием бора в окружающей среде. Токсикол. заявл. Фармакол. 45, 577–590 (1978). [PubMed] [Академия Google]
21. Гупта У. К., Джейм Ю. В., Кэмпбелл К. А., Лейшон А. Дж., Николайчук В., Токсичность и дефицит бора: обзор. Может. J. Почвоведение.
65, 381–409 (1985). [Google Scholar]
Может. J. Почвоведение.
65, 381–409 (1985). [Google Scholar]
22. Агентство по охране окружающей среды США, «Предварительное исследование воздействия на окружающую среду бора, индия, никеля, селена, олова, ванадия и их соединений: Том I: бор» (Tech. Rep., United States Агентство по охране окружающей среды, Вашингтон, округ Колумбия, 1975 г.).
23. Мосс С., Нагпал Н., «Рекомендации по содержанию бора в качестве атмосферной воды» (Технический представитель, Отдел охраны воды, Министерство водных ресурсов, земель и охраны воздуха, провинция Британская Колумбия, Виктория, Канада, 2003 г. ).
24. Бик А., Орон Г., Проектирование установок обратного осмоса для последующей обработки морской воды: выбор технологии удаления бора для производства питьевой воды и контроля окружающей среды. Опреснение 178, 233–246 (2005). [Google Scholar]
25. Пеньяте Б., Гарсия-Родригес Л. Текущие тенденции и будущие перспективы в разработке технологии опреснения морской воды обратным осмосом.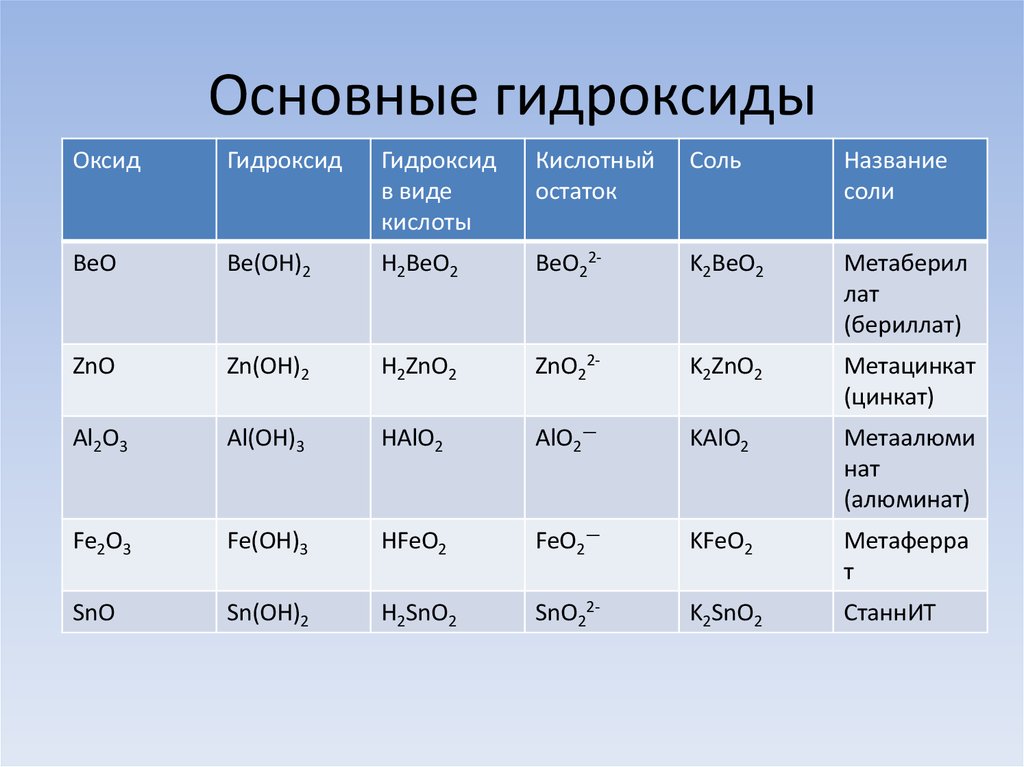 Опреснение
284, 1–8 (2012). [Google Scholar]
Опреснение
284, 1–8 (2012). [Google Scholar]
26. Цзинь Л., Чжан Г., Тянь Х. Текущее состояние очистки сточных вод в Китае. Вода Res. 66, 85–98 (2014). [PubMed] [Google Scholar]
27. Mayer B.K., et al.. Общее значение восстановления фосфора. Окружающая среда. науч. Технол. 50, 6606–6620 (2016). [PubMed] [Google Scholar]
28. Монтойя Дж. Х., Цай С., Воеводич А., Норсков Дж. К., Проблема электрохимического синтеза аммиака: новый взгляд на роль отношений масштабирования азота. ХимСусХим 8, 2180–2186 (2015). [PubMed] [Google Scholar]
29. Ван Ю., Мейер Т. Дж. Путь к возобновляемым источникам энергии, вызванный процессом Габера-Боша. Химия 5, 496–497 (2019). [Google Scholar]
30. Грубер Н., Галлоуэй Дж. Н. Взгляд на глобальный азотный цикл с точки зрения земной системы. Природа 451, 293–296 (2008). [PubMed] [Google Scholar]
31. Вули Р., Ма З., Ван Н. Х., Девятизонная имитация движущегося слоя для извлечения глюкозы и ксилозы из гидролизата биомассы. Инд.Инж. хим. Рез.
37, 3699–3709 (1998). [Google Scholar]
Инд.Инж. хим. Рез.
37, 3699–3709 (1998). [Google Scholar]
32. Ахсан Л., Джахан М. С., Ни Ю., Извлечение/концентрирование гемицеллюлозных сахаров и уксусной кислоты путем нанофильтрации и обратного осмоса из предварительного гидролизного раствора процесса растворения целлюлозы на основе крафт-древесины лиственных пород. Биоресурс. Технол. 155, 111–115 (2014). [PubMed] [Академия Google]
33. Ту К. Л., Нгием Л. Д., Чивас А. Р., Удаление бора мембранами обратного осмоса при опреснении морской воды. раздел. Очист. Тех. 75, 87–101 (2010). [Google Scholar]
34. Magara Y., et al.., Поведение неорганических компонентов и дезинфекция продуктами в процессе опреснения воды обратным осмосом. Науки о воде. Технол. 34, 141–148 (1996). [Google Scholar]
35. Prats D., Chillon-Arias M.F., Rodriguez-Pastor M. Анализ влияния pH и давления на устранение бора в обратном осмосе. Опреснение 128, 269–273 (2000). [Google Scholar]
36. Редондо Дж., Буш М., Де Витте Дж. П. Удаление бора из морской воды с помощью мембран FILMTEC с высоким уровнем задерживания SWRO. Опреснение
156, 229–238 (2003). [Google Scholar]
Удаление бора из морской воды с помощью мембран FILMTEC с высоким уровнем задерживания SWRO. Опреснение
156, 229–238 (2003). [Google Scholar]
37. Xu J., Gao X., Chen G., Zou L., Gao C. Высокоэффективное удаление бора из морской воды с помощью двухпроходной системы SWRO с различными мембранами. Науки о воде. Технол. Водоснабжение 10, 327–336 (2010). [Google Scholar]
38. Ту К. Л., Чивас А. Р., Нгием Л. Д. Влияние загрязнения мембраны и образования накипи на удаление бора мембранами нанофильтрации и обратного осмоса. Опреснение 279, 269–277 (2011). [Google Scholar]
39. Глюкстерн П., Приэль М. Оптимизация удаления бора в старых и новых системах SWRO. Опреснение 156, 219–228 (2003). [Google Scholar]
40. Надав Н., Приэль М., Глюкстерн П. Удаление бора из пермеата крупного завода SWRO в Эйлате. Опреснение 185, 121–129 (2005). [Google Scholar]
41. Гринли Л. Ф., Лоулер Д. Ф., Фримен Б. Д., Маррот Б., Мулен П., Опреснение обратным осмосом: источники воды, технологии и современные проблемы.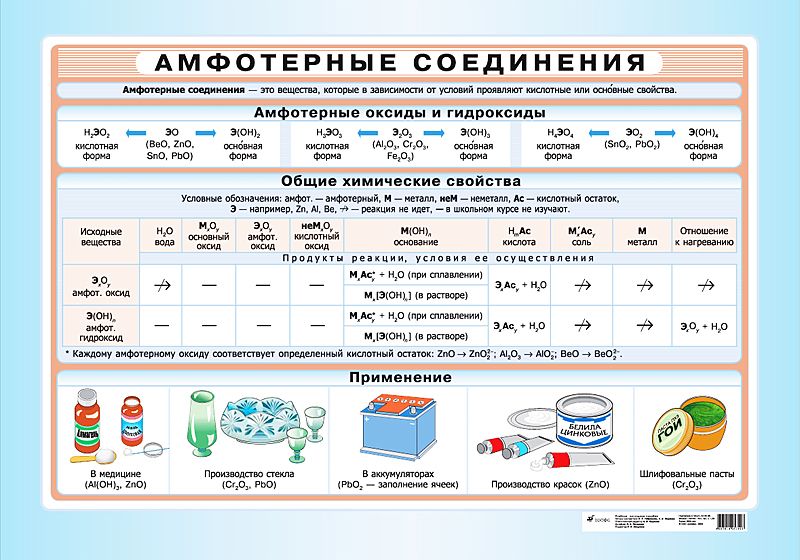 Вода Res.
43, 2317–2348 (2009 г.)). [PubMed] [Google Scholar]
Вода Res.
43, 2317–2348 (2009 г.)). [PubMed] [Google Scholar]
42. Kabay N., Güler E., Bryjak M., Бор в морской воде и методы его выделения — обзор. Опреснение 261, 212–217 (2010). [Google Scholar]
43. Рахмавати К., Гаффур Н., Обри С., Эми Г. Л. Эффективность удаления бора из воды Красного моря с использованием различных мембран SWRO/BWRO. Дж. Член. науч. 423–424, 522–529 (2012). [Google Scholar]
44. Suss M.E., et al.. Опреснение воды с помощью емкостной деионизации: что это такое и чего от него ожидать? Энергетическая среда. науч. 8, 2296–2319 (2015). [Google Scholar]
45. Suss M.E. и др. Емкостное опреснение с проточными электродами. Энергетическая среда. науч. 5, 9511–9519 (2012). [Google Scholar]
46. Дайкстра Дж. Э., Чжао Р., Бишёвель П. М., ван дер Вал А., Идентификация сопротивления и рациональная разработка процесса в емкостной деионизации. Вода Res. 88, 358–370 (2016). [PubMed] [Google Scholar]
47. Коэн И., Авраам Э., Бухадана Ю.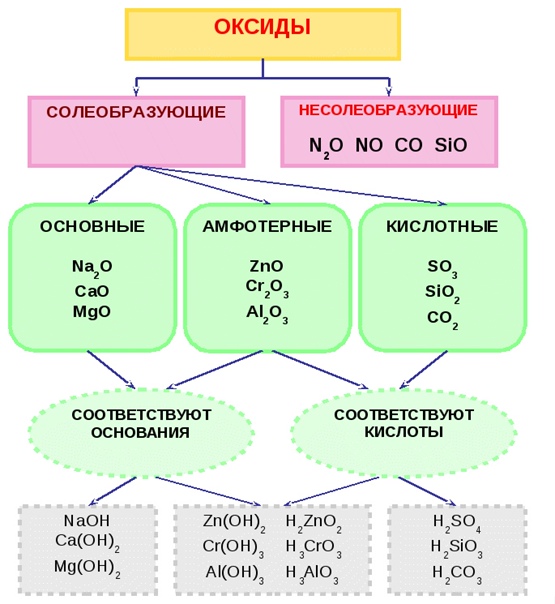
48. Zhang C., He D., Ma J., Tang W., Waite T.D. Сравнение фарадеевских реакций в проточных и проточных системах емкостной деионизации (CDI). Электрохим. Акта 299, 727–735 (2019). [Google Scholar]
49. Сео С. Дж. и др.. Исследование удаления ионов жесткости с помощью емкостной деионизации (CDI) для умягчения воды. Вода Res. 44, 2267–2275 (2010). [PubMed] [Google Scholar]
50. Чжао Р. и др., Зависимая от времени ионная селективность при емкостной зарядке пористых электродов. J. Коллоидный интерфейс Sci. 384, 38–44 (2012). [PubMed] [Академия Google]
51. Suss M.E., Основанная на размере ионная селективность двойных электрических слоев микропор в емкостных деионизационных электродах. Дж. Электрохим. соц. 164, E270–E275 (2017). [Google Scholar]
52. Хоукс С. А. и др. Использование ультрамикропористого углерода для селективного удаления нитратов с помощью емкостной деионизации. Окружающая среда. науч. Технол.
53, 10863–10870 (2019). [PubMed] [Google Scholar]
А. и др. Использование ультрамикропористого углерода для селективного удаления нитратов с помощью емкостной деионизации. Окружающая среда. науч. Технол.
53, 10863–10870 (2019). [PubMed] [Google Scholar]
53. Guyes E.N., Malka T., Suss M.E. Повышение селективности емкостных деионизационных электродов на основе размера ионов. Окружающая среда. науч. Технол. 53, 8447–8454 (2019 г.)). [PubMed] [Google Scholar]
54. Мубита Т. М., Дайкстра Дж. Э., Бишёвель П. М., Ван дер Вал А., Порада С. Селективная адсорбция нитратов над хлоридами в микропористых углях. Вода Res. 164, 114885 (2019). [PubMed] [Google Scholar]
55. Цай С. В., Хакл Л., Кумар А., Хоу С. Х., Изучение электросорбционной селективности нитрата по сравнению с хлоридом при емкостной деионизации (CDI) и мембранно-емкостной деионизации (MCDI). Опреснение 497, 114764 (2021). [Академия Google]
56. Guyes E.N., Shocron A.N., Chen Y., Diesendruck C.E., Suss M.E., Долговечные моновалентные селективные емкостные деионизационные электроды. НПЖ Чистая вода
4, 22 (2021). [Google Scholar]
НПЖ Чистая вода
4, 22 (2021). [Google Scholar]
57. Брусс Т., Белэнджер Д., Лонг Дж. В. Быть или не быть псевдоемкостным? Дж. Электрохим. соц. 162, А5185–А5189 (2015). [Google Scholar]
58. Лукацкая М. Р., Данн Б., Гогоци Ю., Многомерные материалы и архитектуры устройств для будущих гибридных накопителей энергии. Нац. коммун. 7, 12647 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Шримук П. и др., Двумерный карбид молибдена (MXene) с упорядочением бивакансий для опреснения солоноватой и морской воды посредством интеркаляции катионов и анионов. ACS Sustain. Хим. и инж. 6, 3739–3747 (2018). [Google Scholar]
60. Bao W., et al.., Пористый криовысушенный MXene для эффективной емкостной деионизации. Джоуль 2, 778–787 (2018). [Google Scholar]
61. Shen X., Xiong Y., Hai R., Yu F., Ma J., Интегрированный мембранный электрод на основе полностью MXene, сконструированный с использованием Ti3C2T x в качестве интеркалирующего агента для высокоэффективного опреснения. Окружающая среда. науч. Технол.
54, 4554–4563 (2020). [PubMed] [Google Scholar]
Окружающая среда. науч. Технол.
54, 4554–4563 (2020). [PubMed] [Google Scholar]
62. Голубович Н., Омосеби А., Гао С., Лэндон Дж., Лю К., Квазистационарная поляризация выявляет взаимодействие емкостных и фарадеевских процессов при емкостной деионизации. ХимЭлектроХим 4, 2404–2413 (2017). [Google Scholar]
63. Лэндон Дж., Гао С., Омосеби А., Лю К., Серия новых исследователей: влияние локального pH на окисление углерода в архитектурах емкостной деионизации. Окружающая среда. науч. Вода Res. Технол. 7, 861–869(2021). [Google Scholar]
64. He D., Wong C.E., Tang W., Kovalsky P., David Waite T. Фарадеевские реакции при опреснении воды с помощью емкостной деионизации периодического действия. Окружающая среда. науч. Технол. лат. 3, 222–226 (2016). [Google Scholar]
65. Zhang C., He D., Ma J., Tang W., Waite T.D. Фарадеевские реакции при емкостной деионизации (CDI) — проблемы и возможности: обзор. Вода Res. 128, 314–330 (2018). [PubMed] [Google Scholar]
66. Dykstra J. E., Keesman K. J., Biesheuvel P. M., van der Wal A., Теория изменения pH при опреснении воды путем емкостной деионизации. Вода Res.
119, 178–186 (2017). [PubMed] [Google Scholar]
Dykstra J. E., Keesman K. J., Biesheuvel P. M., van der Wal A., Теория изменения pH при опреснении воды путем емкостной деионизации. Вода Res.
119, 178–186 (2017). [PubMed] [Google Scholar]
67. Авраам Э., Нокед М., Соффер А., Аурбах Д., Возможность удаления бора из воды путем емкостной деионизации. Электрохим. Акта 56, 6312–6317 (2011). [Google Scholar]
68. Ким С. Дж., Чой Дж. Х., Ким Дж. Х. Удаление уксусной и серной кислот из гидролизата биомассы с использованием гибридного процесса добавления извести и емкостной деионизации (CDI). Процесс биохим. 47, 2051–2057 (2012). [Google Scholar]
69. Fan C.S., Tseng S.C., Li KC., Hou C.H. Электроудаление мышьяка(III) и мышьяка(V) из водных растворов методом емкостной деионизации. Дж. Азар. Матер. 312, 208–215 (2016). [PubMed] [Академия Google]
70. Fan C.S., Liou S.Y.H., Hou C.H., Емкостная деионизация загрязненных мышьяком подземных вод в однопроходном режиме. Хемосфера 184, 924–931 (2017). [PubMed] [Google Scholar]
71. Хуан С., Хе Д., Тан В., Ковальский П., Уэйт Т. Д., Исследование рН-зависимого удаления фосфатов из сточных вод с помощью мембранно-емкостной деионизации (MCDI). Окружающая среда. науч. Вода Res. Технол.
3, 875–882 (2017). [Google Scholar]
Хуан С., Хе Д., Тан В., Ковальский П., Уэйт Т. Д., Исследование рН-зависимого удаления фосфатов из сточных вод с помощью мембранно-емкостной деионизации (MCDI). Окружающая среда. науч. Вода Res. Технол.
3, 875–882 (2017). [Google Scholar]
72. Wang Z., Gong H., Zhang Y., Liang P., Wang K. Извлечение азота из низкоконцентрированных сточных вод с помощью комбинированного процесса мембранно-емкостной деионизации (MCDI) и ионного обмена (IE). . хим. англ. Дж. 316, 1–6 (2017). [Академия Google]
73. Fang K., et al.. Извлечение аммиака из муниципальных сточных вод методом емкостной деионизации с проточным электродом. хим. англ. Дж. 348, 301–309 (2018). [Google Scholar]
74. Сакар Х., Челик И., Балцик-Канболат С., Кескинлер Б., Карагундуз А. Удаление и извлечение аммония из сточных вод реального дигестата модифицированным методом работы мембранно-емкостной деионизационной установки. Дж. Чистый. Произв. 215, 1415–1423 (2019). [Google Scholar]
75. Jiang J., et al. . Механизмы удаления фосфора из бытовых сточных вод с помощью мембранной емкостной деионизации и оптимизация системы для улучшения удаления фосфатов. Процесс Саф. Окружающая среда. прот.
126, 44–52 (2019). [Google Scholar]
. Механизмы удаления фосфора из бытовых сточных вод с помощью мембранной емкостной деионизации и оптимизация системы для улучшения удаления фосфатов. Процесс Саф. Окружающая среда. прот.
126, 44–52 (2019). [Google Scholar]
76. Фанг К., Хе В., Пэн Ф., Ван К. Извлечение аммиака из концентрированного раствора путем разработки новой многослойной ячейки FCDI. раздел. Очист. Тех. 250, 117066 (2020). [Google Scholar]
77. Хён Х., Ким Дж. Х., Механическое исследование удаления бора мембранами обратного осмоса из морской воды. Дж. Член. науч. 286, 269–278 (2006). [Google Scholar]
78. Bouhadana Y., et al.., Емкостная деионизация растворов NaCl в нестационарных условиях: инверсионная функциональность угольных электродов. Дж. Физ. хим. С 115, 16567–16573 (2011). [Академия Google]
79. Бишевель П. М., Фу Ю., Базант М. З., Диффузный заряд и фарадеевские реакции в пористых электродах. физ. Преп. E Стат. Нонлин. Физика мягких веществ. 83, 061507 (2011). [PubMed] [Google Scholar]
80. Порада С., Чжао Р., ван дер Вал А., Прессер В., Бишевель П. М., Обзор науки и техники опреснения воды методом емкостной деионизации. прог. Матер. науч.
58, 1388–1442 (2013). [Google Scholar]
Порада С., Чжао Р., ван дер Вал А., Прессер В., Бишевель П. М., Обзор науки и техники опреснения воды методом емкостной деионизации. прог. Матер. науч.
58, 1388–1442 (2013). [Google Scholar]
81. Hemmatifar A., Stadermann M., Santiago J.G. Двумерная модель пористого электрода для емкостной деионизации. Дж. Физ. хим. С 119, 24681–24694 (2015). [Google Scholar]
82. Зангле Т. А., Мани А., Сантьяго Дж. Г., О распространении концентрационной поляризации от интерфейсов микроканал-наноканал. Часть II: Численное и экспериментальное исследование. Ленгмюр 25, 3909–3916 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Гайес Э. Н., Шокрон А. Н., Симановский А., Бишёвель П., Сюсс М. Э., Одномерная модель опреснения воды проточной электродной емкостной деионизацией. Опреснение 415, 8–13 (2017). [Академия Google]
84. Хемматифар А. и др.. Термодинамика разделения ионов электросорбцией. Окружающая среда. науч. Технол. 52, 10196–10204 (2018). [PubMed] [Google Scholar]
85. Коэн И., Авраам Э., Нокед М., Соффер А., Аурбах Д. Повышенная эффективность заряда при емкостной деионизации, достигаемая с помощью электродов с обработанной поверхностью и с помощью третьего электрода. . Дж. Физ. хим. С
115, 19856–19863 (2011). [Google Scholar]
Коэн И., Авраам Э., Нокед М., Соффер А., Аурбах Д. Повышенная эффективность заряда при емкостной деионизации, достигаемая с помощью электродов с обработанной поверхностью и с помощью третьего электрода. . Дж. Физ. хим. С
115, 19856–19863 (2011). [Google Scholar]
86. Коэн И., Авраам Э., Бухадана Ю., Соффер А., Аурбах Д. Долговременная стабильность процессов емкостной деионизации для опреснения воды: проблема коррозии положительных электродов. Электрохим. Акта 106, 91–100 (2013). [Google Scholar]
87. Kim C., et al.., Влияние пористой структуры и напряжения ячейки ткани из активированного угля как универсального электродного материала для емкостной деионизации. Углерод 122, 329–335 (2017). [Google Scholar]
88. Bi S., et al.. Пермселективная ионная электросорбция субнанометровых пор при высокой молярной силе позволяет проводить емкостную деионизацию соленой воды. Поддерживать. Энергетическое топливо 4, 1285–1295 (2020). [Google Scholar]
89. Увайид Р., Серафим Н. М., Гайес Э. Н., Айзенберг Д., Сас М. Э., Характеристика и смягчение деградации окисленных катодов во время циклов емкостной деионизации. Углерод
173, 1105–1114 (2021). [Академия Google]
М., Гайес Э. Н., Айзенберг Д., Сас М. Э., Характеристика и смягчение деградации окисленных катодов во время циклов емкостной деионизации. Углерод
173, 1105–1114 (2021). [Академия Google]
90. Лопес Ф. Х., Хименес Э., Эрнандес Ф., Аналитическое исследование по определению бора в пробах воды из окружающей среды. Фрезениус Дж. Анал. хим. 346, 984–987 (1993). [Google Scholar]
91. Легран Л., Шу К., Тедеско М., Дайкстра Дж. Э., Хамелерс Х. В. М., Роль ионообменных мембран и емкостных электродов в мембранной емкостной деионизации (MCDI) для улавливания CO2. J. Коллоидный интерфейс Sci. 564, 478–490 (2020). [PubMed] [Google Scholar]
92. де Вос В. М., Бишевель П. М., де Кейзер А., Кляйн Дж. М., Коэн Стюарт М. А., Адсорбция белка бычьего сывороточного альбумина в плоском щеточном слое полиакриловой кислоты, измеренная с помощью оптическая рефлектометрия. Ленгмюр 24, 6575–6584 (2008). [PubMed] [Академия Google]
93. Hemmatifar A., et al.., Модель равновесия для изменений pH и адсорбции ионов в емкостных деионизационных электродах. Вода Res.
122, 387–397 (2017). [PubMed] [Google Scholar]
Вода Res.
122, 387–397 (2017). [PubMed] [Google Scholar]
94. Оярзун Д. И., Хемматифар А., Палко Дж. В., Штадерманн М., Сантьяго Дж. Г. Ионная селективность при емкостной деионизации с функционализированным электродом: теория и экспериментальная проверка. Вода Res. Икс 1, 100008 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Персат А., Чемберс Р. Д., Сантьяго Дж. Г., Основные принципы химии электролитов для микрожидкостной электрокинетики. Часть I: Кислотно-щелочное равновесие и pH-буферы. Лабораторный чип 9, 2437–2453 (2009). [PubMed] [Google Scholar]
96. Хван Ю. Л., Хельферих Ф., Обобщенная модель многокомпонентной кинетики ионного обмена, включая быстрые обратимые реакции. Реактивные полимеры 5, 237–253 (1987). [Google Scholar]
97. Берковичи М., Леле С. К., Сантьяго Дж. Г., Инструмент моделирования с открытым исходным кодом для электрофоретического суммирования, фокусировки и разделения. Ж. Хроматогр. А 1216, 1008–1018 (2009). [PubMed] [Google Scholar]
98. де Лихтервельде А., тер Хейне А., Хамелерс Х., Бишевел П., Дайкстра Дж. Теория транспорта ионов и электронов в сочетании с биохимическими превращениями в электроактивной биопленке. физ. Преподобный заявл.
014018, д. 12 (2019 г.). [Google Scholar]
де Лихтервельде А., тер Хейне А., Хамелерс Х., Бишевел П., Дайкстра Дж. Теория транспорта ионов и электронов в сочетании с биохимическими превращениями в электроактивной биопленке. физ. Преподобный заявл.
014018, д. 12 (2019 г.). [Google Scholar]
99. Бишевель П. М., Дайкстра Дж. Э., Physics of Electrochemical Processes (2020).
100. Hawks S.A., et al.. Показатели производительности для объективной оценки систем емкостной деионизации. Вода Res. 152, 126–137 (2019). [PubMed] [Google Scholar]
Факты, которые вы должны знать —
Кислород, когда он соединяется с другими элементами, атомами или молекулами, называется оксидами. Здесь мы обсуждаем пример амфотерного оксида и некоторые факты о нем. Амфотерный означает «оба», а слово «амфотерный» происходит от греческого слова «амфотерий», означающего оба. Амфотерные оксиды состоят из металлических элементов.
- Al2O3(т)+6h4O+(водн.)+3h3O(ж)→2Al(Oh3)3+6(водн.
 )
) - Al2O3(т)+2OH-(водн.)+3h3O(ж)→ 2Al(OH)-4(водн.)
- ZnO(т) + 2HNO 3 (водн.) → Zn(NO 3 ) 2 (водн.) + H 2 O(10 9022 9022
- ZnO + H 2 SO 4 → ZNSO 4 + H 2 O
- ZNO (S) + 2NAOH (AQ) → NA 2 ZNO 2 (AQ) 2 ZNO 2 (AQ) + 2
6 2 2 6 2 26. - Al 2 O 3 (s) + 6HCl(aq) → 2AlCl 3 (aq) + 3H 2 O(l)
- Al 2 O 3 (s) + 2NaOH(водн.) → 2NaAlO 2 (водн.) + H 2 O(ж)
- PbO + 2HCl → PbCl 2 + H 2 O
- PBO + 2NAOH + H 2 O → NA 2 [PB (OH) 4 ]
- SNO + 2HCL ⇌ SNCL 2922221515
- + 4NaOH + H 2 O ⇌ Na 4 [Sn(OH) 6 ]
- VO 2 + 2HCl → VOCl 2 + H 2 O
- 4VO 2 + 2NaOH → Na 2 V 4 O 9 + H 2 O
- As2O3(s) + 6HCl(aq) → 2AsCl(aq) + 3h3O(l)
- Ga 2 O 3 + 6HCl → 2GaCl 3 + 3H 2 O
- NaOH + Ga2O3 = h3O + NaGaO2
- Ge2O3 + 2NaOH = Na2Ge2O4 + h3O
- Ge2O3 + HCl = GeCl3 + h3O
- Bi2O3 + 6HCl → 2BiCl3 + 3h3O
- Bi2O3 + NaOH + NaOCl = NaBiO3 + NaCl + h3O
- Sb2O3 + 2NaOH = 2NaSbO2 + h3O
- Sb2O3 + HCl = SbCl3 + h3O
 Соединения кислорода и амфотерные оксиды могут иметь как кислотную, так и основную природу. Следовательно, эти оксиды могут вступать в реакцию нейтрализации и образовывать соль и воду, когда они вступают в реакцию с кислотными соединениями.
Соединения кислорода и амфотерные оксиды могут иметь как кислотную, так и основную природу. Следовательно, эти оксиды могут вступать в реакцию нейтрализации и образовывать соль и воду, когда они вступают в реакцию с кислотными соединениями. Точно так же щелочные металлы реагируют с образованием соли и воды, проявляя свой кислотный характер. Все виды оксидов можно получить при нагревании металлов или любых элементов с кислородом. Когда водные тригалогениды металлов вступают в реакцию с оксидами водорода, образуются гидратированные оксиды. Когда мы опускаемся в группе периодической таблицы, происходит переход оксидов, то есть кислого оксида, затем амфотерного оксида, а затем основных оксидов.
Al2O3(т)+6h4O + (водн.)+3h3O(ж)→2Al(Oh3)3+6(водн.) При взаимодействии оксида алюминия с ионом гидроксония и водой образуются оксиды гидроксида алюминия. Оксид алюминия (Al2O3), который является амфотерным по своей природе и проявляет свойства как кислотного, так и основного оксида.
При попадании оксида алюминия (Al2O3) в реакцию с ионами гидроксида образуется водный гидроксид алюминия. Здесь Al2O3 (оксид алюминия – амфотерный оксид.
ZnO(т) + 2HNO 3 (водн.) → Zn(NO 3 ) 2 (водн.) + H 2 O(ж)При реакции получения оксида цинка с азотной кислотой образуется водный раствор нитрата цинка с удалением воды. Оксид цинка (ZnO) является примером амфотерного оксида.
ZnO + H 2 SO 4 → ZnSO 4 + H 2 OКогда ZnO реагирует с водой с серной кислотой, образуется сульфат цинка. ZnO имеет амфотерную природу.
ZnO(s) + 2NaOH(aq) → Na 2 ZnO 2 (водн.) + H 2 O(ж) Когда оксид цинка (ZnO) реагирует с гидроксидом натрия, который является основанием, оксид натрия цинка образуется при удалении воды, как — продукт. Здесь ZnO является примером амфотерного оксида.
Здесь ZnO является примером амфотерного оксида.
3 соляной кислоты (HCl) происходит образование хлорида алюминия с удалением воды. Здесь Al2O3 является примером амфотерного оксида.
Al 2 O 3 (т) + 2NaOH(водн.) → 2NaAlO 2 (водн.) + H 2 O(л)Когда сильно реагирует с оксидом алюминия основания, такие как гидроксид натрия (NaOH), водный оксид натрия и алюминия образуются при удалении молекул воды. Здесь оксид алюминия Al2O3 является примером амфотерного оксида.
PbO + 2HCl → PbCl 2 + H 2 OКогда оксид свинца реагирует с соляной кислотой, при удалении воды образуется хлорид свинца. Здесь PbO является примером амфотерного оксида.
PbO + 2NaOH + H 2 O → Na 2 [Pb(OH) 4 ] Когда оксид свинца реагирует с основным гидроксидом натрия и водой, получается гидроксид свинца натрия. PbO — амфотерный оксид.
PbO — амфотерный оксид.
SnO + 2HCl ⇌ SnCl 2 + H 2 O
Когда оксид двухвалентного олова (олова (ii) оксид) реагирует с соляной кислотой, при удалении воды образуется хлорид двухвалентного олова. SnO имеет амфотерную природу.
SnO + 4NaOH + H 2 O ⇌ Na 4 [Sn(OH) 6 ]Когда оксид двухвалентного олова реагирует с основанием, таким как гидроксид натрия и вода, образуется гидроксид двухвалентного натрия. SnO является примером амфотерного оксида.
VO 2 + 2HCl → VOCl 2 + H 2 O
Когда водный оксид ванадия реагирует с удалением хлористоводородной кислоты, образуется водный оксид ванадия с удалением хлористоводородной кислоты. Здесь VO2 является примером амфотерного оксида.
4VO 2 + 2NAOH → NA 2 В 4 O + H 2 O, когда Vanadium oxide xecide с Hydiud Hydiud с Hydiud с Hydiud с Hydrood с o
. образуется при удалении воды. Здесь оксид ванадия VO2 имеет амфотерную природу.
образуется при удалении воды. Здесь оксид ванадия VO2 имеет амфотерную природу.
As2O3(s) + 6HCl(aq) → 2AsCl(aq) + 3h3O(l)
При взаимодействии оксида мышьяка с соляной кислотой с удалением воды образуется хлорид мышьяка. As2O3 – пример амфотерного оксида.
Ga 2 O 3 + 6HCl → 2GaCl 3 + 3H 2 OЗдесь оксид галлия является примером амфотерного оксида.
NaOH + Ga2O3 = h3O + NaGaO2Когда оксид галлия реагирует с основанием, таким как гидроксид натрия, при удалении воды образуется оксид галлия натрия. Здесь оксид галлия является примером амфотерного оксида.
Ge2O3 + 2NaOH = Na2Ge2O4 + h3O
Когда оксид германия реагирует с гидроксидом натрия, который является основанием, образуется оксид натрия германия с удалением воды. Оксид германия (Ge2O3) является примером амфотерного оксида.
Ge2O3 + HCl = GeCl3 + h3O При взаимодействии оксида германия с соляной кислотой образуется хлорид германия с удалением воды.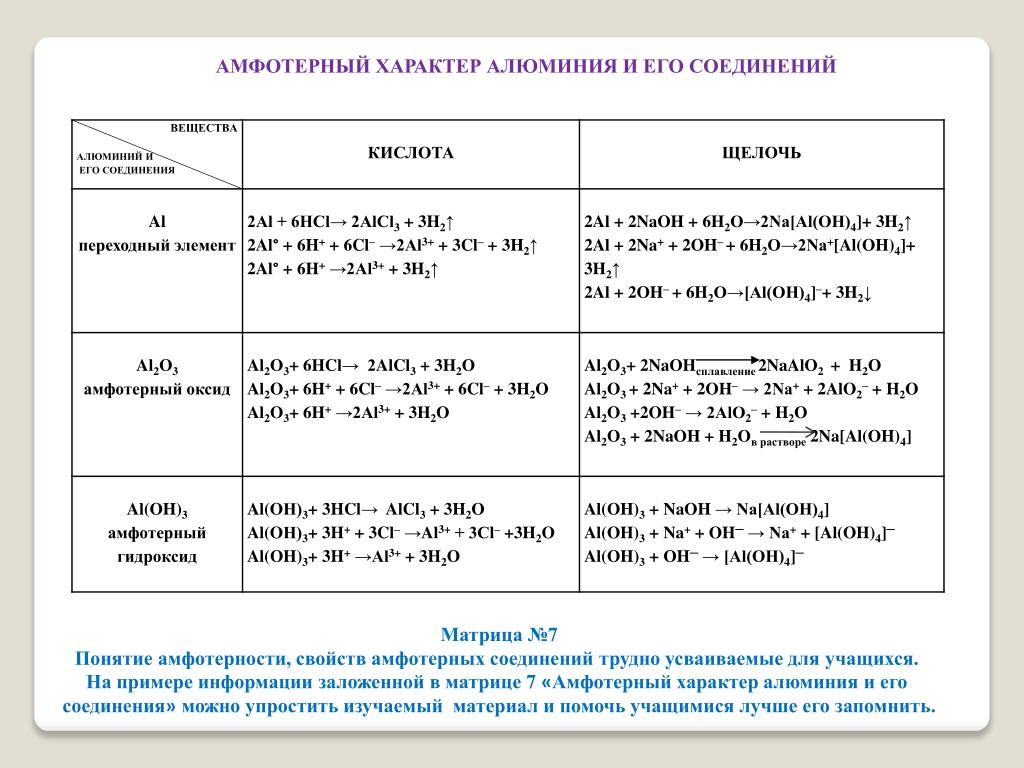 Здесь оксид германия (Ge2O3) является примером амфотерного оксида.
Здесь оксид германия (Ge2O3) является примером амфотерного оксида.
Bi2O3 + 6HCl → 2BiCl3 + 3h3O
При взаимодействии оксида висмута с оксидом соляной кислоты образуется хлорид висмута с удалением воды. Здесь Bi2O3 является примером амфотерного оксида.
Bi2O3 + NaOH + NaOCl = NaBiO3 + NaCl + h3O
При взаимодействии оксида висмута с гидроксидом натрия и оксохлоридом натрия образуется оксид висмута натрия с хлоридом натрия и водой. Здесь оксид висмута является примером амфотерного оксида.
Sb2O3 + 2NaOH = 2NaSbO2 + h3O
При взаимодействии оксида сурьмы с гидроксидом натрия образуются оксиды сурьмы натрия с удалением воды. Здесь Sb2O3 является примером амфотерного оксида.
Sb2O3 + HCl = SbCl3 + h3O При взаимодействии оксида сурьмы с соляной кислотой образуется хлорид сурьмы с удалением молекулы воды. Здесь оксид сурьмы является примером амфотерного оксида.
Оксиды действуют как кислоты, так и основания являются амфотерными оксидами. 2 9Элементы группы 0619 nd и 13 th , которые являются более легкими элементами, и некоторые элементы d-блока, а также элементы группы 14 th и 15 th , которые являются более тяжелыми по своей природе, могут иметь амфотерные оксиды при реакции с кислородом. Самые основные оксиды находятся в нижней левой части периодической таблицы, а очень кислотные оксиды — в верхней правой части периодической таблицы.
Элементы береллий (Be), алюминий (Al), галлий (Ga), германий (Ge), мышьяк (As), олово (Sn), свинец (Pb), сурьма (Sb) и висмут (Bi) являются элементы, которые могут образовывать амфотерные оксиды при взаимодействии с кислородом. Эти элементы расположены по диагонали между кислотными и основными оксидами. Таким образом, граница между кислотными и основными оксидами проходит по диагонали.
Некоторые важные факты об амфотерных оксидах Амфотерная природа любых оксидов металлов зависит от степени окисления этого металла. Амфотерная природа любого оксида, возможно, отражает способность металла поляризовать соседние оксидные ионы (катионы или анионы), т. е. сохранять важный ковалентный характер связей металла с кислородом (МО). Амфотерные оксиды могут проявлять как характеристики кислотных оксидов, так и основных оксидов.
Амфотерная природа любого оксида, возможно, отражает способность металла поляризовать соседние оксидные ионы (катионы или анионы), т. е. сохранять важный ковалентный характер связей металла с кислородом (МО). Амфотерные оксиды могут проявлять как характеристики кислотных оксидов, так и основных оксидов.
Также обладает способностью нейтрализовать как кислотные, так и основные оксиды. Эта способность амфотерных оксидов увеличивается с увеличением степени окисления по мере увеличения положительного заряда центрального атома металла. Следовательно, оксиды группы 15 -й таблицы Менделеева, имеющий более низкую степень окисления, является амфотерным, в то время как оксиды, имеющие более высокую степень окисления, более кислые, чтобы проявлять амфотерную природу.
Кислород при взаимодействии с металлами или неметаллическими элементами образуются соединения, представляющие собой оксиды. В основном амфотерные оксиды классифицируются как оксиды металлов, которые могут реагировать как с кислотами, так и с основаниями, а также образовывать соли и воду.

 )
)