Амфотерность оксида и гидроксида алюминия
I. Оксид алюминия
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6HCl = 2AlCl3 + 3H2O
При сплавлении образуется метаалюминат натрия:
Al2O3(тв)+ 2NaOH (тв) t→ 2NaAlO2 + H2O
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
II. Гидроксид алюминия
Al(OH)

Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
Врасплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
III. Тренажеры
Тренажёр №1 — Амфотерные свойства оксида алюминия
Тренажёр №2 — Амфотерные свойства оксида алюминия (виртуальная лаборатория)
Тренажёр №3 — Получение гидроксида алюминия реакцией обмена
Тренажёр №4 — Характеристика оксида алюминия
Тренажёр №5 — Характеристика гидроксида алюминия
IV. Задания для закрепления
Задания для закрепления
Задание №1. Выполните виртуальный Эксперимент
Оформите отчёт:
Изучение свойств оксида алюминия
Цель:
Оборудование:
Реактивы:
Ход работы:
|
Название опыта |
Что делали? |
Что наблюдали? |
Уравнение реакции |
|
1. Взаимодействие с кислотами |
|||
|
2. Взаимодействие со щелочами |
Вывод:
Задание №2. Загрузите и посмотритеЭксперимент
Оформите отчёт:
Изучение свойств гидроксида алюминия
Оформите отчёт в виде
Цель:
Оборудование:
Реактивы:
Ход работы:
|
Название опыта |
Что делали? |
Что наблюдали? |
Уравнение реакции |
|
1. |
|||
|
2. Взаимодействие со щелочами |
Вывод:
Задание №3. Осуществите превращения:
1) Al -> Al(OH)3 -> AlCl3 — > Al(OH)3 > Na[Al(OH)4]
2) Al -> Al2O3 ->Na[Al(OH)4] -> Al(OH)3 -> Al2O3 — > Al
Промышленный синтез тонкодисперсного гидроксида алюминия при переработке алюминийсодержащего сырья
Journals → Цветные металлы → 2018 → #10 → Back
| Легкие металлы, углеродные материалы | |
| ArticleName | Промышленный синтез тонкодисперсного гидроксида алюминия при переработке алюминийсодержащего сырья |
| DOI | 10. 17580/tsm.2018.10.06 17580/tsm.2018.10.06 |
| ArticleAuthor | Бричкин В. Н., Сизяков В. М., Облова И. С., Федосеев Д. В. |
| ArticleAuthorData | Санкт-Петербургский горный университет, Санкт-Петербург, Россия: В. Н. Бричкин, зав. кафедрой металлургии Эл. почта (общий): kafmet@spmi.ru |
| Abstract | Рост потребления материалов на основе гидроксидов и оксидов алюминия высокой дисперсности с заданными свойствами приводит к развитию разнообразных способов их получения, многие из которых не рассчитаны на массовое производство подобной продукции и обладают низкой адаптацией к существующему металлургическому комплексу. Заметным потенциалом для решения этой задачи обладает современное производство глинозема, основанное на получении и последующей переработке щелочных алюминатных растворов с использованием приемов, хорошо известных в заводской практике.  Это позволяет высказать предположение о двойственном механизме формирования устойчивых кристаллических зародышей в условиях низких температур и возможности получения на этой основе осадков высокой дисперсности при нейтрализации алюминатных растворов промышленного состава. Это позволяет высказать предположение о двойственном механизме формирования устойчивых кристаллических зародышей в условиях низких температур и возможности получения на этой основе осадков высокой дисперсности при нейтрализации алюминатных растворов промышленного состава.
Работа проведена при финансовой поддержке Российского научного фонда по Соглашению № 18-19-00577 от 26.04.2018 о предоставлении гранта на проведение фундаментальных научных исследований и поисковых научных исследований. |
| keywords | Алюминийсодержащее сырье, щелочные алюминатные растворы, гидроксид алюминия, крупность, закономерности осаждения, теоретические основы, экспериментальные исследования |
| References | 1. Болдин М. С., Сахаров Н. В., Шотин С. В. и др. Композиционные керамики на основе оксида алюминия, полученные методом электроимпульсного плазменного спекания для трибологических применений // Физика твердого тела. 4. 5. Sizyakov V. M., Tikhonova E. V., Cherkasova M. V. Efficiency of oxide compounds of magnesium in purification of alumina industry solutions from organic impurities // Non-ferrous Мetals. 2013. No.  2. P. 23–26. 2. P. 23–26.6. Рутман Д. С., Пермикина Н. М., Жолобова Л. С., Кудрявцева Т. И., Мытников А. В., Андреев Н. М. Получение активноспекающегося глинозема и корундовой керамики на его основе // Огнеупоры. 1975. № 9. С. 45–52. 7. Лысенко А. П., Наливайко А. Ю. Механизм получения гидроксида алюминия в электролизере и коагуляция мелких частиц во время седиментации в токопроводящих солевых растворах // Цветные металлы. 2015. № 1. С. 49–53. 8. Jinfeng Li, Wei Chen, Hai-xia Deng. Study of ultrafine α-Al2O3 powder preparation // 31st International Conference of ICSOBA «Bauxite, Alumina, Aluminium industry in Russia and new global developments» : Travaux ICSOBA. 2013. Vol. 38, No. 42. P. 329–332. 9. Wang Xing Li. Alumina Production Theory & Technology. — Changsha : Central South University, 2010. — 411 p. 10. Freij S. J., Parkinson G. M. Surface morphology and crystal growth mechanism of gibbsite in industrial Bayer liquors // Hydrometallurgy.  2005. Vol. 78. P. 246–255. 2005. Vol. 78. P. 246–255.11. Бричкин В. Н., Кремчеева Д. А., Матвеев В. А. Количественное влияние затравки на показатели массовой кристаллизации химических осадков // Записки Горного института. 2015. Т. 211. С. 64–70. 13. Бричкин В. Н., Краславский А. Явление изотермического перехода метастабильных алюминатных растворов в лабильную область и перспективы его промышленного использования // Записки Горного института. 2016. Т. 217. С. 80–87. 14. Зеликман А. И., Вольдман Г. М., Беляевская Л. В. Теория гидрометаллургических процессов. — М. : Металлургия, 1983. — 424 с. 15. Ханамирова А. А. Глинозем и пути уменьшения в нем примесей. — Ереван : Изд-во АН Арм. ССР, 1983. — 243 с. |
| Language of full-text | russian |
| Full content | Buy |
Back
Ионы алюминия в гидроокиси алюминия, фосфатах и системах почва-вода
- Опубликовано:
- М. RAUPACH 1
Природа том 188 , страницы 1049–1050 (1960)Цитировать эту статью
84 доступа
3 Цитаты
Сведения о показателях
Abstract
В последние годы большое внимание уделяется растворимости фосфатов алюминия в почвах. Из изученных синтетических препаратов варисцит, Al(OH) 2 H 2 PO 4 , был наиболее тщательно исследован и оценены критерии его существования в почвах 1 . Предполагалось, что произведение растворимости варисцита можно определить по активности ионных частиц в выражении K sp = (Al 3+ )(OH − ) 2 (H 2 PO 4 − ), и на этой основе были сделаны прогнозы содержания фосфатов в почвах 2 .
Предполагалось, что произведение растворимости варисцита можно определить по активности ионных частиц в выражении K sp = (Al 3+ )(OH − ) 2 (H 2 PO 4 − ), и на этой основе были сделаны прогнозы содержания фосфатов в почвах 2 .
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписка на журнал
Получите полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за выпуск
Подписаться
Расчет налогов будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Ссылки
Линдси В.Л., Пич М. и Кларк Дж.С., Soil Sci.
 соц. амер. проц. , 23 , 357 (1959).
соц. амер. проц. , 23 , 357 (1959).Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Хсу, П. Х., и Джексон, М. Л., Soil Sci. , 90 , 16 (1960).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Киттрик, Дж. А., и Джексон, М. Л., Почвоведение. соц. амер. проц. , 19 , 455 (1955).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Hemwall, J. B., Soil Sci. , 83 , 101 (1957).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Wright, B.C., and Peech, M., Soil Sci. , 90 , 32 (1960).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
См.
 Райт, Британская Колумбия, Дисс. Abstr., 20 , 2991 (1960).
Райт, Британская Колумбия, Дисс. Abstr., 20 , 2991 (1960).Полман Г.Г., Почвоведение. , 36 , 47 (1933).
КАС Google ученый
Раупах, М., и Пайпер, К.С., , Австралия. Дж. Агрик. Рез. , 10 , 818 (1959).
Артикул КАС Google ученый
Download references
Author information
Authors and Affiliations
Division of Soils, Commonwealth Scientific and Industrial Research Organization, Adelaide, South Australia
M. RAUPACH
Authors
- M. RAUPACH
View author публикации
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатки и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Природа комплексов гидроксид алюминия-монтмориллонит1 | Американский минералог
Skip Nav Destination
Исследовательская статья| 01 июня 1966 г.
Дж. Э. Брайдон;
Х. Кодама
Американский минералог (1966) 51 (5-6): 875–889.
История статьи
получено:
01 ноября 1965
принято:
16 февраля 1966
первый онлайн:
06 июля 2018
- Цитировать
- Посмотреть эту цитату
- Добавить в менеджер цитирования
- Делиться
- Твиттер
- MailTo
- Инструменты
Получить разрешения
- Поиск по сайту
Цитирование
Дж. Э. Брайдон, Х. Кодама; Природа комплексов гидроксид алюминия-монтмориллонит. Американский минералог 1966;; 51 (5-6): 875–889. doi:
Э. Брайдон, Х. Кодама; Природа комплексов гидроксид алюминия-монтмориллонит. Американский минералог 1966;; 51 (5-6): 875–889. doi:
Скачать файл цитирования:
- Рис (Зотеро)
- Рефменеджер
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Расширенный поиск
Комплексы гидроксид алюминия-бентонит Вайоминга сравнивали с диоктаэдрическим хлоритом и с различными синтетическими чистыми гидроксидами алюминия с помощью x — дифракция лучей, ДТА, ТГА и ИК-поглощение.
Гидроксид алюминия полностью входит в прослойку монтмориллонита и принимает гиббзитоподобную монослойную структуру в количествах до 8 me Al/г глины. Помимо этого количества, но ниже количества (16 me Al/г глины), необходимого для идеального слоя гиббсита, некоторое количество гидроксида присутствует вне промежуточного слоя монтмориллонита.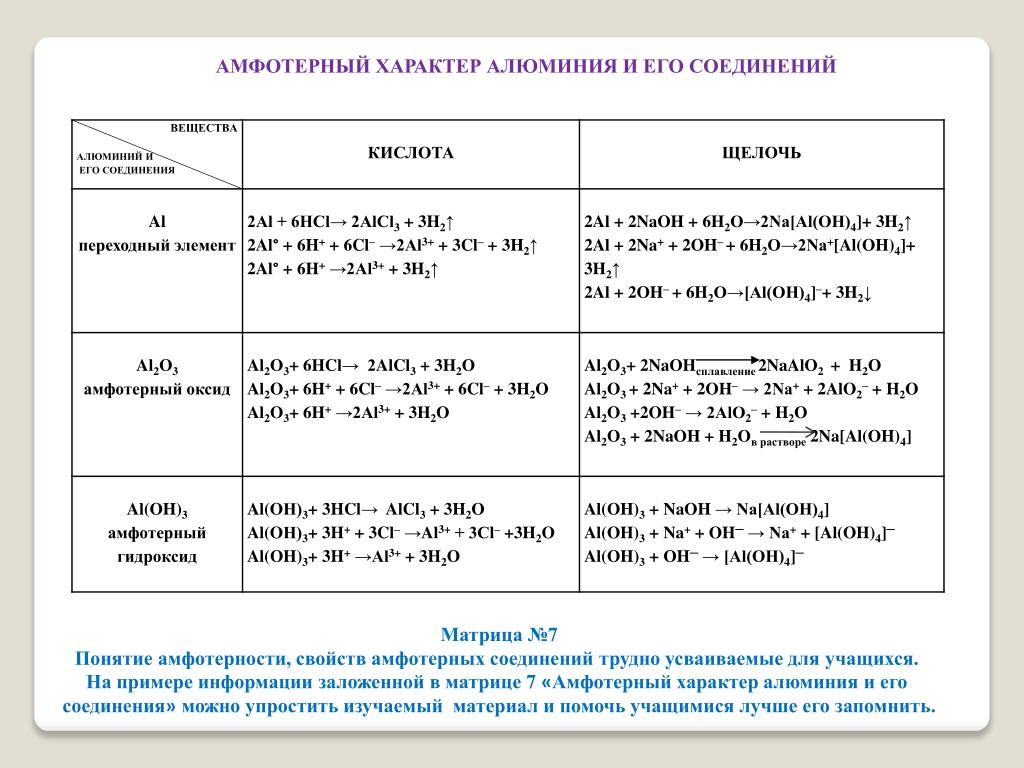

 Взаимодействие с кислотами
Взаимодействие с кислотами
 Вестник Нижегородского университета имени Н. И. Лобачевского. 2012. № 6 (1). С. 32–37.
Вестник Нижегородского университета имени Н. И. Лобачевского. 2012. № 6 (1). С. 32–37. соц. амер. проц. , 23 , 357 (1959).
соц. амер. проц. , 23 , 357 (1959). Райт, Британская Колумбия, Дисс. Abstr., 20 , 2991 (1960).
Райт, Британская Колумбия, Дисс. Abstr., 20 , 2991 (1960).