Кислоты в свете ТЭД — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. КИСЛОТЫ В СВЕТЕ ТЭД.
План работы на уроке.1. Повторить классификацию и формулы
кислот. Номенклатуру.
2. Дать определение кислотам с точки зрения
ТЭД.
3. Изучить физические свойства кислот.
4. Научиться определять кислотную среду
раствора.
5. Изучить взаимодействие кислот с
основаниями.
2. КИСЛОТЫ: НАЗВАНИЯ, ОБЩАЯ ФОРМУЛА, ОПРЕДЕЛЕНИЕ.
СПРАВКА: параграф 20 стр. 71.ЗАДАНИЕ: выберите формулы кислот, запишите в
тетрадь и назовите.

NaOH, HCL, KCL, h3SO4, Na2O, h4PO4,
AL(OH)3, HNO3, Cu2O, K2SO4, h3SiO3, Na2S,
h3CO3, h3S.
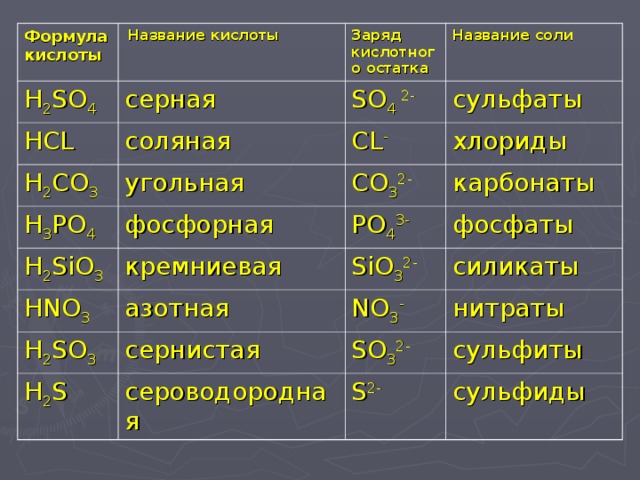
3. Формулы и названия кислот.
HCLh3SO4
h4PO4
HNO3
h3SiO3
h3CO3
h3S
соляная кислота
серная кислота
фосфорная кислота
азотная кислота
кремниевая кислота
угольная кислота
сероводородная кислота
4. Кислоты: общая формула и определение.
Кислоты – сложные вещества, молекулыкоторых состоят из атомов водорода и
кислотных остатков.
Общая формула:
+
Н Ас
—
5. кислоты
По наличиюкислорода
по основности
Одно-
двух-
Трех-
Кислородсодер-ие
Бескислородные
?
?
?
?
?
По растворимости
растворимые
?
нерастворимые
?
6. По стабильности
Нестабильныеh3SO3, h3CO3,
h3SiO3
Стабильные
h3SO4, h4PO4,
HCL
h3SiO3
h3CO3
CO2
SiO2
h3O
h3SO3
SO2
h3O
h3O
7. Разложение угольной кислоты
h3CO3CO2
h3O
по летучести
Летучие
HCL, HNO3,
h3S
Нелетучие
h3SO4,h4PO4
h3SiO3
9.
 Характеристика кислот.Дайте характеристику кислотам:
Характеристика кислот.Дайте характеристику кислотам:1 ряд
2 ряд
3 ряд
азотная
серная
кремниевая
кислота
кислота
кислота
По признакам: — наличие кислорода
— основность
— растворимость в воде
— летучесть
— стабильность
10. Кислоты в свете ТЭД.
Диссоциация кислот.По степени
электролитической
диссоциации
Сильные
h3SO4, HCL,
HNO3
Слабые
h3S, h3SO3,
h3CO3
11. Кислота как сильный или слабый электролит.
Сильные электролиты – которые прирастворении в воде практические полностью
диссоциируют на ионы.
Для сильных электролитов процесс диссоциации практически необратим.
+
HNO3 = H + NO3
Слабые электролиты – которые при растворении в воде почти не диссоциируют на ионы.
Для слабых электролитов процесс диссоциации
обратим.
+
HNO2
H + NO2
12. Сильные и слабые электролиты.
13. Разрушительное действие серной кислоты на различные материалы.

14. Диссоциация кислот.
Вариант 1.1.Выберите сильные электролиты:
а)h4PO4, б)h3SO4, в)HCL, г)HNO3, д)HNO2.
2.Запишите уравнение диссоциации этих в-в.
3.Укажите в растворах каких веществ универс.
индикатор окрасится в красный цвет.
а)HCL, б)NaOH, в)K2O, г)HNO3, д)KNO3.
Вариант 2.
1.Выберите слабые электролиты:
а)h4PO4, б)h3SiO3, в)HCL, г)HNO3, д)h3СO3.
2.Запишите уравнение диссоциации этих в-в.
3.Укажите в растворах каких веществ м.о.
индикатор окрасится в красно-розовый цвет.
а)HCL, б)Na2O, в)KOН, г)h3SO4, д)К2SO4.
15. Диссоциация кислот. ОТВЕТЫ.
Вариант 1.1. б), в), г).
2+
2. h3SO4 = 2H + SO4
+
HCL = H + CL
+
HNO3 = H + NO3
3. а), г).
Вариант 2.
1. а), б), д).
3+
2. h4PO4
3H + PO4
h3SiO3 =
2+
h3CO3
2H + CO3
3. а), г).
16. Общие химические свойства кислот.
+—
HCL = H + CL
+
HNO3 = H + NO3 2h3SO4 = 2H + + SO4
Общие химические свойства кислот.

1. Изменяют окраску индикатора.
2. Взаимодействуют с основаниями.
3. Реагируют с металлами.
4. Взаимодействуют с основными
оксидами.
5. Реагируют с солями.
Общие свойства водных растворов кислот
Обусловлены присутствием ионов
водорода!
17. Изменение окраски индикаторов.
Индикатор.Метиловый
оранжевый
(м.о.)
Окраска
индикатора
в
нейтральной
среде.
ВОДА
Окраска
индикатора в
кислой среде.
КИСЛОТА
оранжевый
Розовокрасный
Универсальный зеленоватый
бумажный
Фенолфталеин бесцветный
(Ф.ф.)
Окраска
индикатора в
щелочной
среде.
ЩЕЛОЧЬ
красный
синий
бесцветный
малиновый
18. Взаимодействие кислот с основаниями.
Гидроксид натрия и соляная кислотаГидроксид натрия и серная кислота
Гидроксид алюминия и азотная кислота
English Русский Правила
Угольная и кремниевая кислоты — Mind Map
Кремниевая кислота
r
Кремниевая кислота h3SiO3 является двухосновной и более слабой, чем угольная кислота. Её получают взаимодействием силикатов (Na2SiO3 или K2SiO3) с более сильными кислотами, например h3SO4, HCl:Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl Сокращенная форма:2H+ + SiO32- = h3SiO3🠗
Её получают взаимодействием силикатов (Na2SiO3 или K2SiO3) с более сильными кислотами, например h3SO4, HCl:Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl Сокращенная форма:2H+ + SiO32- = h3SiO3🠗
Cвойства кремниевой кислоты
r
При незначительном нагревании или длительном хранении кислота разлагается на оксид и воду:h3SiO3 ⟶ᵗ h3O + SiO2Качественная реакция на силикат-ион: Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl Сокращенная форма:2H+ + SiO32- = h3SiO3🠗 Соли кремниевой кислоты реагируют :1.с кислотами:Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl 2.с солями:Na2SiO3 + CaCl2 = 2NaCl + CaSiO3🠗3.с щелочами: h3SiO3 + 2NaOH = Na2SiO3 + 2h3O
Соли кремниевой кислоты
r
Соли кремниевой кислотыДля кремниевой кислоты известны только средние соли — силикаты. Большинство из них плохо растворяются в воде. Растворимые соли силикат натрия и силикат калия называют «растворимые стёкла» и используют как «канцелярский клей». Получить силикаты можно сплавлением оксида кремния(IV) как кислотного оксида со щелочами, оксидами металлов, а также с карбонатами:CaO + SiO2 = CaSiO3;2NaOH(тв) + SiO2 = Na2SiO3 + h3O🠕;Na2CO3 + SiO2 = Na2SiO3 + CO2🠕;
Получить силикаты можно сплавлением оксида кремния(IV) как кислотного оксида со щелочами, оксидами металлов, а также с карбонатами:CaO + SiO2 = CaSiO3;2NaOH(тв) + SiO2 = Na2SiO3 + h3O🠕;Na2CO3 + SiO2 = Na2SiO3 + CO2🠕;
Качественная реакция на силикат-ион
Производство строительных материалов на основе силикатов и карбонатов
r
Природные силикаты и карбонаты служат основой для производства цемента, бетона, стекла.Цемент получают спеканием известняка CaCO3 и глины, одна из составных частей которой — каолинит, включающий оксиды SiO2 и Al2O3.Бетон изготавливают из смеси песка, цемента и воды. Добавляя в такую смесь шлак, получают шлакобетон. Если свежеприготовленной смесью заливают металлический каркас, то при затвердевании получаются железобетонные конструкции. При использовании в качестве наполнителя газообразных веществ получают пенобетон.Стекло применяют в строительной сфере (остекление окон, витражей, дверей, оранжерей), в оптической промышленности, медицине, машиностроении, приборостроении, современной архитектуре, электронике, быту. Сырьём для производства стекла («варки стекла») являются карбонаты натрия и кальция, а также оксид кремния(IV),то есть кристаллическая сода, мел или известняк и кварцевый песок (Na2CO3, CaCO3, SiO2). В состав стекла входят оксиды натрия, кальция и кремния в мольном соотношении 1 : 1 : 6.Для придания стеклу особых свойств в исходную смесь вводят добавки. Так, для его окрашивания используют различные оксиды: СuO придаёт голубой цвет, FeO — зелёный, СоО — от голубого до сине-фиолетового. Глушители уменьшают прозрачность стекла, делают его матовым. Наклеивание полимерных плёнок увеличивает прочность. Армирование металлической проволокой придаёт декоративные свойства и препятствует образованию больших осколков при растрескивании. Следует отметить возможность многократной переработки стекла.
Сырьём для производства стекла («варки стекла») являются карбонаты натрия и кальция, а также оксид кремния(IV),то есть кристаллическая сода, мел или известняк и кварцевый песок (Na2CO3, CaCO3, SiO2). В состав стекла входят оксиды натрия, кальция и кремния в мольном соотношении 1 : 1 : 6.Для придания стеклу особых свойств в исходную смесь вводят добавки. Так, для его окрашивания используют различные оксиды: СuO придаёт голубой цвет, FeO — зелёный, СоО — от голубого до сине-фиолетового. Глушители уменьшают прозрачность стекла, делают его матовым. Наклеивание полимерных плёнок увеличивает прочность. Армирование металлической проволокой придаёт декоративные свойства и препятствует образованию больших осколков при растрескивании. Следует отметить возможность многократной переработки стекла.
Cвойства солей угольной кислоты
r
1.Качественная реакция на карбонат-ион:CaCO3 + 2HCl = CaCl2 + h3O + CO2🠕Сокращенная форма:CaCO3 + 2H+ = Ca2+ + h3O + CO2🠕2. Взаимопревращение карбонатов и гидрокарбонатов:Ca(HCO3)2 + Ca(OH)2 ⟶ 2CaCO3🠗 + 2h3OCaCO3 + h3O + CO2🠕 ⟶ Ca(HCO3)23.Взаимодействие с кислотами:гидрокарбонаты:NaHCO3 + HCl = NaCl + h3O + CO2🠕Сокращенная форма:HCO3- + H+ = h3O + CO2🠕карбонаты:MgCO3 + 2HCl = MgCl2 + h3O + CO2🠕Сокращенная форма:MgCO3 + 2H+ = Mg2+ + h3O + CO2🠕4.Термическое разложение (т.к. угольная кислота обладает невысокой термической устойчивостью (кроме карбонатов натрия и калия, рубидия и цезия):2NaHCO3 = Na2CO3 + h3O + CO2🠕 CaCO3 =CaO + CO2🠕5. с активными металлами: h3CO3 + Mg = MgCO3 + h3🠕6. с основными оксидами:h3CO3 + CaO = CaCO3🠗 + h3O7. с основаниями:h3CO3 + 2NaOH(конц) = Na2CO3 + 2h3Oh3CO3 + 2NaOH(разб) = NaHCO3 + h3O8.В обычных условиях распадается на углекислый газ и воду:h3CO3 ⇆ h3O + CO2🠕
Взаимопревращение карбонатов и гидрокарбонатов:Ca(HCO3)2 + Ca(OH)2 ⟶ 2CaCO3🠗 + 2h3OCaCO3 + h3O + CO2🠕 ⟶ Ca(HCO3)23.Взаимодействие с кислотами:гидрокарбонаты:NaHCO3 + HCl = NaCl + h3O + CO2🠕Сокращенная форма:HCO3- + H+ = h3O + CO2🠕карбонаты:MgCO3 + 2HCl = MgCl2 + h3O + CO2🠕Сокращенная форма:MgCO3 + 2H+ = Mg2+ + h3O + CO2🠕4.Термическое разложение (т.к. угольная кислота обладает невысокой термической устойчивостью (кроме карбонатов натрия и калия, рубидия и цезия):2NaHCO3 = Na2CO3 + h3O + CO2🠕 CaCO3 =CaO + CO2🠕5. с активными металлами: h3CO3 + Mg = MgCO3 + h3🠕6. с основными оксидами:h3CO3 + CaO = CaCO3🠗 + h3O7. с основаниями:h3CO3 + 2NaOH(конц) = Na2CO3 + 2h3Oh3CO3 + 2NaOH(разб) = NaHCO3 + h3O8.В обычных условиях распадается на углекислый газ и воду:h3CO3 ⇆ h3O + CO2🠕
Качественная реакция на карбонат-ион
h3CO3 → CO2 + h3O разложение в присутствии радикалов h3O, HCOOH, Ch4COOH, h3SO4 и HO2: нестабильность газофазной молекулы h3CO3 в тропосфере и нижней стратосфере
H
2 CO 3 → CO 2 + H 2 O Разложение в присутствии H 2 O, HCOOH, CH 3 COOH, H 2 SO 4 и HO 2 2.
Сурав Гошал и и Монту К. Хазра* и
Принадлежности автора
* Соответствующие авторы
и Отделение химических наук, Институт ядерной физики Саха, 1/AF Bidhannagar, Kolkata-700 064, Индия
Электронная почта: h.
Аннотация
Чтобы понять стабильность молекулы газообразной угольной кислоты (H 2 CO 3 ), особенно в тропосфере Земли и нижней стратосфере, здесь мы сообщаем о высокоуровневых квантово-химических расчетах, исследующих энергетику H 2 CO 3 → CO 2 + H 2 O реакция разложения через кратчайший путь в присутствии от одной до трех молекул воды (H 2 O), а также в присутствии муравьиной кислоты (FA), уксусной кислоты (AA), серной кислоты ( SA) и гидропероксидный (HO 2 ) радикал. Расчеты выполнены на МП2/авг- сс -пВДЗ, МП2/авг- 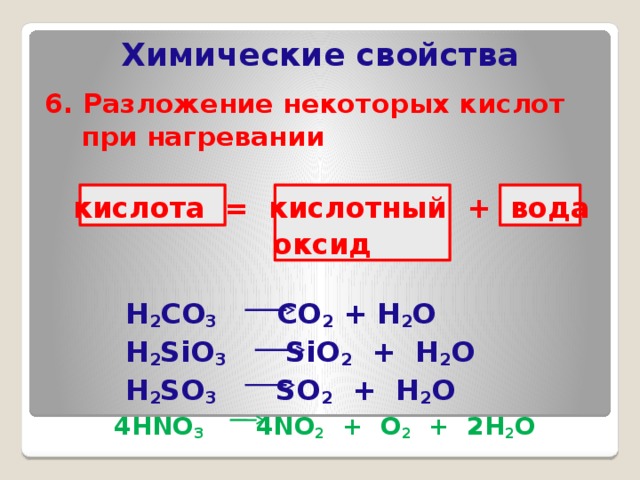 Сравнение скоростей реакций с учетом туннельных поправок по несимметричным потенциальным барьерам Эккарта позволяет предположить, что на высоте 0 км в чистой среде атмосферы Земли газообразный H 2 CO 3 молекула становится нестабильной в присутствии мономера H 2 O, димера, FA и AA. Это следует из того, что H 2 CO 3 → CO 2 + H 2 2 O практически безбарьерные реакции разложения практически эффективны, скорости реакций разложения O близки к безбарьерным реакциям. H 2 O с добавлением мономера, димера, FA и AA H 2 CO 3 реакции разложения сравнимы с точностью ~15 раз. Точно так же на высоте 0 км в загрязненной среде, а также в диапазоне высот от 5 до 15 км преобладающим путем реакции является только разложение H 2 CO 3 с участием FA или AA, особенно, среди всех рассмотренных здесь путей.
Сравнение скоростей реакций с учетом туннельных поправок по несимметричным потенциальным барьерам Эккарта позволяет предположить, что на высоте 0 км в чистой среде атмосферы Земли газообразный H 2 CO 3 молекула становится нестабильной в присутствии мономера H 2 O, димера, FA и AA. Это следует из того, что H 2 CO 3 → CO 2 + H 2 2 O практически безбарьерные реакции разложения практически эффективны, скорости реакций разложения O близки к безбарьерным реакциям. H 2 O с добавлением мономера, димера, FA и AA H 2 CO 3 реакции разложения сравнимы с точностью ~15 раз. Точно так же на высоте 0 км в загрязненной среде, а также в диапазоне высот от 5 до 15 км преобладающим путем реакции является только разложение H 2 CO 3 с участием FA или AA, особенно, среди всех рассмотренных здесь путей. Из результатов прогноза уровня CCSD(T)/aug- cc -pVTZ видно, что на высотах 5, 10 и 15 км в атмосфере Земли скорости реакции H 9 с участием ТВС0050 2 CO 3 Декомпозиция в зависимости от средних концентраций FA составляет соответственно 10 2 , 10 5 и 100050 6 Time Right Spect Spate Spated с таковыми реакции, связанная с расписанием, связанных с реактивными. разложение водного мономера H 2
Из результатов прогноза уровня CCSD(T)/aug- cc -pVTZ видно, что на высотах 5, 10 и 15 км в атмосфере Земли скорости реакции H 9 с участием ТВС0050 2 CO 3 Декомпозиция в зависимости от средних концентраций FA составляет соответственно 10 2 , 10 5 и 100050 6 Time Right Spect Spate Spated с таковыми реакции, связанная с расписанием, связанных с реактивными. разложение водного мономера H 2

Разложение углекислот, кульминационное Элизабет Бёрк
Карбоновая кислота = углекислый газ + вода
H3CO3
Визуальное представление сбалансированного химического уравнения:
Баланс. Химическое уравнение:
202013.3.3c3. CO2 + h3OФизические и химические свойства реагента: реагент нестабилен и не может быть выделен. Он существует только в виде раствора в воде. Угольная кислота является слабой кислотой.
Способ получения реагента: Одним из способов образования угольной кислоты является растворение двуокиси углерода в воде. Вы можете растворить больше углекислого газа, если на газ оказывается более высокое давление. Его также можно получить путем взаимодействия бикарбоната или карбоната с кислотой. Например, при смешивании пищевой соды (бикарбоната натрия) с уксусом (уксусной кислотой) образуется угольная кислота, которая немедленно начинает разлагаться с выделением углекислого газа.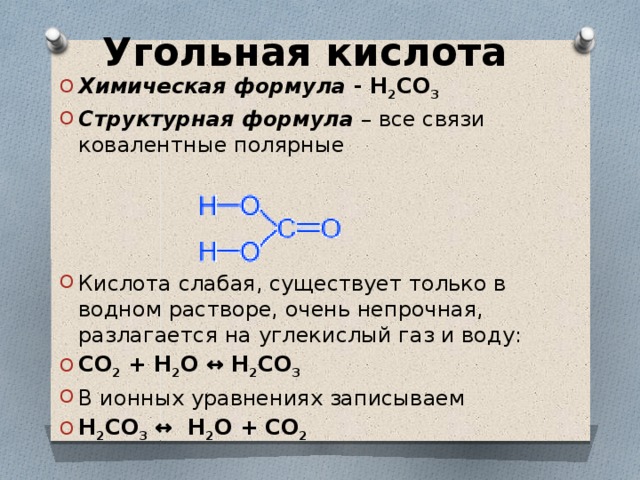
Условия для возникновения реакции? реакция происходит только тогда, когда реагенты помещают в воду. Что может ускорить реакцию, так это высокая температура или кислый раствор (pH <7). Реакция идет медленнее, когда она находится в щелочном растворе (рН>
Тип реакции: разложение. Эта реакция называется разложением, поскольку угольная кислота распадается на углекислый газ и воду.
Физические и химические свойства продуктов: двуокись углерода (CO2) — бесцветный газ. Его температура плавления составляет -78 ° C, а температура кипения составляет -58 ° C. Вода (h3O) бесцветна и не имеет запаха. Температура плавления 0°С, температура кипения 100°С.
Использование продуктов реакции: продукты этой реакции довольно распространены, но двуокись углерода, полученная при разложении угольной кислоты, важна в пищевой промышленности как разрыхлитель и в газированных напитках.
Значение реакции на промышленность:
— используется в безалкогольных напитках, чтобы сделать их газированными: разложение углекислоты ответственно за газированные напитки, такие как безалкогольные напитки, пиво, шампанское и газированная вода.
— используется в хлебобулочных изделиях, чтобы поднять их: разрыхлитель представляет собой смесь бикарбоната натрия и кислоты, и когда они сухие, они не реагируют вместе, но когда они растворяются вместе, угольная кислота начинает разлагаться с выделением углекислого газа, который заставляет тесто подниматься.
История: Угольная кислота существует с тех пор, как на Земле существует углекислый газ, а поскольку углекислый газ находится в атмосфере, углекислый газ можно найти везде, где есть вода. Он играет важную роль в управлении рН воды. Одна из солей угольной кислоты (карбонат кальция) содержится также в земной коре, панцирях и скелетах животных. Еще одна из солей (карбонат натрия) используется при производстве стекла.