Изготовление шипучих таблеток | GxP News
Шипучая таблеткаЭдмонт В. Стоянов, Рейнгард Воллмер
Шипучие таблетки – лекарственная форма, которую с удовольствием принимают не только взрослые, но и дети.
После растворения в воде, шипучие таблетки образуют раствор, имеющий вид газированного напитка с приятным вкусом. Данная лекарственная форма характеризуется быстрым фармакологическим действием и наносит меньше вреда желудку по сравнению с таблеточной формой. В связи с этим шипучие таблетки востребованы как потребителями, так и производителями.
Принцип действия шипучих таблеток заключается в быстром высвобождении активных и вспомогательных веществ вследствие реакции между органическими карбоновыми кислотами (лимонная кислота, винная кислота, адипиновая кислота) и пищевой содой (NaHCO3) при контакте с водой. В результате этой реакции образуется нестабильная угольная кислота (h3CO3), которая сразу же распадается на воду и углекислый газ (СО2). Газ образует пузырьки, которые действуют в качестве суперразрыхлителя. Эта реакция возможна только в воде. Неорганические карбонаты практически нерастворимы в органических растворителях, что делает реакцию невозможной в другой среде.
Газ образует пузырьки, которые действуют в качестве суперразрыхлителя. Эта реакция возможна только в воде. Неорганические карбонаты практически нерастворимы в органических растворителях, что делает реакцию невозможной в другой среде.
Технологически, реакция быстрого растворения происходит между твердой и жидкой лекарственной формой. Такая система доставки лекарственного вещества – наилучший способ избежать недостатков твердых лекарственных форм (медленное растворение и высвобождение активного вещества в желудке) и жидких лекарственных форм (химическая и микробиологическая нестабильность в воде). Растворенные в воде шипучие таблетки характеризуются быстрой абсорбцией и лечебным действием, они не наносят вреда пищеварительной системе и улучшают вкус действующих веществ.
Какие из вспомогательных веществ наиболее приемлемы для производства шипучих таблеток? Возможно ли избежать длительных и дорогостоящих лабораторных исследований для разработки подходящей лекарственной формы? Какую производственную технологию можно использовать: прямого прессования или влажной грануляции? Это те вопросы, на которые мы бы хотели ответить в этой статье, продемонстрировав эффективные способы производства шипучих таблеток.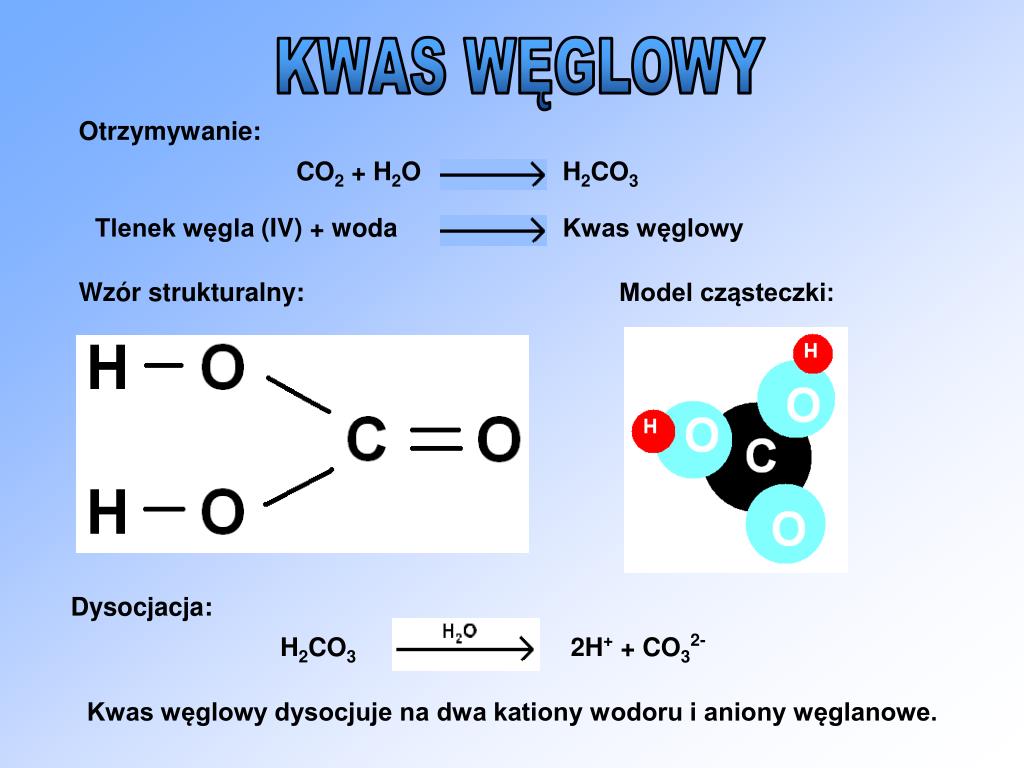
Вспомогательные вещества
Все сырье, используемое для производства шипучих таблеток, должно обладать хорошими показателями растворимости в воде, что исключает использование микрокристаллической или порошковой целлюлозы, двухосновного фосфата кальция и т.д. Главным образом, только два растворимых в воде связующих вещества могут использоваться в производстве – сахара (декстраты или глюкоза) и полиолы (сорбитол, маннитол). Так как размер шипучей таблетки относительно большой (2–4 г), то в производстве таблетки решающим моментом является выбор наполнителя. Необходим наполнитель с хорошими связующими характеристиками для того, чтобы упростить рецептуру и уменьшить количество вспомогательных веществ. Декстраты и сорбитол являются широко используемыми вспомогательными веществами. В таблице 1 сравниваются оба вспомогательных вещества.
| Таблица 1. Сравнение декстратов и сорбитола для шипучих таблеток | ||
| Прессуемость | Очень хорошая | Очень хорошая |
| Растворяемость | Отличная | Очень хорошая |
| Гигроскопичность | Нет | Да |
| Ломкость таблетки | Очень хорошая | Умеренная |
| Сила выталкивания | Низкая | Умеренная |
| Липкость | Нет | Да |
| Текучесть | Очень хорошая | Очень хорошая |
| Отсутствие сахара | Нет | Да |
| Трансформируемость в ходе обмена | Да, полностью | Частично |
| Относительная сладость | 50% | 60% |
Сорбитол подходит для производства таблеток без содержания сахара, хотя данный полиол может вызвать вздутие живота и дискомфорт при высоком содержании. Прилипание к пуансонам таблеточного пресса является определенной трудностью, связанной с использованием сорбитола, но хорошая прессуемость делает это вспомогательное вещество подходящим для рецептур, представляющих сложности в производстве. Гигроскопичность сорбитола может ограничить его использование в шипучих таблетках в связи с высокой восприимчивостью этих таблеток к влаге. Но несмотря на это, сорбитол остается одним из наиболее используемых среди полиолов при производстве шипучих таблеток.
Прилипание к пуансонам таблеточного пресса является определенной трудностью, связанной с использованием сорбитола, но хорошая прессуемость делает это вспомогательное вещество подходящим для рецептур, представляющих сложности в производстве. Гигроскопичность сорбитола может ограничить его использование в шипучих таблетках в связи с высокой восприимчивостью этих таблеток к влаге. Но несмотря на это, сорбитол остается одним из наиболее используемых среди полиолов при производстве шипучих таблеток.
Декстраты – это декстроза, кристаллизованная при помощи распыления, содержащая небольшое количество олигосахаридов. Декстраты представляют собой высокочистый продукт, состоящий из белых сыпучих крупнопористых сфер (рис. 1).
Рис.1. Декстраты представляют собой высокочистый продукт, состоящий из белых сыпучих крупнопористых сферДанный материал обладает хорошей текучестью, прессуемостью и способностью крошиться. Отличные показатели растворимости в воде обеспечивают быструю распадаемость и требования к использованию меньшего количества лубриканта.
Органические кислоты
Количество органических кислот, пригодных для производства шипучих таблеток, ограничено. Наилучший выбор – лимонная кислота: карбоновая кислота, содержащая три функциональные карбоновые группы, которые обычно требуют три эквивалента бикарбоната натрия. В производстве шипучих таблеток обычно используется безводная лимонная кислота. Однако соединение лимонной кислоты и гидрокарбоната натрия очень гигроскопично и проявляет тенденцию к абсорбции воды и потере реакционной способности, поэтому необходим строгий контроль над уровнем влажности в рабо[1]чем помещении. Альтернативными органическими кислотами являются винная, фумаровая и адипиновая, но они не так популярны и используются в том случае, когда лимонная кислота неприменима.
Гидрокарбонаты
Гидрокарбонат натрия (NaHCO3) можно обнаружить в 90% рецептур шипучих таблеток. В случае использования NaHCO3, стехиометрия должна быть точно определена в зависимости от природы активного вещества и других кислот или основ в составе. Например, если активное вещество является кислотообразующим, то можно превысить норму NaHCO3, для улучшения растворимости таблетки. Однако, насущной проблемой NaHCO3 является высокое содержание натрия, что противопоказано людям с повышенным кровяным давлением и заболеваниями почек.
В случае использования NaHCO3, стехиометрия должна быть точно определена в зависимости от природы активного вещества и других кислот или основ в составе. Например, если активное вещество является кислотообразующим, то можно превысить норму NaHCO3, для улучшения растворимости таблетки. Однако, насущной проблемой NaHCO3 является высокое содержание натрия, что противопоказано людям с повышенным кровяным давлением и заболеваниями почек.
Технология прямого прессования или влажной грануляции
Технология прямого прессования является современной, наиболее приемлемой технологией производства твердых лекарственных форм. Если данная технология неприменима, можно использовать технологию влажной грануляции. Как было указано выше, порошок шипучих таблеток очень восприимчив к влаге, и наличие даже небольшого количества воды может вызвать химическую реакцию. Прямое прессование – экономически эффективная технология, позволяющая сохранить время производства и уменьшить количество производственных циклов. С нашей точки зрения, этой технологии следует отдать предпочтение. Технология прямого прессования не требует специального оборудования и подходит для чувствительных к воде материалов.
С нашей точки зрения, этой технологии следует отдать предпочтение. Технология прямого прессования не требует специального оборудования и подходит для чувствительных к воде материалов.
В каких случаях технология прямого прессования неприменима?
- в том случае, когда существует большая разница между насыпными плотностями используемых материалов, что может привести к десегрегации таблетируемого порошка;
- активные вещества, имеющие мелкий размер частиц, используются в малой дозировке. В этом случае может возник нуть проблема, связанная с однородностью состава, но этого можно избежать, измельчая часть наполнителя и предварительно смешивая его с активным веществом;
- липкие или восприимчивые к кислороду вещества требуют наполнителя с очень хорошими показателями текучести, растворимости в воде и абсорбции, такими как декстраты с их пористыми, круглыми частицами (см. рис. 1). Данное вспомогательное вещество, используемое в технологии прямого прессования, подходит для сложных рецептур, не требует дополнительных связующих или антисвязывающих веществ.

Очевидно, что технология прямого прессования не может быть применима в каждом случае, но должна быть выбором номер один в производстве шипучих таблеток.
Лубриканты
Традиционная внутренняя лубрикация шипучей таблетки проблематична в связи с липофильностью лубриканта. Нерастворимые частички появляются на поверхности воды после дезинтеграции в виде пенообразного тонкого слоя. Как предотвратить подобное явление? Одним из способов предотвращения данной проблемы может быть использование водорастворимых лубрикантов – добавление аминокислоты L-лейцин непосредственно в порошок. Другой способ – заменить липофильный стеарат магния более гидрофильным натрия стеарил фумаратом (PRUV®) в качестве внутреннего лубриканта.
Заключение
Правильный выбор вспомогательного вещества и технологии производства шипучих таблеток сэкономят время, уменьшат производственные затраты и позволят использовать в производстве различные подсластители и вещества, маскирующие вкус. Представляем Вашему вниманию некоторые рецептуры производства шипучих таблеток методом прямого прессования.
АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА | ||
Мг/таб | Содержание (%) | |
Ацетилсалициловая кислота | 500,00 | 12,5 |
PRUV® (натрия стеарил фумарат) | 12,00 | 0,3 |
Лимонная кислота | 348,00 | 8,7 |
NaHCO3 | 400,00 | 10,0 |
Глицин гидрохлорид | 128,00 | 3,2 |
Аспартам | 76,00 | 1,9 |
Вкусовая добавка | 36,00 | 0,9 |
EMDEX® (Декстраты) | 2500,00 | 62,5 |
Итого | 4000,00 | |
Характеристики таблетки | ||
Сила сжатия | 23 kN | |
Прочность | 8,0 kp | |
Диаметр | 25 мм | |
Время распадаемости | 133 с | |
Кальций + Витамин С + Витамин В6 + Витамин Д3 | ||
Мг/таб | Содержание (%) | |
VIVAPRESS® CA 800 (CaCO3) | 670,00 | 16,75 |
Витамин С | 500,00 | 12,5 |
Витамин Д3 400 IU/mg | (10 мкг) | 0,00025 |
Витамин В6 | 10,00 | 0,25 |
Натрия гидрогенфосфат | 650,00 | 16,25 |
Лимонная кислота | 575,00 | 14,37 |
Аспартам | 70,00 | 1,75 |
Вкусовая добавка (апельсин) | 100,00 | 2,50 |
Бета каротин 1% CWS | 25,00 | 0,63 |
Xлорид натрия | 10,00 | 0,25 |
EMDEX® (Декстраты) | 1310,00 | 32,75 |
ПЭГ 6000 | 40,00 | 1,00 |
PRUV® (натрия стеарил фумарат) | 40,00 | 1,00 |
Итого | 4000,00 | 100,0 |
Характеристики таблетки | ||
Сила сжатия | 18 kN | |
Прочность | 7,5 kp | |
Диаметр | 25 мм | |
Время распадаемости | < 2 мин | |
Специалисты ООО ТК Аврора (дистрибьютора JRS Pharma GmbH в Украине) с удовольствием ответят на Ваши технические и коммерческие вопросы относительно EMDEX® и PRUV®
ООО ТК Аврора
г.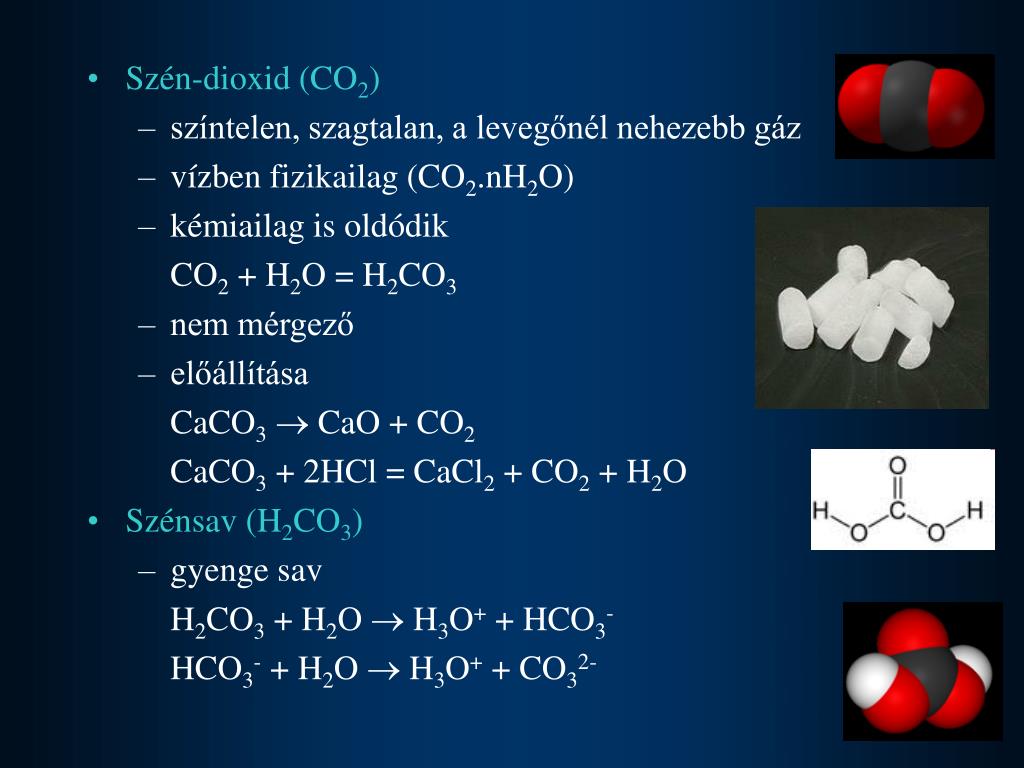 Киев, ул. Дегтяревская, 62
Киев, ул. Дегтяревская, 62
Тел.: (044) 594 8777
Факс: (044) 594 8877
Е-mail: [email protected]
«Промышленное обозрение. Фармацевтическая отрасль» октябрь №5 (16) 2009
C—>CO2–>CaCO3–>h3CO3–>CO2… -reshimne.ru
Новые вопросы
Ответы
C + O2 = CO2
CO2 + Ca(OH)2 = h3O + CaCO3
CaCO3 (t) = CaO + CO2
CO2 + h3O = h3CO3
h3CO3 распадается на CO2 и h3O
Похожие вопросы
Даны вещества O2 h3 Br2 h3O Cl2 .С каким из них будет взаимодействовать пропан…
Какой изм металлов li na k rb расходуется в самом малом количестве и какой в самом большом чтобы получить 5.6 ну водорода?…
Пожалуйста
вычислите массу оксида углерода (4), если его объем 33,6 л .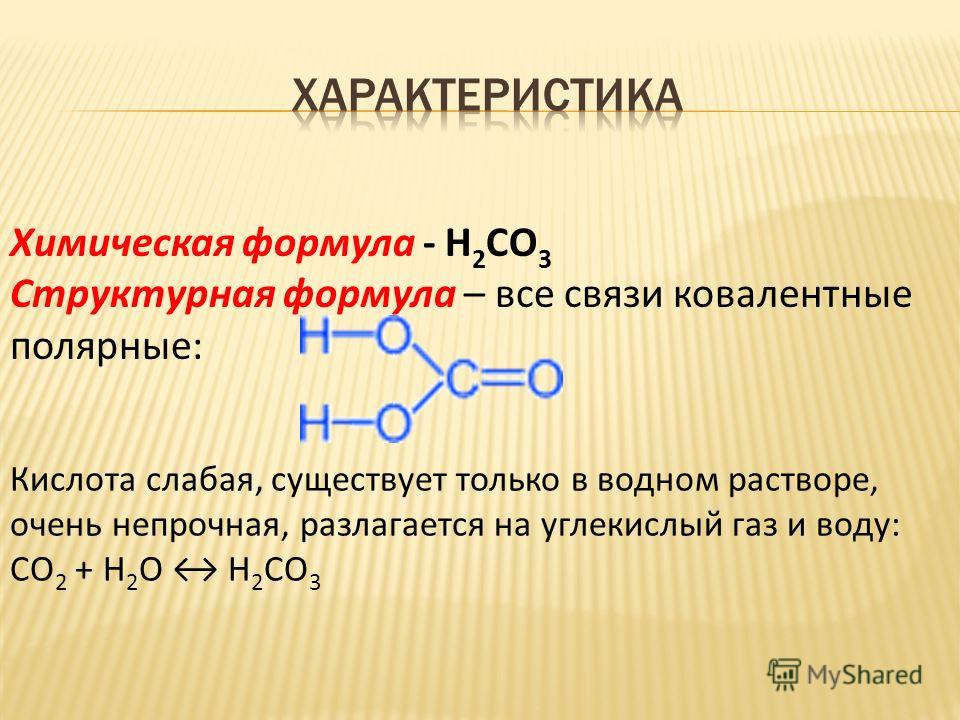 …
…
Помогите решить 86 и 87…
Ch3= CH-Ch3-CH=Ch4 составьте формулы одного гомолога и одного изомера к веществу…
Решите задачу!!!По химии …
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Какой тип реакции NaHCO3 hc2h4o2?
Какой тип реакции NaHCO3 hc2h4o2? Тип химической реакции: Для этой реакции у нас есть химическая реакция. Стратегии уравновешивания: в этой реакции NaHCO3 (пищевая сода) взаимодействует с водным раствором HC2h4O2 (уксус) с образованием NaC2h4O2 + CO2 + h3O.
Стратегии уравновешивания: в этой реакции NaHCO3 (пищевая сода) взаимодействует с водным раствором HC2h4O2 (уксус) с образованием NaC2h4O2 + CO2 + h3O.
Какой тип реакции гидрокарбоната натрия и уксусной кислоты? Углекислый газ на самом деле будет пузыриться из раствора. Это классический пример реакции нейтрализации, при которой бикарбонат натрия или пищевая сода нейтрализуется раствором уксусной кислоты или уксуса.
Что произойдет, если смешать NaHCO3 и HC2h4O2? NaHCO3(водн.) + HC2h4O2(водн.) → CO2(г) + h3O(ж.) + NaC2h4O2(водн.) Образование желтых пузырьков указывает на образование кислого газа (h3CO3 получается в результате взаимодействия CO2 + h3O → h3CO3).
Какая реакция NaHCO3 → Na2CO3 h3O CO2? Этот тип реакции называется термическим разложением. При нагревании смеси Na2CO3 и NaHCO3 разлагается только NaHCO3. NaHCO3 = Na2CO3 + h3O + CO2 – Калькулятор химических реакций.
Какой тип реакции имеет NaHCO3?
Пищевая сода, или бикарбонат натрия (NaHCO3), представляет собой химическое вещество, которое может подвергаться реакции разложения при нагревании. При температуре выше 176 градусов по Фаренгейту (80 градусов по Цельсию) бикарбонат натрия начинает распадаться на три соединения, образуя карбонат натрия (Na2CO3), воду (h3O) и углекислый газ (CO2).
При температуре выше 176 градусов по Фаренгейту (80 градусов по Цельсию) бикарбонат натрия начинает распадаться на три соединения, образуя карбонат натрия (Na2CO3), воду (h3O) и углекислый газ (CO2).
Является ли пищевая сода и уксус кислотно-щелочной реакцией?
Реакция пищевой соды и уксуса на самом деле является двумя отдельными реакциями. Первая реакция – кислотно-щелочная реакция. Когда уксус и пищевая сода сначала смешиваются вместе, ионы водорода в уксусе реагируют с ионами натрия и бикарбоната в пищевой соде.
Является ли пищевая сода и уксус экзотермической реакцией?
Эта реакция называется экзотермической реакцией. В части B этого упражнения пищевая сода была добавлена к уксусу. Пищевая сода вступает в реакцию с уксусом с образованием углекислого газа, ацетата натрия и воды. Эта реакция называется эндотермической реакцией.
Какой тип реакции NaHCO3 HC2h4O2 → NaC2h4O2 h3CO3?
Тип химической реакции: Для этой реакции у нас есть химическая реакция. Стратегии уравновешивания: в этой реакции NaHCO3 (пищевая сода) взаимодействует с водным раствором HC2h4O2 (уксус) с образованием NaC2h4O2 + CO2 + h3O.
Стратегии уравновешивания: в этой реакции NaHCO3 (пищевая сода) взаимодействует с водным раствором HC2h4O2 (уксус) с образованием NaC2h4O2 + CO2 + h3O.
Почему важно нейтрализовать реакционную смесь NaHCO3 во время обработки?
Обычная часть многих процедур включает нейтрализацию. Важно нейтрализовать любой органический растворитель, подвергшийся воздействию кислого или щелочного раствора, поскольку следовые количества кислоты или основания могут вызвать нежелательные реакции при концентрировании растворов.
Является ли Na2CO3 и NaHCO3 буфером?
Кроме того, равновесие Na2CO3/NaHCO3 имеет pKa 10,33, что означает, что это не является хорошим буфером при pH 9.
Что вызывает NaHCO3?
Бикарбонат натрия образуется при смешении молекул углерода, натрия, водорода и кислорода. Эта смесь, также известная как пищевая сода, на самом деле является разновидностью соли.
Каково уравнение баланса NaHCO3?
Сбалансируйте химическое уравнение NaHCo3 > Na2Co3 +h3o + Co2.
К какой реакции относятся HCl и NaHCO3?
Задача: гидрокарбонат натрия реагирует с соляной кислотой в процессе газообразующей реакции с образованием водного раствора хлорида натрия, воды и газообразного диоксида углерода: NaHCO3(s) + HCl(aq) → NaCl(aq) + h3O(l) + CO2(g ) Определите массу газообразного CO2, образовавшегося при добавлении 8,67 г NaHCO3 к раствору, содержащему 5,65 г HCl.
Какой тип реакции имеет пищевая сода и HCl?
Насыщенный раствор бикарбоната натрия реагирует с соляной кислотой с образованием углекислого газа.
Какой тип реакции представляет собой синтез NaCl agno3 → nano3 AgCl?
NaCl + AgNO3→ AgCl + NaNO3
Поскольку между реагентами происходит обмен ионами, это реакция двойного замещения.
Какая реакция пищевой соды и уксуса?
Смешивание пищевой соды и уксуса вызовет химическую реакцию, потому что один из них является кислотой, а другой — основанием. Пищевая сода — это основное соединение, называемое бикарбонатом натрия, а уксус — это разбавленный раствор, содержащий уксусную кислоту (95% воды, 5% уксусной кислоты).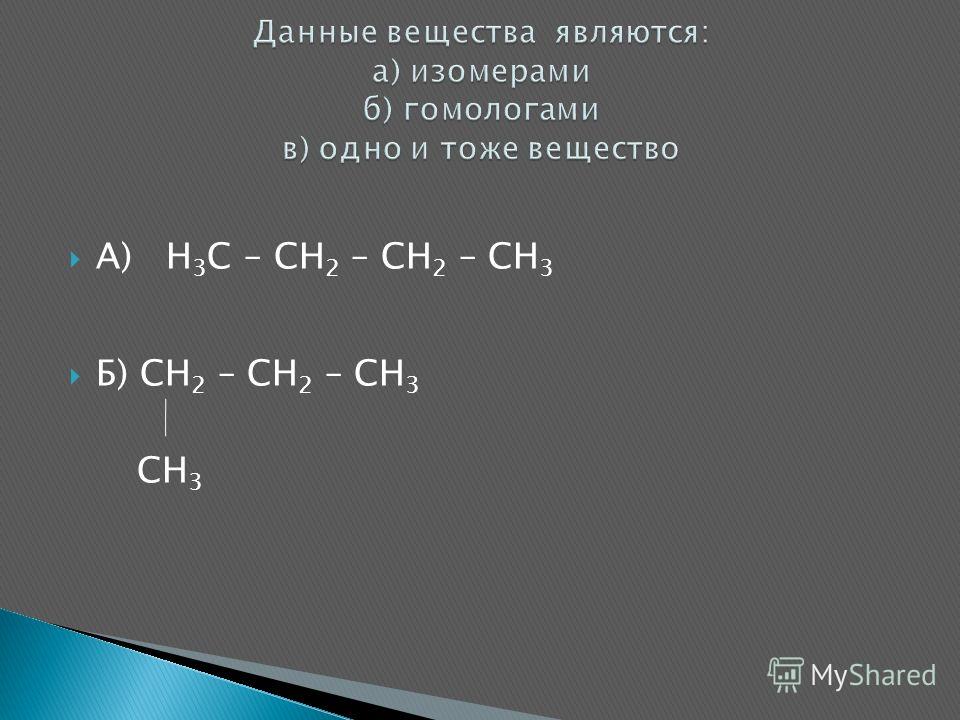
Является ли уксус физической или химической реакцией?
Общие физические изменения включают плавление, изменение размера, объема, цвета, плотности и кристаллической формы. Классическая реакция пищевой соды и уксуса свидетельствует о химическом изменении из-за образования газа и изменения температуры.
Можно ли смешивать пищевую соду и уксус для очистки?
Вот несколько рецептов, которые стоит попробовать. Освежите раковину, смешав одну часть пищевой соды с двумя частями уксуса. Эта смесь высвобождает шипящее шипение углекислого газа, которое очищает и освежает канализацию. Удалите пятна от жесткой воды, положив на пораженный участок полотенце, смоченное уксусом.
Как узнать, является ли реакция экзотермической?
Так, если сумма энтальпий реагентов больше, чем продуктов, реакция будет экзотермической. Если сторона продуктов имеет большую энтальпию, реакция эндотермическая.
Является ли плавление эндотермическим или экзотермическим процессом?
Плавление — это эндотермическая реакция, при которой общее количество тепла в веществе, также известное как энтальпия, увеличивается. Твердое вещество может только
Твердое вещество может только
Какой тип реакции NaHCO3 Ch4COOH?
Это реакция двойного замещения, потому что Na обменивается партнерами с H Ch4COOH. Угольная кислота, образовавшаяся на этапе 1, разлагается на CO₂ и воду. Это реакция разложения, потому что одно вещество превращается в два разных вещества.
Что такое NaHCO3·HC2h4O2?
Калькулятор химических реакций NaHCO3 + HC2h4O2 = CO2 + h3O + NaCh4COO. В результате реакции между пищевой содой (бикарбонатом натрия) и уксусом (разбавленной уксусной кислотой) образуется углекислый газ, который используется в химических вулканах и других проектах.
Как уравновешивается химическое уравнение?
1. Уравнение сбалансировано, когда одинаковое количество каждого элемента представлено на стороне реагента и продукта. Уравнения должны быть сбалансированы, чтобы точно отражать закон сохранения материи.
С какой целью к реакционной смеси добавляют бикарбонат натрия?
С какой целью добавляли бикарбонат натрия в реакционную смесь в лаборатории сложных эфиров? Для удаления избытка уксусной кислоты после протекания реакции.
Что произойдет, если к гидрокарбонату натрия добавить уксусную кислоту?
При добавлении уксусной кислоты к водному раствору бикарбоната натрия происходит кислотно-щелочная реакция (реакция нейтрализации), которая приводит к образованию соли ацетата натрия и воды с выделением углекислого газа. Соль ацетата натрия имеет склонность к гидролизу.
Воздействие инициируемой радикалами OH деградации h3CO3 в атмосфере Земли по механизму переноса электрона с протонной связью
. 2016 4 февраля; 120 (4): 562-75.
doi: 10.1021/acs.jpca.5b08805. Epub 2016 20 января.
Сурав Гошал 1 , Монту К Хазра 1
принадлежность
- 1 Отдел химических наук, Институт ядерной физики Саха, 1/AF Bidhannagar, Kolkata-700 064, Индия.

- PMID: 26731551
- DOI: 10.1021/acs.jpca.5b08805
Сурав Гошал и др. J Phys Chem А. .
. 2016 4 февраля; 120 (4): 562-75.
doi: 10.1021/acs.jpca.5b08805. Epub 2016 20 января.
Авторы
Сурав Гошал 1 , Монту К Хазра 1
принадлежность
- 1 Отдел химических наук, Институт ядерной физики Саха, 1/AF Bidhannagar, Kolkata-700 064, Индия.

- PMID: 26731551
- DOI: 10.1021/acs.jpca.5b08805
Абстрактный
Разложению выделенной молекулы угольной кислоты (h3CO3) на CO2 и h3O (h3CO3 → CO2 + h3O) препятствует большой активационный барьер (>35 ккал/моль). Тем не менее удивительно, что обнаружить молекулу h3CO3 до сих пор не удалось, а охота за свободной молекулой h3CO3 стала сложной задачей не только в земной атмосфере, но и на Марсе. В связи с этим мы сообщаем здесь о высоком уровне квантово-химических расчетов, исследующих как энергетику, так и кинетику реакции разложения h3CO3, инициируемой радикалом OH, для интерпретации потери молекулы h3CO3 в атмосфере Земли. Из нашего исследования видно, что протонно-связанный перенос электрона (ППЭТ) и перенос атома водорода (ПАТ) являются двумя механизмами, с помощью которых радикал ОН инициирует деградацию молекулы h3CO3. Более того, механизм PCET потенциально важен как эффективный барьер, определяемый как разность между энергией нулевых колебаний (ZPE), скорректированной энергией переходного состояния, и полной энергией изолированных исходных реагентов с точки зрения бимолекулярных столкновений. для механизма PCET на уровне теории CCSD(T)/6-311++G(3df,3pd) примерно на 3–4 ккал/моль ниже, чем эффективная высота барьера, связанная с механизмом HAT. Предсказанная уровнем CCSD(T)/6-311++G(3df,3pd) эффективная высота барьера для деградации двух наиболее стабильных конформеров молекулы h3CO3 по механизму PCET составляет всего ~2,7 и 4,3 ккал/моль. Также был проведен сравнительный анализ скорости реакции на уровне теории CCSD(T)/6-311++G(3df,3pd) для изучения потенциального влияния разложения h3CO3, инициируемого радикалом OH, по сравнению с разложением из воды ( h3O), муравьиная кислота (FA), уксусная кислота (AA) и серная кислота (SA) способствовали реакциям разложения h3CO3 → CO2 + h3O как в тропосфере Земли, так и в стратосфере.
Более того, механизм PCET потенциально важен как эффективный барьер, определяемый как разность между энергией нулевых колебаний (ZPE), скорректированной энергией переходного состояния, и полной энергией изолированных исходных реагентов с точки зрения бимолекулярных столкновений. для механизма PCET на уровне теории CCSD(T)/6-311++G(3df,3pd) примерно на 3–4 ккал/моль ниже, чем эффективная высота барьера, связанная с механизмом HAT. Предсказанная уровнем CCSD(T)/6-311++G(3df,3pd) эффективная высота барьера для деградации двух наиболее стабильных конформеров молекулы h3CO3 по механизму PCET составляет всего ~2,7 и 4,3 ккал/моль. Также был проведен сравнительный анализ скорости реакции на уровне теории CCSD(T)/6-311++G(3df,3pd) для изучения потенциального влияния разложения h3CO3, инициируемого радикалом OH, по сравнению с разложением из воды ( h3O), муравьиная кислота (FA), уксусная кислота (AA) и серная кислота (SA) способствовали реакциям разложения h3CO3 → CO2 + h3O как в тропосфере Земли, так и в стратосфере. Сравнение скоростей реакций показывает, что, хотя атмосферная концентрация радикала ОН существенно ниже, чем концентрации h3O, FA, AA в атмосфере Земли, тем не менее реакция разложения h3CO3, инициируемая радикалом OH, оказывает существенное влияние, особенно в сторону потери молекулы h3CO3 в атмосфере Земли. В чистых средах, которые существуют в большем количестве по сравнению с загрязненными средами атмосферы Земли, воздействие реакции разложения h3CO3, инициируемой радикалом OH, сравнимо с воздействием конкурирующего пути, в котором используются молекулы с водородными связями, такие как h3O. , FA или AA для катализа разложения h3CO3. Аналогичным образом, в загрязненных средах, и особенно в тропосфере Земли, хотя скорости реакций разложения h3CO3, инициируемого радикалом ОН, и разложения h3CO3 с участием ФК сравнимы в пределах ∼15 раз, тем не менее, реакция разложения h3CO3 с участием АК оказался доминирующим каналом. Это следует только из-за несколько большей каталитической эффективности АК по сравнению с ФК в реакции разложения h3CO3 → CO2 + h3O.
Сравнение скоростей реакций показывает, что, хотя атмосферная концентрация радикала ОН существенно ниже, чем концентрации h3O, FA, AA в атмосфере Земли, тем не менее реакция разложения h3CO3, инициируемая радикалом OH, оказывает существенное влияние, особенно в сторону потери молекулы h3CO3 в атмосфере Земли. В чистых средах, которые существуют в большем количестве по сравнению с загрязненными средами атмосферы Земли, воздействие реакции разложения h3CO3, инициируемой радикалом OH, сравнимо с воздействием конкурирующего пути, в котором используются молекулы с водородными связями, такие как h3O. , FA или AA для катализа разложения h3CO3. Аналогичным образом, в загрязненных средах, и особенно в тропосфере Земли, хотя скорости реакций разложения h3CO3, инициируемого радикалом ОН, и разложения h3CO3 с участием ФК сравнимы в пределах ∼15 раз, тем не менее, реакция разложения h3CO3 с участием АК оказался доминирующим каналом. Это следует только из-за несколько большей каталитической эффективности АК по сравнению с ФК в реакции разложения h3CO3 → CO2 + h3O. Наоборот, хотя каталитическая эффективность СК, ФК и АК в реакции разложения h3CO3 близка друг к другу, а концентрации как радикала СК, так и радикала ОН в атмосфере Земли более или менее равны между собой, но тем не менее, реакция разложения h3CO3 с участием SA не может конкурировать с реакцией разложения h3CO3, инициируемой радикалом OH.
Наоборот, хотя каталитическая эффективность СК, ФК и АК в реакции разложения h3CO3 близка друг к другу, а концентрации как радикала СК, так и радикала ОН в атмосфере Земли более или менее равны между собой, но тем не менее, реакция разложения h3CO3 с участием SA не может конкурировать с реакцией разложения h3CO3, инициируемой радикалом OH.
Похожие статьи
Новый механизм автокаталитического разложения h3CO3 в паровой фазе.
Гошал С., Хазра М.К. Гошал С. и др. J Phys Chem A. 3 апреля 2014 г.; 118 (13): 2385-92. дои: 10.1021/jp412239e. Epub 2014 24 марта. J Phys Chem A. 2014. PMID: 24617952
Гидролиз формилфторида, катализируемый серной и муравьиной кислотами в атмосфере.
Чжан Л., Лонг Б. Чжан Л.
 и др.
АСУ Омега. 2019 7 ноября; 4 (21): 18996-19004. doi: 10.1021/acsomega.9b01864. Электронная коллекция 2019 19 ноября.
АСУ Омега. 2019.
PMID: 31763521
Бесплатная статья ЧВК.
и др.
АСУ Омега. 2019 7 ноября; 4 (21): 18996-19004. doi: 10.1021/acsomega.9b01864. Электронная коллекция 2019 19 ноября.
АСУ Омега. 2019.
PMID: 31763521
Бесплатная статья ЧВК.Атмосферное разложение трифторметанола, катализируемое муравьиной кислотой.
Парандаман А., Перес Дж. Э., Синха А. Парандаман А. и др. J Phys Chem A. 13 декабря 2018 г .; 122 (49): 9553-9562. doi: 10.1021/acs.jpca.8b09316. Epub 2018 29 ноября. J Phys Chem A. 2018. PMID: 30427671
Идентификация механизмов газофазных реакций X- + Ch4Y SN2 на атомарном уровне с помощью комбинированных экспериментов и моделирования.
Се Дж., Отто Р., Микош Дж., Чжан Дж., Вестер Р., Хасе В.Л. Се Дж. и др. Acc Chem Res. 2014 21 октября; 47 (10): 2960-9.
 дои: 10.1021/ar5001764. Epub 2014 14 августа.
Acc Chem Res. 2014.
PMID: 25120237
Обзор.
дои: 10.1021/ar5001764. Epub 2014 14 августа.
Acc Chem Res. 2014.
PMID: 25120237
Обзор.Стратосфера Земли и микробная жизнь.
ДасСарма П., Антунес А., Симоэс М.Ф., ДасСарма С. Дассарма П. и др. Curr выпускает Mol Biol. 2020;38:197-244. doi: 10.21775/cimb.038.197. Epub 2020 22 января. Curr выпускает Mol Biol. 2020. PMID: 31967581 Обзор.
Посмотреть все похожие статьи
Цитируется
Настройка переноса электрона с протонной связью путем ориентации кристалла для эффективного окисления воды на двойных оксидах перовскита.
Zhu Y, He Z, Choi Y, Chen H, Li X, Zhao B, Yu Y, Zhang H, Stoerzinger KA, Feng Z, Chen Y, Liu M. Чжу Ю и др. Нац коммун.
 2020 27 августа; 11 (1): 4299. doi: 10.1038/s41467-020-17657-9.
Нац коммун. 2020.
PMID: 32855418
Бесплатная статья ЧВК.
2020 27 августа; 11 (1): 4299. doi: 10.1038/s41467-020-17657-9.
Нац коммун. 2020.
PMID: 32855418
Бесплатная статья ЧВК.
Типы публикаций
Взгляд на реакционную способность h3CO3 и…
- Дом
- Поиск
- Изучение реакционной способности h3CO3 и его производных в объемной воде, кластерах воды и на границе воздух/вода: исследования молекулярной динамики и метадинамики Ab initio
- Аспирантура и исследования, Факультет / Тезисы и диссертации
- 367 просмотров
- 309 загрузок
- Автор / Создатель
- Галиб, Мирза
h3CO3 может разлагаться на CO2 в воде либо водным путем (h3CO3 ↔ CO2+h3O ), либо гидроксидным путем (h3CO3 + h3O ↔ CO2+OH−+h4O+).
 Реакции водного пути играют фундаментальную роль в глобальном углеродном цикле, а реакции гидроксидного пути играют важную роль в регуляции рН крови и переносе СО2 во время дыхания. Несмотря на множество экспериментальных работ по этим реакциям в воде, микроскопическое понимание основных механизмов отсутствовало из-за нехватки теоретической работы. В этой диссертации мы использовали молекулярную динамику и метадинамику Кар-Парринелло, чтобы установить микроскопические механизмы и вычислить изменения свободной энергии и барьеры ряда реакций с участием h3CO3, HCO3- и CO2 в объемной воде, кластерах воды и в воздухе. /water, чтобы пролить столь необходимый свет на эти реакции. Прежде чем углубиться в реакционную способность h3CO3 в воде, мы исследовали энергетику и механизмы конформационных изменений цис-цис (ЦЦ), цис-транс (ЦТ) и транс-транс (ТТ) конформеров h3CO3 в воде. Барьеры/изменения свободной энергии для различных конформационных изменений посредством изменения одного из двух двугранных углов были рассчитаны и сопоставлены с ранее рассчитанными значениями для газовой фазы.
Реакции водного пути играют фундаментальную роль в глобальном углеродном цикле, а реакции гидроксидного пути играют важную роль в регуляции рН крови и переносе СО2 во время дыхания. Несмотря на множество экспериментальных работ по этим реакциям в воде, микроскопическое понимание основных механизмов отсутствовало из-за нехватки теоретической работы. В этой диссертации мы использовали молекулярную динамику и метадинамику Кар-Парринелло, чтобы установить микроскопические механизмы и вычислить изменения свободной энергии и барьеры ряда реакций с участием h3CO3, HCO3- и CO2 в объемной воде, кластерах воды и в воздухе. /water, чтобы пролить столь необходимый свет на эти реакции. Прежде чем углубиться в реакционную способность h3CO3 в воде, мы исследовали энергетику и механизмы конформационных изменений цис-цис (ЦЦ), цис-транс (ЦТ) и транс-транс (ТТ) конформеров h3CO3 в воде. Барьеры/изменения свободной энергии для различных конформационных изменений посредством изменения одного из двух двугранных углов были рассчитаны и сопоставлены с ранее рассчитанными значениями для газовой фазы. Затем мы исследовали энергетику и механизмы диссоциации (h3CO3 ↔ HCO3- + H+) и разложения по гидроксильному пути (HCO3- → CO2 + OH-) всех трех конформеров h3CO3 в воде. Было обнаружено, что конформеры CT и TT претерпевают разложение в воде в двухстадийном процессе: диссоциация с последующим разложением. Это контрастирует с согласованным механизмом, предложенным для газовой фазы, который включает дегидроксилирование одной из групп ОН и одновременное депротонирование другой группы ОН с образованием СО2 и Н3О. Наши расчетные значения pKa и барьеры свободной энергии разложения для конформеров CT и TT согласуются с экспериментальными значениями. Было исследовано разложение h3CO3 в кластерах воды разного размера, чтобы определить, преобладает ли в объемной воде согласованный или ступенчатый механизм. Мы обнаружили, что в небольших кластерах (содержащих 6 и 9молекул воды) распад происходит по согласованному механизму переноса протонов, включающему циклическое переходное состояние, тогда как в более крупных кластерах (содержащих 20 и 45 молекул воды) распад происходит по двухстадийному механизму с участием разделенного растворителем HCO3-/h4O+ промежуточная ионная пара.
Затем мы исследовали энергетику и механизмы диссоциации (h3CO3 ↔ HCO3- + H+) и разложения по гидроксильному пути (HCO3- → CO2 + OH-) всех трех конформеров h3CO3 в воде. Было обнаружено, что конформеры CT и TT претерпевают разложение в воде в двухстадийном процессе: диссоциация с последующим разложением. Это контрастирует с согласованным механизмом, предложенным для газовой фазы, который включает дегидроксилирование одной из групп ОН и одновременное депротонирование другой группы ОН с образованием СО2 и Н3О. Наши расчетные значения pKa и барьеры свободной энергии разложения для конформеров CT и TT согласуются с экспериментальными значениями. Было исследовано разложение h3CO3 в кластерах воды разного размера, чтобы определить, преобладает ли в объемной воде согласованный или ступенчатый механизм. Мы обнаружили, что в небольших кластерах (содержащих 6 и 9молекул воды) распад происходит по согласованному механизму переноса протонов, включающему циклическое переходное состояние, тогда как в более крупных кластерах (содержащих 20 и 45 молекул воды) распад происходит по двухстадийному механизму с участием разделенного растворителем HCO3-/h4O+ промежуточная ионная пара. Более крупные кластеры содержат достаточное количество молекул воды для полной сольватации промежуточного соединения h4O+, что является необходимым условием для ступенчатой реакции. Наши результаты показали, что разложение h3CO3 происходит преимущественно по ступенчатому механизму в объемной воде. Затем изучали диссоциацию h3CO3 на границе воздух/вода. Наши результаты показали, что h3CO3 быстрее диссоциирует на поверхности воды, чем в объемной воде, в отличие от недавних экспериментов и моделирования, которые показали, что HNO3 имеет более низкую склонность к диссоциации на поверхности воды, чем в объемной воде. Мы обнаружили, что на поверхности воды вокруг h3CO3 более структурированная сольватная среда, чем в объемной воде, что приводит к снижению энергетического барьера диссоциации за счет стабилизации переходного состояния относительно недиссоциированной кислоты. Затем мы исследовали гидратацию CO2 с образованием HCO3- (т. е. CO2 + 2 h3O → HCO3- + h4O+) на границе раздела воздух/вода.
Более крупные кластеры содержат достаточное количество молекул воды для полной сольватации промежуточного соединения h4O+, что является необходимым условием для ступенчатой реакции. Наши результаты показали, что разложение h3CO3 происходит преимущественно по ступенчатому механизму в объемной воде. Затем изучали диссоциацию h3CO3 на границе воздух/вода. Наши результаты показали, что h3CO3 быстрее диссоциирует на поверхности воды, чем в объемной воде, в отличие от недавних экспериментов и моделирования, которые показали, что HNO3 имеет более низкую склонность к диссоциации на поверхности воды, чем в объемной воде. Мы обнаружили, что на поверхности воды вокруг h3CO3 более структурированная сольватная среда, чем в объемной воде, что приводит к снижению энергетического барьера диссоциации за счет стабилизации переходного состояния относительно недиссоциированной кислоты. Затем мы исследовали гидратацию CO2 с образованием HCO3- (т. е. CO2 + 2 h3O → HCO3- + h4O+) на границе раздела воздух/вода. Мы обнаружили, что СО2 слабо сольватирован, даже в большей степени, чем в объеме, из-за дефицита молекул воды на поверхности. Было обнаружено, что как механизм реакции, так и энергетический барьер диссоциации аналогичны таковым в объемной воде. Хотя изначально предполагалось, что энергетический барьер будет другим, наш результат не был неожиданным, учитывая тот факт, что CO2 слабо сольватируется в обеих средах. Выводы, полученные в этой диссертации, имеют значение для понимания химии CO2 и h3CO3 в различных средах, встречающихся в атмосферной и геологической химии, и закладывают основу для дальнейших кинетических и термодинамических исследований в широком диапазоне водных сред с различной морфологией и составами.
Мы обнаружили, что СО2 слабо сольватирован, даже в большей степени, чем в объеме, из-за дефицита молекул воды на поверхности. Было обнаружено, что как механизм реакции, так и энергетический барьер диссоциации аналогичны таковым в объемной воде. Хотя изначально предполагалось, что энергетический барьер будет другим, наш результат не был неожиданным, учитывая тот факт, что CO2 слабо сольватируется в обеих средах. Выводы, полученные в этой диссертации, имеют значение для понимания химии CO2 и h3CO3 в различных средах, встречающихся в атмосферной и геологической химии, и закладывают основу для дальнейших кинетических и термодинамических исследований в широком диапазоне водных сред с различной морфологией и составами.- Темы/Ключевые слова
- Cpmd
- Метадинамика
- Углекислота
- Дата окончания
- Осень 2014
- Тип изделия
- Диссертация
- Степень
- Доктор философии
- ДОИ
- https://doi.
 org/10.7939/R3DF6KD8M
org/10.7939/R3DF6KD8M
- Лицензия
- Эта диссертация предоставляется библиотеками Университета Альберты с разрешения владельца авторских прав исключительно в некоммерческих целях. Этот тезис или любая его часть не могут быть скопированы или воспроизведены иным образом без письменного согласия владельца авторских прав, за исключением случаев, разрешенных канадским законодательством об авторском праве.
Почему разлагается h3Co3? | Best Of Internet
Почему угольная кислота разлагается на воду и углекислый газ? Оказывается, энергия связи угольной кислоты несколько выше, чем у СО2, растворенного в воде, но незначительно. Это, в свою очередь, означает, что угольная кислота немного более стабильна.
Содержание
Разлагается ли h3Co3?
Абсолютно чистая угольная кислота самопроизвольно не разлагается. В отсутствие воды период полураспада при разложении составляет 180 000 лет. Но даже одна молекула воды ускоряет разложение в пятьдесят миллиардов раз.
Но даже одна молекула воды ускоряет разложение в пятьдесят миллиардов раз.
Какие продукты образуются при разложении h3Co3 Aq?
Водная угольная кислота (h3CO3) разлагается на углекислый газ и жидкую воду.
Как разлагается угольная кислота?
Недавно было показано, что сухая угольная кислота кинетически стабильна даже при комнатной температуре. Добавление молекул воды значительно снижает эту стабильность, и разложение (h3CO3 + nh3O -> (n+1)h3O + CO2) чрезвычайно ускоряется при n = 1, 2, 3.
Что происходит при нагревании h3Co3?
Углекислота (h3CO3) образуется в небольших количествах при растворении CO2 в h3O, но быстро разлагается в условиях температуры и давления окружающей среды. Несмотря на свое мимолетное существование, h3CO3 играет важную роль в глобальном круговороте углерода и в биологических карбонатсодержащих системах.
На что разлагается Hco3?
Гидрокарбонат натрия (также известный как бикарбонат натрия или бикарбонат соды) имеет химическую формулу NaHCO3. При нагревании выше 80°C он начинает разлагаться с образованием карбоната натрия, воды и углекислого газа. Этот тип реакции называется термическим разложением.
При нагревании выше 80°C он начинает разлагаться с образованием карбоната натрия, воды и углекислого газа. Этот тип реакции называется термическим разложением.
На что распадается h3So3?
Некоторые соединения нестабильны и разлагаются на воду и газ. Наиболее распространены три из них: h3CO3, h3SO3 и Nh5OH. Они разлагаются следующим образом: h3CO3 → h3O + CO2↑ h3SO3 → h3O + SO2↑ Nh5OH → h3O + Nh4↑ Когда какое-либо из этих трех соединений появляется в виде продукта, вместо этого запишите форму разложения.
Что происходит с h3Co3, когда он распадается?
H3CO3 распадается на протон (H+) и ион бикарбоната, снижая pH крови. Теперь он транспортируется в легкие. Резюме: Карбоангидраза — это фермент, который уравновешивает рН крови и позволяет выдыхать углекислый газ.
Какой тип реакции у h3Co3?
Этот тип реакции почти всегда приводит к образованию газа. Ниже приведены примеры реакций разложения: При нагревании оксида ртути (II) образуется газообразный кислород: 2HgO (т) → 2Hg (ж) + O2 (г). Если оставить крышку на бутылке с газированным безалкогольным напитком, угольная кислота выделит углекислый газ: h3CO3 (водн.) → h3O (л) + CO2 (г).
Если оставить крышку на бутылке с газированным безалкогольным напитком, угольная кислота выделит углекислый газ: h3CO3 (водн.) → h3O (л) + CO2 (г).
Является ли углекислота газом?
Углекислота — тяжелый газ — тушит огонь и уничтожает все живое.
Почему угольная кислота нестабильна?
Это «гидратированный» диоксид углерода или «угольная кислота». Эта форма чрезвычайно нестабильна и подвержена диспропорционированию из-за неблагоприятного заряда и неблагоприятного характера самого разделения зарядов. Изменение энтропии также благоприятствует продуктам диспропорции.
Что такое Pka угольной кислоты?
При 298 К экспериментальные pKa1 и pKa2 для угольной кислоты составляют 6,36, 10,33 по отдельности, а экспериментальные pKa для муравьиной кислоты составляют 3,75 [17].
Как сделать углекислоту?
Углекислота может быть получена действием сильных кислот на карбонат кальция и пропусканием полученного таким образом диоксида углерода в воду.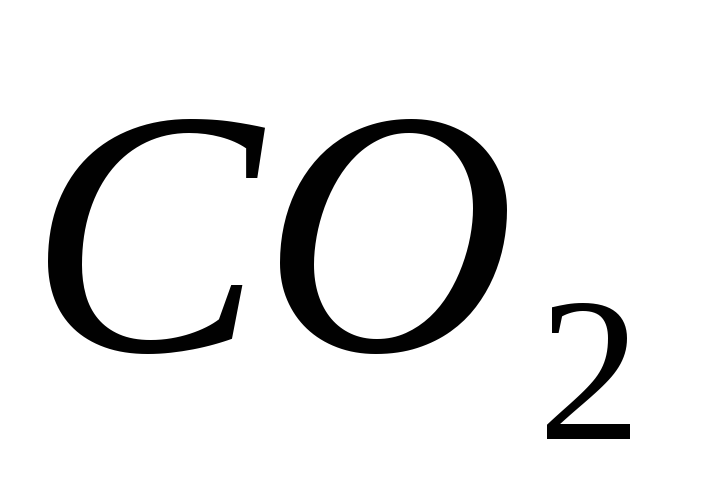 Углекислый газ легко распадается на углекислый газ и снова воду. В этом опыте студенты готовят углекислоту на основе мрамора и изучают ее свойства.
Углекислый газ легко распадается на углекислый газ и снова воду. В этом опыте студенты готовят углекислоту на основе мрамора и изучают ее свойства.
Углекислота сильная или слабая?
Угольная кислота — это слабая кислота, которая диссоциирует на ион бикарбоната (HCO3-) и ион водорода (H+). Угольная кислота является слабой кислотой, потому что не только сопряженное основание сильной кислоты считается слабым (подобно сопряженному основанию HCl является слабым основанием Cl-), но и слабые кислоты лишь частично диссоциируют в водном растворе.
Что делает углекислота в организме?
Угольная кислота играет важную роль в переносе углекислого газа кровью. Углекислый газ поступает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани.
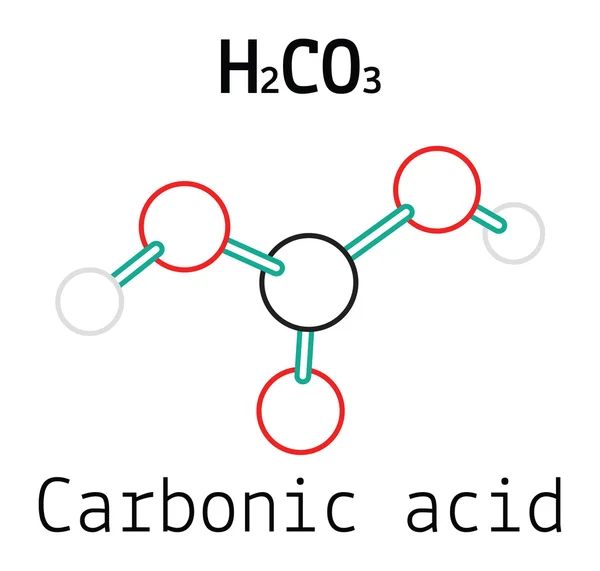
Является ли Hco3 кислотой или основанием?
HCO3- (известный как бикарбонат) представляет собой сопряженное основание h3CO3, слабой кислоты и сопряженной кислоты карбонат-иона.



 и др.
АСУ Омега. 2019 7 ноября; 4 (21): 18996-19004. doi: 10.1021/acsomega.9b01864. Электронная коллекция 2019 19 ноября.
АСУ Омега. 2019.
PMID: 31763521
Бесплатная статья ЧВК.
и др.
АСУ Омега. 2019 7 ноября; 4 (21): 18996-19004. doi: 10.1021/acsomega.9b01864. Электронная коллекция 2019 19 ноября.
АСУ Омега. 2019.
PMID: 31763521
Бесплатная статья ЧВК. дои: 10.1021/ar5001764. Epub 2014 14 августа.
Acc Chem Res. 2014.
PMID: 25120237
Обзор.
дои: 10.1021/ar5001764. Epub 2014 14 августа.
Acc Chem Res. 2014.
PMID: 25120237
Обзор. 2020 27 августа; 11 (1): 4299. doi: 10.1038/s41467-020-17657-9.
Нац коммун. 2020.
PMID: 32855418
Бесплатная статья ЧВК.
2020 27 августа; 11 (1): 4299. doi: 10.1038/s41467-020-17657-9.
Нац коммун. 2020.
PMID: 32855418
Бесплатная статья ЧВК. Реакции водного пути играют фундаментальную роль в глобальном углеродном цикле, а реакции гидроксидного пути играют важную роль в регуляции рН крови и переносе СО2 во время дыхания. Несмотря на множество экспериментальных работ по этим реакциям в воде, микроскопическое понимание основных механизмов отсутствовало из-за нехватки теоретической работы. В этой диссертации мы использовали молекулярную динамику и метадинамику Кар-Парринелло, чтобы установить микроскопические механизмы и вычислить изменения свободной энергии и барьеры ряда реакций с участием h3CO3, HCO3- и CO2 в объемной воде, кластерах воды и в воздухе. /water, чтобы пролить столь необходимый свет на эти реакции. Прежде чем углубиться в реакционную способность h3CO3 в воде, мы исследовали энергетику и механизмы конформационных изменений цис-цис (ЦЦ), цис-транс (ЦТ) и транс-транс (ТТ) конформеров h3CO3 в воде. Барьеры/изменения свободной энергии для различных конформационных изменений посредством изменения одного из двух двугранных углов были рассчитаны и сопоставлены с ранее рассчитанными значениями для газовой фазы.
Реакции водного пути играют фундаментальную роль в глобальном углеродном цикле, а реакции гидроксидного пути играют важную роль в регуляции рН крови и переносе СО2 во время дыхания. Несмотря на множество экспериментальных работ по этим реакциям в воде, микроскопическое понимание основных механизмов отсутствовало из-за нехватки теоретической работы. В этой диссертации мы использовали молекулярную динамику и метадинамику Кар-Парринелло, чтобы установить микроскопические механизмы и вычислить изменения свободной энергии и барьеры ряда реакций с участием h3CO3, HCO3- и CO2 в объемной воде, кластерах воды и в воздухе. /water, чтобы пролить столь необходимый свет на эти реакции. Прежде чем углубиться в реакционную способность h3CO3 в воде, мы исследовали энергетику и механизмы конформационных изменений цис-цис (ЦЦ), цис-транс (ЦТ) и транс-транс (ТТ) конформеров h3CO3 в воде. Барьеры/изменения свободной энергии для различных конформационных изменений посредством изменения одного из двух двугранных углов были рассчитаны и сопоставлены с ранее рассчитанными значениями для газовой фазы. Затем мы исследовали энергетику и механизмы диссоциации (h3CO3 ↔ HCO3- + H+) и разложения по гидроксильному пути (HCO3- → CO2 + OH-) всех трех конформеров h3CO3 в воде. Было обнаружено, что конформеры CT и TT претерпевают разложение в воде в двухстадийном процессе: диссоциация с последующим разложением. Это контрастирует с согласованным механизмом, предложенным для газовой фазы, который включает дегидроксилирование одной из групп ОН и одновременное депротонирование другой группы ОН с образованием СО2 и Н3О. Наши расчетные значения pKa и барьеры свободной энергии разложения для конформеров CT и TT согласуются с экспериментальными значениями. Было исследовано разложение h3CO3 в кластерах воды разного размера, чтобы определить, преобладает ли в объемной воде согласованный или ступенчатый механизм. Мы обнаружили, что в небольших кластерах (содержащих 6 и 9молекул воды) распад происходит по согласованному механизму переноса протонов, включающему циклическое переходное состояние, тогда как в более крупных кластерах (содержащих 20 и 45 молекул воды) распад происходит по двухстадийному механизму с участием разделенного растворителем HCO3-/h4O+ промежуточная ионная пара.
Затем мы исследовали энергетику и механизмы диссоциации (h3CO3 ↔ HCO3- + H+) и разложения по гидроксильному пути (HCO3- → CO2 + OH-) всех трех конформеров h3CO3 в воде. Было обнаружено, что конформеры CT и TT претерпевают разложение в воде в двухстадийном процессе: диссоциация с последующим разложением. Это контрастирует с согласованным механизмом, предложенным для газовой фазы, который включает дегидроксилирование одной из групп ОН и одновременное депротонирование другой группы ОН с образованием СО2 и Н3О. Наши расчетные значения pKa и барьеры свободной энергии разложения для конформеров CT и TT согласуются с экспериментальными значениями. Было исследовано разложение h3CO3 в кластерах воды разного размера, чтобы определить, преобладает ли в объемной воде согласованный или ступенчатый механизм. Мы обнаружили, что в небольших кластерах (содержащих 6 и 9молекул воды) распад происходит по согласованному механизму переноса протонов, включающему циклическое переходное состояние, тогда как в более крупных кластерах (содержащих 20 и 45 молекул воды) распад происходит по двухстадийному механизму с участием разделенного растворителем HCO3-/h4O+ промежуточная ионная пара. Более крупные кластеры содержат достаточное количество молекул воды для полной сольватации промежуточного соединения h4O+, что является необходимым условием для ступенчатой реакции. Наши результаты показали, что разложение h3CO3 происходит преимущественно по ступенчатому механизму в объемной воде. Затем изучали диссоциацию h3CO3 на границе воздух/вода. Наши результаты показали, что h3CO3 быстрее диссоциирует на поверхности воды, чем в объемной воде, в отличие от недавних экспериментов и моделирования, которые показали, что HNO3 имеет более низкую склонность к диссоциации на поверхности воды, чем в объемной воде. Мы обнаружили, что на поверхности воды вокруг h3CO3 более структурированная сольватная среда, чем в объемной воде, что приводит к снижению энергетического барьера диссоциации за счет стабилизации переходного состояния относительно недиссоциированной кислоты. Затем мы исследовали гидратацию CO2 с образованием HCO3- (т. е. CO2 + 2 h3O → HCO3- + h4O+) на границе раздела воздух/вода.
Более крупные кластеры содержат достаточное количество молекул воды для полной сольватации промежуточного соединения h4O+, что является необходимым условием для ступенчатой реакции. Наши результаты показали, что разложение h3CO3 происходит преимущественно по ступенчатому механизму в объемной воде. Затем изучали диссоциацию h3CO3 на границе воздух/вода. Наши результаты показали, что h3CO3 быстрее диссоциирует на поверхности воды, чем в объемной воде, в отличие от недавних экспериментов и моделирования, которые показали, что HNO3 имеет более низкую склонность к диссоциации на поверхности воды, чем в объемной воде. Мы обнаружили, что на поверхности воды вокруг h3CO3 более структурированная сольватная среда, чем в объемной воде, что приводит к снижению энергетического барьера диссоциации за счет стабилизации переходного состояния относительно недиссоциированной кислоты. Затем мы исследовали гидратацию CO2 с образованием HCO3- (т. е. CO2 + 2 h3O → HCO3- + h4O+) на границе раздела воздух/вода. Мы обнаружили, что СО2 слабо сольватирован, даже в большей степени, чем в объеме, из-за дефицита молекул воды на поверхности. Было обнаружено, что как механизм реакции, так и энергетический барьер диссоциации аналогичны таковым в объемной воде. Хотя изначально предполагалось, что энергетический барьер будет другим, наш результат не был неожиданным, учитывая тот факт, что CO2 слабо сольватируется в обеих средах. Выводы, полученные в этой диссертации, имеют значение для понимания химии CO2 и h3CO3 в различных средах, встречающихся в атмосферной и геологической химии, и закладывают основу для дальнейших кинетических и термодинамических исследований в широком диапазоне водных сред с различной морфологией и составами.
Мы обнаружили, что СО2 слабо сольватирован, даже в большей степени, чем в объеме, из-за дефицита молекул воды на поверхности. Было обнаружено, что как механизм реакции, так и энергетический барьер диссоциации аналогичны таковым в объемной воде. Хотя изначально предполагалось, что энергетический барьер будет другим, наш результат не был неожиданным, учитывая тот факт, что CO2 слабо сольватируется в обеих средах. Выводы, полученные в этой диссертации, имеют значение для понимания химии CO2 и h3CO3 в различных средах, встречающихся в атмосферной и геологической химии, и закладывают основу для дальнейших кинетических и термодинамических исследований в широком диапазоне водных сред с различной морфологией и составами.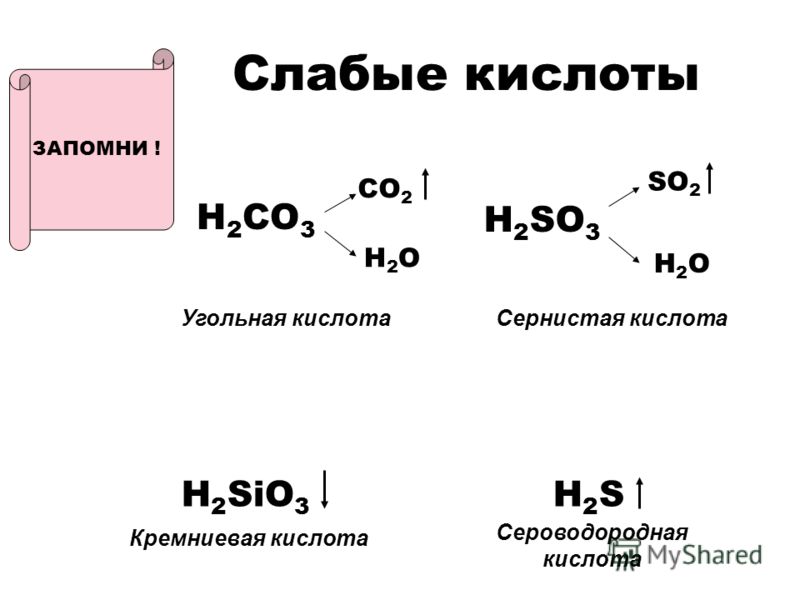 org/10.7939/R3DF6KD8M
org/10.7939/R3DF6KD8M