Контрольная работа для 8 класса, УМК О.С. Габриелян, ФГОС
Материал опубликовал
15
#8 класс #Химия #ФГОС #Учебно-дидактические материалы #Тест (специальный формат) #Учитель-предметник #Школьное образование #УМК О. С. Габриеляна
Нажмите, чтобы скачать публикацию
в формате MS WORD (*.DOC)
Размер файла: 37.5 Кбайт
КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ 8 КЛАСС
1 вариант
1. Определенный вид атомов – это…
а) молекула ; в) физическое тело;
б) химический элемент; г) атом.
2. Относительная молекулярная масса кремниевой кислоты равна:
а) 98; в) 86;
б) 102; г) 78.
3. количество электронов в атоме магния равно:
а) 32; в) 16;
б) 4; г) 12.
4. Какой тип связи в молекуле озона:
а) металлическая; в) ионная;
б) ковалентная; г) нет связи.
5. Дайте определение понятию «реакция обмена».
6. Дайте названия соединениям: 1. MnO2, 2. K2SO4, 3. MgS, 4. HNO2, 5. h3CO3.
7. Допишите реакции. Определите тип реакции.
а) Mg(OH)2 + HCl =
б) KOH + HNO3 =
в) Fe2O3 + Al =
г) Na2O + CO2 =
д) BaCl2 + AgNO3 =
е) Na2O + HNO3 =
8. Осуществите цепочку превращений:
P Р2О3 Р2О5 Н3РО4
9. Сколько молекул содержится в 22 граммах углекислого газа (СО2)
10. Запишите полное ионное и сокращенное ионное уравнения для реакции:
AgNO3 + HCl расставьте коэффициенты.
11.Найти массовую долю химических элементов в P2O5.
2 вариант
1. Вещества, которые образованны атомами разных химических элементов – это…
а) простое вещество; в) физическое тело;
б) сложное вещество; г) атом.
2. Относительная молекулярная масса серной кислоты равна:
а) 98; в) 81;
б) 46; г) 63.
3. Количество протонов и электронов в атоме калия равно:
а) 1; в) 39;
б) 19; г) 4.
4. Какой тип связи в молекуле сероводородной кислоты:
а) металлическая; в) ионная;
б) ковалентная неполярная; г) ковалентная полярная.
5. Дайте определение понятию «реакция замещения».
6. Дайте названия соединениям: 1. HCl, 2. Н2SO3, 3. Na2SiO3, 4. КNO3, 5. h3SO4.
7. Допишите реакции. Определите тип реакции.
а) FeBr3 + Cl2 =
б) PbCl2 + Al =
в) Na2CO3 + HCl =
г) CuSO4 + NaOH =
д) BaCl2 + h3SO4 =
е) Cu(OH)2 + HNO3 =
8. Осуществите цепочку превращений:
S SО2 SО3 Н2SО4
9. Найдите массу 60*1023молекул кислорода?
10. Запишите полное ионное и сокращенное ионное уравнения для реакции:
HNO3 + Na OH = , расставьте коэффициенты.
11.Найти молярную массу K2SO4
Опубликовано в группе «Дополнительные материалы к уроку»
Чтобы написать комментарий необходимо авторизоваться.
Дайте полную характеристику угольной кислоты h3CO3 по пла.
 23 * 12 решите…
23 * 12 решите…Вычислить массу гидроксида Na вступающего в реакцию с CuSO4 массой 32.4 гр…
Составьте термохимическое уравнение разложение Al(OH)3, если при разложении 2, 5 грамм поглощается 850кдж теплоты…
Математика
Литература
АлгебраРусский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
ОБЖ
Психология
Кинетика системы угольной кислоты
Существует два типа угольной кислоты:
| (1a) | истинная угольная кислота: | H 2 CO 3 |
| (1б) | составная (кажущаяся) угольная кислота: | H 2 CO 3 * = CO 2 (водный) + H 2 CO 3 1 |
Каждая из этих двух кислот характеризуется своей константой равновесия (для первой стадии диссоциации):
| угольная кислота | формула реакции | константа равновесия | |
|---|---|---|---|
| (2а) | правда | H 2 CO 3 = H + + HCO 3 — | К правда |
| (2б) | составной (кажущийся) | H 2 CO 3 * = H + + HCO 3 — | К 1 |
Связь между формулой реакции и константой равновесия устанавливается законом действующих масс. Получается:
Получается:
| (3а) | К правда | = | {H + } {HCO 3 — | ||
| (3б) | К 1 | = | {H + } {HCO 3 — } / ({CO 2 (водн.) · H 2 O} + {H 2 CO | 3 0) |
Цель состоит в том, чтобы раскрыть кинетику этого термодинамического подхода. Он позволяет рассчитать константы равновесия K true и K 1 ) исключительно из кинетических скоростей.
Реакционная кинетика
Три компонента, CO 2 (AQ), H 2 CO 3 и HCO 3 — , вовлечены в формацию Carbonic Acid: 2 — , вовлечены в карбоидную форма.
Здесь химическая кинетика полностью определяется шестью отдельными скоростями, от k 12 до k 32 . Преобразование этой диаграммы в набор дифференциальных уравнений дает:
| (4а) | – d [ 1 ] / dt = (k 12 +k 13 ) [ 1 ] – k 21 [ 2 ] – k 31 [ 3 8] |
| (4б) | – d [ 2 ] / dt = (k 21 +k 23 ) [ 2 ] – k 12 [ 1 ] – k 32 [ 3 8] |
| (4с) | – d [ 3 ] / dt = (k 31 +k 32 ) [ 3 ] – k 13 [ 1 ] – k 23 [ 2 ] |
| с сокращениями: | [ 1 ] = H + + HCO 3 |
| [ 2 ] = H 2 CO 3 | |
[ 3 ] = CO 2 (водн. |
Из опытов известно, что скорости медленной реакции (k 13 , k 31 ) и по быстрой реакции (k 12 , k 21 ) существенно отличаются друг от друга (более чем на 5 порядков):
| (5) | к 13 , к 31 ≪ к 12 , к 21 |
Это позволяет пренебречь k 13 и k 31 в 4a . Из условия равновесия для 4a , т.е. d[1]/dt = 0, затем следует:
| (6) | – d [ 1 ] / dt = k 12 [ 1 ] – k 21 [ 2 ] = 0 | ⇒ | .к 21 / к 12 = [ 1 ] / [ 2 ] |
На самом деле отношение скоростей в правой части определяет константу равновесия для истинной угольной кислоты:
| (7) | K верно = [ 1 ] / [ 2 ] = {H + } {HCO 3 — } / {H 2 CO 3 } |
Ввод этого соотношения в форме [ 1 ] = K true [ 2 ] в 4c дает:
| (8) | – d [ 3 ] / dt = (k 31 +k 32 ) [ 3 ] – (k 13 K правда + k 23 ) [ 90] |
Обычно количества в круглых скобках объединены в две новые ставки:
| (9а) | k a = k 13 K правда + k 23 | |
| (9б) | к б = к 31 + к 32 |
Опять же, при условии равновесия, т.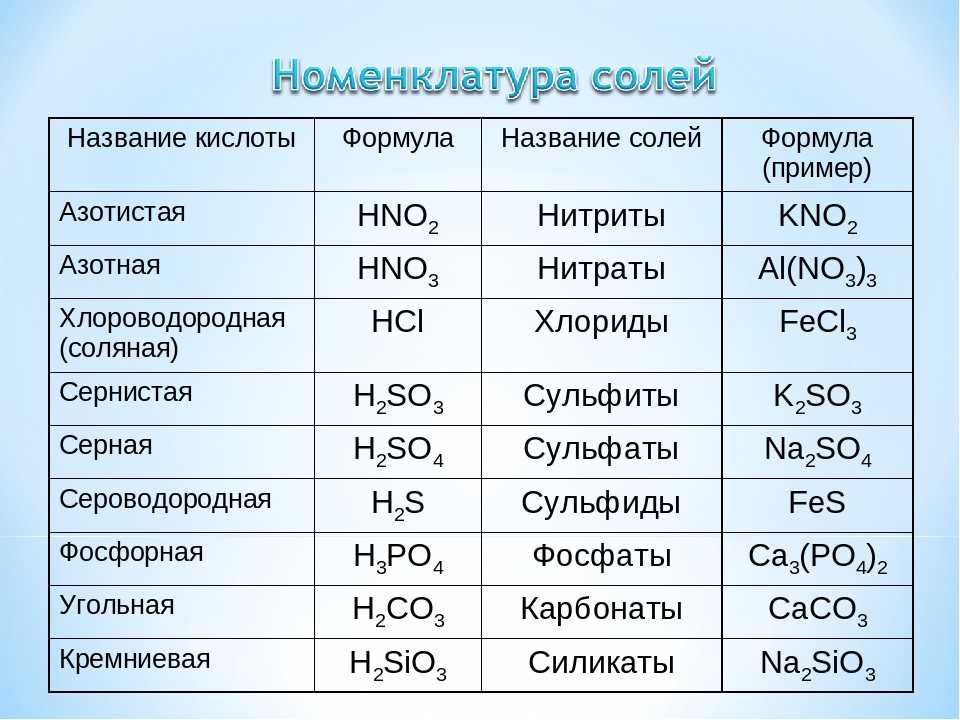 е. d[3]/dt = 0, появляется вторая константа равновесия:
е. d[3]/dt = 0, появляется вторая константа равновесия:
| (10) | К 0 = К a / k b = [ 3 ] / [ 2 ] = {CO 2 (водный) · H 2 O} / {H 2 CO 0 | 3 90} |
Таким образом, приведенная выше диаграмма (где три компонента связаны между собой шестью кинетическими скоростями) сводится к более простой диаграмме, в которой одни и те же компоненты связаны не более чем двумя константами равновесия, K 0 и K true :
Составная константа равновесия K 1
Обычно два вида CO 2 (водн.) и H 2 CO 3 рассматриваются вместе, как если бы они были одно вещество (обозначается как H 2 CO 3 9002) . Как раз это было сделано в 1b выше. Соответствующая константа равновесия дана в 3b , т. е.
| (11) | K 1 = {H + } {HCO 3 — } / ({CO 2 (водный) · H 2 O} + {H 2 CO 3 }) |
Теперь основная идея состоит в том, чтобы выразить задачу об угольной кислоте (характеризуемую двумя константами равновесия K true и K 0 в приведенной выше схеме) с помощью одной константы равновесия, а именно K 1 . Мы получаем желаемое отношение в два шага:
Мы получаем желаемое отношение в два шага:
Сначала мы используем 7 для замены {H + }{HCO 3 — } в числителе 11 :
| (12) | К 1 | = | K True {H + } {H 2 CO 3 } / ({CO 2 (AQ) · H 2 O} + {H 2 CO 3 )) + {H 2 CO 3 )) {H 2 CO 3 }}} {H 2 3 )}}} {H 2 3 )}}} {H 2 3 ). |
| = | K true / ({CO 2 (водн.) · H 2 O}/{H 2 CO 3 } + 1) |
Во-вторых, подставляем 10 и получаем окончательный результат:
| (13) | К 1 = К правда / ( К 0 + 1 ) |
Суммарная константа кислотности угольной кислоты определяется как:
| (13b) | pK a = – log K 1 |
Взаимосвязь между тремя константами равновесия (K 1 , K 0 , K true ) можно изобразить следующим образом: 1 атм ):
| к 12 | = | 5·10 10 М -1 с -1 | Покер и Блумквист 3 | ||
| к 21 | = | 1·10 7 с -1 | Покер и Блумквист 3 | ||
| к а | = | к h3CO3 | ≈ | 18 с -1 | Штумм и Морган 4 |
| к б | = | к СО2 | ≈ | 0,04 с -1 | Штумм и Морган 4 |
[Примечание: для большинства тарифов в литературе указан диапазон параметров, а не конкретное значение. Например, в Штумме и Моргане мы находим k h3CO3 = 10 … 20 с -1 и k CO2 = 0,025 … 0,04 с -1 .]
Например, в Штумме и Моргане мы находим k h3CO3 = 10 … 20 с -1 и k CO2 = 0,025 … 0,04 с -1 .]
Численные значения кинетических скоростей в таблице показывают четкое разделение (или широкий разрыв) между быстрыми реакциями (k 12 , k 21 ) и медленными реакциями (k a , к б ). Поскольку k a является верхней границей k 23 , а k b является верхней границей k 32 , предположение в 5 полностью оправдано.
На основании этих четырех кинетических параметров мы можем рассчитать три константы равновесия: 5
| (14а) | К 0 | = | к а /к б | = | 450 | ⇔ | журнал К 0 | = | 2,65 | |
| (14б) | К правда | = | к 21 /к 12 | = | 2,0·10 -4 М | ⇔ | журнал К правда | = | -3,7 | |
| (14с) | К 1 | = | К правда / ( К 0 + 1 ) | = | 4,4·10 -7 М | ⇔ | журнал К 1 | = | -6,35 |
На самом деле это «официальные» значения K true и K 1 уже представленные здесь.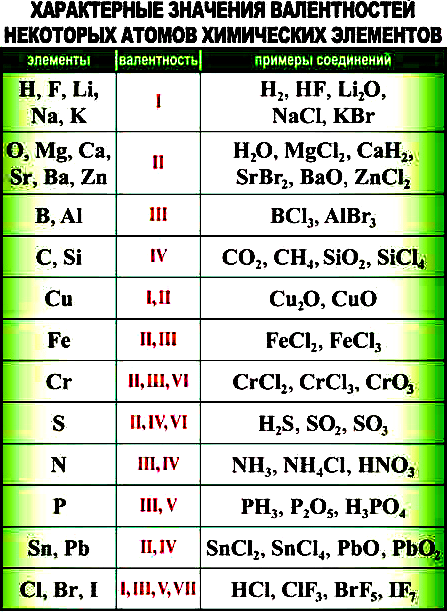
Примечания и ссылки
Это не формула реакции для H 2 CO 3 * ; это всего лишь сокращение от H 2 CO 3 * . ↩
Презентация PowerPoint на эту тему находится здесь. ↩
Pocker, Y., D. Bjorkquist: Исследования с остановленным потоком гидратации диоксида углерода и дегидратации бикарбоната в H3O и D2O кислотно-основном катализе и катализе ионами металлов. Варенье. хим. соц. 99, 6537–6543, 1977 ↩ ↩ 2
В. Штумм и Дж.Дж. Морган: Водная химия, химические равновесия и скорости в природных водах, 3-е изд. John Wiley & Sons, Inc., Нью-Йорк, 1996 ↩ ↩ 2
Обратите внимание на разные единицы измерения для K 0 с одной стороны и для K true и K 1 с другой стороны.
 ↩
↩
[последнее изменение: 25-06-2017]
Какова концентрация (в М) угольной кислоты (h3CO3), если 45,2 г кислоты растворяют в воде, достаточном для получения 250,0 мл раствора?
значок-вопрос Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяУкажите эту страницу следующим образом:
«Какова концентрация (в М) угольной кислоты (h3CO3), если 45,2 г кислоты растворяют в достаточном количестве воды, чтобы получилось 250,0 мл раствора?» eNotes Editorial , 21 февраля 2014 г., https://www.enotes.com/homework-help/what-concentration-m-carbonic-acid-h3co3-45-2-g-466810. По состоянию на 11 декабря 2022 г.
Молярность определяется как количество молей растворенного вещества на литр раствора. Он выражается следующим образом:
Он выражается следующим образом:
«Молярность = (моль растворенного вещества)/(л раствора)»
Моль растворенного вещества: 45,2 г/62,03 г/моль = 0,7287 моль угольной кислоты (h3CO3)
Объем раствора: 250 мл/1000 мл = 0,250 л 0,7287 моль эс)/(0,250 л)`
`Молярность = 2,9147 (моль эс)/(л) = 2,91 М’
отметка мл.
Дополнительное чтение
- https://en.wikipedia.org/wiki/Карбоновая_кислота
- https://en.wikipedia.org/wiki/Молярная_концентрация
Утверждено редакцией eNotes
Наука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 19 сентября 2015 г.
