Как составлять графические формулы 🚩 графическая формула 🚩 Естественные науки
Автор КакПросто!
В графических (структурных) формулах электронная пара, образующая связь между атомами, обозначается черточкой. Графические формулы дают наглядное представление о порядке связей между атомами вещества и особенно широко используются в органической химии. Углеводороды при одинаковом наборе атомов могут сильно отличаться по строению молекул. Эти различия хорошо отражают структурные формулы.

Статьи по теме:
Инструкция
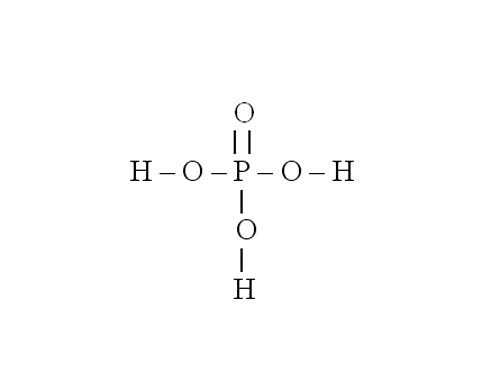
Рассмотрите порядок составления графической формулы на примере фосфата магния. Его химическая формула – Mg3(PO4)2. Сначала нарисуйте структурную формулу для ортофосфорной кислоты, которая образовала эту соль. Для этого определите валентность фосфора в h4PO4. Водород является донором электронов, он одновалентен. Кислород – акцептор электронов, у него валентность равна 2. Значит, четыре молекулы кислорода присоединяют восемь электронов. Три из них дает водород, остальные пять – фосфор. Следовательно, фосфор пятивалентен.Напишите символ фосфора. От него нужно нарисовать пять черточек, обозначающих электронные связи. Три из них забирают группы –OH. Остаются еще две черточки и один атом кислорода, с которым фосфор и соединяется двойной связью.
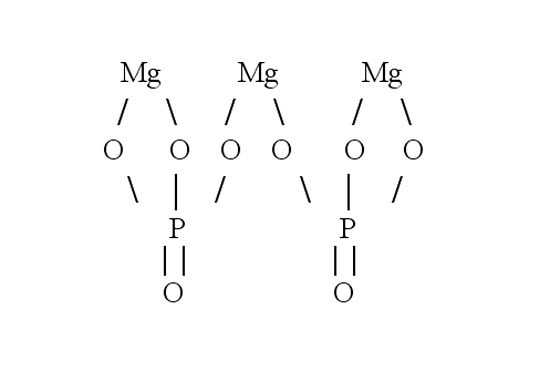
Затем составьте графическую формулу фосфата магния. В молекуле соли три атома металла связаны с двумя кислотными остатками. Запишите в строку три символа, обозначающих магний. Магний двухвалентен — от каждого символа должны отходить по две черточки-связи. В молекуле соли магний вытесняет из кислоты водород и встает на его место. Каждый кислотный остаток забирает по три связи. Чтобы проверить себя, сосчитайте количество атомов в получившейся структурной формуле. Оно должно совпасть с числом атомов в химической формуле.
В органической химии при написании графических формул принято не обозначать связь с атомами водорода. На рисунке показаны примеры таких структурных формул органических соединений.
Видео по теме
Источники:
- графические формулы атомов
Совет полезен?
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
Графические формулы оснований. Структурно-графические формулы веществ
Для того чтобы изобразить формулу соли графически, следует:
1. Правильно написать эмпирическую формулу этого соединения.
2. Учитывая, что любая соль может быть представлена как продукт нейтрализации соответствующих кислоты и основания, следует изобразить отдельно формулы кислоты и основания, образовавших данную соль.
Например :
Ca(HSO 4) 2 — гидросульфат кальция можно получить при неполной нейтрализации серной кислоты H 2 SO 4 гидроксидом кальция Са(ОН) 2 .
3. Определить, какое количество молекул кислоты и основания требуется для получения молекулы этой соли.
Например :
Для получения молекулы Ca(HSO 4) 2 требуется одна молекула основания (один атом кальция) и две молекулы кислоты (два кислотных остатка НSО 4 -1 ).
Са(ОН) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
Построить графические изображения формул установленного числа молекул основания и кислоты и, мысленно убрав, участвующие в реакции нейтрализации и образующие воду, анионы гидроксила основания и катионы водорода кислоты, получить графическое изображение формулы соли:
H — O O H — O O
S S
O – H H — O O O O
Сa + → Ca + 2 H-O-H
O – H H — O O O O
Физические свойства солей.
Соли представляют собой твердые кристаллические вещества. По растворимости в воде их можно подразделить на:
1) хорошо растворимые,
2) мало растворимые,
3) практически нерастворимые.
Большинство солей азотной и уксусной кислот, а также солей калия, натрия и аммония — растворимы в воде. Соли имеют широкий диапазон температур плавления и термического разложения.
Химические свойства солей.
Химические свойства солей характеризуют их отношение к металлам, щелочам, кислотам и солям.
1. Соли в растворах взаимодействуют с более активными металлами.
Более активный металл замещает менее активный металл в соли (см. ряд активностей металлов).Например:
Рb(NO 3) 2 + Zn = Рb + Zn(NO 3) 2
Hg(NO 3) 2 + Cu = Нg + Cu(NO 3) 2
2. Растворы солей взаимодействуют со щелочами, при этом получаются новое основание и новая соль.
Например:
CuSO 4 + 2КОН = Сu(ОН) 2 ¯ + 2K 2 SO 4
FeCl 3 +3NаОН = Fe(OH) 3 ¯ + 3NaCl
3. Соли реагируют с растворами более сильных или менее летучих кислот, при этом получаются новая соль и новая кислота.
Например:
а) в результате реакции образуется более слабая кислота или более летучая кислота:
Na 2 S + 2НС1 = 2NaCl + H 2 S
б) Возможны и реакции с солей сильных кислот с более слабыми кислотами, если в результате реакции образуется малорастворимая соль:
СuSО 4 + Н 2 S = СuS¯ + H 2 SO 4
4. Соли в растворах вступают в обменные реакции с другими солями, при этом получаются две новые соли.
Например:
NaС1 + АgNO 3 = AgCl¯ + NaNO 3
CaCI 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl
CuSO 4 + Na 2 S = CuS¯ + Na 2 SO 4
Обменные реакции протекают практически до конца, если один из продуктов реакции выделяется из сферы реакции в виде осадка, газа или, если при реакции образуется вода или другой слабый электролит.
Способы получения солей.
Известно большое число реакций, приводящих к образованию солей. Приведем наиболее важные из них.
1. Взаимодействие кислот с основаниями (реакция нейтрализации):
NаОН + НNO 3 = NаNO 3 + Н 2 О
Al(OH) 3 + 3НС1 = AlCl 3 + 3Н 2 О
2. Взаимодействие металлов с кислотами:
Fе + 2HCl = FeCl 2 + Н 2
Zn + Н 2 SО 4 разб. = ZnSO 4 + Н 2
3. Взаимодействие кислот с основными и амфотерными оксидами:
СuO + Н 2 SO 4 = СuSO 4 + Н 2 О
ZnO + 2HCl = ZnСl 2 + Н 2 О
4. Взаимодействие кислот с солями:
FeCl 2 + H 2 S = FeS¯ + 2HCl
AgNO 3 + HCI = AgCl¯ + HNO 3
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
5. Взаимодействие растворов двух различных солей:
BaCl 2 + Na 2 SO 4 = ВаSO 4 ¯ + 2NаСl
Pb(NO 3) 2 + 2NaCl = РbС1 2 ¯ + 2NaNO 3
6. Взаимодействие оснований с кислотными оксидами (щелочей с амфотерными оксидами):
Са(ОН) 2 + СО 2 = СаСО 3 ¯ + Н 2 О,
2NаОН (тв.) + ZnO Na 2 ZnO 2 + Н 2 О
7. Взаимодействие основных оксидов с кислотными:
СаO + SiO 2 СаSiO 3
Na 2 O + SO 3 = Na 2 SO 4
8. Взаимодействие металлов с неметаллами:
2К + С1 2 = 2КС1
Fе + S FеS
9. Взаимодействие металлов с солями.
Cu + Hg(NO 3) 2 = Hg + Cu(NO 3) 2
Pb(NO 3) 2 + Zn = Рb + Zn(NO 3) 2
10. Взаимодействие растворов щелочей с растворами солей
CuCl 2 + 2NaOH = Cu(OH) 2 ↓+ 2NaCl
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
Применение солей.
Ряд солей являются соединениями необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса
hentairo.ru
Графические изображения формул неорганических соединений
При графическом изображении формул веществ указывается последовательность расположения атомов в молекуле с помощью, так называемых валентных штрихов (термин «валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил сцепления атомов), иначе называемых валентной чертой (каждая валентная черта, или валентный штрих, эквивалентны одной паре электронов в ковалентных соединениях или одному электрону, участвующему в образовании ионной связи). Часто неправильно принимают графическое изображение формул за структурные формулы, приемлемые только для соединений с ковалентной связью и показывающие взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе). В узлах кристаллической решетки NаСI находятся ионы, причем каждый Nа+ окружен шестью хлорид-ионами. Это графическое изображение формулы вещества, показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не соединяются между собой и хлорид-ионы, они соединены с ионами натрия.Покажем это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько столбцов и выполняем действия согласно алгоритмам по графическому изображению формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое изображение формул оксидов (например, Аl2O3)
III II
1. Определяем валентность атомов элементов в Аl2O3
2. Записываем химические знаки атомов металлов на первое место (первый столбец). Если атомов металлов больше одного, то записываем и в один столбец и обозначаем валентность (число связей между атомами) валентными штрихами
З. Второе место (столбец), тоже в один столбец, занимают химические знаки атомов кислорода, причем к каждому атому кислорода должно подходить по два валентных штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1. Определяем валентность атомов элементов Fе(ОН)3
2. На первом месте (первый столбец) пишем химические знаки атомов металла, обозначаем их валентность Fе
З. Второе место (столбец) занимают химические знаки атомов кислорода, которые присоединяются одной связью к атому металла, вторая связь пока «свободна»
4. Третье место (столбец) занимают химические знаки атомов водорода, присоединяющихся на «свободную» валентность атомов кислорода
Графическое изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем валентность атомов элементов Н2SO4.
2. На первом месте (первый столбец) пишем химические знаки атомов водорода в один столбец с обозначением валентности
Н—
Н—
З. Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной связью к атому водорода, при этом вторая валентность каждого атома кислорода пока «свободна»
Н— О —
Н— О —
4. Третье место (столбец) занимают химические знаки атомов кислотообразователя с обозначением валентности
5. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Графическое изображение формул солей
Средние соли (например, Fe2SO4)3) В средних солях все атомы водорода кислоты замещены на атомы металла, поэтому при графическом изображении их формул первое место (первый столбец) занимают химические знаки атомов металла с обозначением валентности, а далее — как в кислотах, то есть второе место (столбец) занимают химические знаки атомов кислорода, третье место (столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н
Н—
Н—
Ва =
Н—
Н—
Второе место (столбец) занимают химические знаки атомов кислорода
Третье место (столбец) — химические знаки атомов кислотообразователя, на «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Основные соли (например, А1ОНSO4) Основные соли определяем, чем как продукт частичного замещения группы ОН основания на кислотный остаток. При составлении графических формул основных солей первое место (столбец) занимают химические знаки атомов металлов с обозначением валентности, второе (столбец) — химические знаки атомов металлов кислорода, третье — химические знаки атомов водорода и кислотообразователя с обозначением соответствующей валентности. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По графическому изображению формул веществ можно судить об их свойствах, определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1 или в органических соединениях
Структурная формула Фосфата кальция Ca3(PO4)2 Ca+23(P+5O-24)2
blogg-latofa.blogspot.com
Калькулятор молярной массы, молекулярной массы и строения элементов
| |||||
ru.webqc.org
| Продукция | Синонимы | CAS № | ГОСТ | Марка/сорт | Упаковка/вес |
| Белила цинковые | окись цинка, оксид цинка | 1314-13-2 | 202-84 | БЦ-0М | Мешок 40 кг |
| Борная кислота | ортоборная кислота, кислота борная | 10043-35-3 | 18704-78, импорт | гранулированная NS, порошкообразная, малосульфатная LS | МКР 1000 кг, Мешок 25 кг |
| Бура безводная | натрий тетраборнокислый, тетраборат динатрия, бура кальцинированная, обезвоженная бура | 1330-43-4 | импорт | «Этибор-68» (Etibor-68) | МКР 1000 кг, Мешок 25 кг |
| Бура пятиводная | динатрий тетраборат пентагидрат, тетраборат натрия пентагидрат, боракс пентагидрат | 12179-04-3 | импорт | «Этибор-48» (Etibor-48) | МКР 1000 кг, Мешок 25 кг |
| Глет свинцовый | оксид свинца, окись свинца, свинца моноксид | 1317-36-8 | 5539-73, импорт | Мешок 25 кг | |
| Глинозем | оксид алюминия | 1344-28-1 | 30558-98 | неметаллургический, металлургический | МКР/разновес (800-1000 кг), Мешок 50 кг |
| Двуокись титана пигментная | титана диоксид пигментный, оксид титана (IV), титановые белила | 13463-67-7 | У.24.1-05766356-054:2005 | SumTITAN R-202, SumTITAN R-203, SumTITAN R-206 | Мешок 25 кг |
| Двуокись циркония | диоксид циркония, окись циркония | 1314-23-4 | 21907-76, импорт | Мешок 25 кг | |
| Калий азотнокислый технический | селитра калиевая, нитрат калия, калиевая соль азотной кислоты | 7757-79-1 | P 53949-2010 | Б | Мешок 50 кг |
| Калий азотнокислый технический СХ | селитра калиевая, нитрат калия | 7757-79-1 | 2180-037-00203795-2009 | Мешок 25 кг | |
| Калий углекислый технический | поташ, карбонат калия, калиевая соль угольной кислоты | 584-08-7 | 10690-73 | кальцинированный/первый, второй, третий полутораводный/первый, второй, третий | Мешок 25 кг, 38-42 кг |
| Каолин обогащенный | белая глина, дигидросиликат алюминия, каолинит, глина каолиновая | 1332-58-7 | У 14.2-00282033-003-01, 5729-070-00284530-96 | П-2, КЕ-2 | Мешок 17-23 кг |
| Колеманит молотый | борат кальция, дикальций гексаборат пентагидрат | 12291-65-5 | импорт | МКР 1000 кг | |
| Криолит искусственный технический | алюминия тринатрия гексафторид, гексафторалюминат натрия, натрия фторалюминат | 13775-53-6 | 2157-001-00194085-2011, BY 400069905.039-2010, импорт | КА, КП | МКР 300 кг, Мешок 25 кг, 40 кг |
| Литий углекислый | карбонат лития, литиевая соль угольной кислоты, карбонат лития двузамещенный, литий карбонат | 554-13-2 | импорт | Мешок 25 кг | |
| Лития гидроокись техническая | моногидрат гидроксида лития, гидрат окиси лития, гидроксид лития, гидроокись лития | 1310-66-3 | импорт | Мешок 25 кг | |
| Магнезия жженая | магния оксид | 1309-48-4 | импорт | LUVOMAG MO72, LUVOMAG MO87 | Мешок 25 кг |
| Натрий азотнокислый технический | селитра натриевая, нитрат натрия, чилийская селитра, натриевая соль азотной кислоты | 7631-99-4 | 828-77 | Б | Мешок 50 кг |
| Натрий кремнефтористый технический | динатрия гексафторсиликат, натрия фторсиликат | 16893-85-9 | 113-08-587-87 | высший, первый | Мешок 50 кг |
| Сода кальцинированная техническая | натрий углекислый, карбонат натрия, динатрий карбонат | 497-19-8 | 5100-85 | А, Б | Мешок 25 кг, 50 кг, МКР 600 кг, 800 кг, 1250 кг |
| Сурик свинцовый | ортоплюмбат свинца, монооксид свинца, окись свинца | 1314-41-6 | импорт | Мешок 25 кг | |
| Цирконовый концентрат | силикат циркония, цирконовый песок, цирконовая мука | 14940-68-2 | У 14-10-015-98, импорт | кцз, кцп-63, кцпт, тонкодисперсный 5 — 20 мкм | МКР 1000 кг, Мешок 50 кг |
| Шпат плавиковый | концентрат плавиковошпатовый сварочный и кислотный керамический, флюорит, флюоритовый концентрат | 7789-75-5 | 29219-91, 4421-73 | ФФ-95А, ФФС-95 | МКР 1000 кг |
www.chempack.ru
Калькулятор молярной массы, молекулярной массы и строения элементов
| |||||
ru.webqc.org
Калькулятор молярной массы, молекулярной массы и строения элементов
| |||||
ru.webqc.org
