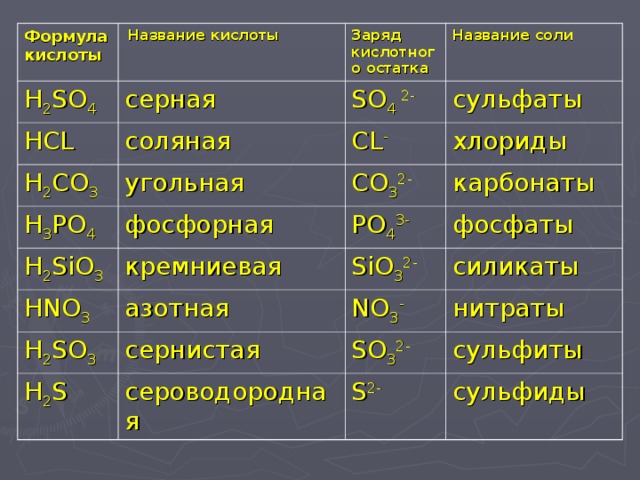
Упражнения для самопроверки
Напишите эмпирические и графические формулы всех оксидов Ca, Si, Fe, Sb, S, Cr и Sn. Назовите оксиды и укажите, какие оксиды относятся к основным, кислотным и амфотерным.
Какие из перечисленных оксидов N2O3, NO2, MgO, SO2, P2O5, Bi2O3, CO2, FeO способны к солеобразованию с основаниями? Напишите уравнения реакций их взаимодействия с гидроксидом кальция.
Напишите уравнения реакций солеобразования с серной кислотой и гидроксидом калия, характеризующие амфотерные свойства BeO, Al2O3, GeO, Cr2O3, GeO2.
2.2.3 Пероксиды
Соединения,
содержащие кислород в степени окисления
(–1), называют пероксидами. В этой степени окисления два атома
кислорода образуют пероксо-группу
[–O–O–],
где кислород двухвалентен.
Пример
Написать эмпирическую и графическую формулу пероксида калия.
Р е ш е н и е: В фомуле оксида натрия вместо атома кислорода подставляем пероксо-группу
Na2O Na2O2; Na–O–Na Na–O–O–Na
Называют пероксиды по правилам номенклатуры бинарных соединений: Na2O2 – пероксид натрия, ВаО2 – пероксид бария.
Пероксиды щелочных и щелочно-земельных металлов представляют собой твёрдые кристаллические вещества, реагирующие с водой с образованием пероксида водорода:
BaO2 + 2H2O H2O2 + Ba(OH)22.
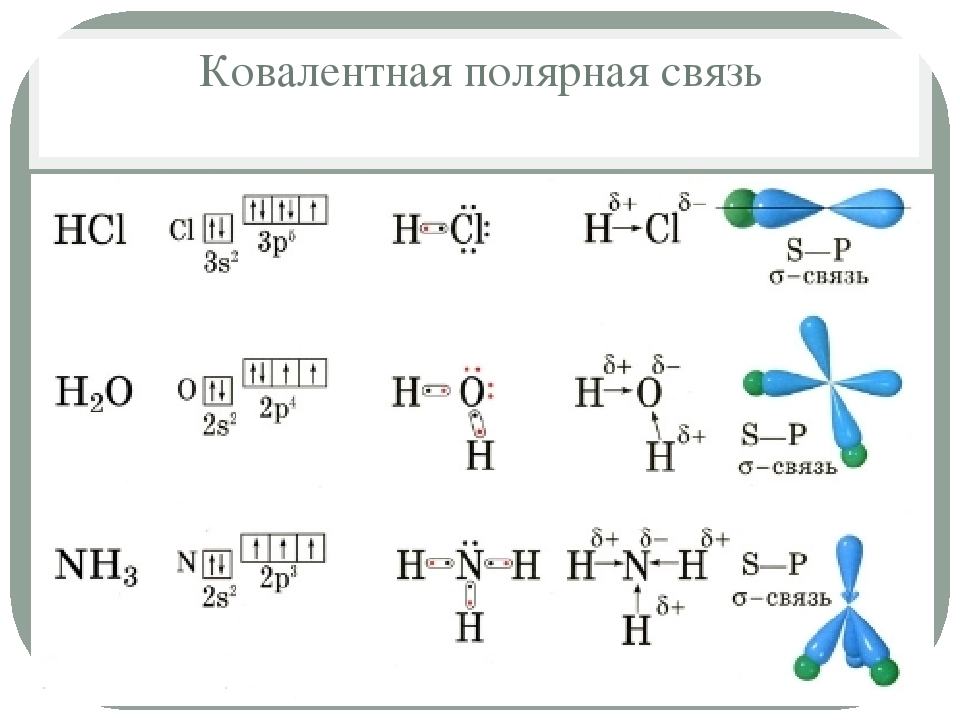 3 Гидроксиды
3 ГидроксидыГидроксиды – это вещества, которые можно рассматривать как продукты соединения оксидов с водой. Многие гидроксиды так и получают, например:
CaO + H2O Ca(OH)2
P2O5 + 3H2O 2H3PO4.
Однако большинство оксидов с водой не реагируют. Их гидроксиды получают косвенным путём, например в реакциях обмена:
FeCl2 + 2NaOH Fe(OH)2 + 2NaCl
Na2SnO3 + 2HNO3 H2SnO3 + 2NaNO3.
Состав гидроксидов можно записать общей формулой – mЭхОуnН2О, где m и n – целые и дробные числа кратные ½.
Являясь производными оксидов, гидроксиды также подразделяются по характеру реакций солеобразования на три группы –
 Важно
отметить, что характер гидроксида и
соответствующего ему оксида совпадают.
Важно
отметить, что характер гидроксида и
соответствующего ему оксида совпадают.Гидроксиды, вступающие в реакции солеобразования с кислотами и кислотными оксидами, называются основаниями:
Fe(OH)2 + H2SO4 FeSO4 + 2H2O
2NaOH + SO2 Na2SO3 + H2O.
Эмпирические формулы оснований получаются добавлением справа от символа металла ОН-групп в количестве, равном степени окисления металла.
Примеры
К+ОН Fe+2(OH
)2 Bi+3(OH)3При изображении графических формул оснований следует учитывать, что ОН-группы соединяются с атомом металла через кислород.
Примеры
AgOH Ag–O–H Cu(OH)2 H–O–Cu–O–H
Номенклатура
оснований
проста и подобна номенклатуре бинарных
соединений с той разницей, что
электроотрицательной частицей является
не атом, а сложный ион ОН–,
который в этом случае имеет название гидроксид.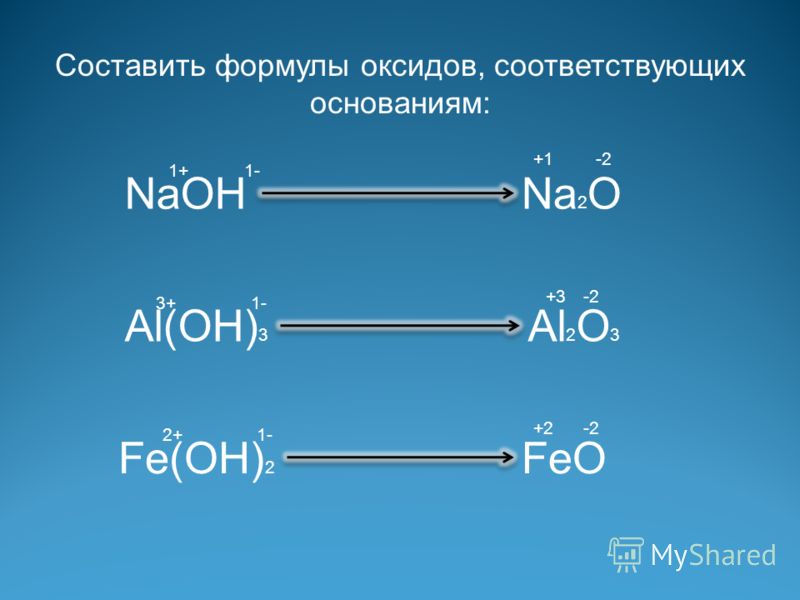
Примеры
КОН – гидроксид калия CuOH – гидроксид меди(+1)
Cu(OH)2 – гидроксид меди(+2) Bi(OH)3 – гидрокс
Mg(OH)2 – гидроксид магния La(OH)3 – гидроксид лантана
Гидроксиды, вступающие в реакции солеобразования с основаниями и основными оксидами, относят к кислотам. Эту группу гидроксидов правильнее называть оксокислотами:
HNO3 + NaOH NaNO3 + H2O
H2SO4 + MgO Mg(OH)2 + H2O.
Написание
эмпирических формул оксокислот
вызывает определённые сложности. Причина
в том, что многие из них имеют несколько
гидратных форм отличающихся соотношением n и m (mЭхОуnН2О),
т. е. формальным содержанием воды.
Различают
мономерные формы – мета- и орто-,
димерные и полимерные формы кислот.
е. формальным содержанием воды.
Различают
мономерные формы – мета- и орто-,
димерные и полимерные формы кислот.
формула оксида + формула воды.
Примеры
а) Формулу метаформы кислоты кремния(+4) получаем сложив формулу оксида в формулой воды:
SiO2 + H2O = H2SiO3.
б) Метаформу кислоты фосфора(+5) получаем следующим образом:
Р2О5 + Н2О = Н2Р2О6,
В получившейся формуле численные индексы нужно сократить в два раза:
Н2Р2О6 2 = НРО3.
Ортоформа
кислоты содержит ОН-групп больше, чем
метаформа. Её формулу можно вывести по
алгоритму:
Её формулу можно вывести по
алгоритму:
формула метаформы кислоты + формула воды.
Примеры
а) Формулу ортоформы кислоты кремния(+4) получаем сложив формулы метаформы кислоты и воды:
H2SiO3 + H2O = H4SiO4.
б) Аналогично выводим формулу ортоформы кислоты фосфора(+5):
HPO3 + H2O = H3PO4.
В димерной форме кислоты (диформа) содержится два атома кислотообразующего элемента. Обычно димерные кислоты получаются в реакциях поликонденсации мономеров с отщеплением воды. Эту реакцию можно использовать в качестве алгоритма вывода формул дикислот. Для этого из удвоенной формулы мономера, содержащего 2 или 3 атома водорода, вычитают формулу воды.
Примерыа) Формулу димерной кислоты кремния(+4) выводим исходя из метаформы:
2H2SiO3 – H2O
= H2Si2O5.
б) Формулу димерной кислоты фосфора(+5) нужно выводить из ортоформы кислоты, так как её метаформа (HPO3) содержит только один атом водорода:
2Н3РО4 – Н2О = Н4Р2О7.
Изображение графических формул кислот следует начинать с атома кислотообразующего элемента, вокруг которого располагают атомы кислорода. Затем атомы кислорода соединяют с атомом элемента одинарными связями. Если валентность центрального атома больше числа атомов кислорода, то часть атомов кислорода соединяют с центральным атомом двойными связями. К другим атомам кислорода присоединяют одинарными связями атомы водорода.
Примеры
Ортофосфорная кислота Ортокремневая кислота
H3PO4 H4SiO4
В
графических формулах дикислот два атома
кислотообразующего элемента соединяют
кислородным мостиком, а оставшиеся
атомы кислорода распределяют поровну
между атомами кислотообразующего
элемента. Далее поступают так же, как и
в случае мономеров.
Далее поступают так же, как и
в случае мономеров.
Примеры
Дикремневая кислота Дифосфорная кислота
H2Si 2O5 H4P2O7
Номенклатура оксокислот. К кислотам применяется традиционная номенклатура, правила которой максимально адаптированы к русскому языку:
В названии кислоты используется русское название кислотообразующего элемента.
Названия кислот с максимальной степенью окисления кислотообразующего элемента имеют окончания «-ная», «-овая» или «-евая».
Примеры
H2C+4O3 – угольная кислота, H2Cr+6O4 – хромовая кислота,
H4Si+4O4 – ортокремневая
кислота.
Примеры
HN+3O2 – азотистая кислота, H2S+4O3 – сернистая кислота.
Если у кислотообразующего элемента несколько промежуточных степеней окисления, то для обозначения низшей степени окисления и степени окисления ближайшей к высшей в название кислоты добавляется суффикс «-оват-».
Пример
В случае оксокислот хлора это правило выполняется в полном объёме:
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O
– хлорноватистая
кислота.
Гидратные формы кислот указываются приставками «мета», «орто», «ди» и др.
Примеры
HPO3 – метафосфорная кислота,
H3PO4 – ортофосфорная кислота,
Н4Р2О7 – дифосфорная кислота,
Н5Р3О10 – трифосфорная кислота.
Следует отметить, что у ряда элементов – С, N, Cl, Br, I – не
существуют димерные формы кислот. У элементов C, N, S, Se, Cl, Br не существует ортоформ кислот, поэтому в названиях метаформ кислот приставка «мета» обычно опускается.
Кислотно-основные
свойства гидроксидов определяются
свойствами ОН-группы. У оснований легко
отщепляется ОН-группа с образованием
иона металла и гидроксид-иона – ОН–. В кислотах, напротив, от ОН-группы легко
отщепляется водород с образованием
иона кислотного остатка и иона водорода
– Н+.
Эти свойства гидроксидов определяют
протекание реакций нейтрализации:
В кислотах, напротив, от ОН-группы легко
отщепляется водород с образованием
иона кислотного остатка и иона водорода
– Н+.
Эти свойства гидроксидов определяют
протекание реакций нейтрализации:
Основание + Кислота = Вода + Соль
Fe(OH)2 + H2SO4 = 2H2O + FeSO4
По числу замещаемых ОН-групп основания делятся на однокислотные, двухкислотные, трёхкислотными и т.д.. По числу замещаемых ионов водорода кислоты подразделяются на одноóсновные, двухóсновные, трёхóсновные и т.д..
В ряде гидроксидов в равной степени могут отщепляться и ионы Н+ и ионы ОН–, т.е. гидроксиды могут проявлять свойства кислот и оснований.
Гидроксиды проявляющие свойства кислот и оснований называются амфотерными гидроксидами.
Типичным амфотерным гидроксидом является гидроксид цинка:
Zn(OH)2 + 2HNO3 2H2O + Zn(NO3)2
H2ZnO2 + 2NaOH
2H2O
+ Na2ZnO2.
Из приведённого примера видно, что эмпирические формулы амфотерных гидроксидов можно записывать как формулы оснований, так и кислот. Такой подход допускается и в названиях амфотерных гидроксидов.
Примеры
Zn(OH)2 – гидроксид цинка или H2ZnO2 – цинковая кислота
Sb(OH)3 – гидроксид сурьмы(+3) или H3SbO3 – ортосурьмянистая кислота
Теоретический материал по химии на тему «Графические формулы неорганических соединений» (11 класс)
ГРАФИЧЕСКИЕ ФОРМУЛЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
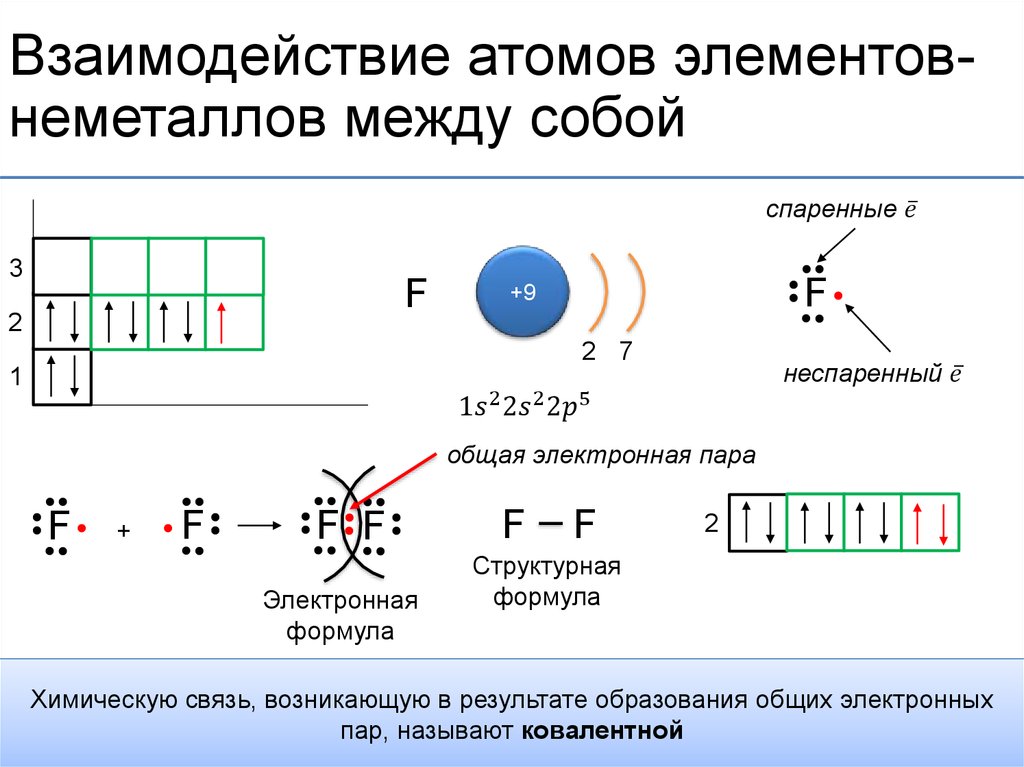
Очень часто формулы молекул оксидов, оснований, кислот, амфотерных гидроксидов и солей изображают графически. Для этого необходимо знать валентность каждого элемента, входящего в состав молекулы. Валентность элементов изображается черточками. Число черточек, отходящих от химического знака элементов, равно его валентности, например, Н , О =, Al и т. д.
д.
Так как в молекуле свободные валентности отсутствуют, то надо так составить формулу, чтобы число черточек одного элемента соответствовало числу черточек другого элемента. Валентность разных атомов в молекуле взаимонасыщенна (отсутствуют свободные черточки), например, оксид натрия Na2O, в котором натрий одновалентен, а кислород двухвалентен.
Тогда графическая формула оксида имеет вид:
Na – O – Na
От атома кислорода отходят две черточки, от каждого атома натрия – по одной.
Графическая формула оксида алюминия Al2O3 имеет вид:
O = Al – O – Al = O
Алюминий трехвалентен, а кислород двухвалентен. От каждого атома алюминия отходят три черточки, от атома кислорода – две.
Графические формулы оснований
K – O – H H – O – Ba – O – H H – O – Al – О – Н
׀
O – H
KOH Ba(OH)2 Al(OH)3
гидроксид калия гидроксид бария гидроксид алюминия
В молекуле оснований атомы водорода связаны с кислородом.
Графические формулы кислот
В молекулах кислородосодержащих кислот атомы водорода, способные замещаться металлом, связаны с атомом неметалла через кислород:
H – O
Н – O – N = О Н – О – C – О – Н H – О – P = O
H – O ׀׀ ׀׀
O О
HNO3 H2CO3 H3PO4
азотная кислота угольная кислота ортофосфорная кислота
В состав уксусной кислоты СН3СООН входят четыре атома водорода, но только один из них связан с кислородом, поэтому в уксусной кислоте только один атом водорода, соединенный с атомом кислорода, способен замещаться атомом металла:
Н О
׀ ׀׀
Н – С – С – О – Н
׀
Н
Графические изображения солей
Графическое изображение формул средних и особенно кислых солей часто вызывает затруднения. При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
Графическая формула средней (нормальной) соли Mg(NO3)2 имеет вид:
HNO3 Mg(NO3)2
азотная кислота нитрат магния
O
׀׀
O – N = O
Mg
O – N = O
׀׀
O
O
׀׀
H – O – N = O
Mg
H – O – N = O
׀׀
O
Графическая формула кислой соли КHCO3 имеет вид:
Н2СО3 КНCO3
угольная кислота гидрокарбонат калия
К H – O – С – O – Н
׀׀
O
К – O – С – O – Н
׀׀
O
При составлении основных солей нужно сначала написать графическую формулу основания и затем заменить в ней частично гидроксогруппы ОН кислотными остатками. Например, в основной соли MgOHNO3 гидроксогруппа ОН замещена кислотным остатком NO.
Например, в основной соли MgOHNO3 гидроксогруппа ОН замещена кислотным остатком NO.
Графическая формула основной соли MgOHNO3 имеет вид:
Mg(OH)2 HNO3 MgOHNO3
гидроксид магния азотная кислота гидроксонитрат магния
O
׀׀
H – O – Mg – O – N = O
O
׀׀
H – O – Mg – O – H H – O – N = O
What, How to Balance & FAQs —
By Sarnali Mukherjee гидроксид (Ba(OH) 2 ). Дайте нам знать соединение ниже:
Сернистая кислота (H 2 SO 3 ) была идентифицирована как одна из самых слабых кислот. Кислота находится в растворе, то есть в жидком состоянии, но отдельные молекулы находятся в газообразном состоянии. Кроме того, гидроксид бария (Ba(OH) 2 ) представляет собой сильное основание, которое находится в виде белого аморфного твердого вещества.
Кроме того, гидроксид бария (Ba(OH) 2 ) представляет собой сильное основание, которое находится в виде белого аморфного твердого вещества.
H 2 SO 3 + Ba(OH) 2 — это реакция, которая будет проанализирована в этой статье путем количественной оценки некоторых ценных фактов, касающихся процесса этой химической реакции. В статье будут продемонстрированы такие факты, как сбалансированное химическое уравнение, буферный раствор, межмолекулярные силы и другие.
Что является продуктом H
2 SO 3 + Ba(OH) 2 ?H 2 SO 3 + Ba(OH) 2 выдают сульфит бария (BaSO 3 ) и воду (H 2 O). Реакция заключается в следующем:
H 2 SO 3 + BA (OH) 2 = BASO 3 + H 2 O
Какой тип реакции H
2 SO 3 + Ba(OH) 2 ? H 2 SO 3 + Ba(OH) 2 — кислотно-щелочная реакция. Поскольку H 2 SO 3 является слабой кислотой, а Ba(OH) 2 является сильным основанием, реакция считается кислотно-основной.
Поскольку H 2 SO 3 является слабой кислотой, а Ba(OH) 2 является сильным основанием, реакция считается кислотно-основной.
Как сбалансировать H
2 SO 3 + Ba(OH) 2 ?H 2 SO 3 + Ba(OH) 2 реакцию можно уравновесить, выполнив несколько общих шагов, которые показаны ниже:
- обе стороны должны быть рассчитаны
- Общее уравнение реакции — H 2 SO 3 + BA (OH) 2 = BASO 3 + H 2 O
- В Реагентских средствах 4 H, 1 S, 1 S,
- в реализации 4 H, 1 S, 1 S, 5 O, 1Ba присутствуют.
- В продуктах присутствует 2 H, 1 S, 4 O, 1 Ba.
- Количество молекул водорода и кислорода, необходимых для баланса
- Сначала умножение H 2 SO 3 на 2 было выполнено, чтобы сбалансировать количество водорода.
- Уравнение, полученное как 2H 2 SO 3 + BA (OH) 2 = BASO 3 + H 2 O
- Отмена. Умножение H 2 3
- .
с 2, то же самое было сделано с молекулой воды - Полученное уравнение:
- Теперь все элементы сбалансированы с каждой стороны.
- Окончательное сбалансированное уравнение — H 2 SO 3 + BA (OH) 2 = BASO 3 + 2H 2 O
H
2 SO 9005 3H
2 SO 9005 3 + BAH
2 SO 9005 3H
2 SO +H
2 SO +. (OH) 2 титрование H 2 SO 3 + Ba(OH) 2 титрование не оправдано, т.к. и струнная кислота, гидроксид бария. Ва(ОН) 2 более надежен для получения положительных результатов при титровании с H 2 SO 4 .
Ва(ОН) 2 более надежен для получения положительных результатов при титровании с H 2 SO 4 .
H
2 SO 3 + BA (OH) 2 Чистое ионное уравнение H 2 SO 3 + BA (OH) 2 . H 2 SO 3 (водн.) + Ba(OH) 2 (т) = BaSO 3 (т)+ 2 6 H
H
2 SO 3 + BA (OH) 2 СОПРОГАТЕЛЬНЫЕ ПАРЫH 2 SO 3 + BA (OH) 2 СООБОР :
- H 2 SO 3 and Ba(OH) 2 can be considered as a conjugate acid-base pair
- The conjugate base of H 2 SO 3 is HSO 3 –
- Конъюгатная кислота H 2 SO 3 IS H +
- Конъюгатная кислота BA (OH) 2 IS BA +
- .
 Согласная база BA OR) (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) (OH). 2 IS OH —
Согласная база BA OR) (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) OR (OH) (OH). 2 IS OH —
H
2 SO 3 + BA (OH) 2 Межмолекулярные силыH 2 SO 3 + BA (OH) 2 2 SO 3 + BA (OH) 2 6 2 6 2 6 2 6 2 6 2 6 2 3 3 + BA (OH) 2 2 SO силы приведены ниже:
- H 2 SO 3 представляет собой ионное соединение, состоящее из ионных связей, что указывает на более сильную межмолекулярную силу.
- BA (OH) 2 также изготовлен из ионных связей, что указывает на сильные ионные межмолекулярные силы
H
2 SO 3 + BA (OH) 2 Entallpy9 + BA (OH) 2 . 2 SO 3 + Ba(OH) 2 энтальпии реакции приведены ниже:
- Энтальпия формирования H 2 SO 3 IS -655,5 кДж / моль
- Энтюльпия формирования BA (OH) 2 is -643.
 9. Формирования Baso 3 IS -1030 кДж / моль
9. Формирования Baso 3 IS -1030 кДж / моль - Энтальпия образования H 2 O -285,8 кДж / моль
IS H
2 SO 9000 3 9000 + 9000 + 9000 + BA. (OH) 2 буферный раствор?H 2 SO 3 + Ba (OH) 2 являются прекрасным примером кислого буферного раствора. Эта реакция между слабой кислотой и сильным основанием достигает кислотного равновесия, когда в растворе начинает образовываться сульфит бария. Этот раствор в равновесной фазе находится в виде кислого буфера H 2 SO 3 и Ba (OH) 2 .
Является ли H
2 SO 3 + Ba(OH) 2 полной реакцией? H 2 SO 3 + Ba (OH) 2 представляют собой полную реакцию, которая может достичь точной равновесной фазы после того, как реагенты конкурируют друг с другом. В результате реакции также выделяется определенное количество продукта.
В результате реакции также выделяется определенное количество продукта.
Является ли H
2 SO 3 + Ba(OH) 2 экзотермической или эндотермической реакцией?H 2 SO 3 + Ba(OH) 2 является экзотермической реакцией, так как энтальпии образования продуктов отрицательны. Это означает, что в конце реакции выделяется определенное количество тепловой энергии.
График экзотермической реакцииIs H
2 SO 3 + Ba(OH) 2 окислительно-восстановительная реакция? H 2 SO 3 + Ba(OH) 2 можно считать окислительно-восстановительной реакцией. Присоединение OH – к H относится к окислению. С другой стороны, выход H + из сернистой кислоты относится к реакции восстановления. Оба в равной степени происходят в этой реакции, поэтому это может быть окислительно-восстановительная реакция.
Н
2 SO 3 + Ba(OH) 2 реакция осаждения?H 2 SO 3 + Ba(OH) 2 – реакция осаждения. Основной продукт – сульфит бария – образуется в виде белого осадка в растворе продукта, нерастворимого в воде и других органических соединениях.
Является ли H
2 SO 3 + Ba(OH) 2 обратимой или необратимой реакцией?Н 2 SO 3 + Ba(OH) 2 является необратимой реакцией, так как продукты, Вода и сульфит бария не вступают в дальнейшую реакцию на реагент обратно.
Is H
2 SO 3 + Ba(OH) 2 реакция замещения? H 2 SO 3 + Ba(OH) 2 является реакцией замещения. Ионы H + из H 2 SO 3 покидают соединение и занимают место Ba в Ba(OH) 2 . Кроме того, при выходе Ba(OH) 2 Ba соединяется с SO 3 .
Кроме того, при выходе Ba(OH) 2 Ba соединяется с SO 3 .
Заключение
Реакция между сернистой кислотой и гидроксидом бария является удивительным примером буферного раствора, когда он достигает равновесия. Однако эта реакция относится к кислотно-щелочной реакции, в которой объединены знания о конъюгации слабой кислоты и сильного основания.
ap химия рабочий лист 7 эмпирические и молекулярные формулы ответы
AlleBilderVideosBücherMapsNewsShopping
suchoptionen
[PDF] Эмпирические формулы — физика
Shakerscience.weebly.com › 7 › 7 › Experiment_formulas_pogil_key
В этом упражнении будут сравниваться два типа полезных формул. Модель 1 – Эмпирическая формула. Эмпирические формулы. Как химические формулы соединения могут быть …
[PDF] EMPIRICAL AND MOLECULAR FORMULA WORKSHEET
swhschemistry.weebly.com › uploads › 7 › lt_6. 4__key.pdf
4__key.pdf
EMPIRICAL AND MOLECULAR FORMULA WORKS. 1. Установлено, что оксид хрома имеет следующий % состав: 68,4 % Cr и 31,6 % 0,
[PDF] Решения для эмпирических и молекулярных формул
www.peoriapublicschools.org › cms › lib2 › Centricity › Domain › E…
Решения для эмпирических и молекулярных формул. 1. Найдено соединение, содержащее 63,52 % железа и 36,48 % серы. Найдите его эмпирическую формулу. 63,52 г Fe.
Bilder
Alle anzeigen
Alle anzeigen
[PDF] WS 7 3 Percent Comp and Empirical Formulas.pdf
www.basd.k12.wi.us …
Обведите свой окончательный ответ. А. Рассчитайте процентный состав следующих соединений. 1. Сг2О3. Кр. 2.
[PDF] AP Chemistry Worksheet 1: Significant Figures and Dimension…
www.gambrellchemistry.com › uploads › ap_chemistry_review_assig…
AP Chemistry Worksheet 7: Эмпирические и молекулярные формулы. Для каждой приведенной ниже задачи напишите уравнение и покажите свою работу. Всегда используйте единицы измерения и коробки в своем …
Всегда используйте единицы измерения и коробки в своем …
[DOC] AP Chem Summer Assignment DOC — Средняя школа Ривер-Сити
rivercity.wusd.k12.ca.us › Phyllis-Cruz › документы › AP-Chemistry
Надеюсь, таким образом вы сможете начать работу и получить ответы на любые вопросы, а не… AP Chemistry Worksheet 7: Empirical и молекулярные формулы.
[PDF] Процентный состав и молекулярная формула Рабочий лист
www.monroe.k12.ky.us › пользовательские файлы › Классы › Процентный состав a…
Соединение с эмпирической формулой C2H8N и молярной массой 46 грамм на моль. Ответьте на следующие вопросы: 9. Процентный состав уксусной кислоты …
[DOC] Процентный состав и эмпирическая и молекулярная формула
www.teachnlearnchem.com › Формула › Word
Найдите эмпирическую формулу соединения, состоящего из 53,7% железа и 46,3% … Найдите молекулярную формулу этана. Ответы: 1. Na2SO3 6. h4PO4. 2. Fe2S3 7.