Гипохлорит натрия — Физические свойства
Химия — Гипохлорит натрия — Физические свойства
01 марта 2011Оглавление:
1. Гипохлорит натрия
2. История открытия
3. Физические свойства
4. Химические свойства
5. Идентификация
6. Коррозионное воздействие
7. Физиологическое действие и воздействие на окружающую среду
8. Лабораторные методы получения
9. Применение
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na, Cl, O.
Хорошо растворим в воде: 53,4 г в 100 граммах воды.
У соединения известно три кристаллогидрата:
- крайне неустойчив, разлагается выше 60 °C, при более высоких температурах со взрывом.
- NaOCl · 2,5H2O более устойчив, плавится при 57,5 °C.
- пентагидрат NaOCl · 5H2O наиболее устойчивая форма, представляет собой белые ромбические кристаллы. Не гигроскопичен, хорошо растворим в воде: 26, 29,5, 38, 82, 100. В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления: 24,4 °C, при нагревании разлагается.
Плотность водного раствора гипохлорита натрия при 18 °C:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔH298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔG298: −298,7 кДж/моль.
Просмотров: 19003
4108.ru
Гипохлорит натрия марка А: характеристики, применение
Гипохлорит натрия — это химический материал, используемый в разных сферах в качестве дезинфектанта. Применяться это соединение может для обеззараживания всевозможных поверхностей, материалов, жидкостей и пр. Разновидностей такого вещества существует несколько. Очень часто в качестве дезинфектанта применяется, к примеру, гипохлорит натрия марки А.
Что собой представляет
На рынок это средство поставляется в виде жидкости зеленовато-желтого цвета. Получают его путем электролиза поваренной соли. Иногда гипохлорита натрия делают и посредством хлорирования водного раствора едкого натра. Химическая формула этого соединения выглядит следующим образом — NaClO. Основной отличительной чертой гипохлорита натрия марки А является высокая антибактериальная активность.

По-другому это соединение называют «жавелевой» или «лабарраковой» водой. В свободном состоянии гипохлорит натрия является веществом довольно-таки неустойчивым.
Сфера применения
Изготавливаться гипохлорит натрия может по ГОСТ или по ТУ. Первая разновидность средств при этом используется в основном для обеззараживания воды. Это может быть:
питьевая и техническая вода в централизованных коммунальных сетях;
промышленные и бытовые стоки;
вода в плавательных бассейнах.
Гипохлорит натрия, выпускаемый по ТУ и имеющий качество ниже, также применяется, конечно же, с целью дезинфекции. Это средство, к примеру, часто используют для:
обеззараживания природных и сточных вод;
очистки воды в рыбохозяйственных водоемах;
дезинфекции в пищевой промышленности.
Также такой гипохлорит натрия может использоваться и для изготовления разного рода отбеливающих средств. К плюсам этого соединения при применении в качестве обеззараживателя относят и экологическую безопасность. В окружающей среде гипохлорит натрия быстро разлагается на воду, поваренную соль и кислород.

Принцип действия
Одной из отличительных черт гипохлорита натрия марки А является то, что он способен оказывать губительное влияние на болезнетворные микроорганизмы самых разных типов. То есть отнесен он может быть к группе универсальных дезинфектантов.
При растворении в воде это соединение, наподобие обычной хлорки, образует кислоту, которая и оказывает обеззараживающее действие. Формула образования дезинфицирующего средства при этом выглядит следующим образом:
Такая реакция является равновесной. Зависит же процесс образования хлорноватистой кислоты прежде всего от pH воды и от ее температуры.
Уничтожать в воде гипохлорит натрия может, к примеру, следующие виды бактерий:
патогенные энтерококки;
грибок Candida albicans;
некоторые разновидности анаэробных бактерий.
Убивает вредные микроорганизмы это средство не только эффективно, но еще и очень быстро — в течение 15-30 секунд.

Гипохлорит натрия марки А: характеристики
Как уже упоминалось, представляет собой это соединение зеленоватую жидкость. Техническими же характеристиками этот дезинфектант отличается следующими:
массовая концентрация хлора — минимум 190 г/дм3;
коэффициент светопропускания — минимум 20%;
концентрация щелочи — 10-20 г/дм3 в пересчете на NaOH;
концентрация железа — не более 0.02 г/дм3.
Активного хлора в состав этого соединения может доходить до 95%.
Транспортировка и хранение
Разливаться гипохлорит натрия может в тару разных типов. Чаще всего его перевозят в гуммированных стальных железнодорожных цистернах. Расфасовываться же этот материал может в контейнеры из стеклопластика и полиэтилена. Также в качестве тары могут использоваться бочки и стеклянные бутылки. Автомобильным транспортом гипохлорит натрия перевозят в контейнерах с соблюдением соответствующих норм безопасности.
Хранить это соединение полагается в неотапливаемых помещениях. При этом нельзя допускать попадания на складированный гипохлорит натрия солнечных лучей. В больших объемах этот материал хранят обычно в гуммированных стальных или же в покрытых стойкими к коррозии материалами емкостях.
К сожалению, гарантийного срока годности для гипохлорита натрия марки А не предусмотрено. Предприятия, отвечающие за обеззараживание воды, должны самостоятельно проверять пригодность этого средства перед использованием. Качество этого соединения должно быть не ниже рекомендуемого нормативной документацией для дезинфекции данных конкретных объектов.

Маркировка упаковки
Срока хранения для гипохлорита натрия марки А, таким образом, не предусматривается. Перед использованием на качество это соединение проверяют сами компании-потребители. Но конечно же, определенную информацию организации, занимающиеся обеззараживанием воды, о том, какое именно средство они покупают, иметь должны.
Разумеется, на тару с гипохлоритом натрия, как и с любым другим химическим соединением, наносится маркировка, которая должна, помимо всего прочего, содержать:
наименование компании-производителя и ее контакты;
название собственно самого продукта и его марку;
номер партии и дату изготовления.
Основные правила использования
Для того чтобы обеззараживание воды было эффективным, использовать для этой процедуры, конечно же, нужно только качественный гипохлорит натрия марки А. Согласно действующим нормативам ГОСТ (измененный, ред №1) и ТУ, потери хлора по прошествии 10 суток со дня отгрузки в этом соединении не должны превышать 30%.

Также нормативы не запрещают использовать изготовленный по ТУ или ГОСТ (с изменениями) гипохлорит натрия марки А, изменивший свой цвет на красно-коричневый. Такое соединение также обеззараживает воду очень эффективно.
Техника безопасности
Представляет собой гипохлорит натрия хотя и негорючее, но очень едкое вещество. Поэтому при работе с ним специалисты в обязательном порядке должны защищать руки и глаза. Класс опасности гипохлорита натрия марки А — II (по хлору). При попадании на кожу этот дезинфектант способен вызывать серьезные ожоги. Если же это соединение попадет в глаза, человек и вовсе может ослепнуть. Вдыхание паров этого средства может вызывать удушье и раздражающий эффект.
Использовать гипохлорит натрия для обеззараживания персонал должен в спецодежде с применением спецсредств:
в противогазе БКФ или Б;
резиновых перчатках;
защитных очках;
- специальных костюмах.
Тот участок кожи, на который по неосторожности попало это соединение, следует промывать обильным количеством проточной воды в течение не менее 10 мин. При попадании брызг в глаза пострадавшего нужно доставить к врачу. Перед этим, конечно же, также следует сделать тщательное промывание.
Изготовленный по ГОСТ 11086-76 гипохлорит натрия марки А при высыхании может вызывать самовозгорание разного рода органических веществ. Поэтому хранить это соединение в одном помещении, к примеру, с опилками или ветошью нельзя.

Другие марки
Помимо гипохлорита натрия марки А, в качестве дезинфектанта может использоваться NaClO:
марки Б;
В;
Г;
Э.
Такие растворы являются менее концентрированными (за исключением гипохлорита натрия марки Б, изготавливаемого по ТУ). NaClO марки Э, помимо этого, представляет собой не зеленую жидкость, а бесцветную. На упаковки с гипохлоритом Б, помимо всего прочего, должна наноситься надпись «Непригоден к обеззараживанию воды питьевой и в плавательных бассейнах».
Соединения этой марки допускается использовать в основном только для отбеливания тканей. Также такой гипохлорит натрия может применяться в качестве окислителя в витаминной промышленности.
fb.ru
Гипохлорит натрия — WiKi
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
| Гипохлорит натрия | |
|---|---|
| Общие | |
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Хим. формула | NaOCl |
| Рац. формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] |
| 5%-й раствор[2]: 40 °C | |
| Энтальпия образования | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| PubChem | 23665760 |
| Рег. номер EINECS | 231-668-3 |
| SMILES | |
| InChI | |
| RTECS | Nh4486300 |
| ChEBI | 32146 |
| Номер ООН | 1791 |
| ChemSpider | 22756 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора[К 5]. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[2], гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор[5]. Спустя 11 лет в 1785 году (по другим данным — в 1787 году[2]), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами[6][К 6].
- Cl2+h3O=HCl+HOCl (1){\displaystyle {\mathsf {Cl_{2}+H_{2}O=HCl+HOCl}}\ \ \ \ (1)}
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2)), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения[7].
- Cl2+2K2CO3+h3O=2KHCO3+KOCl+KCl (2){\displaystyle {\mathsf {Cl_{2}+2K_{2}CO_{3}+H_{2}O=2KHCO_{3}+KOCl+KCl}}\ \ \ \ (2)}
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение
- Cl2+2NaOH=NaCl+NaOCl+h3O (3){\displaystyle {\mathsf {Cl_{2}+2NaOH=NaCl+NaOCl+H_{2}O}}\ \ \ \ (3)}
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге[2]; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити[8].
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C) [9].
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом[3].
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C[3].
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые[10]) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения[3]. Температура плавления: 24,4 °C (по другим данным: 18 °C[10]), при нагревании (30—50 °C) разлагается[1].
Плотность водного раствора гипохлорита натрия при 18 °C[11]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций[12]:[стр. 458]:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе[13]:
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
- 2NaOCl=2NaCl+O2{\displaystyle {\mathsf {2NaOCl=2NaCl+O_{2}}}}
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора[К 5][13]. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом[14].
При нагревании параллельно происходит реакция диспропорционирования[13]:
- 3NaOCl=NaClO3+2NaCl{\displaystyle {\mathsf {3NaOCl=NaClO_{3}+2NaCl}}}
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
- NaOCl →h3O Na++OCl−{\displaystyle {\mathsf {NaOCl\ {\xrightarrow {H_{2}O}}\ Na^{+}+OCl^{-}}}}
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537[13]), гипохлорит-ион в водной среде подвергается гидролизу:
- OCl−+h3O⇆HOCl+OH−{\displaystyle {\mathsf {OCl^{-}\!+H_{2}O\leftrightarrows HOCl+OH^{-}}}}
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства[13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки[3]). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11)[3].
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом[15]:
- 2OCl−=2Cl−+O2{\displaystyle {\mathsf {2OCl^{-}\!=2Cl^{-}\!+O_{2}}}}
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования[15]:
- 3OCl−=2Cl−+ClO3−{\displaystyle {\mathsf {3OCl^{-}\!=2Cl^{-}\!+ClO_{3}^{-}}}}
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
- HOCl+2ClO−=ClO3−+2Cl−+H+{\displaystyle {\mathsf {HOCl+2ClO^{-}=ClO_{3}^{-}+2Cl^{-}+H^{+}}}}
- HOCl+ClO−=O2+2Cl−+H+{\displaystyle {\mathsf {HOCl+ClO^{-}\!=O_{2}+2Cl^{-}\!+H^{+}}}}
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
- 4HOCl=2Cl2+O2+2h3O{\displaystyle {\mathsf {4HOCl=2Cl_{2}+O_{2}+2H_{2}O}}}
Если для подкисления используется соляная кислота, в результате выделяется
ru-wiki.org
Гипохлорит натрия — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Гипохлорит натрия | |
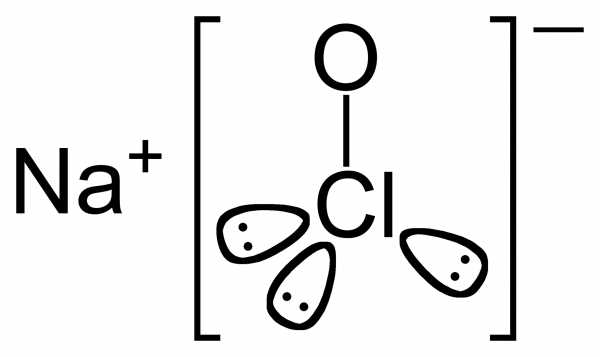 | |
| Общие | |
|---|---|
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Хим. формула | NaOCl |
| Рац. формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] |
| Т. разл. | 5%-й раствор[2]: 40 °C |
| Энтальпия образования | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора
wiki-org.ru
Гипохлорит натрия марка А ГОСТ 11086-76 | aquachem.ru
Уважаемые партнеры, в последнее время участились запросы, связанные с введением нового ГОСТа на гипохлорит натрия. Считаем необходимым сделать разъяснение о том, что ГОСТ Р 57568-2017 «Натрия гипохлорит раствор водный» введен НЕ ВЗАМЕН ГОСТ 11086-76 «Гипохлорит натрия (марка А)» и НЕ ОТМЕНЯЕТ (не заменяет) его. Новый ГОСТ разработан и введен для гипохлорита натрия, получаемого мембранным методом. Тем не менее продукты, изготовленные по обоим гостам (ГОСТ Р 57568-2017 — мембранный метод, ГОСТ 11086-76 — диафрагменный метод), имеют одинаковую область применения — в системах питьевого водоснабжения и для обеззараживания воды плавательных бассейнов и могут применяться на равных условиях, с учетом их концентрации, указанной в технической и разрешительной документации.
ОБЛАСТЬ ПРИМЕНЕНИЯ:
Водные растворы гипохлорита натрия широко используются для дезинфекции благодаря высокой антибактериальной активности и широкому спектру действия на различные микроорганизмы, это дезинфицирующее средство находит применение во многих направлениях человеческой деятельности, главным образом, при обработке питьевой воды и сточных вод.
Гипохлорит натрия различных марок применяют:
- раствор марки А по ГОСТ 11086-76 — в химической промышленности, для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки;
- раствор марки Б по ГОСТ 11086-76 — в витаминной промышленности, как окислитель для отбеливания ткани;
- раствор марки А по ТУ — для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды рыбохозяйственных водоемов, дезинфекции в пищевой промышленности, получения отбеливающих средств;
- раствор марки Б по ТУ — для дезинфекции территорий, загрязненных фекальными сбросами, пищевыми и бытовыми отходами; обеззараживании сточных вод;
- раствор марки В, Г по ТУ — для дезинфекции воды рыбохозяйственных водоемов;
- растворы марок Э по ТУ — для дезинфекции аналогично марке А по ТУ, а также дезинфекции в медико-санитарных учреждениях, предприятиях общественного питания, объектах ГО и др., а также — обеззараживания питьевой воды, стоков и отбеливания.
ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ:
Гипохлорит натрия — NaCIO, получают хлорированием водного раствора едкого натра (NaOH) молекулярным хлором (Cl2) или электролизом раствора поваренной соли (NaCI). Молекулярная масса NaCIO (по международным атомным массам 1971 г.) -74,44. Промышленностью выпускается в виде водных растворов различной концентрации.
Дезинфицирующее действие гипохлорита натрия основано на том, что при растворении в воде он точно так же, как хлор при растворении в воде, образует хлорноватистую кислоту, которая оказывает непосредственное окисляющее и дезинфицирующее действие
NaCIO + h30 NaOH + HCIO
Реакция является равновесной, и образование хлорноватистой кислоты зависит от величины рН и температуры воды.
В РФ состав и свойства гипохлорит натрия, выпускаемого промышленностью, или получаемого непосредственно у потребителя в электрохимических установках, должен соответствовать требованиям, предъявляемым в ГОСТе или ТУ. Основные характеристики растворов гипохлорит натрия, регламентируемые этими документами, приведены в таблице.
Наименование показателя | Норма для марок | ||||||
| По ГОСТ 11086-76 | По ТУ | ||||||
| Марка А | Марка Б | Марка А | Марка Б | Марка В | Марка Г | Марка Э | |
| 1. Внешний вид | Жидкость зеленовато-желтого цвета | Жидкость зеленовато-желтого цвета | Бесцветная жидкость | ||||
| 2. Коэффициент светопропускания, %, не менее | 20 | 20 | Не регламентируется | Не регламентируется | |||
| 3. Массовая концентрация | 190 | 170 | 120 | 120 | 190 | 120 | 7 |
| 4. Массовая концентрация щелочи в пересчете | 10-20 | 40-60 | 40 | 90 | 10-20 | 20-40 | 1 |
| 5.Массовая концентрация железа, г/дмЗ, не более | 0,02 | 0,06 | Не регламентируется | Не регламентируется | |||
Примечания:
- Для растворов по ГОСТ 11086-76 допускается потеря активного хлора по истечении 10 суток со дня отгрузки не более 30% первоначального содержания и изменение окраски до красновато-коричневого цвета.
- Для растворов по ТУ допускается потеря активного хлора по истечении 10 суток со дня отгрузки для марок А и Б не более 30% первоначального содержания, для марок В и Г — не более 20%, для Марки Э — не более 15%.
ООО «Аква-Кемикал», будучи официальным дистрибьютором ООО «Скоропусковский синтез» по Северо-Западному федеральному округу РФ, осуществляет поставки только гипохлорита натрия марки А по ГОСТ 11086-76.
Дальнейшая информация относится только к этой марке.
РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ И ХРАНЕНИЮ:
Гипохлорит натрия должен храниться в неотапливаемых вентилируемых складских помещениях, не допускается хранение с органическими продуктами, горючими материалами и кислотами. Не допускается попадание в продукт солей тяжелых металлов и контакт с такими металлами.
Продукт рекомендуется хранить при температуре не выше 15°С, при температуре выше 35°С гипохлорит натрия быстро разлагается с потерей активного хлора. При температуре ниже -7°С продукт начинает кристаллизоваться, а при -25°С и ниже – полностью застывает.
Обладает высокой коррозионной активностью по отношению к большинству металлов, в том числе, к нержавеющей стали. Рекомендуется хранить и транспортировать в пластиковой или титановой таре.
МЕРЫ ПРЕДОСТОРОЖНОСТИ:
раствор гипохлорита натрия по ГОСТ 11086-76 марки А является сильным окислителем, при попадании на кожу может вызвать ожоги, а при попадании в глаза — слепоту.
При нагревании выше 35°С гипохлорит натрия разлагается с образованием хлоратов и выделением хлора и кислорода. ПДК хлора в воздухе рабочей зоны — 1 мг/мЗ; в воздухе населенных мест: 0,1 мг/мЗ — максимальная разовая и 0,03 мг/мЗ — среднесуточная.
Гипохлорит натрия негорюч и невзрывоопасен, однако в контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их самовозгорание.
Индивидуальная защита персонала должна осуществляться с применением специальной одежды и индивидуальных средств защиты: противогазов марки Б или БКФ, перчаток резиновых и очков защитных.
При попадании раствора гипохлорита натрия на кожные покровы необходимо обмыть их обильной струёй воды в течение 10-12 мин, при попадании брызг продукта в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу.
ВАРИАНТЫ УПАКОВКИ И ПОСТАВКИ:
Продукт поставляется в полиэтиленовой таре (контейнеры, бочки, канистры) и танк-контейнерах.
Кубовая емкость | П/э бочки | Канистра | Танк-контейнер | |||
1 000 Л | 220 Л | 20 — 30 Л | До 25 000 Л |
НОРМАТИВНО-ТЕХНИЧЕСКАЯ ДОКУМЕНТАЦИЯ:
aquachem.ru
Гипохлорит натрия — Gpedia, Your Encyclopedia
| Гипохлорит натрия | |
|---|---|
| Общие | |
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Хим. формула | NaOCl |
| Рац. формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] |
| 5%-й раствор[2]: 40 °C | |
| Энтальпия образования | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| PubChem | 23665760 |
| Рег. номер EINECS | 231-668-3 |
| SMILES | |
| InChI | |
| RTECS | Nh4486300 |
| ChEBI | 32146 |
| Номер ООН | 1791 |
| ChemSpider | 22756 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора[К 5]. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[2], гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор[5]. Спустя 11 лет в 1785 году (по другим данным — в 1787 году[2]), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами[6][К 6].
- Cl2+h3O=HCl+HOCl (1){\displaystyle {\mathsf {Cl_{2}+H_{2}O=HCl+HOCl}}\ \ \ \ (1)}
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2)), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения[7].
- Cl2+2K2CO3+h3O=2KHCO3+KOCl+KCl (2){\displaystyle {\mathsf {Cl_{2}+2K_{2}CO_{3}+H_{2}O=2KHCO_{3}+KOCl+KCl}}\ \ \ \ (2)}
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение (3)). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции[7].
- Cl2+2NaOH=NaCl+NaOCl+h3O (3){\displaystyle {\mathsf {Cl_{2}+2NaOH=NaCl+NaOCl+H_{2}O}}\ \ \ \ (3)}
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге[2]; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити[8].
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C)[9].
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом[3].
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C[3].
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые[10]) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения[3]. Температура плавления: 24,4 °C (по другим данным: 18 °C[10]), при нагревании (30—50 °C) разлагается[1].
Плотность водного раствора гипохлорита натрия при 18 °C[11]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций[12]:[стр. 458]:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе[13]:
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
- 2NaOCl=2NaCl+O2{\displaystyle {\mathsf {2NaOCl=2NaCl+O_{2}}}}
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора[К 5][13]. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом[14].
При нагревании параллельно происходит реакция диспропорционирования[13]:
- 3NaOCl=NaClO3+2NaCl{\displaystyle {\mathsf {3NaOCl=NaClO_{3}+2NaCl}}}
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
- NaOCl →h3O Na++OCl−{\displaystyle {\mathsf {NaOCl\ {\xrightarrow {H_{2}O}}\ Na^{+}+OCl^{-}}}}
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537[13]), гипохлорит-ион в водной среде подвергается гидролизу:
- OCl−+h3O⇆HOCl+OH−{\displaystyle {\mathsf {OCl^{-}\!+H_{2}O\leftrightarrows HOCl+OH^{-}}}}
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства[13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки[3]). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11)[3].
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом[15]:
- 2OCl−=2Cl−+O2{\displaystyle {\mathsf {2OCl^{-}\!=2Cl^{-}\!+O_{2}}}}
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования[15]:
- 3OCl−=2Cl−+ClO3−{\displaystyle {\mathsf {3OCl^{-}\!=2Cl^{-}\!+ClO_{3}^{-}}}}
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
- HOCl+2ClO−=ClO3−+2Cl−+H+{\displaystyle {\mathsf {HOCl+2ClO^{-}=ClO_{3}^{-}+2Cl^{-}+H^{+}}}}
- HOCl+ClO−=O2+2Cl−+H+{\displaystyle {\mathsf {HOCl+ClO^{-}\!=O_{2}+2Cl^{-}\!+H^{+}}}}
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
- 4HOCl=2Cl2+O2+2h3O{\displaystyle {\mathsf {4HOCl=2Cl_{2}+O_{2}+2H_{2}O}}}
Если для подкисления используется соляная кислота, в результате выделяется хлор:
- NaOCl+2HCl=NaCl+Cl2↑+h3O{\displaystyle {\mathsf {NaOCl+2HCl=NaCl+Cl_{2}\!\uparrow \!+H_{2}O}}}
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
- NaOCl+h3O+CO2=NaHCO3↓+HOCl{\displaystyle {\mathsf {NaOCl+H_{2}O+CO_{2}=NaHCO_{3}\!\downarrow \!+HOCl}}}
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды[16].
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде[17][К 7]:
- в кислой среде:
- NaOCl+H+=Na++HOCl{\displaystyle {\mathsf {NaOCl+H^{+}=Na^{+}+HOCl}}}
| 2HOCl+2H++2e−=Cl2↑+2h3O{\displaystyle {\mathsf {2HOCl+2H^{+}\!+2e^{-}=Cl_{2}\!\uparrow \!+2H_{2}O}}} | Eo=1,630B{\displaystyle E^{o}{\mathsf {=1,630B}}} |
| HOCl+H++2e−=Cl−+h3O{\displaystyle {\mathsf {HOCl+H^{+}\!+2e^{-}=Cl^{-}\!+H_{2}O}}} | Eo=1,500B{\displaystyle E^{o}{\mathsf {=1,500B}}} |
- в нейтральной и щелочной среде:
| OCl−+h3O+2e−=Cl−+2OH−{\displaystyle {\mathsf {OCl^{-}\!+H_{2}O+2e^{-}=Cl^{-}\!+2OH^{-}}}} | Eo=0,890B{\displaystyle E^{o}{\mathsf {=0,890B}}} |
| 2OCl−+2h3O+2e−=Cl2↑+ 4OH−{\displaystyle {\mathsf {2OCl^{-}\!+2H_{2}O+2e^{-}=Cl_{2}\!\uparrow \!+\ 4OH^{-}}}} | Eo=0,421B{\displaystyle E^{o}{\mathsf {=0,421B}}} |
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
- NaOCl+2NaI+h3O=NaCl+I2+2NaOH{\displaystyle {\mathsf {NaOCl+2NaI+H_{2}O=NaCl+I_{2}+2NaOH}}}
- 3NaOCl+NaI=3NaCl+NaIO3{\displaystyle {\mathsf {3NaOCl+NaI=3NaCl+NaIO_{3}}}}
- 4NaOCl+NaI=4NaCl+NaIO4{\displaystyle {\mathsf {4NaOCl+NaI=4NaCl+NaIO_{4}}}}
- NaOCl+K2SO3=NaCl+K2SO4{\displaystyle {\mathsf {NaOCl+K_{2}SO_{3}=NaCl+K_{2}SO_{4}}}}
- 2NaOCl+Ca(NO2)2=2NaCl+Ca(NO3)2{\displaystyle {\mathsf {2NaOCl+Ca(NO_{2})_{2}=2NaCl+Ca(NO_{3})_{2}}}}
- NaOCl+NaOH+HCOONa=NaCl+Na2CO3+h3O{\displaystyle {\mathsf {NaOCl+NaOH+HCOONa=NaCl+Na_{2}CO_{3}+H_{2}O}}}
- 2As+6NaOH+5NaOCl=2Na3AsO4+5NaCl+3h3O{\displaystyle {\mathsf {2As+6NaOH+5NaOCl=2Na_{3}AsO_{4}+5NaCl+3H_{2}O}}}
- NaOCl+Nh4=NaOH+Nh3Cl{\displaystyle {\mathsf {NaOCl+NH_{3}=NaOH+NH_{2}Cl}}}
- Nh3Cl+NaOH+Nh4=N2h5+NaCl+h3O{\displaystyle {\mathsf {NH_{2}Cl+NaOH+NH_{3}=N_{2}H_{4}+NaCl+H_{2}O}}}
- См. подробнее подраздел «Производство гидразина».
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления[18]:[стр. 138, 308][19]:[стр. 200]:
- NaOCl+PbO=NaCl+PbO2{\displaystyle {\mathsf {NaOCl+PbO=NaCl+PbO_{2}}}}
- 2NaOCl+MnCl2+4NaOH=Na2MnO4+4NaCl+2h3O{\displaystyle {\mathsf {2NaOCl+MnCl_{2}+4NaOH=Na_{2}MnO_{4}+4NaCl+2H_{2}O}}}
- 3NaOCl+2Cr(OH)3+4NaOH=2Na2CrO4+3NaCl+5h3O{\displaystyle {\mathsf {3NaOCl+2Cr(OH)_{3}+4NaOH=2Na_{2}CrO_{4}+3NaCl+5H_{2}O}}}
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI); Co(II) → Co(III) → Co(IV); Ni(II) → Ni(III); Ru(IV) → Ru(VIII); Ce(III) → Ce(IV) и прочие[20].
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
- 2NaOCl+Tl2SO4+2NaOH=2TlO(OH)↓+2NaCl+Na2SO4{\displaystyle {\mathsf {2NaOCl+Tl_{2}SO_{4}+2NaOH=2TlO(OH)\!\downarrow +2NaCl+Na_{2}SO_{4}}}}
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия[21].
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА)[К 8] или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА)[К 9] с использованием бром-ионоселективного электрода (Br-ИСЭ)[22].
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия)[23].
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные[24]:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 | 10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием[25]. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями[26].
Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis[К 10] погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бак
www.gpedia.com
Гипохлорит натрия — Википедия РУ
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
| Гипохлорит натрия | |
|---|---|
| Общие | |
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Хим. формула | NaOCl |
| Рац. формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] |
| Термические свойства | |
| Т. плав. | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] |
| 5%-й раствор[2]: 40 °C | |
| Энтальпия образования | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| PubChem | 23665760 |
| Рег. номер EINECS | 231-668-3 |
| SMILES | |
| InChI | |
| RTECS | Nh4486300 |
| ChEBI | 32146 |
| Номер ООН | 1791 |
| ChemSpider | 22756 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора[К 5]. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[2], гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор[5]. Спустя 11 лет в 1785 году (по другим данным — в 1787 году[2]), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами[6][К 6].
- Cl2+h3O=HCl+HOCl (1){\displaystyle {\mathsf {Cl_{2}+H_{2}O=HCl+HOCl}}\ \ \ \ (1)}
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2)), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения[7].
- Cl2+2K2CO3+h3O=2KHCO3+KOCl+KCl (2){\displaystyle {\mathsf {Cl_{2}+2K_{2}CO_{3}+H_{2}O=2KHCO_{3}+KOCl+KCl}}\ \ \ \ (2)}
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение (3)). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции[7].
- Cl2+2NaOH=NaCl+NaOCl+h3O (3){\displaystyle {\mathsf {Cl_{2}+2NaOH=NaCl+NaOCl+H_{2}O}}\ \ \ \ (3)}
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге[2]; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити[8].
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C)[9].
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом[3].
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C[3].
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые[10]) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения[3]. Температура плавления: 24,4 °C (по другим данным: 18 °C[10]), при нагревании (30—50 °C) разлагается[1].
Плотность водного раствора гипохлорита натрия при 18 °C[11]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций[12]:[стр. 458]:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе[13]:
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
- 2NaOCl=2NaCl+O2{\displaystyle {\mathsf {2NaOCl=2NaCl+O_{2}}}}
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора[К 5][13]. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом[14].
При нагревании параллельно происходит реакция диспропорционирования[13]:
- 3NaOCl=NaClO3+2NaCl{\displaystyle {\mathsf {3NaOCl=NaClO_{3}+2NaCl}}}
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
- NaOCl →h3O Na++OCl−{\displaystyle {\mathsf {NaOCl\ {\xrightarrow {H_{2}O}}\ Na^{+}+OCl^{-}}}}
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537[13]), гипохлорит-ион в водной среде подвергается гидролизу:
- OCl−+h3O⇆HOCl+OH−{\displaystyle {\mathsf {OCl^{-}\!+H_{2}O\leftrightarrows HOCl+OH^{-}}}}
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства[13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки[3]). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11)[3].
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом[15]:
- 2OCl−=2Cl−+O2{\displaystyle {\mathsf {2OCl^{-}\!=2Cl^{-}\!+O_{2}}}}
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования[15]:
- 3OCl−=2Cl−+ClO3−{\displaystyle {\mathsf {3OCl^{-}\!=2Cl^{-}\!+ClO_{3}^{-}}}}
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
- HOCl+2ClO−=ClO3−+2Cl−+H+{\displaystyle {\mathsf {HOCl+2ClO^{-}=ClO_{3}^{-}+2Cl^{-}+H^{+}}}}
- HOCl+ClO−=O2+2Cl−+H+{\displaystyle {\mathsf {HOCl+ClO^{-}\!=O_{2}+2Cl^{-}\!+H^{+}}}}
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
- 4HOCl=2Cl2+O2+2h3O{\displaystyle {\mathsf {4HOCl=2Cl_{2}+O_{2}+2H_{2}O}}}
Если для подкисления используется соляная кислота, в результа
http-wikipediya.ru
