Гипохлорит стронция, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Очистка воды от стронция
1. Стронций в воде
В природной среде элемент стронций является составляющей частью микроорганизмов и растений. При накоплении данного вещества его токсичность возрастает. Но в большинстве случаев повышенная концентрация радионуклидов стронция появляются в воде в результате деятельности промышленных предприятий или аварии. Большое количество стронция содержится в сточных водах и такую загрязненную воду нельзя утилизировать без предварительной обработки.
Стронций находится в воде в виде бивалентных ионов. Определяется путем проведения химического анализа воды. По регламенту радионуклидов стронция в воде быть не должно. Поэтому перед утилизацией сточных вод требуется тщательная обработка.
2. Методы очистки сточных вод от стронция
Существуют реагентные и безреагентные методы очистки. К первым относят окисление. Ко второму варианту – обратный осмос, ионозамещение, адсорбцию.
Химический метод. Для устранения стронция в воду добавляются определенные реагенты: озон, гипохлорит натрия, перманганат калия. Все эти вещества способны окислить среду и вызвать выпадение стронция в осадок. Метод очистки происходит следующим образом: реагент дозировано подается в воду, где происходит химическая реакция. При взаимодействии химических веществ, изменении кислотности, стронций выпадает в осадок. Далее происходит очистка сорбционными фильтрами для устранения остаточных соединений процесса, а также утилизации осадка. Преимущество способа в его эффективной очистке. Реагенты могут работать с большим количеством воды. И сам процесс происходит относительно быстро. Что касается недостатков, то здесь в первую очередь выявляют экономическую составляющую – постоянный расход реагентов. Причём показатели и степень загрязнённости воды могут увеличить эти расходы.
Рис 1 Химический способ
Системы обратного осмоса. Фильтрация воды происходит после предварительной обработки для устранения механических загрязнений и/или хлористых соединений. Далее поток под давлением подается на полупроницаемую мембрану, которая пропускает молекулы водорода и кислорода. Все загрязнения остаются на внешней части элемента. Преимущество метода в очистке воды до 99%. Устраняется не только стронций, но и другие примеси. Не требуется изменять существующие характеристики воды. Но мембране требуется периодическая промывка по мере загрязнения. К тому же фильтр требуется менять. Сроки варьируются от 1 года до нескольких лет. Сроки определяет производительность, материал мембраны, степень загрязненности. Обязательна предварительная подготовка воды.
Далее поток под давлением подается на полупроницаемую мембрану, которая пропускает молекулы водорода и кислорода. Все загрязнения остаются на внешней части элемента. Преимущество метода в очистке воды до 99%. Устраняется не только стронций, но и другие примеси. Не требуется изменять существующие характеристики воды. Но мембране требуется периодическая промывка по мере загрязнения. К тому же фильтр требуется менять. Сроки варьируются от 1 года до нескольких лет. Сроки определяет производительность, материал мембраны, степень загрязненности. Обязательна предварительная подготовка воды.
Рис. 2 Система обратного осмоса
Ионозамещение. Фильтрующим элементом выступает ионная смола. В ней находятся ионы. И при контакте с водой начинается обмен. Гранулы смолы притягивают стронций и заменяют его на безопасные вещества. Для каждого типа примесей используется своя смола. Эффективна очистка на сильнокислых катионитах в натриевой форме. Также подходит H катиониты. Коэффициент однородности составляет более 1,2. Предварительная обработка воды требуется только при очень высоких концентрациях стронция, повышенной мутности. Для этого происходит обработка на сорбционных фильтрах. Преимущества способа в его простоте и безопасности. Ионная смола позволяет устранить стронций со степенью очистки до 95%. При этом качество воды не подвергается ухудшению не требуется дополнительная очистка. Но при заполнении смолы её необходимо регенерировать. Для этого производится промывание концентрированным раствором. Недостатки метода в обязательной обработке смолы. Тем более воду, которая использовать для регенерации также требуется фильтровать перед утилизацией.
Предварительная обработка воды требуется только при очень высоких концентрациях стронция, повышенной мутности. Для этого происходит обработка на сорбционных фильтрах. Преимущества способа в его простоте и безопасности. Ионная смола позволяет устранить стронций со степенью очистки до 95%. При этом качество воды не подвергается ухудшению не требуется дополнительная очистка. Но при заполнении смолы её необходимо регенерировать. Для этого производится промывание концентрированным раствором. Недостатки метода в обязательной обработке смолы. Тем более воду, которая использовать для регенерации также требуется фильтровать перед утилизацией.
Рис.3 Система ионного обмена
Адсорбция. Одним из наиболее распространенных вариантов удаления радионуклидов из воды является использование сорбентов. В зависимости от требуемой производительности и объема фильтруемой воды подбирается сорбент. Основное внимание уделяется его впитывающим способностям и емкости. Приоритетными по праву считаются глины, цеолиты, активированный уголь. Процесс протекает следующим образом: поток воды проходит через колонну с загрузочным сорбентным материалом. Поверхность гранул имеет пористую структуру и при взаимодействии с молекулами стронция впитывает их. Адсорбция может производиться несколькими типами сорбента с разной пористостью веществ. В этом случае сначала устраняются наиболее крупные элементы, а в нижних слоях загрузки – мелкие. Промывается фильтр путем подачи воды в обратном направлении для взрыхления. Преимущества способа в его высокой производительности и высокой степенью очистки. Недостатки в том, что при высокой концентрации стронция потребуется частая промывка сорбента и последующая замена материала.
Процесс протекает следующим образом: поток воды проходит через колонну с загрузочным сорбентным материалом. Поверхность гранул имеет пористую структуру и при взаимодействии с молекулами стронция впитывает их. Адсорбция может производиться несколькими типами сорбента с разной пористостью веществ. В этом случае сначала устраняются наиболее крупные элементы, а в нижних слоях загрузки – мелкие. Промывается фильтр путем подачи воды в обратном направлении для взрыхления. Преимущества способа в его высокой производительности и высокой степенью очистки. Недостатки в том, что при высокой концентрации стронция потребуется частая промывка сорбента и последующая замена материала.
3. Выводы
Стронций является токсичным веществом. При высокой концентрации элемента приоритетной будет следующая схема очистки:
— механическая обработка воды для устранения крупных загрязнений;
— обработка на сорбционных фильтрах с многокомпонентной загрузкой;
Либо
— механическая очистка;
— сорбционные фильтры, для устранения основной части стронция и других примесей;
— системы обратного осмоса, доочистка воды;
Либо
— механическая фильтрация;
— сорбционные фильтры;
— ионный обмен;
Также эффективно будет использование химических реагентов. Но тут вопрос в эффективности обработки и контроле неизменности состава воды. Так как химические элементы могут взаимодействовать и образовывать новые соединения. После такой очистки рекомендовано прогонять воду через сорбционные фильтры. Реагенты подаются в воду дозировано. Расчет производится в зависимости от концентрации стронция и объема воды. Если добавить реагента недостаточно, то реакция будет незаконченной. Если больше – возможно образование токсичных элементов и ухудшение исходного состава воды.
Но тут вопрос в эффективности обработки и контроле неизменности состава воды. Так как химические элементы могут взаимодействовать и образовывать новые соединения. После такой очистки рекомендовано прогонять воду через сорбционные фильтры. Реагенты подаются в воду дозировано. Расчет производится в зависимости от концентрации стронция и объема воды. Если добавить реагента недостаточно, то реакция будет незаконченной. Если больше – возможно образование токсичных элементов и ухудшение исходного состава воды.
Если вода будет использоваться повторно, например, в технических целях, то потребуется более расширенная очистка. Если фильтрация проводится перед утилизацией, то достаточно будет устранить стронций и другие примеси при наличии.
Гипохлорит стронция | S1508882 | smolecule
Гипохлорит стронция | S1508882 | дым- Этот продукт не предназначен для использования людьми или ветеринарами. Только для исследовательских целей.
№ по каталогу:
S1508882Номер CAS:
14674-76-1Молекулярная формула:
Sr(ClO)2
Cl2O2SМолекулярный вес:
190,5 г/моль- Пожалуйста, Запросите
- Описание
Купить гипохлорит стронция (CAS № 14674-76-1) в Smolecule. Молекулярная формула: Sr(ClO)2
Молекулярная формула: Sr(ClO)2
Cl2O2S. Молекулярная масса: 190,5 г/моль.
| Количество CAS | 14674-76-1 |
| наименование товара | Гипохлорит стронция |
| Название ИЮПАК | стронций; дигипохлорит |
| Молекулярная формула | Sr(ClO)2 Cl2O2S |
| Молекулярная масса | 190,5 г/моль |
| ИнЧИ | InChI=1S/2ClO.Sr/c2*1-2;/q2*-1;+2 |
| Ключ ИнЧИ | DFKCZMNZBDPBGG-UHFFFAOYSA-N |
| УЛЫБКИ | [O-]Cl.[O-]Cl.[Sr+2] |
| Канонические Улыбки | [O-]Cl.[O-]Cl.[Sr+2] |
- Технические характеристики
| Молекулярная масса | 190,5 г/моль |
- Другие
| Даты | Изменить: 2022-04-08 |
- Онлайн-запрос
* Этот продукт предназначен только для исследовательских или производственных целей. Использование человеком строго запрещено.
* Обратите внимание, что мы будем отправлять предложения только на действительные профессиональные адреса электронной почты.
Использование человеком строго запрещено.
* Обратите внимание, что мы будем отправлять предложения только на действительные профессиональные адреса электронной почты.
* Для заказов с помощью кредитной карты мы вышлем вам цифровой счет, чтобы вы могли разместить заказ онлайн.
Часто просматриваемые
Номенклатура
НоменклатураНоменклатура
| Общие названия | Ионные соединения | Положительные ионы | Отрицательные ионы |
| Многоатомные отрицательные ионы | Наименование многоатомных ионов | Ковалентная Соединения | Кислоты |
| Металлы с неметаллами | Неметаллы с неметаллами | ||
Задолго до того, как химики узнали формулы химических соединений, они разработали систему
номенклатуры , которая дала каждому соединению уникальное название. Сегодня мы часто используем химические
формулы, такие как NaCl, C 12 H 22 O 11 и Co(NH 3 ) 6 (ClO 4 ) 3 ,
описывать химические соединения. Но нам по-прежнему нужны уникальные имена, однозначно идентифицирующие
каждое соединение.
Сегодня мы часто используем химические
формулы, такие как NaCl, C 12 H 22 O 11 и Co(NH 3 ) 6 (ClO 4 ) 3 ,
описывать химические соединения. Но нам по-прежнему нужны уникальные имена, однозначно идентифицирующие
каждое соединение.
Общие имена
Некоторые соединения известны так давно, что систематическая номенклатура не может конкурировать с хорошо зарекомендовавшими себя общеупотребительными именами. Примеры соединений, для которых распространены названия включают воду (H 2 O), аммиак (NH 3 ) и метан (CH 4 ).
Наименование ионных соединений
(металлы с неметаллами)
Названия ионных соединений записывают, перечисляя название положительного иона
с последующим названием отрицательного иона.
| NaCl | хлорид натрия | ||
| (NH 4 ) 2 SO 4 | сульфат аммония | ||
| NaHCO 3 | бикарбонат натрия |
Поэтому нам нужен ряд правил, позволяющих однозначно называть положительные и отрицательные ионы, прежде чем мы сможем назвать соли, которые образуют эти ионы.
Наименование положительных ионов
Одноатомные положительные ионы имеют название элемента, из которого они образованы.
| Нет данных + | натрий | Цинк 2+ | цинк | |
| Ка 2+ | кальций | Н + | водород | |
| К + | калий | Ср 2+ | стронций |
Некоторые металлы образуют положительные ионы в более чем одной степени окисления. Один из самых ранних
методы различения этих ионов использовали суффиксы -ous и -ic добавлено к латинскому названию элемента для обозначения низшей и высшей степеней окисления,
соответственно.
Один из самых ранних
методы различения этих ионов использовали суффиксы -ous и -ic добавлено к латинскому названию элемента для обозначения низшей и высшей степеней окисления,
соответственно.
| Fe 2+ | черные | Fe 3+ | железо | |
| Сн 2+ | оловянный | Сн 4+ | олово | |
| Медь + | медь | Cu 2+ | медь |
Теперь химики используют более простой метод, в котором заряд иона обозначается символом Римская цифра в скобках сразу после названия элемента.
| Fe 2+ | железо(II) | Fe 3+ | железо (III) | |
| Сн 2+ | олово(II) | Сн 4+ | олово(IV) | |
| Медь + | медь(I) | Медь 2+ | медь(II) |
Многоатомные положительные ионы часто имеют общие названия, оканчивающиеся суффиксом -оний .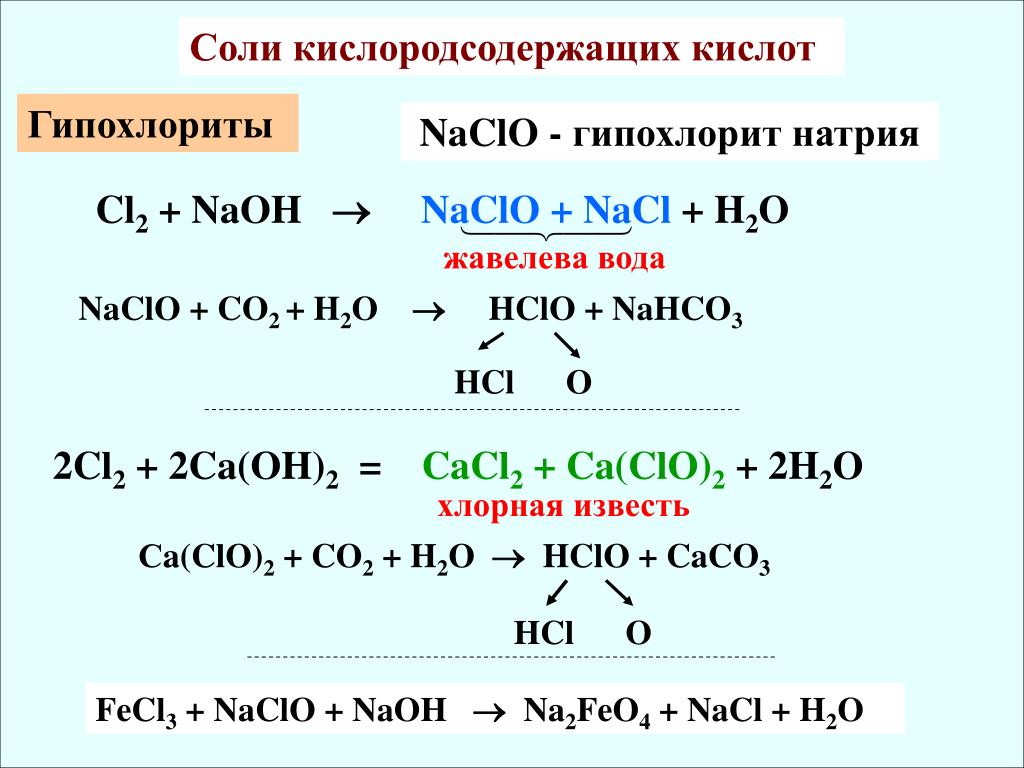
| Н 3 О + | гидроксоний |
| НХ 4 + | аммоний |
Наименование отрицательных ионов
Отрицательные ионы, состоящие из одного атома, называются с добавлением суффикса -ide к основе названия элемента.
| Ф — | фторид | О 2- | оксид |
| Класс — | хлорид | С 2- | сульфид |
| Бр — | бромид | Н 3- | нитрид |
| I — | йодид | Р 3- | фосфид |
| Н — | гидрид | С 4- | карбид |
| Практическая задача 4 Предскажите формулу соединения
который образуется, когда металлический магний реагирует с азотом с образованием нитрида магния. Нажмите здесь, чтобы проверьте свой ответ на практическое задание 4 |
Общие многоатомные отрицательные ионы
| -1 ионы | ||||
| ОХС 3 — | бикарбонат | ХСО 4 — | гидросульфат (бисульфат) | |
| CH 3 CO 2 — | ацетат | ClO 4 — | перхлорат | |
| № 3 — | нитрат | ClO 3 — | хлорат | |
| № 2 — | нитрит | ClO 2 — | хлорит | |
| MnO 4 — | перманганат | ClO — | гипохлорит | |
| CN — | цианид | ОХ — | гидроксид | |
| -2 иона | ||||
| СО 3 2- | карбонат | О 2 2- | пероксид | |
| СО 4 2- | сульфат | CrO 4 2- | хромат | |
| СО 3 2- | сульфит | Cr 2 O 7 2- | дихромат | |
| С 2 О 3 2- | тиосульфат | ГПО 4 2- | гидрофосфат | |
| -3 иона | ||||
| Заказ на поставку 4 3- | фосфат | АсО 4 3- | арсенат | |
| БО 3 3- | борат |
Наименование многоатомных ионов
На первый взгляд, номенклатура многоатомных отрицательных ионов в таблице выше
кажется безнадежным. Однако есть несколько общих правил, которые могут внести некоторый порядок в
этот кажущийся хаос.
Однако есть несколько общих правил, которые могут внести некоторый порядок в
этот кажущийся хаос.
Имя иона обычно оканчивается либо на -ite , либо на -ate . -ite окончание указывает на низкую степень окисления. Таким образом, ион NO 2 — является нитрит-ион.
Окончание -ate указывает на высокую степень окисления. № 3 — ион, например, нитрат-ион.
Префикс гипо — используется для обозначения самой низкой степени окисления. ClO- ион, например, представляет собой ион гипохлорита.
Префикс к — (как в гипер-) используется для обозначения самого высокого уровня окисления. состояние. Таким образом, ион ClO 4 — является ионом перхлората.
Есть лишь несколько исключений из этих обобщений.
Названия гидроксида (OH —), цианида (CN —) и пероксида (O 2 2-)
ионы, например, имеют окончание -ide , потому что когда-то считалось, что они
одноатомные ионы.
| Практическая задача 5 Кости и зубная эмаль в вашем теле содержат ионные соединения, такие как фосфат кальция и гидроксиапатит. Предсказать формулу фосфата кальция, который содержит ионы Ca 2+ и PO 4 3-. Рассчитайте значение x , если формула гидроксиапатита Ca x (PO 4 ) 3 (ОН). Нажмите здесь, чтобы проверьте свой ответ на практическое задание 5 |
Наименование простых ковалентных соединений
(Неметаллы с неметаллами)
Степени окисления также играют важную роль в названии простых ковалентных соединений.
название атома в положительной степени окисления указано первым. Суффикс -иде затем добавляется к основе названия атома в отрицательной степени окисления.
Суффикс -иде затем добавляется к основе названия атома в отрицательной степени окисления.
| HCl | хлористый водород |
| № | оксид азота |
| БрКл | хлорид брома |
Как правило, химики пишут формулы, в которых элемент в положительной степени окисления Сначала пишется, а затем элемент (элементы) с отрицательной степенью окисления.
Число атомов элемента в простых ковалентных соединениях указывается добавлением один из следующих греческих префиксов к имени элемента.
| 1 моно- | 6 гекс- | ||
| 2 ди- | 7 гепта- | ||
| 3 три- | 8 окта- | ||
| 4 тетра- | 9 нон- | ||
| 5 пента- | 10 дека- |
Префикс моно — используется редко, так как является избыточным. Главное исключение
к этому правилу относится окись углерода (СО).
Главное исключение
к этому правилу относится окись углерода (СО).
Наименование кислот
Простые ковалентные соединения, содержащие водород, такие как HCl, HBr и HCN, часто растворяются в воде с образованием кислот. Эти решения названы путем добавления префикса hydro — к названию соединения, а затем заменив суффикс -ide на -ic . Для например, хлороводород (HCl) растворяется в воде с образованием соляной кислоты; водород бромид (HBr) образует бромистоводородную кислоту; цианистый водород (HCN) образует синильную кислоту.
Многие многоатомные отрицательные ионы, богатые кислородом, из таблицы 2.1 образуют кислоты, названные заменив суффикс — ate на -ic и суффикс -ite на -ous .
| Кислоты, содержащие ионы, оканчивающиеся на иде часто стать | водородная кислота | |||
| Класс — | хлорид | HCl | соляная кислота | |
| Ф — | фторид | ВЧ | фтористоводородная кислота | |
| С 2- | сульфид | Н 2 С | сероводородная кислота | |
| | ||||
| Кислоты, содержащие ионы, оканчивающиеся на обычно стать | -иловая кислота | |||
| CH 3 CO2 — | ацетат | CH 3 CO 2 H | уксусная кислота | |
| СО 3 2- | карбонат | H 2 CO 3 | угольная кислота | |
| БО 3 3- | борат | Н 3 БО 3 | борная кислота | |
| № 3 — | нитрат | HNO 3 | азотная кислота | |
| СО 4 2- | сульфат | H 2 SO 4 | серная кислота | |
| ClO 4 — | перхлорат | HClO 4 | хлорная кислота | |
| Заказ на поставку 4 3- | фосфат | H 3 Заказ на покупку 4 | фосфорная кислота | |
| MnO 4 — | перманганат | HMnO 4 | пермарганцевая кислота | |
| CrO 4 2- | хромат | H 2 CrO 4 | хромовая кислота | |
| ClO 3 — | хлорат | HClO 3 | хлористоводородная кислота | |
| Кислоты, содержащие ионы, оканчивающиеся на ite обычно стать | кислота | |||
| ClO 2 — | хлорит | HClO 2 | хлорноватистая кислота | |
| № 2 — | нитрит | HNO 2 | азотистая кислота | |
| СО 3 2- | сульфит | H 2 SO 3 | сернистая кислота | |
| ClO — | гипохлорит | HClO | хлорноватистая кислота | |
Сложные кислоты можно назвать, указав на присутствие кислого водорода следующим образом.

