Гипохлорид натрия
Описание: Натрия гипохлорит, как правило, имеет вид водного раствора с большим процентным содержанием химически активного хлора. Водный раствор данного вещества обладает резким запахом и цветом, близким к зелено-желтому. В свободном состоянии (без примесей) отличается крайне малой устойчивостью, из-за чего, в подобном состоянии встречается крайне редко.
Фасовка: Из-за химических особенностей чрезвычайно сильного окислителя, гипохлорит натрия фасуется в специализированные стеклопластиковые и полиэтиленовые канистры строго определенной емкости, а так же в стальные бочки с защитным антикоррозийным внутренним покрытием.
Физико-химические свойства: В зависимости от концентрации, водный раствор гипохлорита натрия обладает различной температурой замерзания, которая может колебаться от -1 до -30 градусов по Цельсию. Температурный нагрев раствора вызывает его разрушение. Из-за достаточно сильных окислительных качеств, производство, ровно как и эксплуатация данного химического вещества осуществляется только лишь в лабораторных или промышленных условиях.
Хранение и транспортировка: Воздействие высоких температур и прямых солнечных лучей губительны для данного химического вещества. Именно по этой причине, хранение и транспортировка хлорноватистокислого натрия предписывает светонепроницаемые, герметичные емкости, бочки или канистры, изготавливаемые из полиэтилена или металла с дополнительным антикоррозийным защитным покрытием.
Применение: Область применения данного вещества чрезвычайно обширно. Благодаря исключительно сильным антисептическим действиям, гипохлорит натрия активно используется для очистки воды и любых предметов, нуждающихся в быстрой и качественной дезинфекции. Помимо этого, данное вещество отлично себя зарекомендовало в качества активных добавок в разнообразные бытовые и промышленные чистящие средства и отбеливатели. Именно по этой причине, гипохлорит натрия купить может практически каждая организация, нуждающаяся в качественном дезинфекторе.
Меры предосторожности и воздействие: Из-за высокой химической активности, работа с данным веществом требует наличия особых мер индивидуальной защиты, отсутствие которых может повлечь за собой повреждение кожного покрова и слизистой оболочки человека.
| химическая формула | NaClO |
| ГОСТ или ТУ | ТУ 2147-255-05763458-98 |
| молекулярная масса | 74,44 |
| внешний вид | Жидкость зеленовато-желтого цвета |
| спецификация | Концентрация активного хлора, г/куб. дм, минимум — 120. Массовая доля щелочи в пересчете на NaOH, г/куб. дм, — 20-50. |
| применение | Отбеливающее, окисляющее и обеззараживающее средство. |
| упаковка | Тара потребителя |
| транспортировка и хранение | Железнодорожным и автомобильным транспортом. |
| особые свойства | Хранить в специальных гуммированных или покрытых коррозионностойкими материалами емкостях, защищенных от солнечного света. Гарантийный срок хранения 3 месяца. Гарантийный срок хранения 3 месяца. |
| меры безопасности | Негорюч и невзрывоопасен. Сильный окислитель, вызывает раздражение кожных покровов и слизистой оболочки. Применять индивидуальные средства защиты. |
Водоподготовка
Биохимические препараты для очистки воды
контакты
«Все, что нужно знать об отбеливании»
- Подробности
Любые белые ткани с течением времени и при многократной стирке желтеют из-за действия света и солей жесткости. Вернуть таким тканям первоначальную белизну помогают химические отбеливатели.
Вопрос о применении отбеливающих препаратов в процессах профессиональной стирки многократно рассматривался в различной литературе, нормативных документах и статьях. Однако, чем чаще встречаешься с технологами и владельцами прачечных в различных регионах страны, тем больше понимаешь, что до сих пор остаются вопросы по применению не только современных средств для отбеливания, но и классических, давно известных веществ.
Однако, чем чаще встречаешься с технологами и владельцами прачечных в различных регионах страны, тем больше понимаешь, что до сих пор остаются вопросы по применению не только современных средств для отбеливания, но и классических, давно известных веществ.
Полагаю, целесообразно еще раз вернуться к рассмотрению свойств веществ, используемых в процессах отбеливания белья.
Что было
Можно предположить, что период раннего средневековья не является объектом нашего внимания. Тогда на Руси вместо мыла использовали измельченные ягоды бузины, корни мыльнянки, смешанные с зольным щелоком, а основным отбеливателем было солнце — то есть солнечный свет в ультрафиолетовом диапазоне. По современным меркам это были действительно экологически чистые технологии.
После открытия шведским химиком Карлом Вильгельмом Шееле хлора в 1774 году началось время химических отбеливателей. Они бывают трех типов: пероксидные (перекисные или кислородосодержащие), хлорные и серосодержащие. Применение химических отбеливателей основано на процессе окисления кислородом различных веществ, придающих желтизну ткани.
Более чем двухсотлетнюю историю применения в отбеливании тканей имеет хорошо известный гипохлорит натрия (англ. sodium hypochlorite) — натрий хлорноватистокислый. Историческое название гипохлорита натрия лабарракова вода или жавелевая вода. Гипохлорит натрия относится к химическим хлорным отбеливателям. Химическая формула — NaOCl. Обычно в прачечных применяются его водные растворы различной концентрации.
Хлорные отбеливатели типа гипохлорита натрия, хлорамина, хлорной извести, ди-хлоризоциануратов калия и натрия действуют на холоде. Пользоваться этими дешевыми отбеливателями удобно и просто, они универсальны и могут применяться не только при стирке белья, но для дезинфекции. Однако у них имеются и существенные недостатки: они раздражают кожу рук и сильно снижают прочность ткани. Если капля хлорного отбеливателя попадает на цветное белье, получаются ничем неудаляемые пятна самого неожиданного цвета (например, оранжевые на темно-синем фоне), а неотстиранные жировые загрязнения в хлорном отбеливателе могут приобрести ярко-желтый цвет.
Серосодержащие отбеливатели (например, на основе гидросульфита натрия) при нагревании с водой выделяют сернистый газ. Гидросульфит натрия применяется в текстильной промышленности главным образом как восстановительное средство для кубовых красителей, для восстановительной очистки при крашении полиэфира и для снятия прямых активных красителей при крашении хлопка. Он обесцвечивает не только окрашенные пятна вина, ягод и фруктов, но и цветные изделия. Серосодержащие красители универсальны, могут применяться для обработки любых тканей. Однако против сернистого газа в водной среде не могут устоять даже самые прочные текстильные красители. По этой причине серосодержащие препараты применяются при отбеливании тканей крайне редко.
К пероксидным отбеливателям относятся: пероксид водорода (30%-ный водный раствор которого до сих пор иногда называют пергидроль), пероксоборат или пероксокарбонат натрия (персоль), пероксосульфат калия, гидропероксид карбамида (гидроперит), — то есть это соединения, в молекулах или ионах которых присутствует пероксидный фрагмент из двух атомов кислорода, соединенных между собой: -О-О-. При нагревании в водной среде и разложении эти вещества выделяют атомарный кислород, который окисляет и обесцвечивает загрязнения. Пероксидные отбеливатели проявляют свои свойства эффективнее всего при 80-90°С, даже при кипячении они обычно не портят красок рисунка хлопчатобумажной или льняной ткани.
При нагревании в водной среде и разложении эти вещества выделяют атомарный кислород, который окисляет и обесцвечивает загрязнения. Пероксидные отбеливатели проявляют свои свойства эффективнее всего при 80-90°С, даже при кипячении они обычно не портят красок рисунка хлопчатобумажной или льняной ткани.
Что есть
Как это не покажется странным, но за прошедшие годы практически ничего не изменилось. В качестве средств для отбеливания применяются все те же химические отбеливатели. До сих пор действуют Правила технологического процесса обработки белья в прачечных, утвержденные Министерством жилищно-коммунального хозяйства РСФСР от 14 декабря 1972 года (текст документа по состоянию на июль 2011 года).
«Отбелка белья.
- Отбеливают только белое белье. Хлопчатобумажное и льняное белье отбеливают каждую стирку, шелковое и синтетическое — при появлении желтого оттенка.
- В качестве отбеливателей используют химические и оптические отбеливающие средства».

В этом же документе приводятся нормы расхода отбеливающих средств.
Нормы расхода отбеливающих средств в кг на 1 т сухого белья
| Отбеливающее средство | Количество отбеливающих средств на 1 т сухого белья | |
|---|---|---|
| кг | л | |
| Пергидроль (30-процентный) | 4 | — |
| Перборат | 2 | — |
| Перкарбонат | 2 | — |
| Персульфат | 4 | — |
| Гипохлорит натрия с концентрацией | — | 3,8 |
| 185 г/куб. дм активного хлора | ||
| Гидросульфит натрия | 160 | — |
Позволю себе еще раз остановиться на, казалось бы, хорошо известном и сказать несколько слов о самых широко используемых отбеливающих средствах.
Гипохлорит натрия
В нашей стране состав и свойства гипохлорита натрия нормируются ГОСТом или ТУ и производятся, в зависимости от марки, с массовой концентрацией активного хлора от 120 до 190 г/дм³ и массовой концентрацией щелочи в пересчете на NaOH от 10 до 90 г/дм³. Растворы гипохлорита натрия недостаточно стабильны. Для растворов гипохлорита натрия по ГОСТ 11086-76 допускается потеря активного хлора по истечении 10 суток со дня отгрузки не более 30% первоначального содержания и изменение окраски до красновато-коричневого цвета. А для растворов по ТУ допускается потеря активного хлора по истечении 10 суток со дня отгрузки для марок А и Б не более 30% первоначального содержания, для марок В и Г — не более 20%, для Марки Э — не более 15%.
Гипохлорит натрия различных марок применяют:
- Раствор марки А по ГОСТ 11086-76 — в химической промышленности, для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки;
- Раствор марки Б по ГОСТ 11086-76 — в витаминной промышленности, а также как окислитель для отбеливания ткани;
- Раствор марки А по ТУ — для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды рыбохозяйственных водоемов, дезинфекции в пищевой промышленности, получения отбеливающих средств;
- Раствор марки Б по ТУ — для дезинфекции территорий, загрязненных фекальными сбросами, пищевыми и бытовыми отходами; обеззараживания сточных вод;
- Раствор марки В, Г по ТУ — для дезинфекции воды рыбохозяйственных водоемов;
- Раствор марки Э по ТУ — для дезинфекции аналогично марке А по ТУ, а также для дезинфекции в медико-санитарных учреждениях, предприятиях общественного питания, объектах ГО и др.
 Помимо этого для обеззараживания питьевой воды, стоков и отбеливания.
Помимо этого для обеззараживания питьевой воды, стоков и отбеливания.
Без гипохлорита натрия не обойтись при отбелке больничного белья или белья, пораженного плесенью. Он прекрасно работает при низких температурах (~ 40°С), поэтому, чаще всего его рекомендуют применять при замачивании белья IV категории загрязнения в виде рабочих растворов с концентрацией 5 г/л , а также в 1-ю ванну при двухванновом способе стирки. Периодически приходится сталкиваться с тем, что гипохлорит добавляют без предварительного разбавления. В этом случае производители нормируют его расход 5-20 мл на килограмм сухого белья.
Перборат натрия, перкарбонат натрия и пероксид водорода
Наиболее распространены кислородсодержащие отбеливатели, которые, так же как и хлорсодержащие, обладают дезинфицирующими свойствами. Выделяемый ими кислород окисляет нестойкие органические соединения, скопившиеся в местах загрязнений. После этого они либо переходят в раствор, либо образуют новые соединения, которые легко удаляются при последующей стирке.
Самым распространенными отбеливателями в синтетических стиральных порошках являются перборат натрия (NaBO3•4H2O) и перкарбонат натрия (Na2CO3•1,5H2O2). Соединяясь с водой, перборат натрия высвобождает перекись водорода. При повышенных температурах (от 600 градусов) перекись водорода распадается на воду и кислород.
В отличие от пербората натрия, перкарбонат натрия не содержит бор, то есть он более экологичен.
В качестве индивидуального отбеливающего вещества, усиливающего эффект стирки, в прачечных применяют или перкарбонат натрия, или пероксид водорода. Последний представляет собой прозрачную негорючую жидкость, способную самопроизвольно разлагаться на воду и кислород. Пероксид водорода коррозионно опасен для большинства металлов.
В промышленных масштабах в нашей стране выпускается пероксид водорода с массовой долей действующего вещества от 30 до 40% (по ГОСТ 177-88 или ТУ). В течение гарантийного срока хранения допускается снижение массовой доли перекиси водорода до 1,5-2,5%.
Обычно пероксид водорода применяют в виде рабочего раствора с концентрацией 6% по активному кислороду. При дозировании в стиральную машину пероксид водорода рекомендуется добавлять во вторую ванну к основному моющему средству при температуре от 60°С при двухванновом способе стирки в концентрации 5-10 млна килограмм белья.
Что же изменилось за время, прошедшее с начала промышленного производства химических отбеливателей? До сих пор в профессиональных прачечных применяются те же вещества, что и более чем сто лет назад. Однако нельзя сказать, что ничего нового не придумано. Так для снижения температуры отбеливания в состав стиральных порошков вводят активатор отбеливателя, самым распространенным из которых является тетраацетилэтилендиамин — ТАЭД. Это позволяет снизить температуру отбеливания до 30-40°С.
Кроме того более 70 лет назад были открыты оптические отбеливатели. В 1929 году Пол Крайс впервые провел эксперимент по отбеливанию волокон натуральным отбеливающим агентом (гликозидом 6,7-дигидроксикумарина), относящимся к группе флуоресцентных отбеливающих веществ. Оптические отбеливатели — это бесцветные или слабоокрашенные органические соединения, обладающие способностью поглощать ультрафиолетовую составляющую солнечного света (300-400 нм) и преобразовывать полученную энергию в видимый свет, преимущественно в голубой или фиолетовой части спектра (400-500 нм). Отбеливающее действие оптических отбеливателей основано на том, что излучаемый ими свет компенсирует недостаток синих лучей в свете, отражаемом материалом (в этом их коренное отличие от химических отбеливателей). В отличие от подсинивания ультрамарином (синькой), при котором уменьшение желтизны происходит из-за частичного поглощения света в желто-красной области спектра, при отбеливании оптическими отбеливателями благодаря флуоресценции резко увеличивается интенсивность отражаемого света в фиолетово-синей части спектра, что особенно проявляется при дневном свете и ультрафиолетовом освещении.
Оптические отбеливатели — это бесцветные или слабоокрашенные органические соединения, обладающие способностью поглощать ультрафиолетовую составляющую солнечного света (300-400 нм) и преобразовывать полученную энергию в видимый свет, преимущественно в голубой или фиолетовой части спектра (400-500 нм). Отбеливающее действие оптических отбеливателей основано на том, что излучаемый ими свет компенсирует недостаток синих лучей в свете, отражаемом материалом (в этом их коренное отличие от химических отбеливателей). В отличие от подсинивания ультрамарином (синькой), при котором уменьшение желтизны происходит из-за частичного поглощения света в желто-красной области спектра, при отбеливании оптическими отбеливателями благодаря флуоресценции резко увеличивается интенсивность отражаемого света в фиолетово-синей части спектра, что особенно проявляется при дневном свете и ультрафиолетовом освещении.
Происходят изменения и в оборудовании. Меняется экологическое законодательство, актуальными становится технологии стирки и отбеливания, позволяющие осуществлять экономию воды, электроэнергии и других ресурсов.
Что будет
Сегодня на фоне изменения ассортимента изделий и состава тканей отчетливо просматривается тенденция применения экологичных моющих и отбеливающих препаратов и снижения температуры стирки.
На диаграмме реализации средств для отбеливания компанией «УНИВЕРСАЛ» можно увидеть изменения в потреблении отбеливающих препаратов за последние несколько лет. Так, отчетливо виден рост потребления пероксида водорода и перкарбоната при уменьшении потребления гипохлорита натрия (г/х Na).
В будущем представляется наиболее перспективным все более широкое применение препаратов для отбеливания, основанных на действии надкислот. Из них наиболее известны — это препараты на основе перуксусной (надуксусной) кислоты.
Надуксусная кислота (пероксиуксусная кислота, перуксусная кислота, НУК) — химическое соединение, органическая надкислота с формулой СН3СО3Н. Она представляет собой бесцветную жидкость с резким запахом, относится к группе сильных окислителей. Перуксусная кислота в товарном виде существует в виде равновесной четырехкомпонентной смеси, состоящей из уксусной и перуксусной кислот, пероксида водорода и воды. Перуксусная кислота содержит пероксидную функциональную группу, поэтому по химическим свойствам схожа с перекисью водорода. Механизм отбеливания при применении перуксусной кислоты аналогичен механизму отбеливания перекисью водорода в щелочной среде. Известно, что при этом почти не происходит деструкции целлюлозы хлопкового волокна, достигается высокая капиллярность и более устойчивая белизна, обеспечивается устойчивость отбеливающих растворов и появляется возможность отбеливания тканей при низких температурах.
Перуксусная кислота в товарном виде существует в виде равновесной четырехкомпонентной смеси, состоящей из уксусной и перуксусной кислот, пероксида водорода и воды. Перуксусная кислота содержит пероксидную функциональную группу, поэтому по химическим свойствам схожа с перекисью водорода. Механизм отбеливания при применении перуксусной кислоты аналогичен механизму отбеливания перекисью водорода в щелочной среде. Известно, что при этом почти не происходит деструкции целлюлозы хлопкового волокна, достигается высокая капиллярность и более устойчивая белизна, обеспечивается устойчивость отбеливающих растворов и появляется возможность отбеливания тканей при низких температурах.
На российском рынке уже присутствуют средства на основе надуксусной (перуксусной) кислоты, применяемые для отбеливания (в том числе низкотемпературного) в процессе стирки. Они подходят как для белых, так и для окрашенных тканей, для отбеливания шерстяных тканей и цветного льна. Обычно подобные препараты представляет собой высококонцентрированные средства, обладающие хорошими отбеливающими, пятновыводящими и дезинфицирующими свойствами.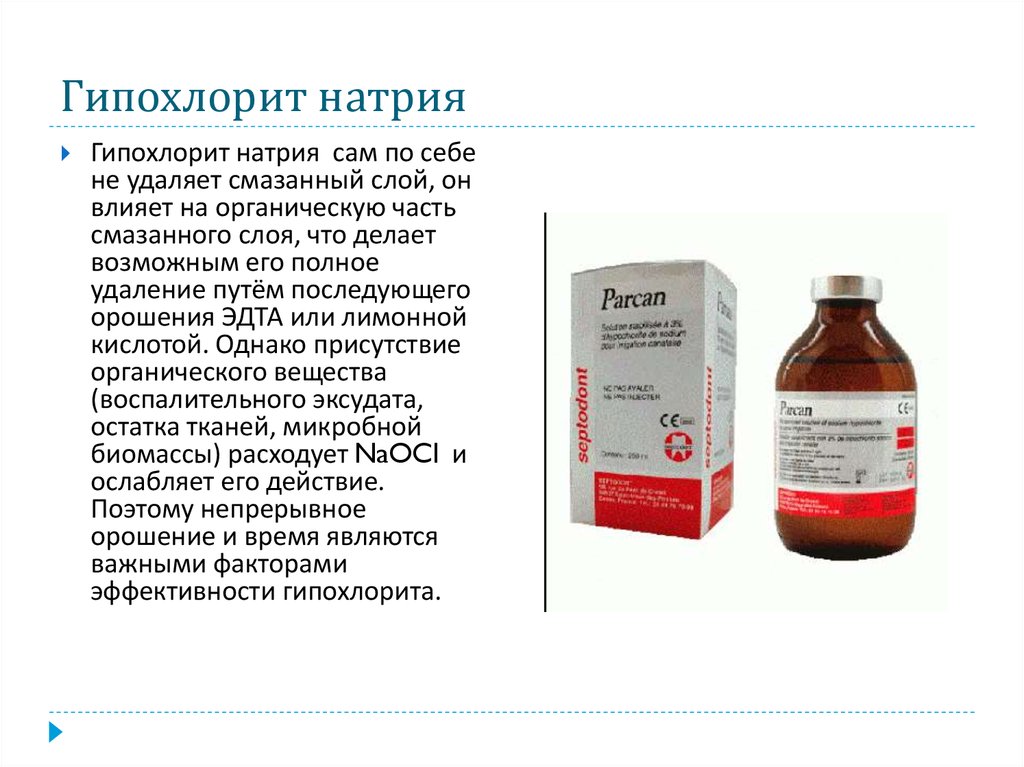 Препараты на основе перуксусной кислоты после применения разлагаются на воду, кислород и уксусную кислоту, которая в дальнейшем распадается на углекислый газ и воду, обеспечивая экологическую безопасность. Дозируются они в зависимости от степени загрязнения: от 2 мл до 5 мл на 1 кг сухого белья.
Препараты на основе перуксусной кислоты после применения разлагаются на воду, кислород и уксусную кислоту, которая в дальнейшем распадается на углекислый газ и воду, обеспечивая экологическую безопасность. Дозируются они в зависимости от степени загрязнения: от 2 мл до 5 мл на 1 кг сухого белья.
Однако появление подобных препаратов никак не исключает применение и других ранее описанных отбеливающих средств. Сегодня компания «УНИВЕРСАЛ» поставляет своим заказчикам весь ассортимент отбеливающих препаратов для профессиональной стирки: перкарбонат натрия, гипохлорит натрия и пероксид водорода и др. А линейка препаратов для стирки под торговой марки «УНИВЕР» включает в себя препараты для отбеливания белья на основе всех имеющихся отбеливающих веществ, включая перуксусную кислоту. Качество всей продукции обеспечивается за счет осуществления постоянного контроля как на предприятиях-изготовителях, так и в наших двух собственных лабораториях. Одна из них находится непосредственно на складе готовой продукции, что позволяет нам оперативно реагировать на любые внештатные ситуации. Таким образом компания «УНИВЕРСАЛ» поставляет заказчикам только продукты гарантированного качества.
Таким образом компания «УНИВЕРСАЛ» поставляет заказчикам только продукты гарантированного качества.
Хочется надеяться, что очередной возврат к известной теме будет полезен технологам профессиональных прачечных и читателям журнала.
Марина Галаничева,
руководитель направления технологий и разработки компании «Универсал»,
к.т.н.
Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Формула гипохлорита натрия — свойства, применение, приготовление и часто задаваемые вопросы
Гипохлорит натрия является широко используемым химическим соединением, наиболее распространенным применением соединения является его использование в качестве отбеливающего и дезинфицирующего средства. Гипохлорит натрия также известен как оксихлорид натрия. Химическое соединение можно описать как соль натрия с гипохлоритом в качестве противоиона. Формула гипохлорита натрия такая же, как и формула оксихлорида натрия.
Формула гипохлорита натрия может быть представлена как NaClO или альтернативным способом представления формулы гипохлорита натрия является NaOCl. В этой статье основное внимание уделяется химической формуле, получению и структурной формуле соединения, в статье также описываются химические свойства, а также физические свойства соединения.
В этой статье основное внимание уделяется химической формуле, получению и структурной формуле соединения, в статье также описываются химические свойства, а также физические свойства соединения.
Оксихлорид натрия Формула
Оксихлорид натрия — это альтернативное название гипохлорита натрия. Соединение определяется как натриевая соль хлорноватистой кислоты. Соединение содержит катион Na+, связанный с анионом гипохлорита, химическая формула гипохлорита (CLO-). Формула хлорита натрия записывается как NaClO. Другим способом представления химической формулы гипохлорита натрия является NaOCl. Название IUPAC оксихлорида натрия — гипохлорит натрия. Структурная формула гипохлорита натрия представлена следующим образом.
[Изображение будет загружено в ближайшее время]
Химическое соединение широко известно как отбеливающее и дезинфицирующее средство. Соединение легко разлагается на хлор, и хлор высвобождается. Эта реакция является основным принципом использования соединения в качестве отбеливающего агента.
Метод приготовления
Существуют различные методы приготовления оксихлорида натрия. Первое коммерческое производство гипохлорита натрия наблюдалось в 1798 году, соединение было впервые синтезировано Клодом Луи Бертолле из Франции. Процесс основан на пропускании газообразного хлора через раствор калийного щелока. Химическое соединение синтезируется в промышленных масштабах с использованием процесса Гукера. Это различные подготовительные методы соединения, некоторые процессы перечислены ниже
Хлорирование соды было процессом, использованным Клодом Луи Бертолле из Франции. Он пропускал газообразный хлор через калийный щелок. Происходящая химическая реакция известна как реакция диспропорционирования. В этой реакции одновременно протекают реакции окисления и восстановления.
Гипохлорит натрия получают из гипохлорита кальция, при этом карбонат натрия реагирует со смесью гипохлорита кальция Ca(OCl)2, хлорида кальция CaCl2 и гидроксида кальция Ca(OH)2.

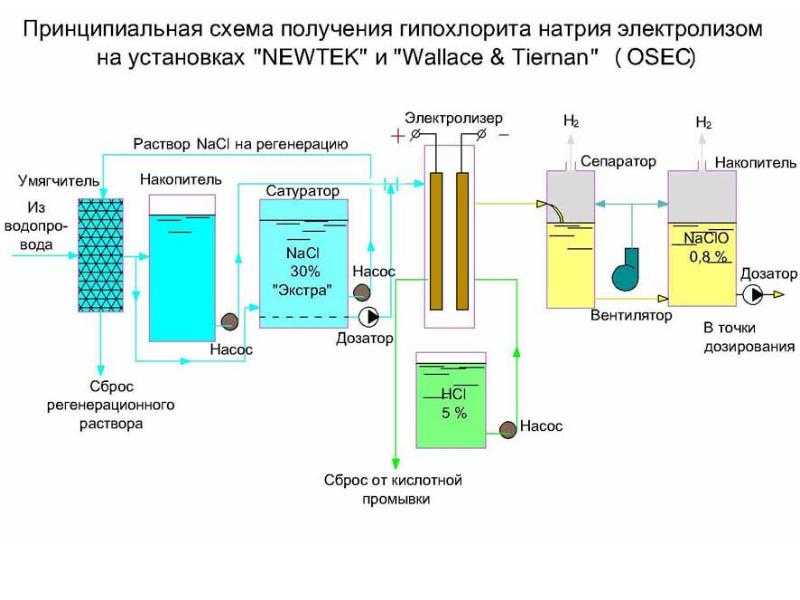
Электролиз рассола, химическая реакция включает электролиз рассола с образованием гидроксида натрия и газообразного хлора. Затем продукты смешивают с образованием гипохлорита натрия.
Производство гипохлорита натрия может производиться также из хлорноватистой кислоты и соды.
Общие названия соединения
Название соединения по ИЮПАК — гипохлорит натрия, некоторые другие распространенные названия соединения включают следующее:
Sodium oxychloride
Sodium hypochloride (sodium hypochloride formula is the same as the sodium hypochlorite)
Antiformin
Bleach
Chloride of soda
In dilution:
Раствор Каррела-Дакина
Модифицированный раствор Дакина
Хирургический раствор хлорированной соды
Химические свойства соединения
Химические свойства соединения включают формулу раствора гипохлорита натрия, молекулярную массу гипохлорита натрия, реакции, донор и акцептор водородной связи, сложность соединения. Общие химические свойства соединений указаны следующим образом:
Общие химические свойства соединений указаны следующим образом:
химическая формула гипохлорита натрия – NaClO
молекулярная масса гипохлорита натрия – 74,442 г/моль
формула раствора гипохлорита натрия также представлена как NaClO
Соединение характеризуется высокой нестабильностью.
При разложении химическое соединение выделяет хлор, что делает его основой для дезинфицирующего средства на основе хлора.
Количество доноров водородной связи равно 0, тогда как количество акцепторов водородной связи для соединения равно 1.
Сложность соединения составляет 4,8
Кислотность или значение pKa соединения составляет 7,5185
Основность или значение pKb соединения составляет 6,4815.

Физические свойства гипохлорита натрия
Физические свойства соединения включают температуру плавления, точку кипения, плотность и внешний вид соединения. Некоторые из свойств соединения упомянуты ниже.
Температура плавления гипохлорита натрия 18 °С
Температура кипения соединения 101 °C
Плотность соединения 1,11 г/см3
Внешний вид соединения можно описать как кристалл зеленовато-желтого цвета
Запах соединения можно охарактеризовать как сладковатый, похожий на хлор.
Плотность соединения 1,11 г/см 3
Растворимость соединения в воде 290,3 г/100 мл.

Использование и риск
Химическое соединение в основном используется в качестве отбеливателя. Несколько разбавленных составов используются в качестве дезинфицирующего средства, помимо этих распространенных применений, гипохлорит натрия также используется в следующих случаях:
Они используются в качестве дезодорирующего средства
Он используется при очистке сточных вод
Он используется в эндодонтии
Используется в качестве нейтрализатора нервно-паралитического агента
Существуют различные риски, связанные с соединением из-за его нестабильной природы. В высоких концентрациях соединение токсично и может серьезно повредить область контакта. Воздействие химического соединения также может привести к образованию волдырей, повреждению кожи, сыпи и раздражению.
Воздействие химического соединения также может привести к образованию волдырей, повреждению кожи, сыпи и раздражению.
Заключение
Гипохлорит натрия или оксихлорид натрия представляет собой соль хлорноватистой кислоты. Он более известен как Антиформин. Это химическое соединение имеет коммерческое значение из-за его реакции разложения с выделением хлора. Он широко используется в качестве отбеливателя. Соединение промышленно производится по методу Гукера. Помимо использования в качестве отбеливающего агента, это соединение является важным химическим веществом для очистки сточных вод.
Как химически действует отбеливатель?
Как действует отбеливатель химически? Ну, разрушая молекулярные связи пятен, что эффективно удаляет эти пятна. Принцип действия отбеливателя на самом деле представляет собой простую реакцию окисления, которая удаляет электроны из хромофоров, иначе известных как молекулы пигмента.
В этой статье объясняется химия этого повседневного вещества, от различных типов отбеливателей на химической основе до химического состава отбеливателя.
В этом посте:
Каково химическое название отбеливателя?Химическое название отбеливателя — гипохлорит натрия (NaClO), соединение хлора, обладающее прекрасными дезинфицирующими свойствами. Это может звучать пугающе, но даже жидкие отбеливатели, коммерчески доступные для домашнего использования, представляют собой разбавленные растворы NaClO, а также вторичные ингредиенты. Это самый распространенный тип отбеливателя, который вы найдете на рынке.
Активный ингредиент гипохлорита натрия в отбеливателях обычно имеет концентрацию около 5%, в то время как жидкие отбеливатели промышленного класса имеют более высокие концентрации. Однако существует много других типов отбеливателей, которые можно разделить на три основные категории: отбеливатели на основе хлора, на основе пероксида и на основе диоксида серы. Большинство бытовых и промышленных отбеливателей относятся к одной из этих категорий, поэтому химическое название отбеливателя будет зависеть от того, к какой категории относится продукт.
Отбеливатели этой категории основаны на разложении соединений хлора для разрушения молекулярных связей в молекулах пигмента. Примеры отбеливателей на основе хлора включают:
- Гипохлорит натрия: Обычно продается в виде жидкого раствора отбеливателя в воде, как правило, с концентрацией 5-6% по весу. Это химическое вещество также широко используется в качестве дезинфицирующего средства из-за его способности денатурировать белки в микроорганизмах и убивать бактерии и вирусы.
- Отбеливатель: Это смесь нескольких химических веществ, включая гипохлорит кальция, гидроксид кальция и хлорид кальция. Также известный как порошок хлора или хлорная известь, он используется не только в качестве отбеливателя, но и для обработки воды.
- Газообразный хлор: Обычно используется для очистки водопроводной воды, а также больших плавательных бассейнов.
 Его также можно использовать для отбеливания древесной массы в промышленных масштабах, но в последние годы эта практика значительно сократилась из-за экологических проблем и правил химического производства.
Его также можно использовать для отбеливания древесной массы в промышленных масштабах, но в последние годы эта практика значительно сократилась из-за экологических проблем и правил химического производства.
- Диоксид хлора: Нестабилен в газообразной форме, поэтому хранится в виде разбавленного водного раствора. Диоксид хлора широко используется для отбеливания древесной массы в бумажной промышленности. Он также используется для отбеливания жиров и масел, текстиля, пчелиного воска и кожи животных.
Активным агентом отбеливателей на основе перекиси является кислород. Так как же действует отбеливатель химически, если хлор не используется? Что ж, в этих составах отбеливающее действие зависит от разложения перекиси водорода или других перекисных соединений. Некоторые распространенные примеры отбеливателей с перекисью:
- Перекись водорода: Обычно используется в качестве антисептика для ран, хотя перекись водорода имеет множество других применений, помимо этого, в том числе в качестве осветляющего агента в косметике и парикмахерских услугах.
 В промышленных масштабах он используется для отбеливания древесной массы и для приготовления других типов отбеливающих веществ, таких как пербораты и перкарбонаты.
В промышленных масштабах он используется для отбеливания древесной массы и для приготовления других типов отбеливающих веществ, таких как пербораты и перкарбонаты.
- Перкарбонат натрия: Это аддукт двух химических веществ, а именно перекиси водорода и карбоната натрия. При растворении в воде перкарбонат натрия образует раствор, который можно одновременно использовать как отбеливатель и как обезжириватель.
- Перборат натрия: При растворении в воде образуется некоторое количество перекиси водорода. Его отбеливающее действие зависит от разложения перекиси водорода и нуклеофильного окисления аниона пербората.
- Перуксусная кислота: Также известна как пероксиуксусная кислота и может быть очень коррозионной. Надуксусная кислота образуется из стиральных порошков при растворении в воде и продается на рынке для промышленной и сельскохозяйственной дезинфекции
- Перекись бензоила: Хотя перекись бензоила обычно используется в качестве лекарства от прыщей, на самом деле она классифицируется как пищевая добавка.
 Фактически, отбеливающее действие перекиси бензоила в основном используется для отбеливания муки из-за его способности окислять каротиноиды муки.
Фактически, отбеливающее действие перекиси бензоила в основном используется для отбеливания муки из-за его способности окислять каротиноиды муки.
- Персульфатные соли: Это очень сильные окислители, которые обычно используются в порошковых продуктах для осветления волос. Примерами солей персульфата являются персульфат калия, персульфат аммония и персульфат натрия.
Этот тип отбеливателя содержит диоксид серы в качестве активного ингредиента, отбеливающее действие которого достигается за счет химического разложения оксо-анионов серы.
Дитионит натрия, также известный как гидросульфит натрия, является наиболее распространенным и важным примером отбеливателей на основе диоксида серы. Продается в виде белого кристаллического порошка со слегка сернистым запахом. Этот отбеливатель получают в результате реакции бисульфита натрия с цинком.
Для осветления волос можно использовать отбеливатели на основе перекиси водорода. Какова химическая формула отбеливателя?
Какова химическая формула отбеливателя? На самом деле не существует единой химической формулы отбеливателя просто из-за того, что существует множество различных типов отбеливателя. Каждая категория отбеливателей состоит из отдельных химических веществ, которые определяют его химическую формулу, а также химическое действие различных отбеливателей. Вот несколько примеров различных отбеливателей, чтобы показать, как могут измениться химические формулы:
- Гипохлорит натрия: NaClO
- Гипохлорит кальция: Ca(ClO)
- Гидроксид кальция: Ca(OH) 2
- Хлорид кальция: CaCl 2
- Перекись водорода: H 2 O 2
- Перкарбонат натрия: Na 2 H 3 CO 6
- Персульфат калия: K 2 S 2 O 8
А теперь главный вопрос о том, как химически действует отбеливатель. Химический состав отбеливателя можно определить, посмотрев на его действие. Химически все виды хлорной извести действуют как акцепторы протонов — поэтому хлорную известь называют нуклеофильной, т.е. любителем ядра. В двух словах, продукты отбеливания окисляют другие вещества, удаляя внешние электроны, а затем притягивая протон в ядре.
Химический состав отбеливателя можно определить, посмотрев на его действие. Химически все виды хлорной извести действуют как акцепторы протонов — поэтому хлорную известь называют нуклеофильной, т.е. любителем ядра. В двух словах, продукты отбеливания окисляют другие вещества, удаляя внешние электроны, а затем притягивая протон в ядре.
Фактически, молекулярные связи химических веществ, которые воздействуют на отбеливатель, особенно хромофоров (эти химические пигменты), разрушаются химическими веществами внутри отбеливателя. Те же действия происходят, когда молекулы отбеливателя соприкасаются с клеточными мембранами вирусов и бактерий: возбудители разрываются, что убивает их и предотвращает заражение.
Отбеливатель также является основным или щелочным веществом. Например, наиболее распространенным типом жидкого отбеливателя является разбавленный водный раствор гипохлорита натрия, который обычно имеет pH 11 при использовании в концентрации 5%. При более высоких концентрациях уровень pH может подняться до 13. Вот почему высокие концентрации отбеливателя могут вызывать коррозию, особенно с учетом того, что сильные основания обладают способностью глубоко проникать в поверхность.
Вот почему высокие концентрации отбеливателя могут вызывать коррозию, особенно с учетом того, что сильные основания обладают способностью глубоко проникать в поверхность.
Как щелочные или основные вещества, все типы отбеливателей представляют собой высокополярные молекулы из-за способа их связывания. Эти типы связей могут различаться от продукта к продукту, например, ионная связь молекул гипохлорита натрия по сравнению со слабой ковалентной связью перекиси водорода.
Полярность отбеливателей определяется геометрией молекул, особенно углом связи и распределением электронов. В случае гипохлорита натрия ионная связь делает атом натрия положительно заряженным, в то время как группы хлора и кислорода заряжены отрицательно.
Примером отбеливающего соединения, которое является полярным из-за валентного угла, является перекись водорода. Здесь связи придают молекуле зигзагообразную форму: два атома кислорода образуют прямую линию в центре плоскости на расстоянии 147,4 пикометра друг от друга. Между тем, два атома водорода имеют одинаковые 95 пикометров от соответствующих им атомов кислорода. Внутренний угол между атомом кислорода и водорода составляет 94,8 градуса.
Между тем, два атома водорода имеют одинаковые 95 пикометров от соответствующих им атомов кислорода. Внутренний угол между атомом кислорода и водорода составляет 94,8 градуса.
Отбеливатели имеют множество применений в промышленности и быту. Хотя они, пожалуй, чаще всего используются в качестве чистящего средства для ванных комнат, кухонь и прачечных, некоторые виды отбеливателей используются в сфере красоты и косметики в качестве осветлителя, будь то волосы, ногти или даже кожа.
Более высокие концентрации отбеливателя могут использоваться на промышленном уровне для дезинфекции воды, загрязненной загрязняющими веществами и патогенами. Другие типы промышленных отбеливателей имеют широкий спектр применения в производстве бумаги, например, для отбеливания древесной массы.
Независимо от того, как вы его используете, отбеливатель может быть очень агрессивным, поэтому всегда следует соблюдать осторожность при обращении с этим химическим веществом.

 Помимо этого для обеззараживания питьевой воды, стоков и отбеливания.
Помимо этого для обеззараживания питьевой воды, стоков и отбеливания.

 Его также можно использовать для отбеливания древесной массы в промышленных масштабах, но в последние годы эта практика значительно сократилась из-за экологических проблем и правил химического производства.
Его также можно использовать для отбеливания древесной массы в промышленных масштабах, но в последние годы эта практика значительно сократилась из-за экологических проблем и правил химического производства. В промышленных масштабах он используется для отбеливания древесной массы и для приготовления других типов отбеливающих веществ, таких как пербораты и перкарбонаты.
В промышленных масштабах он используется для отбеливания древесной массы и для приготовления других типов отбеливающих веществ, таких как пербораты и перкарбонаты. Фактически, отбеливающее действие перекиси бензоила в основном используется для отбеливания муки из-за его способности окислять каротиноиды муки.
Фактически, отбеливающее действие перекиси бензоила в основном используется для отбеливания муки из-за его способности окислять каротиноиды муки.