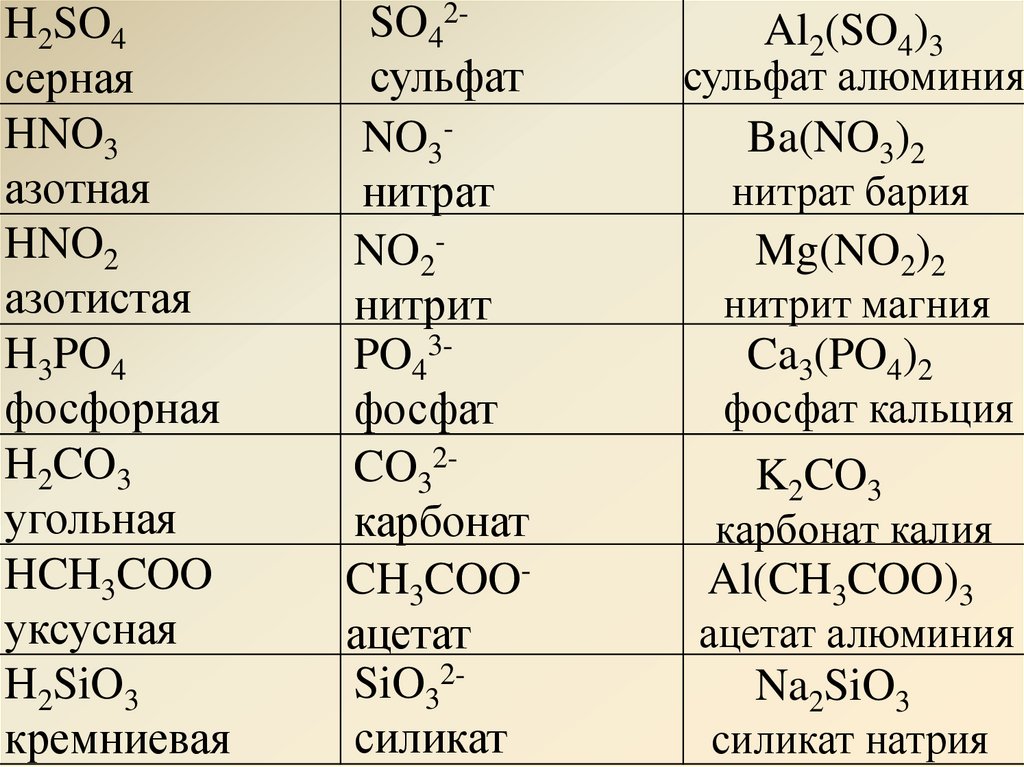
6. Названия некоторых средних, кислых и основных солей
Формула | Название |
Средние соли | Содержат в своём составе катионы металлов и кислотные остатки |
NaCl | хлорид натрия |
K2SO4 | сульфат калия |
K2CrO4 | хромат калия |
Fe2(SO4)3 | сульфат железа (III) |
(NH4)3PO4 | ортофосфат аммония |
A1(NO3)3 | нитрат алюминия |
Кислые соли | Содержат кислотные остатки с незамещёнными атомами водорода |
NaHCO3 | гидрокарбонат натрия |
K2HPO4 | гидроортофосфат калия |
| KH2PO4 | дигидроортофосфат калия |
Ca(HS)2 | гидросульфид кальция |
Fe(HCO3)2 | гидрокарбонат железа (II) |
Ba(H2PO4)2 | дигидроортофосфат бария |
Основные соли | Содержат в своём составе гидроксогруппы |
(CaOH)2SO4 | гидроксосульфат кальция (сульфат гидроксокальция) |
(CoOH)NO3 | гидроксонитрат кобальта (II) |
FeOHCl | гидроксохлорид железа (II) (хлорид гидроксожелеза(II)) |
FeOHCl2 | гидроксохлорид железа (III) (дихлорид гидроксожелеза (III)) |
Fe(OH)2Cl | дигидроксохлорид железа (III) |
Fe(OH)2NO3 | дигидроксонитрат железа (III) |
| [Fe(OH)2]2SO4 | дигидроксосульфат железа (III) |
(AlOH)2SiO4 | ортосиликат гидроксоалюминия |
Продолжение
7. Электрохимический
ряд напряжений металлов
Электрохимический
ряд напряжений металлов
Li Rb К Ва Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt
Au
Анионы по способности окисляться располагаются в следующем порядке: I—; Br—; S2-; Сl—; OH—; SO42-; NO3—
Li+ Rb+ K+ Ba2+ Sr2+ Ca2+ Na+ Mg2+ A13+ | Mn2+ Zn2+ Cr3+ Fe2+ Fe3+ Cd2+ Со2+ Ni2+ Sn2+ Pb2+ | Sb3+Bi3+Cu2+Hg2+Ag+Pd2+ Pt2+Au3+ |
На катоде | ||
При электролизе водных растворов не восстанав- ливаются. восстанавливаются ионы водорода: 2Н+ + 2е— = Н2 или 2Н2О + 2е— = Н2 + 2OH— | При электролизе растворов восстанавливаются на катоде одновременно с молекулами воды: 2Н2О + 1e— = Н2 + 2ОН— | При
электролизе растворов практически
полностью катоде. |
На аноде В случае растворимого анода (Cu, Ag, Zn, Cd, Hg, Ni и др.) при электролизе водного раствора окисляется анод, и металл переходит в раствор в виде ионов: Сu — 2е— = Сu2+ | ||
В случае с инертным (нерастворимым) анодом: 1)
при электролизе водных растворов
солей бескислородных кислот (Сl—,
Вr—,
I—,
S2- и др. 2) при электролизе водных растворов солей кислородсодержащих кислот окисляются молекулы воды или гидроксид-ионы: 2Н2О — 4е— = О2 + 4Н+ или 4ОН— — 4е— = О2 + 2Н2О. | ||
Нитрат хрома(III), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| |||||||||||||||||||||
| |||||||||||||||||||||
Учебные материалы по химии, ЗФ
Skip to main content
Sorry, the requested file could not be found
More information about this error
Jump to… Jump to…ОбъявленияЛекции по химии почвСвойства и особенности формирования почв Томской областиТемы рефератовВопросы для подготовки к зачетуХимический состав почвХимия. Сборник задач и упражнений. Часть 2
Skip Calendar| No events, Saturday, 1 October 1 | No events, Sunday, 2 October 2 | |||||
| No events, Monday, 3 October 3 | No events, Tuesday, 4 October 4 | No events, Wednesday, 5 October 5 | No events, Thursday, 6 October 6 | No events, Friday, 7 October 7 | No events, Saturday, 8 October 8 | No events, Sunday, 9 October 9 |
| No events, Monday, 10 October 10 | No events, Tuesday, 11 October 11 | No events, Wednesday, 12 October 12 | No events, Thursday, 13 October 13 | No events, Friday, 14 October 14 | No events, Saturday, 15 October 15 | No events, Sunday, 16 October 16 |
| No events, Monday, 17 October 17 | No events, Tuesday, 18 October 18 | No events, Wednesday, 19 October 19 | No events, Thursday, 20 October 20 | No events, Friday, 21 October 21 | No events, Saturday, 22 October 22 | No events, Sunday, 23 October 23 |
| No events, Monday, 24 October 24 | No events, Tuesday, 25 October 25 | No events, Wednesday, 26 October 26 | No events, Thursday, 27 October 27 | No events, Friday, 28 October 28 | No events, Saturday, 29 October 29 | No events, Sunday, 30 October 30 |
| No events, Monday, 31 October 31 |
- Hide site events
- Hide category events
- Hide course events
- Hide group events
- Hide user events
- Hide other events
No online users (last 5 minutes)
Skip StatisticsГДЗ / ОТВЕТЫ Химия 8 класc Габриелян О.
 С. §42 Соли, их классификация и свойства » Крутые решение для вас от GDZ.cool
С. §42 Соли, их классификация и свойства » Крутые решение для вас от GDZ.coolГДЗ / ОТВЕТЫ Химия 8 класc Габриелян О.С. §42 Соли, их классификация и свойства
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Из перечня формул выпишите отдельно формулы средних, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации: Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.
Средние соли:
Формула | Название | Уравнение диссоциации |
| Ca(NO3)2 | нитрат кальция | Ca(NO3)2 ⟶ Ca2+ + 2NO3— |
| Na3PO4 | фосфат натрия | Na3PO4 ⟶ 3Na+ + PO43- |
Кислые соли:
Формула | Название | Уравнение диссоциации |
| Ca(HSO4)2 | гидросульфат кальция | Ca(HSO4)2 ⟶ Ca2+ + 2HSO4— |
| NaH2PO4 | дигидрофосфат натрия | NaH2PO4 ⟶ Na+ + H2PO4— |
Основные соли:
Формула | Название | Уравнение диссоциации |
| (CaOH)2SO4 | гидроксосульфат кальция | (CaOH)2SO4 ⟶ 2CaOH+ + SO42- |
| MgOHNO3 | гидроксонитрат магния | MgOHNO3 ⟶ MgOH+ + NO3— |
Задание 2 Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
а) HCl + Na2SO4 ≠ Реакция не происходит, т. к. не выделяется газ, не образуется осадок или вода.
к. не выделяется газ, не образуется осадок или вода.
б) H3PO4 + CaCl2 ⟶
2H3PO4 + 3CaCl2 = 6HCl + Ca3(PO4)2↓
6H+ + 2PO43- + 3Ca2+ + 6Cl— = 6H+ + 6Cl— + Ca3(PO4)2↓
3Ca2+ + 2PO43- = Ca3(PO4)2↓
в) FeCl3 + AgNO3 ⟶
FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl↓
Fe3+ + 3Cl— + 3Ag+ + 3NO3— = Fe3+ + 3NO3— + 3AgCl↓
3Ag+ + 3Cl— = 3AgCl↓ : 3
Ag+ + Cl— ⟶ AgCl↓
г) KNO3 + NaCl ≠ Реакция не происходит, т. к. не выделяется газ, не образуется осадок или вода.
д) NaOH + FeS↓ ≠ Реакция не происходит, т. к. сульфид железа (II) ― нерастворимая в воде соль.
е) KOH + Al2(SO4)3 ⟶
6KOH + Al2(SO4)3 = 3K2SO4 + 2Al(OH)3↓
6K+ + 6OH— + 2Al3+ + 3SO42- = 6K+ + 3SO42- + 2Al(OH)3↓
2Al3+ + 6OH— = 2Al(OH)3↓ :2
Al3+ + 3OH— = Al(OH)3↓
ж) Ca + CuCl2 ⟶
Ca + CuCl2 = CaCl2 + Cu↓
з) Cu + AgNO3 ⟶
Cu + 2AgNO3 = Cu(NO3) + 2Ag↓
и) Mg + ZnS ≠ Реакция не происходит, т. к. сульфид цинка (II) ― нерастворимая в воде соль.
к) Cu + Fe(NO3)2 ≠ Реакция не происходит, т. к. медь не может вытеснить железо (в электрохимическом ряду напряжений медь Сu стоит правее железа Fe).
Задание 3 К 980 г 5%-го раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка. Ответ
Дано: m(раствора)=980 г, ω(H2SO4)=5%
Найти: m(BaSO4)-?
Решение
1-й способ
1. Вычисляем массу серной кислоты в растворе:
m(H2SO4)=(m(аствора)•ω(H2SO4)):100%=980 г • 5% : 100%=49 г
2. Количество вещества серной кислоты массой 49 г вычисляем по формуле: n=m/M, где M ― молярная масса.
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98, поэтому M(H2SO4)=98 г/моль
n(H2SO4)=m(H2SO4)/M(H2SO4)=49 г : 98 г/моль=0,5 моль
3. Составим химическое уравнение:
H2SO4 + Ba(NO3)2 = 2HNO3 + BaSO4↓
По уравнению реакции n(H2SO4):n(BaSO4↓)=1:1, количество вещества одинаковое, поэтому:
n(BaSO4)=n(H2SO4)=0,5 моль
4. Массу осадка сульфата бария количеством вещества 0,5 моль вычисляем по формуле: m=n•M.
Массу осадка сульфата бария количеством вещества 0,5 моль вычисляем по формуле: m=n•M.
Mr(BaSO4)=Ar(Ba)+Ar(S)+4•Ar(O)=137+32+4•16=233, поэтому M(BaSO4)=233 г/моль
m(BaSO4)=n(BaSO4)•M(BaSO4)=0,5 моль • 233 г/моль=116,5 г
2-й способ
1. Вычисляем массу серной кислоты в растворе:
m(H2SO4)=(m(аствора)•ω(H2SO4)):100%=980 г • 5% : 100%=49 г
2. Составим химическое уравнение:
49 г х г
H2SO4 + Ba(NO3)2 = 2HNO3 + BaSO4↓
98 г 233 г
Над формулами соединений H2SO4 и BaSO4 записываем вычисленную массу серной кислоты (49 г) и неизвестную массу сульфата бария (х г), а под формулами соединений ― массу соответствующего количества вещества согласно коэффициентам в химическом уравнении.
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98, поэтому M(H2SO4)=98 г/моль, масса 1 маль=98 г
Mr(BaSO4)=Ar(Ba)+Ar(S)+4•Ar(O)=137+32+4•16=233, поэтому M(BaSO4)=233 г/моль, масса 1 моль=233 г
3. Массу сульфата бария рассчитываем с помощью пропорции:
49 г / 98 г = х г / 233 г, отсюда
х=m(BaSO4)=233 г • 49 г : 98 г=116,5 г
Ответ: образуется 116,5 г осадка сульфата бария.
Задание 4 Запишите уравнения реакций всех возможных способов получения сульфата железа (II).
Fe + H2SO4 = FeSO4 + H2↑
Fe + CuSO4 = FeSO4 + Cu↓
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
FeS + H2SO4 = FeSO4 + H2S↑
FeCl2 + Ag2SO4 = FeSO4 + 2AgCl↓
FeS2 + 3O2 = FeSO4 + SO2↑
Задание 5 Определите степени окисления элементов в солях, формулы которых: Na2SO4, K2SO3, Fe(NO3)3, Fe(NO2)2, Mg(HCO3)2, Ca3(PO4)2, NaHSO4, CuOHNO3. Дайте названия солей.
Дайте названия солей.
Na2+1S+6O4−2 − сульфат натрия
В сульфате натрия Na2SO4 степень окисления натрия равна +1, а кислорода -2. Обозначим степень окисления серы через х: Na+12SxO4-2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 2•(+1)+x+4•(-2)=0, отсюда х=8-2=6. Cтепень окисления серы равна +6.
K2+1S+4O3−2 − сульфит калия
В сульфите калия К2SO3 степень окисления калия равна +1, а кислорода -2. Обозначим степень окисления серы через х: К+12SxO3-2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 2•(+1)+x+3•(-2)=0, отсюда х=6-2=4. Cтепень окисления серы равна +4.
Fe+3(N+5O3-2)3 − нитрат железа (III)
В нитрате железа (III) Fe(NO3)3 степень окисления железа равна +3, а кислорода -2. Обозначим степень окисления азота через х: Fe+3(NxO3-2)3, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+3)+3•x+9•(-2)=0, отсюда х=(18-3):3=5. Cтепень окисления азота равна +5.
Обозначим степень окисления азота через х: Fe+3(NxO3-2)3, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+3)+3•x+9•(-2)=0, отсюда х=(18-3):3=5. Cтепень окисления азота равна +5.
Fe+2(N+3O2-2)2 − нитрит железа (II)
В нитрите железа (II) Fe(NO2)2 степень окисления железа равна +2, а кислорода -2. Обозначим степень окисления азота через х: Fe+2(NxO2-2)2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+2)+2•x+4•(-2)=0, отсюда х=(8-2):2=3. Cтепень окисления азота равна +3.
Mg+2(H+1C+4O3-2)2− гидрокарбонат магния
В гидрокарбонате магния Mg(HCO3)2 степень окисления магния равна +2, водорода +1, а кислорода -2. Обозначим степень окисления углерода через х: Mg+2(H+1CxO3-2)2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+2)+2•(+1)+2•x+6•(-2)=0, отсюда х=(12-2-2):2=4. Cтепень окисления углерода равна +4.
Cтепень окисления углерода равна +4.
Ca3+2(P+5O4-2)2− фосфат кальция
В фосфате кальция Ca3(PO4)2 степень окисления кальция равна +2, а кислорода -2. Обозначим степень окисления фосфора через х: Ca3+2(PxO4-2)2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 3•(+2)+2•x+8•(-2)=0, отсюда х=(16-6):2=5. Cтепень окисления фосфора равна +5.
Na+1H+1S+6O4−2 − гидросульфат натрия
В гидросульфате натрия NaHSO4 степень окисления натрия равна +1, водорода +1, а кислорода -2. Обозначим степень окисления серы через х: Na+1H+1SxO4-2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+1)+1•(+1)+1•x+4•(-2)=0, отсюда х=8-1-1=6. Cтепень окисления серы равна +6.
Cu+2O−2H+1N+5O3−2− гидроксонитрат меди (II)
В гидроксонитрате меди (II) CuOHNO3 степень окисления меди равна +2, водорода +1, а кислорода -2. Обозначим степень окисления азота через х: Cu+2O-2H+1NxO3-2, принимая во внимание свойство электронейтральности вещества, получим уравнение: 1•(+2)+1•(-2)+1•(+1)+1•x+3•(-2)=0, отсюда х=6-2+2-1=5. Cтепень окисления азота равна +5.
Другие задания смотри здесь…
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ ОБМЕНА — КиберПедия
181. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) хлорид кобальта и сульфид калия;
б)гидросиликат калия и гидроксид калия.
Чему равна концентрация каждого иона в насыщенном растворе сульфида серебра.
182. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Ca2+ + CO32- = CaCO3↓;
б) 2Н+ + 2NO2— = NO↑ + NO2↑ + H2O.
Исходя из значения произведения растворимости карбоната магния, вычислите массу соли, содержащуюся в 100 мл насыщенного раствора.
183. Какое из веществ: гидрокарбонат калия, сульфат кадмия, гидроксид бария будет взаимодействовать с серной кислотой ? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
В растворе хлорноватистой кислоты концентрации 0,1 М степень диссоциации равна 0,025%. При какой концентрации раствора степень диссоциации увеличится в три раза?
184. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) гидроксохлорид алюминия и соляная кислота;
б) хлорид кальция и карбонат натрия.
Рассчитать концентрацию ионов СlО— в растворе, в 0,5л которого содержится 0,05 моля хлорноватистой кислоты и 0,03 моля соляной кислоты, если последняя диссоциирует полностью.
185. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) 3Cа2+ + 2РО43- = Cа3(РО4)2↓;
б) NH4+ + OH— = NH4OH.
Чему равна растворимость cульфида кадмия в моль/л и г/моль?
186. Какое из веществ: гидроксонитрат магния, сульфат аммония и хромат натрия будет взаимодействовать с гидроксидом натрия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
В насыщенном растворе фторида стронция концентрация ионов F— равна 1,1×10-3 моль/л. Вычислите произведение растворимости .
187. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) нитрит калия и азотная кислота;
б) дигидрофосфат калия и гидроксид калия.
Сколько граммов гидроксида натрия находится в состоянии полной диссоциации в 100 мл раствора, рН которого равен 13?
188. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) SO32- + 2H+ = H2O + SO2↑;
б) Hg2+ + 4Cl— = [HgCl4]2-.
Вычислите рН 2%-ного раствора гидроксида аммония.
189. Какое из веществ: гидроксохлорид магния, нитрат калия или гидрокид цинка будет взаимодействовать соляной кислотой? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Вычислите степень диссоциации 1,5%-ного раствора синильной кислоты.
190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) сульфат железа и нитрат стронция;
б) нитрит натрия и соляная кислота.
Вычислите концентрации всех ионов в 2%-ных растворах сульфата калия и нитрата свинца, если степень диссоциации равна 70%.
191. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Ni2+ + 4NH4OH = [Ni(NH3)4]2+ + 4 H2O;
б) СО32- + 2H+ = CO2↑ + H2O.
Растворимость хромата бария равна 0,235 мг на 100мл. Вычислите ПР этой соли.
192. Какое из веществ: карбонат натрия, гидрокарбонат натрия или нитрат натрия будет взаимодействовать с уксусной кислотой? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Какую массовую долю фторида водорода должен иметь раствор, чтобы степень диссоциации раствора плавиковой кислоты составляла 1%?
193. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) гидроксид алюминия и гидроксид натрия;
б) карбонат калия и уксусная кислота.
Вычислите концентрацию ионов СN— в растворе, в 300мл которого содержится 0,05 моль синильной кислоты и 0,25 моль соляной кислоты, считая диссоциацию соляной кислоты полной.
194. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а)Pb2+ + 2I— = PbI2↓;
б) NH4OH + H+ = NH4+ + H2O.
Насыщенный раствор карбоната серебра объемом 2 л содержит в виде ионов 0,056 г серебра. Вычислите ПР этой соли.
195. Какое вещество: сульфат меди, хлорид меди или гидроксид натрия будет взаимодействовать с ацетатом свинца? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Вычислите концентрацию ионов Н+ в 5%-ном растворе соляной кислоты и в 0,05 М растворе HCN. Чему равны рН этих растворов?
196. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) ацетат цинка и серная кислота;
б) хромат калия и нитрат бария.
Вычислите рН насыщенного раствора гидроксида магния.
197. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Mn2+ + 2OH— = Mn(OH)2↓;
б) Н+ + НСОО— = НСООН.
Вычислите концентрации всех ионов в насыщенном растворе фторида кальция.
198. Какое вещество: азотная кислота, нитрат магния или сульфат натрия будет взаимодействовать с силикатом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,01 М раствора азотистой кислоты добавить 0,01 моль нитрита натрия?
199. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) нитрит натрия и серная кислота;
б) нитрат магния и фосфат натрия.
Степень диссоциации слабой одноосновной кислоты в 0,01 н. растворе равна 0,5%. Вычислите рН раствора этой кислоты.
200. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Al3+ + 4OH— = [Al(OH)4]—;
б) 3Ag+ + PO43- = Ag3PO4↓.
Вычислите рН 5%-ного раствора азотной кислоты
ГИДРОЛИЗ СОЛЕЙ
201.Составьте молекулярные и ионные уравнения гидролиза солей Li3PO4, KCl, CuCl2. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей? На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
202. Составьте молекулярные и ионные уравнения гидролиза солей CoSO4, KCN, Na2 SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
203. Составьте молекулярные и ионные уравнения гидролиза солей (NH4)2СO3, МоSO4, LiNO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
204. Составьте молекулярные и ионные уравнения гидролиза солей Cr2(SO4)3 и Na2SiO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
При смешивании растворов солей Cr2(SO4)3 и Na2SiO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
На основании табличных данных вычислите константы гидролиза сульфата хрома по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
205. Составьте молекулярные и ионные уравнения гидролиза солей NaCN, Cr(NO3)3, K2SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
206. Составьте молекулярные и ионные уравнения гидролиза солей Pb(NO3)2, NaNO3, K2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
207. Составьте молекулярные и ионные уравнения гидролиза солей Al(NO3)3 и K2CO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
При смешивании растворов солей Al(NO3)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
На основании табличных данных вычислите константы гидролиза карбоната калия по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
208. Составьте молекулярные и ионные уравнения гидролиза солей ZnSO4, Na3PO4, CsBr. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
209. Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
Сравните значения рН по всем ступеням.
210. Составьте молекулярные и ионные уравнения гидролиза солей AlCl3 и Na2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
При смешивании растворов солей AlCl3 и Na2SO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. На основании табличных данных вычислите константы гидролиза сульфита натрия по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени.
Сравните значения рН по всем ступеням.
211. Составьте молекулярные и ионные уравнения гидролиза солей Al2(SO4)3, KF, KI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
Сравните значения рН по всем ступеням.
212. Составьте молекулярные и ионные уравнения гидролиза солей MnSO4, KNO3, NaF. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
213. Составьте молекулярные и ионные уравнения гидролиза солей Сd(NO3)2, NaCl, KBrO. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
214. Составьте молекулярные и ионные уравнения гидролиза солей Al2(SO4)3 и K2CO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
При смешивании растворов солей Al2(SO4)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. На основании табличных данных вычислите константы гидролиза сульфата алюминия по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени.
Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. На основании табличных данных вычислите константы гидролиза сульфата алюминия по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени.
Сравните значения рН по всем ступеням.
215. Составьте молекулярные и ионные уравнения гидролиза солей NiCl2, Na3PO4, NaCl. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
216. Составьте молекулярные и ионные уравнения гидролиза солей Mn(NO3)2, K2SiO3, SrSO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
Сравните значения рН по всем ступеням.
217. Составьте молекулярные и ионные уравнения гидролиза солей MgSO4, Na2CO3, Ca(NO3)2. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
218. Напишите молекулярные и ионно-молекулярные уравнения гидролиза Hg(NO3)2 и K2CO3 и их совместного гидролиза.
На основании табличных данных вычислите константы гидролиза нитрата ртути по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
219. Составьте молекулярные и ионные уравнения гидролиза солей NiSO4, Na2S, K3AsO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
220. Составьте молекулярные и ионные уравнения гидролиза солей СdBr2, K3PO4, LiI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
Эндотермические реакции твердое тело-твердое | Эксперимент
- Пять из пяти
В этом демонстрационном или классном эксперименте учащиеся наблюдают эндотермическую реакцию между твердым гидратированным гидроксидом бария и твердым хлоридом аммония. В результате реакции образуется жидкость, которая превращается в газообразный аммиак при резком падении температуры примерно до –20 °C 9.0018
В результате реакции образуется жидкость, которая превращается в газообразный аммиак при резком падении температуры примерно до –20 °C 9.0018
Хотя эксперимент можно безопасно проводить в классе (имея в виду кандидатов на сдачу экзамена GCSE или A-level), он длится всего около 5 минут и может не стоить дополнительного времени, затрачиваемого учащимися на установку и уборку. Поэтому рекомендуется как более подходящая демонстрация для учителя. Ученикам можно было позволить ощупать внешний вид очень холодного контейнера.
Оборудование
Аппарат
- Защита глаз (очки)
- Стакан, 100 см 3
- Стекло для часов
- Термометр для измерения до –30 °C (примечание 3)
- Верхние весы
- Вытяжной шкаф (дополнительно)
Химические вещества
- Гидроксид бария-8-вода (КОРРОЗИОННОЕ ВЕЩЕСТВО), 32 г
- Хлорид аммония (ВРЕДЕН), 10 г
- Кислота соляная концентрированная (КОРРОЗИОННАЯ)
- Универсальная индикаторная (или лакмусовая) бумага, 1 полоска
Здоровье, безопасность и технические примечания
- Всегда используйте защитные очки (очки).

- Работать в вытяжном шкафу, если помещение хорошо не проветривается.
- Рассмотрите возможность использования термометра термопарного типа, который можно подключить к большому дисплею или компьютерному монитору.
- Гидроксид бария-8-вода, Ba(OH) 2 .8H 2 O(s), (КОРРОЗИОННОЕ ВЕЩЕСТВО) – см. карточку опасности CLEAPSS HC010B. По возможности избегайте образования комков при взвешивании необходимого количества.
- Хлорид аммония, NH 4 Cl(s), (ВРЕДЕН) – см. карточку опасности CLEAPSS HC009a. По возможности избегайте образования комков при взвешивании необходимого количества.
- Концентрированная соляная кислота, HCl (водн.), (КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC047a. Используйте небольшую бутылку с запасом, чтобы обеспечить пары для теста с аммиаком.
Процедура
- Поставьте химический стакан на часовое стекло с несколькими каплями воды так, чтобы дно стакана касалось воды.

- Обратите внимание на температуру в помещении.
- Смешайте два твердых вещества в стакане и перемешайте термометром. Смесь становится мутной, так как образуется жидкость вместе с белой суспензией.
- Наличие аммиака можно обнаружить по запаху и подтвердить, продув пары из бутыли с соляной кислотой через горлышко стакана и используя влажную индикаторную бумагу.
- Наблюдают падение температуры, что подтверждается тем фактом, что мензурка примерзает к часовому стеклу.
Учебные заметки
Удобно использовать большой дисплей термометра. Холодный стакан можно раздать по классу, как только выделение аммиака прекратится.
Невозможно легко определить точное соединение бария или соединения, образующиеся в этой реакции, но уравнение обычно представляется в виде: Cl(т) → 2NH 3 (г) + 10H 2 O(ж) + BaCl 2 (т)
или
Ba(OH) 2 .8H 2 O(s) + 2NH 4 Cl(s) → 2NH 3 (g) + 8H 2 O(l) + BaCl 2 . 2H 2 O(s)
2H 2 O(s)
Учащихся уровня A можно попросить рассчитать значение энтальпии и изменения энтропии для реакции, используя стандартные изменения энтальпии образования и стандартные значения энтропии, полученные из справочника данных или из таблицу ниже.
Соединение | DH f ⦵ / кДж моль -1 | S ⦵ / Дж моль -1 К -1 |
Ba(OH) 2 .8H 2 O(s) | -3345 | 427 |
NH 4 Класс(ы) | -314 | 95 |
NH 3 (г) | -46 | 192 |
Н 2 О(л) | -286 | 70 |
BaCl 2 (с) | -859 | 124 |
BaCl 2 . | -1460 | 203 |
Изменение энтальпии +164 кДж моль –1 получено, если предположить, что продукт представляет собой BaCl 2 (с) и +135 кДж моль –1 если предполагается, что это BaCl 2 .2H 2 O(s). Студенты должны быть в состоянии качественно предсказать, что изменение энтропии для системы имеет положительное значение, поскольку газ и жидкость образуются из двух твердых тел. Из приведенных выше значений их также можно попросить рассчитать фактическое изменение энтропии для системы и окружающей среды и, следовательно, ∆S в сумме или ∆G для реакции и подтвердить, что процесс является самопроизвольным. Значение ∆S системы из +591 Дж моль –1 K –1 получается, если предполагается, что продукт представляет собой BaCl 2 (с) и +530 Дж моль –1 K –1 если предполагается, что продукт представляет собой BaCl 2 . 2H 2 O(s).
2H 2 O(s).
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
- Пять из пяти
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2h3O
| Поиск |
азотная кислота + гидроксид бария = нитрат бария + вода |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| jpg» substance-weight=»63.0128″> 2HNO 3 | + | 121139000000-download.jpg» substance-weight=»18.01528 ± 0.00044″> 2H 2 O | |||||
| nitric acid | barium hydroxide | barium nitrate | water | ||||
| (dd) | (dd) | (dd) | (lỏng) | ||||
| (không màu) | (không màu) | (trắng) | (không màu) | ||||
| 2 | 1 | 1 | 2 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении (OH)2 (гидроксид бария) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Ba(NO3)2 (нитрат бария) и h3O (вода) ?
HNO3 реагирует с Ba(OH)2
В полном предложении вы также можете сказать, что HNO3 (азотная кислота) реагирует с Ba(OH)2 (гидроксид бария) и производит Ba(NO3)2 (нитрат бария) и h3O (вода)
Явление после HNO3 (азотная кислота) реагирует с Ba(OH)2 (гидроксидом бария)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта h3O (вода), появляющаяся в конце реакции.
Или если какое-либо из следующих реагентов Ba(OH)2 (гидроксид бария), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дальнейшие вопросы, связанные с химическими реакциями 2HNO
3 + BA (OH) 2 → BA (№ 3 ) 2 + 2H 2 O . (азотная кислота)Каковы химические и физические характеристики HNO3 (азотная кислота)? В каких химических реакциях используется HNO3 (азотная кислота) в качестве реагента?
Вопросы, связанные с реагентом Ba(OH)2 (гидроксид бария)
Каковы химические и физические характеристики Ba(OH)2 (гидроксид бария)? ) в качестве реагента?
Вопросы, связанные с продуктом Ba(NO3)2 (нитрат бария)
Каковы химические и физические характеристики Ba(NO3)2 (гидроксид бария)? ) как товар?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (гидроксида бария)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Уравнения с HNO3 в качестве реагента
азотная кислота
(6x-2y) HNO 3 + Fexoy → (3x-y) H 2 O + 3x-2yno 2 + XFE (№ 3 ) 3 24HNO 3 + FECS 2 24HNO 3 + FEC.
Уравнения с Ba(OH)2 в качестве реагента
гидроксид бария
2 (NH 4 ) 3 PO 4 + 3BA (OH) 2 → 6H 2 O + 6NH 3 + BA 3 (PO 4 ) + 2 (PO 4 ) + 2 (PO 4 ) + 3 (PO 4 ) + BA 3 (PO 4 ) + BA 3 (PO 4 ) + BA 3 (PO 9003 4 ) + BA 3 . 2 + Ва(ОН) 2 → Ba(HSO 3 ) 2 2Cl 2 + 2Ba(OH) 2 → BaCl 2 + 2H 2 O 9 BaO(ClO6) 64 Просмотреть все уравнения с Ba(OH)2 в качестве реагента
Рекламное объявление
Уравнения с Ba(OH)2 как произведение
гидроксид бария
BaCl 2 + Ca(OH) 2 → Ba(OH) 2 + CaCl 2 BaO + H 2 O → Ba(OH) 2 → 9 Ba(OH) 90 90 Н 2 + Ва(ОН) 2 Просмотреть все уравнения с Ba(OH)2 как произведение
Уравнения с Ba(OH)2 как произведение
гидроксид бария
BaCl 2 + Ca(OH) 2 → Ba(OH) 2 + CaCl 2 BaO + H 2 O → Ba(OH) 2 → 9 Ba(OH) 90 90 Н 2 + Ва(ОН) 2 Просмотреть все уравнения с Ba(OH)2 как произведение
Обзор, вопросы, простые приемы, правила, подготовка
Введение
Гидроксид бария представляет собой белое гранулированное соединение. Он состоит из воды и оксида бария. Он преимущественно используется для производства других вещей из бария. Одним из основных производных элемента бария является моногидрат, известный как барит или барит-вода.
Он состоит из воды и оксида бария. Он преимущественно используется для производства других вещей из бария. Одним из основных производных элемента бария является моногидрат, известный как барит или барит-вода.
Содержание
- Химический состав гидроксида бария
- Свойства гидроксида бария
- Использование гидроксида бария
- Физические свойства гидроксида бария
- Часто задаваемые вопросы о гидроксиде бария
Химическая формула оксида бария интересна из-за химической формулы гидроксида бария. Гидроксид бария состоит из бария и гидроксида. Итак, с технической точки зрения, Ва должна быть формулой (ОН). Тогда почему мы пишем формулу гидроксида бария как Ba(OH)2? Это потому, что есть два положительных иона бария и один отрицательный в гидроксиде. Итак, мы добавляем еще один гидроксид к гидроксиду бария и делаем его нейтральным, чтобы продемонстрировать барий как нейтральное соединение.
Гидроксид бария состоит из бария и гидроксида. Итак, с технической точки зрения, Ва должна быть формулой (ОН). Тогда почему мы пишем формулу гидроксида бария как Ba(OH)2? Это потому, что есть два положительных иона бария и один отрицательный в гидроксиде. Итак, мы добавляем еще один гидроксид к гидроксиду бария и делаем его нейтральным, чтобы продемонстрировать барий как нейтральное соединение.
Свойства гидроксида бария следующие:
- Молярная масса
Молярная масса гидроксида бария составляет 171,344 г/моль
- Температура плавления
Температура плавления гидроксида бария зависит от количества содержащейся в нем воды. Фаза октагидрата оксида бария плавится при 78 градусах Цельсия. При 300 градусах Цельсия моногидратная фаза плавится, а безводная форма плавится при 407 градусах Цельсия
- Растворимость
Бария гидроксид только частично растворим в воде
- Температура кипения
Гидроксид бария кипит при 780 градусах Цельсия. Он разложится и выделит оксид бария, если вам удастся его прокипятить. Для этого температура должна превышать 800 градусов Цельсия.
Он разложится и выделит оксид бария, если вам удастся его прокипятить. Для этого температура должна превышать 800 градусов Цельсия.
- Известь гидроксида бария обычно используется в качестве альтернативы натронной извести. Соединение присутствует в высокой концентрации в севофлуране 9.0004
- Используется для производства щелочей, присадок к стеклу, маслам и жирам, бариевых мыл и других соединений бария
Запах | Без запаха |
Внешний вид | Белый сплошной |
Ковалентно-связанные блоки | Три |
Давление пара | 0,48 кПа при 17,6°С |
рН | 11,27 |
Растворимость | Частично растворим в воде |
Гидроксид бария класса 11:
В главе об элементах р-блока вы узнаете о барии и его соединениях. Вес этой главы составляет 5-6 баллов в классе 11.
Вес этой главы составляет 5-6 баллов в классе 11.
Иллюстрированные примеры:
- Какова молекулярная масса гидроксида бария?
Масса бария = 137,33 г/моль
Масса кислорода = 16 г/моль = 32 г из-за 2 молей
Масса водорода = 1 г/моль = 2 г из-за 2 молей моль
- Как получают гидроксид бария?
Обычно гидроксид бария получают в воде путем растворения оксида бария (химическая формула: BaO). Ниже приведено химическое уравнение этой реакции:
BaO + 9h3O → Ba(OH)2·8h3O
- Найдите уровень pH 0,10 М раствора гидроксида бария.
Раствор:
Ba(OH)2 (s) →Ba2++ 2OH−
Раствор будет содержать 0,20 М гидроксид-ионов
[H+][OH-]=1,0×10-14M
[OH-]=2,0×10-1M
[H+]=5,0×10-14M
pH = -log10([H+]=5,0 ×10−14) = 13,30
Часто задаваемые вопросы о гидроксиде бария
В. Является ли гидроксид бария основанием или кислотой?
Является ли гидроксид бария основанием или кислотой?
А. Гидроксид бария является стабильным основанием, таким как NaOH и KOH. Гидроксид бария представляет собой гидроксид металла группы IIA, который растворяется в воде, образуя хороший раствор основания, такой как гидроксиды металлов группы IA. Гидроксид бария полностью растворяется в воде и содержит ионы бария и гидроксильные ионы.
В. Является ли гидроксид бария водным раствором?
А. Гидроксид бария используется в аналитической химии для титрования слабых кислот, особенно органических кислот. В отличие от гидроксидов щелочных металлов, он образует прозрачные водные растворы, не содержащие карбонатов, поскольку карбонат бария нерастворим в воде.
В. Каков заряд Ba(OH)2?
А.
В группе 2 барий является атомом, поэтому у него два валентных электрона, а его заряд равен 2+. Гидроксид — это отрицательный многоатомный ион со значением 1, а 1 — это заряд.

 На
катоде
На
катоде ) окисляются анионы бескислородных
кислот: 2Сl— — 2е—= С12;
) окисляются анионы бескислородных
кислот: 2Сl— — 2е—= С12;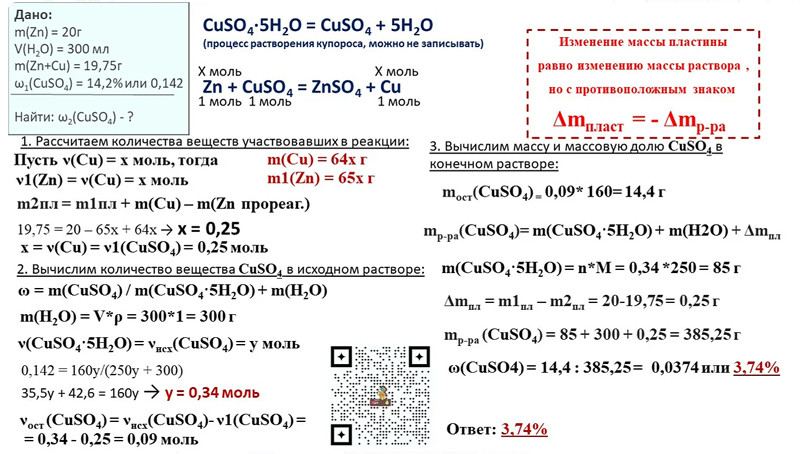
 к. ZnS и MgS нерастворимые соли
к. ZnS и MgS нерастворимые соли
 narod.ru/
narod.ru/ 
 2H 2 O(s)
2H 2 O(s)