Гидроксонитрат алюминия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химия — 8
7. Соли—состав, классификация, наименование и методы получения
По своему составу соли подразделяются в основном на 5 групп: нормальные, кислые, основные, двойные и смешанные соли.
Наименование солей. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов (или же сложными ионами, например, ионом аммония NH4+ ), называются нормальными солями. При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем — название металла.
| Нормальная соль | Название | Нормальная соль | Название | |
|---|---|---|---|---|
| Al2(SO4)3 | сульфат алюминия | Na2ZnO2 | цинкат натрия | |
| Ca(NO3)2 | нитрат кальция | KMnO4 | перманганат калия | |
| Na3PO4 | ортофосфат натрия | KClO3 | хлорат калия |
Если металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
|---|---|---|---|---|
| FeSO4 | сульфат железа (II) | Cu(NO3)2 | нитрат меди(II) | |
| FeCl3 | хлорид железа(III) | Cr2(SO4)3 | сульфат хрома(III) |
Соли, полученные в результате частичного замещения атомов водорода, относяшихся к основности кислот, атомами металлов (или сложными ионами, например, ионами аммония), называются кислыми солями. При наименовании кислых солей пользуются теми же правилами, как и при наименовании нормальных солей. Разница лишь в том, что вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, не замещенных металлом, с приставкой «гидро-», так, при двухатомах водорода, не замещенных металлом, «дигидро-», а следом дается название металла. При одном атоме водорода приставка «моно» не употребляется.
При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
|---|---|---|---|---|
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| NaHCO3 | гидрокарбонат натрия | NaH2PO4 | дигидроортофосфат натрия | |
| Fe(HSO4)2 | гидросульфат железа(II) | Ca(H2PO4)2 | дигидроортофосфат кальция | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония | |
Соли, полученные в результате частичного замещения кислотными остатками гидроксильных групп, относящихся к кислотным основаниям, называются основными солями. Основные соли называют так же, как и нормальные соли. К кислотным остаткам здесь добавляется приставка «гидроксо-» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно-» не употребляется.
Основные соли называют так же, как и нормальные соли. К кислотным остаткам здесь добавляется приставка «гидроксо-» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно-» не употребляется.
| Основные соли | ||||
|---|---|---|---|---|
| Гидроксосоли | Дигидроксосоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксодихлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия | |
| Cu(OH)NO3 | гидроксонитрат меди(II) | Fe(OH)2NO3 | дигидроксонитрат железа(III) | |
| Fe(OH)Cl | гидроксохлорид железа(II) | Cr(OH)2Br | дигидроксобромид хрома(III) | |
Ион-ионные взаимодействия повышают растворимость алюминия в щелочных суспензиях наногиббсита (α-Al(OH)3) с нитритом/нитратом натрия
У вас не включен JavaScript. Пожалуйста, включите JavaScript
чтобы получить доступ ко всем функциям сайта или получить доступ к нашему
страница без JavaScript.
Пожалуйста, включите JavaScript
чтобы получить доступ ко всем функциям сайта или получить доступ к нашему
страница без JavaScript.
Выпуск 8, 2020 г.
Из журнала:
Физическая химия Химическая физика
Ион-ионные взаимодействия повышают растворимость алюминия в щелочных суспензиях наногиббсита (α-Al(OH)
3 ) с нитритом/нитратом натрия† Матеуш
Дембовски,
* и Мишель М.
Снайдер, и Кэлвин Х.
Делегард, б Джейкоб Г.
Рейнольдс, с Трент Р. Грэм, а Сю-Вэнь
Ван, д Ян И.
Леви, и Стивен Р.
Баум, и Одета
Кафоку, и Мэтью С.
Фонтан, и Кевин М.
Россо, и Сью Б.
Кларк и и
Каролин И.
Пирс
* и
Грэм, а Сю-Вэнь
Ван, д Ян И.
Леви, и Стивен Р.
Баум, и Одета
Кафоку, и Мэтью С.
Фонтан, и Кевин М.
Россо, и Сью Б.
Кларк и и
Каролин И.
Пирс
* и
Принадлежности автора
* Соответствующие авторы
и Тихоокеанская северо-западная национальная лаборатория, Ричленд, Вашингтон, 99352, США
Электронная почта: mateusz. [email protected], [email protected]
[email protected], [email protected]
б Trade Wind Services, LLC, Ричленд, Вашингтон 99352, США
в Washington River Protection Solutions, LLC, Ричленд, Вашингтон 99352, США
д Окриджская национальная лаборатория, Ок-Ридж, Теннесси, 37831, США
Аннотация
rsc.org/schema/rscart38″> Несмотря на широкое промышленное значение, прогнозирование растворимости металлов в высококонцентрированных многокомпонентных водных растворах затруднено из-за плохо изученных взаимодействий ион-ион и ион-растворитель. Растворимость твердой фазы гидроксида алюминия в концентрированных растворах гидроксида натрия (NaOH) является одним из таких случаев, что имеет серьезные последствия для переработки руды, а также для обработки радиоактивных отходов, хранящихся на объектах наследия Министерства энергетики США, таких как Хэнфордский объект, штат Вашингтон. Растворимость гиббсита (α-Al(OH) 3 ) часто плохо прогнозируется, поскольку другие ионы влияют на активность гидроксидных (OH − ) и алюминатных (Al(OH) 4 −8) анионов. В настоящем исследовании мы систематически изучали влияние ключевых анионов, нитритов (NO 2 − ) и нитратов (NO 3 − 9 ), растворимость солей натрия. α-Al(OH) 3 в растворах NaOH, стараясь установить равновесие как при недостаточном, так и при перенасыщении. Быстрое уравновешивание стало возможным благодаря использованию высокочистого и кристаллического синтетического наногиббсита с четко определенным размером и формой частиц. Измеренные концентрации растворенного алюминия сравнивали с предсказанными с помощью модели растворимости α-Al(OH) 3 , полученной для простого Al(OH) 4 − /OH − − систем. Специфические анионные эффекты выражали в виде коэффициента усиления (Al enhc ), отражающего избыток растворенного алюминия. При 45 °C системы, содержащие NaNO 2 и NaNO 3 , показали значения Al enhc , равные 2,70 и 1,88, соответственно, что указывает на значительное улучшение. Растворы исследовали с помощью рамановской и высокопольной 27 Al ЯМР-спектроскопии, что указывает на специфические взаимодействия, включая Al(OH) 4 — –NA + СОБИТСЯ ИОНСКИЕ ПАРЯ 3 − ион-ионные взаимодействия.
α-Al(OH) 3 в растворах NaOH, стараясь установить равновесие как при недостаточном, так и при перенасыщении. Быстрое уравновешивание стало возможным благодаря использованию высокочистого и кристаллического синтетического наногиббсита с четко определенным размером и формой частиц. Измеренные концентрации растворенного алюминия сравнивали с предсказанными с помощью модели растворимости α-Al(OH) 3 , полученной для простого Al(OH) 4 − /OH − − систем. Специфические анионные эффекты выражали в виде коэффициента усиления (Al enhc ), отражающего избыток растворенного алюминия. При 45 °C системы, содержащие NaNO 2 и NaNO 3 , показали значения Al enhc , равные 2,70 и 1,88, соответственно, что указывает на значительное улучшение. Растворы исследовали с помощью рамановской и высокопольной 27 Al ЯМР-спектроскопии, что указывает на специфические взаимодействия, включая Al(OH) 4 — –NA + СОБИТСЯ ИОНСКИЕ ПАРЯ 3 − ион-ионные взаимодействия. Наблюдалась динамическая эволюция частиц α-Al(OH) 3 , включая рост и агломерацию, что свидетельствует о важности растворения/переосаждения в установлении равновесия. Эти исследования показывают, что неполная гидратация ионов в результате низкой активности воды в этих концентрированных электролитах приводит к: (i) повышенной реакционной способности гидроксид-иона по отношению к α-Al(OH) 3 ; (ii) повышенные концентрации Al(OH) 4 − в растворе; и (iii) более сильные ион-ионные взаимодействия, которые стабилизируют пересыщенные растворы. Эта информация о механизмах перенасыщения α-Al(OH) 3 необходима для более энергоэффективных технологий обработки алюминия, включая переработку миллионов галлонов Al(OH) 4 − – богатые высокоактивные радиоактивные отходы.
Наблюдалась динамическая эволюция частиц α-Al(OH) 3 , включая рост и агломерацию, что свидетельствует о важности растворения/переосаждения в установлении равновесия. Эти исследования показывают, что неполная гидратация ионов в результате низкой активности воды в этих концентрированных электролитах приводит к: (i) повышенной реакционной способности гидроксид-иона по отношению к α-Al(OH) 3 ; (ii) повышенные концентрации Al(OH) 4 − в растворе; и (iii) более сильные ион-ионные взаимодействия, которые стабилизируют пересыщенные растворы. Эта информация о механизмах перенасыщения α-Al(OH) 3 необходима для более энергоэффективных технологий обработки алюминия, включая переработку миллионов галлонов Al(OH) 4 − – богатые высокоактивные радиоактивные отходы.- Эта статья является частью тематического сборника:
ГОРЯЧИЕ статьи PCCP 2019 г.

Варианты загрузки Пожалуйста, подождите…
Дополнительные файлы
- Дополнительная информация PDF (796 КБ)
Информация о товаре
- ДОИ
- https://doi.org/10.1039/C9CP05856G
- Тип изделия
- Бумага
- Отправлено
- 28 окт. 2019
- Принято
- 10 дек.
 2019
2019 - Впервые опубликовано
- 13 дек 2019
Скачать цитату
Физ. хим. хим. физ. , 2020, 22 , 4368-4378
BibTexEndNoteMEDLINEProCiteReferenceManagerRefWorksRIS
Доступна авторская версия
Скачать авторскую версию (PDF)
Разрешения
Запросить разрешения
Социальная деятельность
Получение данных из CrossRef.
Загрузка может занять некоторое время.
Прожектор
Объявления
Нитрат алюминия | Сульфат алюминия
Нитрат алюминия представляет собой соединение, представляющее собой соль азотной кислоты и алюминия. В нормальных условиях нитрат алюминия существует в виде кристаллогидрата. Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.Физические свойства нитрата алюминия
У этого соединения много различных физических свойств. Например, нитрат алюминия имеет молярную массу, равную 212,996 г/моль. Что касается плотности соединения, то она составляет 1,401 г/см3. Кроме того, как и любое другое соединение, нитрат алюминия имеет температуры плавления и кипения, которые составляют 72,8°С и 135°С соответственно.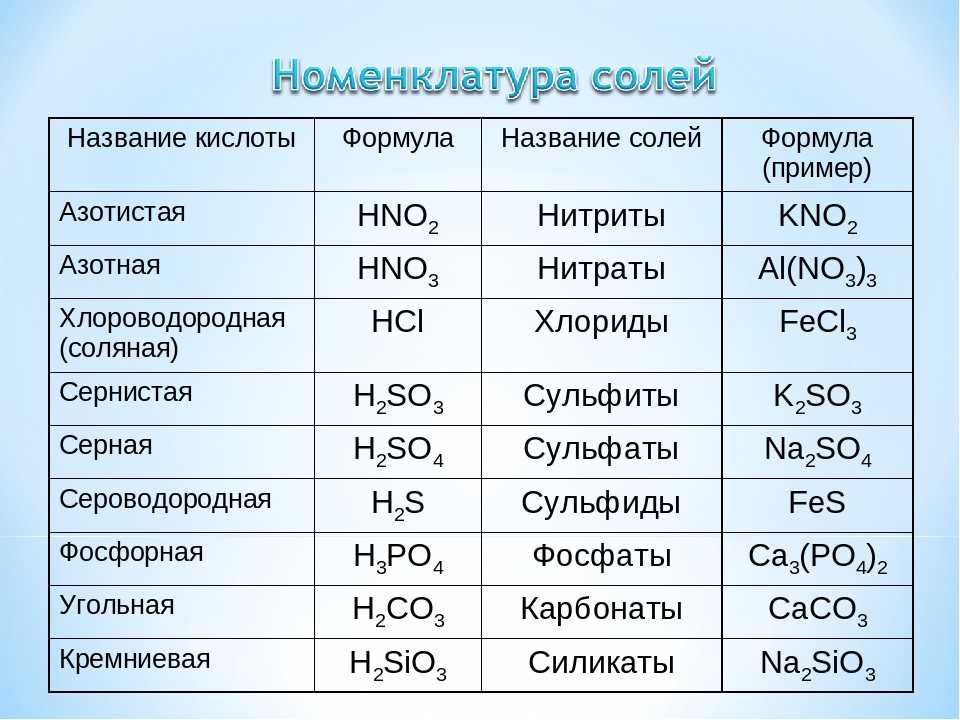 Растворимость нитрата алюминия известна в различных жидкостях. Нитрат алюминия не имеет запаха, а его молекулярная масса составляет 375,13. Химическая формула нитрата алюминия – Al(NO₃)₃.
Растворимость нитрата алюминия известна в различных жидкостях. Нитрат алюминия не имеет запаха, а его молекулярная масса составляет 375,13. Химическая формула нитрата алюминия – Al(NO₃)₃.
Получение нитрата алюминия
Вы не сможете легко получить нитрат алюминия, просто объединив азотную кислоту и алюминий. В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
Растворимость нитрата алюминия в различных веществах
Нитрат алюминия пытались растворить в таких веществах, как вода, метанол, этанол и этиленгликоль. Нитрат алюминия растворим во всех этих веществах. Что касается воды, он растворяется в количестве 160 г/100 мл при 100 °C. В случае метанола растворимый показатель составляет 14,45 г/100 мл. Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Что касается воды, он растворяется в количестве 160 г/100 мл при 100 °C. В случае метанола растворимый показатель составляет 14,45 г/100 мл. Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Применение нитрата алюминия
Это соединение представляется весьма ценным и имеет множество важных применений. Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Нитрат алюминия используется для извлечения урана. Процесс добычи урана заключается в извлечении урана из земли. Учитывая, насколько важен уран, без него очень сложно представить современный мир. Нитрат алюминия используется для этого процесса извлечения урана. Поэтому проведение экстракции было бы намного сложнее без нитрата алюминия.
Наверное, каждый человек нашего века знает об антиперспирантах и области их применения. Антиперспиранты относятся к группе дезодорантов и препятствуют потоотделению, а также влияют на запах тела человека. Обычно антиперспиранты наносят под руки. Нитрат алюминия является незаменимым компонентом антиперспирантов, производство которых невозможно без нитрата алюминия.
Соединение нитрата алюминия также широко используется в качестве компонента ингибиторов коррозии. Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Другой важной областью применения нитрата алюминия является крашение, где он используется в качестве протравы. Морилка – это специальное средство, которое служит определенной цели, заключающейся в связывании красителей с материалами. Когда дело доходит до нитрата алюминия, он специально используется с хлопком. Без использования нитрата алюминия красители просто не будут связываться с хлопком. По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
Когда дело доходит до нитрата алюминия, он специально используется с хлопком. Без использования нитрата алюминия красители просто не будут связываться с хлопком. По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
Нефть и масла также очищаются нитратом алюминия. Большое значение в промышленности имеют процессы переработки нефти и нефти. Например, благодаря такой переработке сырая нефть может быть преобразована в бензин или газолин, LPG (сжиженный нефтяной газ), керосин, дизельное топливо, мазут и реактивное топливо. И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И, конечно же, азотнокислый алюминий, как химическое соединение, широко используется для демонстрации студентам и учащимся различных типов химических реакций. При применении нитрата алюминия эти реакции приобретают действительно интересный и яркий вид. Видя такие яркие реакции, студенты и школьники лучше понимают процессы, происходящие в химии, становятся более умными и образованными.
Видя такие яркие реакции, студенты и школьники лучше понимают процессы, происходящие в химии, становятся более умными и образованными.
Что касается других гидратированных и негидратированных типов нитратов алюминия, они также находят широкое применение в промышленности. Использование, которое выделяется среди всех, заключается в следующем. Соли нитрата алюминия используются для производства глинозема, который затем используется для производства различных видов изоляционной бумаги. Электронно-лучевая трубка состоит из различных элементов, а в ее нагревательных элементах используется нитрат алюминия. Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Хорошо известно, что различные соединения широко используются в области медицины, и в этой области также предпринимались попытки применить нитрат алюминия. Однако на данный момент его применяли только к крысам во время различных тестов. Результаты этих тестов были разными, включая как эффективное, так и неэффективное использование нитрата алюминия по отношению к крысам. Что касается применения нитрата алюминия для человека, то оно еще не применялось. В то же время исследования в этой области продолжаются и, возможно, когда-нибудь нитрат алюминия будет применяться по отношению к человеку. Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Результаты этих тестов были разными, включая как эффективное, так и неэффективное использование нитрата алюминия по отношению к крысам. Что касается применения нитрата алюминия для человека, то оно еще не применялось. В то же время исследования в этой области продолжаются и, возможно, когда-нибудь нитрат алюминия будет применяться по отношению к человеку. Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Меры предосторожности при пожаре
Несмотря на то, что нитрат алюминия является легковоспламеняющимся соединением, он может вызвать некоторые проблемы, связанные с пожаром, поэтому при работе с ним необходимо соблюдать некоторые меры предосторожности. При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой.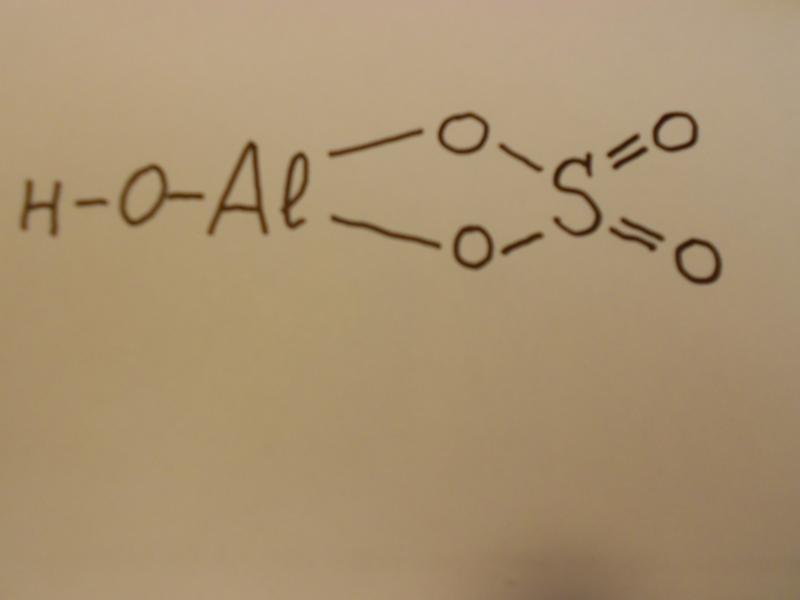 В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
Нитрат алюминия следует хранить вдали от канализации и источников воды. Следует избегать контакта нитрата алюминия с пламенем, искрами и различного рода возгораниями.
Как защитить себя при работе с нитратом алюминия?
Хотя это вещество не очень опасно, вы должны действовать надлежащим образом, чтобы защитить себя при работе с ним. Например, при работе с нитратом алюминия следует надевать средства защиты. Защитное снаряжение включает лицевой щиток и защитные очки. Кроме того, следует также использовать перчатки из резины и пылезащитные респираторы.
Если вы по какой-то причине проглотили это вещество в большой дозе, у вас будут серьезные осложнения со здоровьем, включая раздражение желудка, рвоту, понос и тошноту. В случае любого из них в результате приема нитрата алюминия следует обратиться к врачу.


 2019
2019