Гидроксид алюминия — Википедия
Материал из Википедии — свободной энциклопедии
 Гидроксид алюминия
Гидроксид алюминияГидрокси́д алюми́ния — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3+3NaOH⟶Al(OH)3↓+3NaCl{\displaystyle {\mathsf {AlCl_{3}+3NaOH\longrightarrow Al(OH)_{3}\downarrow +3NaCl}}}
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с карбонатами щелочных металлов:
- 2AlCl3+3Na2CO3+3h3O→2Al(OH)3↓+6NaCl+3CO2{\displaystyle {\mathsf {2AlCl_{3}+3Na_{2}CO_{3}+3H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +6NaCl+3CO_{2}}}}
Видео по теме
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- Al(OH)3+3HCl⟶AlCl3+3h3O{\displaystyle {\mathsf {Al(OH)_{3}+3HCl\longrightarrow AlCl_{3}+3H_{2}O}}}
- В растворах:
- Al(OH)3+NaOH⟶Na[Al(OH)4]{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\longrightarrow Na[Al(OH)_{4}]}}}
- При сплавлении:
- Al(OH)3+NaOH→NaAlO2+2h3O{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\rightarrow NaAlO_{2}+2H_{2}O}}}
При нагревании разлагается:
- 2Al(OH)3→Al2O3+3h3O{\displaystyle {\mathsf {2Al(OH)_{3}\rightarrow Al_{2}O_{3}+3H_{2}O}}}
С растворами аммиака не реагирует.
Безопасность
ЛД50
>5000 мг/кг (крысы, орально)
NFPA 704
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества, в медицине, в качестве антацидного средства[1], в качестве адъюванта при изготовлении вакцин[2]. Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов[3].
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Гидроксид алюминия — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
 Гидрокси́д алюми́ния, вещество с формулой Al(OH)3 (а также H3AlO3, HAlO2 и [Al2O3 • H2O] • nH2OК:Википедия:Статьи без источников (тип: не указан)[источник не указан 1252 дня]) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Гидрокси́д алюми́ния, вещество с формулой Al(OH)3 (а также H3AlO3, HAlO2 и [Al2O3 • H2O] • nH2OК:Википедия:Статьи без источников (тип: не указан)[источник не указан 1252 дня]) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
<math>\mathsf{AlCl_3 + 3NaOH \longrightarrow Al(OH)_3 \downarrow + 3NaCl}</math>
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с карбонатами щелочных металлов:
- <math>\mathsf{2AlCl_3 + 3Na_2CO_3 + 3H_2O \rightarrow 2Al(OH)_3\downarrow + 6NaCl + 3CO_2}</math>
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- <math>\mathsf{Al(OH)_3 + 3HCl \longrightarrow AlCl_3 + 3H_2O}</math>
- В растворах:
- <math>\mathsf{Al(OH)_3 + NaOH \longrightarrow Na[Al(OH)_4]}</math>
- При сплавлении:
- <math>\mathsf{Al(OH)_3 + NaOH \rightarrow NaAlO_2 + 2H_2O}</math>
При нагревании разлагается:
- <math>\mathsf{2Al(OH)_3 \rightarrow Al_2O_3 + 3H_2O}</math>
С растворами аммиака не реагирует.
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества, в медицине, в качестве антацидного средства[1], в качестве адъюванта при изготовлении вакцин[2]. Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
Напишите отзыв о статье «Гидроксид алюминия»
Примечания
- ↑ [lecarstva.com/drugs/dr0014.htm Гидроксид алюминия. Справочник лекарственных средств.]
- ↑ Ярилин А.А., Основы иммунологии: Учебник. — М.: Медицина, 1999. — С. 608. — ISBN 5-225-02755-5.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Отрывок, характеризующий Гидроксид алюминия
«Ничего нового, только что солдаты позволяют себе грабить и воровать. 9 октября».«Воровство и грабеж продолжаются. Существует шайка воров в нашем участке, которую надо будет остановить сильными мерами. 11 октября».]
«Император чрезвычайно недоволен, что, несмотря на строгие повеления остановить грабеж, только и видны отряды гвардейских мародеров, возвращающиеся в Кремль. В старой гвардии беспорядки и грабеж сильнее, нежели когда либо, возобновились вчера, в последнюю ночь и сегодня. С соболезнованием видит император, что отборные солдаты, назначенные охранять его особу, долженствующие подавать пример подчиненности, до такой степени простирают ослушание, что разбивают погреба и магазины, заготовленные для армии. Другие унизились до того, что не слушали часовых и караульных офицеров, ругали их и били».
«Le grand marechal du palais se plaint vivement, – писал губернатор, – que malgre les defenses reiterees, les soldats continuent a faire leurs besoins dans toutes les cours et meme jusque sous les fenetres de l’Empereur».
Войско это, как распущенное стадо, топча под ногами тот корм, который мог бы спасти его от голодной смерти, распадалось и гибло с каждым днем лишнего пребывания в Москве.
Но оно не двигалось.
Оно побежало только тогда, когда его вдруг охватил панический страх, произведенный перехватами обозов по Смоленской дороге и Тарутинским сражением. Это же самое известие о Тарутинском сражении, неожиданно на смотру полученное Наполеоном, вызвало в нем желание наказать русских, как говорит Тьер, и он отдал приказание о выступлении, которого требовало все войско.
Убегая из Москвы, люди этого войска захватили с собой все, что было награблено. Наполеон тоже увозил с собой свой собственный tresor [сокровище]. Увидав обоз, загромождавший армию. Наполеон ужаснулся (как говорит Тьер). Но он, с своей опытностью войны, не велел сжечь всо лишние повозки, как он это сделал с повозками маршала, подходя к Москве, но он посмотрел на эти коляски и кареты, в которых ехали солдаты, и сказал, что это очень хорошо, что экипажи эти употребятся для провианта, больных и раненых.
wiki-org.ru
Алюминий гидроксид — Справочник химика 21
Чем по химическим свойствам отличаются оксид бора от оксида алюминия гидроксид бора от гидроксида алюминия У соединений какого элемента сильнее выражены кислотные свойства Напишите уравнения соответствующих реакций. [c.128]Алюминий —> гидроксид алюминия [c.299]
Активный оксид алюминия высокой чистоты с большой удельной поверхностью (до 500 м /г) может быть получен гидролизом алюминийорганических соединений. Образующийся при гидролизе алкоголятов алюминия гидроксид алюминия подвергают термической обработке с получением активного оксида алюминия.
Напишите формулы таких соединений нитрата натрия, сульфата меди (II), дигидрофосфата кальция, оксида железа (III), сульфита магния, карбоната натрия, сульфида алюминия, гидроксида магния, оксида хрома (VI). [c.22]
Гидроксид алюминия Гидроксид аммония Гидроксид бария Гидроксид ванадия (/ /) Гидроксид железа (II) Гидроксид железа (III) [c.141]
Оксид алюминия, гидроксид кальция. Крахмал, силикагели, кизельгур, карбонат кальция, сахар, тальк [c.152]
Первичные минералы в условиях земной поверхности неустойчивы и под действием сил выветривания переходят в более устойчивые соединения — вторичные минералы. Процесс выветривания протекает под влиянием как чисто физических (колебания температуры, ветер, движущая сила воды), так и химических и биологических факторов. В результате этого из первичных минералов могут образоваться вторичные минералы простого состава гидроксиды железа (II) и (III), алюминия, гидроксид кремния и некоторые другие соединения. [c.36]
А1(0Н)з (алюминия гидроксид, алюминия гидроокись) [c.286]
Оксид алюминия, гидроксид кальция, крахмал, силикагели, кизельгур, карбонат кальция, тальк, сахар [c.60]
А1(ОН)з (алюминия гидроксид, алюминия гидроокись, гиббсит) [c.286]
Алюминия гидроксид тонко-дисперсный для ПВХ Композиций [c.196]
Химическое наименование. Алюминия гидроксид рег. № AS 21645—51—2. [c.15]
Хранение. Алюминия гидроксид следует хранить в плотно укупоренной таре. [c.15]
Общее требование. Алюминия гидроксид содержит не менее 71,9 иле более 94,9% А1(0Н)з- [c.15]
А1(ОН)з (алюминия гидроксид, алюминия гидроокись, гиббсит) А1(0Н)з + Н2О = IT + А1(0Н) [c.286]
После промежутка времени достаточного для получения фосфата кальция добавляют требуемое количество щелочного материала, например гидроксида натрия или калия, для растворения присутствующих в осадке соединений галлия и алюминия. Гидроксид добавляется в количестве, достаточном для создания постоянного значения pH = 11. [c.160]
Носители для осадочной хроматографии — силикагель, оксид алюминия, гидроксид алюминия, сульфат бария, крахмал, песок и др. Целесообразность применения того или другого носителя в каждом отдельном случае зависит от,характера разделяемых веществ. [c.202]
Золь гидроксида алюминия. Гидроксид алюминия получают при взаимодействии хлорида алюминия с карбонатом аммония. Для этого 5 мл приблизительно 30%-ного раствора AI I3 разбавляют водой до 100 мл. К этому раствору прибавляют по каплям, при энергичном встряхивании, около 3 мл 20%-ного раствора (Nh5)2 Os до тех пор, пока выпадающий осадок гидроксида алюминия растворяется уже с трудом. При этом образуется бесцветный опалесцирующий золь гидроксида алюминия. [c.83]
А1(0Н)з (алюминия гидроксид, алюминия гидроокись, байерит) А1(ОН)з (алюминия гидроксид, алюминия гидроокись, байерит) А1(0Н)з + Н2О = РГ + А1(0Н) [c.286]
В качестве адсорбентов обычно используют неорганические вещества — алюминия гидроксид, алюминия фосфат, кальция [c.468]
Очищенный сорбированный на алюминия гидроксиде столбнячный анатоксин применяют для ревакцинации людей, являющихся затем донорами специфического Ig. Схема его выделения аналогична той, которая описана ранее для IgG. Выпускают противостолбнячный Ig в жидком виде в ампулах. [c.592]
Для улучшения свойств лакокрасочных материалов и эксплуатационных характеристик лакокрасочных покрытий (прочности, влаго-, свето- и термостойкости), а также для экономии пигментов в состав красок вводят наполнители (25—50% от массы пигмента). Наполнителями служат неорганические природные (мел, слюда, тальк, каолин) и синтетические (оксид алюминия, гидроксид алюминия, карбонат бария) вещества. Наиболее часто используют белые наполнители серые и цветные наполнители находят ограниченное применение. Укрывистость пигментов при введении наполнителей практически не ухудшается. [c.213]
Алюминия гидроксид (/Сз) А ммиака раствор А1(0Н)з 1,38. 10- 8,86 [c.118]
Алюминий гидроксид порошок Алюминиевое покрытие Алюминпеиый сплав 245Т Асбестовая бумага Асбестовый картон Асбестовая ткань Асбестовый шифер АРМКО (железо) [c.257]
При альдольной конденсации а-атом углерода одной молекулы альдегида или кетона присоединяется к карбонильной группе другой молекулы, [375]. Чаще всего в качестве основания используют ОН-, хотя иногда применяются и более сильные основания, например трет-бутилат алюминия. Гидроксид ион — недостаточно сильное основание, чтобы практически все молекулы альдегида или кетона можно было превратить в соответствующий енолят-ион, т. е. равновесие реакции [c.381]
Оборудование и реактивы к опытам 10.66 10.74. Штатив с пробирками. Две большие пробирки. Горелка. Штатив с лапкой. Деревянная держалка для пробирки. Центрифуга. Воронка диаметром 10 сМ. Фарфоровая чашка. Кристаллизагор. Керамическая плитка. Тигель. Стеклянная палочка. Платиновая или нихромовая провтэлоч-ка. Промывалка с дистиллированной водой. Фильтровальная бумага. Лучины. Растворы серная кислота (1 1), уксусная кислота (2 н.), соляная кислота (2 н.), гидроксид аммония (2 н.), гидрофосфат натрия, хлорид магния, молибденовая жидкость, нитрат кобальта (П), нитрат хрома (П1), сульфат меди (И), хлорид бария, сульфат железа (П) свежеприготовленный, сульфат алюминия, гидроксид кальция, сероуглерод. Сухие реактивы гидрофосфат натрия, дигидрофосфат натрия, фосфат натрия, фосфоритная мука. Красный и белый фосфор. Нейтральный лакмус. рН-индикаторная бумага. Препараты фосфорных удобрений для демонстрации. [c.194]
АЛЮМИНИЯ ГИДРОКСИД А1(ОН)з, бесцв, твердое в-во. Известны четыре кристаллич модификации (см. табл)-моноклинный (у) и триклинный у ) гиббсит, или гидрар- [c.118]
Алюминия гидроксид. 1. Растворяют 100 г сульфата алюминия AI2(804)3 I8h3O в 150 мл дистиллированной воды и фильтруют. Фильтрат нагревают до 75—80°С и вливают тонкой струйкой при перемешивании в горячий раствор 63 г гидроксида натрия NaOH в 150 мл воды. Полученный раствор выдерживают при 70—80 °С в течение 20— 30 мин и фильтруют через двойной складчатый фильтр до полной прозрачности фильтрата. Осадок на фильтре промывают 30—50 мл горячей воды. [c.11]
Дегалогенирующими реагентами являются щелочные металлы, медь, цинк, магний, алюминий, гидроксиды и иодиды щелочных металлов, растворенные в ацетоне или спирте, например [c.146]
Для установления возможности использования в данном синтезе гетерогенных катализаторов, применение которых позволило бы исключить из процесса стадию нейтрализации реакционной массы, а также необходимость утилизации образующихся сточных вод и солей, были испытаны промышленные катализаторы анионит АВ-17, силикагель КСК № 5, гидроксид алюминия, гидроксид кальция (ХП-И), а также катализаторы, приготовленные на основе гидроксидов магния, кальция и бария в смеси с гидроксидом алюминия. Наибольшей активностью обладал катализатор состава 40% ВаО, 60% AI2O3. В табл. 3.8 представлены данные о влиянии скорости подачи ацетона на его конверсию и селективность превращения в ДАС при 10 °С. Содержание воды в исходном ацетоне не должно превышать [c.247]
Сорбенты минерального происхождения — слабокислотные ка-, тиониты или слабоосновные аниониты. Наиболее часто применяются в качестве катионитов оксид алюминия, щелочной силикагель и различные природные алюмосиликаты, фосфат циркония. В качестве анионитов используют оксид алюминия, гидроксид циркония и др. Катионит на основе оксида алюминия готовят растворением металлического алюминия в растворе ЫаОН, последующим осаждением с помощью СОг и прокаливанием выделенного осадка. На поверхности прокаленного А Оз алюминат натрия образует соединение состава (АЬОз) НаАЮг. Подвижные ионы натрия способны к замещению на другие катионы, содержащиеся в растворе [c.196]
Ионообменные сорбенты минерального происхождения. Сорбенты минерального происхождения представляют собой слабокислотные катиониты или слабоосновные аниониты. Наиболее распространены катиониты оксид алюминия, щелочной силикегель и различные природные алюмосиликаты, фосфат циркония. В качестве анионитов можно использовать оксид алюминия, гидроксид циркония и др. [c.299]
Химический тренажер. Ч.1 (1986) — [ c.28 , c.72 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.28 ]
Справочник Химия изд.2 (2000) — [ c.308 ]
Вредные химические вещества Неорганические соединения элементов 1-4 групп (1988) — [ c.206 , c.208 , c.211 , c.213 , c.215 , c.219 , c.221 , c.476 ]
Неорганическая химия (1974) — [ c.339 ]
Неорганическая химия Издание 2 (1976) — [ c.393 ]
Общая химия 1982 (1982) — [ c.637 ]
Общая химия 1986 (1986) — [ c.617 ]
Общая и неорганическая химия (1981) — [ c.340 ]
Неорганическая химия (1978) — [ c.292 ]
Общая химия Издание 18 (1976) — [ c.625 ]
Общая химия Издание 22 (1982) — [ c.637 ]
Общая и неорганическая химия (1994) — [ c.181 , c.192 , c.353 ]
Справочник по общей и неорганической химии (1997) — [ c.50 , c.57 , c.79 , c.137 , c.138 ]
Неорганическая химия (1994) — [ c.224 ]
Курс общей химии (0) — [ c.267 , c.268 ]
Курс общей химии (0) — [ c.267 , c.268 ]
Предмет химии (0) — [ c.267 , c.268 ]
chem21.info
Гидроксид алюминия Википедия
 Гидроксид алюминия
Гидроксид алюминияГидрокси́д алюми́ния — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Получение[ | код]
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3+3NaOH⟶Al(OH)3↓+3NaCl{\displaystyle {\mathsf {AlCl_{3}+3NaOH\longrightarrow Al(OH)_{3}\downarrow +3NaCl}}}
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с карбонатами щелочных металлов:
- 2AlCl3+3Na2CO3+3h3O→2Al(OH)3↓+6NaCl+3CO2{\displaystyle {\mathsf {2AlCl_{3}+3Na_{2}CO_{3}+3H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +6NaCl+3CO_{2}}}}
Физические свойства[ | код]
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства[ | код]
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
ru-wiki.ru
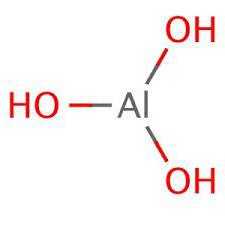
Формула Гидроксида алюминия структурная химическая
Структурная формула
 |
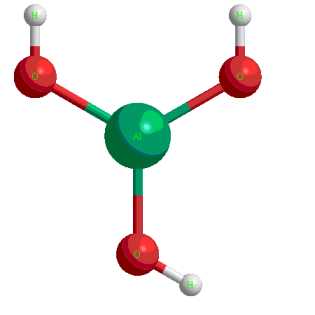 |
Истинная, эмпирическая, или брутто-формула: AlH3O3
Химический состав Гидроксида алюминия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Al | Алюминий | 26,092 | 1 | 33,8% |
| H | Водород | 1,008 | 3 | 3,9% |
| O | Кислород | 15,999 | 3 | 62,2% |
Молекулярная масса: 77.113
Гидрокси́д алюми́ния, вещество с формулой Al(OH)3 — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами..
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка. Гидроксид алюминия выпадает в виде белого студенистого осадка. Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с карбонатами щелочных металлов.
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества, в медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин. Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
formula-info.ru
Оксид и гидроксид алюминия
Оксид и гидроксид алюминия, их амфотерность
Важнейшими соединениями алюминия является алюминий оксид и алюминий гидроксид.
Алюминий оксид Al2O3 — белая тугоплавкая кристаллическое вещество, нерастворимое в воде. В лабораторных условиях алюминий оксид добывают сжиганием алюминия или термическим разложением алюминий гидроксида:
4Al + 3O2 → 2Al2O3
2Al(OH)3 Al2O3 + 3h3O.
По химическим свойствам алюминий оксид являются амфотерными. Он реагирует с кислотами, проявляя свойства основных оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3h3O.
Реагируя с лугами, он проявляет свойства кислотных оксидов. В растворах щелочей образуются комплексные соединения:
Al2O3 + 2KOH + 3h3O = 2K [Al(OH)4].
При сплавлении образуются соли метаалюминиевои кислоты, например, метаалюминат калия:
Al2O3 + 2KOH 2KAlO2 + h3O.
Естественную кристаллическую модификацию алюминий оксида (корунд) применяются в различных областях науки и производства. Рубины, например, является материалом для изготовления рабочих камней точных механизмов. Кристаллы корунда — рабочие тела лазеров. Рубины и сапфиры используют для отделки ювелирных изделий. Алюминий оксид является главной составляющей наждака — абразивного материала. Тугоплавкость и коррозионная стойкость алюминий оксида предопределяет его применение для изготовления термостойкого химической посуды, кирпича для кладки стекловаренных печей.
Алюминий гидроксид Al(OH)3 — это нерастворимое в воде кристаллическое вещество белого цвета. В лаборатории алюминий гидроксид добывают из растворимых солей алюминия при их взаимодействии с растворами щелочей, например:
AlCl3 + 3КOH = Al(OH)3 ↓ + 3КCl.
Полученный алюминий гидроксид имеет вид студенистого осадка.
Алюминий гидроксид проявляет амфотерные свойства и растворяется как в кислотах, так и в щелочах:
Al(OH)3 + 3HCl → AlCl3 + 3h3O
Al(OH)3 + NaOH → Na[Al(OH)4].
При сплавлении алюминий гидроксида с натрий гидроксидом образуется натрий метаалюминат:
Al(OH)3 + NaOH NaAlO2 + 2h3O.
Способность алюминий гидроксида реагировать с кислотами используют в терапии. Он входит в состав лекарственных препаратов, используемых для снижения кислотности и уменьшение изжоги.
Итак, главными особенностями алюминий оксида и алюминий гидроксида является их амфотерными свойствами.
xn—-7sbfhivhrke5c.xn--p1ai
Гидроксид алюминия — это… Что такое Гидроксид алюминия?
Гидроксид алюминияГидрокси́д алюми́ния, вещество с формулой (а также , и ) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
Свежеосаждённый гидроксид алюминия способен взаимодействовать с:
Высушенный гидроксид алюминия представляет собой белое кристаллическое вещество, нерастворимое в кислотах и щёлочах.
Отдельные случаи взаимодействия гидрооксида алюминия с: гидрооксидом рубидия
Al(OH)3 + 3RbOH (водн. р-р) — Rb3[Al(OH)6]
оксидом рубидия
2Al(OH)3 + Rb2O (сплав.) — 2RbAlO2 + 3H2O
гидроксидом цезия
Al(OH)3 + CsOH (сплав.) — CsAlO2 + 2H2O
карбонатом цезия
2Al(OH)3 + Cs2CO3 (сплав.) — 2CsAlO2 + 3H2O + CO2
Называется орто- и метааллюминевая кислота.
Применение
Используется при очистке воды, так как обладает способностью поглощать (адсорбировать) различные вещества, в медицине, в качестве антацидного средства,[1] в качестве адъюванта при изготовлении вакцин.[2] Применяется в качестве антипирена (подавителя горения) в пластиках и других материалах.
Примечания
dvc.academic.ru
