Ацетат натрия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Работа 2
Определение содержания гидроксида и карбоната натрия при их
Совместном присутствии
I. Цель работы
Ознакомление с методикой определения содержания гидроксида и карбоната натрия при совместном присутствии титрованием с двумя индикаторами.
Расчет общей щелочности раствора.
П. Основные теоретические положения
Гидроксид натрия легко поглощает из воздуха диоксид углерода, частично превращаясь при этом в карбонат натрия:
2NaOH + СО2 = Na2CO3 + Н2О
Гидроксид натрия является одним из основных продуктов химической промышленности и широко применяется как в самой химической промышленности, так и во многих других производствах.
Поэтому
определение содержания гидроксида и
карбоната натрия при
их совместном присутствии является
широко распространенной задачей
в практике заводских лабораторий.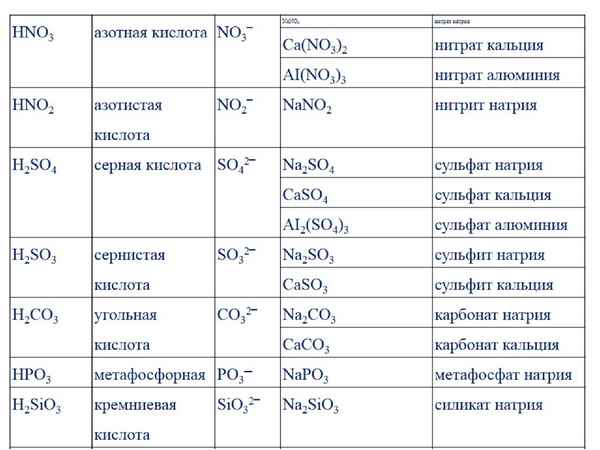
Наряду с задачей определения содержания каждого из указанных веществ в отдельности в аналитическом контроле технологических процессов в химической промышленности существует задача определения общей щелочности.
Общая щелочность — это сумма масс гидроксида натрия, присутствующего в растворе, и гидроксида натрия, эквивалентного имеющемуся в этом растворе количеству карбоната натрия.
Титрование раствора, содержащего оба названных компонента, хлороводородной кислотой можно рассматривать как двустадийный процесс:
NaOH + Na2CO3 + 2 НС1 = 2NaCl + NaHCO3 + H2O
NaHCO3 + HC1 = NaCl + H2CO3
Следовательно,
первая стадия соответствует оттитровыванию
всего гидроксида
натрия и половины исходного количества
карбоната натрия. По
окончании первой стадии реакции в
растворе присутствует гидрокарбонат
натрия и хлорид натрия. рН раствора
примерно равен рН
~ 8,3. По окончании второй стадии реакции
в растворе присутствует угольная
кислота, и рН раствора составляет около
рН ~ 4. Поэтому первую
точку конца титрования устанавливают
по фенолфталеину, а
вторую
— по метиловому
оранжевому.
рН раствора
примерно равен рН
~ 8,3. По окончании второй стадии реакции
в растворе присутствует угольная
кислота, и рН раствора составляет около
рН ~ 4. Поэтому первую
точку конца титрования устанавливают
по фенолфталеину, а
вторую
— по метиловому
оранжевому.
Точность этого метода с использованием двух индикаторов не превышает 1%, поскольку в процессе титрования раствор может поглощать диоксид углерода из воздуха и часть гидроксида будет превращаться в карбонат натрия. Чтобы уменьшить погрешности при определении используют несколько приемов: разбавление раствора проводят прокипяченной дистиллированной водой, охлажденной в сосуде с поглотительной трубкой, заполненной натронной известью; после перенесения аликвотной части анализируемого раствора в колбу для титрования раствор титруют сразу, без промедления.
III. Порядок выполнения работы
Выполнение работы включает следующие этапы:
Получение у преподавателя исследуемой пробы, приготовление из нее анализируемого раствора; последовательное проведение титрования 4 аликвотных частей раствора с двумя индикаторами.

Расчет массы гидроксида и карбоната натрия в исследуемом растворе.
Расчет общей щелочности раствора.
Расчет абсолютной и относительной ошибок определения.
1. Проведение титрования исследуемого раствора
Методика определения
Анализируемый раствор количественно переносят в мерную колбу вместимостью 50 — 100 мл, доливают до метки дистиллированной водой, перемешивают и, промыв пипетку небольшим количеством раствора, отбирают ею 10 мл в коническую колбу для титрования. Добавляют к раствору 2 капли индикатора фенолфталеина и сразу же титруют фиолетовый раствор до обесцвечивания.
Записывают показания шкалы бюретки в рабочий журнал в таблицу по форме 3.
Добавляют
в обесцвеченный раствор одну каплю
метилового оранжевого
и продолжают
титрование до перехода желтой окраски раствора
в розовую.
Записывают второе показание шкалы
бюретки в таблицу
по форме 3. Обратите
внимание: заполнение бюретки проводят
только перед началом титрования, один
раз на одну аликвотную
часть раствора; результаты титрования
с обоими индикаторами
отмечаются от одной нулевой точки. Новое заполнение
бюретки проводится только перед началом
титрования следующей аликвотной части
раствора.
Обратите
внимание: заполнение бюретки проводят
только перед началом титрования, один
раз на одну аликвотную
часть раствора; результаты титрования
с обоими индикаторами
отмечаются от одной нулевой точки. Новое заполнение
бюретки проводится только перед началом
титрования следующей аликвотной части
раствора.
Форма 3
Результаты титрования исследуемого раствора
Индикатор | Показания шкалы бюретки | ||||
h1 | h2 | h3 | h4 | hср | |
Фенолфталеин | hср. | ||||
Метилораж | hср.м.о. | ||||
Закончив титрование первой пробы, отбирают из анализируемого раствора вторую аликвотную часть и точно так же титруют ее, последовательно используя два индикатора.
Оттитровав 4 аликвотные части раствора, сравнивают результаты параллельных титрований: они не должны расходиться более, чем на 0,1 мл для макробюретки и на 0,02 мл для полумикробюретки.
2. Расчет массы гидроксида и карбоната натрия в исследуемом растворе
По усредненным данным показаний шкалы бюретки (форма 3) рассчитайте объемы хлороводородной кислоты, израсходованные на титрование исследуемого раствора с фенолфталеином V1 и с метиловым
оранжевым
V2. При этом необходимо учесть вместимость
мерной колбы Vк и вместимость пипетки Vn
При этом необходимо учесть вместимость
мерной колбы Vк и вместимость пипетки Vn
V1 = (hcp.ф. ∙ Vк) /Vп и V2 = (hср.мо.∙ Vк) / Vп .
Объем V1 соответствует объему кислоты, израсходованной на титрование всего гидроксида натрия и половины карбоната натрия; объем V2 — объем кислоты, израсходованной на титрование всего гидроксида и всего карбоната натрия.
Тогда разность этих величин V3 = V2 − V1 соответствует объему хлороводородной кислоты, израсходованной на титрование половины количества карбоната натрия в исследуемом растворе.
Объем кислоты V4, пошедшей на титрование гидроксида натрия, может быть вычислен двумя способами:
V4 = V2 — 2 V3 или V4 = V1 — V3.
Полученные значения объемов позволяют рассчитать массы гидроксида и карбоната натрия в исследуемом растворе (г):
m(NaOH) = Т(НС1 / NaOH) ∙ V4 , m(Na2CO3) = Т(НС1 / Na2CO3) ∙ 2 V3 .
3. Расчет общей щелочности раствора
Как уже было указано, общая щелочность — это сумма масс гидроксида натрия, присутствующего в исследуемом растворе, и гидроксида натрия, эквивалентного имеющемуся в этом растворе количеству карбоната натрия.
Пересчитать найденное количество карбоната натрия m(Na2CO3) на эквивалентное ему количество гидроксида натрия mt(NaOH) можно на основе следующего уравнения:
m1(NaOH) = [m(Na2CO3)/M(l/2Na2CO3)]-M(NaOH).
Значение величины общей щелочности m(О.Щ.) можно рассчитать по уравнению
mО.Щ.)
= m(NaOH)
+ m1 (NaOH).
25
4. Расчет абсолютной и относительной ошибки определения Получив у преподавателя контрольное (истинное) значение величины общей щелочности исследуемого раствора m(О.Щ.)ист, рассчитайте абсолютную ∆ и относительную D ошибки определения.
∆ = m(О.Щ.)ист — m(О.Щ),
D = [∆/m(О.Щ.)ист]- 100%.
Рассчитав абсолютную и относительную погрешности определения, сформулируйте вывод об оценке результатов определения общей щелочности исследуемого раствора и оценке результатов стандартизации раствора хлороводородной кислоты, проведенной в работе 1.
Фракционное определение смеси гидроксида натрия и карбоната натрия|HIRANUMA Co., Ltd.
| HIRANUMA ПРИМЕНЕНИЕ | Автоматический титратор | Данные № | ч3 | 5 апреля 2019 г. |
| ЦЕЛЛЮЛОЗНАЯ ПРОМЫШЛЕННОСТЬ | Фракционное определение смеси гидроксида натрия и карбоната натрия |
1. Аннотация
Гидроксид натрия и карбонат натрия играют важную роль в качестве химических веществ, составляющих щелочь, которые используются в самых разных отраслях промышленности. Концентрация обоих компонентов должна быть определена, потому что они иногда используются в смеси.
В этом отчете приводится пример того, что смешанный раствор гидроксида натрия и карбоната натрия определяется фракционно с помощью потенциометрического титрования. Титрование гидроксида натрия и карбоната натрия соляной кислотой протекает по следующей формуле реакции:
| NaOH + HCl → NaCl + H₂O | ・・・(1) |
| Na₂CO₃ + HCl → NaHCO3 + NaCl | ・・・(2) |
РН достигает примерно 9 в конечной точке формулы реакции (1) и (2). Карбонат натрия образует гидрокарбонат натрия (NaHCO3) по реакции (2), затем непрерывно образующийся гидрокарбонат натрия титруют соляной кислотой. Она достигает конечной точки при рН около 4. Реакция между гидрокарбонатом натрия и соляной кислотой описывается формулой (3).
Карбонат натрия образует гидрокарбонат натрия (NaHCO3) по реакции (2), затем непрерывно образующийся гидрокарбонат натрия титруют соляной кислотой. Она достигает конечной точки при рН около 4. Реакция между гидрокарбонатом натрия и соляной кислотой описывается формулой (3).
| NaHCO₃ + HCl → NaCl + CO₂ + H₂O | ・・・(3) |
Соотношение кривой титрования и формулы (1)(2)(3) показано на следующем рисунке.
2. Комплектация инструментов и реактивов
| (1) | Конфигурация приборов | ||
| Основной блок | : | Автоматический титратор Hiranuma серии COM | |
| Электроды | : | Стеклянный электрод GE-101B Электрод сравнения RE-201Z *Вместо вышеуказанного электрода можно использовать следующие стеклянные электроды сравнения.  ・GR-501BZ (комбинированный стеклянный электрод сравнения)… Тип с фиксированной гильзой ・GR-511BZ (комбинированный стеклянный электрод сравнения)… Тип | с подвижной гильзой|
| (2) | Реагенты | ||
| Титрант | : | 0,1 моль/л стандартный раствор соляной кислоты | |
3. Процедура измерения
| (1) | Перелейте 20 мл образца в химический стакан на 100 мл с помощью мерной пипетки. |
| (2) | Добавьте 30 мл деионизированной воды. |
| (3) | Погрузите электроды и титруйте стандартным раствором соляной кислоты с концентрацией 0,1 моль/л. |
4. Условия и результаты измерений
Примеры условий титрования
(1) Условия измерения гидроксида натрия и карбоната натрия
| Контр. № | 1 | |
| Метод | Авто | |
| Бюретка № | 1 | |
| Ампер № | 1 | |
| D. Блок | рН | |
| S-таймер | 5 | сек |
К. П. мл П. мл | 0 | мл |
| Таймер T | 0 | сек |
| Д.П. мл | 0 | мл |
| Концевой датчик | 1000 | |
| Более мл | 0 | мл |
| Макс. объем. | 20 | мл |
| Константа № | 1 | |
| Размер | 20 | мл |
| Пусто | 0 | мл |
| Молярность | 0,1 | моль/л |
| Коэффициент | 1,005 | |
| К | 40,0 | |
| Л | 0 | |
| Блок | г/л | |
| Формула | ||
| (ВА-ВБ)*К*Ф*М/С | ||
| Десятичные разряды | 4 | |
Авто в коляске. | Нет | |
| № режима | 4 | |
| Предварительно | 0 | сек |
| Дел К | 9 | |
| Дель Сенс | 0 | мВ |
| Целое время | 3 | сек |
| Внутренний датчик | 3 | мВ |
| Скорость | 2 | |
| Импульс | 40 | |
| 0,05 | мл | |
(2) Условия измерения гидрокарбоната натрия
Контр. № № | 2 | |
| Метод | Авто | |
| Бюретка № | 1 | |
| Ампер № | 1 | |
| D. Блок | рН | |
| S-таймер | 0 | сек |
| К.П. мл | 0 | мл |
| Таймер T | 0 | сек |
Д. П. мл П. мл | 0 | мл |
| Концевой датчик | 1000 | |
| Более мл | 0,5 | мл |
| Макс. объем. | 20 | мл |
| Константа № | 2 | |
| Размер | 20 | мл |
| Пусто | 0 | мл |
| Молярность | 0,1 | моль/л |
| Коэффициент | 1,005 | |
| К | 105,99 | |
| Л | 0 | |
| Блок | г/л | |
| Формула | (Д-Б)*К*Ф*М/С | |
| Десятичные разряды | 4 | |
Авто в коляске. | Нет | |
| № режима | 4 | |
| Предварительно | 0 | сек |
| Дел К | 9 | |
| Дель Сенс | 0 | мВ |
| Целое время | 3 | сек |
| Внутренний датчик | 3 | мВ |
| Скорость | 2 | |
| Импульс | 40 | |
| 0,05 | мл | |
Примеры кривых титрования
Результаты измерения
Результаты измерения гидроксида натрия
| Номер измерения | Размер (мл) | Титрант Объем (мл) | Концентрация (г/л) |
|---|---|---|---|
| 1 | 20 | 2,481 | 0,3614 |
| 2 | 20 | 2,476 | 0,3588 |
| 3 | 20 | 2,474 | 0,3586 |
| Статистика расчет | Ср. | 0,360 г/л | |
| SD | 0,0016 г/л | ||
| РСД | 0,43 % | ||
Результаты измерения гидрокарбоната натрия
| Номер измерения | Размер (мл) | Титрант объем (мл) | Концентрация (г/л) |
|---|---|---|---|
| 1 | 20 | 0,683 | 0,3638 |
| 2 | 20 | 0,691 | 0,3680 |
| 3 | 20 | 0,690 | 0,3675 |
| Статистика расчет | Ср. | 0,366 г/л | |
| SD | 0,0023 г/л | ||
| РСД | 0,63 % | ||
5.Примечание
(1) Титрование карбоната натрия
В этом отчете карбонат натрия титровали непосредственно стандартным раствором соляной кислоты. Существует еще один метод титрования карбоната бария, полученного путем предварительного добавления хлорида бария. Этот метод полезен для определения низкой концентрации карбоната натрия, точка перегиба для карбоната становится единственной на кривой титрования. (Первая точка перегиба относится только к гидроксиду натрия, а вторая точка перегиба относится только к карбонату натрия (карбонату бария).) Однако этот метод не подходит для определения высокой концентрации карбоната натрия, поскольку количество осажденного карбоната бария увеличивается, а титрование скорость становится медленной.
(2) Среда для титрования
Атмосфера содержит около 0,03 % углекислого газа. При поглощении диоксида углерода раствором пробы при титровании гидроксида натрия объем титранта, израсходованного на гидроксид натрия, уменьшается, а при титровании карбоната натрия увеличивается. Подача газообразного азота в свободное пространство над раствором пробы служит эффективной мерой решения этой проблемы. Использование воздуха, пропускаемого через абсорбционную колонну с натронной известью, вместо газообразного азота также дает положительный эффект.
Ключевые слова: Гипохлорит натрия, Хлорид натрия, Остаточная щелочь, Доступный хлор, Осадочное титрование
*Некоторые измерения будут невозможны в зависимости от дополнительной конфигурации системы.
Анализ гидроксида натрия и карбоната натрия
Общая цель
Определение индивидуальной концентрации как гидроксида натрия, так и карбоната натрия в смеси.
Метод
Кислотно-основное титрование.
Цели обучения (МОТ)
Определение индивидуальной концентрации ингредиентов смеси.
Понимание реакций нейтрализации.
Понятие о кислотно-основном титровании.
Понимание концепции метода двойного индикатора в кислотно-основном титровании.
Теоретическая основа/контекст
Значения pKa1 и pKa2 для h3CO3 весьма различны, поэтому при титровании раствора карбоната соляной кислотой возникают две отчетливые области резкого изменения pH.
Первый соответствует образованию HCO3- (pH 8-10), а второй — полной нейтрализации при pH 4-6. Первый находится в диапазоне рН, при котором цвет фенолфталеина меняется с красного на бесцветный, а второй — в диапазоне, при котором метиловый оранжевый меняет цвет с желтого на оранжево-красный. Резкое изменение рН происходит в диапазоне рН, включающем области изменения окраски обоих индикаторов, поэтому оба они дают правильную конечную точку.
Итак, когда в растворе присутствуют и карбонат натрия, и гидроксид натрия, титрование с использованием фенолфталеина дает титр (объем в точке эквивалентности), соответствующий гидроксиду натрия плюс половина карбоната, а титр, полученный с метиловым оранжевым, соответствует общая щелочь. Индивидуальные концентрации карбоната натрия и гидроксида могут быть рассчитаны по данным.Принцип работы
NaOH является сильным основанием, которое можно определить непосредственно с помощью HCl с использованием индикатора фенолфталеина, при котором цвет меняется с розового на бесцветный в конечной точке:
NaOH + HCl→NaCl + h3O
Ион карбоната реагирует с ионами водорода поэтапно:
CO32- + H+→HCO3- –
HCO3- + H+→h3CO3 →CO2+ h3O
PraxiLabs признана во всем мире
Клиенты любят PraxiLabs
«С началом пандемии COVID-19 мы обнаружили
себя в ситуации, которая заставила
нам действовать быстро, чтобы найти наилучшее доступное решение
предоставить нашим студентам качественный
лабораторный опыт молекулярной генетики».
Корри Торлациус, бакалавр наук.
Инструктор лаборатории биологии
Кафедра биологии
Квантленский политехнический университет
» Хотя в настоящее время есть несколько поставщиков, предлагающих программное обеспечение виртуальной реальности для лабораторий физики, есть только одно, которое предлагает реалистичное, я чувствую, что нахожусь в настоящей лаборатории, решение: PraxiLabs».
Доктор Уильям Х. Майнер младший
Профессорфизики
Пальма Пляж Штат Колледж
Бока Ратон Флорида
» PraxiLabs предложила моим студентам возможность активно работать с материалом.


 ф
ф

 Первый соответствует образованию HCO3- (pH 8-10), а второй — полной нейтрализации при pH 4-6. Первый находится в диапазоне рН, при котором цвет фенолфталеина меняется с красного на бесцветный, а второй — в диапазоне, при котором метиловый оранжевый меняет цвет с желтого на оранжево-красный. Резкое изменение рН происходит в диапазоне рН, включающем области изменения окраски обоих индикаторов, поэтому оба они дают правильную конечную точку.
Первый соответствует образованию HCO3- (pH 8-10), а второй — полной нейтрализации при pH 4-6. Первый находится в диапазоне рН, при котором цвет фенолфталеина меняется с красного на бесцветный, а второй — в диапазоне, при котором метиловый оранжевый меняет цвет с желтого на оранжево-красный. Резкое изменение рН происходит в диапазоне рН, включающем области изменения окраски обоих индикаторов, поэтому оба они дают правильную конечную точку.