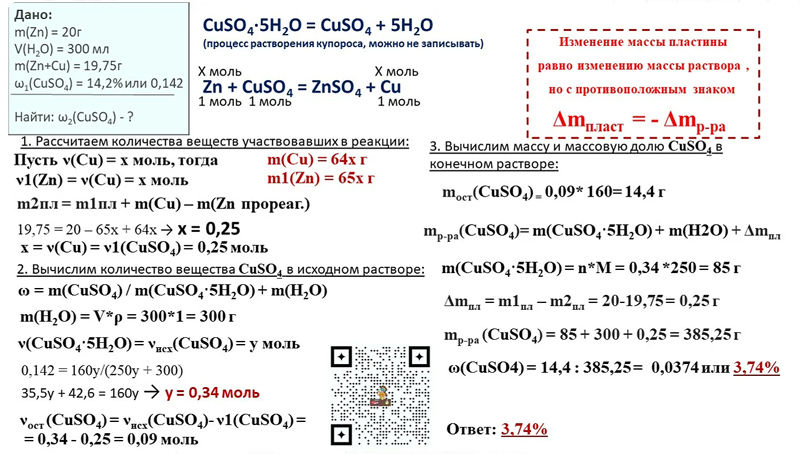
Решение задачи
Задача 10
-
Реакция разложения карбоната двухвалентного металла: MCO3 → MO + CO2↑, т.е. потеря массы приходится на CO2. Следовательно, остальные 64,9% – это оксид металла, и M(MO)/M(CO2)=64,9/35,1 ⇒ M(MO)=44,0·64,9/35,1=81,4 а.е.м. Отсюда M (M) = 65.4 и М = Zn.
-
ZnO+ 2HCl → ZnCl2+ H2O; ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
-
nH2O: M(Zn(NO3)2·nH2O)/M(Zn(NO3)2) = 100% / 63,7% = (189,4 + 18n) / 189,4; n=6.
-
Процентная концентрация фактически дана в условии задачи: ω=63,7%; смас=63,7/(100/1,4)=0,892г/мл; смол = смас/M(Zn(NO3)2)=0,00471 моль/мл.
-
Zn(NO3)2→ ZnO + 2NO
 ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
Задача 100
Масса смеси составит 3,5*106*0,584 = 2044000 г или 2044 кг. Пропана в смеси 0,58*2044 = 1185,5 кг или 1185,5/44 = 26,94 кмоль. Бутана в смеси 0,42*2044 = 858,5 кг или 858,5/58 = 14,80 кмоль. Мольное отношение пропан/бутан составляет 1,82, общее количество молекул в цистерне газовоза (26,94 + 14,80)*103*6,02*1023 = 2,51*1028, атомов (26,94*11 + 14,80*14)*103*6,02*1023 = 3,03*1029 шт. Объем газообразной смеси при н.у. равен (26,94 + 14,80)*103*22,4 = 935*103 л или 935 м3, что в 935/3,5 = 267 раз больше объема жидкости.
- С3Н8 + 5О2 = 3СО2 + 4Н2О (ж) (DrQ0= 3*393,5 + 4*241,8 – 103,9 = 2043,8 кДж/моль).

С4Н10 + 6,5О2 = 4СО2 + 5Н2О(ж) (DrQ0= 4*393,5 + 5*241,8 – 126,2 = 2656,8 кДж/моль). - При сгорании всей смеси, содержащейся в газовозе, выделится 26,94*103*2043,8 + 14,80*103*2656,8 = (55060 + 39321)*103 кДж = 94,4*106 кДж тепла.
- Масса бензина (октана) 3,5*106*0,703 = 2460500 г или 2460,5 кг. Его количество 2460,5/114 = 21,58 кмоль. Теплота сгорания: С8Н18 + 12,5О2 = 8СО2 + 9Н2О(ж) (DrQ0= 8*393,5 + 9*241,8 – 249,9 = 5074,3 кДж/моль). Количество тепла, которое выделится при сгорании всего бензина 21,58*103*5074,3 = 109,5*106 кДж. Получается, что приобретать пропан-бутановую смесь выгоднее в 94,4*10
- СН3-СH2-CH(СН3)-CH2-CH2-CH2-CH3(3-метилгептан) – 8 монохлорпроизводных; а) (СН3)3С-С(СН3)3 (2,2,3,3-тетраметилбутан) – 1; б) СН3-CH2-СH2-CH(СН3)-CH2-CH2-CH3(4-метилгептан) – 5.

Задача 101
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н 2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром.
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
Задача 102
1. Рассмотрим схему превращений, основанную на применении этилена в качестве исходного соединения. Этилен при окислении, в присутствии металлического серебра в качестве катализатора окисляется кислородом до этиленоксида (соединение V). Более старым способом его получения является хлорирование этилена в водном растворе, с образованием 2-хлорэтанола (Б), который далее обрабатывают гидроксидом кальция при нагревании. Другим важным мономером, получаемым из этилена, является винилхлорид (III), который образуется при пиролизе 1,2-дихлорэтана (А). Промышленным методом получения 1,2-дихлорэтана является нагревание этилена со смесью хлороводорода и кислорода в присутствии катализатора. При нагревании этилена с уксусной кислотой в присутствии кислорода воздуха образуется винилацетат (IV). Этот процесс имеет сложный многостадийный характер и представляет собой одну из модификаций Вакер-процесса.
Рассмотрим вторую схему превращений. На первой стадии пропилен в условиях кислотного катализа присоединяет воду, образуя изопропиловый спирт (В), который далее превращается в ацетон (Г). Следующая стадия представляет собой реакцию нуклеофильного присоединения синильной кислоты к ацетону с образованием соответствующего циангидрина (Д). При неполном гидролизе нитрильной группы получается амид Е, который при нагревании с метанолом дает метилметакрилат (V).
- Решение задачи 103
- Решение задачи 104
- Решение задачи 105
- Решение задачи 11
Гидроксид калия KOH раствор. Химические растворы. … Производитель Россия
Калия гидроксид (кали едкое, пищевая добавка Е525, гидроокись калия, калия гидрат окиси, каустический поташ) – едкая щелочь широкого спектра применения.
Технический гидрат окиси калия применяют для производства удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов, ксантогенатов, солей, в медицинской промышленности и в других отраслях народного хозяйства
Физико-химические свойства
Гидроксид калия KOH — бесцветное кристаллическое вещество без запаха. Температура плавления 380°С. Температура кипения 1320°С. Плотность 2,12 г/см3. Сильно гигроскопичен, на воздухе кристаллы расплываются вследствие поглощения влаги. Разлагает материалы органического происхождения, водные растворыры корродируют стекло, расплавы – фарфор, платину; концентрированные растворы вызывают тяжёлые ожоги кожи и слизистых оболочек.
Температура плавления 380°С. Температура кипения 1320°С. Плотность 2,12 г/см3. Сильно гигроскопичен, на воздухе кристаллы расплываются вследствие поглощения влаги. Разлагает материалы органического происхождения, водные растворыры корродируют стекло, расплавы – фарфор, платину; концентрированные растворы вызывают тяжёлые ожоги кожи и слизистых оболочек.
Растворимость калия гидроксида в различных растворителях
| Растворитель | Температура, °С | Растворимость, г/100г растворителя |
| Этанол | 28 | 38,7 |
| Метанол | 28 | 55 |
| Вода | 0 | 97,6 |
| 10 | 102,4 | |
| 20 | 112,4 | |
| 25 | 117,9 | |
| 40 | 135,3 | |
| 60 | 147,5 | |
| 80 | 162,5 | |
| 100 | 179,3 | |
| 120 | 206 | |
| 140 | 367 |
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- алкалиновые батареи,
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- перегонка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
Одна из важнейших областей применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов.
Другая важная область применения — производство различных солей калия.
Гидроксид калия также применяют вместе с каустической содой в производстве многих красителей и других органических соединений, а также как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов, в щелочных аккумуляторах, для получения различных соединений калия.
Кроме того, гидроксид калия используется для обеззараживания сточных вод, в азотной промышленности для осушки газов, в резинотехнической промышленности в качестве «калийного мыла», предотвращающего слипание крошки каучука и др.
Жидкий технический гидроксид калия применяется при производстве удобрений, синтетического каучука, электролитов, реактивов, в медицинской промышленности.
Чешуированный гидроксид калия используется в производстве удобрений и синтетического каучука, в фармацевтической промышленности и в других отраслях.
Гидроокись калия техническая применяется для выщелачивания отливок стального литья, для поддержания в заданных пределах щелочности буровых растворов, для производства удобрений, синтетического каучука и в других отраслях.
Регулятор кислотности Е525 разрешён в продуктах из какао и шоколада в количестве до 70 г/кг от сухого обезжиренного вещества, также Е525 используется как катализатор перерэтерификации глицерином рафинированных жиров и саломасов из хлопкового или подсолнечного масла: дозировка катализатора 0,3% от массы жира.
Характеристики
| Страна производитель | Россия |
| Дополнительные характеристики | |
|---|---|
| Назначение | химический раствор |
| Форма выпуска | Жидкость |
| Стандарт | ГОСТ 9285-78 |
| Химическая формула | KOH |
| Степень токсичности | 2 |
| Взрыво- и пожароопасность | Негорюч, взрывобезопасен |
Основания — Значения pH
Значения pH для таких оснований, как гидроксид натрия, аммиак и другие.
Рекламные ссылки
pH является мерой активности ионов водорода ( H+ ) в растворе и, следовательно, его кислотности или щелочности.
Values for some common bases:

 ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.

 4
4 1 N
1 N
 Основания — значения pH . [онлайн] Доступно по адресу: https://www.engineeringtoolbox.com/bases-ph-d_402.html [День доступа, мес. год].
Основания — значения pH . [онлайн] Доступно по адресу: https://www.engineeringtoolbox.com/bases-ph-d_402.html [День доступа, мес. год]. Но гидроксид натрия относительно распространен и дешевле, чем гидроксид калия. Из-за фактора стоимости гидроксид натрия в основном используется во многих приложениях. Но гидроксид калия также имеет свои уникальные свойства.
Но гидроксид натрия относительно распространен и дешевле, чем гидроксид калия. Из-за фактора стоимости гидроксид натрия в основном используется во многих приложениях. Но гидроксид калия также имеет свои уникальные свойства. Для химиков это ценная прочная основа, и она также имеет множество промышленных применений. Это соединение коммерчески доступно в виде желтоватых или белых гранул. Он становится очень липким, поглощая воду, так как он очень гигроскопичен и его трудно обезвоживать.
Для химиков это ценная прочная основа, и она также имеет множество промышленных применений. Это соединение коммерчески доступно в виде желтоватых или белых гранул. Он становится очень липким, поглощая воду, так как он очень гигроскопичен и его трудно обезвоживать.