ЕГЭ по химии 2023 задание 8: номер 83
Русский язык Математика (профильная) Обществознание Физика История Биология Химия Английский язык Информатика Литература
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
Разбор сложных заданий в тг-канале:
Посмотреть
Гидроксид бария не взаимодействует с
- H2SO4
- NO2
- FeS
- HNO3
Объект авторского права ООО «Легион»
Посмотреть решение
Предыдущая задача
Следующая задача
Задана следующая схема превращений веществ:
$Cu {→}↖{X} CuCl_2 {→}↖{Y} CuS.
Определите, какие из указанных веществ являются веществами X и Y.
- Cl2
- H2S
- HCl
- PbS
- H2SO4
Запишите выбран…
Задана следующая схема превращений веществ:
$P_2O_5 {→}↖{X} Н_3PO_4 {→}↖{Y} K_3PO_4.$
Определите, какие из указанных веществ являются веществами X и Y.
- H2
- KHSO4
- H2O
- K2Cr2O7
- KOH
Зап…
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответству…
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подб…
Популярные материалы
Основания 8 класс онлайн-подготовка на Ростелеком Лицей
- Видео
- Тренажер
- Теория
Заметили ошибку?
Состав оснований
При взаимодействии некоторых основных оксидов с водой образуются гидроксиды металлов.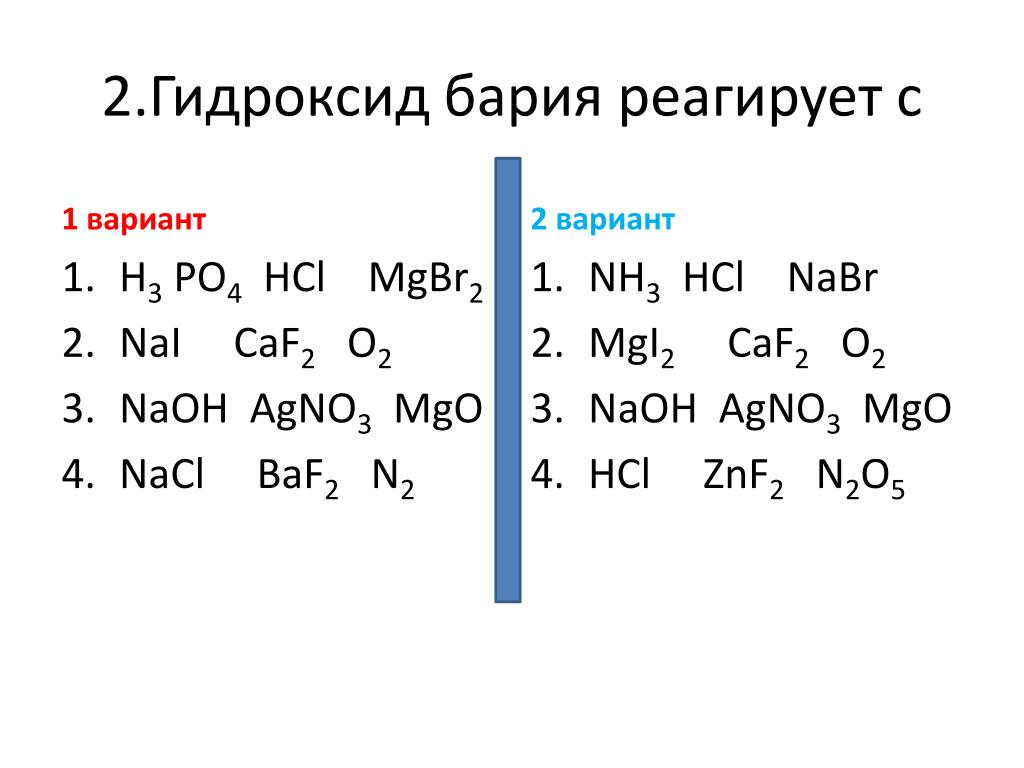 Эти гидроксиды относятся к классу оснований.
Эти гидроксиды относятся к классу оснований.
Например: оксид кальция взаимодействует с водой с образованием гидроксида кальция Са(ОН)2, оксид бария взаимодействует с водой с образованием гидроксида бария Ва(ОН)2:
СаО + Н2О = Са(ОН)2
ВаО + Н2О = Ва(ОН)2
Гидроксиды кальция и бария относятся к классу оснований.
Основания – сложные вещества, образованные атомами металла и гидроксильными группами ОН. Валентность гидроксильной группы равна I.
NaOH – гидроксид натрия
KOH – гидроксид калия
Cu(OH)2 — гидроксид меди (II)
Классификация оснований
Все основания делят на две группы – растворимые в воде (они называются щелочами) и нерастворимые в воде.
Чтобы привести примеры щелочей и нерастворимых оснований, нужно воспользоваться таблицей растворимости некоторых веществ воде. К щелочам относятся, например, гидроксиды натрия, калия, кальция. Оксид меди (II) и гидроксид железа (III) являются нерастворимыми основаниями.
Оксид меди (II) и гидроксид железа (III) являются нерастворимыми основаниями.
Химические свойства щелочей и нерастворимых оснований
Свойства щелочей отличаются от свойств оснований, нерастворимых в воде. Рассмотрим в сравнении свойства щелочей и нерастворимых оснований (Таблица 1).
Щелочи изменяют окраску индикаторов. Например, лакмус в щелочной среде становится синим, а метилоранж – желтым. Нерастворимые в воде основания окраски индикаторов практически не меняют.
Все щелочи взаимодействуют с кислотными оксидами, при этом образуются соль и вода. При взаимодействии гидроксида бария с оксидом серы (VI) образуется сульфат бария ВаSO4 и вода.
Нерастворимые в воде основания с кислотными оксидами не взаимодействуют.
Нерастворимые в воде основания легко разлагаются при нагревании. В результате этих реакций образуются оксиды металлов и вода. Щелочи разлагаются с трудом, только при высокой температуре. Исключение составляет гидроксид кальция, он разлагается при нагревании на оксид кальция и воду.
|
Химические свойства |
|
|
растворимых в воде оснований (щелочей) |
нерастворимых в воде оснований |
|
1. Изменяют окраску индикаторов |
1. Не изменяют окраски индикаторов |
|
2. Взаимодействуют с кислотными оксидами: 2KOH + CO2 = K2CO3 + H2O Ba(OH)2 + SO3 = BaSO4 + H2O |
2. Не взаимодействуют с кислотными оксидами |
|
3. Разлагаются только при высоких температурах Исключение: Са(ОН)2 = СаО + Н2О |
3. Сu(OH)2 = CuO + H2O |
Особенности строения кислот и оснований
Почему же кислородсодержащие кислоты и основания, являясь гидроксидами, существенно отличаются по своим свойствам? Чтобы ответить на этот вопрос, необходимо написать структурные формулы этих веществ.
Рис. 1. Структурные формулы серной кислоты и гидроксида натрия
И в кислородсодержащих кислотах, и в основаниях содержатся гидроксильные группы. Но в молекулах кислот подвижный фрагмент не гидроксильная группа, а атомы водорода. Именно они в химических реакциях замещаются на атомы металла. В основаниях атомы водорода от гидроксильной группы не отделяются.
Список рекомендованной литературы
- Сборник задач и упражнений по химии: 8-й кл.: к учеб. П. А. Оржековского и др. «Химия. 8 класс» / П. А. Оржековский, Н. А. Титов, Ф.
 Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 102-106)
Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 102-106) - Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006. (с. 104-106)
- Химия. 8 класс. Учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§32)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§38)
- Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§31)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
- Классификация и химические свойства оснований (Источник)
- Свойства и классификация оснований (Источник)
- Действие щелочей на индикаторы (Источник)
- Распознавание растворов щелочи, кислоты и воды с помощью индикаторов (Источник)
- Химические свойства нерастворимых оснований (Источник)
Домашнее задание
- с.
 104-106 №№ 1, 2, 7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006.
104-106 №№ 1, 2, 7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006. - с. 184 №№ 1, 3 из учебника П. А. Оржековского, Л. М. Мещеряковой, М. М. Шалашовой «Химия: 8 кл.», 2013 г.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: Основания по предмету Химия за 8 класс.
Данная реакция BaOH3 + 2Nh5Cl является эндотермическим классом 11 химии CBSE
Ответ
Проверено
143.4k+ просмотров
Подсказка: Чтобы понять вопрос, мы должны знать, что такое экзотермическая и эндотермическая реакция. Экзотермические реакции передают энергию окружающей среде, и температура окружающей среды увеличивается. Эндотермические реакции потребляют энергию, и температура окружающей среды снижается. Для дальнейшего объяснения обратитесь к решению.
Для дальнейшего объяснения обратитесь к решению.
Полный ответ:
Хлорид аммония реагирует с гидроксидом бария с образованием аммиака. Реакция между гидроксидом бария и хлоридом аммония представляет собой реакцию выделения газа с двойным замещением. Продуктами этой реакции являются хлорид бария, аммиак и вода.
\[Ba{(OH)_2} + 2N{H_4}Cl \to BaC{l_2} + 2N{H_3} + 2{H_2}O\]
Эта реакция является эндотермической реакцией. Эндотермические реакции — это химические реакции, в которых реагенты поглощают тепловую энергию из окружающей среды с образованием продуктов. Физические процессы также могут быть эндотермическими. Кубики льда поглощают тепловую энергию из окружающей среды и тают, образуя жидкую воду.
Хлорид аммония слабокислый, а гидроксид бария очень щелочной. В эндотермической реакции $\Delta H$ положительна, что соответствует поглощенному теплу. Таким образом, это положительное значение $\Delta H$ должно компенсироваться достаточным увеличением энтропии.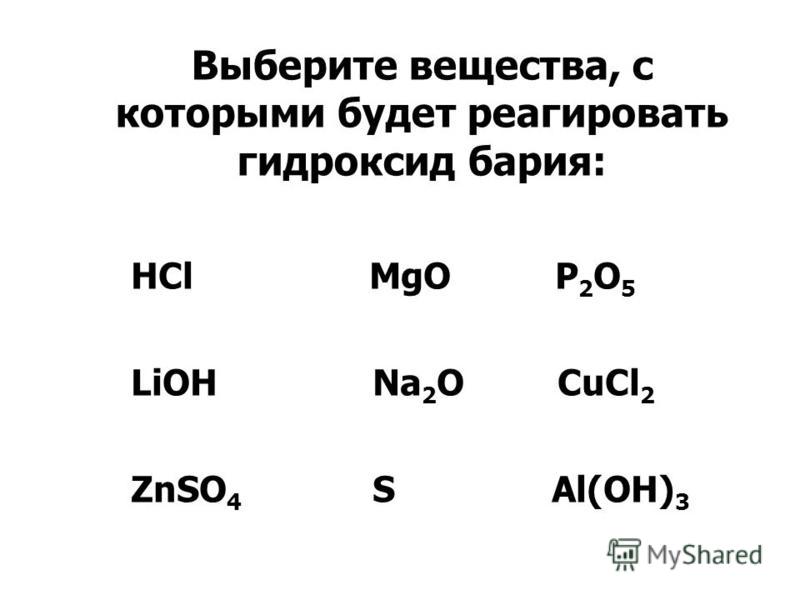
Дополнительная информация:
Хлорид аммония – соль для системного и мочевого подкисления. Хлорид аммония помогает поддерживать рН и оказывает мягкое мочегонное действие. Эта кислотообразующая соль также оказывает отхаркивающее действие, раздражая слизистые оболочки, и используется для облегчения кашля. Хлорид аммония представляет собой белое кристаллическое вещество.
Примечание:
Данная реакция является реакцией двойного замещения. Реакции, в которых два соединения реагируют путем обмена ионами с образованием двух новых соединений, называются реакциями двойного замещения. В реакциях двойного замещения положительные ионы обмениваются партнерами с отрицательными ионами. Многие реакции двойного замещения происходят между ионными соединениями, растворенными в воде.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Формула гидроксида бария – структура, свойства, применение, примерные вопросы
Гидроксид бария представляет собой смесь элементов бария, водорода и кислорода.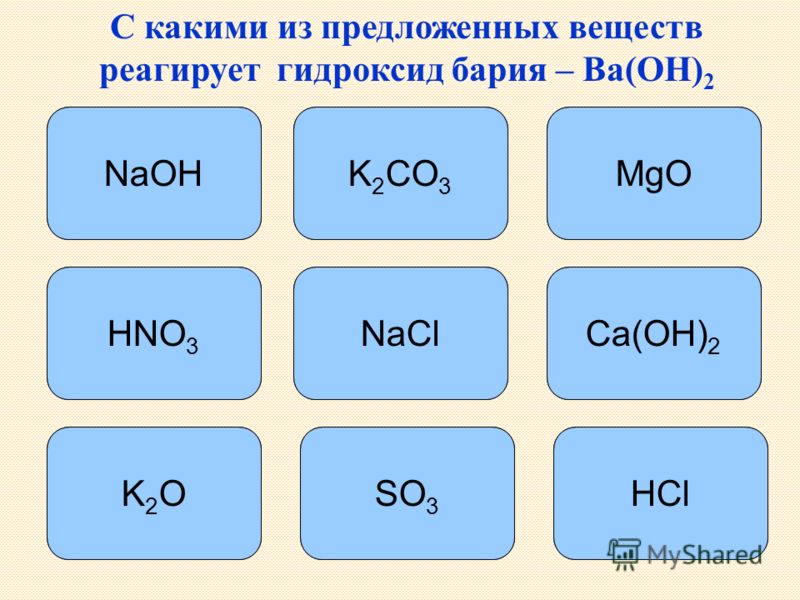 Барий — мягкий щелочноземельный металл серебристого цвета, присутствующий во 2-й группе периодической таблицы. Он химически очень реактивен. Поэтому он никогда не встречался в природе как свободный элемент. Он используется в металлургии, а его соединения используются в нефтедобыче и радиологии. Водород является первым элементом периодической таблицы с атомным номером 1. Это бесцветный газ без запаха и вкуса. Кислород является высокореактивным неметаллом и окислителем, который образует оксиды со многими элементами/соединениями.
Барий — мягкий щелочноземельный металл серебристого цвета, присутствующий во 2-й группе периодической таблицы. Он химически очень реактивен. Поэтому он никогда не встречался в природе как свободный элемент. Он используется в металлургии, а его соединения используются в нефтедобыче и радиологии. Водород является первым элементом периодической таблицы с атомным номером 1. Это бесцветный газ без запаха и вкуса. Кислород является высокореактивным неметаллом и окислителем, который образует оксиды со многими элементами/соединениями.
Гидроксид бария
Формула гидроксида бария: Ba(OH) 2 . Гидроксид бария представляет собой прозрачный белый порошок без запаха и ядовит по своей природе. Гидроксид бария состоит из оксида бария и воды. Одним из основных соединений элемента бария является его моногидрат, который также называют баритом. Поэтому гидроксид бария также называют баритом. Гидроксид бария также имел другие названия, такие как дигидроксид бария и едкий барит. Он ионный по своей природе, т. Е. В водном растворе он обеспечивает два иона гидроксида на молекулу.
Он ионный по своей природе, т. Е. В водном растворе он обеспечивает два иона гидроксида на молекулу.
Barium Hydroxide Structure
Properties of Barium Hydroxide

 Легко разлагаются при нагревании
Легко разлагаются при нагревании Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 102-106)
Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 102-106) 104-106 №№ 1, 2, 7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006.
104-106 №№ 1, 2, 7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006. 27
27
