Реакции ионного обмена
1. Реакции ионного обмена идут до конца, если: выпадает осадок, выделяется газ, образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не раскладывают.
Давайте порассуждаем вместе
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + H2SO4 = BaSO4 + 2HCl
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
3) 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
4) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3
Ответ: уравнению №2, т.
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca(OH)2 + CO2 + CaCO3 + H2O
3) Ca(HCO3)2 = CaCO3 + CO2 + H2O
4) CaO + CO2 = CaCO3
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3 выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
Ответ: №4, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
Ответ: №3, т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
5.
1) Cu2+ и Cl—
2) Cu2+ и S2-
3) Al3+ и SO42-
4) Zn2+ и NO3—
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4
2) H2SO4 и Ba(OH)2
3) HNO3 + Ba(OH) 2
4) HCl + Ba(OH)2
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) NH4Cl
2) CuCl2
3) ZnSO4
4) H3PO4
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + h3O
выделяется газ аммиак
1) Оксид натрия 2) серная кислота 4) вода 8) соляная кислота 16) гидроксид бария 32) гидроксид натрия
Какие оксиды образуются при окислительном обжиге пирита? Укажите номер или сумму условных номеров, под которыми расположены формулы этих веществ.
1) FeO 2) CO2 4) SO3 8) Fe2O3 16) SO2
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые можно использовать для осушки углекислого газа.

1) P2O5 2) H2SO4 4) NaOH 8) Ca(OH)2 16) CaO
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые можно получить из оксида меди (II) в одну стадию.
1) Сu(NO3)2 2) Cu 4) CuSO4 8) Cu(OH)2 16) CuCl2 .
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, для которых справедливы следующие характеристики – являются при обычных условиях твердыми веществами, нерастворимы в воде, взаимодействуют как с кислотами, так и со щелочами.
1) СаO 2) ZnO 4) SO3 8) PbO 16) Ag2O
Состав обычного стекла часто выражают формулой в виде оксидов: Na2O·CaO·6SiO2.

Чему равна массовая доля элемента железа (в %) в оксиде железа (III)?
Установите формулу одного из оксидов марганца, количественный состав которого задан следующим соотношением: m(Mn) : m(O) = 1 : 1,02. В ответе укажите общее число атомов в молекуле этого оксида.
ОСНОВАНИЯ
Напишите эмпирические и графические формулы гидроксидов калия, магния, алюминия, хрома (III), цинка. В ответе укажите число гидроксидов, обладающих амфотерными свойствами.
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, являющихся гидроксидами, растворимыми в воде.
1) Zn(OH) 2 2) Fe(OH)3 4) Ba(OH)2 8) Fe(OH)2
16) NH4OH 32) LiOH.
Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, являющихся щелочами.
1) Mg(OH)2 2) Fe(OH)3 4) Ba(OH)2 8) KOH
16) NH4OH 32) LiOH.
Укажите номер или сумму условных номеров, под которыми перечислены способы получения оснований.
1) Взаимодействие основания с кислотой 2) взаимодействие активного металла с водой 4) взаимодействие основных оксидов с водой 8) взаимодействие солей со щелочами
16) Электролиз водных растворов солей 32) взаимодействие амфотерных оксидов с водой.

1) Mg, Ca 2) Fe, Na 4) Ba, Rb 8) K, Cs 16) Pb, Ca
32) Li, Rb.
Чему равна сумма коэффициентов в уравнении реакции раствора гидроксида бария с оксидом хлора (V)?
Какие продукты могут образоваться при взаимодействии оксида серы (IV) с раствором гидроксида калия? Укажите номер или сумму условных номеров, под которыми расположены формулы этих веществ.
1) К2S 2) K2SO3 4) K2SO4 8) KHSO3 16) H2O 32) H2SO3.
34.
Укажите номер или сумму условных номеров,
под которыми расположены группы формул
веществ, все из которых способны в водных
растворах реагировать с гидроксидом
алюминия.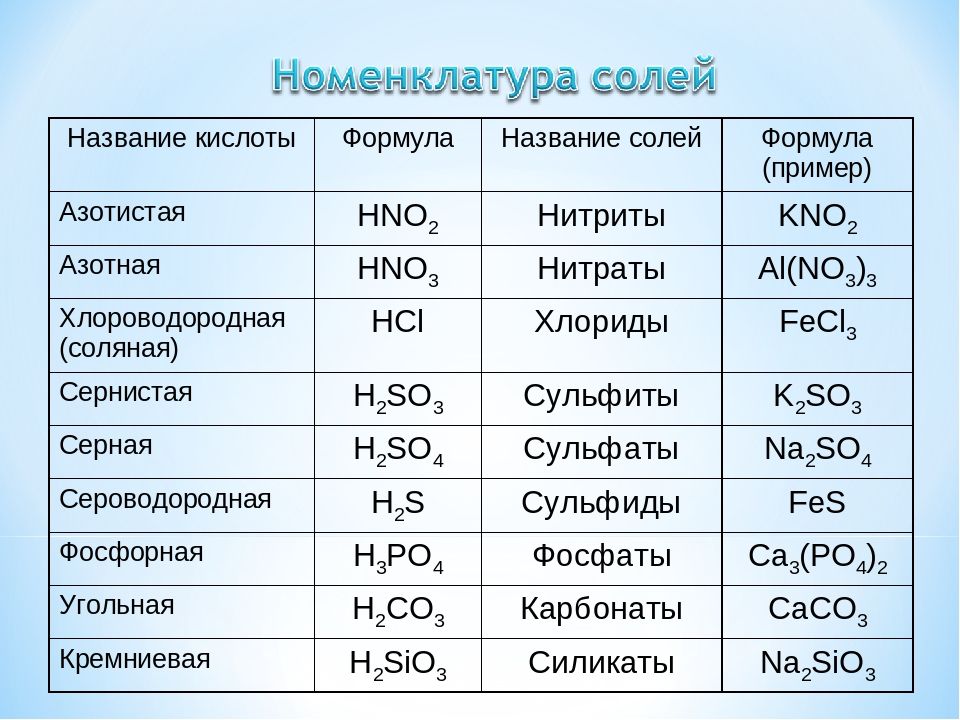
1) Mg(OH)2, CaCl2 2) RbOH, HNO3 4) BaCl2, H2SO4
8) KOH, HCl 16) H2SiO3, KNO3 32) LiOH, RbCl.
Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, все из которых способны реагировать в водном растворе с гидроксидом цинка.
1) MgCl2, Ca(OH)2 2) RbOH, HNO3 4) Ba(OH)2, H2SO4
8)
KOH, HCl 16) H2SO3,
KNO3 32) NaNO3,
RbOH.
36. Укажите номер или сумму условных номеров, под которыми расположены группы формул веществ, все из которых способны реагировать в водном растворе с гидроксидом натрия.
1) PbCl2, CuSO4 2) RbOH, HNO3 4) Al2O3, CO2
8) Cl2, HCl 16) Si, Al 32) Cr2O3, Cl2O7
37 Укажите номер или сумму условных номеров, под которыми расположены названия веществ, способных реагировать и с гидроксидом магния и гидроксидом хрома (III).
Гидроксид бария является щелочью. Реагирует с соляной кислотой. Как изменяется pH соляной кислоты при добавлении избытка водного раствора гидроксида бария? (A) pH снижается с pH 14 и становится постоянным при pH 7.
 (B) pH уменьшается с pH 14 примерно до pH 1.( C) pH увеличивается с pH 1 и становится постоянным при pH 7. (D) pH увеличивается с pH 1 примерно до pH 14.
(B) pH уменьшается с pH 14 примерно до pH 1.( C) pH увеличивается с pH 1 и становится постоянным при pH 7. (D) pH увеличивается с pH 1 примерно до pH 14.Дата последнего обновления: 11 марта 2023 г. •
Просмотров сегодня: 3,37 тыс.
Ответить
Проверено
255,9 тыс.+ просмотров
Подсказка: pH — это своего рода измерительная шкала, используемая для определения кислотности или щелочности водного раствора. Он варьировался от 1 до 14 в зависимости от их кислотного и основного характера. pH 7 указывает на то, что раствор нейтрален.
Полный пошаговый ответ:
— Во-первых, сообщите нам шкалу рН. Шкала рН колеблется от 1 до 14; растворы, имеющие рН менее 7, считаются кислыми, рН 7 — нейтральными, а рН более 7 — щелочными по своей природе.
— Как упоминалось в вопросе, гидроксид бария является щелочью, это означает, что его диапазон pH больше 7; тогда как соляная кислота является сильной кислотой, ее значение pH меньше 7.
Реакция между кислотой и основанием называется реакцией нейтрализации, и в результате реакции образуется соль и вода. Реакция указана ниже:
\[Ba{{(OH)}_{2}}+2HCl\to BaC{{l}_{2}}+2{{H}_{2}}O\]
-Теперь, когда мы добавим избыток водного гидроксида бария, это повлияет на рН раствора.
— Добавление гидроксида бария сначала нейтрализует кислую природу HCl, что приводит к увеличению pH до 7, а затем, после добавления избытка гидроксида бария, приводит к увеличению pH с 7 до 14,
— При добавлении pH соляной кислоты увеличится с pH 1 до 14, что означает, что раствор окажется основным по своей природе, и действие кислоты в растворе уменьшится.
-В последнем можно сделать вывод, что рН увеличивается от рН 1 примерно до рН 14. Правильный вариант Д.
Примечание: Следует отметить, что приведенная выше реакция является своего рода реакцией нейтрализации . Реакция которой указана ниже-
\[2HCl+Ba{{(OH)}_{2}}\to BaC{{l}_{2}}+2{{H}_{2}}O\ ] 9{-}}$ ионы из основания. Это также называется точкой эквивалентности, когда количество молей ионов гидроксида равно количеству молей ионов водорода.
Это также называется точкой эквивалентности, когда количество молей ионов гидроксида равно количеству молей ионов водорода.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химия JEE_Main
Что из нижеперечисленного является истинным пероксидом? A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс химического состава JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса химического состава JEE_Main
В Индии на случай брака фейерверк 12 класс химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть устроены 12 класс химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 по химии JEE_Main
Фосфин получают из следующей руды A кальций класс 12 по химии JEE_Main
90710Актуальные сомнения
Для следующей реакции 30,3 грамма соляной кислоты реагируют с 61,0 граммом гидроксида бария.

Реагенты, ограничивающие химию
Татьяна А.
спросил 17.03.18соляная кислота (водн.) + гидроксид бария (водн.) хлорид бария (водн.) + вода (л)
Какое максимальное количество хлорида бария может образоваться? грамм
Что такое ФОРМУЛА лимитирующего реагента?
Какое количество избыточного реагента остается после завершения реакции? грамм
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Дж. Р. С. ответил 17.03.18
Репетитор
5,0 (140)
к. т.н. Профессор университета со стажем репетиторства более 10 лет
т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Сначала напишите сбалансированное уравнение реакции: 2HCl(водн.) + Ba(OH)2(водн.) ==> BaCl 2 (водн.) + 2H 2 O(л)
Затем найдите ограничивающий реагент. Это проще всего сделать, сравнив количество молей HCl с количеством молей Ba(OH) 2 и разделив каждое значение на коэффициент в сбалансированном уравнении.
>> моль HCl = 30,3 г x 1 моль/36,5 г = 0,830 моль HCl (деленное на 2 = 0,415 моль)
>> моль Ba(OH) 2 = 61,0 г x 1 моль/171 г = 0,357 моль с Ba(OH) 2 (деленное на 1 = 0,357 моль)
(OH) 2 является ограничивающим.
Максимальное количество BaCl 2 , которое может образоваться (в граммах), определяется количеством Ba(OH) 2
0,357 моль Ba(OH) 2 x 1 моль BaCl 2 /моль Ba(OH) 2 = 0,357 моль BaCl 2 может образовываться
Mass = 0. 357 moles BaCl 2 x 208 g/mole = 74.2 grams of BaCl 2 can be formed
357 moles BaCl 2 x 208 g/mole = 74.2 grams of BaCl 2 can be formed
Formula of limiting reagent is Ba(OH) 2
Количество избыточного реагента (HCl) определяют следующим образом:
0,357 моль Ba(OH) 2 x 2 моль HCl/моль Ba(OH) 2 = 0,714 моль HCl прореагировало.
Осталосьмоль HCl = 0,830 моль — 0,714 моль = 0,116 моль HCl осталось
Осталосьграмма HCl = 0,116 моль HCl x 36,5 г/моль = Осталось 4,23 грамма HCl.
Голосовать за 0 Понизить
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.

 к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O

