Химические свойства оснований и амфотерных гидроксидов ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Химические свойства оснований
- Основания способны реагировать с кислотами и кислотными оксидами. В ходе взаимодействия происходит образование солей и воды
- Щелочи, гидроксид аммония всегда реагируют с растворами солей, только в случае образования нерастворимых оснований.
- Реакция кислоты с основанием именуется нейтрализацией. В ходе данной реакции, катионы кислот Н+ и анионы оснований ОН— образуют молекулы воды. После чего, среда раствора становится нейтральной. В результате начинается выделение тепла. В растворах, это ведет к постепенному нагреву жидкости. В случае крепких растворов, тепла более чем достаточно, чтобы жидкость начала кипеть. Необходимо помнить, что реакция нейтрализации происходит достаточно быстро.
| Сильные основания |
|
| Слабые основания |
|
Химические свойства амфотерных гидроксидов
- Амфотерные основания реагируют и с кислотами и со щелочами.
 В ходе взаимодействия происходит образование соли и воды. При прохождении какой — либо реакции с кислотами, амфотерные основания всегда проявляют свойства типичных оснований.
В ходе взаимодействия происходит образование соли и воды. При прохождении какой — либо реакции с кислотами, амфотерные основания всегда проявляют свойства типичных оснований. - В ходе реакции со щелочами, амфотерные основания способны проявлять свойства кислот. В процессе сплавления со щелочами, образуется соль и вода.
- При взаимодействии с растворами щелочей, всегда будут образовываться комплексные соли.
- Щелочи растворяют амфотерные металлы. В ходе данной реакции выделяется водород. В результате данной химической реакции, при опускании в раствор щелочи алюминия, выделяется газ. Так же это можно увидеть при его поджигании.
Гидроксиды и их классификация
Основания образуются атомами металлов и гидроксогруппой (ОН—), поэтому их называют гидроксидами.
1. По отношению к воде основания подразделяются на:
- растворимые — гидроксиды щелочных и щелочноземельных металлов, поэтому их называют щелочами, гидроксид аммония, но он слабый электролит.
 Основания, образованные остальными металлами в воде не растворяются. Щелочи в водном растворе диссоциируются полностью до катионов металла и анионов гидроксид — ионов ОН—.
Основания, образованные остальными металлами в воде не растворяются. Щелочи в водном растворе диссоциируются полностью до катионов металла и анионов гидроксид — ионов ОН—. - нерастворимые
2. По взаимодействию с иными химическими веществами гидроксиды делятся на:
- основные гидроксиды — заряд катиона равен +1 или +2
- кислотные гидроксиды (кислородсодержащие кислоты),
- амфотерные гидроксиды — заряд катиона равен +3 или +4
Ряд исключений:
- La(OH)3, Bi(OH)3, Tl(OH)3 – основания;
- Be (OH)2, Sn (OH)2, Pb(OH)2, Zn(OH)2, Ge(OH)2 — амфотерными основания.
Смотри химические свойства
Решай с ответами:
Основания (гидроксиды) — Справочник химика 21
Нейтрализация слабой кислоты (уксусной) с и л ь ным основанием (гидроксидом натрия) [c. 248]
248]Нейтрализация сильной кислоты (азотной) слабым основанием (гидроксидом аммония) [c.248]
Гидроксиды щелочных металлов МеОН — кристаллические вещества, растворимые в воде и спиртах. Их водные растворы — едкие щелочи — самые сильные основания. Гидроксиды получают электролизом водных растворов хлоридов . При этом в катодном пространстве выделяется водород и образуется гидроксид щелочного металла. Побочными продуктами производства являются водород и хлор (на аноде). При нейтрализации растворов гидроксидов щелоч- [c.116]
В качестве титрантов для определения кислот применяют неорганические и органические основания, ацетаты и алкоголя-ты щелочных металлов, амины и т. д. Наиболее сильными основными титрантами в неводных растворах являются четвертичные аммониевые основания — гидроксиды тетраметил-, тетраэтил- и тетрабутиламмония и их производные.
Примеры сильных оснований гидроксиды щелочных металлов (LiOH, NaOH, КОН и др. ). Их называют также щелочами. Гидроксиды щелочноземельных металлов (Са(ОН) , Ba(OH) и др.) тоже можно считать сильными основаниями. Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
). Их называют также щелочами. Гидроксиды щелочноземельных металлов (Са(ОН) , Ba(OH) и др.) тоже можно считать сильными основаниями. Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
Оксид магния MgO — тоже основной оксид. Он малорастворим в воде, но ему соответствует основание — гидроксид магния Mg(0H)2, который можно получить из MgO косвенным путем. [c.30]
При нейтрализации слабого основания — гидроксида аммония— сильной кислотой в растворе тоже устанавливаются два равновесия [c.255]
Раствор хлорида натрия нейтрален и имеет pH = 7,0. Это понятно, поскольку хлорид натрия-соль сильного основания (гидроксида натрия) и сильной (хлористоводородной) кислоты, а когда такие вещества взяты в равных количествах, они должны полностью нейтрализовать друг друга. В отличие от этого ацетат натрия представляет собой соль сильного основания и слабой кислоты. Интуитивно можно ожидать, что раствор ацетата натрия окажется несколько основным, и это действительно так. Часть ацетатных ионов, образованных этой солью, соединяется с водой, образуя недиссоциированную уксусную кислоту и гидроксидные ионы [c.242]
Интуитивно можно ожидать, что раствор ацетата натрия окажется несколько основным, и это действительно так. Часть ацетатных ионов, образованных этой солью, соединяется с водой, образуя недиссоциированную уксусную кислоту и гидроксидные ионы [c.242]
Название оснований (гидроксидов металлов) состоит из слова «гидроксид» — названия гидроксильного остатка и названия металла, из которого образован ион металла, в родительном падеже.
Как основание гидроксид натрия сильнее, чем гидроксид кальция. Однако равновесие реакции сдвинуто вправо из-за образования нерастворимого карбоната кальция. Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы. [c.145]
Выделение связанного аммиака осуществимо только при химической обработке воды растворами сильных оснований гидроксида кальция или натрия. [c.190]
Основания Гидроксид аммония С/С С/С С/С С/С с/с с/с СИ О-Н/0 со С/С [c. 214]
214]
Значительное изменение кислотности или основности раствора оказывает влияние на растворимость почти всех солей. Однако это влияние заметно только в тех случаях, когда один или оба иона, из которых состоит соль, обладают достаточно сильными кислотными или основными свойствами. Как мы только что убедились, гидроксиды металлов являются наглядным примером соединений, в состав которых входит сильное основание, гидроксид-ион. В качестве другого примера рассмотрим СаРз, куда [c.128]
Примеры слабых оснований гидроксиды остальных металлов (Fe(OH)j, u(OH) , Al(OH),, и др), а также вода. [c.126]
Большинство основных оксидов с водой не взаимодействуют, 0 им также соответствуют основания (гидроксиды), которые можно получить косвенным путем. Например, не взаимодействующим с водой оксиду марганца (И) и оксиду марганца (П1) соответствуют гидроксиды Мп(0Н)2 и Мп(0Н)з. [c.28]
Названия оснований (гидроксидов) образуются так же, как и оксидов. Например, Са(0Н)2 — гидроксид кальция, Ре(0Н)2 — гидроксид железа (И), Ре (ОН) з — гидроксид железа (1И).
Например, Са(0Н)2 — гидроксид кальция, Ре(0Н)2 — гидроксид железа (И), Ре (ОН) з — гидроксид железа (1И).
Основания (гидроксиды) наиболее активных металлов можно получить либо путем непосредственного взаимодействия металла с водой [c.29]
Если данный атом проявляет различную положительную валентность, то указанные выше свойства гидроксидов сохраняются. Так, гидроксид двухвалентного марганца есть основание гидроксид четырехвалентного марганца амфотерен гидроксиды шести- и семивалентного марганца — кислоты. [c.98]
Выделяющийся водород воспламеняется. В результате реакции получаются сильные основания — гидроксид натрия или гидроксид калия. Загоревшиеся натрий и калий нельзя тушить водой [c.145]
Следовательно, в водных растворах самая сильная кислота — ионы гидроксония и самое сильное основание — гидроксид-ионы. [c.50]
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН [c. 188]
188]
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Ре(ОН)а. [c.188]
Подобно другим основаниям, гидроксид кальция является щелочным и едким веществом. [c.282]
Оснбены.чи называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам отвечают основания. Например, оксиду кальция СаО отвечает основание гидроксид кальция Са(0Н)2 оксиду кадмия dO — гидроксид кадмия d(0H)2- [c.31]
Ионные основа ния, такие, как гидроксид натрия NaOH и гидроксид калия КОН, — сильные основания, т. е. их растворы содержат только катионы и ионы ОН. Однако концентрация ионов ОН в растворе иногда ограничена низкой растворимостью основания. Пример такого основания — гидроксид магния Mg(0H)2- [c.427]
Основными оксидами называются такие, которые прн взаимодействии с кислотами образуют соль и воду.

При взаимодействии оксида натрия ЫагО с водой образуется сильное основание — гидроксид натрия NaOH. Проставим в химической формуле гидроксида натрия над [c.131]
Положения протолитической теории приложимы к кислотноосновным равновесиям в растворах комплексных соединений. Под влиянием координации могут существенно изменяться свойства центральных атомов и лигандов. Это отчетливо проявляется при координации водородсодержащих веществ, например воды, аммиака, метиламина Nh3—СНз, этиламина Nh3—С2Н5. В водном растворе аммиак образует основание — гидроксид аммония [c.389]
Различаются между собой и гидроксиды этой группы гидроксид бериллия Ве(ОН)г — амфотерное основание, гидроксид магния Mg (ОН) 2 — слабое основание [хотя диссоциирует сильнее, чем такие слабые основания, как, например, 2п(0Н)г, А1(0Н)з], гидроксиды кальция, стронция, бария и радия — сильные основания.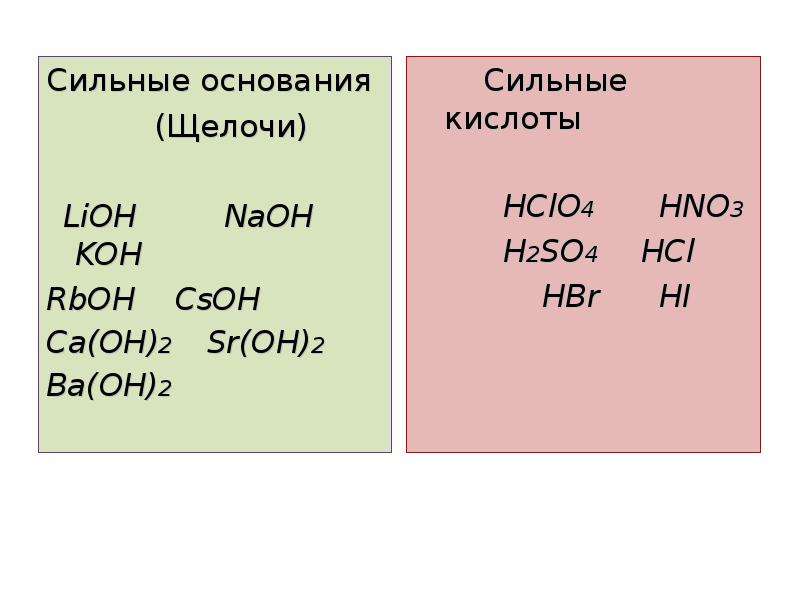 Растворы Са(ОН)г и Ва(ОН)г называют соответственно известковой и баритовой водой. Гидроксид магния растворяется в воде в присутствии солей аммония, так как в этом случае образуется слабо-диссоциированный Nh5OH [c.205]
Растворы Са(ОН)г и Ва(ОН)г называют соответственно известковой и баритовой водой. Гидроксид магния растворяется в воде в присутствии солей аммония, так как в этом случае образуется слабо-диссоциированный Nh5OH [c.205]
Решение. 1. Соль NaHSOg образована сильным основанием (гидроксидом натрия) и слабой (сернистой) кислотой. В этом случае гидролизу подвергается аиион слабой кислоты [c.65]
Пример 4. Требуется вычислить pH сантимолярного раствора гидроксида натрия. Гидратированные ионы натрия представляют собой очень слабую катионную кислоту (см. табл. 3) и практически на pH раствора не влияют. Последний зависит от присутствующего сильного основания — гидроксид-ионов
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (И) и сильная хлороводородная кислота H I. Однако степень гидролиза по второй ступени намного меньше, чем по первой стушзни. [c.212]
Водородные соединения неметаллов характеризуются различным отношением к воде.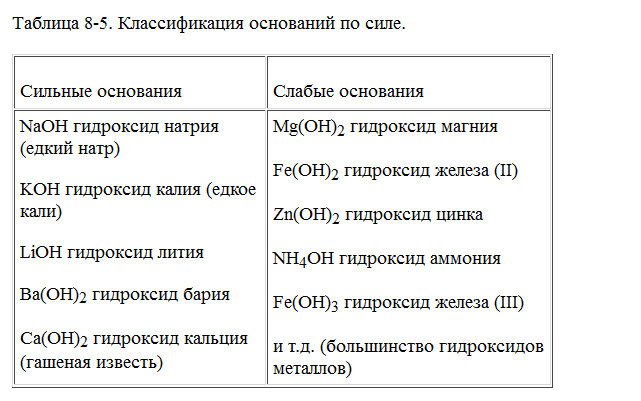 Метан и силан в воде плохо растворимы. Аммиак и фосфин при растворении в воде образуют слабые основания — гидроксид аммоиия Nh5OH и гидроксид фосфония РН4ОН. [c.330]
Метан и силан в воде плохо растворимы. Аммиак и фосфин при растворении в воде образуют слабые основания — гидроксид аммоиия Nh5OH и гидроксид фосфония РН4ОН. [c.330]
Тест на химические свойства оснований и амфотерных гидроксидов.
Задание №1
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)3
Задание №2
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Fe(OH)3
- 5. Fe(OH)2
Задание №3
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1.
 Zn(OH)2
Zn(OH)2 - 2. RbOH
- 3. CsOH
- 4. Sr(OH)2
- 5. KOH
Задание №4
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Mg(OH)2
- 2. Be(OH)2
- 3. Cu(OH)2
- 4. Pb(OH)2
- 5. Sr(OH)2
Задание №5
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. CrO2(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Ca(OH)2
Задание №6
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №7
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
Число верных ответов может быть любым.
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
Задание №8
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. RbOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №9
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №10
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Ba(OH)2
- 5. Al(OH)3
Задание №11
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1.
 Zn(OH)2
Zn(OH)2 - 2. Ba(OH)2
- 3. Mn(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №12
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Fe(OH)2
- 3. Ba(OH)2
- 4. Mg(OH)2
- 5. Sr(OH)2
Задание №13
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. KOH
- 2. Cr(OH)2
- 3. Ba(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)3
Задание №14
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. Sr(OH)2
- 2. Ba(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №15
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1.
 RbOH
RbOH - 2. Ba(OH)2
- 3. CsOH
- 4. Sr(OH)2
- 5. Zn(OH)2
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn(OH)2 = ZnO + H2O
Задание №16
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1. CsOH
- 2. Ba(OH)2
- 3. KOH
- 4. Sr(OH)2
- 5. Al(OH)3
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al(OH)3 = Al2O3 + 3H2O
Задание №17
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид лития.
1) нитрат свинца
2) бромид калия
3) фосфат натрия
4) хлорид натрия
5) йодид рубидия
РешениеЗадание №18
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид натрия.
1) фторид калия
2) сульфат цинка
3) нитрат аммония
4) сульфат бария
5) хлорид серебра
РешениеЗадание №19
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид кальция.
1) карбонат цезия
2) нитрат бария
3) бромид натрия
4) сульфат аммония
5) йодид свинца
РешениеЗадание №20
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид бария.
1) хлорид аммония
2) карбонат калия
3) сульфат стронция
4) нитрат калия
5) бромид лития
РешениеЗадание №21
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид цезия.
1) нитрат железа(II)
2) хлорид рубидия
3) карбонат калия
4) карбонат аммония
5) нитрат натрия
РешениеЗадание №22
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид рубидия.
1) нитрат калия
2) нитрат бария
3) нитрат магния
4) нитрат аммония
5) нитрат свинца
РешениеЗадание №23
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид стронция.
1) сульфат натрия
2) фосфат калия
3) фторид натрия
4) хлорид натрия
5) йодид цезия
РешениеЗадание №24
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид натрия.
1) бромид аммония
2) фторид кальция
3) нитрат аммония
4) силикат цинка
5) хлорид магния
РешениеЗадание №25
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид бария.
1) сульфат меди
2) карбонат свинца
3) сульфат аммония
4) карбонат натрия
5) сульфат стронция
РешениеЗадание №26
Из приведенного списка солей выберите две такие, с которыми не будет взаимодействовать гидроксид калия.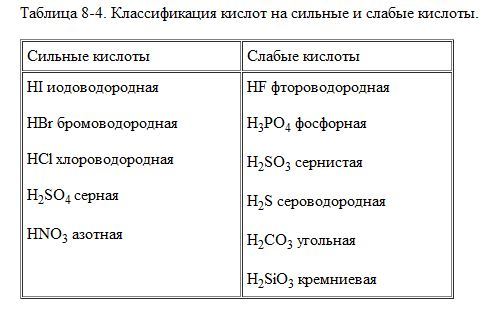
1) силикат натрия
2) сульфид железа(II)
3) сульфид аммония
4) нитрат свинца
5) нитрат цинка
РешениеЗадание №27
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с углекислым газом.
1) едкий натр
2) гидроксид железа(III)
3) гидроксид алюминия(III)
4) гашеная известь
5) гидроксид хрома(III)
РешениеЗадание №28
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом натрия.
1) гидроксид лития
2) едкое кали
3) гидроксид алюминия
4) гидроксид стронция
5) гидроксид цинка
РешениеЗадание №29
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом алюминия.
1) гидроксид цезия
2) гидроксид бериллия
3) гидроксид свинца
4) гидроксид бария
5) гидроксид цинка
РешениеЗадание №30
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с оксидом кремния.
1) гидроксид железа (II)
2) гидроксид рубидия
3) едкий натр
4) гидроксид хрома(III)
5) гашеная известь
РешениеЗадание №31
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кальция.
1) гидроксид хрома(II)
2) гидроксид хрома(III)
3) гидроксид железа(II)
4) гидроксид железа(III)
5) гидроксид натрия
РешениеЗадание №32
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом цинка.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Mn(OH)2
- 5. Cu(OH)2
Задание №33
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом углерода (IV).
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Fe(OH)3
Задание №34
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом бария.
- 1. Ba(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Mn(OH)2
- 5. Cr(OH)3
Задание №35
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом хрома(III).
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №36
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кремния.
- 1. Ca(OH)2
- 2. Cr(OH)2
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Cu(OH)2
Задание №37
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с едким кали.
- 1. Pb(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №38
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с едким натром.
- 1. Cr(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Be(OH)2
Задание №39
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гашеной известью.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)2
Задание №40
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом стронция.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)2
Задание №41
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом рубидия.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4.
 Fe(OH)3
Fe(OH)3 - 5. Sr(OH)2
Задание №42
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом алюминия.
- 1. Mn(OH)2
- 2. Be(OH)2
- 3. Ca(OH)2
- 4. Ba(OH)2
- 5. Sr(OH)2
Задание №43
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом цинка.
- 1. Zn(OH)2
- 2. Be(OH)2
- 3. CsOH
- 4. Pb(OH)2
- 5. KOH
Задание №44
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом хрома(III).
- 1. Fe(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №45
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом железа(III).
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №46
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом свинца.
- 1. Cr(OH)2
- 2. Ca(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Задание №47
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №48
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с сернистой кислотой.
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5.
 Zn(OH)2
Zn(OH)2
Задание №49
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Al(OH)3
Задание №50
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с сероводородной кислотой.
- 1. NaOH
- 2. Al(OH)3
- 3. Ba(OH)2
- 4. Cr(OH)3
- 5. Sr(OH)2
Задание №51
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремнием.
- 1. Sr(OH)2
- 2. Be(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №52
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с серой.
- 1. NaOH
- 2. Mn(OH)2
- 3. RbOH
- 4. Cr(OH)3
- 5. Ca(OH)2
Задание №53
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремнием.
- 1. RbOH
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Zn(OH)2
Задание №54
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с фосфором.
- 1. Mg(OH)2
- 2. Ba(OH)2
- 3. Cu(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №55
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с фосфором.
- 1. Ca(OH)2
- 2. Cu(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Задание №56
Из приведенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1.
 Cr + NaOH
Cr + NaOH - 2. Si + CsOH
- 3. Fe + NaOH
- 4. I2 + Ba(OH)2
- 5. C + KOH
Задание №57
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с йодом.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Fe(OH)3
- 5. CsOH
Задание №58
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1. Al + Zn(OH)2
- 2. Cl2 + Al(OH)3
- 3. P + NaOH
- 4. S + Ba(OH)2
- 5. Br2 + Cu(OH)2
Задание №59
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида бария:
- 1. H2
- 2. Cl2
- 3. N2
- 4. O2
- 5.
 I2
I2
Задание №60
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида калия:
- 1. Al
- 2. Cu
- 3. P
- 4. Cr
- 5. C
Задание №61
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида натрия:
- 1. Fe
- 2. Cu
- 3. S
- 4. C
- 5. Zn
Задание №62
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Cu + NaOH
- 2. Cl2 + Cu(OH)2
- 3. C + KOH
- 4. Si + Ba(OH)2
- 5. Zn + Sr(OH)2
Задание №63
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Al + Fe(OH)2
- 2.
 I2 + RbOH
I2 + RbOH - 3. Cr + NaOH
- 4. N2 + KOH
- 5. P + CsOH
Задание №64
Из приведенного списка гидроксидов выберите такой, который взаимодействует с цинком.
- 1. NaOH
- 2. Fe(OH)2
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
В поле ответа введите уравнение реакции водного раствора данного гидроксида с цинком. В качестве разделителя левой и правой частей используйте знак равенства (=).
РешениеОтвет: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Задание №65
Установите соответствие между формулой/названием гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид цинка Б) едкий натр В) гидроксид хрома(III) | 1) алюминий, хлор, серная кислота 2) гидроксид цезия, соляная кислота, оксид натрия 3) вода, кислород, сера 4) азотная кислота, оксид серы(VI), вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №66
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) KOH Б) Al(OH)3 В) Ba(OH)2 | 1) Na2CO3, Br2, H2O 2) HNO3, P, HI 3) NaOH, HBr, K2O 4) HNO3, Fe(OH)2, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №67
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид меди Б) гашеная известь В) гидроксид цинка | 1) сульфат бария, нитрат аммония, карбонат свинца 2) серная кислота, сера, хлорид натрия 3) вода, кислород, кремний 4) азотная кислота, соляная кислота, оксид серы(VI) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №68
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) LiOH Б) Al(OH)3 В) Fe(OH)3 | 1) фторид натрия, бром, кремний 2) гидроксид натрия, гашеная известь, вода 3) оксид бария, гидроксид калия, серная кислота 4) цинк, фосфор, нитрат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №69
Цинк сплавили со гидроксидом натрия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn + 2NaOH = Na2ZnO2 + H2
Задание №70
Хлор пропустили через холодный раствор гидроксида калия. В случае если реакция протекает запишите ее уравнение. Если реакция не протекает введите в поле ответа знак минус (-).
В случае если реакция протекает запишите ее уравнение. Если реакция не протекает введите в поле ответа знак минус (-).
Ответ: Cl2 + 2KOH = KClO + KCl + H2O
Задание №71
Серу подвергли совместному нагреванию с избытком концентрированного водного раствора гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №72
Кремний растворили в водном растворе гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: Si + 2NaOH + H2O = 2H2 + Na2SiO3
Задание №73
Алюминий растворили при нагревании в растворе гидроксида рубидия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: 2Al + 2RbOH + 6H2O = 2Rb[Al(OH)4] + 3H2
Задание №74
Хлор пропустили через горячий раствор гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Задание №75
Через известковую воду пропустили углекислый газ в результате чего наблюдали ее помутнение. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ca(OH)2 + CO2 = CaCO3 + H2O
Задание №76
Через известковую воду пропустили некоторое количество углекислого газа, в результате чего был получен прозрачный раствор. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: Ca(OH)2 + 2CO2 = Ca(HCO3)2
Задание №77
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Сульфат калия + гидроксид бария
РешениеОтвет: K2SO4 + Ba(OH)2 = BaSO4 + 2KOH
Задание №78
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид свинца + кремниевая кислота
РешениеЗадание №79
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид натрия + нитрат железа(III)
РешениеОтвет: 3NaOH + Fe(NO3)3 = Fe(OH)3 + 3NaNO3
Задание №80
К смеси порошкообразных гидроксида бария и хлорида аммония добавили каплю воды. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3 + 2H2O
Задание №81
Оксид алюминия прокалили совместно с твердым гидроксидом натрия. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2NaOH + Al2O3 = 2NaAlO2 + H2O
Задание №82
Оксид алюминия поместили в концентрированный водный раствор гидроксида калия и подвергли нагреванию. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2KOH + Al2O3 + 3H2O = 2K[Al(OH)4]
Задание №83
Твердый гидроксид калия сплавили с гидроксидом цинка. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
Ответ: 2KOH + Zn(OH)2 = K2ZnO2 + 2H2O
Задание №84
Сероводород пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №85
Углекислый газ пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №86
Вычислите массу осадка, полученную при взаимодействии избытка серной кислоты и 30 мл 10% раствора гидроксида бария (плотность 1,1 г/мл).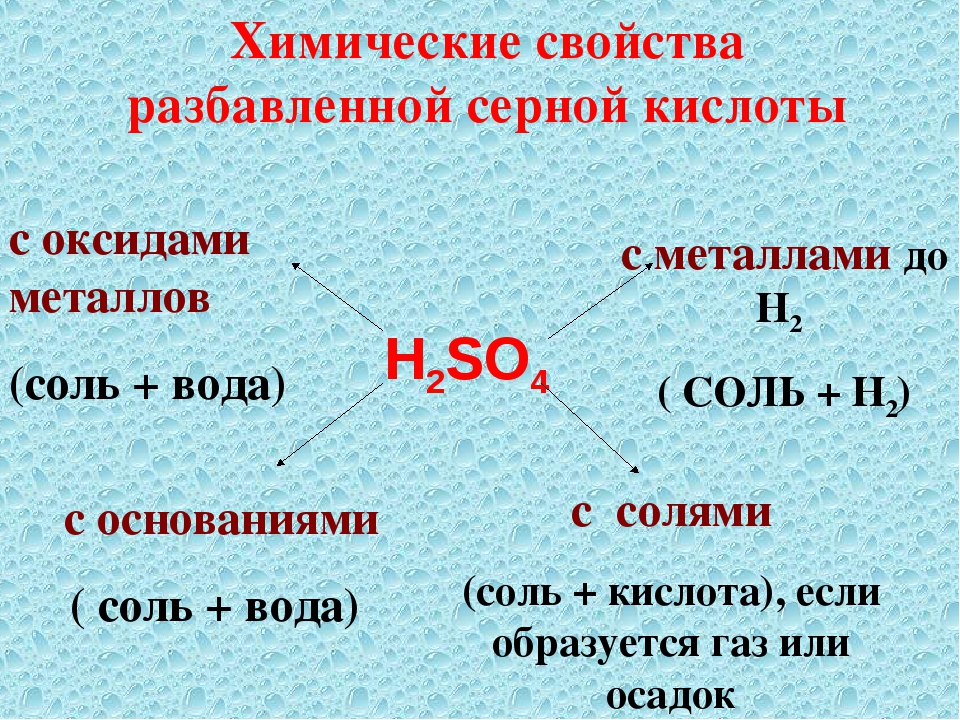 Ответ укажите в граммах и округлите с точностью до десятых.
Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №87
Рассчитайте объем 5% раствора соляной кислоты (плотность 1,05 г/см3), необходимый для полной нейтрализации 14 г едкого кали. Ответ укажите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №88
Определите массу воды, полученную при термическом разложении смеси 1,5 моль гидроксида алюминия и 49 г гидроксида меди. Ответ укажите в граммах округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №89
Вычислите массу твердого остатка, полученного при прокаливании 214 г гидроксида железа(III). Ответ укажите в граммах и округлите с точностью до целых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №90
Рассчитайте массовую долю бромата калия в растворе, полученном при полном растворении 8 г брома в 92 г горячего концентрированного раствора гидроксида калия.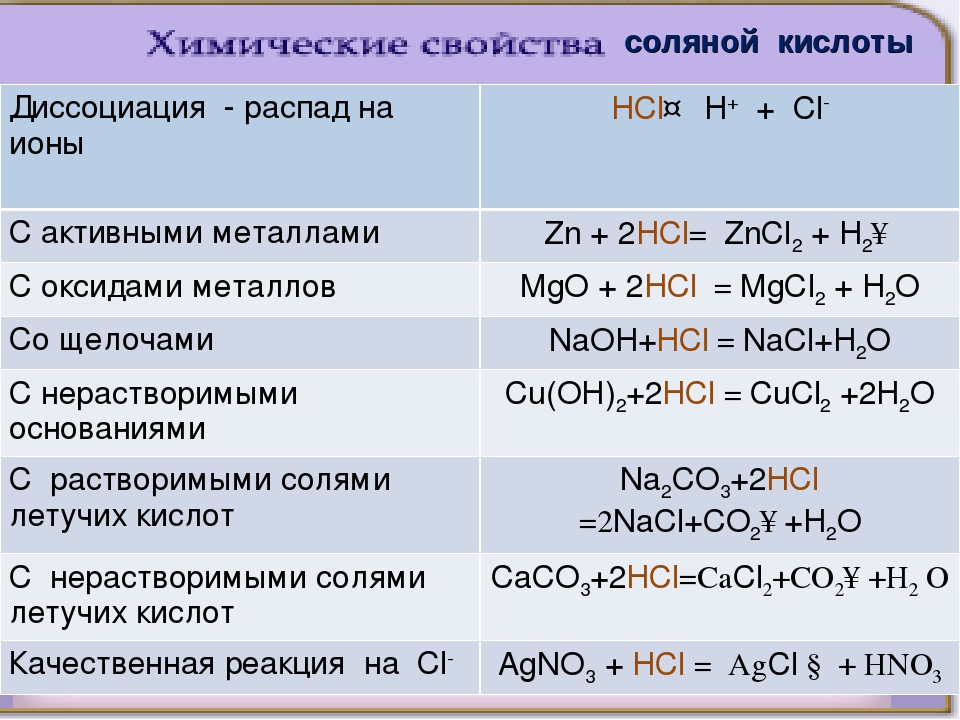 Ответ укажите в процентах и округлите до сотых.
Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №91
Навеску порошка кремния массой 3,5 г растворили при нагревании в избытке гидроксида натрия. Определите массу осадка, который можно получить при подкислении данного раствора соляной кислотой. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №92
Смесь гидроксидов алюминия и магния имеет массу 100 г. Определите массовую долю гидроксида магния в исходной смеси, если для растворения гидроксида алюминия потребовалось 140 г 10% раствора гидроксида калия. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №93
Навеску гидроксида магния прокалили до постоянной массы. Определите массу азотной кислоты, необходимой для растворения твердого остатка, если при прокаливании выделилось 4,5 г паров воды. Ответ укажите в граммах и округлите до десятых.
Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №94
При растворении навески кремния в избытке гидроксида натрия выделился водород. Определите массу исходной навески, если выделившимся газом можно восстановить 20 г оксида меди(II). Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №95
Рассчитайте объем хлора, который может поглотить горячий раствор, содержащий 10 г гидроксида натрия и 7 г гидроксида калия. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №96
Вычислите массу хлорида аммония, необходимую для получения 112 л аммиака по реакции с гидроксидом бария. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №97
Определите массу осадка, оставшегося после реакции 39 г гидроксида алюминия и 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл). Ответ укажите в граммах и округлите до сотых.
Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №98
Рассчитайте объем углекислого газа, необходимого для полного осаждения карбоната бария из 0,2 л 15% раствора его гидроксида (плотность 1,12 г/см3). Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №99
Какую массу воды можно получить при прокаливании образца гидроксида железа(III) массой 59,5 г, содержащего 10% песка. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №100
При полном растворении навески серы массой 9,6 г в избытке раствора гидроксида калия получено 100 г раствора. Рассчитайте массовую долю сульфида калия в получившемся растворе. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Основание (химия) — это… Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение
Классификация
Основания классифицируются по ряду признаков.
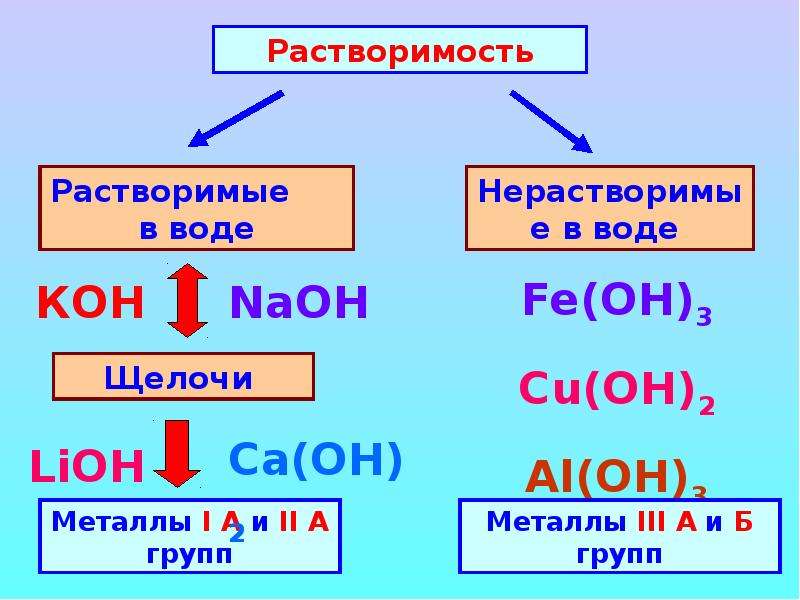
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.

- Летучие: NH
- Нелетучие: щёлочи, нерастворимые основания.
- Летучие: NH
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
- Tl2O3•n H2O — полигидрат оксида таллия(III)
- MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
- Примечание: реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Основания вступают в обменные реакции (реагируют с растворами солей):
- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.

См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9
Введение в титрование
https://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-introduction2021-04-30T03:04:38ZВведение в титрованиеВведение в кислотно-щелочное титрование на примере титрования 20,0 мл HCl неизвестной концентрации с 0,100 моль/л раствором NaOH. В этом уроке мы узнаем как выбрать соответствующие индикаторы, что такое конечная точка, точка эквивалентности, а также научимся рассчитывать неизвестную концентрацию исследуемого раствора.Jayvideohttps://cdn.kastatic.org/googleusercontent/wwC4m1ihyER4iKAMoxXi7-AkYFcDw9sNGZ-aBTZhjqiqvOtK0B0xeHDfNhLxzAAh4i9_KhFX-QC_aI-omO3_KCAВведение в титрованиеВведение в кислотно-щелочное титрование на примере титрования 20,0 мл HCl неизвестной концентрации с 0,100 моль/л раствором NaOH. В этом уроке мы узнаем как выбрать соответствующие индикаторы, что такое конечная точка, точка эквивалентности, а также научимся рассчитывать неизвестную концентрацию исследуемого раствора.https://cdn.kastatic.org/ka-youtube-converted/Qt_DDqhBCg8.mp4/Qt_DDqhBCg8.mp4530Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-calculation-example2021-05-08T09:16:20ZПример вычисления концентрации вещества при помощи титрованияПример титрования сильной кислоты (соляной) с сильным основанием (гидроксид бария). Как рассчитать неизвестную концентрацию, если у вас нет молярного соотношения 1:1 (H+ к OH-).Jayvideohttps://cdn.kastatic.org/googleusercontent/0dFNgJGgoVbahvyiY5YntkZQIqccZQ1imVCLKVSbr6rhHiSJCLOk-yy7RFumf8Yo_QP5D62j9NqHxaM0KR10RCcПример вычисления концентрации вещества при помощи титрованияПример титрования сильной кислоты (соляной) с сильным основанием (гидроксид бария). Как рассчитать неизвестную концентрацию, если у вас нет молярного соотношения 1:1 (H+ к OH-).
В этом уроке мы узнаем как выбрать соответствующие индикаторы, что такое конечная точка, точка эквивалентности, а также научимся рассчитывать неизвестную концентрацию исследуемого раствора.https://cdn.kastatic.org/ka-youtube-converted/Qt_DDqhBCg8.mp4/Qt_DDqhBCg8.mp4530Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-calculation-example2021-05-08T09:16:20ZПример вычисления концентрации вещества при помощи титрованияПример титрования сильной кислоты (соляной) с сильным основанием (гидроксид бария). Как рассчитать неизвестную концентрацию, если у вас нет молярного соотношения 1:1 (H+ к OH-).Jayvideohttps://cdn.kastatic.org/googleusercontent/0dFNgJGgoVbahvyiY5YntkZQIqccZQ1imVCLKVSbr6rhHiSJCLOk-yy7RFumf8Yo_QP5D62j9NqHxaM0KR10RCcПример вычисления концентрации вещества при помощи титрованияПример титрования сильной кислоты (соляной) с сильным основанием (гидроксид бария). Как рассчитать неизвестную концентрацию, если у вас нет молярного соотношения 1:1 (H+ к OH-). https://cdn.kastatic.org/ka-youtube-converted/aw-7J9XXr5s.mp4/aw-7J9XXr5s.mp4470Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-strong-acid-with-a-strong-base2021-01-11T12:02:49ZТитрование сильной кислоты сильным основанием. Часть 1При кислотно-основном титровании сильная кислота и основание будут реагировать с образованием нейтрального раствора. В точке эквивалентности реакции ионы гидрония (H+) и гидроксида (OH-) вступают в реакцию с образованием воды, в результате pH получается равным 7. Это верно для всех сильных кислот и оснований. Примером этого может служить титрование соляной кислоты (сильная кислота) и гидроксида натрия (сильное основание) с образованием хлорида натрия и воды.Jayvideohttps://cdn.kastatic.org/googleusercontent/nwNZe3Ny2HPY4yU1Oztxotau4bFY591l0LXkYtMw-yFr0opryRTcgYCsM2_giS_E3AaMF0RJXz4RT837ls5AcyDrAAТитрование сильной кислоты сильным основанием. Часть 1При кислотно-основном титровании сильная кислота и основание будут реагировать с образованием нейтрального раствора.
https://cdn.kastatic.org/ka-youtube-converted/aw-7J9XXr5s.mp4/aw-7J9XXr5s.mp4470Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-strong-acid-with-a-strong-base2021-01-11T12:02:49ZТитрование сильной кислоты сильным основанием. Часть 1При кислотно-основном титровании сильная кислота и основание будут реагировать с образованием нейтрального раствора. В точке эквивалентности реакции ионы гидрония (H+) и гидроксида (OH-) вступают в реакцию с образованием воды, в результате pH получается равным 7. Это верно для всех сильных кислот и оснований. Примером этого может служить титрование соляной кислоты (сильная кислота) и гидроксида натрия (сильное основание) с образованием хлорида натрия и воды.Jayvideohttps://cdn.kastatic.org/googleusercontent/nwNZe3Ny2HPY4yU1Oztxotau4bFY591l0LXkYtMw-yFr0opryRTcgYCsM2_giS_E3AaMF0RJXz4RT837ls5AcyDrAAТитрование сильной кислоты сильным основанием. Часть 1При кислотно-основном титровании сильная кислота и основание будут реагировать с образованием нейтрального раствора. В точке эквивалентности реакции ионы гидрония (H+) и гидроксида (OH-) вступают в реакцию с образованием воды, в результате pH получается равным 7. Это верно для всех сильных кислот и оснований. Примером этого может служить титрование соляной кислоты (сильная кислота) и гидроксида натрия (сильное основание) с образованием хлорида натрия и воды.https://cdn.kastatic.org/ka-youtube-converted/TCyUgg485Mk.mp4/TCyUgg485Mk.mp4612Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-strong-acid-with-a-strong-base-continued2021-01-11T12:02:49ZТитрование сильной кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/usBGTj7JEFIJzrg6oTySD_n-BMnmcgzaEMRU-ZwWKAmVNxpI_YeTdB9-J7uqEjUD5Q8LckE4ItwIbaN0Z4OIDpLQrQТитрование сильной кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.
В точке эквивалентности реакции ионы гидрония (H+) и гидроксида (OH-) вступают в реакцию с образованием воды, в результате pH получается равным 7. Это верно для всех сильных кислот и оснований. Примером этого может служить титрование соляной кислоты (сильная кислота) и гидроксида натрия (сильное основание) с образованием хлорида натрия и воды.https://cdn.kastatic.org/ka-youtube-converted/TCyUgg485Mk.mp4/TCyUgg485Mk.mp4612Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-strong-acid-with-a-strong-base-continued2021-01-11T12:02:49ZТитрование сильной кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/usBGTj7JEFIJzrg6oTySD_n-BMnmcgzaEMRU-ZwWKAmVNxpI_YeTdB9-J7uqEjUD5Q8LckE4ItwIbaN0Z4OIDpLQrQТитрование сильной кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности. https://cdn.kastatic.org/ka-youtube-converted/0pW1uFq4F4Y.mp4/0pW1uFq4F4Y.mp4617Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-acid-with-a-strong-base2021-01-11T12:02:50ZТитрование слабой кислоты сильным основанием. Часть 1Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH до начала титрования и в точке полуэквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/ukCnRO1OKlFXzmGgv5y8O_nd1XSooBQS_j0xp-NuOeYfWWDBrOjGvfGun_ncAlAY6PYTcwNOSdabM64T6JYHxUsТитрование слабой кислоты сильным основанием. Часть 1Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH до начала титрования и в точке полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WN6oVDV5BEc.mp4/WN6oVDV5BEc.mp4867Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-acid-with-a-strong-base-continued2021-01-11T12:02:49ZТитрование слабой кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/bwu5usJWd0K2b22PG0c55G2YlsY6OJr29IiuCVmP8uqFhosv7e0Is5aF9UTze3of-cHWEbCOD8uxClAbQaIc9yFXpgТитрование слабой кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WceBOpxuf-I.mp4/WceBOpxuf-I.mp4913Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-base-with-a-strong-acid2021-01-11T12:02:50ZТитрование слабого основание сильной кислотой. Часть 1При титровании слабого основания сильной кислотой кислота с основанием будут взаимодействовать с образованием кислого раствора. В результате получится сопряжённая кислота, которая затем вступит в реакцию с водой с образованием ионов гидрония. Таким образом уровень pH получившегося раствора будет ниже семи. Примером может послужить титрование аммиака (слабое основание) соляной кислотой (сильная кислота), вследствие чего образуется сопряженная кислота аммония, и раствор становится кислым.Jayvideohttps://cdn.kastatic.org/googleusercontent/dUbOKPWIfB0HILmSii2afyP5IXGlGZuvRK4qcS5jXds9VUxeO-U4sqs4MNVMxxFncllDgYbLwfSrufNLs1Cvq5RnТитрование слабого основание сильной кислотой. Часть 1При титровании слабого основания сильной кислотой кислота с основанием будут взаимодействовать с образованием кислого раствора. В результате получится сопряжённая кислота, которая затем вступит в реакцию с водой с образованием ионов гидрония. Таким образом уровень pH получившегося раствора будет ниже семи. Примером может послужить титрование аммиака (слабое основание) соляной кислотой (сильная кислота), вследствие чего образуется сопряженная кислота аммония, и раствор становится кислым.https://cdn.kastatic.org/ka-youtube-converted/751o7icQGaE.mp4/751o7icQGaE.mp4898Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-base-with-a-strong-acid-continued2021-01-11T12:02:49ZТитрование слабого основание сильной кислотой. Часть 2 Рассчитываем pH при титровании слабого основания, аммиака, с помощью сильной кислоты, HCl, в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/uIKje1Dl2lRQbj-dvnVzjP9Val1aM4lfbeu7YTozQ1fF6oPnCHiD6NVn4_tpkNJI_XII6V_AL5LsHcpucMn3Pq1imgТитрование слабого основание сильной кислотой. Часть 2 Рассчитываем pH при титровании слабого основания, аммиака, с помощью сильной кислоты, HCl, в точке эквивалентности и после точки эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/FMwLSvZtsRw.mp4/FMwLSvZtsRw.mp4888Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3b2021-01-11T12:02:50ZЗадачи по химии с экзамена 2015 года, задача 3bВычисляем концентрацию слабого основания на основе данных о точке эквивалентности при титровании.videohttps://cdn.kastatic.org/googleusercontent/fLXUmz-9z1cyTxCS-q0vQuVKptE2dHSJZqKjTLnDhyCl5Yw6IxXWEWS8Y0JyqVMOQlnjagjLJ_6fDHnFvqCMjzkЗадачи по химии с экзамена 2015 года, задача 3bВычисляем концентрацию слабого основания на основе данных о точке эквивалентности при титровании.https://cdn.kastatic.org/ka-youtube-converted/V4txaUgwEdg.mp4/V4txaUgwEdg.mp4376Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3c2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3cВыбираем наиболее подходящий индикатор для определения конечной точки титрования.videohttps://cdn.kastatic.org/googleusercontent/tJOS7TrovGrEk9b9W_CAi8rUeNCTqvxh5Ld9CL3f47zozU7JAUedQBjT6GLh2iO-QqrvaJspGk89CAhEdScAxc7aygЗадачи по химии с экзамена 2015 года, задача 3cВыбираем наиболее подходящий индикатор для определения конечной точки титрования.https://cdn.kastatic.org/ka-youtube-converted/hFHpRoIZp0E.mp4/hFHpRoIZp0E.mp470Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3d2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3dРасчет pH раствора в точке полу-эквивалентности для титрования слабого основания сильной кислотой HCl.videohttps://cdn.kastatic.org/googleusercontent/lhNzCLT-zY69INrs3u4H6U5yqGNM4pwEQVgCJm5QBGULWjmsZdfmNzYDbOBRmQv6cIMGkYGoJeSwJfwcW8clPODbЗадачи по химии с экзамена 2015 года, задача 3dРасчет pH раствора в точке полу-эквивалентности для титрования слабого основания сильной кислотой HCl.https://cdn.kastatic.org/ka-youtube-converted/o3U-Or96RdY.mp4/o3U-Or96RdY.mp4256Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3e2021-01-11T12:02:50ZЗадачи по химии с экзамена 2015 года, задача 3eСтроим кривую титрования, зная точку эквивалентности и полуэквивалентности.videohttps://cdn.kastatic.org/googleusercontent/fZdaDcb4IYJzubtzAawYO0YD097S-3hKnLn6Iyqr6qW9KPB6s12bZGhgZv8r0-ZEfrf0rO6LCGfhJ4jqma1pexndЗадачи по химии с экзамена 2015 года, задача 3eСтроим кривую титрования, зная точку эквивалентности и полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/5MANZ52pAKU.mp4/5MANZ52pAKU.mp4176Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-resonse-3f2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3fАнализируем концентрации, при которых pH ниже точки полуэквивалентности.videohttps://cdn.kastatic.org/googleusercontent/N1879yrcyvC1v92zDauIunQ9UgBUv4T4QmW1VkaqOxX9VOr3bSS6N-58yRhRmTvMu1egXFzMVrM929u9SJGnur_5Задачи по химии с экзамена 2015 года, задача 3fАнализируем концентрации, при которых pH ниже точки полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WyZY4-3gjyU.mp4/WyZY4-3gjyU.mp4282Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-curves-and-acid-base-indicators2021-01-11T12:02:49ZКривые титрования и кислотно-основные индикаторыВыбор подходящего индикатора для титрования в зависимости от значения рН в точке эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/LBKbBshyK99HnBBRKH_uQo1fucyXtiBN0AKwTcrLS08hqvz91pfddHcRX0zdBYk3qt5d7QPXcf-DUGCT1y7Jj9SsКривые титрования и кислотно-основные индикаторыВыбор подходящего индикатора для титрования в зависимости от значения рН в точке эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/9gtj1P8kER8.mp4/9gtj1P8kER8.mp4430Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-roundup2021-01-11T12:02:50ZТитрование — итогиПодводим итоги и рассматриваем различные кривые титрования, сравнивая начальный уровень pH и уровень pH в точке эквивалентности для разных типов титрования.Сэл Ханvideohttps://cdn.kastatic.org/googleusercontent/5YBlsyngE0RfEhMHcs0Bo2hN9Uw750QiPZ2hvVHZVnVfHzX3a3LLSq1l8jPDYEBHdVaS51DjEAqPKQKIfg8YiIdiТитрование — итогиПодводим итоги и рассматриваем различные кривые титрования, сравнивая начальный уровень pH и уровень pH в точке эквивалентности для разных типов титрования.https://cdn.kastatic.org/ka-youtube-converted/zh8KL4-ys5E.mp4/zh8KL4-ys5E.mp4662Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/acid-base-titration2021-01-11T12:02:50ZЗадача на кислотно-основное титрованиеПри помощи титрования находим массу слабой щавелевой кислоты. Сэл Ханvideohttps://cdn.kastatic.org/googleusercontent/vvoKHUBRmbiMbOAL44eGBpksoDB83Dcr7R4ZsFLoFfGfdEm1OGkf5Sdwc5qLFsjtlAGahFqEIU0niAnSHfSmf9ALOAЗадача на кислотно-основное титрованиеПри помощи титрования находим массу слабой щавелевой кислоты. https://cdn.kastatic.org/ka-youtube-converted/vdAhnC31maU.mp4/vdAhnC31maU.mp4751Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/redox-titration2021-05-08T09:16:20Z Титрование окислительно-восстановительной реакцииПример окислительно-восстановительного титрования: титрование раствора Fe (II) перманганатом калия.Jayvideohttps://cdn.kastatic.org/googleusercontent/BPObG2_2bDElT6YXT4u0uqA8IzbzsPJUwnEvyWimCOn98PAKgSy6JZcFm6fewADrgywPFPNtfpgBTpcypR8u2K0 Титрование окислительно-восстановительной реакцииПример окислительно-восстановительного титрования: титрование раствора Fe (II) перманганатом калия.https://cdn.kastatic.org/ka-youtube-converted/iFcznUhlcvg.mp4/iFcznUhlcvg.mp4478Титрование
https://cdn.kastatic.org/ka-youtube-converted/0pW1uFq4F4Y.mp4/0pW1uFq4F4Y.mp4617Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-acid-with-a-strong-base2021-01-11T12:02:50ZТитрование слабой кислоты сильным основанием. Часть 1Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH до начала титрования и в точке полуэквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/ukCnRO1OKlFXzmGgv5y8O_nd1XSooBQS_j0xp-NuOeYfWWDBrOjGvfGun_ncAlAY6PYTcwNOSdabM64T6JYHxUsТитрование слабой кислоты сильным основанием. Часть 1Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH до начала титрования и в точке полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WN6oVDV5BEc.mp4/WN6oVDV5BEc.mp4867Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-acid-with-a-strong-base-continued2021-01-11T12:02:49ZТитрование слабой кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/bwu5usJWd0K2b22PG0c55G2YlsY6OJr29IiuCVmP8uqFhosv7e0Is5aF9UTze3of-cHWEbCOD8uxClAbQaIc9yFXpgТитрование слабой кислоты сильным основанием. Часть 2Рассчитываем pH при титровании уксусной кислоты сильным основанием NaOH в точке эквивалентности и после точки эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WceBOpxuf-I.mp4/WceBOpxuf-I.mp4913Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-base-with-a-strong-acid2021-01-11T12:02:50ZТитрование слабого основание сильной кислотой. Часть 1При титровании слабого основания сильной кислотой кислота с основанием будут взаимодействовать с образованием кислого раствора. В результате получится сопряжённая кислота, которая затем вступит в реакцию с водой с образованием ионов гидрония. Таким образом уровень pH получившегося раствора будет ниже семи. Примером может послужить титрование аммиака (слабое основание) соляной кислотой (сильная кислота), вследствие чего образуется сопряженная кислота аммония, и раствор становится кислым.Jayvideohttps://cdn.kastatic.org/googleusercontent/dUbOKPWIfB0HILmSii2afyP5IXGlGZuvRK4qcS5jXds9VUxeO-U4sqs4MNVMxxFncllDgYbLwfSrufNLs1Cvq5RnТитрование слабого основание сильной кислотой. Часть 1При титровании слабого основания сильной кислотой кислота с основанием будут взаимодействовать с образованием кислого раствора. В результате получится сопряжённая кислота, которая затем вступит в реакцию с водой с образованием ионов гидрония. Таким образом уровень pH получившегося раствора будет ниже семи. Примером может послужить титрование аммиака (слабое основание) соляной кислотой (сильная кислота), вследствие чего образуется сопряженная кислота аммония, и раствор становится кислым.https://cdn.kastatic.org/ka-youtube-converted/751o7icQGaE.mp4/751o7icQGaE.mp4898Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-of-a-weak-base-with-a-strong-acid-continued2021-01-11T12:02:49ZТитрование слабого основание сильной кислотой. Часть 2 Рассчитываем pH при титровании слабого основания, аммиака, с помощью сильной кислоты, HCl, в точке эквивалентности и после точки эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/uIKje1Dl2lRQbj-dvnVzjP9Val1aM4lfbeu7YTozQ1fF6oPnCHiD6NVn4_tpkNJI_XII6V_AL5LsHcpucMn3Pq1imgТитрование слабого основание сильной кислотой. Часть 2 Рассчитываем pH при титровании слабого основания, аммиака, с помощью сильной кислоты, HCl, в точке эквивалентности и после точки эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/FMwLSvZtsRw.mp4/FMwLSvZtsRw.mp4888Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3b2021-01-11T12:02:50ZЗадачи по химии с экзамена 2015 года, задача 3bВычисляем концентрацию слабого основания на основе данных о точке эквивалентности при титровании.videohttps://cdn.kastatic.org/googleusercontent/fLXUmz-9z1cyTxCS-q0vQuVKptE2dHSJZqKjTLnDhyCl5Yw6IxXWEWS8Y0JyqVMOQlnjagjLJ_6fDHnFvqCMjzkЗадачи по химии с экзамена 2015 года, задача 3bВычисляем концентрацию слабого основания на основе данных о точке эквивалентности при титровании.https://cdn.kastatic.org/ka-youtube-converted/V4txaUgwEdg.mp4/V4txaUgwEdg.mp4376Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3c2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3cВыбираем наиболее подходящий индикатор для определения конечной точки титрования.videohttps://cdn.kastatic.org/googleusercontent/tJOS7TrovGrEk9b9W_CAi8rUeNCTqvxh5Ld9CL3f47zozU7JAUedQBjT6GLh2iO-QqrvaJspGk89CAhEdScAxc7aygЗадачи по химии с экзамена 2015 года, задача 3cВыбираем наиболее подходящий индикатор для определения конечной точки титрования.https://cdn.kastatic.org/ka-youtube-converted/hFHpRoIZp0E.mp4/hFHpRoIZp0E.mp470Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3d2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3dРасчет pH раствора в точке полу-эквивалентности для титрования слабого основания сильной кислотой HCl.videohttps://cdn.kastatic.org/googleusercontent/lhNzCLT-zY69INrs3u4H6U5yqGNM4pwEQVgCJm5QBGULWjmsZdfmNzYDbOBRmQv6cIMGkYGoJeSwJfwcW8clPODbЗадачи по химии с экзамена 2015 года, задача 3dРасчет pH раствора в точке полу-эквивалентности для титрования слабого основания сильной кислотой HCl.https://cdn.kastatic.org/ka-youtube-converted/o3U-Or96RdY.mp4/o3U-Or96RdY.mp4256Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-response-3e2021-01-11T12:02:50ZЗадачи по химии с экзамена 2015 года, задача 3eСтроим кривую титрования, зная точку эквивалентности и полуэквивалентности.videohttps://cdn.kastatic.org/googleusercontent/fZdaDcb4IYJzubtzAawYO0YD097S-3hKnLn6Iyqr6qW9KPB6s12bZGhgZv8r0-ZEfrf0rO6LCGfhJ4jqma1pexndЗадачи по химии с экзамена 2015 года, задача 3eСтроим кривую титрования, зная точку эквивалентности и полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/5MANZ52pAKU.mp4/5MANZ52pAKU.mp4176Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/2015-ap-chemistry-free-resonse-3f2021-01-11T12:02:49ZЗадачи по химии с экзамена 2015 года, задача 3fАнализируем концентрации, при которых pH ниже точки полуэквивалентности.videohttps://cdn.kastatic.org/googleusercontent/N1879yrcyvC1v92zDauIunQ9UgBUv4T4QmW1VkaqOxX9VOr3bSS6N-58yRhRmTvMu1egXFzMVrM929u9SJGnur_5Задачи по химии с экзамена 2015 года, задача 3fАнализируем концентрации, при которых pH ниже точки полуэквивалентности.https://cdn.kastatic.org/ka-youtube-converted/WyZY4-3gjyU.mp4/WyZY4-3gjyU.mp4282Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-curves-and-acid-base-indicators2021-01-11T12:02:49ZКривые титрования и кислотно-основные индикаторыВыбор подходящего индикатора для титрования в зависимости от значения рН в точке эквивалентности.Jayvideohttps://cdn.kastatic.org/googleusercontent/LBKbBshyK99HnBBRKH_uQo1fucyXtiBN0AKwTcrLS08hqvz91pfddHcRX0zdBYk3qt5d7QPXcf-DUGCT1y7Jj9SsКривые титрования и кислотно-основные индикаторыВыбор подходящего индикатора для титрования в зависимости от значения рН в точке эквивалентности.https://cdn.kastatic.org/ka-youtube-converted/9gtj1P8kER8.mp4/9gtj1P8kER8.mp4430Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/titration-roundup2021-01-11T12:02:50ZТитрование — итогиПодводим итоги и рассматриваем различные кривые титрования, сравнивая начальный уровень pH и уровень pH в точке эквивалентности для разных типов титрования.Сэл Ханvideohttps://cdn.kastatic.org/googleusercontent/5YBlsyngE0RfEhMHcs0Bo2hN9Uw750QiPZ2hvVHZVnVfHzX3a3LLSq1l8jPDYEBHdVaS51DjEAqPKQKIfg8YiIdiТитрование — итогиПодводим итоги и рассматриваем различные кривые титрования, сравнивая начальный уровень pH и уровень pH в точке эквивалентности для разных типов титрования.https://cdn.kastatic.org/ka-youtube-converted/zh8KL4-ys5E.mp4/zh8KL4-ys5E.mp4662Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/acid-base-titration2021-01-11T12:02:50ZЗадача на кислотно-основное титрованиеПри помощи титрования находим массу слабой щавелевой кислоты. Сэл Ханvideohttps://cdn.kastatic.org/googleusercontent/vvoKHUBRmbiMbOAL44eGBpksoDB83Dcr7R4ZsFLoFfGfdEm1OGkf5Sdwc5qLFsjtlAGahFqEIU0niAnSHfSmf9ALOAЗадача на кислотно-основное титрованиеПри помощи титрования находим массу слабой щавелевой кислоты. https://cdn.kastatic.org/ka-youtube-converted/vdAhnC31maU.mp4/vdAhnC31maU.mp4751Титрованиеhttps://ru.khanacademy.org/science/chemistry/acid-base-equilibrium/titrations/v/redox-titration2021-05-08T09:16:20Z Титрование окислительно-восстановительной реакцииПример окислительно-восстановительного титрования: титрование раствора Fe (II) перманганатом калия.Jayvideohttps://cdn.kastatic.org/googleusercontent/BPObG2_2bDElT6YXT4u0uqA8IzbzsPJUwnEvyWimCOn98PAKgSy6JZcFm6fewADrgywPFPNtfpgBTpcypR8u2K0 Титрование окислительно-восстановительной реакцииПример окислительно-восстановительного титрования: титрование раствора Fe (II) перманганатом калия.https://cdn.kastatic.org/ka-youtube-converted/iFcznUhlcvg.mp4/iFcznUhlcvg.mp4478ТитрованиеХимические свойства оснований
Основания
Помощник: Сайкум
K OH K + + OH —
Ba (ОН) 2 Ba 2+ + 2 OH —
Основания – вещества, в растворах которых содержатся гидроксильные ионы
Какие из перечисленных оснований щелочи?
Нерастворимые основания
Щелочи
а) КОН
б) Cu(ОН) 2
в) NH 4 OH
д) Ba(ОН) 2
г) Al(ОН) 3
а) КОН
б) Cu(ОН) 2
в) NH 4 OH
г) Al(ОН) 3
д) Ba(ОН) 2
Сильные и слабые основания
Слабые основания
Сильные основания
щелочи
Все нерастворимые основания и NH 4 OH
LiOH гидроксид лития
NH 4 OH гидроксид аммония
NaOH гидроксид натрия
Mg(OH) 2 гидроксид магния
(едкий натр)
KOH гидроксид калия
Fe(OH) 2 гидроксид железа (II)
(едкое кали)
Zn(OH) 2 гидроксид цинка
Fe(OH) 3 гидроксид железа (III)
RbOH гидроксид рубидия
CsOH гидроксид цезия
Ca(OH) 2 гидроксид кальция Sr(OH) 2 гидроксид стронция Ba(OH) 2 гидроксид бария
Химические свойства
Нерастворимые основания
Щелочи изменяют окраску индикаторов
Взаимодействуют с:
1) Кислотами
2) Кислотными оксидами
3) Растворами солей
1) Взаимодействуют с
Кислотами
2) При нагревании разлагаются
Cu(OН) 2 =
С
HСI+NaOH =
+ Н 2 О
О
Л
Ь
щелочь
кислота
=
оксид неме
+
талла
=
Растворсоли
=
+ Н 2 О
Ca(OH) 2 + CO 2 =
(NH 4 )₂SO₄ + КОН =
NH 4 NO 3 + КОН =
+ новое основание
ЩЕЛОЧИ:
1. С КИСЛОТАМИ
Щелочь +Кислота = СОЛЬ + H₂O ( р-я обмена)
↓
NaOH + HСI = NaCI + H₂O (р-я нейтрализации)
↓
2. С ОКСИДАМИ НЕМЕТАЛЛОВ
Щелочь + оксид неметалла = СОЛЬ + Н₂О ( р-я обмена)
6NaOH + P 2 O 5 2Na 3 PO 4 + 3H 2 O
Ca(OН)₂ + CO 2 = CaCO 3 + H₂O
3. С РАСТВОРАМИ СОЛЕЙ
ЩЕЛОЧЬ + Р-Р СОЛЬ = НОВАЯ СОЛЬ + НОВОЕ ОСНОВАНИЕ ( р-я обмена)
Протекают только при условии: образуются осадок или газ
(NH 4 )₂SO₄ + 2КОН = К ₂SO₄ + 2 NH 3 + 2 H₂O
NH 4 NO 3 + КОН = КNO 3 + NH 3 + H₂O
Cu(NO 3 ) 2 + 2NaOH = Cu(OН) 2 ↓ + 2NaNO 3
НЕРАСТВОРИМЫЕ ОСНОВАНИЯ:
1. С КИСЛОТАМИ
Нерастворимое основание + Кислота = СОЛЬ + Н₂О ( р-я обмена)
Cu( OH) 2 + 2 H NO 3 = Cu(NO 3 ) 2 + 2 H 2 O
2. ПРИ НАГРЕВАНИИ РАЗЛАГАЮТСЯ ( р-я разложения)
Cu(OН) 2 = CuO + H₂O
2 Fe(OH) 3 = Fe 2 O 3 + 3 H 2 O
6 NaOH + P 2 O 5 2 Na 3 PO 4 + 3 H 2 O
Щелочь
Соль
+
+
Н 3 PO 4
Кислотный оксид
Вода
Ca( OH) 2 + CO 2 Ca CO 3 + H 2 O
Нейтрализация
Н 2 CO 3
с кислотные оксиды, кислоты и их соли
Кислотный оксид
Соответствующая кислота
Кислотный остаток в соли
SO 2
H 2 SO 3
Me SO 3 (II) сульфит
SO 3
H 2 SO 4
Me SO 4 (II) сульфат
Me PO 4 (III) фосфат
H 3 PO 4
P 2 O 5
N 2 O 5
H NO 3
Me NO 3 (I) нитрат
Me CO 3 (II) карбонат
CO 2
H 2 CO 3
SiO 2
H 2 SiO 3
Me SiO 3 (II) силикат
Закрепление
- C какими из перечисленных веществ взаимодействует NaOH. Составьте уравнения возможных реакции.
1. SO 3 ;
2. LiOH;
3. Ва(NO)₃;
4. НСl;
5. FeCI 2 ;
6. LiNO₃;
Ответ
1. 2NaOH + SO 3 → Na 2 SO 4 + 2H₂O
2. NaOH + 2LiОН →
3. 2NaOH + Ba(NO₃)₂ →
4. NaOH + HCl → NaCI + H₂O
5. 2NaOH + FeCI 2 → Fe (OH)₂ ↓ + 2NaCI
6. NaOH + LiNO₃ →
Домашнее задание
Упражнение:
стр 162-163
Гидроксид — бериллий — Большая Энциклопедия Нефти и Газа, статья, страница 2
Гидроксид — бериллий
Cтраница 2
Гидроксид бериллия Ве ( ОН) 2 имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов щелочноземельных металлов. [16]
Гидроксид бериллия Ве ( ОН) 2 амфотерен. Амфотерность гидроксида бериллия резко отличает этот элемент от других элементов главной подгруппы II группы. В этом отношении бериллий напоминает алюминий. Оба металла ( Be и AI) растворяются в щелочах с образованием соответственно бериллатов или алюминатов. [17]
Гидроксид бериллия Be ( ОН) 2 имеет ясно выраженный амфо-терный характер, чем резко отличается от гидроксидов щелочноземельных металлов. [19]
Поскольку гидроксид бериллия амфотерен, для получения его осаждением из растворов солей применяют не щелочи, а гидрат аммиака. Вот почему гидроксид магния в присутствии избытка катионов аммония переходит в раствор, а гидроксид бериллия не переходит. [20]
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидроли-зуются. [21]
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидролизуются. [22]
Кислотные свойства гидроксида бериллия выражены очень слабо, полому в водном растворе бериллаты сильно гидролнзуются. [23]
Гидроксид бария содержит примесь гидроксида бериллия. [24]
Вместо него из раствора выпадает гидроксид бериллия. [26]
Какие свойства имеют оксиды и гидроксиды бериллия и магния. [27]
Бериллиевые концентраты перерабатывают в оксид или гидроксид бериллия, из которых получают фторид или хлорид бериллия. Металлический бериллий получают либо восстановлением фторида бериллия магнием, либо электролизом из хлоридного электролита. [28]
Гидроксиды проявляют основные свойства за исключением гидроксида бериллия, который амфотерен. [29]
Различаются между собой и гидроксиды этой группы: гидроксид бериллия Be ( ОН) 2 — амфотерное основание, гидроксид магния Mg ( OH) 2 — слабое основание [ хотя диссоциирует сильнее, чем такие слабые основания, как, например, Zn ( OH) 2, A1 ( OH) 3 ], гидроксиды кальция, стронция, бария и радия — сильные основания. Растворы Са ( ОН) 2 и Ва ( ОН) 2 называют соответственно известковой и баритовой водой. [30]
Страницы: 1 2 3
Является ли гидроксид бария сильным основанием?
ДА. Гидроксид бария — сильное основание, такое как NaOH, КОН.
Гидроксид бария — группа Гидроксид металла IIA, и он очень хорошо растворяется в воде, образуя прочное основание. решение, такое как группа IA гидроксиды металлов. Гидроксид бария полностью диссоциирует в воде с образованием ионов бария и гидроксильные ионы.
Что такое сильная база?
Сильное основание полностью диссоциирует на катион и анион в воде. Это реакция , а не . обратимый.
При увеличении концентрации OH — на больше и больше базовая сила базы увеличивается.
Пример: OH — концентрация водный раствор аммиака намного меньше по сравнению с OH — концентрация водного Ba (OH) 2 .Следовательно, водный раствор аммиака считать слабым основанием, а Ba (OH) 2 — сильным основанием.
Растворимость Ba (OH)
2Растворимость Ba (OH) 2 больше, чем Be (OH) 2 , Mg (OH) 2 , Ca (OH) 2 и Sr (OH) 2 . Это причина, по которой гидроксид бария стал более сильным основанием, чем другая группа 2. металл гидроксиды.
Диссоциация гидроксида бария в воде
Теперь мы знаем, что Ba (OH) 2 полностью диссоциирует в воде.
Как на практике доказать, что гидроксид бария является сильным основанием? — определить pH
Приготовьте раствор гидроксида бария с концентрацией 0,005 моль / дм -3 . Вы можете приготовить этот раствор, отмерив 0,86 г Ba (OH) 2 и растворив его в 1 дм 3 дистиллированной воды. Затем проверьте pH приготовленного раствора гидроксида бария.Вы можете видеть, что значение pH составляет 12.
Если значение pH равно 12, концентрация OH — должна быть 0,01 моль-дм -3 . Это как двукратная концентрация приготовленного раствора Ba (OH) 2 . Таким образом, очевидно, что гидроксид бария является сильным основанием и полностью диссоциирует в воде.
Основные характеристики гидроксидов других щелочноземельных металлов
- Be (OH) 2 , Mg (OH) 2 — Слабые основания и белые осадки
- Ca (OH) 2 — Щелочь и растворить в избытке воды.Если концентрация ионов увеличивается, осаждается в виде белого осадок.
- Sr (OH) 2 , Ba (OH) 2 — Сильные основания
Основные характеристики щелочноземельных металлов ‘ гидроксидов увеличивается при понижении группы.
BaO и Ba (OH)
2BaO легко растворяется в воде с образованием бесцветного раствора Ba (OH) 2 .
Какие еще сильные базы?
Гидроксиды всех щелочных металлов являются сильными основаниями.Из гидроксидов щелочноземельных металлов Sr (OH) 2 и Ba (OH) 2 — сильные основания
Вопросы студентов
Задайте свой вопрос по химии
Является ли Ba (OH)
2 более сильным основанием, чем Sr (OH) 2 ?Растворимость Ba (OH) 2 намного выше, чем Sr (OH) 2 . Таким образом, большее количество OH — может быть передано с помощью Ba (OH) 2 водному раствору.Следовательно, Ba (OH) 2 является более сильным основанием, чем Sr (OH) 2 .
Гидроксид бария кислота или основание?
Посмотрите на диссоциацию гидроксида бария в воде. Как видите, из него в воду передаются ионы гидроксила (OH — ). Тогда концентрация OH — увеличивается больше, чем концентрация H 3 O + . Это доказывает, что гидроксид бария — это кислота.
Уравнение диссоциации ba (oh) 2 + naoh
Диссоциация Ba (OH) 2 и NaOH происходит отдельно, как показано ниже.
Ba (OH) 2 → Ba 2+ + 2OH —
NaOH → Na + + OH —
Связанные руководства для Ba (OH)
2 сильная кислота?Кислоты и основания — сильные и слабые кислоты и основания — гидроксидные, уксусные, растворные и ионизированные
Важным фактором при работе с кислотами и основаниями является их сила ; то есть, насколько химически они активны как кислоты и основания.Сила кислоты или основания определяется степенью ионизации кислоты или основания в растворе, то есть процентным содержанием растворенных молекул кислоты или основания, которые выделяют ионы водорода или гидроксида. Если вся растворенная кислота или основание разделяется на ионы, это называется сильной кислотой или сильным основанием . В противном случае это слабая кислота или слабое основание . Есть только несколько сильных кислот: соляная кислота (HCl), бромистоводородная кислота (HBr), йодоводородная кислота (HI), хлорная кислота (HClO 4 ), азотная кислота (HNO 3 ) и . серная кислота (H 2 SO 4 ).Точно так же есть только несколько сильных оснований: гидроксид лития (LiOH), гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca [OH] 2 ), гидроксид стронция. (Sr [OH] 2 ) и гидроксид бария (Ba [OH] 2 ).
Эти сильные кислоты и основания на 100% ионизированы в водном растворе. Все остальные кислоты и основания Аррениуса являются слабыми кислотами и основаниями. Например, уксусная кислота (HC 2 H 3 O 2 ) и щавелевая кислота (H 2 C 2 O 4 ) являются слабыми кислотами, в то время как гидроксид железа , Fe (OH) 3 и гидроксид аммония, NH 4 OH (который на самом деле всего лишь аммиак , NH 3 , растворенный в воде ), являются примерами слабых оснований.Процент молекул кислоты и основания, которые ионизируются в растворе, варьируется и зависит от концентрации кислоты. Например, 2% раствор уксусной кислоты в воде, концентрация которого примерно равна концентрации уксуса, ионизирован всего на 0,7%. Это означает, что полностью 99,3% молекул уксусной кислоты неионизированы и существуют в растворе в виде полной молекулы уксусной кислоты.
Список сильных оснований (оснований Аррениуса)
Сильные основания — это основания, которые полностью диссоциируют в воде на катион и OH — (гидроксид-ион).Гидроксиды металлов группы I (щелочные металлы) и металлов группы II (щелочноземельные) обычно считаются сильными основаниями. Это классические основания Аррениуса. Вот список наиболее распространенных сильных оснований.
- LiOH — гидроксид лития
- NaOH — гидроксид натрия
- KOH — гидроксид калия
- RbOH — гидроксид рубидия
- CsOH — гидроксид цезия
- * Ca (OH) 2 — гидроксид кальция
- * Sr (OH) 2 — гидроксид стронция
- * Ba (OH) 2 — гидроксид бария
* Эти основания полностью диссоциируют в растворах 0.01 М или меньше. Другие основания составляют 1,0 М растворы и при этой концентрации диссоциируют на 100%. Есть и другие сильные основания, чем перечисленные, но они встречаются не часто.
Свойства крепких оснований
Сильные основания являются отличными акцепторами протонов (ионов водорода) и донорами электронов. Сильные основания могут депротонировать слабые кислоты. Водные растворы сильных оснований скользкие и мыльные. Однако никогда не стоит прикасаться к раствору, чтобы проверить его, потому что эти основания имеют тенденцию быть едкими.Концентрированные растворы могут вызвать химические ожоги.
Супербазы
Помимо сильных оснований Аррениуса, есть еще и супербазы. Супероснования — это основания Льюиса, которые представляют собой соли карбанионов группы 1, такие как гидриды и амиды. Основания Льюиса имеют тенденцию быть даже сильнее, чем сильные основания Аррениуса, потому что их сопряженные кислоты настолько слабы. В то время как основания Аррениуса используются в виде водных растворов, супероснования депротонируют воду, полностью вступая с ней в реакцию. В воде исходный анион сверхоснования не остается в растворе.Супероснования чаще всего используются в органической химии в качестве реагентов.
Примеры супербазов:
- Ион этоксида
- Бутиллитий (н-BuLi)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Диэтиламид лития (LDEA)
- Амид натрия (NaNH 2 )
- Гидрид натрия (NaH)
- Бис (триметилсилил) амид лития, ((CH 3 ) 3 Si) 2 NLi
Определение сильного основания — Химический глоссарий
Сильная основа — это основа, полностью диссоциированная в водном растворе.Эти соединения ионизируются в воде с образованием одного или нескольких гидроксид-ионов (OH —) на молекулу основания.
Напротив, слабое основание только частично диссоциирует на ионы в воде. Аммиак — хороший пример слабого основания.
Сильные основания реагируют с сильными кислотами с образованием стабильных соединений.
Примеры сильных оснований
К счастью, сильных баз не так уж и много. Это гидроксиды щелочных и щелочноземельных металлов.Вот таблица сильных оснований и посмотрите на ионы, которые они образуют:
| База | Формула | Ионы |
| натрия гидроксид | NaOH | Na + (водн.) + ОН — (водн.) |
| гидроксид калия | КОН | К + (водн.) + ОН — (водн.) |
| гидроксид лития | LiOH | Li + (водн.) + ОН — (водн.) |
| гидроксид рубидия | RbOH | руб. + (водн.) + ОН — (водн.) |
| гидроксид цезия | CsOH | CS + (водн.) + ОН — (водн.) |
| гидроксид кальция | Са (ОН) 2 | Ca 2+ (водн.) + 2ОН — (водн.) |
| гидроксид бария | Ba (OH) 2 | Ba 2+ (водн.) + 2ОН — (водн.) |
| гидроксид стронция | Sr (OH) 2 | Sr 2+ (водн.) + 2OH — (водн.) |
Обратите внимание, что, хотя гидроксид кальция, гидроксид бария и гидроксид стронция являются сильными основаниями, они плохо растворяются в воде.Небольшое количество соединения, которое растворяется, диссоциирует на ионы, но большая часть соединения остается в твердом состоянии.
Конъюгированные основания очень слабых кислот (pKa больше 13) являются сильными основаниями.
Супербазы
Соли амидов, карбанионов и гидроксидов группы 1 (щелочные металлы) называются супероснованиями. Эти соединения нельзя хранить в водных растворах, поскольку они являются более сильными основаниями, чем ион гидроксида. Они депротонируют воду.
4. Сильные и слабые базы
На этой странице объясняются термины «сильная» и «слабая» применительно к базам.В рамках этого он определяет и объясняет K b и pK b . Обычный способ сравнения силы оснований — посмотреть, насколько легко они производят гидроксид-ионы в растворе. Это может быть связано с тем, что они уже содержат ионы гидроксида, или потому, что они отбирают ионы водорода из молекул воды для образования ионов гидроксида.
Прочные основания
Сильное основание — это полностью ионный гидроксид натрия или гидроксид калия. Вы можете думать о соединении как о 100% расщеплении на ионы металлов и гидроксид-ионы в растворе.
Каждый моль гидроксида натрия растворяется с образованием одного моля гидроксид-ионов в растворе.
Некоторые сильные основания, такие как гидроксид кальция, плохо растворяются в воде. +] \]
Поскольку pH является мерой концентрации ионов водорода, как раствор, содержащий ионы гидроксида, может иметь pH? Чтобы понять это, нужно знать об ионном продукте для воды.-_ {(водный)} \]
В присутствии дополнительных гидроксид-ионов, скажем, из гидроксида натрия, равновесие все еще существует, но положение равновесия сдвинуто влево согласно принципу Ле Шателье. Ионов водорода будет гораздо меньше, чем в чистой воде, но ионы водорода все равно будут. PH является мерой их концентрации.
Схема метода определения pH сильного основания
- Определите концентрацию гидроксид-ионов.
- Используйте K w для определения концентрации ионов водорода.
- Преобразование концентрации ионов водорода в pH.
Пример 1
Что такое pH 0,500 моль дм -3 раствора гидроксида натрия 😕
Решение
Поскольку гидроксид натрия полностью ионный, каждый его моль дает такое же количество молей гидроксид-ионов в растворе.
[OH — ] = 0,500 моль дм -3
Теперь вы используете значение K w для температуры вашего раствора.Обычно вы принимаете это как 1,00 x 10 -14 моль 2 дм -6 .
[H + ] [OH –] = 1,00 x 10 -14
Это верно независимо от того, чистая вода или нет. В этом случае у нас есть значение для концентрации гидроксид-иона. Подставляя, что дает:
[H + ] x 0,500 = 1,00 x 10 -14
Если вы решите это для [H + ], а затем преобразуете его в pH, вы получите pH 13.-_ {(водный)} \]
Однако реакция обратима, и в любой момент около 99% аммиака все еще присутствует в виде молекул аммиака. Только около 1% фактически произвел ионы гидроксида. Слабое основание — это основание, которое не полностью превращается в ионы гидроксида в растворе. Когда слабое основание реагирует с водой, положение равновесия меняется от основания к основанию. Чем левее, тем слабее основание.
Вы можете измерить положение равновесия, написав константу равновесия для реакции.-]} {[B:]} \]
Связь между K b и pK b точно такая же, как и между всеми другими терминами «p» в этой теме:
\ [pK_b = — \ log_ {10} K_b \]
В таблице показаны некоторые значения для \ (K_b \) и \ (pK_b \) для некоторых слабых оснований.
| основание | K b (моль дм -3 ) | pK b |
|---|---|---|
| C 6 H 5 NH 2 | 4.17 х 10 -10 | 9,38 |
| NH 3 | 1,78 x 10 -5 | 4,75 |
| CH 3 NH 2 | 4,37 x 10 -4 | 3,36 |
| CH 3 CH 2 NH 2 | 5,37 x 10 -4 | 3,27 |
По мере продвижения по таблице значение K b увеличивается.Значит, укрепляются базы. По мере того, как K b становится больше, pK b становится меньше. Чем ниже значение pK b , тем сильнее база. Это точно соответствует соответствующему термину для кислот, pK a — чем меньше значение, тем сильнее кислота.
Авторы и авторство
Кислоты и Основания — MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или несколько ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; а также Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Сильные кислоты и основные растворы
15.6: Сильные кислоты и основные растворы
Сильная кислота — это соединение, которое полностью диссоциирует в водном растворе и дает концентрацию ионов гидроксония, равную начальной концентрации кислоты.Например, 0,20 М бромистоводородная кислота полностью диссоциирует в воде и дает 0,20 М ионов гидроксония и 0,20 М ионов бромида.
С другой стороны, сильное основание — это соединение, которое полностью диссоциирует в водном растворе и производит ионы гидроксида. Например, 0,015 М КОН, гидроксид металла 1-й группы, полностью диссоциирует с образованием 0,015 М OH — и 0,015 М K + .
Гидроксиды металлов 2 группы, такие как гидроксид бария [Ba (OH) 2 ] и гидроксид стронция [Sr (OH) 2 ], также являются сильными основаниями и содержат два гидроксид-иона.Это заставляет их производить более щелочной раствор по сравнению с NaOH или KOH при той же концентрации. Например, 0,015 M Ba (OH) 2 дает 0,015 M Ba + и 0,030 M гидроксид.
Поскольку сильные кислоты и основания полностью диссоциируют, молярные отношения могут использоваться для определения их концентраций гидроксония и гидроксида, которые, в свою очередь, могут использоваться для расчета pH или pOH раствора.
