Гидроксид бария, Ba(OH)2, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Свойства гидроксида бария (Ba (OH) 2) (25 полных фактов) —
By Рахул Шарма
Гидроксид бария Ba(OH)2 является одним из основных соединений бария. Давайте узнаем о его важных свойствах.
Гидроксид бария представляет собой химическое соединение, используемое при титровании кислот. Гидроксид бария является важным промышленным предшественником многих соединений бария. Гидроксид бария также является катализатор во многих органических/неорганических реакциях.
Теперь давайте рассмотрим номенклатуру, важные свойства и структуру гидроксида бария в этой статье.
Гидроксид бария название IUPAC
Компания Название ИУАПК Гидроксид бария представляет собой дигидроксид бария (2+). (+2) указывает на степень окисления, а суффикс di указывает на присутствие двух ионов гидроксида.
Химическая формула гидроксида бария
Химическая формула гидроксида бария: Ba(OH). 2.
2.
Гидроксид бария номер CAS
Компания CAS номер гидроксида бария 17194-00-2.
Гидроксид бария ChemSpider ID
Компания Идентификатор ChemSpider of Ва (ОН)2 является 26408
Химическая классификация гидроксида бария
Ва (ОН)2 химически классифицируется как:
- Неорганическая металлическая основа
- Щелочная земля гидроксид.
Молярная масса гидроксида бария
Ва (ОН)2Молярная масса 171.343. Расчет показан ниже:
Молярная масса Ва (ОН)2=MBa+2*МOH
=137.327+2*17.008
= 171.343
Цвет гидроксида бария
Ва (ОН)2 белый.
Молярная плотность гидроксида бария
Гидроксид бария существует в 2 формах; плотности приведены ниже:
- Молярная плотность Ва (ОН)2 моногидрат 0.0197684 моль/см3 так как его плотность 3.743 г/см3.
- Молярная плотность Ва (ОН)2 октагидрат 0.00691311 моль/см3 так как его плотность 2.180 г/см3.
Температура плавления гидроксида бария
Температура плавления безводного Ва (ОН)2 составляет 407 °С
Температура кипения гидроксида бария
Точка кипения Ва (ОН)2 составляет 780 ° C.
Состояние гидроксида бария при комнатной температуре
Ва (ОН)2 представляет собой гранулированный твердый/прозрачный порошок при комнатной температуре (обе формы)
Ионно-ковалентная связь гидроксида бария
Ba2+ и ОН– ионы соединены ионными связями. Связь между O и H в OH– ион ковалентный, электроны общие.
Связь между O и H в OH– ион ковалентный, электроны общие.
Ионный радиус гидроксида бария
Ионный радиус для Ba(OH) не определен.2 поскольку ионный радиус определяется и измеряется только для атомов, а не для молекул.
Электронные конфигурации гидроксида бария
Электронные конфигурации показывают, как электроны распределены в атомное or молекулярная орбиталь. Давайте узнаем электронную конфигурацию гидроксида бария.
- Электронная конфигурация Ba2+ в гидроксиде бария составляет 1 с2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6, что также можно записать в терминах конфигурации благородных газов как [Xe] 6s0.
- МО конфигурация ОН– is 1s2 2s2 σ2pz2№2pX2№2py2
Степень окисления гидроксида бария
Атом Ba находится в степени окисления +2. Атом О находится в степени окисления -2.. Атом H находится в степени окисления +1.
Атом О находится в степени окисления -2.. Атом H находится в степени окисления +1.
Гидроксид бария щелочной
С Ва (ОН)2 представляет собой гидроксид щелочноземельный металл, он сильно щелочной и сильно основной.
Гидроксид бария без запаха
Ва (ОН)2 не имеет запаха; поэтому он без запаха.
Является ли гидроксид бария парамагнитным?
Вещества с неспаренным электроном на атомной/молекулярной орбитали, парамагнитные вещества, слабо притягиваются к магнитам. Выясним, является ли Ba(OH)2 является парамагнетиком.
Гидроксид бария не является парамагнитным. так как все электроны парные.
Гидроксид бария гидраты
Гидроксид бария имеет три наблюдаемые формы гидратов, перечисленные ниже, с уменьшающимся количеством воды гидратации.
- Октагидрат: Когда гидроксид бария находится в присутствии воды, он образует октагидрат.
- Тригидрат: он образуется, когда октагидрат гидроксида бария нагревается и сначала растворяется в собственных водах гидратации (78 ° C), а затем теряет четыре молекулы воды с образованием тригидрата при температуре около 125 ° C. Он нестабилен и, наконец, наблюдается моногидратная форма
- Моногидрат: он образуется после нагревания октагидрата гидроксида бария примерно до 180 ° C. Это еще одна стабильная форма гидроксида бария.
Кристаллическая структура гидроксида бария
- Ва (ОН)2 октагидрат образует моноклинные кристаллы, принадлежащие P21/n космическая группа. Он имеет четыре формульные единицы в ячейке размерами a = 9.35 Å, b = 9.28 Å, c = 11.87 Å при β = 99°.
- Ва (ОН)2 было определено, что тригидрат имеет орторомбический кристалл, принадлежащий пространственной группе Pnma, с a = 7.
 640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4.
640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4. - Ва (ОН)2 моногидрат принимает слоистую структуру с центрами Ba2+, имеющими квадратную антипризматическую геометрию.
Полярность и проводимость гидроксида бария
- Ва (ОН)2 полярный так как это ионное соединение.
- Ва (ОН)2 проводит электричество в водном растворе, так как он дает два гидроксид-иона на молекулу и катион Ba2+. Точно так же он также будет обеспечивать ионы для проведения электричества в расплавленном состоянии.
Реакция гидроксида бария с кислотой
Ва (ОН)2 например, будет реагировать с кислотами с образованием соответствующих солей.
Ва (ОН)2+2HCl→BaCl2+ 2H2O
Реакция гидроксида бария с основанием
Ва (ОН)2 не реагирует с основаниями.
Реакция гидроксида бария с оксидом
Ва (ОН)2 реагирует с кислыми оксидами неметаллов с образованием, например, карбонатов.
Ва (ОН)2 + H2CO3 -> БаСО3 + 2H2O
Заключение
Мы узнали о Ba(OH)2, высокореактивное соединение, особенно полезное в лабораториях для аналитических и каталитических применений и различных процессов в нефтяной и водной промышленности.
Формула гидроксида бария, молярная масса, октагидрат, применение, MSDS
- Что такое гидроксид бария?
- Химическая формула
- Молярная масса
- Растворим ли гидроксид бария в воде?
- Свойства гидроксида бария
- Октагидрат гидроксида бария
- Применение гидроксида бария
- MSDS гидроксида бария
- Гидроксид бария и соляная кислота id
- Гидроксид бария и хлорид аммония
- Гидроксид бария и тиоцианат аммония
- Моногидрат гидроксида бария
- Является ли гидроксид бария сильным или слабым основанием?
- Бария гидроксид и азотная кислота
- Бария гидроксид и углекислый газ
- Хлорная кислота и бария гидроксид
- Уксусная кислота и бария гидроксид
- Бария гидроксид и фосфорная кислота 900 03 Гидроксид бария и нитрат аммония
- Гидроксид бария и хлорид аммония
- Октагидрат гидроксида бария и тиоцианат аммония
Что такое гидроксид бария?
Это химическое вещество, также известное как «барит». Это соединение бария, мягкого серебристого металла щелочноземельной группы.
Это соединение бария, мягкого серебристого металла щелочноземельной группы.
Его можно получить путем растворения оксида бария (представленного как BaO) в воде. Это выражается следующей химической реакцией:
BaO + 9h3O → Ba(OH)2·8h3O
Химическая формула
Химическая формула гидроксида бария: Ba(OH)2.
Молярная масса
Молярная масса гидроксида бария
171,34 г/моль (в безводных растворах)
189,355 г/моль (моногидрат)
315,46 г/моль (октагидрат)
Растворим ли гидроксид бария в воде?
Растворимость гидроксида бария в воде умеренная. Однако это соединение нерастворимо в ацетоне. При комнатной температуре он может образовывать раствор. Установлено, что раствор гидроксида бария имеет приблизительную концентрацию 0,1 моль дм-3. 9Рисунок 1
Стабильность
Это стабильное соединение. Он несовместим с углекислым газом, кислотами и влагой. Необходимо избегать контакта этого вещества с несовместимыми материалами.
Внешний вид
Это кристаллическое вещество, цвет которого может варьироваться от белого до прозрачного.
Удельный вес
Удельный вес этого вещества составляет 2,18.
Температура плавления
Вещество плавится при температуре 408 °C.
Температура кипения
Материал кипит при температуре 780 °C.
Значение pH
Значение pH гидроксида бария фактически зависит от его концентрации. Тем не менее, pH этого соединения составляет около -2. Это указывает на то, что он является очень основным по своей природе.
Плотность
Имеет плотность 2,18 на г см-3
Молекулярная формула
Молекулярная формула октагидрата гидроксида бария: Bah28O10.
Октагидрат гидроксида бария
Это химическое соединение в виде белого кристаллического порошка. Он твердый и растворяется в воде. Он имеет температуру плавления 78 ° C.
Он также известен под другими названиями, такими как
- Гидрат бария
- Бария гидроксид
- 8-гидрат
Гидроксид бария Применение
Он используется для ряда целей, таких как
- При производстве щелочи
- В строительном стекле
- При вулканизации синтетического каучука
- В ингибиторах коррозии
- В качестве буровых растворов, пестицидов и смазочных материалов
- Для средства от накипи
- Для рафинации растительных и животных масел
- Для фресковой живописи
- В воде для умягчения
- В составе гомеопатических средств
- Для очистки разливов кислоты
Также используется в сахарной промышленности для приготовления свекловичного сахара.
Гидроксид бария MSDS
Паспорт безопасности материала (MSDS) для гидроксида бария:
Меры безопасности
Это вещество может быть вредным при вдыхании, проглатывании или даже контакте с ним. Прямое воздействие на кожу, глаза или одежду может быть опасным. Руки должны быть тщательно вымыты после работы с этим материалом. При попадании на одежду этого вещества ее следует немедленно снять. Любой участок кожи, подвергшийся воздействию этого соединения, следует немедленно промыть холодной водой с легким мылом.
Токсикология
Длительное воздействие этого вещества может вызвать раздражение кожи. Пыль этого материала может раздражать легкие и дыхательные пути. Проглатывание может вызвать ряд неприятных симптомов, таких как
- Тошнота
- Рвота
- Головная боль
- Головокружение
- Раздражение желудочно-кишечного тракта
Лица с ранее существовавшими заболеваниями дыхательной системы, кожи или глаз могут стать более восприимчивыми к одному или нескольким из вышеупомянутых симптомов.
Личная безопасность
Необходимо безопасно хранить этот материал, чтобы избежать утечки и пожара. Любой пожар, возникший из-за этого вещества, можно потушить с помощью огнетушителей. Лица, использующие это соединение, должны носить защитную одежду и использовать автономный дыхательный аппарат для предотвращения контакта этого материала с глазами, одеждой или кожей.
Гидроксид бария и соляная кислота
Гидроксид бария используется для нейтрализации соляной кислоты. Химическая реакция между двумя соединениями представлена как:
Ba(OH)2 (водный) + 2HCl (водный) -> BaCl2 (водный) + 2h3O (жидкий)
Гидроксид бария и серная кислота
Гидроксид бария часто используется для нейтрализации серной кислоты. Реакция выражается следующим представлением:
Ba(OH)2(твердый) + h3SO4(водный) → BaSO4(твердый) + 2h3O(жидкий)
Небольшое количество BaSO4, получаемое из умеренно растворимого Ba(OH )2 покрывает и осаждает Ba(OH)2. В результате реакция между h3SO4 и Ba(OH)2 останавливается.
Гидроксид бария и хлорид аммония
Реакция нейтрализации твердого гидратированного гидроксида бария твердым хлоридом аммония носит эндотермический характер. В результате реакции образуется жидкость, сопровождающаяся падением температуры примерно до -20°С. Он представлен как:
Ba(OH)2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газовый) + HOH (жидкий).
Гидроксид бария и тиоцианат аммония
Это эндотермическая реакция, в результате которой образуется тиоцианат бария. Это выражается через эту химическую реакцию:
Ba(OH)2.8h3O (твердое) + 2 Nh5SCN (твердое) → Ba(SCN)2 (твердое) + 10h3O (жидкое) + 2 Nh4 (газообразное).
Моногидрат гидроксида бария
Это химическое соединение выглядит как белый порошок. Он также известен под другими названиями, такими как
- Сухой гидроксид бария .
- Едкий барит моногидрат
- Гидроксид бария 1-гидрат
Состав используется для различных целей, таких как
- Очистка воды
- Производство присадок к маслам
- Изготовление смазочных материалов
- Производство химикатов с высоким содержанием бария
Контакт с кожей, вдыхание или проглатывание этого материала может представлять опасность для здоровья. В острых случаях также может наступить смерть. Это негорючее вещество, но оно может разлагаться при воздействии тепла и образовывать токсичное и/или коррозионное пламя. Его следует хранить в контейнерах в прохладном, сухом месте и всегда держать вдали от источников тепла. В противном случае контейнеры могут взорваться в нагретой среде.
В острых случаях также может наступить смерть. Это негорючее вещество, но оно может разлагаться при воздействии тепла и образовывать токсичное и/или коррозионное пламя. Его следует хранить в контейнерах в прохладном, сухом месте и всегда держать вдали от источников тепла. В противном случае контейнеры могут взорваться в нагретой среде.
Является ли гидроксид бария сильным или слабым основанием?
Это соединение хорошо растворяется в воде. Он считается единственным двухосновным сильным основанием. Он способен окрашивать лакмусовую бумагу в синий цвет и может образовывать соль и воду при взаимодействии с кислотой.
Гидроксид бария и азотная кислота
Гидроксид бария реагирует с азотной кислотой с образованием соли (нитрата бария) и воды, как и в случае классических кислотно-щелочных реакций. Химическая реакция выражается следующим образом:
2HNO3(водная азотная кислота) + Ba(OH)2(водный раствор гидроксида бария) → Ba(NO3)2(водный раствор нитрата бария) + 2h3O(вода)
Гидроксид бария и двуокись углерода
Ba(OH)2 реагирует с двуокисью углерода с образованием карбоната бария. Это выражается следующей химической реакцией:
Это выражается следующей химической реакцией:
Ba(OH)2 + CO2 → BaCO3 + h3O.
Хлорная кислота и гидроксид бария
Две молекулы хлорной кислоты реагируют с одной молекулой гидроксида бария с образованием двух молекул воды и одной молекулы перхлората бария (также известного как хлорат бария). Реакция выражается как
Ba(OH)2 + 2 HClO4 (водный) → Ba(ClO4)2 (водный) + 2 h3O (жидкий).
Гидроксид бария, используемый в этой реакции, представляет собой либо твердое вещество, либо сильно разбавленный водный раствор.
Уксусная кислота и гидроксид бария
Две молекулы уксусной кислоты реагируют с одной молекулой гидроксида бария с образованием соли (нитрата бария) вместе с водой, как и любая другая кислотно-щелочная реакция. Это выражается как:
2 Ch4COOH + Ba(OH)2 → Ba(C2h4O2)2 + 2h3O
Реакцию можно облегчить, заменив C2h4O2 на Ac. Заменив таким образом, химическая реакция может быть представлена в виде:
2 HAc + Ba(OH)2 → Ba(Ac)2 + 2h3O
Гидроксид бария и фосфорная кислота
В этой кислотно-основной реакции нейтрализации участвуют три молекулы гидроксида бария и две молекулы фосфорной кислоты. Формула этой химической реакции выглядит следующим образом:
Формула этой химической реакции выглядит следующим образом:
3 Ba(OH)2 + 2 h4PO4 → Ba3(PO4)2 + 6h3O
Она приводит к осаждению фосфата бария. Это можно рассматривать как реакцию «двойного замещения», в которой барий замещает водород, который, в свою очередь, заменяет барий.
3 Ba(OH)2 + 2 h4PO4 → Ba3(PO4)2 + 6HOH
Гидроксид бария и нитрат аммония
Две молекулы водного раствора гидроксида бария реагируют с водным раствором нитрата аммония с образованием водных растворов нитрата бария, вода. Химическая реакция представлена в виде:
Ba(OH)2 (водный) + 2 Nh5NO3 (водный) → Ba(NO3)2 (водный) + 2 Nh4 (водный) + 2 h3O (жидкий).
Аммиак может растворяться в растворе до насыщения. Затем он может превратиться в газ, тем самым завершив химическое изменение.
Гидроксид бария и хлорид аммония
Твердый хлорид аммония смешивают с твердым гидратированным гидроксидом бария в химическом стакане с образованием хлорида бария. Другими продуктами этой эндотермической реакции являются газообразный аммиак и гидроксид водорода (вода). В ходе этой холодной реакции температура резко падает примерно до -20 °C.
В ходе этой холодной реакции температура резко падает примерно до -20 °C.
Формула этой реакции выглядит следующим образом:
Ba(OH)2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газообразный) + HOH (жидкий)
Октагидрат гидроксида бария и тиоцианат аммония
Тиоцианат аммония (Nh5SCN) смешивают с твердым октагидратом гидроксида бария (Ba(OH)2.8h3O) для получения тиоцианата бария. В результате кислотно-щелочной реакции образуется щелочной газ, который можно определить с помощью индикаторной бумаги.
Уравнение этой эндотермической реакции имеет следующий вид:
Ba(OH)2,8h3O(твердое) + 2 Nh5SCN(твердое) → Ba(SCN)2(т) + 10h3O(жидкое) + 2 Nh4(газообразное) .
Это эндотермическая реакция, при которой происходит поглощение тепла из окружающей среды. Это приводит к быстрому падению температуры этой реакции, которую можно измерить с помощью цифрового термометра. Это заставляет стакан примерзнуть к деревянной доске. По этой причине стакан следует поставить на маленькую доску, на которую налито несколько капель воды.
Гидроксид бария является одним из основных соединений бария. Коммерчески он чаще всего доступен в виде белого гранулированного моногидрата.
- Каталожные номера
- http://jchemed.chem.wisc.edu/JCESoft/CCA/CCA3/MAIN/ENDO2/PAGE1.HTM
- http://www.practicalchemistry.org/experiments/endothermic-solid-solid-reactions,277,EX.html
- http://www.chem.umn.edu/outreach/endoexo.html
- http://www.chemicalbook.com/ChemicalProductProperty_EN_CB4318493.хтм
Гидроксид бария – определение, химическая структура, свойства и применение
Вы ищете всю информацию о гидроксиде бария, от определения до применения? Вы достигли места назначения, потому что здесь Vedantu предоставляет всю информацию по теме гидроксида бария — определение, химическая структура, свойства и использование. Тема начинается с определения и продолжается, чтобы охватить все, что связано с этой темой.
Гидроксид бария представляет собой белое гранулированное соединение.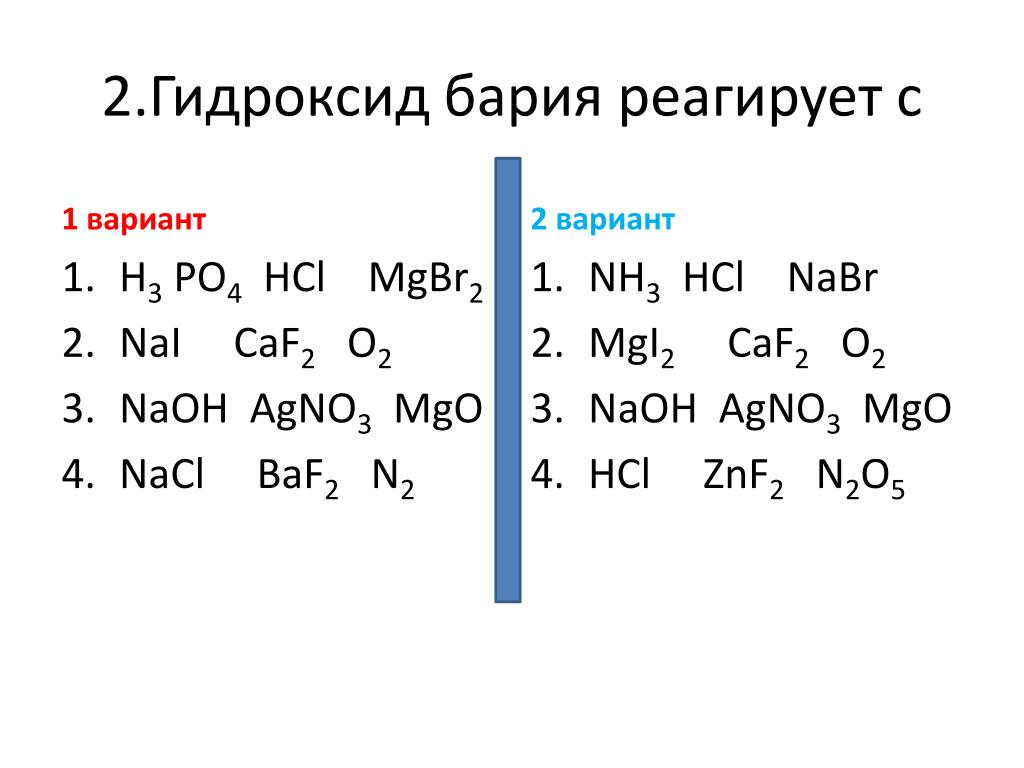 Он состоит из оксида бария и воды. Он в основном используется для производства других продуктов бария. Гидроксид бария имеет химическую формулу Ba(OH)₂ₓ. Одним из основных соединений элемента бария является его моногидрат, который также известен как барит или барит-вода. Однако в коммерческой сфере белый гранулированный моногидрат бария используется для многих целей.
Он состоит из оксида бария и воды. Он в основном используется для производства других продуктов бария. Гидроксид бария имеет химическую формулу Ba(OH)₂ₓ. Одним из основных соединений элемента бария является его моногидрат, который также известен как барит или барит-вода. Однако в коммерческой сфере белый гранулированный моногидрат бария используется для многих целей.
Химическая структура гидроксида бария
Химическая формула оксида бария: Ba(OH)₂. Химическая формула гидроксида бария интересна. Как видно из названия, гидроксид бария состоит из бария и гидроксида. Итак, логически говоря, формула должна быть Ba(OH). Тогда почему мы пишем Ba(OH)₂ как формулу гидроксида бария? Это связано с тем, что барий имеет два положительных иона, а гидроксид — один отрицательный. Итак, чтобы показать барий как нейтральное соединение, мы добавляем еще один гидроксид к гидроксиду бария и делаем его нейтральным 9.0051
(изображение будет обновлено в ближайшее время)
Свойства гидроксида бария
Молярная масса
Чтобы найти молярную массу гидроксида бария, нам нужно сложить молярные массы элементов, из которых состоит это соединение .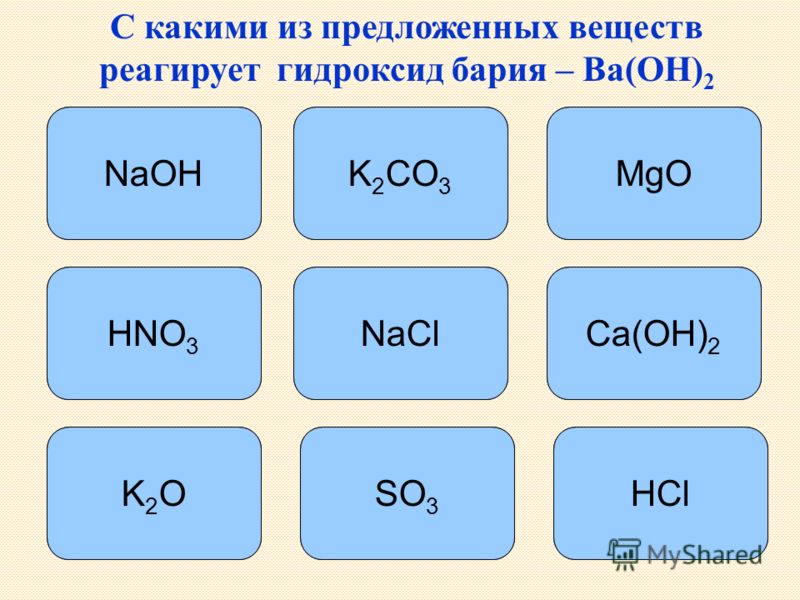 Молярная масса или молекулярная масса бария составляет 137,33. В соединении есть только один барий. Молярная масса водорода 1,008. В соединении два атома водорода. Таким образом, общая молярная масса двух объединенных атомов водорода составляет 2,016. Молярная масса кислорода 15,9.99. Существует два атома кислорода, поэтому общая молярная масса двух атомов кислорода вместе равна 31,998. Теперь, если мы сложим эти числа, мы получим 171.344. Таким образом, молярная масса гидроксида бария составляет 171,344 г/моль.
Молярная масса или молекулярная масса бария составляет 137,33. В соединении есть только один барий. Молярная масса водорода 1,008. В соединении два атома водорода. Таким образом, общая молярная масса двух объединенных атомов водорода составляет 2,016. Молярная масса кислорода 15,9.99. Существует два атома кислорода, поэтому общая молярная масса двух атомов кислорода вместе равна 31,998. Теперь, если мы сложим эти числа, мы получим 171.344. Таким образом, молярная масса гидроксида бария составляет 171,344 г/моль.
Оксид бария: сильное основание
Основание — это химическое вещество, которое вступает в реакцию с водой с выделением ионов гидроксида. Сильное основание — это такое основание, которое может полностью диссоциировать в воде с выделением точного количества анионов и катионов, которое было у элементов в нерасщепленном основании.
(изображение скоро будет обновлено)
Температура плавления
Температура плавления гидроксида бария зависит от количества воды в нем. Октагидратная форма оксида бария плавится при 78 градусах Цельсия. Моногидратная форма плавится при 300 градусах Цельсия, а безводная форма плавится при 407 градусах Цельсия.
Октагидратная форма оксида бария плавится при 78 градусах Цельсия. Моногидратная форма плавится при 300 градусах Цельсия, а безводная форма плавится при 407 градусах Цельсия.
Растворимость
Хотя гидроксид бария растворим в воде, он растворяется лишь в незначительной степени. Вам нужно соединение гидроксида бария с молярной концентрацией 0,1 М, если вы хотите, чтобы оно растворялось в воде.
Температура кипения
Гидроксид бария кипит при 780 градусах Цельсия. Если вы продолжите кипятить и температура достигнет 800 градусов по Цельсию, он разложится и выделит оксид бария.
Другие свойства гидроксида бария
Гидроксид бария имеет белый цвет.
Обычно выглядит как зернистое твердое вещество.

Без запаха.
pH гидроксида бария составляет 11,27
Плотность моногидрата гидроксида бария составляет 3,74 г/см3. А плотность октагидратной формы составляет 2,18 г/куб.см.
Свойства гидроксида бария Краткий обзор
Внешний вид 90 420 | Белый, гранулированный, без запаха |
Химическая формула | Ba(OH) ₂ |
Молярная масса | 171,344 г/моль |
pH гидроксида бария | 11,27 |
Плотность | 3,74 г/см3 моногидратная форма. |
Растворимость | Слабо растворим в воде (до 0,1 М молярной концентрации) |
Температура плавления | 78°С (для октагидратной формы), 300°С (для моногидратной формы), 407°С (для безводной формы) |
Температура кипения гидроксида бария | 780 градусов C |
Эндотермическая реакция
Статья о гидроксиде бария останется неполной, если мы не будем говорить о конце термические реакции и роль в них гидроксида бария. Эндотермическая реакция — это любая реакция, которая заимствует тепло из окружающих областей. Таким образом, область становится заметно прохладной.
Вы можете увидеть эту эндотермическую реакцию, если смешаете гидроксид бария с хлоридом аммония. Когда вы смешиваете два соединения в стакане, температура падает слишком быстро. Если вы измерите температуру внутри стакана, то увидите, что она опустилась ниже -20 градусов. Реакция поглощает окружающее тепло и приводит к образованию аммиака, хлорида бария и воды.
Когда вы смешиваете два соединения в стакане, температура падает слишком быстро. Если вы измерите температуру внутри стакана, то увидите, что она опустилась ниже -20 градусов. Реакция поглощает окружающее тепло и приводит к образованию аммиака, хлорида бария и воды.
Применение
Гидроксид бария в основном используется для производства других продуктов из бария. Однако об этих продуктах речь пойдет позже. Гидроксид бария также используется в лабораториях для измерения концентрации слабых кислот. Этот процесс называется титрованием. Это соединение также используется для изготовления стекла, жира или других щелочей. Он также используется для очистки сточных вод.
Резюме
Если вы забыли предыдущие темы, не волнуйтесь, мы вас обеспечим. Мы предоставили вам несколько пунктов, чтобы вспомнить эту тему менее чем за 3 минуты.
Гидроксид бария представляет собой белое гранулированное соединение.

Изготовлен из ионов бария и гидроксида.
В своей исходной форме он является ионным.
Гидроксид бария имеет молекулярную массу 171,344 г/моль.
Гидроксид бария является сильным основанием, так как полностью диссоциирует в воде с образованием катиона BaO и катиона гидроксида.
Для плавления октагидратной формы гидроксида бария требуется 78 градусов Цельсия. Для плавления моногидрата и безводных форм требуется 300 и 407 градусов Цельсия.
Температура кипения гидроксида бария составляет 780 градусов Цельсия. Если вы нагреете соединение дальше, это приведет к термическому разложению, и вы получите оксид бария.

Гидроксид бария может растворяться в воде, он малорастворим. Соединение гидроксида бария с молярной концентрацией 0,1 М растворяется в воде. Соединение с более высокой молярной концентрацией не может растворяться в воде.
Гидроксид бария может быть опасен
Хотя гидроксид бария не так опасен, как, скажем, кислоты, он вызывает коррозию. Он может нанести вред коже, глазам, пальцам и т. д. Имеются также данные о повреждении почек из-за длительного воздействия гидроксида бария. Вдыхание оксида бария может повредить дыхательные пути. Следовательно, в промышленных условиях с гидроксидом бария осторожно обращаются обученные рабочие.
Гидроксид бария слишком дорог для учителей, чтобы показать вам, как протекает эндотермическая реакция. Состав не используется в бытовых условиях. Тем не менее, вы должны прочитать об этом соединении из-за его уникальных свойств и из-за его применения в промышленных областях.

 640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4.
640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4.
 2,18 г/куб.см в октагидратной форме.
2,18 г/куб.см в октагидратной форме.
