Реакции ионного обмена
1. Реакции ионного обмена идут до конца, если: выпадает осадок, выделяется газ, образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не раскладывают.
Давайте порассуждаем вместе
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + H2SO4 = BaSO4 + 2HCl
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
3) 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
4) Ba(NO3)2 + K2
SO4 = BaSO4 + 2KNO3
Ответ: уравнению №2, т.
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
2. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca(OH)2 + CO2 + CaCO3 + H2O
3) Ca(HCO3)2 = CaCO3 + CO2 + H2O
4) CaO + CO2 = CaCO3
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3 выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
Ответ: №4, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
Ответ: №3, т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
5. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl—
2) Cu2+ и S2-
3) Al3+ и SO42-
4) Zn2+ и NO3—
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4
2) H2SO4 и Ba(OH)2
3) HNO3 + Ba(OH)2
4) HCl + Ba(OH)2
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7.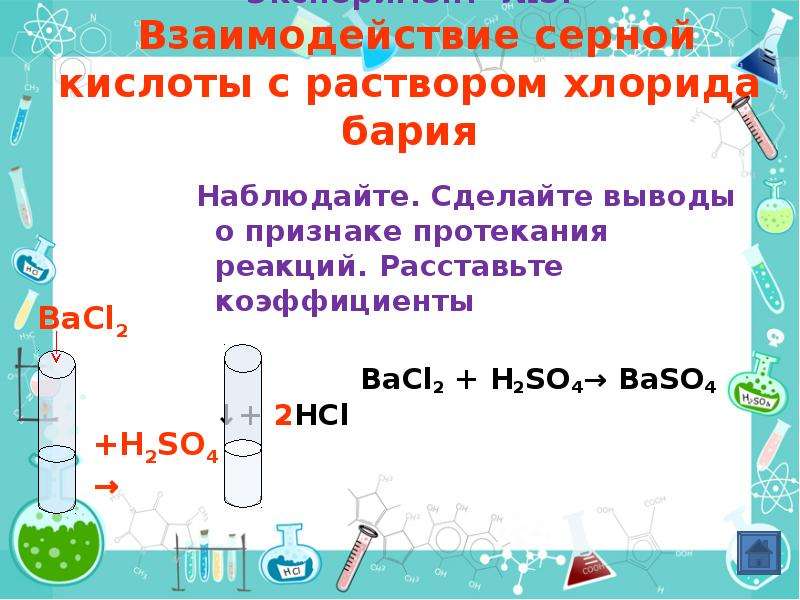 При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) NH4Cl
2) CuCl2
3) ZnSO4
4) H3PO4
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + h3O
выделяется газ аммиак
Гидроксид бария, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s 2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
404 — Документ не найден
Документ не найден.
Пожалуйста, воспользуйтесь поиском или нижним меню.
Обжимные фитинги муфты, штуцера, адаптеры, уголки, кресты, тройники Резьбовые фитинги ниппели, муфты, тройники.. Приварные фитинги VCR, VCO, БРС
Фитинги
Запорная арматура Игольчатые вентили Шаровые краны Мембранные клапаны Сильфонные вентили Манометрические вентили
Клапаны
Баллонные
Общепромышленные
Высокоточные
До себя
Для чистых сред
Двухступенчатые
Регуляторы давления
Фильтры и фильтрующие элементы
фильтры финишной очистки
Промышленные фильтры
Микронные фильтры
Фильтры
Калиброванные бесшовные трубки
Инструмент для труб
полимерные трубки
зажимы и крепления для труб
гибкие рукава
Зажимы, трубы, рукава и аксессуары
Изделия собственного производства газоразрядные рампы атмосферные испарители газовые шкафы устройства отбора пробы
Изделия
Поточные нагреватели жидкостей и газов
Нагреватели
Расходомеры Ротаметры
Средства контроля расхода
Уровнемеры Смотровые стёкла
Средства измерения уровня
Манометры
Преобразователи давления
Реле давления
Разделительные мембраны
Средства измерения давления
Средства измерения температуры
Анализаторы газов
Алюминиевые газовые баллоны:
— Одногорловые
— Двугорловые
Баллоны и Сосуды
Кабельные вводы
Реальный ЕГЭ по химии 2020.
 Задание 31
Задание 31Чтобы поделиться, нажимайте
Представляем вашему вниманию задание 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решениеK2CrO4 + 2CH3COOAg = 2CH3COOK + Ag2CrO4↓
2K+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2K+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 2
Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение3NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 3Na+ + PO43- + 6H2O
3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + PO43- + 6H2O
или
2NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Sr2+ + 4OH— = Sr3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 3
Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделения газа и без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеHNO3 + CH3COONH4 = CH3COOH + NH4NO3
H+ + NO3— + CH3COO— + NH4+ = CH3COOH + NH4+ + NO3—
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 4
Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNa2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
2Na+ + SiO32- + 2H+ + SO42- = H2SiO3↓ + 2Na+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020. Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, но без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2KOH + Ca(HCO3)2 = CaCO3↓ + K2CO3 + 2H2O
2K+ + 2OH— + Ca2+ + 2HCO3— = CaCO3↓ + 2K+ + CO32- + 2H2O
2OH— + Ca2+ + 2HCO3— = CaCO3↓ + CO32- + 2H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение(NH4)2SO3 + 2HBr = 2NH4Br + SO2↑ + H2O
2NH4+ + SO32- + 2H+ + 2Br— = 2NH4+ + 2Br— + SO2↑ + H2O
SO32- + 2H+ = SO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение3Mg(H2PO4)2 + 12KOH = Mg3(PO4)2↓ + 4K3PO4 + 12H2O
3Mg2+ + 6H2PO4— + 12K+ + 12OH— = Mg3(PO4)2↓ + 12K+ + 4PO43- + 12H2O
3Mg2+ + 6H2PO4— + 12OH— = Mg3(PO4)2↓ + 4PO43- + 12H2O
Как ни странно, была защитана реакция с образованием осадка гидроксида магния и дигидрофосфата калия (что на самом деле маловероятно в щелочной среде). Поэтому привожу вам эту реакцию:
Поэтому привожу вам эту реакцию:
Mg(H2PO4)2 + 2KOH = Mg(OH)2↓ + 2KH2PO4
Mg2+ + 2H2PO4— + 2K+ + 2OH— = Mg(OH)2↓ + 2K+ + 2H2PO4—
Mg2+ + 2OH— = Mg(OH)2↓
Реальный ЕГЭ 2020. Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
HNO3 + CH3COOAg = AgNO3 + CH3COOH
H+ + NO3— + CH3COO— = Ag+ + NO3— + CH3COOH
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества одного класса, реакция ионного обмена между которыми протекает с выпадением белого осадка и без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеBa(HCO3)2 + K2SO4 = BaSO4↓ + 2KHCO3
Ba2+ + 2HCO3— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2HCO3—
Ba2+ + SO42- = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 10
Задание 31. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + SO42- + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
HSO4— + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
С учётом этого, можно было записать эти уравнения по-другому:
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2H+ + 2SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
H+ + SO42- + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 11
Задание 31. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + K3PO4 + 6H2O
3K+ + 3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 3K+ + PO43- + 6H2O
3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + PO43- + 6H2O
или
2KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2KOH + 4H2O
2K+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2K+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 12
Задание 31. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2CO2↑ + 2H2O
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2CO2↑ + 2H2O
HCO3— + H+ = CO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 13
Задание 31. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4NaOH + 2H2O
4Na+ + 2HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4Na+ + 4OH— + 2H2O
2HPO42- + 3Ba2+ + 2OH— = Ba3(PO4)2↓ + 2H2O
или
6Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4Na3PO4 + 6H2O
12Na+ + 6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 12Na+ + 4PO43- + 6H2O
6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4PO43- + 6H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 14
Задание 31. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра (I), хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решениеNa2CrO4 + 2CH3COOAg = 2CH3COONa + Ag2CrO4↓
2Na+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2Na+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2LiOH + (NH4)2SO3 = Li2SO3 + 2NH3∙H2O
2Li+ + 2OH— + 2NH4+ + SO32- = 2Li+ + SO32- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV). Допустимо использование водных растворов веществ.

Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеCH3COONH4 + NaOH = CH3COONa + NH3∙H2O
CH3COO— + NH4+ + Na+ + OH— = CH3COO— + Na+ + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых изменений. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
H2SO4 + Mg(NO2)2 = MgSO4 + 2HNO2
2H+ + SO42- + Mg2+ + 2NO2— = Mg2+ + SO42- + 2HNO2
H+ + NO2— = HNO2
Реальный ЕГЭ 2020. Задание 31. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
K2S + (CH3COO)2Fe = FeS↓ + 2CH3COOK
2K+ + S2- + 2CH3COO— + Fe2+ = FeS↓ + 2CH3COO— + 2K+
Fe2+ + S2- = FeS↓
Реальный ЕГЭ 2020. Задание 31. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2KOH + (NH4)2SO4 = K2SO4 + 2NH3∙H2O
2K+ + 2OH— + 2NH4+ + SO42- = 2K+ + SO42- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 20
Задание 31. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделение газа, причём одно из реагирующих веществ является кислой солью. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + HSO4— + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
HSO4— + Ba2+ = BaSO4↓ + H+
или
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2HSO4— + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
2HSO4— + Ba2+ = SO42- + BaSO4↓ + 2H+
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
С учётом этого, можно было записать эти уравнения по-другому:
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + H+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2H+ + 2SO42- + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеFeS + H2SO4 = FeSO4 + H2S↑
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S↑
FeS + 2H+ = Fe2+ + H2S↑
Реальный ЕГЭ 2020. Задание 31. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
2CH3COONH4 + Ba(OH)2 = (CH3COO)2Ba + 2NH3↑ + 2H2O
2CH3COO— + 2NH4+ + Ba2+ + 2OH— =2CH3COO— + Ba2+ + 2NH3↑ + 2H2O
NH4+ + OH— =NH3↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
NH4HCO3 + HNO3 =NH4NO3 + CO2↑ + H2O
NH4+ + HCO3— + H+ + NO3— = NH4+ + NO3— + CO2↑ + H2O
H+ + HCO3— = CO2↑ + H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
K2SiO3 + H2SO4 = H2SiO3↓ + K2SO4
2K+ + SiO32- +2H+ + SO42- = H2SiO3↓ + 2K+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
NH4NO3 + KOH = KNO3 + NH3∙H2O
NH4+ + NO3— + K+ + OH— = K+ + NO3— + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции газ не образуется. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNH4HSO4 + Ba(NO3)2 = BaSO4↓ + NH4NO3 + HNO3
NH4+ + HSO4— + Ba2+ + 2NO3— = BaSO4↓ + NH4+ + NO3— + H+ + NO3—
HSO4— + Ba2+ = BaSO4↓ + H+
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 4
Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 5
Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNa2HPO4 + NaOH = Na3PO4 + H2O
2Na+ + HPO42- + Na+ + OH— = 3Na+ + PO43- + H2O
HPO42- + OH— = PO43- + H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2NaH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеFeCl3 + 3NH4F = FeF3↓ + 3NH4Cl
Fe3+ + 3Cl— + 3NH4+ + 3F— = FeF3↓ + 3NH4+ + 3Cl—
Fe3+ + 3F— = FeF3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3— + 2K+ + 2OH— = 2Na+ + CO32- + 2K+ + CO32- + 2H2O
HCO3— + OH— = CO32- + H2O
или
NaHCO3 + 2KOH = NaOH + K2CO3 + H2O
Na+ + HCO3— + 2K+ + 2OH— = Na+ + OH— + 2K+ + CO32- + H2O
HCO3— + OH— = CO32- + H2O
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2020 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaiqQVHd8oCDZ7GBW7e2sBQ» frameborder=»0″ allowfullscreen=»allowfullscreen» data-mce-fragment=»1″/>
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
Сульфат бария: способы получения и химические свойства
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
1. Сульфат бария реагирует с простыми веществами:
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
BaSO4 + 4H2 = BaS + 4H2O
2. Сульфат бария вступает в реакцию со сложными веществами:
Сульфат бария вступает в реакцию со сложными веществами:
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
BaSO4 + H2SO4 = Ba(HSO4)2
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
2BaSO4 = 2BaO + 2SO2 + O2
Боксит.
 Методы определения диоксида углерода – РТС-тендер
Методы определения диоксида углерода – РТС-тендер
ГОСТ 14657.9-96
Группа А39
МКС 73.060*
ОКСТУ 1711
_______________
* В указателе «Национальные стандарты» 2007 г.
МКС 73.060.40. — Примечание изготовителя базы данных.
Дата введения 1999-01-01
1 РАЗРАБОТАН Межгосударственным техническим комитетом 99 «Алюминий», Всероссийским алюминиево-магниевым институтом (АО ВАМИ)
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 9 от 12 апреля 1996 г.)
За принятие проголосовали:
Наименование государства | Наименование национального органа по стандартизации |
Азербайджанская Республика | Азгосстандарт |
Республика Беларусь | Госстандарт Беларуси |
Республика Казахстан | Госстандарт Республики Казахстан |
Российская Федерация | Госстандарт России |
Туркменистан | Главгосслужба «Туркменстандартлары» |
Украина | Госстандарт Украины |
3 Постановлением Государственного комитета Российской Федерации по стандартизации, метрологии и сертификации от 17 декабря 1997 г. N 415 межгосударственный стандарт ГОСТ 14657.9-96 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 1999 г.
N 415 межгосударственный стандарт ГОСТ 14657.9-96 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 1999 г.
4 ВЗАМЕН ГОСТ 14657.9-78
5 ПЕРЕИЗДАНИЕ
1 Область применения
Настоящий стандарт распространяется на боксит и устанавливает газоволюметрический и титриметрический методы определения диоксида углерода при массовой доле от 0,1% до 15%.
При возникновении разногласий определение проводят газоволюметрическим методом.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 83-79 Натрий углекислый. Технические условия
ГОСТ 3118-77 Кислота соляная. Технические условия
ГОСТ 4107-78 Бария гидроокись 8-водная. Технические условия
ГОСТ 4108-72 Бария хлорид 2-водный. Технические условия
ГОСТ 4204-77 Кислота серная. Технические условия
Технические условия
ГОСТ 4233-77 Натрий хлористый. Технические условия
ГОСТ 6552-80 Кислота ортофосфорная. Технические условия
ГОСТ 14657.0-96 (ИСО 8558-85) Боксит. Общие требования к методам химического анализа
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
3 Общие требования
Общие требования к методам анализа — по ГОСТ 14657.0.
4 Газоволюметрический метод
Метод основан на разложении карбонатов, содержащихся в боксите, соляной кислотой и измерении объема выделившегося диоксида углерода.
4.1 Аппаратура, реактивы и растворы
Газоволюметр (рисунок 1).
Рисунок 1 — Газоволюметр
1 — реакционная пробирка; 2 — резиновая пробка с отводной трубкой и капельной воронкой;
3 — метка на капельной воронке; 4 — капельная воронка; 5 — трехходовой кран; 6 — термометр;
7 — газосборная бюретка; 8 — водяная рубашка; 9 — уравнительная склянка; 10 — водяная баня
Рисунок 1 — Газоволюметр
Пробирка реакционная П2Т-31-ТС по ГОСТ 25336.
Барометр.
Электропечь муфельная с терморегулятором, обеспечивающая температуру нагрева 400 °С.
Термометр лабораторный.
Известь натронная.
Кислота соляная по ГОСТ 3118, раствор 1:1.
Кислота ортофосфорная по ГОСТ 6552, раствор 1:1.
Кислота серная по ГОСТ 4204.
Натрий хлористый по ГОСТ 4233, раствор с массовой долей 20%.
Спирт этиловый по ГОСТ 18300.
Метиловый оранжевый (пара-диметиламиноазобензосульфокислый натрий), спиртовой раствор с массовой долей 0,1%.
Растворы для заполнения газосборной бюретки: раствор ортофосфорной кислоты, окрашенный метиловым оранжевым до ярко-розовой окраски, или раствор хлорида натрия с массовой долей 20%, подкисленный серной кислотой и окрашенный метиловым оранжевым.
Натрий углекислый безводный по ГОСТ 83.
Стандартный раствор углекислого натрия: 9,4600 г предварительно прокаленного при температуре 400 °С 1 ч углекислого натрия помещают в стакан вместимостью 400 см и растворяют в воде. Раствор переливают в мерную колбу вместимостью 500 см, доливают водой до метки и перемешивают.
Раствор переливают в мерную колбу вместимостью 500 см, доливают водой до метки и перемешивают.
Стандартный раствор хранят в бутыли, закрытой пробкой с хлоркальциевой трубкой, заполненной натронной известью.
1 см стандартного раствора содержит 0,00785 г диоксида углерода, который в газообразном состоянии при нормальных условиях занимает объем 4 см.
Для приготовления стандартного раствора углекислого натрия используют свежепрокипяченную дистиллированную воду.
4.2 Проведение анализа
4.2.1 Навеску боксита массой 0,1-2 г (в зависимости от массовой доли диоксида углерода) помещают в реакционную пробирку (рисунок 1), закрывают пробкой и наливают в капельную воронку раствор соляной кислоты до метки. Пробирку помещают в водяную баню, температура воды в которой одинакова с температурой воды в рубашке газоволюметра. Трехходовым краном соединяют систему с атмосферным воздухом и с помощью уравнительной склянки устанавливают затворную жидкость в газосборной бюретке на нулевое деление. Поворотом крана отсоединяют систему от атмосферного воздуха, опускают уравнительную склянку и через 5-10 мин снова поднимают ее до первоначального положения. Если уровень затворной жидкости в газосборной бюретке останется на нулевом делении, то система считается герметичной. Опускают уравнительную склянку, отмеряют 10 см раствора соляной кислоты в капельную воронку, и, открывая кран капельной воронки, постепенно вливают раствор соляной кислоты в реакционную пробирку. Закрывают кран капельной воронки в тот момент, когда мениск раствора соляной кислоты дойдет до метки. Помещают реакционную пробирку в водяную баню с кипящей водой и нагревают 10 мин при периодическом встряхивании.
Поворотом крана отсоединяют систему от атмосферного воздуха, опускают уравнительную склянку и через 5-10 мин снова поднимают ее до первоначального положения. Если уровень затворной жидкости в газосборной бюретке останется на нулевом делении, то система считается герметичной. Опускают уравнительную склянку, отмеряют 10 см раствора соляной кислоты в капельную воронку, и, открывая кран капельной воронки, постепенно вливают раствор соляной кислоты в реакционную пробирку. Закрывают кран капельной воронки в тот момент, когда мениск раствора соляной кислоты дойдет до метки. Помещают реакционную пробирку в водяную баню с кипящей водой и нагревают 10 мин при периодическом встряхивании.
Реакционную пробирку сначала охлаждают в стаканах с водой комнатной температуры, а затем в водяной бане с термометром до температуры, которая была в начале анализа, хорошо встряхивают до полного насыщения соляной кислоты углекислым газом и измеряют объем выделившегося газа. Повторяют термостатирование и измерение через каждые 5 мин до тех пор, пока объем не станет постоянным.
4.2.2 Одновременно с анализом пробы определяют объем диоксида углерода, выделившегося из стандартного раствора углекислого натрия. Пипеткой, с помощью груши в пробирку отмеряют рассчитанное количество стандартного раствора, содержащего приблизительно такое же количество диоксида углерода, которое выделилось при разложении боксита. Далее анализ проводят, как указано в 4.2.1. Объем раствора в реакционной пробирке должен быть таким, как объем раствора при анализе пробы, поэтому необходимое количество раствора соляной кислоты для разложения углекислого натрия рассчитывают по разности объемов раствора соляной кислоты (10 см), прибавляемой при разложении пробы боксита и стандартного раствора углекислого натрия, взятого на определение.
Допускается проводить одно разложение стандартного раствора углекислого натрия и разложение нескольких проб боксита, если температура окружающей среды не меняется более чем на 2-3 °С, атмосферное давление — более чем на 5 мм рт. ст. и объемы диоксида углерода, выделившиеся при разложении пробы и стандартного раствора углекислого натрия, отличаются друг от друга не более чем на .
ст. и объемы диоксида углерода, выделившиеся при разложении пробы и стандартного раствора углекислого натрия, отличаются друг от друга не более чем на .
4.3 Обработка результатов
4.3.1 Массовую долю диоксида углерода , %, вычисляют по формуле
,
где — объем диоксида углерода, измеренный после разложения боксита, см;
— объем раствора соляной кислоты, введенный в реакционную колбу для выделения из боксита диоксида углерода, см;
— объем стандартного раствора углекислого натрия, израсходованного на определение, см;
0,00785 — массовая концентрация углекислого натрия, выраженная в граммах диоксида углерода, г/см;
— объем диоксида углерода, измеренный после разложения стандартного раствора углекислого натрия, см;
— объем раствора соляной кислоты, введенный в реакционную колбу для выделения диоксида углерода из стандартного раствора углекислого натрия, см;
— масса навески бокси
та, г.
4.3.2 Результаты анализа рассчитывают до третьего и округляют до второго десятичного знака при массовой доле диоксида углерода от 0,10% до 3,00% включительно, рассчитывают до второго и округляют до первого десятичного знака при массовой доле диоксида углерода свыше 3,00%.
4.3.3 Допускаемое расхождение результатов параллельных определений и результатов анализа не должно превышать значения, указанного в таблице 1.
Таблица 1
Массовая доля диоксида углерода в боксите, % | Допускаемое расхождение, % абс. | |
Сходимость | Воспроизводимость | |
От 0,10 до 0,50 включ. | 0,05 | 0,07 |
Св. 0,50 » 1,50 « | 0,10 | 0,15 |
» 1,50 » 3,00 « | 0,15 | 0,20 |
» 3,00 » 10,0 « | 0,2 | 0,3 |
» 10,0 » 15,0 « | 0,3 | 0,4 |
5 Титриметрический метод
Метод основан на разложении карбонатов, содержащихся в боксите, серной кислотой, поглощении выделяющегося диоксида углерода раствором гидроксида бария и титровании избытка раствора гидроксида бария соляной кислотой.
5.1 Аппаратура, реактивы и растворы
Установка для определения диоксида углерода (рисунок 2).
Рисунок 2 — Установка для определения диоксида углерода
1 — нагреватель; 2 — автотрансформатор; 3 — реакционная колба; 4 — капельная воронка;
5 — холодильник; 6 — верхний кран; 7 — средний кран; 8 — нижний кран; 9 — отвод холодильника
Рисунок 2 — Установка для определения диоксида углерода
Вода, не содержащая углекислого газа: воду кипятят 20 мин, охлаждают в бутыли, закрытой пробкой с хлоркальциевой трубкой. Используют для приготовления растворов и в процессе анализа.
Кислота соляная по ГОСТ 3118, раствор 0,1 моль/дм.
Кислота серная по ГОСТ 4204, раствор 1:4.
Спирт этиловый по ГОСТ 18300.
Тимоловый синий, раствор с массовой долей 0,5% в этиловом спирте.
Известь натронная.
Бария хлорид по ГОСТ 4108.
Бария гидроксид по ГОСТ 4107.
Пентан, ч.
Эфир петролейный.
Раствор гидроксида бария: 53 г гидроксида бария и 100 г хлорида бария растворяют примерно в 1800 см воды при слабом нагревании и быстром перемешивании. Охлажденный раствор с осадком углекислого бария отфильтровывают через фильтр средней плотности в мерную колбу вместимостью 2000 см. Опалесцирующий фильтрат доливают водой до метки и перемешивают.
5.2 Проведение анализа
5.2.1 Бюретку заполняют примерно на 1-2 см по высоте пентаном или петролейным эфиром, затем раствором гидроксида бария. На верхний конец бюретки устанавливают небольшую трубку с натронной известью.
5.2.2 Навеску пробы массой согласно таблице 2 в зависимости от массовой доли диоксида углерода помещают в реакционную колбу, затем в колбу приливают 50 см воды. Для равномерного кипения добавляют несколько стеклянных бусинок.
Таблица 2
Массовая доля диоксида углерода, % | Масса навески пробы, г | Объем раствора гидроксида бария, см |
От 0,1 до 0,5 включ. | 2,00 | 10,0 |
Св. 0,5 » 1,5 « | 1,00 | 10,0 |
» 1,5 » 3,0 « | 0,50 | 10,0 |
» 3,0 » 10,0 « | 0,25 | 15,0 |
» 10,0 » 15,0 « | 0,25 | 25,0 |
Отмечают уровень растворов в реакционной колбе, поддерживая его постоянным в процессе кипения. Колбу и насадку прикрепляют друг к другу за стеклянные ушки, имеющиеся на их поверхности, с помощью стальных стержней. Аппарат закрепляют в штатив в средней части холодильника (рисунок 2).
После установки аппарата трубку капельной воронки заполняют водой всасыванием во избежание образования пузырьков воздуха и включают нагреватель. Нагревание регулируют с помощью лабораторного автотрансформатора так, чтобы поддерживалось равномерное кипение в реакционной колбе.
5.2.3 После обильного выделения водяного пара в отводе холодильника включают водяное охлаждение. Открывают нижний кран холодильника и закрывают средний и верхний краны. Одновременно в коническую колбу вместимостью 200 см добавляют 5-10 см пентана или петролейного эфира и раствор гидроксида бария согласно таблице 2. Раствор со стенок колбы смывают 3-5 см воды и колбу закрывают корковой пробкой, в которую вставлен холодильник так, чтобы трубка достигала дна колбы. В воронку, расположенную в другом отверстии корковой пробки, помещают последовательно слой сухой ваты и смоченный в растворе гидроксида бария ватный тампон. Открывают средний кран холодильника и закрывают нижний кран, при этом раствор гидроксида бария в холодильнике поднимается примерно до нижней трети высоты.
В капельную воронку приливают 10 см раствора серной кислоты, затем по каплям добавляют ее в реакционную колбу.
5.2.4 Одновременно следят за уровнем раствора гидроксида бария в холодильнике с тем, чтобы пузырьки диоксида углерода не барбатировали в поглотительную колбу. При необходимости устанавливают третью степень охлаждения, открывая верхний кран и закрывая средний кран.
Во избежание подсоса воздуха в реакционную колбу при добавлении раствора серной кислоты в капельной воронке оставляют небольшой затворный слой раствора (примерно 1 см).
Кипячение проводят 20 мин, добавляя одновременно через капельную воронку воду для сохранения постоянного объема раствора в реакционной колбе. Затем приемную колбу опускают на 2-3 мм, закрывают верхний и средний краны и одновременно открывают нижний кран. При этом раствор гидроксида бария вытесняется из холодильника. Далее приемную колбу опускают настолько, чтобы конец отводной трубки холодильника оказался выше уровня жидкости. Кипячение продолжают еще 1 мин для того, чтобы промыть холодильник.
5.2.5 К раствору в приемной колбе добавляют 10 капель индикатора тимолового синего и титруют медленно раствором соляной кислоты до образования зеленого окрашивания. При титровании содержимое колбы многократно интенсивно встряхивают, закрывая ее пробкой.
5.2.6 Одновременно с анализом пробы определяют объем раствора соляной кислоты, израсходованной на титрование раствора гидроксида бария.
В коническую колбу вместимостью 200 см добавляют примерно 10 см пентана или петролейного эфира, растворов гидроксида бария согласно таблице 2, затем доливают водой до объема, соответствующего объему при определении массовой доли диоксида углерода в пробе. В колбу добавляют 10 капель индикатора тимолового синего и титруют раствором соляной кислоты согласно 5.2.5.
5.3 Обработка результатов
5.3.1 Массовую долю диоксида углерода , %, вычисляют по формуле
,
где — объем раствора соляной кислоты, израсходованный на титрование раствора гидроксида бария, см;
— объем раствора соляной кислоты, израсходованный на титрование раствора гидроксида бария после поглощения диоксида углерода, см;
0,0022 — массовая концентрация (титр) 0,1 моль/дм раствора соляной кислоты, выраженный в граммах диоксида углерода, г/см;
— масса навески пробы, г
.
5.3.2 Расчет результатов анализа — по 4.3.2.
5.3.3 Допускаемое расхождение результатов параллельных определений и результатов анализа — по 4.3.3.
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
Боксит. Методы анализа: Сб. стандартов. —
М.: ИПК Издательство стандартов, 2002
Задания 9. Основания, амфотерные гидроксиды и кислоты.
Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
Ответ: 4
Пояснение:
Гидроксид алюминия Al(OH)3 является амфотерным гидроксидом, т.е. веществом, в зависимости от условий проявляющим либо кислотные, либо основные свойства.
Из предложенных вариантов как основание Al(OH)3 реагирует с серной кислотой H2SO4:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O, или в зависимости от соотношений реагентов:
Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O — образование кислой соли гидросульфата алюминия;
2Al(OH)3 + 3H2SO4 = [Al(OH)2]2(SO4)3 + 2H2O – образование основной соли дигидроксосульфата алюминия;
Al(OH)3 + H2SO4 = [AlOH]SO4 + H2O – образование основной соли гидроксосульфата алюминия.
Кроме того, как кислота Al(OH)3 реагирует с щелочами, поэтому с NaOH реакция протекает:
NaOH + Al(OH)3 = NaAlO2 + 2H2O (сплавление)
NaOH(раствор) + Al(OH)3 = Na[Al(OH)4]
С оксидом переходного металла CuO и оксидом слабой угольной кислоты CO2 гидроксид алюминия Al(OH)3 не взаимодействует.
Соляная кислота HCl реагирует с оксидами металлов, основаниям, металлами, стоящими в электрохимическом ряду напряжений металлов до водорода и солями металлов, образованных более слабыми кислотами, или с образованием осадка. Таким образом, HCl реагирует с CuO и NaOH, но не реагирует с серной кислотой и углекислым газом – кислотным оксидом:
CuO + 2HCl = CuCl2 + H2O (реакция обмена)
NaOH + HCl = NaCl + H2O (реакция нейтрализации: кислота + щелочь = соль + вода).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Гидроксид бария — обзор
Гидроксид бария
Гидроксид бария имеет молекулярную формулу Ba (OH) 2 и молекулярную массу 121,6324 г / моль. Он представляет собой ангидрат, призматические бесцветные кристаллы которого очень расплываются. Гидроксид бария можно получить растворением оксида бария (BaO) в воде:
BaO + 9H 2 O ⇒ Ba (OH) 2 · 8H 2 O
Он кристаллизуется в виде октагидрата, который превращается в моногидрат при нагревании на воздухе.Оксид бария реагирует с водяным паром при температурах от 1443 до 1593 K с образованием газообразного Ba (OH) 2 в соответствии с реакцией:
BaO (твердый) + H 2 O (газ) ⇒ Ba ( OH) 2 (газ)
Стандартная свободная энергия образования дается уравнением Δ G r ° = 49 400 — 16,6 Тл (кал / моль) в данном диапазоне температур. Согласно термодинамическому циклу, энергия связи между барием и двумя гидроксильными группами оказалась равной 196.8 ккал / моль.
Лучший метод приготовления включает добавление NaOH к нитрату. Поскольку гидроксид бария достаточно растворим, необходимо выпарить раствор для кристаллизации Ba (OH) 2 · 8H 2 О. Этанол добавлен для облегчения этой кристаллизации. Кристаллы промывают холодным этанолом для удаления ионов натрия, а затем сушат. Октагидрат гидроксида бария образует кристаллические осадки, растворимость которых не изменяется при старении и растворимость которых в воде увеличивается с повышением температуры.
При нагревании октагидрат разлагается на моногидрат примерно при 78 ° C и на ангидрат примерно при 375 ° C. Изучена термическая дегидратация кристаллического октагидрата гидроксида бария. Октагидрат сначала растворяется в собственных водах гидратации (78 ° C), а затем теряет четыре воды с образованием тригидрата при температуре около 125 ° C. Тригидрат нестабилен, и это моногидрат, который получают при 180 ° C. Постепенная термическая обработка на воздухе приводит к образованию безводного гидроксида бария при 375 ° C.Оксид бария образуется при температуре около 410 ° C в инертной атмосфере. Гидроксид превращается непосредственно в пероксид в диапазоне температур 400–600 ° C.
Физические свойства этих соединений гидроксида бария перечислены в таблице 3.7.
ТАБЛИЦА 3.7.
| Номер CAS | Ангидрат-17194-00-2 |
| Моногидрат-22326-55-2 | |
| Октагидрат-12230-71-6 | |
| Молекулярная масса | Ангидрат-171.3422 г / моль |
| Моногидрат-189,3925 г / моль | |
| Октагидрат-315,4636 г / моль | |
| Плотность | Ангидрат-4495 г / см 3 |
| Моногидрат-3,743 г / см 3 | |
| Октагидрат — 2,18 г / см 3 | |
| Точка плавления | 78 ° C — октагидрат |
| 407 ° C — Ангидрат | |
| Точка кипения | 780 ° C— Ангидрат |
| Основность | P K d = −2.02 |
| Показатель преломления | η D = 1,51 (октагидрат) |
| Энтапия образования | Δ f H = -944,7 кДж / моль |
| Стандартная энтропия | Ssolid0 = 100 ± 6 Дж / моль · K |
| Теплота плавления | Δ H f = 93,38 кДж (ангидрат) |
Гидроксид бария используется в аналитической химии для титрования слабых кислот, в частности органические кислоты.Он образует прозрачные водные растворы, не содержащие карбонатов, в отличие от гидроксидов щелочных металлов, поскольку карбонат бария нерастворим в воде. Это позволяет использовать такие индикаторы, как фенолфталеин или тимофталеин (со щелочным изменением цвета), без риска ошибок титрования из-за присутствия слабоосновных ионов CO32–.
Гидроксид бария используется в органическом синтезе как сильное основание, например, для гидролиза сложных эфиров и нитрилов (рис. 3.6).
РИСУНОК 3.6.
Его использовали для гидролиза одной из двух эквивалентных сложноэфирных групп в диметилэндекандиоате. Он также используется при получении циклопентанона, диацетонового спирта и d-глюонового γ-лактона (рис. 3.7).
РИСУНОК 3.7.
Гидроксид бария используется в качестве добавки к термопластам (например, фенольным смолам), стабилизаторам вискозы и ПВХ для улучшения пластических свойств. Этот материал используется как универсальная присадка к смазочным материалам и консистентным смазкам. Другие промышленные применения гидроксида бария включают производство сахара, производство мыла, омыление жиров, плавление силикатов и химический синтез других соединений бария и органических соединений.
Гидроксид бария — важный компонент при получении «высокотемпературных сверхпроводников». Высококачественный объемный YBa 2 Cu 3 O 7- x был синтезирован путем сплавления стехиометрических количеств нитратов иттрия и меди и гидроксида бария на воздухе с использованием обычной горелки Бунзена. Исходные материалы проходят через короткоживущую жидкую фазу, давая твердый черный продукт, который затем подвергали термообработке (900 ° C, 18–24 ч на воздухе, затем 500 ° C, 5 ч в O 2 ).Эти материалы имели фазовую чистоту более 99% с CuO в качестве единственной другой фазы, и они демонстрировали температуру перехода 92 К, идеальный диамагнитный отклик на 15,5% (с полевым охлаждением). Этот синтез представляет собой усовершенствование по сравнению с гораздо более трудоемкими и трудоемкими традиционными методами, поскольку он позволяет быстро получать высококачественные сверхпроводящие материалы различного состава.
Определена структура тригидрата гидроксида бария. Он ромбический; пространственная группа = Pnma с и = 7.640 Å, b = 11,403 Å, c = 5,965 Å, V = 519,7 Å 3 , Z = 4 и плотность = 2,88 г / см 3 . Молекулы воды имеют прочные водородные связи с гидроксид-анионом с расстояниями H – O 1,693 Å (H 2 OI), 1,672 Å (H 2 O-II) и 1,667 Å (H 2 O-III). . Сами по себе гидроксид-анионы не связаны водородными связями. Длины связи ОН составляют 0,99–1,01 Å (H 2 O) и 0,948 Å (OH –).Углы HOH составляют 102 ° (H 2 O-I) и 107,6 ° (H 2 O-II).
Эта соль использовалась в качестве катализатора окислительного сочетания метана с образованием углеводородов с более высокой молекулярной массой. Каталитические свойства щелочноземельных металлов, Be, Mg, Ca, Sr и Ba, были изучены для окислительного сочетания метана с образованием (C x H y ) n углеводородов ( n ≥ 2). Для сравнения различных каталитических соединений применялись нормированные условия реакции: T = 740 ° C, PoCh5 = 660 мбар, PoO2 = 80 мбар, PoN2 = 260 мбар при общем давлении 1 бар.C 2+ Селективность увеличилась с BeO (22%) через MgO (от 22 до 53%) и CaO (от 47 до 55%) до SrO и BaO (от 70 до 72%), при этом Ba (OH) 2 является наибольшим многообещающий.
Гидроксид бария продается как октагидрат, так и моногидрат. Он продается в больших количествах.
Титрование BaSO4 (сульфатом бария) — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
Требуемое обучение | Необходимые СИЗ |
|---|---|
Основы безопасности в лаборатории UC | Лабораторный халат, защитные очки / защитные очки, нитриловые перчатки |
Оборудование | Химическая промышленность |
Демонстрационная установка | 1.89 г гидроксида бария |
Стакан | 0,25M Серная кислота |
Доступ к розетке | |
Порядок действий:
** Осторожно обращайтесь с кольцевой подставкой, мешалкой, бюреткой и электродом как с одним целым **
- Растворите гидроксид бария в 100 мл деионизированной воды в стакане емкостью 300 мл.Это может занять некоторое время.
- Опустите электрод в раствор.
- Перед тем, как добавить серную кислоту в химический стакан, убедитесь, что электроника работает нормально, а лампочка горит ярко.
- Начните добавлять кислоту при перемешивании.
- Примерно на 17-19 мл свет погаснет.
- Добавленная дополнительная кислота снова включит свет.
Обсуждение:
Два контакта демонстрационной установки — проводники; если раствор между ними представляет собой электролит, загорится свет.В этом случае индикатор горит, кроме случаев, когда имеется стехиометрическое соотношение гидроксида бария и серной кислоты. Вначале растворение гидроксида бария дает ионы, в то время как в конце избыточная серная кислота дает ионы. Реакция показана ниже:
Ba (OH) 2 + h3SO4 → BaSO4 (т) + h3O
Тот факт, что мы видим тусклый свет лампочки, показывает, что этот процесс постепенен по мере добавления кислоты и выпадения в осадок большего количества бария.
Опасности:
С серной кислотой следует обращаться осторожно, особенно во время транспортировки демонстрационного образца.Пролитую кислоту следует нейтрализовать в соответствии с MSDS бикарбонатом натрия или другим подходящим материалом. Гидроксид бария несовместим с кислотами; убедитесь, что сухой гидроксид не подвергается случайному выбросу серной кислоты.
СОП:
Коррозионное вещество — гидроксид бария, серная кислота
Утилизация (складским помещением)
Верните отработанный раствор на склад для надлежащей утилизации через EH&S. Барий представляет опасность для окружающей среды, и его нельзя смывать в канализацию.
6.4: Кислотно-щелочная прочность — Chemistry LibreTexts
Навыки для развития
- Оценить относительную силу кислот и оснований в соответствии с их константами ионизации
- Понимать тенденции относительной силы сопряженных кислотно-основных пар и полипротонных кислот и оснований
Мы можем ранжировать силу кислот по степени их ионизации в водном растворе. Реакция кислоты с водой дается общим выражением:
\ [\ ce {HA} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {h4O +} (водн. {-}} \) — сопряженное основание кислоты \ (\ ce {HA} \), и ион гидроксония представляет собой сопряженную кислоту воды.{-}} \).
| Шесть сильных кислот | Шесть прочных оснований | ||
|---|---|---|---|
| \ (\ ce {HClO4} \) | кислота хлорная | \ (\ ce {LiOH} \) | гидроксид лития |
| \ (\ ce {HCl} \) | кислота соляная | \ (\ ce {NaOH} \) | натрия гидроксид |
| \ (\ ce {HBr} \) | бромистоводородная кислота | \ (\ ce {KOH} \) | гидроксид калия |
| \ (\ ce {HI} \) | иодоводородная кислота | \ (\ ce {Ca (OH) 2} \) | гидроксид кальция |
| \ (\ ce {HNO3} \) | азотная кислота | \ (\ ce {Sr (OH) 2} \) | гидроксид стронция |
| \ (\ ce {h3SO4} \) | серная кислота | \ (\ ce {Ba (OH) 2} \) | гидроксид бария |
Относительную силу кислот можно определить путем измерения их констант равновесия в водных растворах.В растворах с той же концентрацией более сильные кислоты ионизируются в большей степени и, следовательно, дают более высокие концентрации ионов гидроксония, чем более слабые кислоты. Константа равновесия кислоты называется константой ионизации кислоты, K a . Для реакции кислоты \ (\ ce {HA} \):
\ [\ ce {HA} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {h4O +} (водн.) + \ Ce {A -} (водн.) \]
запишем уравнение для константы ионизации как:
\ [K_ \ ce {a} = \ ce {\ dfrac {[h4O +] [A-]} {[HA]}} \]
, где концентрации являются равновесными.{-}} \) относительно концентрации неионизированной кислоты, \ (\ ce {HA} \). Таким образом, более сильная кислота имеет большую константу ионизации, чем более слабая кислота. Константы ионизации увеличиваются с увеличением силы кислот.
Следующие данные о константах кислотной ионизации указывают порядок силы кислоты: \ (\ ce {Ch4CO2H} <\ ce {HNO2} <\ ce {HSO4 -} \)
\ [\ begin {выровнено} \ ce {Ch4CO2H} (водн. {- 5} \\ [4pt] \ ce {HNO2} (водн.) + \ ce {h3O} (l) & ⇌ \ ce {h4O +} (водн.) + \ ce {NO2- } (вод.) & K_ \ ce {a} = 4.{−2} \ end {align} \]
Еще одним показателем силы кислоты является ее ионизация 900–60%. . Процент ионизации слабой кислоты — это отношение концентрации ионизированной кислоты к исходной концентрации кислоты, умноженное на 100:
.\ [\% \: \ ce {ionization} = \ ce {\ dfrac {[h4O +] _ {eq}} {[HA] _0}} × 100 \% \ label {PercentIon} \]
Поскольку соотношение включает начальную концентрацию, процент ионизации для раствора данной слабой кислоты варьируется в зависимости от исходной концентрации кислоты и фактически уменьшается с увеличением концентрации кислоты.
Пример \ (\ PageIndex {1} \): Расчет процентной ионизации от pH
Рассчитайте процент ионизации раствора азотистой кислоты (слабая кислота) 0,125– M с pH 2,09.
Решение
Процент ионизации кислоты:
\ [\ ce {\ dfrac {[h4O +] _ {eq}} {[HNO2] _0}} × 100 \]
Химическое уравнение диссоциации азотистой кислоты:
\ [\ ce {HNO2} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {NO2 -} (водн.) + \ Ce {h4O +} (водн.).{−3}} {0,125} × 100 = 6,5 \% \]
Помните, логарифм 2,09 указывает концентрацию иона гидроксония только с двумя значащими цифрами.
Упражнение \ (\ PageIndex {1} \)
Рассчитайте процент ионизации раствора уксусной кислоты 0,10 M с pH 2,89.
- Ответ
1,3% ионизированный
Мы можем ранжировать силу оснований по их склонности к образованию гидроксид-ионов в водном растворе.{+}} \) представляет собой сопряженную кислоту основания \ (\ ce {B} \), а ион гидроксида является сопряженным основанием воды. Сильное основание дает 100% (или почти так) OH — и HB + , когда оно реагирует с водой; Рисунок \ (\ PageIndex {1} \) перечисляет несколько сильных оснований. Слабое основание дает небольшую долю гидроксид-ионов. Растворимые ионные гидроксиды, такие как NaOH, считаются сильными основаниями, поскольку они полностью диссоциируют при растворении в воде.
Как и в случае с кислотами, мы можем измерить относительную силу оснований, измерив их константу ионизации основанием ( K b ) в водных растворах.В растворах с той же концентрацией более сильные основания ионизируются в большей степени и поэтому дают более высокие концентрации гидроксид-иона, чем более слабые основания. Более сильное основание имеет большую константу ионизации, чем более слабое основание. Для реакции основания \ (\ ce {B} \):
\ [\ ce {B} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {HB +} (водн.) + \ Ce {OH -} (водн.), \]
запишем уравнение для константы ионизации как:
\ [K_ \ ce {b} = \ ce {\ dfrac {[HB +] [OH-]} {[B]}} \]
, где концентрации являются равновесными.{−5} \ end {align} \]
Таблица констант ионизации слабых оснований представлена в таблице E2. Как и в случае с кислотами, процент ионизации можно измерить для основных растворов, но он будет варьироваться в зависимости от константы ионизации основания и начальной концентрации раствора.
Сильные стороны конъюгированных кислотно-основных пар
Сила кислоты / основания пары конъюгата связаны друг с другом. Рассмотрим реакции ионизации для сопряженной пары кислота-основание, HA — A — :
\ [\ ce {HA} (aq) + \ ce {h3O} (l) ⇌ \ ce {h4O +} (aq) + \ ce {A -} (aq) \ hspace {20px} K_ \ ce {a} = \ ce {\ dfrac {[h4O +] [A-]} {[HA]}} \]
\ [\ ce {A -} (aq) + \ ce {h3O} (l) ⇌ \ ce {OH -} (aq) + \ ce {HA} (aq) \ hspace {20px} K_ \ ce {b } = \ ce {\ dfrac {[HA] [OH]} {[A-]}} \]
Сложение этих двух химических уравнений дает уравнение для автоионизации воды:
\ [\ cancel {\ ce {HA} (aq)} + \ ce {h3O} (l) + \ cancel {\ ce {A -} (aq)} + \ ce {h3O} (l) ⇌ \ ce {h4O +} (aq) + \ cancel {\ ce {A -} (aq)} + \ ce {OH -} (aq) + \ cancel {\ ce {HA} (aq)} \]
\ [\ ce {2h3O} (l) ⇌ \ ce {h4O +} (водн.) + \ Ce {OH -} (водн.) \]
Как показано в предыдущей главе о равновесии, выражение K для химического уравнения, полученное путем сложения двух или более других уравнений, является математическим произведением выражений K других уравнений.Умножая выражения массового действия вместе и отбрасывая общие термины, мы видим, что:
\ [K_ \ ce {a} × K_ \ ce {b} = \ ce {\ dfrac {[h4O +] [A-]} {[HA]} × \ dfrac {[HA] [OH-]} {[ A-]}} = \ ce {[h4O +] [OH-]} = K_ \ ce {w} \]
Например, константа кислотной ионизации уксусной кислоты (CH 3 COOH) составляет 1,8 × 10 −5 , а константа ионизации основанием сопряженного основания, ацетат-иона (\ (\ ce {Ch4COO -} \) ), составляет 5,6 × 10 −10 . Произведение этих двух констант действительно равно K w :
.\ [K_ \ ce {a} × K_ \ ce {b} = (1.{−14} = K_ \ ce {w} \]
Степень, в которой кислота, HA, отдает протоны молекулам воды, зависит от силы конъюгированного основания A — кислоты. Если A — является более сильным основанием, большинство протонов, которые передаются молекулам воды, повторно захватываются A —. Таким образом, в растворе относительно мало A — и \ (\ ce {h4O +} \), а кислота, HA, является слабой. Если A — — более слабое основание, вода сильнее связывает протоны, и раствор содержит в основном A — и H 3 O + — кислота более сильная.Таким образом, силы кислоты и сопряженного с ней основания обратно пропорциональны, как показано на (Рисунок \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \) : На этой диаграмме показаны относительные силы сопряженных кислотно-основных пар, на что указывают их константы ионизации в водном растворе.Более сильная кислота имеет более слабое сопряженное основание. Более слабая кислота имеет более сильное сопряженное основание.
На рисунке \ (\ PageIndex {3} \) перечислены кислоты и основания в порядке уменьшения силы кислот и соответствующего увеличения силы оснований.Кислота и основание в данном ряду сопряжены друг с другом.
Первые шесть кислот на рисунке \ (\ PageIndex {3} \) являются наиболее распространенными сильными кислотами. Эти кислоты полностью диссоциируют в водном растворе. Конъюгированные основания этих кислот являются более слабыми основаниями, чем вода. Когда одна из этих кислот растворяется в воде, их протоны полностью переходят в воду, более сильное основание.
Те кислоты, которые находятся между ионом гидроксония и водой на рисунке \ (\ PageIndex {3} \), образуют сопряженные основания, которые могут конкурировать с водой за обладание протоном.Ионы гидроксония и молекулы неионизированной кислоты находятся в равновесии в растворе одной из этих кислот. Соединения, которые являются более слабыми кислотами, чем вода (находящиеся под водой в столбце кислот) на рисунке \ (\ PageIndex {3} \), не проявляют заметного кислотного поведения при растворении в воде. Их сопряженные основания сильнее, чем гидроксид-ион, и если бы какое-либо сопряженное основание образовалось, оно бы реагировало с водой, чтобы повторно сформировать кислоту.
Рисунок \ (\ PageIndex {3} \): диаграмма показывает относительную силу конъюгированных кислотно-основных пар.Степень, в которой основание образует гидроксид-ион в водном растворе, зависит от силы основания по сравнению с гидроксид-ионом, как показано в последнем столбце на рисунке \ (\ PageIndex {3} \). Сильное основание, такое как одно из тех, которые лежат ниже гидроксид-иона, принимает протоны из воды, давая 100% сопряженной кислоты и гидроксид-иона. Те основания, которые находятся между водой и гидроксид-ионом, принимают протоны от воды, но в результате получается смесь гидроксид-иона и основания. Основания, которые более слабые, чем вода (те, которые лежат над водой в колонке оснований), не проявляют наблюдаемого основного поведения в водном растворе.
Пример \ (\ PageIndex {2} \): Продукт K a × K b = K w
Используйте K b для нитрит-иона \ (\ ce {NO2 -} \), чтобы вычислить K a для его сопряженной кислоты.
Решение
K b для \ (\ ce {NO2 -} \) дается в этом разделе как 2,17 × 10 −11 . Кислота, сопряженная с \ (\ ce {NO2 -} \), представляет собой HNO 2 ; K a для HNO 2 можно рассчитать, используя соотношение:
\ [K_ \ ce {a} × K_ \ ce {b} = 1.{−4} \]
Этот ответ можно проверить, найдя K a для HNO 2 в таблице E1
Упражнение \ (\ PageIndex {2} \)
Мы можем определить относительную концентрацию кислоты \ (\ ce {Nh5 +} \) и HCN, сравнивая их константы ионизации. Константа ионизации HCN представлена в таблице E1 как 4,9 × 10 -10 . Константа ионизации \ (\ ce {Nh5 +} \) не указана, но константа ионизации сопряженного с ним основания, NH 3 , указана как 1.8 × 10 −5 . Определите константу ионизации \ (\ ce {Nh5 +} \) и решите, какая кислота сильнее: HCN или \ (\ ce {Nh5 +} \).
- Ответ
\ (\ ce {Nh5 +} \) — немного более сильная кислота ( K a для \ (\ ce {Nh5 +} \) = 5,6 × 10 −10 ).
Полипротонные кислоты и основания
Мы можем классифицировать кислоты по количеству протонов в молекуле, которые они могут отдать в реакции.Кислоты, такие как \ (\ ce {HCl} \), \ (\ ce {HNO3} \) и \ (\ ce {HCN} \), могут отдавать только один протон на молекулу. Это монопротонная кислота, кислоты. Несмотря на то, что она содержит четыре атома водорода, уксусная кислота, \ (\ ce {Ch4CO2H} \), также является монопротонной, потому что только атом водорода из карбоксильной группы (\ (\ ce {-COOH} \)) реагирует с основаниями:
Точно так же монопротонные основания — это основания, которые принимают один протон.
Однако некоторые кислоты способны отдавать более одного протона на молекулу в кислотно-основных реакциях.{−2} \).
Обратите внимание, что первая ионизация имеет гораздо более высокое значение K , чем вторая. Это иллюстрирует важный момент в отношении полипротонных кислот: первая ионизация всегда имеет место в большей степени, чем последующие ионизации.
В большинстве случаев полипротонные кислоты теряют свои протоны по одному, с K a1 >> K a2 >> K a3 и т. Д.
Когда мы делаем раствор слабой полипротонной кислоты, мы получаем раствор, содержащий смесь кислот.{−11} \]
\ (K _ {\ ce {h3CO3}} \) больше, чем \ (K _ {\ ce {HCO3 -}} \) в 10 раз. 4 , поэтому H 2 CO 3 является доминирующим продуцент иона гидроксония в растворе. Это означает, что небольшая часть \ (\ ce {HCO3 -} \), образовавшаяся в результате ионизации H 2 CO 3 , ионизируется с образованием ионов гидроксония (и карбонат-ионов), а концентрации H 3 O + и \ (\ ce {HCO3 -} \) практически равны в чистом водном растворе H 2 CO 3 .
Этот ступенчатый процесс ионизации происходит для всех полипротонных кислот, как показано в Таблице \ (\ PageIndex {1} \).
Таблица \ (\ PageIndex {1} \). Обычные полипротонные кислоты с их константами ионизации
| Полипротонные кислоты | Формула | Сильная / Слабая кислота | Количество ионизируемых водородов | К A1 | К A2 | К A3 |
|---|---|---|---|---|---|---|
| Серная кислота | H 2 SO 4 | Сильный | 2 (дипротический) | Очень большой | 1.1E-2 | |
| Сернистая кислота | H 2 SO 3 | Слабая | 2 (дипротический) | 1.3E-2 | 6.2E-8 | |
| Фосфорная кислота | H 3 PO 4 | Слабая | 3 (трипротический) | 7.1E-3 | 6.3E-8 | 4.2E-13 |
| Угольная кислота | H 2 CO 3 | Слабая | 2 (дипротический) | 4.4E-7 | 4,7E-11 | |
| Сероводородная кислота или сероводород | H 2 S | Слабая | 2 (дипротический) | 1.0E-7 | 1E-19 | |
| Щавелевая кислота | H 2 C 2 O 4 | Слабая | 2 (дипротический) | 5.4E-2 | 5.3E-5 | |
| Малоновая кислота | H 2 C 3 H 2 O 4 | Слабая | 2 (дипротический) | 1.5E-3 | 2.0E-6 |
Различия в константах ионизации каждой полипротонной кислоты говорят нам о том, что на каждом последующем этапе степень ионизации значительно слабее. Константы последовательной ионизации часто отличаются примерно от 10 5 до 10 6 . С практической точки зрения, если первая константа ионизации больше второй, по крайней мере, в 20 раз, целесообразно рассматривать первую ионизацию отдельно при выполнении расчетов равновесия для полипротонных кислот, что значительно упрощает эти вычисления.
Сводка
Сила кислот и оснований Бренстеда-Лоури в водных растворах может быть определена их константами кислотной или щелочной ионизации. Более сильные кислоты образуют более слабые сопряженные основания, а более слабые кислоты образуют более сильные сопряженные основания. Таким образом, сильные кислоты полностью ионизируются в водном растворе, поскольку их сопряженные основания являются более слабыми основаниями, чем вода. Слабые кислоты ионизируются лишь частично, потому что их сопряженные основания достаточно сильны, чтобы успешно конкурировать с водой за обладание протонами.{−14} = K_w \, (\ text {при комнатной температуре}) \)
Глоссарий
- константа кислотной ионизации ( K a )
- константа равновесия ионизации слабой кислоты
- константа основной ионизации ( K b )
- константа равновесия для ионизации слабого основания
- выравнивающий эффект воды
- любая кислота, более сильная, чем \ (\ ce {h4O +} \), или любое основание, более сильное, чем OH — , будет реагировать с водой с образованием \ (\ ce {h4O +} \) или OH — , соответственно; вода действует как основание, чтобы все сильные кислоты казались одинаково сильными, и действует как кислота, заставляя все сильные основания казаться одинаково сильными
- процентная ионизация
- отношение концентрации ионизированной кислоты к исходной концентрации кислоты, умноженное на 100
А кондуктометрическое титрование | Эксперимент
В этом эксперименте ученики наблюдают, что происходит, когда в пробирке смешиваются равные объемы разбавленной серной кислоты и щелочного раствора гидроксида бария.Затем они наблюдают, как демонстратор выполняет кондуктометрическое титрование, добавляя серную кислоту к раствору гидроксида бария по мере прохождения через него тока.
Титрование позволяет студентам наблюдать, как нейтрализация кислоты щелочью связана с изменениями концентрации ионов в результате реакции между ионами водорода и ионами гидроксида. Это также является важным доказательством простой теории кислотности ионов водорода.
Гидроксид бария — слаботоксичный щелочной раствор.Он требует тщательной подготовки и манипуляций, включая кондуктометрическое титрование. Четкая демонстрация с большей вероятностью приведет к успешному обучению, чем занятие в классе, которое потребует большой поддержки учителя.
Хорошая демонстрация займет около 25 минут.
Оборудование
Аппарат
- Защита глаз (для учителя и учащихся, помогающих на скамейке)
- Пробирка, 150 x 25 мм
- Штатив для пробирок
- Стаканы, 100 см 3 , 2 шт.
- Измерительный цилиндр, 100 см 3
- Стеклянный стержень
- Бюретка, 50 см 3
- Зажимы, 2 шт., И подставка
- Маленькая воронка (для наполнения бюретки)
- Белая плитка (для использования в стоячем стакане во время титрования) и белый фон карточки (для видимости класса)
- Пара угольных электродов (см. Примечание 6 ниже)
- Провода для вилок, 4 мм разъемы на каждом конце, 4 шт.
- Лампочка, 12 В, в держателе
- Амперметр переменного тока демонстрационный
- Низковольтное питание переменного тока (см. Примечание 7)
Химическая промышленность
- Раствор гидроксида бария, 0.10 M, (ВРЕДНЫЙ, РАЗДРАЖАТЕЛЬНЫЙ), около 200 см 3
- Разбавленная серная кислота, 1,0 М, (РАЗДРАЖАЮЩИЙ), около 25 см 3
- Вода очищенная (дистиллированная или деионизированная)
- Раствор индикатора фенолфталеина (легковоспламеняющийся)
Примечания по безопасности, охране труда и технике
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Раствор гидроксида бария, Ba (OH) 2 (водн.), (ВРЕДНО, РАЗДРАЖАЮЩЕЕ при использованной концентрации) — см. CLEAPSS Hazcard HC010B.Твердый гидроксид бария (КОРРОЗИОННЫЙ) содержит кристаллизационную воду и реагирует с диоксидом углерода из воздуха при хранении. Он слабо растворяется в воде (максимум 4 г в 100 см. 3 ), но раствор гораздо более щелочной, чем известковая вода. Сделайте 250 см 3 раствора. Очищенную воду необходимо кипятить для удаления двуокиси углерода перед добавлением к твердому гидроксиду бария. После приготовления раствор очень чувствителен к углекислому газу и сразу же мутнеет (карбонат бария) при контакте с атмосферой.Все свежие растворы, которые являются щелочными и могут вызвать раздражение чувствительной кожи, должны быть защищены защитной трубкой из натронной извести. По всем этим причинам важно проверить концентрацию раствора перед демонстрацией, чтобы убедиться, что она достаточно близка к 0,10 М — точная концентрация не требуется. Для этого оттитруйте 50 см 3 раствора разбавленной серной кислотой (1,0 М), которая будет использоваться в эксперименте, используя фенолфталеиновый индикатор (две капли). Допустимо значение титра от 4 см 3 до 6 см 3 .
- Разбавленная серная кислота, H 2 SO 4 (водн.), (РАЗДРАЖАЮЩИЙ при используемой концентрации) — см. CLEAPSS Hazcard HC098a и книгу рецептов CLEAPSS RB098.
- Раствор индикатора фенолфталеина (ОЧЕНЬ ВОСПЛАМЕНЯЮЩИЙСЯ) — см. CLEAPSS Hazcard HC032 и CLEAPSS Recipe Book RB000. Раствор индикатора фенолфталеина должен быть предоставлен в бутылке-капельнице.
- Два угольных электрода необходимо надежно закрепить в держателе, который удерживает их параллельно. Если возможно, в верхней части каждого электрода должен быть установлен переходник на 4 мм.Если их нет, можно использовать зажимы типа «крокодил», но вам понадобится картонный или пластиковый разделитель между зажимами, чтобы избежать случайного короткого замыкания.
- Низковольтный источник питания должен представлять собой регулируемый низковольтный блок, способный подавать переменный ток (AC) напряжением около 12 В при подключении через лампу на 12 В и электроды, последовательно погруженные в раствор. Демонстрационный амперметр переменного тока должен быть включен, если таковой имеется, и если лампа на 12 В не загорается достаточно ярко, чтобы класс мог это увидеть при испытании, как на этапе 1 ниже, амперметр необходим.
Процедура
1 этап
- Смешайте равные объемы разбавленной серной кислоты и раствора гидроксида бария в пробирке, чтобы увидеть, что произойдет.
- Добавьте 50 см. 3 раствора гидроксида бария в один стакан и добавьте 2–4 капли индикаторного раствора фенолфталеина, чтобы показать, что раствор щелочной.
- Окуните электроды в этот раствор, чтобы продемонстрировать, что он проводит электричество.Источник переменного тока должен гарантировать отсутствие электролиза.
- Промойте электроды очищенной водой. Теперь проверьте серную кислоту во втором стакане, чтобы показать, что она проводит электричество.
2 этап
- Заполните бюретку 1,0 М серной кислотой до нулевой отметки. Надежно закрепите бюретку над стаканом, содержащим 50 см. 3 0,1 М раствора гидроксида бария, готового к титрованию.
- Плотно зажмите узел электрода на одной стороне стакана, чтобы электроды погрузились на всю глубину раствора, и подсоедините его к остальной части испытательной схемы.Поместите палочку для перемешивания в раствор.
- Включите питание, обратите внимание на показания амперметра и яркость лампочки.
- Добавить серную кислоту из бюретки по 0,5 см. 3 за один раз при перемешивании. После каждого добавления записывайте показания амперметра и яркость лампочки и следите за постоянным изменением цвета индикатора.
- В конечной точке индикатора отметьте объем добавленной кислоты, показания амперметра и яркость лампы.
- Продолжайте добавлять порции кислоты и записывать показания амперметра и яркость лампы до тех пор, пока изменение при дальнейшем добавлении не станет минимальным.
Учебные заметки
Этот эксперимент является важным доказательством простой теории кислотности ионов водорода и ионной природы реакции нейтрализации гидроксид-ионами. Таким образом, она является естественной частью серии экспериментов, в которых эта теоретическая модель может быть построена для студентов. Этот эксперимент вряд ли принесет пользу сам по себе.
Это также зависит от понимания студентами ионной теории в целом и их понимания того, что проводимость раствора зависит от концентрации ионов в растворе.Вместо постоянного тока используется переменный ток, чтобы избежать электролиза, по крайней мере, в той степени, которая могла бы повлиять на результат эксперимента.
Хотя это, вероятно, будет демонстрацией для большинства учеников, некоторые учителя могут пожелать использовать его в качестве классного эксперимента, возможно, со старшими учениками. Проблемы безопасности относительно незначительны, в основном при использовании разбавленной серной кислоты (1,0 М) и раствора гидроксида бария (0,1 М). К последнему следует относиться как к ВРЕДНОМУ для студентов, даже при такой низкой концентрации.
Причина использования таких разных концентраций при кондуктометрическом титровании состоит в том, чтобы минимизировать снижение проводимости, вызванное увеличением объема воды, присутствующей в процессе титрования, помимо изменений общего количества присутствующих ионов.
Скачать рабочий лист
Рабочий лист учащегося с вопросами, сопровождающими эту демонстрацию, доступен для загрузки в виде редактируемого документа Word или файла PDF. Ответы на вопросы приведены ниже.
ответов
- Это пересматривает понимание учащимися ионов и их способность определять присутствующие ионы (катионы бария и анионы гидроксида в гидроксиде бария, катионы водорода и анионы сульфата в серной кислоте). Символы для этих ионов:
Ba 2+ , OH — , H + , SO 4 2–
- Ионы являются носителями тока в растворе, а проводимость зависит от концентрации ионов.Если задать вопрос, какие ионы удаляются при образовании сульфата бария, есть возможность написать ионное уравнение для реакции осаждения:
Ba 2+ (водн.) + SO 4 2– (водн.) → BaSO 4 (с)
Следовательно, можно идентифицировать падение общей концентрации ионов, что отражается в падении проводимости.
- Разобравшись с ионами бария и сульфата, студенты могут сосредоточиться на том, что еще происходит, начиная с определения катионов водорода и анионов гидроксида как потенциальных реагентов.Эти ионы действительно вступают в реакцию, и реакция проста.
- Ионное уравнение реакции между этими ионами:
H + (водн.) + OH — (водн.) → H 2 O (l)
- Любой реагент, добавленный после достижения конечной точки, является «избыточным», и поэтому ионы снова присутствуют, и проводимость раствора снова повышается. Маловероятно, что конечная точка будет отмечена нулевой проводимостью. Используемый метод титрования слишком груб, чтобы найти точную точку, в которой почти нет ионов, и даже капля серной кислоты, добавленная почти в конечной точке, приведет к тому, что реакция пройдет мимо конечной точки.
Дополнительная информация
Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов. Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические примечания и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
Использование проводимости для определения точки эквивалентности
Введение
“
В этом эксперименте вы будете контролировать проводимость во время реакции между серной кислотой H 2 SO 4 и гидроксидом бария Ba (OH) 2 , чтобы определить точку эквивалентности. Из этой информации вы можете найти концентрацию раствора Ba (OH) 2 .Вы также увидите влияние ионов, осадков и воды на проводимость. Уравнение реакции в этом эксперименте:
Перед реакцией Ba (OH) 2 и H 2 SO 4 почти полностью диссоциируют на свои соответствующие ионы. Однако ни один из продуктов реакции существенно не диссоциирует. Сульфат бария представляет собой осадок, а вода преимущественно молекулярная.
Поскольку 0,02 M H 2 SO 4 медленно добавляется к Ba (OH) 2 с неизвестной концентрацией, изменения проводимости раствора будут отслеживаться с помощью датчика проводимости.Когда зонд помещается в раствор, содержащий ионы и, таким образом, обладающий способностью проводить электричество, электрическая цепь замыкается на электродах, которые расположены по обе стороны от отверстия в нижней части корпуса зонда. Это приводит к значению проводимости, которое может быть прочитано интерфейсом. Единица измерения проводимости, используемая в этом эксперименте, — микросименс на сантиметр или мкСм / см.
Перед проведением эксперимента очень важно выдвинуть гипотезу о проводимости раствора на различных стадиях реакции.Ожидаете ли вы, что показания проводимости будут высокими или низкими, увеличиваться или уменьшаться в каждой из этих ситуаций?
- Когда датчик проводимости помещен в Ba (OH) 2 , до добавления H 2 SO 4 .
- As H 2 SO 4 медленно добавляется с образованием BaSO 4 и H 2 O.
- Когда добавлено количество молей H 2 SO 4 , равняется количеству молей BaSO 4 , присутствовавшего изначально.
- В качестве избытка H 2 SO 4 добавляется сверх точки эквивалентности.
“
Цели
В этом эксперименте вы получите
- Выдвинуть гипотезу о проводимости раствора серной кислоты и гидроксида бария на различных стадиях реакции.
- Используйте датчик проводимости для контроля проводимости во время реакции.
- Просмотрите влияние ионов, осадков и воды на проводимость.
Датчики и оборудование
В этом эксперименте используются следующие датчики и оборудование.Может потребоваться дополнительное оборудование.
Формула гидроксида бария, молярная масса, октагидрат, применение, MSDS
Что такое гидроксид бария?
Это химическое вещество, также известное как «Барита». Это соединение бария, мягкого серебристого металла группы щелочноземельных металлов.
Его можно получить путем растворения оксида бария (обозначается BaO) в воде. Это выражается этой химической реакцией:
BaO + 9 h3O → Ba (OH) 2 · 8h3O
Химическая формула
Химическая формула гидроксида бария — Ba (OH) 2.
Молярная масса
Молярная масса гидроксида бария составляет
171,34 г / моль (в безводных растворах)
189,355 г / моль (моногидрат)
315,46 г / моль (октагидрат)
Растворим ли гидроксид бария в воде?
Растворимость гидроксида бария в воде средняя. Однако это соединение не растворяется в ацетоне. При комнатной температуре может образоваться раствор. Установлено, что раствор гидроксида бария имеет приблизительную концентрацию 0,1 моль дм-3.
Рисунок 1 — Гидроксид бария
Источник — flish3010.en.made-in-china.com
Свойства гидроксида бария
Физические и химические свойства этого соединения следующие:
Стабильность
Это стабильное соединение. Несовместим с углекислым газом, кислотами и влагой. Необходимо избегать контакта этого вещества с несовместимыми материалами.
Внешний вид
Это кристаллическое вещество, цвет от белого до прозрачного.
Удельный вес
Удельный вес этого вещества 2,18.
Точка плавления
Вещество плавится при температуре 408 ° C.
Температура кипения
Материал кипит при температуре 780 ° C.
Значение pH
Значение pH гидроксида бария фактически зависит от его концентрации. Тем не менее, pH этого соединения составляет около -2. Это указывает на то, что это очень простой по своей природе.
Плотность
Имеет плотность 2.18 штук на г см-3
Молекулярная формула
Молекулярная формула октагидрата гидроксида бария — Bah28O10.
Октагидрат гидроксида бария
Это химическое соединение, представляющее собой белый кристаллический порошок. Он твердый и растворим в воде. Он имеет температуру плавления 78 ° C.
Он также известен под другими названиями, такими как
.- Барий гидрат
- Гидроксид бария
- 8-гидрат
Использование гидроксида бария
Он используется для ряда целей, например,
- При производстве щелочи
- В строительстве из стекла
- При вулканизации синтетического каучука
- В ингибиторах коррозии
- В качестве буровых растворов, пестицидов и смазочных материалов
- Средство от накипи на котле
- Для рафинации растительных и животных масел
- Для фресковой живописи
- В воде для умягчения
- В составе гомеопатических средств
- Для ликвидации разливов кислоты
Также используется в сахарной промышленности для приготовления свекловичного сахара.
Гидроксид бария MSDS
Паспорт безопасности материала (MSDS) гидроксида бария выглядит следующим образом:
Меры безопасности
Это вещество может причинить вред при вдыхании, проглатывании или даже при контакте с ним. Прямое воздействие на кожу, глаза или одежду может быть опасным. После работы с этим материалом следует тщательно вымыть руки. Если одежда попала в контакт с этим веществом, ее следует немедленно снять. Любой участок кожи, подвергшийся воздействию этого соединения, следует немедленно промыть холодной водой с легким мылом.
Токсикология
Продолжительное воздействие этого вещества может вызвать раздражение кожи. Пыль этого материала может раздражать легкие и дыхательные пути. Проглатывание может вызвать ряд неприятных симптомов, например
- Тошнота
- Рвота
- Головная боль
- Головокружение
- Раздражение желудочно-кишечного тракта
Люди с уже существующими заболеваниями дыхательной системы, кожи или глаз могут стать более восприимчивыми к одному или нескольким из вышеупомянутых симптомов.
Личная безопасность
Необходимо безопасно хранить этот материал, чтобы избежать утечки и опасности возгорания. Любой пожар, возникший из-за этого вещества, можно остановить с помощью огнетушителей. Лица, использующие это соединение, должны носить защитную одежду и использовать автономный дыхательный аппарат для предотвращения контакта этого материала с глазами, одеждой или кожей.
Гидроксид бария и соляная кислота
Гидроксид бария используется для нейтрализации соляной кислоты.Химическая реакция между двумя соединениями дается как:
Ba (OH) 2 (водный) + 2HCl (водный) -> BaCl2 (водный) + 2h3O (жидкий)
Гидроксид бария и серная кислота
Гидроксид бария часто используется для нейтрализации серной кислоты. Реакция выражается через это представление:
Ba (OH) 2 (твердый) + h3SO4 (водный) → BaSO4 (твердый) + 2h3O (жидкий)
Небольшое количество BaSO4, которое получают из умеренно растворимого Ba (OH) 2, покрывает и осаждает Ba (OH) 2.В результате реакция между h3SO4 и Ba (OH) 2 останавливается.
Гидроксид бария и хлорид аммония
Реакция нейтрализации твердого гидратированного гидроксида бария твердым хлоридом аммония носит эндотермический характер. В результате реакции образуется жидкость, температура которой падает примерно до -20 ° C. Он представлен как:
Ba (OH) 2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газообразный) + HOH (жидкий).
Гидроксид бария и тиоцианат аммония
Это эндотермическая реакция, в результате которой образуется тиоцианат бария.Выражается через эту химическую реакцию:
Ba (OH) 2,8h3O (твердый) + 2 Nh5SCN (твердый) → Ba (SCN) 2 (твердый) + 10 h3O (жидкий) + 2 Nh4 (газообразный).
Моногидрат гидроксида бария
Это химическое соединение представляет собой белый порошок. Он также известен под другими названиями, такими как
.- Сухой гидроксид бария
- Каустический моногидрат бариты
- 1-Гидрат гидроксида бария
Соединение используется для различных целей, например,
- Очищающая вода
- Присадки к производственным маслам
- Производство смазочных материалов
- Производство химикатов с высоким содержанием бария
Контакт с кожей, вдыхание или проглатывание этого материала может нанести вред здоровью.В острых случаях также может наступить смерть. Это негорючее вещество, но при нагревании может разлагаться и образовывать токсичное и / или коррозионное пламя. Его следует хранить в контейнерах в прохладном, сухом месте и вдали от источников тепла. В противном случае контейнеры могут взорваться в нагретой среде.
Гидроксид бария — сильное или слабое основание?
Это соединение хорошо растворяется в воде. Он считается единственным двухосновным сильным основанием. Он способен делать лакмусовую бумагу синей и может образовывать соль и воду при реакции с кислотой.
Гидроксид бария и азотная кислота
Гидроксид бария реагирует с азотной кислотой с образованием соли (нитрата бария) и воды, как в случае классических кислотно-основных реакций. Химическая реакция выражается как:
2HNO3 (водный раствор азотной кислоты) + Ba (OH) 2 (водный гидроксид бария) → Ba (NO3) 2 (водный нитрат бария) + 2h3O (вода)
Гидроксид бария и диоксид углерода
Ba (OH) 2 реагирует с диоксидом углерода с образованием карбоната бария. Это выражается следующей химической реакцией:
Ba (OH) 2 + CO2 → BaCO3 + h3O.
Хлорная кислота и гидроксид бария
Две молекулы хлорной кислоты реагируют с одной молекулой гидроксида бария с образованием двух молекул воды и одной молекулы перхлората бария (также известного как хлорат бария). Реакция выражается как
.Ba (OH) 2 + 2 HClO4 (водный) → Ba (ClO4) 2 (водный) + 2 h3O (жидкий).
Гидроксид бария, используемый в этой реакции, представляет собой твердый или сильно разбавленный водный раствор.
Уксусная кислота и гидроксид бария
Две молекулы уксусной кислоты реагируют с одной молекулой гидроксида бария с образованием соли (нитрата бария) вместе с водой, как и при любой другой кислотно-основной реакции.Выражается как:
2 Ch4COOH + Ba (OH) 2 → Ba (C2h4O2) 2 + 2h3O
Реакцию можно облегчить, заменив C2h4O2 на Ac. Замененная таким образом химическая реакция может быть представлена как:
2 HAc + Ba (OH) 2 → Ba (Ac) 2 + 2h3O
Гидроксид бария и фосфорная кислота
В этой кислотно-щелочной реакции нейтрализации участвуют три молекулы гидроксида бария и две молекулы фосфорной кислоты. Формульное представление этой химической реакции выглядит следующим образом:
3 Ba (OH) 2 + 2 h4PO4 → Ba3 (PO4) 2 + 6h3O
Приводит к осаждению фосфата бария.Это можно рассматривать как реакцию «двойной замены», в которой барий заменяет водород, который, в свою очередь, заменяет барий.
3 Ba (OH) 2 + 2 h4PO4 → Ba3 (PO4) 2 + 6HOH
Гидроксид бария и нитрат аммония
Две молекулы водного гидроксида бария реагируют с водным раствором нитрата аммония с образованием водных растворов нитрата бария, аммиака и воды. Химическая реакция представлена как:
Ba (OH) 2 (водный) + 2 Nh5NO3 (водный) → Ba (NO3) 2 (водный) + 2 Nh4 (водный) + 2 h3O (жидкий).
Аммиак может растворяться в растворе до насыщения. Затем он может превратиться в газ, тем самым завершив химическое изменение.
Гидроксид бария и хлорид аммония
Твердый хлорид аммония смешивают с твердым гидратированным гидроксидом бария в химическом стакане с образованием хлорида бария. Газообразный аммиак и гидроксид водорода (вода) — другие продукты, возникающие в результате этой эндотермической реакции. В этой холодной реакции температура резко падает примерно до -20 ° C.
Формульное представление этой реакции выглядит следующим образом:
Ba (OH) 2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газообразный) + HOH (жидкий)
Октагидрат гидроксида бария и тиоцианат аммония
Тиоцианат аммония (Nh5SCN) смешивают с твердым октагидратом гидроксида бария (Ba (OH) 2,8h3O) для получения тиоцианата бария. В результате кислотно-щелочной реакции образуется щелочной газ, который можно определить с помощью pH-бумаги.
Уравнение этой эндотермической реакции имеет вид:
Ва (ОН) 2.8h3O (твердый) + 2 Nh5SCN (твердый) → Ba (SCN) 2 (т. Е) + 10 h3O (жидкий) + 2 Nh4 (газообразный).
Это эндотермическая реакция, при которой происходит поглощение тепла из окружающей среды. Это приводит к быстрому падению температуры этой реакции, которую можно определить с помощью цифрового термометра. Стакан прилипает к деревянной доске. По этой причине стакан следует поставить на небольшую доску, на которую налито несколько капель воды.
Гидроксид бария — одно из основных соединений бария.В продаже он чаще всего доступен в виде белого гранулированного моногидрата.
Артикул:
http://jchemed.chem.wisc.edu/JCESoft/CCA/CCA3/MAIN/ENDO2/PAGE1.HTM
http://www.practicalchemistry.org/experiments/endothermic-solid-solid-reactions,277,EX.html
http://www.chem.umn.edu/outreach/endoexo.html
http://www.chemicalbook.com/ChemicalProductProperty_EN_CB4318493.htm
.
 к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O
к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH— + 2H+ + SO42- = BaSO4 + 2H2O Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.