свойства, реакции, методы получения и применение
Гидроксид цинка — это неорганическое соединение. Химическая формула гидроксида цинка -Zn(OH)2. Является белым порошком, практически нерастворимым в воде, но легко растворяется в кислотах и щелочах.
Гидроксид цинка какой гидроксид? Гидроксид цинка — основной гидроксид. Он образуется в результате реакции между металлическим ионом цинка (Zn2+) и гидроксидным ионом (OH-) в водном растворе.
Гидроксид цинка является амфотерным соединением, то есть он может проявлять свойства как кислоты, так и основания в зависимости от условий реакции.
Содержание
Модификации гидроксида цинка
Гидроксид цинка 1. Аморфный гидроксид цинка — это неструктурированный порошок, получаемый при осаждении из раствора цинксодержащих солей.
Гидроксид цинка 2. Белый гидроксид цинка — это белый кристаллический порошок, получаемый при нагревании аморфного гидроксида цинка до 300 °C.
Гидроксид цинка 3. Зеленый гидроксид цинка — это зеленый кристаллический порошок, получаемый при нагревании аморфного гидроксида цинка до 350 °C.
Гидроксид цинка 4. Гексагональный гидроксид цинка — это кристаллический порошок с гексагональной решеткой, получаемый при реакции цинка с гидроксидом аммония.
Гидроксид цинка 5. Двухслойный гидроксид цинка — это сложный кристаллический порошок, состоящий из двух слоев гидроксида цинка, разделенных ионами аниона, такими как карбонат или нитрат. Он часто используется в качестве катализатора и в качестве прочного ионного обменника.
У гидроксида цинка существует несколько модификаций из-за того, что его структура не является жестко заданной и может быть изменена под воздействием различных условий.
Гидроксид цинка может иметь различное количество молекул воды, которые могут оказывать влияние на его структуру и свойства.
Формирование различных модификаций гидроксида цинка может быть обусловлено разными методами синтеза, температурными условиями, реактивами и т. д.
д.
Каждая модификация гидроксида цинка имеет свои уникальные свойства и может быть использована в различных областях промышленности, медицины и науки.
Свойства гидроксида цинка
Физические свойства гидроксида цинка
- Физическое состояние: гидроксид цинка является твердым веществом, которое может иметь различные формы (аморфная порошкообразная масса, кристаллический порошок или кристаллы).
- Цвет: гидроксид цинка может быть белым, зеленым или серовато-белым в зависимости от его модификации.
- Температура плавления: 125 °C.
- Растворимость: плохо растворим в воде (0,0002 г/100 мл при 20 °C), но лучше растворяется в щелочных растворах.
- Плотность: 3,05 г/см³.
- Магнитные свойства: гидроксид цинка не обладает магнитными свойствами.
- Излучение: гидроксид цинка не является радиоактивным веществом.

- pH раствора: гидроксид цинка имеет слабощелочную природу и может растворяться в кислых растворах с образованием ионов цинка.
- Масса гидроксида цинка зависит от его количества. Молярная масса гидроксида цинка (Zn(OH)2) равна сумме молярных масс цинка, кислорода и водорода, умноженных на соответствующие коэффициенты в формуле соединения. Молярная масса цинка равна 65,38 г/моль, кислорода — 15,99 г/моль, а водорода — 1,01 г/моль.
Молярная масса гидроксида цинка вычисляется следующим образом: Молярная масса Zn(OH)2 = 65,38 г/моль (масса цинка) × 1 + 15,99 г/моль (масса кислорода) × 2 + 1,01 г/моль (масса водорода) × 4 Молярная масса Zn(OH)2 = 99,38 г/моль Молярная масса гидроксида цинка равна приблизительно 99,38 г/моль. Для расчета массы гидроксида цинка можно использовать формулу: масса = молярная масса × количество Например, для расчета массы 1 моль гидроксида цинка: масса = 99,4 г/моль × 1 моль = 99,4 г Если известно количество гидроксида цинка в граммах, то массу можно вычислить следующим образом: масса = количество / количество в 1 моле × молярная масса Например, для расчета массы 10 гидроксида цинка: масса = 10 г / 99,4 г/моль × 1 моль = 0,1007 моль масса = 0,1007 моль × 99,4 г/моль = 10,01 г
Масса гидроксида цинка зависит от его количества и может быть вычислена с использованием его молярной массы и количества в молях или граммах.
Гидроксид цинка химические свойства
Гидроксид цинка (Zn(OH)2) — это белый порошок, который не растворяется в воде, но может диссоциировать в щелочной среде.
- Он является амфотерным, т.е. гидроксид цинка взаимодействует как с кислотами, так и со щелочами. При этом сильные кислоты приводят к растворению гидроксида цинка, а сильные щелочи приводят к его осаждению.
- Гидроксид цинка является слабой основой и может диссоциировать, образуя ионы Zn2+ и OH-. Уровень растворимости гидроксида цинка в воде невысок, но может увеличиваться при наличии анионов, таких как гидрокарбонатные или фосфатные.
- Гидроксид цинка взаимодействие с кислородом приводит к образованию основной соли ZnO.
- Применяется в качестве катализатора в некоторых химических реакциях.
- Гидроксид цинка обладает свойствами адсорбции и может быть использован в качестве сорбента для удаления тяжелых металлов из воды.
- Используется в качестве пигмента в различных промышленных областях, включая краски и лаки.

- Гидроксид цинка применяется для производства других соединений цинка, таких как оксид цинка и карбонат цинка.
Гидроксид цинка карбонат цинка — этот процесс происходит путем обработки гидроксида цинка углекислым газом, что приводит к образованию карбоната цинка и воды. Углекислый газ реагирует с гидроксидом цинка в соотношении:
Zn(OH)2 + CO2 → ZnCO3 + h3O
Полученный карбонат цинка широко используется в различных промышленных процессах, таких как производство красок, пластмасс, каучука, резины, лекарственных препаратов и других изделий.
Гидроксид цинка реакции
С гидроксидом цинка реагируют вещества – кислоты, гидроксиды других металлов, окислители, аммиак и др.
Гидроксид цинка кислота
Гидроксид цинка может растворяться в кислотах, образуя соль цинка и воду. Гидроксид цинка с кислотой реакции – общая формула реакции нейтрализации, в результате которой образуется соль цинка и вода:
Zn(OH)2 + 2HX → ZnX2 + 2h3O
где X — любая кислота.
Гидроксид цинка уравнение реакции — кислота отбирает ионы гидроксида (OH-) из гидроксида цинка, образуя воду, а ионы цинка соединяются с ионами кислоты, образуя соль цинка.
Гидроксид цинка и соляная кислота
Раствор гидроксида цинка (Zn(OH)2) может реагировать с соляной кислотой (HCl), образуя соль цинка (ZnCl2) и воду (h3O). Уравнение реакции гидроксид цинка соляная кислота:
Zn(OH)2 + 2HCl → ZnCl2 + 2h3O
Взаимодействие гидроксида цинка с соляной кислотой — эта реакция нейтрализации, где щелочь (гидроксид цинка) и кислота (соляная кислота) реагируют, образуя соль и воду. В этой реакции соляная кислота отбирает ионы гидроксида (OH-) из гидроксида цинка, образуя воду, а ионы цинка соединяются с ионами хлора (Cl-), образуя соль цинка.
Гидроксид цинка и серная кислота
Гидроксид цинка (Zn(OH)2) может реагировать с серной кислотой (h3SO4), образуя соль цинка (ZnSO4) и воду (h3O). Гидроксид цинка серная кислота уравнение реакции
Гидроксид цинка серная кислота уравнение реакции
Zn(OH)2 + h3SO4 → ZnSO4 + 2h3O
Эта реакция гидроксида цинка с кислотой является типичной реакцией нейтрализации, где щелочь (гидроксид цинка) и кислота (серная кислота) реагируют, образуя соль и воду. Знание этой реакции может быть полезным, например, при очистке воды или при синтезе некоторых соединений цинка.
Гидроксид цинка азотная кислота
Гидроксид цинка (Zn(OH)2) и азотная кислота (HNO3) могут реагировать между собой, образуя соль и воду:
Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2h3O
Таким образом, продуктами реакции будут нитрат цинка (Zn(NO3)2) и вода (h3O).
Реакция гидроксида цинка со щелочами
Гидроксид цинка гидроксид натрия
Гидроксид цинка может реагировать со щелочами, образуя осадок гидроксида цинка. Уравнение реакции гидроксид цинка и гидроксид натрия:
Zn(OH)2 + 2NaOH → Na2Zn(OH)4.
Гидроксид цинка и раствор гидроксида натрия результатом реакции является белый осадок двойного гидроксида натрия и цинка, который может быть использован в качестве катализатора в различных химических реакциях. 2-). Это соединение может использоваться в качестве ингредиента в различных химических и фармацевтических процессах, например, в производстве цемента, стекла, бумаги и других продуктов.
2-). Это соединение может использоваться в качестве ингредиента в различных химических и фармацевтических процессах, например, в производстве цемента, стекла, бумаги и других продуктов.
Гидроксид цинка и гидроксид калия
Раствор гидроксида цинка и гидроксида калия могут реагировать, образуя гидроксид цинка калия (K2Zn(OH)4). Реакция гидроксид цинка гидроксид кальция:
Zn(OH)2 + 2KOH → K2Zn(OH)4 — гидроксид цинка гидроксид калия уравнение
Гидроксид цинка и гидроксид калия реакция приводит к образованию белого осадка гидроксида цинка калия, который может быть использован в качестве катализатора в различных химических реакциях.
Диссоциация в воде
Гидроксид цинка может диссоциировать в воде, образуя ионы Zn2+ и OH-. Гидроксид цинка уравнение реакции:
Zn(OH)2 ↔ Zn2+ + 2OH-
Гидроксид цинка оксид цинка — это реакция диссоциации, при которой одно соединение распадается на два других соединения в результате дегидратации. Оксид цинка гидроксид цинка реакция происходит с потерей молекулы воды, поэтому оксид цинка (ZnO) содержит меньше кислорода, чем гидроксид цинка (Zn(OH)2).
Оксид цинка гидроксид цинка реакция происходит с потерей молекулы воды, поэтому оксид цинка (ZnO) содержит меньше кислорода, чем гидроксид цинка (Zn(OH)2).
Образование основных солей, реакция гидроксида цинка с кислородом
Гидроксид цинка может реагировать с кислородом, образуя основную соль ZnO. Напишете уравнение реакции гидроксида цинка:
2Zn(OH)2 → 2ZnO + 2h3O.
Амфотерность
С гидроксидом цинка реагируют вещества различные по своему составу — кислоты, основания.
Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2h3O
Zn(OH)2 + 2NaOH → Na2Zn(OH)4.
Окисление
Гидроксид цинка может вступать в реакции с различными окислителями, например, гидроксид цинка взаимодействует с такими веществами как перекись водорода, кислород.
Zn(OH)2 + h3O2 → ZnO + 2h3O
Гидроксид цинка с чем реагирует еще
Цинк гидроксид меди
Реакция между цинком и гидроксидом меди выглядит:
Zn + Cu(OH)2 → Zn(OH)2 + Cu
В результате этой реакции образуется гидроксид цинка (Zn(OH)2) и медь (Cu). -) – результат реакции. При этом образовавшийся осадок гидроксида цинка в дальнейшем превращается в оксид цинка при высушивании и нагревании. Реакция также сопровождается образованием ионов нитрата в растворе.
-) – результат реакции. При этом образовавшийся осадок гидроксида цинка в дальнейшем превращается в оксид цинка при высушивании и нагревании. Реакция также сопровождается образованием ионов нитрата в растворе.
Гидроксид цинка оксид меди
Реакция между гидроксидом цинка и оксидом меди выглядит следующим образом:
Zn(OH)2 + CuO → Cu(OH)2 + ZnO
Процесс происходит в водной среде, при нагревании.
Реакция происходит за счет образования осадка гидроксида меди, который в дальнейшем превращается в оксид меди при высушивании и нагревании. Реакция также сопровождается образованием оксида цинка в виде осадка.
Гидроксид цинка оксид кальция
Реакция между гидроксидом цинка и оксидом кальция выглядит следующим образом:
Zn(OH)2 + CaO → Ca(OH)2 + ZnO
В результате этой реакции образуются гидроксид кальция (Ca(OH)2) и оксид цинка (ZnO). Обычно эта реакция проводится в водной среде, при нагревании.
Происходит образование осадка гидроксида кальция, который в дальнейшем превращается в гидроксид кальция при контакте с водой. Реакция также сопровождается образованием оксида цинка в виде осадка.
Реакция также сопровождается образованием оксида цинка в виде осадка.
Оксид магния гидроксид цинка
MgO + Zn(OH)2 → Mg(OH)2 + ZnO
Реакция происходит в водном растворе с образованием гидроксида магния (Mg(OH)2) и оксида цинка (ZnO).
Процесс протекает за счет обмена ионами между соединениями. Магний и цинк меняются местами с гидроксидными группами, образуя гидроксид магния и оксид цинка в виде осадка.
Эта реакция не является очень интенсивной, так как оба соединения не слишком реакционноспособны в данной ситуации.
Магний гидроксид цинка
Реакция между магниевым гидроксидом и цинком не происходит напрямую. Эти два соединения не реагируют между собой при обычных условиях.
Однако если добавить к магниевому гидроксиду некоторое количество цинка и нагреть смесь, то может произойти следующая реакция:
Zn + 2Mg(OH)2 → 2MgO + Zn(OH)2
В результате этой реакции образуются оксид цинка (ZnO) и гидроксид цинка (Zn(OH)2), а также оксид магния (MgO).
Реакция происходит за счет окисления цинка и образования ионов цинка, которые вступают в реакцию с гидроксидом магния, образуя гидроксид цинка и оксид магния.
Гидроксид натрия соляная кислота гидроксид цинка
Реакция между гидроксидом натрия (NaOH) и соляной кислотой (HCl) приведет к образованию соли натрия (NaCl) и воды (h3O):
NaOH + HCl → NaCl + h3O
После реакции гидроксид натрия и соляной кислоты образуется NaCl и h3O, а гидроксид цинка (Zn(OH)2) не участвует в реакции.
Если к полученной соли NaCl добавить гидроксид цинка, то произойдет реакция образования осадка гидроксида цинка и растворимого натрия-тетрагидроксоцинката (II):
NaCl + Zn(OH)2 → Zn(OH)2↓ + NaOH· Zn(OH)4
Здесь ↓ обозначает образование осадка, а · обозначает комплексную связь.
Гидроксид бария гидроксид цинка гидроксид натрия
Между гидроксидами бария (Ba(OH)2), цинка (Zn(OH)2) и натрия (NaOH) не происходит прямых реакций, так как это все основания. Если смешать раствор гидроксида бария и раствор гидроксида натрия, то произойдет двойная заместительная реакция, в результате которой образуется осадок гидроксида бария (Ba(OH)2) и растворимая соль натрия:
Ba(OH)2 + 2NaOH → Ba(OH)2↓ + 2NaOH
Если добавить гидроксид цинка к полученному раствору, то произойдет реакция образования осадка гидроксида цинка и растворимого натрия-цинкатного (II) комплекса:
Zn(OH)2 + NaOH + NaBa(OH)4 → Zn(OH)2↓ + Na2Ba(OH)4
Здесь ↓ обозначает образование осадка, а Ba(OH)4^(2-) — растворимый комплексный ион бария с гидроксидами. (2-) — ион сернокислого радикала.
(2-) — ион сернокислого радикала.
Гидроксид цинка оксид цинка вода
Когда гидроксид цинка (Zn(OH)2) нагревают, он разлагается на оксид цинка (ZnO) и воду (h3O):
Zn(OH)2 → ZnO + h3O
Эта реакция является термическим разложением. Оксид цинка образуется в виде белого порошка, а вода выходит в виде пара. В результате реакции объем веществ уменьшается, так как из одного молекулы гидроксида цинка образуется одна молекула оксида цинка и одна молекула воды.
Основные методы получения гидроксида цинка
Окисление цинка
Гидроксид цинка образуется путем окисления цинка в щелочной среде при наличии воздуха или кислорода. Цинк гидроксид натрия уравнение:
Zn + 2NaOH + h3O → Na2Zn(OH)4
Полученный продукт можно обработать кислотой для получения гидроксида цинка:
Na2Zn(OH)4 + 2HCl → Zn(OH)2 + 2NaCl + 2h3O
Растворение цинка в гидроксиде натрия
Гидроксид цинка можно получить путем растворения цинка в гидроксиде натрия (NaOH).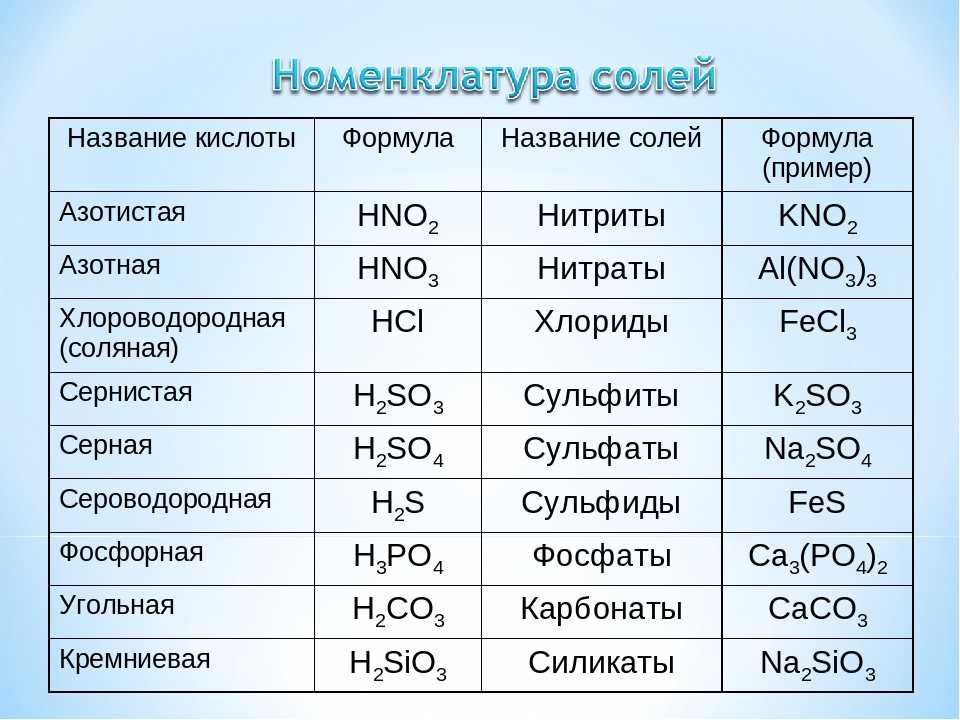
Zn + 2NaOH + 2h3O → Na2Zn(OH)4 + h3
Затем полученный продукт можно обработать кислотой для получения гидроксида цинка.
Нейтрализация раствора соли цинка щелочью
Гидроксид цинка можно получить путем нейтрализации раствора соли цинка (например, ZnCl2) щелочью (например, NaOH).
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
Гидроксид цинка осадок можно перевести в твердое состояние, затем вымыть и просушить
Цинк гидроксид меди
Реакция между цинком и гидроксидом меди (Cu(OH)2) может привести к образованию гидроксида цинка (Zn(OH)2), если условия реакции позволяют цинку замещать медь в соединении. Для этого необходимо, чтобы цинк был более реакционноспособным, чем медь, что зависит от условий реакции, таких как температура, pH среды и т.д.
Если медный гидроксид находится в растворе и взаимодействует с цинком в качестве металлического порошка, цинк гидроксид меди реакция:
Zn + Cu(OH)2 → Zn(OH)2 + Cu
Цинк замещает медь в соединении, образуется гидроксид цинка и медь осаждается в металлическом виде.
Если медный гидроксид находится на поверхности меди, то реакция может быть сложнее и может приводить к образованию различных медных соединений, таких как медный оксид (CuO) или медный карбонат (CuCO3), вместо образования гидроксида цинка.
Применение гидроксида цинка
- Производство резин и пластмасс — используется в качестве катализатора при производстве некоторых видов резин и пластмасс.
- Производство лаков и красок, так же может служить в качестве стабилизатора цвета и улучшать свойства покрытия.
- Производство косметических средств — кремы и пудры, используется как компонент, обладающий абсорбирующими свойствами и способностью защищать кожу от солнечных лучей.
- Производство лекарственных средств — антибиотики, антисептики и дезинфицирующие средства.
- Производство электронных компонентов — используется в качестве электроизоляционного материала и диэлектрика в электронных компонентах, таких как конденсаторы и резисторы.
- Производство катализаторов в ряде химических процессов, таких как производство метилового спирта и др.

Кроме того, гидроксид цинка также используется в производстве других продуктов, таких как аккумуляторы, пигменты для красок и керамики, и др.
Производство гидроксида цинка
- Нейтрализация раствора соли цинка щелочью: гидроксид цинка – процесс нейтрализации раствора соли цинка (например, хлорида цинка) щелочью (например, гидроксидом натрия). Этот метод является одним из наиболее распространенных способов производства гидроксида цинка.
- Прямое осаждение из раствора цинка: гидроксид цинка может быть получен путем прямого осаждения из раствора цинка (например, нитрата цинка) добавлением аммиака или реагентов.
- Электролиза раствора цинка в присутствии гидроксида или других электролитов.
- Путем обработки цинковых руд, таких как сфалерит или оксид цинка, с помощью кислот или щелочей.
После производства гидроксид цинка может быть дополнительно очищен и обработан для получения нужной формы и размера частиц в зависимости от его применения.
История открытия и развития изучения гидроксида цинка
Гидроксид цинка был открыт в 1810 году датским химиком Йенсом Берцелиусом. Он получил этот соединительный гидроксид цинка путем растворения цинка в щелочи, а затем добавления к нему кислоты.
Позже, в 1892 году, гидроксид цинка был использован в качестве белого пигмента в красках и лаках. Это было возможно благодаря тому, что гидроксид цинка обладает высокой оптической плотностью и способностью отражать свет.
В 1920-х годах гидроксид цинка начали использовать в качестве лекарства для лечения кожных заболеваний, таких как экзема и акне. Это происходило благодаря его способности уменьшать воспаление и ускорять заживление ран.
В последующие годы гидроксид цинка нашел широкое применение в различных областях, таких как косметика, металлургия, стекольная и электронная промышленность, а также в производстве резиновых изделий и пластмасс.
Цинк оксид цинка хлорид цинка гидроксид цинка
Цинк образует несколько основных соединений, в том числе оксид цинка (ZnO), хлорид цинка (ZnCl2) и гидроксид цинка (Zn(OH)2):
- Оксид цинка (ZnO) — это белый порошок, который образуется при нагревании цинка в кислородной среде или при обжиге гидроксида цинка.
 Он также может быть получен путем реакции между гидроксидом цинка и оксидом углерода (IV) (CO2) при высокой температуре:
Он также может быть получен путем реакции между гидроксидом цинка и оксидом углерода (IV) (CO2) при высокой температуре:
Zn(OH)2 + CO2 → ZnO + h3O + CO
- Хлорид цинка (ZnCl2) — это бесцветные кристаллы или белый порошок, который образуется при реакции металлического цинка с хлоридной кислотой (HCl). Он также может быть получен путем реакции гидроксида цинка с хлористым водородом (HCl):
Zn(OH)2 + 2HCl → ZnCl2 + 2h3O
- Гидроксид цинка (Zn(OH)2) — это белый порошок, который может быть получен путем растворения цинка в растворе щелочи или реакции между хлоридом цинка и гидроксидом натрия (NaOH):
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
В то же время, гидроксид цинка также может претерпевать дальнейшую реакцию с щелочью, образуя тетрагидроксоцинкат (II) ион (Zn(OH)4) в растворе.
Цинк гидроксид карбонат
Цинк гидроксид карбонат (Zn(OH)2CO3) — это соединение, которое может быть получено в результате реакции между гидроксидом цинка (Zn(OH)2) и угольной кислотой (h3CO3), которая может быть образована путем растворения угольного диоксида (CO2) в воде:
Zn(OH)2 + h3CO3 → Zn(OH)2CO3 + h3O
В результате этой реакции образуется цинк гидроксид карбонат и вода.
Этот продукт может быть также получен при взаимодействии гидроксида цинка с другими угольными кислотами, например, соляной кислотой (HCl) или серной кислотой (h3SO4) в присутствии угольного диоксида. Это связано с тем, что образующийся при растворении угольного диоксида водный раствор угольной кислоты может реагировать с гидроксидом цинка, образуя цинк гидроксид карбонат.
Цинк, гидроксид, карбонат — реакция? Реакция между цинком, гидроксидом и карбонатом может происходить в следующем виде:
Zn2+ + 2OH- + CO32- → Zn(OH)2CO3↓
В этой реакции ионы цинка (Zn2+) соединяются с ионами гидроксида (OH-) и ионами карбоната (CO32-), образуя цинк гидроксид карбонат (Zn(OH)2CO3), который выпадает в виде белого осадка.
Здесь важно отметить, что этот процесс является необратимым, то есть цинк гидроксид карбонат не будет разлагаться на ионы цинка, гидроксида и карбоната при добавлении воды или изменении условий реакции.
Химия — 8
Щелочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Гидроксиды других металлов не растворяются или очень мало растворяются в воде.
Часть нерастворимых в воде оснований обладает амфотерными (двойственными) свойствами.
Основания, вступающие в реакцию как с кислотами, так и с щелочами, образуя соли и воду, называют амфотерными основаниями.
Например:
Zn(OH)2, Be(OH)2, Al(OH)3, Pb(OH)2, Fe(OH)3, Cr(OH)3 и т.д.
Число гидроксильных групп в составе оснований определяет их кислотность.
Наименование оснований. Если металл, образующий основание, имеет постоянную валентность, то вначале указывается слово «гидроксид», а затем название металла. Если металл обладает переменной валентностью, то ее отмечают после слов «гидроксид» и названия металла римскими цифрами в скобках.
| Однокислотные основания | Название |
|---|---|
| LiOH | Гидроксид лития |
| NaOH | Гидроксид натрия |
| KOH | Гидроксид калия |
| CuOH | Гидроксид меди(I) |
| Трехкислотные основания |
Название |
|---|---|
| Al(OH)3 | Гидроксид алюминия |
| Fe(OH)3 | Гидроксид железа(III) |
| Cr(OH)3 | Гидроксид хрома(III) |
| Двухкислотные основания |
Adı |
|---|---|
| Mg(OH)2 | Гидроксид магния |
| Ca(OH)2 | Гидроксид кальция |
| Cu(OH)2 | Гидроксид меди(II) |
| Fe(OH)2 | Гидроксид железа(II) |
| Cr(OH)2 | Гидроксид хрома(II) |
| Pb(OH)2 | Гидроксид свинца(II) |
| Zn(OH)2 | Гидроксид цинка |
| Ba(OH)2 | Гидроксид бария |
Методы получения оснований
Получение щелочей в лабораторных условиях:
1) При взаимодействии активных металлов (щелочных металлов — Li, Na, K, Rb, Cs и щелочноземельных металлов — Ca, Sr, Ba) с водой посредством реакции замещения образуются щелочи.
Эти реакции протекают в обычных условиях.
2) В результате взаимодействия в обычных условиях гидридов щелочных и щелочноземельных металлов с водой образуются щелочи.
Слой оксида цинка, модифицированный гидроксидом бария, модифицированный гидроксидом бария, легированный алюминием, для высокоэффективных инвертированных органических солнечных элементов
Слой оксида цинка, модифицированный гидроксидом бария, модифицированный гидроксидом бария, легированный алюминием, для высокоэффективных инвертированных органических солнечных элементов†
 Брабек аб
Брабек аб Принадлежности автора
* Соответствующие авторы
и Институт материалов для электроники и энергетических технологий (i-MEET), Университет Фридриха-Александра, Эрланген-Нюрнберг, Martensstraße 7,
Электронная почта: [email protected]
Факс: +49 (0)9131-8528495
Тел.: +49 (0)9131-8527722
б Баварский центр прикладных энергетических исследований (ZAE Bayern), Haberstraße 2a, Эрланген, Германия
с Эрлангенская высшая школа передовых оптических технологий (SAOT), Paul-Gordan-Straße 6,
д BASF Schweiz AG, Schwarzwaldallee 215, CH-4002 Базель, Швейцария
Аннотация
rsc.org/schema/rscart38″> Инвертированные органические солнечные элементы (iOSC) со стабильными на воздухе материалами интерфейса и верхними электродами и эффективностью 6,01% достигаются за счет введения слоя гидроксида бария (Ba(OH) 2 ) между слоем оксида цинка, легированного алюминием (AZO) слой извлечения электронов и активный слой. Чередующийся сополимер дикетопирролопиррола и квинкетиофена с низкой шириной запрещенной зоны (pDPP5T-2) и метиловый эфир фенил-C61-масляной кислоты (PC 61 BM) были выбраны в качестве соединений активного слоя. По сравнению с контрольным устройством без Ba(OH) 2 , введение слоя Ba(OH) 2 толщиной в несколько нм приводит к усилению V OC 10%, Дж SC 28%, FF 28% и PCE 80%. Модификация АЗО раствором обработанного недорогого слоя Ba(OH) 2 повысила эффективность инвертированного устройства за счет преимущественного снижения энергетического барьера для извлечения электронов из ПК 61 BM и, следовательно, наблюдается уменьшенная рекомбинация заряда. Резкое повышение эффективности устройства и простота изготовления путем обработки в растворе позволяют предположить, что Ba(OH) 2 является многообещающим и практичным способом снижения рекомбинационных потерь, вызванных интерфейсом, на катоде органических солнечных элементов.
Резкое повышение эффективности устройства и простота изготовления путем обработки в растворе позволяют предположить, что Ba(OH) 2 является многообещающим и практичным способом снижения рекомбинационных потерь, вызванных интерфейсом, на катоде органических солнечных элементов.Продукты растворимости
Продукты растворимости Отдельные продукты растворимости и
Константы образования при 25 o C
Растворимость
Правила
Хотя все соединения обладают характерной растворимостью в воде при данной температуре, некоторые
семейства соединений более растворимы, чем другие, и полезно знать некоторые общие правила
растворимости. Мы называем любое вещество, растворимость которого меньше
более 0,01 моль/л нерастворим. Если его растворимость больше 0,1 моль/л, мы называем его растворимым. Если это
растворимость составляет от 0,01 до 0,1 моль/л, мы говорим, что он малорастворим. Следующая растворимость
правила можно использовать для определения растворимости в воде, с оговоркой, что они не всегда
они не включают в себя все широко используемые ионы, но хорошо иметь поблизости
когда нужно:
Следующая растворимость
правила можно использовать для определения растворимости в воде, с оговоркой, что они не всегда
они не включают в себя все широко используемые ионы, но хорошо иметь поблизости
когда нужно:
1. Все соли натрия, калия и аммония растворимы.
2. Все нитраты, ацетаты и
перхлораты растворимы.
3. Все соли серебра, свинца и ртути(I) нерастворимы.
4. Все
хлориды, бромиды и йодиды растворимы.
5. Все карбонаты, сульфиды, оксиды и гидроксиды нерастворимы.
6. Все сульфаты растворимы
кроме сульфата стронция и сульфата бария.
Как уже было сказано, вот таблица константы произведения растворимости.




 Он также может быть получен путем реакции между гидроксидом цинка и оксидом углерода (IV) (CO2) при высокой температуре:
Он также может быть получен путем реакции между гидроксидом цинка и оксидом углерода (IV) (CO2) при высокой температуре: H 2 O
H 2 O